M U R T A I P
SEKOLAH PASCASARJANA
INSTITUT PERTANIAN BOGOR
BOGOR
2010
MURTAIP
Tesis
Sebagai salah satu syarat untuk memperoleh gelar Magister Sains pada
Program Studi Mikrobiologi
SEKOLAH PASCASARJANA
INSTITUT PERTANIAN BOGOR
BOGOR
2010
Dengan ini saya menyatakan bahwa tesis Induksi Senyawa Gaharu Melalui Kombinasi Senyawa Kimia dan Acremonium adalah karya saya dengan arahan dari komisi pembimbing dan belum diajukan dalam bentuk apa pun kepada perguruan tinggi mana pun. Sumber informasi yang berasal atau dikutip dari karya yang diterbitkan maupun tidak diterbitkan dari penulis lain telah disebutkan dalam teks dan dicantumkan dalam Daftar Pustaka di bagian akhir tesis ini.
Bogor, Desember 2010 Murtaip
Hak Cipta Milik IPB, tahun 2010 Hak Cipta dilindungi Undang-Undang
Dilarang mengutip sebagian atau seluruh karya tulis ini tanpa mencantumkan atau menyebutkan sumbernya. Pengutipan hanya untuk kepentingan pendidikan, penelitian, penulisan karya ilmiah, penyusunan laporan, penulisan kritik, atau tinjauan suatu masalah; dan pengutipan tersebut tidak merugikan kepentingan yang wajar IPB
Dilarang mengumumkan dan memperbanyak sebagian atau seluruh karya tulis dalam bentuk apa pun tanpa izin IPB
TRIADIATI
Agarwood is an aromatic resin produced by Aquilaria spp. The resin was formed as a response to fungal infection, mechanical damage or chemical treatment. This research was aiming at evaluation of the effectivity of single induction agent (salicylic acid (A), methyl jasmonate (M), Acremonium (F)) and in comparison to combination of induction agents. Trunks of Aquilaria crassna (±10 years old) was induced by either a single induction agents (A, M or F) or its combination (AF, AM, MF or AMF). Acremonium was given as pellets, while A and M were given at 100 mM and 750 mM, respectively. The tree was first drilled (4 mm diam. and one third diameter of the stem), with 20 cm distance between holes. The trunk was then injected with A, subsequently with M and inoculated with F, with a week interval of teratments. Agarwood quality criteria such as wood discoloration, fragrance level, and also terpenoid accumulation were observed monthly for four months periode. The results indicated that intensity of wood discoloration of all treatments ranges from brownish white to dark brown with AMF combination gave highest intensity. Fragrance did not induce by all treatments with AMF combination given highest mean score, but on the base at percentage of point induction, MF and F were more effective to induce fragrance. All of treatments induced terpenoids formation. AM and F treatments induced high triterpenoid accumulation with concentration 268.25 ppm. Wood discoloration was not correlated with fragrance level, but it was correlated with terpenoid accumulation. AMF stimulated wood discoloration and its fragrance level was better than the other treatments. However, only MF and F were effective to induce spesific agarwood fragrance.
Keywords : Aquilaria crassna, Acremonium, salycilic acid, methyl jasmonate, discoloration, fragrance level, terpenoid
Acremonium. Dibimbing oleh GAYUH RAHAYU dan TRIADIATI
Gaharu atau gubal gaharu (agarwood, eaglewood, aloeswood) merupakan hasil hutan bukan kayu yang berupa damar wangi (aromatik resin) dari pohon
Aquilaria spp. dan genus lain dari Thymeleaceae. Gaharu digunakan sebagai
bahan dasar dalam industri parfum, dupa untuk berbagai ritual keagamaan, kosmetik dan obat-obatan. Senyawa gaharu terbentuk sebagai respon pertahanan pohon gaharu terhadap berbagai gangguan seperti gangguan fisik, infeksi patogen, atau perlakuan kimiawi. Di antara molekul-molekul sinyal yang terlibat di dalam mengaktifkan respons pertahanan adalah asam salisilat, jasmonat, metil jasmonat, etilen, hidrogen peroksida dan superoksida radikal. Penelitian ini bertujuan untuk mengetahui efektivitas penginduksi tunggal asam salisilat, metil jasmonat (MeJA) dan Acremonium sp. serta kombinasinya.
Penginduksi asam salisilat (A), MeJA (M) dan Acremonium sp. IPBCC07525 (F) diberikan secara tunggal atau kombinasinya pada batang A.
crassna berukuran 20 cm (diam), umur 10 tahun. Penginduksi tunggal terdiri dari
A, M atau F, kombinasi ganda terdiri dari AM, AF dan MF, sedangkan kombinasi tiga penginduksi yaitu AMF. Penginduksi pertama diberikan sesaat setelah pelubangan. Penginduksi kedua diberikan 1 minggu setelah penginduksi pertama dan penginduksi ke tiga diberikan 1 minggu setelah penginduksi kedua. Batang yang hanya dibor dijadikan kontrol. Pengamatan dilakukan terhadap gejala pembentukkan gubal gaharu (perubahan warna kayu dan tingkat wangi) serta kandungan terpenoidnya. Percobaan dilakukan dalam Rancangan Acak Lengkap dan diolah dengan SAS.
Secara umum semua penginduksi merangsang perubahan warna dengan intensitas dan ukuran zona perubahan warna berbeda nyata dibandingkan dengan perlakuan pelubangan (K+), sehingga semua penginduksi dinyatakan efektif dalam merangsang perubahan warna. Pelukaan, pemberian asam salisilat, MeJA dan inokulasi Acremonium sp. atau kombinasinya menyebabkan perubahan warna kayu dari putih menjadi gelap. Perubahan warna ini terjadi akibat adanya akumulasi senyawa gaharu hasil induksi. Oleh sebab itu, perubahan warna kayu merupakan respon non spesifik dari pohon gaharu.
Penginduksi tiga kombinasi (AMF) menghasilkan intensitas perubahan warna yang tidak berbeda nyata dengan penginduksi ganda AM tetapi panjang dan lebar zona perubahan warnanya berbeda nyata. Tidak berbedanya intensitas perubahan warna antara penginduksi AMF dengan AM diduga karena akumulasi senyawa gaharunya tidak cukup untuk memberikan kesan intensitas yang berbeda. Intensitas warna berkorelasi dengan akumulasi terpenoid. Adanya penambahan panjang dan lebar zona perubahan warna penginduksi AMF, kemungkinan disebabkan oleh pengaruh inokulasi Acremonium sp. pada penginduksi tiga kombinasi AMF tersebut.
Acremonium sp. merupakan salah satu cendawan patogen pada berbagai tanaman termasuk pohon gaharu. Cendawan ini dapat menginduksi terbentuknya senyawa gaharu (senyawa fitoaleksin) pada pohon gaharu A. crassna dan A.
empulur dan trakea xilem.
Intensitas dan zona perubahan warna penginduksi AMF berbeda nyata dengan penginduksi tunggalnya A, M dan F. Hal ini menunjukkan penginduksi A, M dan F dalam bentuk kombinasi (AMF) bersinergi dalam merangsang perubahan warna kayu.
Penginduksi ganda (AF dan MF) menghasilkan intensitas perubahan warna yang tidak berbeda nyata, tetapi berbeda dalam panjang zona perubahan warnanya. Zona perubahan warna pada AF lebih panjang daripada MF. Hal ini mungkin disebabkan oleh perbedaan kemampuan asam salisilat dan MeJA dalam mempengaruhi aktivitas Acremonium sp. dan adanya perbedaan ketahanan (kebugaran) masing-masing individu pohon gaharu A. crassna. Selain itu, disebabkan juga oleh adanya perbedaan migrasi senyawa kimia dalam jaringan tumbuhan dan oleh sifat Acremonium sp. yang lebih bersinergi dengan asam salisilat daripada metil jasmonat.
Semua penginduksi menyebabkan perubahan aroma kayu, namun tingkat aromanya sangat rendah. Aromanyapun sangat bervariasi. AMF menginduksi wangi dengan tingkat wangi tertinggi, namun aromanya bukan wangi khas gaharu. Secara umum hanya AMF dan F yang dapat merangsang munculnya wangi khas gaharu pada kategori agak wangi (skor mendekati 1). Munculnya aroma wangi pada kayu gaharu setelah diinduksi tentu disebabkan oleh adanya senyawa gaharu yang terakumulasi pada kayu gaharu tersebut. Tidak semua senyawa gaharu akan memberikan aroma wangi. Penelitian lain menyebutkan bahwa salah satu senyawa metabolit sekunder yang beraroma wangi adalah sesquiterpenoid (sesquiterpenoid aromatik). Dengan demikian pada penginduksi AMF dan F diduga jumlah senyawa sesquiterpenoid yang terakumulasi lebih tinggi daripada penginduksi yang lain.
Berdasarkan pada frekuensi titik induksi yang wangi, pemberian inokulan MF dan F lebih efektif dalam menginduksi wangi bila dibandingkan dengan penginduksi yang lain. Namun intensitas warna kayu lebih rendah dari penginduksi AMF. Hal ini menunjukkan bahwa aroma wangi yang dihasilkan tidak selalu sebanding dengan intensitas warna kayu.
Pada semua penginduksi baik penginduksi tunggal maupun penginduksi kombinasi terjadi pembentukan senyawa terpenoid. Hasil uji kandungan senyawa terpenoid menunjukkan bahwa endapan ekstrak kayu memiliki warna mulai dari hijau, hijau kekuningan, kuning, coklat, coklat kemerahan sampai coklat kehitaman. Warna-warna ini mengindikasikan bahwa yang terbentuk adalah senyawa sterol dan triterpenoid. Sterol merupakan senyawa terpenoid yang terikat asam lemak.
Dari bulan pertama sampai bulan ke empat masa induksi terjadi peningkatan jumlah ekstrak kayu gaharu yang endapannya berwarna coklat. Semua penginduksi, kecuali AF, berpotensi menyebabkan ekstrak kayu membentuk endapan coklat. Warna coklat menunjukkan terdeteksinya senyawa-senyawa dalam kelompok triterpenoid. Dengan demikian semua penginduksi, kecuali AF, dapat menginduksi terbentuknya senyawa triterpenoid.
masing individu pohon gaharu A. crassna. Selain itu, kombinasi dari dua jenis senyawa kimia (asam salisilat dan MeJA) yang tergolong senyawa elisitor fitoaleksin dapat mendorong produksi senyawa fitoaleksin (senyawa terpenoid). Inokulasi Acremonium sp. dilakukan setelah selesai pelubangan yang memungkinkan cendawan ini dapat segera tumbuh dan melakukan infeksi yang berdampak pada produksi senyawa terpenoid yang lebih tinggi.
Baik intensitas warna maupun tingkat wangi tidak berkorelasi dengan konsentrasi senyawa terpenoid selama 4 bsi, sehingga intensitas warna, tingkat wangi dan konsentrasi terpenoid merupakan kriteria yang independen dalam penentuan mutu gaharu.
Kombinasi tiga penginduksi (AMF) merupakan penginduksi yang paling efektif dalam menginduksi pembentukkan senyawa gaharu (gubal gaharu) pada pohon A. crassna selama 4 bsi. Intensitas warna kayu, luas zona perubahan warna kayu dan aroma yang dihasilkan menunjukkan nilai tertinggi. Namun wangi khas gaharu hanya diinduksi oleh MF dan F. Semua penginduksi efektif dalam merangsang pembentukkan terpenoid dengan variasi konsentrasi terpenoid yang tinggi pada setiap pohon. Kombinasi asam salisilat dengan MeJA dan penginduksi tunggal Acremonium sp. menghasilkan triterpenoid dengan konsentrasi tertinggi yaitu 268,25 ppm pada 4 bulan setelah induksi.
Kata kunci : Aquilaria crassna, asam salisilat, metil jasmonat, Acremonium sp., perubahan warna, zona perubahan warna, tingkat wangi, terpenoid.
NRP : G351070141
Disetuji Komisi Pembimbing
(Dr. Ir. Gayuh Rahayu) ( Dr. Dra. Triadiati, M.Si Anggota Anggota
)
Diketahui
Ketua Mayor Mikrobiologi Dekan Sekolah Pascasarjana
(Dr. Ir. Gayuh Rahayu) (Prof. Dr. Ir. Khairil A. Notodiputro, M.S.)
Nya sehingga penulis dapat menyelesaikan karya ilmiah ini sebagai syarat untuk memperoleh gelar Magister Sains di Sekolah Pascasarjana Institut Pertanian Bogor. Tema yang dipilih dalam penelitian yang dilaksanakan sejak April sampai Desember 2009 ini adalah induksi gubal gaharu, dengan judul Induksi Senyawa Gaharu Melalui Kombinasi Senyawa Kimia dan Acremonium.
Terima kasih penulis ucapkan kepada Ibu Dr. Ir. Gayuh Rahayu dan Ibu
Dr. Dra. Triadiati, M.Si selaku pembimbing yang telah memberikan saran, koreksi, motivasi, bimbingan, dan fasilitas yang diberikan selama pengerjaan tesis ini serta ucapan ucapan terimakasih penulis sampaikan kepada Dr. Ir. Widodo, M.Si selaku penguji luar komisi pembimbing yang telah banyak memberi saran dan kepada Saudari Lia Yunita, S.Si, yang telah membantu selama pengumpulan data. Penulis juga mengucapkan terima kasih kepada DIKTI melalui program hibah kemitraan HI-LINK 2009 yang telah mendanai penelitian ini. Ungkapan terima kasih juga disampaikan kepada ayah, ibu, istri serta seluruh keluarga, atas segala doa dan kasih sayangnya.
Semoga karya ilmiah ini bermanfaat.
Bogor, Desember 2010 Murtaip
dan ibu Ayunim. Penulis merupakan putra kedua dari empat bersaudara.
Tahun 1999 penulis lulus dari SMU Negeri I Praya, pada tahun 2003 lulus S1-Pendidikan Biologi di Fakultas Keguruan dan Ilmu Pendidikan (FKIP) Universitas Mataram dan Tahun 2007 penulis lulus seleksi masuk Sekolah Pascasarjana IPB yang disponsori oleh Departemen Agama RI. Penulis memilih mayor Mikrobiologi, Fakultas Matematika dan Ilmu Pengetahuan Alam IPB.
DAFTAR TABEL --- iii DAFTAR GAMBAR --- iv DAFTAR LAMPIRAN --- v 1 PENDAHULUAN --- 1 1.1 Latar Belakang --- 1 1.2 Tujuan --- 3 1.3 Hipotesis --- 3 1.4 Manfaat --- 3 2 TINJAUAN PUSTAKA --- 4
2.1 Gaharu : Prospek dan Permasalahannya --- 4
2.1.1 Gaharu dan Pohon Penghasilnya --- 4
2.1.2 Manfaat Gaharu --- 4
2.1.3 Permasalahan dalam Mendapatkan Gubal Gaharu di Alam --- 5
2.1.4 Pembentukkan Gubal Gaharu dan Indikasinya --- 5
2.1.5 Kandungan Terpenoid pada Gubal Gaharu --- 6
2.1.6 Mutu Gubal gaharu --- 9
2.2 Cendawan Penginduksi Pembentukkan Gubal Gaharu --- 11
2.3 Jasmonat --- 13
2.4 Asam salisilat --- 14
3 BAHAN DAN METODE --- 16
3.1 Waktu dan Tempat --- 16
3.2 Alat dan Bahan --- 16
3.3 Metode --- 16
3.3.1 Persiapan Inokulan Acremonium --- 16
3.3.2 Induksi Pembentukkan Gubal Gaharu --- 17
3.3.3 Pembuatan Larutan Metil Jasmonat dan Asam Salisila --- 17
3.3.4 Uji Terpenoid dengan Metode Lieberman-Burchard --- 19
3.4 Analisis Data --- 19
4 HASIL DAN PEMBAHASAN --- 20
4.1 Hasil --- 20
4.1.1 Gejala Pembentukkan Gubal Gaharu --- 20
4.1.2 Pembentukkan Senyawa Terpenoid --- 25
4.2 Pembahasan --- 28
4.2.1 Induksi Gejala Pembentukkan Gubal Gaharu --- 28
4.2.2 Pembentukkan Senyawa Terpenoid --- 34
5 SIMPULAN DAN SARAN --- 37
5.1 Simpulan --- 37
DAFTAR TABEL
Halaman
1 Kandungan sesquiterpen pada gubal gaharu --- 9
2 Klasifikasi produk gaharu dan sejenisnya --- 10
3 Persyaratan mutu gubal gaharu --- 10
4 Persyaratan mutu kemedangan --- 11
5 Persyaratan mutu abu gaharu --- 11
6 Perlakuan inokulasi pada pohon gaharu --- 17
7 Skor perubahan warna dan tingkat wangi gaharu --- 18
8 Frekuensi titik induksi yang wangi --- 25
9 Warna endapan ekstrak kayu gaharu selama 4 bulan pengamatan --- 27
DAFTAR GAMBAR
Halaman
1 Biosintesis pada kelompok terpenoid --- 7
2 Jalur utama biosintesis metabolit sekunder --- 8
3 Lubang induksi pada batang A. crassna --- 18
4 Panjang dan Lebar zona perubahan warna pada batang A. crassna --- 18
5 Warna kayu gaharu setelah diberi berlakuan --- 20
6 Intensitas warna kayu A. crassna pada masing-masing penginduksi--- 21
7 Intensitas warna kayu A. crassna selama 4 bulan pengamatan --- 21
8 Panjang zona perubahan warna kayu A. crassna pada masing-masing penginduksi --- 22
9 Panjang zona perubahan warna kayu A. crassna selama 4 bulan pengamatan --- 22
10 Lebar zona perubahan warna kayu A. crassna pada masing-masing penginduksi --- 23
11 Lebar zona perubahan warna kayu A. crassna selama 4 bulan pengamatan -- 23
12 Tingkat wangi kayu A. crassna pada masing-masing penginduksi --- 24
13 Tingkat wangi kayu A. crassna selama 4 bulan pengamatan --- 25
14 Hasil uji Lieberman-Burchard pada ekstrak kayu A. crassna pada bulan ke-4 masa induksi --- 26
DAFTAR LAMPIRAN
Halaman
1 Sidik Ragam Intensitas Prubahan Warna --- 43
2 Sidik Ragam Panjang Zona Perubahan Warna --- 43
3 Sidik Ragam Lebar Zona Perubahan Warna --- 43
4 Sidik Ragam Tingkat Wangi Kayu A. crassna --- 44
5 Nilai Absorbansi Ekstrak Kayu A. crassna --- 45
6 Konsentrasi Terpenoid Ekstrak Kayu A. crassna --- 46
1 PENDAHULUAN
1.1 Latar BelakangGaharu atau gubal gaharu (agarwood, eaglewood, aloeswood) merupakan hasil hutan bukan kayu yang berupa damar wangi (aromatik resin) dari pohon
Aquilaria spp. dan genus lain dari Thymeleaceae (Whitmore 1980). Gaharu juga
didefinisikan sebagai sejenis kayu dengan berbagai bentuk dan warna yang khas serta memiliki kandungan kadar damar wangi (Dewan Standar Nasional Indonesia 1999).
Gaharu merupakan salah satu hasil hutan bukan kayu yang dapat digunakan untuk berbagai macam keperluan, diantaranya digunakan sebagai bahan dasar dalam industri parfum, dupa untuk berbagai ritual keagamaan, kosmetik dan obat-obatan (Barden et al. 2000).
Senyawa gaharu terbentuk sebagai respon pertahanan pohon gaharu terhadap berbagai gangguan seperti pelukaan, infeksi patogen, atau perlakuan senyawa kimia (Nobuchi & Siripatanadilok 1991). Pertahanan dapat bersifat pasif yaitu pertahanan sudah ada sebelum datangnya gangguan dan bersifat aktif yaitu pertahanan yang dipicu oleh datangnya gangguan (Goodman et al. 1986, Agrios 2005). Tanaman secara umum memiliki mekanisme sistem pertahanan yang diaktivasi ketika tanaman diinfeksi oleh mikroorganisme patogen seperti bakteri, cendawan dan virus. Secara umum interaksi tanaman dan patogen menimbulkan suatu tanggapan hipersensitif sistemik dan lokal yang dikendalikan oleh suatu mekanisme molekular yang kompleks yang ditimbulkan oleh molekul-molekul sinyal (Creelman & Mullet 1997). Di antara molekul-molekul sinyal yang terlibat di dalam mengaktifkan respon pertahanan adalah asam salisilat, jasmonat, etilen, hidrogen peroksida dan superoksida radikal (Vijayan et al. 1998). Yang et al. (1997) juga menyatakan bahwa metil jasmonat (MeJA), asam salisilat dan etilen merupakan senyawa sinyal bagi pertahanan pohon.
Cendawan patogen yang dapat menginfeksi berbagai tanaman termasuk pohon gaharu adalah dari kelompok Acremonium dan Fusarium. Infeksi cendawan patogen ini melibatkan beberapa mekanisme. Williams (1979) mengemukakan mekanisme itu mencakup kekuatan mekanik, enzim dan toksin.
Semua mekanisme tersebut akan berhadapan dengan sistem pertahanan pasif dan aktif pohon inang. Salah satu sistem pertahanan aktifnya adalah dengan menghasilkan senyawa fitoaleksin (Goodman et al. 1986; Harbone 1988).
Fitoaleksin merupakan senyawa antimikrob dengan berat molekul rendah yang terakumulasi pada tanaman sebagai reaksi terhadap infeksi dan cekaman (Mert-Turk 2002). Michiho (2005) menjelaskan bahwa, senyawa fitoaleksin ini diduga memberikan aroma pada gaharu. Sebelumnya Yuan (1995) melaporkan bahwa salah satu senyawa fitoaleksin yang menyebabkan gaharu memiliki aroma wangi yang khas adalah termasuk dalam senyawa sesquiterpen.
Senyawa fitoaleksin yang dibentuk oleh tanaman termasuk pohon gaharu dalam sistem pertahanannya selain dipengaruhi oleh infeksi cendawan juga diaktifkan oleh adanya molekul sinyal. Franceschi et al. (2002) melaporkan bahwa molekul sinyal yang dapat merangsang pembentukan senyawa fitoaleksin adalah metil jasmonat (MeJA). Kemudian Yukie & Michiho (2009) melaporkan kembali bahwa molekul sinyal yang dapat merangsang pembentukan senyawa fitoaleksin adalah metil jasmonat (MeJA) dan asam salisilat.
Michiho (2005) melaporkan bahwa pemberian MeJA 0,1 mM dapat menginduksi terbentuknya senyawa terpenoid pada kalus A. sinensis, dan pemberian satu kali MeJA 750 mM juga mampu menginduksi pembentukan senyawa terpenoid pada A. crassna. Pemberian asam salisilat pada konsentrasi 100 mM dapat merangsang perubahan warna kayu, menginduksi akumulasi terpenoid tetapi tidak merangsang pembentukkan wangi (Rahayu 2010). Selanjutnya Yukie & Michiho (2009) melaporkan bahwa, pemberian asam salisilat pada konsentrasi 1 mM dan 10 mM serta inokulasi MeJA pada konsentrasi 300 mM dapat menginduksi pembentukkan senyawa wangi pada kultur A. crassna dan A. sinensis. Penelitian menggunakan kombinasi antara cendawan dengan agen penginduksi telah mulai dilakukan. Pemberian MeJA 750 mM seminggu setelah inokulasi Acremonium sp. efektif dalam meningkatkan kemampuan Acremonium sp. dalam membentuk gejala gubal gaharu selama 3 bulan induksi pada A. microcarpa (Rahayu at al. 2009a).
Acremonium merupakan salah satu jenis cendawan yang telah terbukti
dikombinasikan dengan MeJA belum menghasilkan gaharu pada tingkat gubal, induksi ini baru menghasilkan kemedangan tingkat IV (Rahayu et al. 2009a). Penggunaan cendawan patogen untuk menginduksi pembentukkan gaharu bila diaplikasikan dalam jangka waktu lama dikhawatirkan dapat menimbulkan suatu permasalahan baru. Kemungkinan permasalahan yang muncul adalah terjadinya mutasi pada patogen yang sengaja diaplikasikan yang akan mengakibatkan pada peningkatan patogenitas. Untuk menghindari hal tersebut perlu dilakukan alternatif penginduksi dengan menggunakan senyawa kimia seperti asam salisilat dan MeJA, sehingga kekhawatiran akan adanya mutasi pada patogen dapat dihindari. Disamping untuk menghindari hal tersebut di atas, diharapkan aplikasi penginduksi senyawa kimia yang akan dikombinasikan dengan Acremonium sp. dapat meningkatkan mutu gaharu. Oleh sebab itu penelitian mengenai induksi senyawa gaharu melalui kombinasi Acremonium, MeJA dan asam salisilat perlu dilakukan dengan tujuan untuk meningkatkan kualitas gaharu.
1.2 Tujuan
Berdasarkan pada permasalahan yang dihadapi di atas maka penelitian ini bertujuan untuk mengetahui efektivitas penginduksi tunggal asam salisilat, metil jasmonat (MeJA) dan Acremonium sp. serta kombinasinya dalam pembentukkan senyawa gaharu.
1.3 Hipotesis
Hipotesis yang diajukan dalam penelitian ini yaitu penginduksi kombinasi yaitu Acremonium, MeJA dan asam salisilat efektif dalam menginduksi pembentukkan senyawa gaharu.
1.4 Manfaat
Penelitian ini diharapkan dapat :
1. Memberikan informasi cara-cara meningkatkan mutu gaharu atau gubal gaharu.
2. Memberikan informasi mengenai mekanisme pembentukkan gubal gaharu 3. Menyediakan bahan rujukan bagi para peneliti selanjutnya.
2 TINJAUAN PUSTAKA
2.1 Gaharu : Prospek dan Permasalahannya2.1.1 Gaharu dan Pohon Penghasilnya
Gaharu adalah sejenis kayu dengan berbagai bentuk dan warna yang khas, serta memiliki kandungan kadar damar wangi, berasal dari pohon atau bagian pohon penghasil gaharu yang tumbuh secara alami dan telah mati, sebagai akibat dari proses infeksi yang terjadi baik secara alami atau buatan pada pohon tersebut, dan pada umumnya terjadi pada pohon Aquilaria spp. (Dewan SNI 01-5009.1-1999). Gaharu atau gubal gaharu sebagai resin dari pohon gaharu terdeposit di dalam jaringan kayu, deposit resin ini mengakibatkan adanya perubahan warna kayu dari putih menjadi coklat kehitaman sampai hitam yang tersebar tidak menentu di dalam pohon gaharu (Scuitemaker 1933).
di Indonesia ada 8 genus tanaman penghasil gaharu yaitu Aquilaria,
Aetoxylon, Enkleia, Gonystylus, Wikstroemia, Grynops, Delbergia dan Excoccaria
(Sumarna 2002). Aquilaria memiliki 6 spesies penghasil gaharu yaitu A.
beccariana, A. cumingiana, A. filaria, A. hirta, A. malaccensis, dan A. microcarpa
(Soehartono 1997).
2.1.2 Manfaat Gaharu
Gaharu telah banyak digunakan selama ribuan tahun yang lalu. Masyarakat cina telah memanfaatkan gaharu untuk obat-obatan (Barden et al. 2000). Gaharu yang berkualitas baik dipergunakan untuk membuat obat beberapa penyakit yang berbahaya seperti asma, radang selaput dada, sakit perut dan untuk memperkuat vitalitas (Lam 2003). Umboh (1998) menambahkan bahwa gaharu juga digunakan sebagai obat rematik, malaria, hamil dan sesudah melahirkan. Selain manfaat di atas, gaharu juga banyak dimanfaatkan untuk keperluan yang lain. Barden et al. (2000) menjelaskan bahwa gaharu dibakar selama festival atau upacara tradisional di Taiwan dan pada upacara koh doh di Jepang. Lam (2003) menambahkan bahwa gaharu digunakan sebagai bahan untuk membuat parfum, sampo, dan sabun kelas tinggi serta dipergunakan untuk dibakar dan membuat dupa (kemenyan).
2.1.3 Permasalahan dalam Mendapatkan Gubal Gaharu di Alam
Gaharu dengan produk gubalnya telah lama diperdagangkan sebagai komoditas elit untuk keperluan industri. Sampai saat ini hampir semua produk gaharu di Indonesia diperoleh dari alam, terutama di daerah Sumatera, Kalimantan, Irian, Nusa Tenggara, Sulawesi, dan Maluku (Amirudin 2001), padahal gaharu yang ditemukan di alam hanya dalam presentase kecil dari pohon gaharu yang ada. LaFrankie (1994) melaporkan bahwa hanya 10 % di antara pohon gaharu dewasa berdiameter lebih dari 20 cm yang memproduksi gaharu dan umumnya pohon tersebut sudah berumur 20-50 tahun.
Barden et al. (2000) menjelaskan bahwa permintaan gaharu masih di atas persediaan yang ada. Kenyataannya produksi gaharu masih sangat tergantung pada hasil hutan. Sampai saat ini eksploitasi pohon gaharu masih berlangsung. Penebangan pohon gaharu bahkan sudah mencapai hutan yang paling dalam dengan wilayah perburuan gubal bergeser dari Sumatera dan Kalimantan ke Irian Jaya. Pengumpul gubal sudah mulai merasakan sulitnya mencari pohon gaharu di hutan dengan kualitas gubal yang baik. Pencarian gaharu di hutan semakin intensif dan penebangan pohon dilakukan secara serampangan tanpa diimbangi dengan penanaman kembali. Akibatnya, semakin sulit memperoleh gaharu di alam.
Pemanfaatan gaharu dewasa ini dan pada masa yang akan datang akan semakin meningkat, sedangkan persediaan di alam terbatas karena produksinya di alam cukup lama (Susmianto 2001). Peningkatan perdagangan gaharu di pasar internasional makin memicu kehawatiran akan punahnya spesies tanaman ini, jika produksi, perdagangan, dan pemanfaatan tidak segera diatur.
2.1.4 Pembentukkan Gubal Gaharu dan Indikasinya
Gaharu atau gubal gaharu terbentuk sebagai respon pohon gaharu terhadap infeksi patogen yang mengakibatkan keluarnya resin. Resin yang terbentuk tidak dikeluarkan dari pohon, melainkan disimpan pada jaringan kayu sehingga jaringan kayu putih yang bertekstur halus menjadi gelap dan keras (Situmorang & Rahayu 2004). Menurut Ng et al. (1997) bahwa pembentukkan gaharu berkaitan dengan gejala patologis yang diawali dengan serangan cendawan.
Acremonium sp. merupakan salah satu cendawan yang terbukti dapat
menginduksi terbentuknya senyawa gaharu pada pohon Aquilaria (Rahayu et al. 1999). Ramadani et al. (2005) juga melaporkan bahwa pelet Acremonium sp. dapat menginduksi pembentukkan gubal gaharu pada pohon A. crassna umur 1 sampai 3 tahun.
Gaharu biasanya terbentuk setelah satu periode yang lama setelah terinfeksi. Bentuk dan ukuran gaharu pada A. crassna tergantung pada ukuran luka akibat infeksi dan waktu infeksinya (Lam 2003). Terjadi perubahan warna kayu dari putih menjadi coklat pada cabang yang telah diinduksi dengan
Acremonium sp. selama 3 bulan (Ramadani et al. 2005). Pada pohon gaharu umur
4-7 tahun, gejala pembentukkan gubal terlihat setelah 1 tahun induksi dan pada pohon gaharu yang lebih muda (umur 2 tahun), induksi pembentukkan gubal memerlukan periode inkubasi antara 2 – 4 bulan (Rahayu et al. 1999). Jika pohon gaharu terinfeksi cendawan patogen selama 8 bulan maka akan terbentuk kemedangan, jika berlangsung 10-12 bulan maka akan terbentuk gubal gaharu dan jika berlangsung selama 2 tahun akan terbentuk gaharu kelas super (Anonim 1995). Parman & Rachman (1996) menyatakan pohon gaharu umur 3-4 tahun yang diinokulasi dengan Fusarium lateritium selama 2 bulan menunjukkan adanya gejala gaharu walaupun kadarnya masih rendah.
Pohon gaharu yang telah terinfeksi Acremonium sp. akan mengalami klorosis pada daun di bagian apikal pada cabang yang terinfeksi. Klorosis merupakan gejala awal dalam pembentukkan gubal gaharu (Rahayu et al. 2001). Hal yang sama juga dilakporkan oleh Ramadani et al. (2005) bahwa terjadi klorosis daun pada cabang A. crassna pada satu dan dua minggu setelah diinokulasi dengan pelet Acremonium sp. Selain itu menurut Agrios (2005) infeksi cendawan dapat mengakibatkan klorosis pada daun dan nekrosis pada daerah terinfeksi.
2.1.5 Kandungan Terpenoid pada Gubal Gaharu
Salah satu senyawa terpenoid komponen gubal gaharu adalah sesquiterpenoid (Ishihara et al. 1991). Sesquiterpen adalah salah satu metabolit sekunder golongan terpen yang mengandung 15 atom karbon dalam bentuk tiga
unit fusi C5 (Taiz & Zeiger 2002). Sesquiterpen (sesquiterpenoid) merupakan
salah satu dari beberapa metabolit sekunder dari kelompok terpenoid yang berasal dari biosintesis isopentenil dan dimetilalil pirofosfat (Gambar 1) (Brown 1999). Sesquiterpenoid pada pohon gaharu dibentuk melalui jalur asam mevalonat (Gambar 2) (Huang 2001).
Gambar 1. Biosintesis pada kelompok terpenoid (Brown 1999)
Isopentenil pirofosfat Dimetilalil pirofosfat
Monoterpen laktosa (iridoid) Monoterpenoid (C10) Geranil pirofosfat (C10) Sesquiterpen laktosa Sesquiterpenoid Farnesil pirofosfat (C15) Triterpenoid (C30) Geranil -geranil pirofosfat l
(C20)
Saponins, phytosterols Diterpenoids (C20)
(Giberilin, resin asid)
Limonoid, cardenolides, quassinoid,
Gambar 2. Jalur utama biosintesis metabolit sekunder (Huang 2001)
Terpen berperan penting terhadap pertumbuhan dan perkembangan tanaman dan merupakan prekursor terhadap biosintesis asam absisat. Salah satu contoh senyawa terpen adalah sesquiterpen. Senyawa ini berfungsi sebagai materi
CO2 + H2O
Senyawa aromatic (fenolik)
Jalur pentose phosphate
Asam amino Karbohidrat Siklus TCA Asam piruvat Asetil Co A
Jalur asam sikimat
Jalur asam malonat Glikolisis
Jalur asam mevalonat
Asam lemak
Asam mevalonat fenol
Isopentenil pirofosfat
Monoterpen Geranil pirofosfat
Sesquiterpen Farnesil pirofosfat
pertahanan (toksin) terhadap cendawan patogen dan bakteri serta menghasilkan aroma wangi sehingga dikenal sebagai sesquiterpen aromatik (Taiz & Zeiger 2002). Pada umumnya setiap tanaman menghasilkan sesquiterpen aromatik yang berbeda-beda. Pada kapas dihasilkan sesquiterpen aromatik yang dikenal sebagai “gossipol” (Picman 1986), sedangkan pada gaharu dikenal sebagai ”jinkohol” (Nakanishi et al. 1981).
Hasil percobaan Yoneda et al. (1984) menunjukkan bahwa sesquiterpen yang dihasilkan pada A. malaccensis lebih lengkap dan mengandung agarospirol serta jinkohol yang lebih tinggi dibandingkan A. agallocha asal India (Tabel 1).
Tabel 1. Kandungan sesquiterpen pada gubal gaharu (Yoneda et al. 1984)
No Komponen Persentasi Minyak Esensial
A. agallocha A. malaccensis 1 2 3 4 5 6 7 8 9 10 11 β – Agarofuran α – Agarofuran Non- ketoagarofuran (-)-10-Epi-y-eudesmol Agarospirol Jinkohol I Jinkohol-eremoi Kusunol Dihydrokaranone Jinkohol II Oxo-agarospirol 0,6 - 0,6 - 4,7 - 4,0 2,9 2,4 - 5,8 - 1,3 - 6,2 7,2 5,2 3,7 3,4 - 5,6 3,1
2.1.6 Mutu Gubal gaharu
Dalam dunia perdagangan, produk gaharu bisa berupa bagian kayu, serbuk dan kadang berupa cairan atau minyak. Warna bagian kayu bervariasi dari coklat sampai gelap atau mendekati hitam. Produk yang lebih gelap mengandung minyak lebih banyak atau kualitasnya lebih tinggi bila dibandingkan dengan produk gaharu yang warnanya lebih terang (coklat). Pembagian kelompok produk gaharu yang menggambarkan kualitas (mutu) ternyata berbeda-beda antar daerah. Soehartono dan Mardiastuti (1997) memberikan contoh bahwa di Kalimantan Barat pengelompokkan gaharu menjadi 9 kelompok yaitu dari kualitas super A sampai kemedangan kropos/ terburuk. Di Kalimantan Timur dan Riau gaharu dibagi menjadi 8 kelompok mulai dari mutu super A sampai mutu kemedangan
(terburuk). Klasifikasi dan standar mutu gaharu telah ditetapkan beberapa kriteria berdasarkan SNI (01-5009.1-1999). Dalam standar tersebut produk gaharu dan sejenisnya (Tabel 2) dikelompokkan berdasarkan kriteria mutu yang telah ditentukan (Tabel 3–5).
Tabel 2. Klasifikasi produk gaharu dan sejenisnya
No Jenis Ket. Mutu Lambang
1 Gubal Gaharu : Mutu utama Mutu pertama Mutu kedua Mutu super Mutu AB
Mutu sabah super
U I II 2 Kemedangan : Mutu pertama Mutu kedua Mutu ketiga Mutu keempat Mutu kelima Mutu keenam Mutu ketujuh
Mutu TGA atau TK.I Mutu SB.I Mutu TAB Mutu TGC Mutu M1 Mutu M2 Mutu M. I II III IV V VI VII 3 Abu gaharu : Mutu utama Mutu pertama Mutu kedua Mutu utama Mutu pertama Mutu kedua U I II
Tabel 3. Persyaratan Mutu Gubal Gaharu
No Karakteristik Mutu U I II 1 Bentuk - - - 2 Ukuran P L T 4-15 cm 2-3 cm ≥ 0,5 cm 4-15 cm 2-3 cm ≥0,5 cm ≥ 15 cm - -
3 Warna Hitam merata Hitam
kecoklatan
Hitam kecoklatan
4 Kandungan damar wangi Tinggi Cukup Sedang
5 Serat Padat Padat Padat
6 Bobot Berat Agak berat Sedang
Tabel 4. Persyaratan Mutu Kemedangan No Karakater Mutu I II II IV V VI VII 1 Warna Coklat kehitaman Coklat bergaris hitam Coklat bergaris putih tipis Kecoklatan bergaris putih tipis Kecoklatan bergaris putih lebar Kebiru-biruan bergaris hitam tipis Putih kebiuan 2 Kandungan damar wangi
Tinggi Cukup Sedang Sedang Sedang Kurang Kurang
3 Serat Agak padat Agak
padat Agak padat Kurang padat Kurang padat Jarang Jarang
4 Bobot Agak berat Agak
berat
Agak berat
Agak berat Ringan Ringan Ringan
5 Aroma
(dibakar)
Agak kuat Agak
kuat
Agak kuat
Agak kuat Kurang
kuat
Kurang kuat
Kurang kuat
Tabel 5. Persyaratan Mutu Abu Gaharu
No karakter Mutu
Utama Pertama Kedua
1 Warna Hitam Coklat
kehitaman
Putih
kecoklatan/kekuningan
2 Kandungan
damar wangi
Tinggi Sedang Kurang
3 Aroma
(dibakar)
Kuat Sedang Kurang
Sumber : Klasifikasi dan persyaratan mutu produk gaharu (SNI 1999).
2.2 Cendawan Penginduksi Pembentukkan Gubal Gaharu
Berbagai macam penyakit pada tumbuhan termasuk pohon gaharu disebabkan oleh berbagai jenis mikroba patogen. Agrios (2005) menjelaskan bahwa patogen-patogen tersebut terdiri dari cendawan, bakteri, virus dan protozoa. Richard (2003) menyebutkan bahwa cendawan dari kelompok
Chytridiomycetes, Deuteromycetes, Ascomycetes dan Basidiomycetes banyak
menimbulkan gangguan pada tanaman tertentu.
Acremonium dan Fusarium merupakan cendawan busuk batang yang telah
terbukti dapat menginduksi pembentukkan gaharu atau gubal gaharu (Rahayu 2007). Fusarium lateritium dapat menginduksi pembentukkan gubal gaharu pada
Aquilaria sp. setelah diinokulasikan satu tahun namun kualitasnya rendah
(Subeham et al. 2005). Acremonium telah dilaporkan mempunyai kemampuan untuk menginduksi pembentukkan senyawa aromatik pada kalus dan pohon A.
crassna, A. malaccensis, dan A. microcarpa yang berumur sekitar 2 tahun
(Khayrunnisa et al. 1999; Rahayu et al. 1999). Hasil induksi tunas A. crassna (klon AC 8 dan AC 14) dan A. filaria (klon Afl. 8) dengan Acremonium (isolat F, G, L, dan M) menunjukkan bahwa hanya isolat F dan M yang mampu menginduksi pembentukkan senyawa aromatik pada media Murashige Skoog modifikasi 50, 75, dan 100 % (Isnaini 2003). Hasil uji laboratorium terhadap kultur tunas 13 klon Aquilaria spp. (A. crassna, A. filaria, A. malaccensis, dan A.
microcarpa) yang diinduksi dengan Acremonium isolat (F dan M) secara kultur
ganda pada media dasar MS mod dengan konsentrasi atau pH berbeda menunjukkan bahwa klon A. malaccensis (Ama 7, Ama 13), dan A. microcarpa (Ami 2064) berpotensi menghasilkan metabolit sekunder yang lebih harum daripada klon-klon lain (Isnaini 2004).
Hasil penelitian lain juga memperjelas bahwa Acremonium mampu
menginduksi pembentukan senyawa gaharu. Inokulasi Acremonium sp. pada
A. malaccensis (klon Ama1, Ama 7 dan Ama 13), A. microcarpa (klon Ami 5,
Ami 8 dan P6), A. crassna (klon Ac 14) dan Gyrinops verstegii (klon Af1.8) mampu mempengaruhi kebugaran dan menginduksi wangi pada semua tunas gaharu tersebut (Rahayu & Situmorang 2004).
Cendawan yang menginfeksi tanaman dan menyebabkan penyakit dapat mengganggu aktivitas bahkan mematikan jaringan atau sel-sel tanaman dengan beberapa mekanisme. Mekanisme tersebut mencakup kekuatan mekanik, enzim, dan toksin (Williams 1979). Kekuatan mekanik terutama digunakan oleh patogen dalam proses infeksi menembus permukaan tubuh inang (Brown 1980).
Enzim-enzim hidrolitik yang menghidrolisis pektin, selulosa, lemak, dan protein menjadi monomernya, berperan dalam proses infeksi. Cendawan patogen mensekresikan enzim ekstraseluler yang cukup untuk memaserasi jaringan pada stadia infeksi lanjut. Di antara enzim hidrolitik, pektinase merupakan enzim yang dihasilkan oleh hampir seluruh cendawan patogen (Williams 1979).
Aktivitas suatu enzim hidrolitik sering didukung oleh beberapa enzim. Sebagai contoh, glukanase, glukan-selobiohidrolase (CBH), dan β-glukosidase (β-G) merupakan enzim-enzim yang berperan dalam degradasi selulosa. Glukanase sendiri terdiri atas eksoglukanase dan endoglukanase (EG). Enzim-enzim pektin
metil esterase (PME), poligalakturonase (PG), pektin metil galaktorunase (PMG), pektin transeliminase (PTE) dan pektin acid transeliminase (PATE) merupakan pendukung aktivitas pektinolitik (Goodman et al. 1986 ; Dahm & Strzelczyk 1987).
Toksin merupakan metabolit sekunder yang dihasilkan cendawan patogen yang berpengaruh merusak terhadap satu atau lebih fungsi penting dalam sel-sel tanaman inang. Toksin ada yang bekerja mengubah fungsi membran plasma sehingga mengakibatkan kebocoran elektrolit dari dalam sel, ada pula yang mempengaruhi fungsi kloroplas atau aktivitas mitokondria. Jenis-jenis Fusarium dilaporkan menghasilkan toksin yang berbeda-beda (Williams 1979; Goodman et
al. 1986). Semua cendawan-cendawan patogen termasuk Fusarium dan Acremonium menghasilkan suatu senyawa toksin (mikotoksin) yang sangat kuat
yang dapat mematikan sel-sel inang (pohon) (Richard 2003). Mikotoksin yang dihasilkan oleh cendawan patogen termasuk Fusarium dan Acremonium merupakan senyawa yang amat membahayakan pohon inang termasuk jika masuk ke dalam tubuh hewan dan manusia (Agrios 2005).
Jadi mikotoksin yang dihasilkan oleh Fusarium dan Acremonium akan mengganggu bahkan mematikan sel atau jaringan pohon gaharu sehingga pohon gaharu akan melakukan pertahanan dengan mengeluarkan senyawa sesquiterpenoid yang merupakan senyawa gaharu atau gubal gaharu yang memiliki aroma wangi.
2.3 Jasmonat
Jasmonat khususnya asam jamonat dan metil ester (metil jasmonat) merupakan penghubung antara serangga (patogen lain) dan ketahanan (resisten) terhadap penyakit (William et al. 2004). Menurut Babst et al. (2005), metil jasmonat (MeJA) merupakan fitohormon endogen.
MeJA memiliki peran dalam meregulasi beberapa proses fisiologis tanaman, misalnya merangsang pertumbuhan akar dan transportasi karbon tanaman (Babst et al. 2005), induksi pematangan buah, sinyal regulasi ekspresi gen pada proses penuaan daun dan bunga (Srivastava 2002), dan sinyal transduksi respon ketahanan tanaman terhadap cekaman biotik dan abiotik (Yang et al.
1997). MeJA akan menjadi komponen yang lebih aktif jika diberikan dalam bentuk fitohormon eksogen (Srivastava 2002).
MeJA dan etilen berperan sebagai komponen sinyal kunci untuk menginduksi mekanisme pertahanan dan pertahanan sistemik meliputi lintasan-lintasan fenilpropanoid dan terpenoid resin pada konifer (Hudgins & Franceschi 2004). Michiho (2005) melaporkan bahwa pemberian MeJA 0,1 mM dapat menginduksi terbentuknya senyawa terpenoid pada kalus A. sinensis, kemudian Rahayu et al. (2009a) melaporkan bahwa pemberian satu kali MeJA 750 mM cenderung mendorong untuk meningkatkan intensitas perubahan warna, memperpanjang dan memperlebar zona perubahan warna, serta kandungan sterol pada A. microcarpa.
2.4 Asam Salisilat
Asam salisilat merupakan derivat senyawa fenolik tanaman yang terdistribusi pada berbagai bagian penting tanaman budidaya, dan mempunyai peran penting dalam pengaturan pertumbuhan dan perkembangan tanaman (Raskin 1995).
Asam salisilat dilaporkan memenuhi kriteria sebagai hormon tumbuhan dan dapat merangsang pertumbuhan tunas kultur kulit tembakau (Salisburry & Ross 1985; Davies 1995). Asam salisilat diidentifikasi sebagai
senyawa florigen yang dapat memacu pembentukan
batang dan bunga Sauramatum guttatum, meningkatkan toleransi panas pada bibit mustard dan memberikan perlindungan terhadap tekanan temperatur rendah pada jagung. Asam salisilat yang dikombinasikan dengan kinetin dan Indole Acetic
Acid (IAA) dapat merangsang pertumbuhan tunas dan umbi kentang (Davies
1995). Penelitian Raskin (1995) menunjukkan bahwa asam salisilat juga dapat meningkatkan aktivitas nitrat reduktase pada semaian bibit jagung. Asam salisilat dan 100 mM Na dapat meningkatkan aktivitas isoenzim aldehid-oksidase pada aklimatisasi tanaman tomat. Peranan asam salisilat yang diberikan secara eksogen dalam memacu pertumbuhan bibit pisang Ambon Curup diduga mengikuti peran yang ditunjukkan oleh aplikasi zat pengatur tumbuh (ZPT). Asam salisilat dengan konsentrasi antara 124,48 mM - 211,58 mM mampu
meningkatkan pertumbuhan bibit pisang Ambon Curup (Mukhtasar et al. 2004). Asam salisilat selain memiliki fungsi di atas, juga mempunyai fungsi yang lain. Conrath et al. (1995) menyebutkan bahwa asam salisilat atau 2-hidroksi-benzoat merupakan salah satu molekul signal untuk terjadinya aktivasi sistem pertahanan tanaman.
3 BAHAN DAN METODE PENELITIAN
3.1 Waktu dan TempatPenelitian dilakukan di kebun gaharu, Jabon-Parung, Bogor mulai dari bulan April sampai dengan Desember 2009.
3.2 Alat dan Bahan Alat
Alat-alat yang diperlukan dalam penelitian ini adalah cawan Petri, erlemeyer, penangas, sendok (makan dan teh), jarum inokulasi, lampu bunsen, laminar flow, autoklaf, panci, kompor gas, botol selai, bor listrik dan matanya yang berdiameter 4 mm, jenset, pipet mikro, pipet, penggaris, meteran, pisau, martil (palu), pahat, gelas kimia, kertas saring, tabung reaksi, spektofotometer dan alat timbangan.
Bahan
Bahan-bahan yang dibutuhkan dalam penelitian ini antara lain; biakan murni Acremonium sp. IPBCC 07525, Potato Dekstrosa Agar (PDA), alkohol 70 %, alkohol absolut 98 %, aquades, metil jasmonat (MeJA) 750 mM dalam air, asam salisilat 100 mM dalam alkohol 98 %, bahan inokulan, air, pohon gaharu (A.
crassna) berdiameter ± 20 cm, asam asetat anhidrat, dietil eter, H2SO4
3.3 Metode
dan etanol absolut.
3.3.1 Persiapan Inokulan Acremonium
Kultur stok Acremonium sp. diremajakan dan biakan yang berumur 7 hari menjadi sumber inokulan. Acremonium sp. dibiakan kembali dalam media jagung pecah steril selama 2 minggu dan dijadikan sumber inokulum bagi pembuatan inokulan (pelet).
Acremonium sp. pada media jagung dibiakkan pada media serbuk gergaji
(Rahayu, komunikasi pribadi, 8 Februari 2008) dan diinkubasi selama 2 sampai 4 minggu dan kemudian dibentuk berupa pelet.
3.3.2 Pembuatan Larutan MeJA dan Asam Salisilat
Larutan MeJA yang akan dipergunakan dalam penelitian ini adalah MeJA dengan konsentrasi 750 mM, sebagai pelarutnya adalah aquades steril. Sementara larutan asam salisilat yang akan digunakan adalah larutan asam salisilat dengan konsentrasi 100 mM, sebagai pelarutnya adalah alkohol absolut 98 %.
3.3.3 Induksi Pembentukkan Gubal Gaharu
Induksi pembentukkan gubal gaharu dilakukan pada pohon gaharu (A. crassna) yang berumur ± 10 tahun dan berdiameter ± 20 cm dengan berbagai perlakuan penginduksi pembentukkan gubal gaharu menggunakan senyawa kimia dan Acremonium sp. (Tabel 6). Batang pohon pada ketinggian ± 70 cm di atas permukaan tanah dilubangi dengan mata bor berdiameter 4 mm sampai kedalaman ± 1/3 dari diameter batang (Gambar 3). Sederetan lubang (20 lubang/pohon) dibuat dengan jarak arah vertikal ± 15 cm dan jarak ke arah horizontal ± 5 cm. Pada perlakuan ganda (Tabel 6), lubang-lubang ini diberi berurut-turut dengan 1 ml asam salisilat, 1 ml MeJA dengan jarak pemberian 1 minggu bergantung jenis kombinasinya.
Tabel 6. Perlakuan inokulasi pada pohon gaharu.
Kode Perlakuan AMF AM AF MF A M F K+
Kombinasi asam salisilat, MeJA, Acremonium IPBCC 07525 Kombinasi asam salisilat dan MeJA
Kombinasi asam salisilat dan Acremonium IPBCC 07525 Kombinasi MeJA dan Acremonium IPBCC 07525 Asam salisilat
MeJA
Acremonium IPBCC 07525
Batang pohon gaharu yang dibor saja (sebagai kontrol)
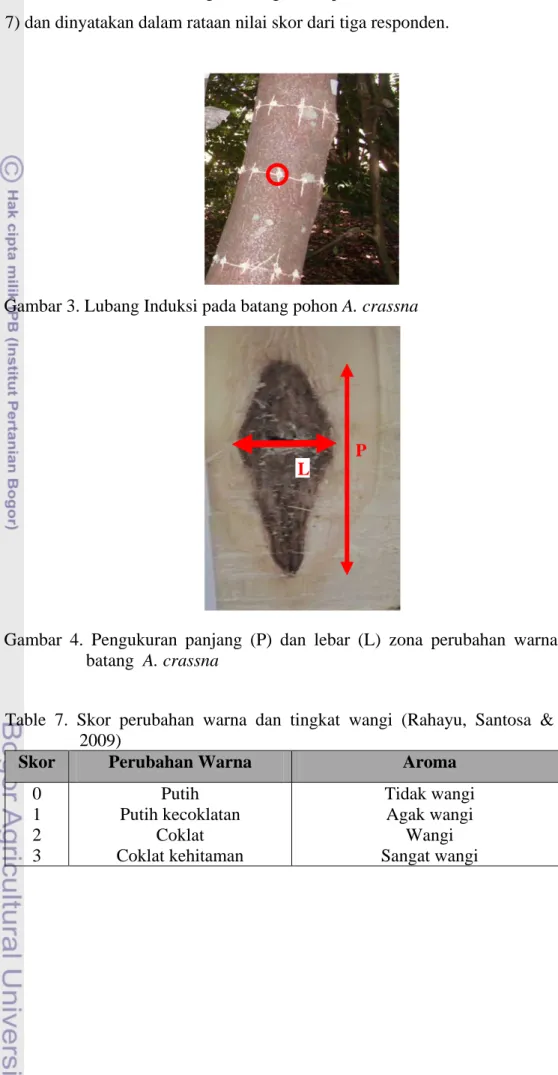
Pengamatan terhadap pembentukan gubal (warna kayu dan tingkat wangi kayu ketika kayu dibakar) dilakukan setiap bulan setelah induksi (bsi) selama 4 bulan pada lubang induksi yang berbeda. Perubahan warna kayu meliputi tingkat perubahan dan luas zona perubahan warna kayu. Tingkat perubahan warna kayu ditetapkan berdasarkan sistem skor (Tabel 7) dan dinyatakan dalam rataan skor dari tiga responden. Zona perubahan warna kayu dinyatakan dalam panjang dan
lebar zona (Gambar 4). Tingkat wangi ditetapkan berdasarkan sistem skor (Tabel 7) dan dinyatakan dalam rataan nilai skor dari tiga responden.
Gambar 3. Lubang Induksi pada batang pohon A. crassna
Gambar 4. Pengukuran panjang (P) dan lebar (L) zona perubahan warna pada batang A. crassna
Table 7. Skor perubahan warna dan tingkat wangi (Rahayu, Santosa & Ririn 2009)
Skor Perubahan Warna Aroma
0 1 2 3 Putih Putih kecoklatan Coklat Coklat kehitaman Tidak wangi Agak wangi Wangi Sangat wangi P L
3.3.4 Uji Terpenoid dengan Metode Lieberman-Burchard
Bagian kayu yang menunjukkan perubahan warna dari satu sampel dipisahkan dari bagian kayu yang tidak menunjukkan perubahan warna. Kayu-kayu yang menunjukkan perubahan warna dan merupakan hasil dari satu perlakuan digabungkan. Sebanyak ± 0,4 gram kayu yang berubah warna tersebut direndam dalam 5 ml etanol absolut panas (didihkan) kemudian disaring dan diuapkan hingga kering sampai terbentuk endapan berwarna kuning.
Endapan tersebut kemudian ditambahkan 1 ml dietil eter dan dihomogenisasi. Setelah endapan dihomogenisasi selanjutnya dipindahkan ke dalam tabung reaksi steril lalu ditambahkan 3 tetes asam asetat anhidrat dan 1 tetes H2SO4
3.4 Analisis Data
pekat. Warna merah kecoklatan atau ungu yang terbentuk pada endapan menunjukkan adanya senyawa triterpenoid. Warna hijau sampai kuning kehijauan mengindikasikan sterol. Ke dalam larutan ekstrak gaharu tersebut, ditambahkan sebanyak 5 ml etanol absolut kemudian absorbansinya diukur dengan spektrofotometer pada λ 268 nm. Nilai absorbansi tersebut dipergunakan untuk menentukan konsentrasi senyawa terpenoid melalui konversi kurva standar terpenoid dari minyak gaharu alami.
Percobaan dilakukan dalam Rancangan Acak Lengkap dan dianalisis menggunakan program SAS, dan diuji ANOVA pada α = 5 %. Bila perlakuan berpengaruh nyata maka setiap perlakuan dibandingkan dengan menggunakan uji lanjut Duncan pada taraf uji 5 %. Transformasi dilakukan pada data yang menunjukkan koefisien variasi yang besar.
4 HASIL DAN PEMBAHASAN
4.1 HASIL4.1.1 Gejala Pembentukkan Gubal Gaharu
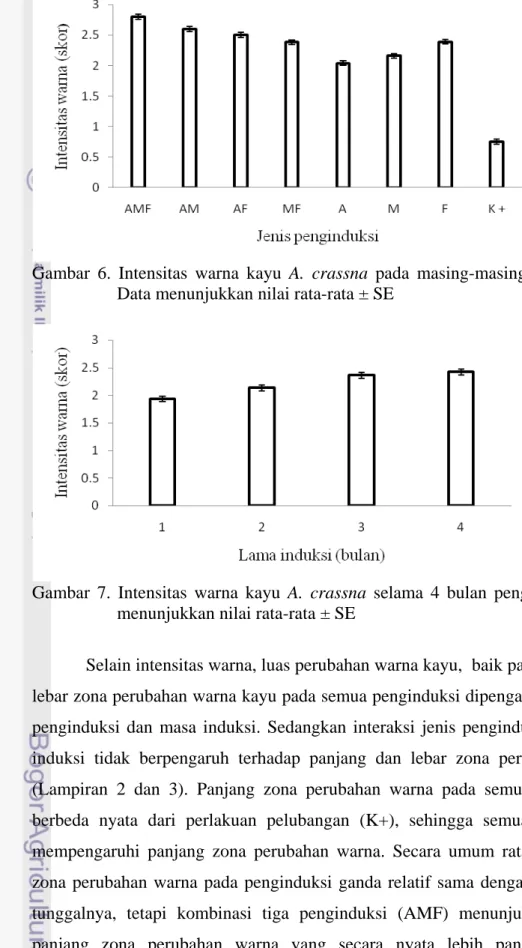
Gejala pembentukkan gubal ditandai oleh adanya perubahan warna kayu dan munculnya aroma wangi ketika bagian kayu yang berubah warnanya itu dibakar. Semua kayu gaharu yang diinduksi mengalami perubahan warna (Gambar 5 dan 6) dan mengeluarkan beragam aroma. Perubahan warna kayu dipengaruhi oleh jenis penginduksi dan masa induksi. Sedangkan interaksi jenis penginduksi dan masa induksi tidak berpengaruh terhadap perubahan warna (Lampiran 1). Secara umum semua penginduksi merangsang perubahan warna dengan intensitas yang berbeda nyata dibanding perlakuan pelubangan (K+), sehingga semua penginduksi efektif dalam merangsang perubahan warna. Induksi ganda cenderung tidak menyebabkan perubahan warna dengan intensitas lebih tinggi daripada penginduksi tunggal, tetapi kombinasi tiga penginduksi (AMF) menunjukkan intensitas warna yang secara nyata lebih gelap daripada penginduksi tunggal (Gambar 6). Intensitas warna juga meningkat secara nyata pada 3 bsi pada semua penginduksi (Gambar 7).
0 1 2 3
Gambar 5. Warna kayu gaharu A. crassna setelah diberi perlakuan (0 = Putih, 1 = Putih kecoklatan, 2 = coklat dan 3 = Coklat kehitaman) setelah 4 bulan induksi.
Gambar 6. Intensitas warna kayu A. crassna pada masing-masing penginduksi. Data menunjukkan nilai rata-rata ± SE
Gambar 7. Intensitas warna kayu A. crassna selama 4 bulan pengamatan. Data menunjukkan nilai rata-rata ± SE
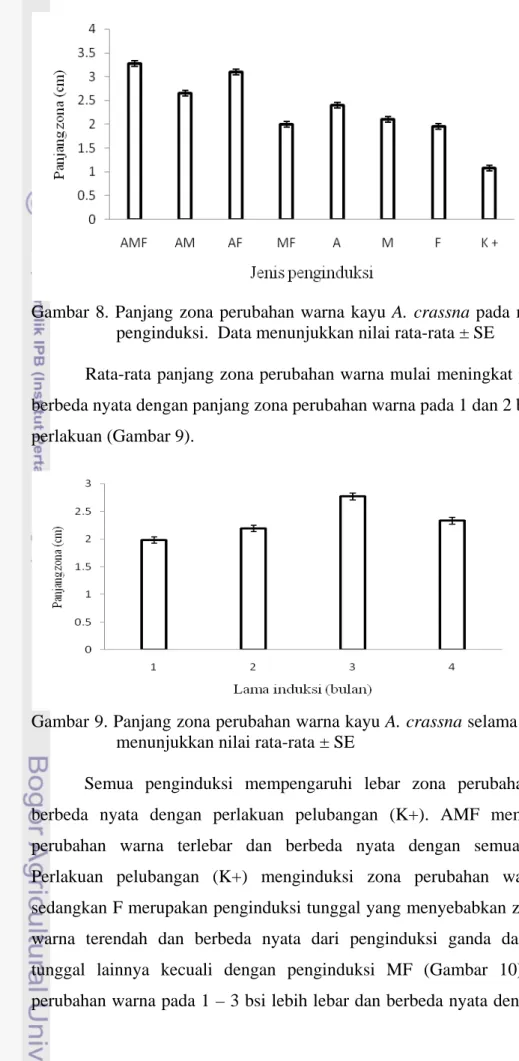
Selain intensitas warna, luas perubahan warna kayu, baik panjang maupun lebar zona perubahan warna kayu pada semua penginduksi dipengaruhi oleh jenis penginduksi dan masa induksi. Sedangkan interaksi jenis penginduksi dan masa induksi tidak berpengaruh terhadap panjang dan lebar zona perubahan warna (Lampiran 2 dan 3). Panjang zona perubahan warna pada semua penginduksi berbeda nyata dari perlakuan pelubangan (K+), sehingga semua penginduksi mempengaruhi panjang zona perubahan warna. Secara umum rata-rata panjang zona perubahan warna pada penginduksi ganda relatif sama dengan penginduksi tunggalnya, tetapi kombinasi tiga penginduksi (AMF) menunjukkan rata-rata panjang zona perubahan warna yang secara nyata lebih panjang daripada penginduksi tunggal (Gambar 8).
Gambar 8. Panjang zona perubahan warna kayu A. crassna pada masing-masing penginduksi. Data menunjukkan nilai rata-rata ± SE
Rata-rata panjang zona perubahan warna mulai meningkat pada 3 bsi dan berbeda nyata dengan panjang zona perubahan warna pada 1 dan 2 bsi pada semua perlakuan (Gambar 9).
Gambar 9. Panjang zona perubahan warna kayu A. crassna selama 4 bulan. Data menunjukkan nilai rata-rata ± SE
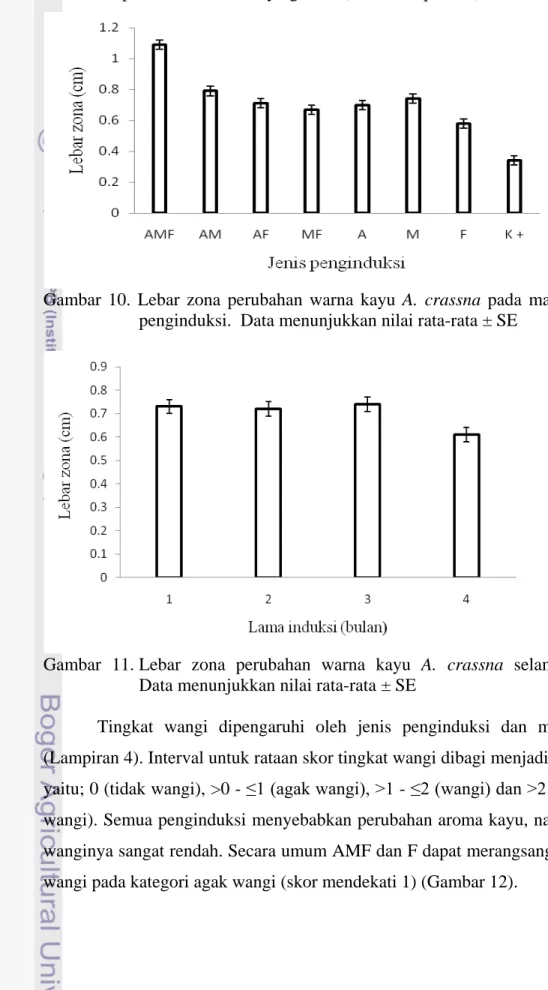
Semua penginduksi mempengaruhi lebar zona perubahan warna dan berbeda nyata dengan perlakuan pelubangan (K+). AMF memberikan zona perubahan warna terlebar dan berbeda nyata dengan semua penginduksi. Perlakuan pelubangan (K+) menginduksi zona perubahan warna terendah, sedangkan F merupakan penginduksi tunggal yang menyebabkan zona perubahan warna terendah dan berbeda nyata dari penginduksi ganda dan penginduksi tunggal lainnya kecuali dengan penginduksi MF (Gambar 10). Lebar zona perubahan warna pada 1 – 3 bsi lebih lebar dan berbeda nyata dengan 4 bsi pada
semua perlakuan (Gambar 11). Panjang zona perubahan warna berkorelasi dengan lebar zona perubahan warna kayu gaharu (r = 0,523, p<0,05).
Gambar 10. Lebar zona perubahan warna kayu A. crassna pada masing-masing penginduksi. Data menunjukkan nilai rata-rata ± SE
Gambar 11. Lebar zona perubahan warna kayu A. crassna selama 4 bulan. Data menunjukkan nilai rata-rata ± SE
Tingkat wangi dipengaruhi oleh jenis penginduksi dan masa induksi (Lampiran 4). Interval untuk rataan skor tingkat wangi dibagi menjadi 4 kelompok yaitu; 0 (tidak wangi), >0 - ≤1 (agak wangi), >1 - ≤2 (wangi) dan >2 - ≤3 (sangat wangi). Semua penginduksi menyebabkan perubahan aroma kayu, namun tingkat wanginya sangat rendah. Secara umum AMF dan F dapat merangsang munculnya wangi pada kategori agak wangi (skor mendekati 1) (Gambar 12).
Gambar 12. Tingkat wangi kayu A. crassna pada masing-masing penginduksi. Data menunjukkan nilai rata-rata ± SE
Selama masa pengamatan, kayu gaharu pada titik induksi menunjukkan tingkat wangi yang bervariasi mulai tidak wangi (skor 0) sampai sangat wangi (skor 3). Wangi dibagi dalam tiga kategori yaitu agak wangi, wangi dan sangat wangi. Induksi pada kategori sangat wangi, hanya diperoleh dari penginduksi MF dan F, meskipun frekuensinya rendah yaitu berturut-turut 22,2 % dan 11,1 % pada 3 bsi dan 4 bsi (Tabel 8).
Semua penginduksi dapat merangsang munculnya aroma kayu yang berbeda dari aroma kayu sehat. Aroma ini dapat mirip dengan bau karet terbakar, bau kopi sampai aroma khas gaharu. Aroma khas gaharu hanya terdeteksi pada titik induksi F. Penginduksi F mengeluarkan aroma khas gaharu yang mulai terdeteksi pada bulan ke satu induksi dengan frekuensi 11,1 % (tingkat wangi berada pada kategori agak wangi). Frekuensi ini meningkat menjadi 2-3 kali pada bulan-bulan berikutnya.
Peningkatan skor wangi pada 2 – 4 bsi dan berbeda nyata dengan tingkat wangi pada 1 bsi, namun peningkatan ini tidak mencapai wangi pada katagori agak wangi pada semua penginduksi (Gambar 13). Intensitas warna tidak berkorelasi dengan tingkat wangi kayu gaharu (r = 0,022, p<0,05).
Tabel 8. Frekuensi titik induksi yang wangi
Penginduksi
Frekuensi Titik Induksi Kategori Wangi
1 2 3 4 AW W SW AW W SW AW W SW AW W SW AMF - - - 44,4 11,1 - 44,4 22,2 - 44,4 11,1 - AM 11,1 - - 33,3 - - 22,2 22,2 - 11,1 11,1 - AF 22,2 - - - 11,1 - - - - 22,2 11,1 - MF 11,1 - - 11,1 - - 11,1 - 22,2 33,3 - - A 11,1 - - 22,2 - - 11,1 - - 22,2 11,1 - M 22,2 - - 33,3 - - - - - 11,1 - - F 11,1 - - 33,3 - - 33,3 11,1 - 22,2 22,2 11,1 K+ - - - 33,3 - - - - -
Keterangan : Agak wangi (AW), wangi (W) dan sangat wangi (SW)
Gambar 13. Tingkat wangi kayu A. crassna selama 4 bulan. Data menunjukkan nilai rata-rata ± SE
4.1.2 Pembentukkan Senyawa Terpenoid
Hasil uji kandungan senyawa terpenoid, menunjukkan bahwa endapan ekstrak kayu gaharu memiliki warna mulai dari hijau, hijau kekuningan, kuning, coklat, coklat kemerahan sampai coklat kehitaman (Gambar 14).
AMF AM AF MF
A M F K+
Gambar 14. Hasil Uji Lieberman-Burchard pada ekstrak kayu A. crassna pada bulan ke-4 masa induksi
Ekstrak gaharu pada umumnya menunjukkan warna hijau sampai hijau kekuningan pada 1 bsi (Tabel 9). Endapan berwarna coklat terdeteksi pada beberapa penginduksi seperti pada penginduksi AMF, MF, F dan K+ pada 2 bsi. Semakin banyak penginduksi yang ekstrak kayunya menunjukkan endapan berwarna coklat terjadi pada 3 bsi. Selama masa induksi, semua penginduksi berpotensi untuk menyebabkan ekstrak kayu membentuk endapan coklat, kecuali AF. Warna coklat sampai coklat kehitaman menunjukkan terdeteksinya senyawa-senyawa dalam kelompok triterpenoid, sedangkan warna hijau menunjukkan bahwa pada endapan terdapat senyawa sterol. Warna-warna selain warna hijau dan coklat sampai coklat kehitaman menunjukkan dalam endapan tersebut terdapat senyawa-senyawa lain yang tidak diketahui.
Endapan hasil ekstrak menunjukkan kepekatan yang berbeda-beda. Hasil pengukuran kadar senyawa triterpenoid berdasarkan konversi dengan kurva standar minyak gaharu menunjukkan bahwa penginduksi AM dan F memiliki kandungan triterpenoid dengan konsentrasi tertinggi yaitu 268,25 ppm kemudian diikuti oleh penginduksi MF (213 ppm), A (202,17 ppm), AMF (191,17 ppm), K+ (139,33 ppm) dan M (108,58 ppm) pada pohon dan bulan yang berbeda (Tabel 10).
Dalam penentuan konsentrasi senyawa gaharu, yang dipakai sebagai pembanding adalah minyak gaharu asal Kalimantan. Ketika diuji dengan metode Liberman-Burchad, minyak gaharu tersebut menampakkan warna coklat kemerahan dengan nilai absorbansi 3,010. Warna yang ditimbulkan ini menunjukkan bahwa di dalam endapannya mengandung senyawa triterpenoid.
Inokulasi penginduksi yang sama pada pohon yang berbeda memperlihatkan respon yang berbeda. Hal ini ditunjukkan oleh perbedaan warna ekstrak pada uji senyawa terpenoid dan perbedaan konsentrasi senyawa yang dikandungnya. Konsentrasi senyawa terpenoid yang tinggi tidak menunjukkan bahwa di dalam endapan ekstrak tersebut mengandung senyawa triterpenoid (Tabel 10).
Tabel 9. Warna endapan ekstrak kayu selama 4 bulan pengamatan
Perlakuan Pohon Pengamatan bulan ke-
1 2 3 4
AMF 1 Hijau Hijau Hijau Hijau
2 Hijau kekuningan Coklat Coklat Coklat
3 Hijau Coklat Kehitaman Coklat Kehitaman Hijau
AM 4 Hijau Kuning Hijau Coklat
5 Hijau kekuningan Hijau Coklat Hijau
6 Hijau Hijau Hijau Coklat
AF 7 Hijau Hijau Hijau kekuningan Hijau
8 Hijau kekuningan Kuning Hijau Hijau
9 Hijau Kuning Hijau Hijau
MF 10 Hijau kekuningan Coklat Coklat Kehitaman Coklat
11 Hijau Hijau kekuningan Hijau Hijau
12 Hijau kekuningan Coklat Coklat kemerahan Coklat
A 13 Hijau Hijau Hijau Hijau
14 Hijau kekuningan Kuning Coklat Hijau
15 Hijau Hijau Coklat Coklat
M 16 Hijau Kuning Coklat Coklat
17 Hijau Hijau Hijau Hijau
18 Hijau Kuning Kuning Hijau kecoklatan
F 19 Hijau Kuning kecoklatan Hijau Coklat
20 Hijau kekuningan Hijau Kuning kecoklatan Hijau 21 Hijau Kuning kecoklatan Kuning kecoklatan Coklat
K+ 22 Hijau kekuningan Coklat Coklat Coklat
23 Hijau Kuning Coklat Coklat
24 Hijau Kuning Kuning kecoklatan Coklat
Keterangan : Warna hijuau menunjukkan sterol, warna coklat-coklat kehitaman menunjukkan triterpenoid sedangkan warna-warna yang lain kemungkinan mengandung senyawa lain.
Intensitas warna tidak berkorelasi dengan konsentrasi senyawa terpenoid (r = 0,063), demikian juga tingkat wangi tidak berkorelasi dengan konsentrasi senyawa terpenoid (r = 0,049).
Penginduksi Pohon Pengamatan Bulan Ke- 1 2 3 4 AMF 1 64,25* 74,67* 16,42* 118,42* 2 89,17 175,42** 152,25** 159** 3 66,67* 191,17** 182,75** 152,58* AM 4 105,42* 3,58 81,5* 268,25** 5 100,08 47,75* 196,83** 105,33* 6 111,08* 24,83* 16,25* 127,67** AF 7 11,67* 3,42* 45,75 94,42* 8 53,92 45,67 16,67* 36* 9 21,42* 36,42 19,17* 98,42* MF 10 143,25 158** 184,08** 137,92** 11 57,33* 56,33 75,08* 88,17 12 140,42 97** 167,42** 213** A 13 31,67* 30,5* 26,58* 47,75* 14 88,58 75 71,83** 70,58* 15 69,42* 62,17* 173,25** 202,17** M 16 43,42* 61,25 106,67** 108,58** 17 52,25* 80,5* 70,08* 160,08* 18 58,67* 66,83 124,42 171,75 F 19 26,08* 108,33 27,83* 213** 20 90,33 114,58* 113 187,08* 21 5,58* 50,67 163,58 268,25** K + 22 98 136,17** 136,58** 139,33** 23 33,5* 64,08 170,75** 97** 24 47,83* 61,25 43,58 40,67**
Keterangan : Angka yang diikuti oleh (*) = sterol, Angka yang diikuti oleh (**) = triterpenoid sedangkan angka yang tidak ditandai diduga adalah senyawa lain.
4.2 PEMBAHASAN
4.2.1 Induksi Gejala Pembentukkan Gubal Gaharu
Secara umum semua penginduksi merangsang perubahan warna dengan intensitas dan zona perubahan warna yang berbeda nyata dibanding perlakuan pelubangan (K+), sehingga semua penginduksi efektif dalam merangsang perubahan warna. Pelukaan, pemberian asam salisilat, MeJA dan inokulasi
putih menjadi gelap. Perubahan warna ini terjadi akibat adanya akumulasi senyawa gaharu yang berhasil diinduksi oleh semua perlakuan tersebut di atas. Perubahan warna kayu telah dilaporkan dapat disebabkan oleh pelukaan, serangan patogen (cendawan), dan penggunaan senyawa kimia (Walker et al. 1997). Pemberian MeJA secara berulang dan pelukaan dapat menyebabkan perubahan warna kayu gaharu Aquilaria crassna yang berkisar dari putih kecoklatan sampai coklat kehitaman (Hamim et al. 2009). Pemberian etepon 0,5 %, 1,5 % dan 2,5 % serta inokulasi Acremonium sp. dapat menginduksi perubahan warna pada kayu gaharu A. microcarpa (Rahayu et al. 2009b). Perubahan warna kayu merupakan respon non spesifik dari pohon gaharu. Hal ini dibuktikan oleh semua penginduksi dan pelukaan dapat menyebabkan perubahan warna pada kayu gaharu.
Penginduksi tiga kombinasi (AMF) menghasilkan intensitas perubahan warna yang tidak berbeda nyata dengan penginduksi ganda (AM), tetapi panjang dan lebar zona perubahan warnanya berbeda nyata. Tidak berbedanya intensitas perubahan warna antara penginduksi AMF dengan AM diduga karena akumulasi senyawa gaharunya tidak cukup untuk memberikan kesan intensitas yang berbeda. Adanya penambahan panjang dan lebar zona perubahan warna yang dihasilkan penginduksi AMF, kemungkinan disebabkan oleh pengaruh inokulasi
Acremonium sp. pada penginduksi tersebut. Hal ini sesuai dengan hasil penelitian
Putri et al. (2008) bahwa inokulasi Acremonium sp. menghasilkan panjang dan lebar zona perubahan warna yang lebih besar dibandingkan dengan penginduksi senyawa kimia saja.
Acremonium sp. merupakan salah satu cendawan patogen pada berbagai
tanaman termasuk pohon gaharu. Cendawan ini pada pohon gaharu dapat menginduksi terbentuknya senyawa gaharu (senyawa fitoaleksin). Rahayu et al. (1999) melaporkan bahwa Acremonium sp. merupakan salah satu cendawan yang terbukti dapat menginduksi terbentuknya senyawa gaharu (senyawa fitoaleksin) pada pohon Aquilaria. Ramadani et al. (2005) juga melaporkan bahwa pelet
Acremonium sp. dapat menginduksi pembentukkan gubal gaharu pada pohon A. crassna umur 1 sampai 3 tahun. Ditambahkan oleh Rahayu et al. (2009c) bahwa
inokulasi Acremonium sp. dan Fusarium sp. dalam bentuk inokulan tunggal atau inokulan ganda dapat merangsang pohon gaharu A. microcarpa membetuk
(2008) juga melaporkan bahwa inokulasi Acremonium sp. pada A. crassna terbukti dapat merangsang pembentukkan senyawa fitoaleksin (senyawa gaharu).
Inokulasi Acremonium sp. yang berbentuk pelet pada pohon gaharu yang sebelumnya telah dilubangi akan memberi kemudahan pada cendawan ini untuk tumbuh, khususnya dengan adanya air, unsur hara dan metabolit primer yang tersedia pada pohon gaharu tersebut. Tersedianya faktor ini mendukung propagul infektif (konidia dan askospora) dari Acremonium sp. untuk berkecambah membentuk hifa. Hifa cendawan ini selanjutnya akan melakukan penetrasi ke sel dan jaringan dari pohon gaharu melalui ruang antar sel (lamela) atau penetrasi langsung dengan melisis dinding sel dan membran sel, yang lambat laun akhirnya akan menginfeksi. Williams (1979) menjelaskan bahwa, infeksi cendawan patogen termasuk Acremonium sp. melibatkan beberapa mekanisme diantaranya kekuatan mekanik, enzim dan toksin.
Infeksi Acremonium sp. pada pohon gaharu A. crassna akan meluas karena adanya penyebaran propagul infektif (askospora dan konidia) dari Acremonium sp. melalui berkas pembuluh ke bagian tubuh tumbuhan A. crassna yang lain sehingga zona infeksi dari Acremonium sp. akan bertambah luas. Penyebaran propagul infektif Acremonium sp. akan terjadi seperti pada cendawan patogen yang lain. Agrios (2005) menjelaskan bahwa cendawan patogen Fusarium
oxysporum f.sp. lycopersicum yang patogen pada cabai dan Fusarium oxysporum
f.sp. zingiberi pada jahe masuk melalui akar yang luka, kemudian melakukan penetrasi ke jaringan pembuluh melalui parenkim dan berkembang di xilem, di bagian ini dimungkinkan propagul infektif akan menyebar ke bagian tubuh tumbuhan yang lain.
Adanya penambahan luas zona infeksi dari cendawan ini berpengaruh terhadap luasan dari zona akumulasi senyawa gaharu (senyawa fitoaleksin) yang mengakibatkan penambahan zona perubahan warna. Asam salisilat dan MeJA merupakan senyawa kimia yang juga berperan penting dalam menginduksi pembentukan senyawa fitoaleksin. Klessig et al. (2001) menjelaskan bahwa asam salisilat berperan penting dalam memberikan isyarat untuk mengaktifkan tanggapan pertahanan tanaman yang mengikuti infeksi patogen. Asam salisilat
bersama metil jasmonat juga merupakan elisitor kimiawi yang merangsang pembentukan senyawa fitoaleksin (Franceschi et al. 2002; Taiz & Zeiger 2002).
Pemberian asam salisilat dan metil jasmonat secara eksogen ditambah dengan inokulasi Acremonium sp. (kombinasi tiga penginduksi AMF) pada pohon gaharu A. crassna merupakan faktor penentu dalam penambahan zona akumulasi senyawa fitoaleksin pada jaringan kayu gaharu A. crassna tersebut. Situmorang & Rahayu (2004) menjelaskan bahwa senyawa gaharu yang merupakan resin dari pohon gaharu yang terbentuk tidak dikeluarkan dari pohon, melainkan disimpan pada jaringan kayu sehingga jaringan kayu putih yang bertekstur halus menjadi gelap dan keras. Hamim et al. (2009) melaporkan bahwa akumulasi senyawa gaharu pada A. crassna terjadi pada jaringan parenkim jejari, unsur trakea xilem dan empulur. Rahayu & Situmorang (2006) menjelaskan bahwa, senyawa fitoaleksin pada gaharu diduga dideposit pada kayu dan berkaitan dengan perubahan warna. Semakin luas zona infeksi dan semakin banyak senyawa fitoaleksin yang terdeposit di kayu gaharu akan berdampak pada zona perubahan warna yang semakin tinggi.
Intensitas dan zona perubahan warna penginduksi AMF berbeda nyata dengan penginduksi tunggalnya A, M dan F. Hal ini diduga terkait dengan kemampuan pengiduksi A, M dan F dalam bentuk kombinasi (AMF) lebih kuat bila dibandingkan dengan penginduksi tersebut diberikan secara tunggal. Hal ini sesuai dengan laporan Rahayu et al. (2009a) bahwa, inokulasi Acremonium sp. yang dikombinasikan dengan pemberian MeJA lebih efektif dalam menginduksi perubahan warna kayu gaharu A. microcarpa dengan intensitas dan zona perubahan warna yang lebih tinggi dan lebih besar bila dibandingkan dengan penginduksian secara sendiri-sendiri selama 3 bulan induksi.
Penginduksi ganda AF dan MF menghasilkan intensitas perubahan warna yang tidak berbeda nyata, tetapi berbeda dalam panjang zona perubahan warnanya, meskipun intensitas dan zona perubahan warna perlakuan tunggalnya tidak berbeda. Hal ini mungkin disebabkan oleh perbedaan kemampuan asam salisilat dan MeJA dalam mempengaruhi aktivitas Acremonium sp. dalam menginduksi panjang zona perubahan warna dan adanya perbedaan ketahanan
dalam penelitian ini.
Perbedaan kemampuan antara asam salisilat dan MeJA dalam mempengaruhi aktivitas Acremonium sp. diduga terkait dengan adanya perbedaan zona penyebaran (migrasi) antara kedua senyawa tersebut dan oleh sifat
Acremonium sp. yang lebih bersinergi dengan asam salisilat daripada metil
jasmonat. Transportasi asam salisilat dan MeJA terjadi melalui berkas pembuluh, baik xilem maupun floem menuju daerah basal dan apeks dari tanaman. Rocher et
al. (2006) melaporkan bahwa transportasi asam salisilat ke akar melalui berkas
pembuluh xilem dan ditransportasikan kembali ke bagian tanaman yang lain melalui berkas pembuluh floem.
Hasil penelitian memperlihatkan bahwa, penginduksi AF menghasilkan panjang zona perubahan warna yang lebih panjang daripada penginduksi MF. Hasil penelitian ini sesuai dengan laporan Rahayu (2010) bahwa panjang zona perubahan warna kayu gaharu A. crassna yang diinduksi oleh asam salisilat dengan konsentrasi 100 mM yang diamati pada hari ke-10 setelah induksi adalah 11 cm dan panjang perubahan warna ini terus bertambah seiring bertambahnya masa induksi, sedangkan Hamim et al. (2009) melaporkan bahwa pemberian pertama MeJA dengan konsentrasi 750 mM pada perlakuan secara berulang yang diamati pada 10 hari setelah induksi memperlihatkan panjang zona perubahan warnanya adalah 3,8 cm dan panjang zona perubahan warna ini terus bertambah seiring bertambahnya masa induksi. Dengan memperhatikan panjang zona perubahan warna dari kedua jenis penginduksi tersebut, kemungkinan zona penyebaran asam salisilat lebih luas daripada zona penyebaran MeJA. Perbedaan jangkauan (zona penyebaran) asam salisilat dan MeJA pada pohon gaharu
A.crassna akan berpengaruh terhadap jumlah sel yang akan terinduksi untuk
memproduksi senyawa fitoaleksin dan jumlah sel yang pengakumulasi. Jumlah sel pengakumulasi senyawa fitoaleksin yang berbeda, akan mempengaruhi zona perubahan warna.
Berbeda dengan perubahan warna, semua penginduksi menyebabkan perubahan aroma kayu, namun tingkat wanginya sangat rendah. Aromanyapun sangat bervariasi. AMF menginduksi wangi dengan tingkat wangi tertinggi,