GLANZMANN’S THROMBASTHENIA
Senior Tawarta, Andri Iskandar, Suhartono,
Henny Syahrini, Savita Handayani, Dairion Gatot, Muhammad Fauzi
Divisi Hematologi Onkologi Medik – Departemen Ilmu Penyakit Dalam Fakultas Kedokteran Universitas Sumatera Utara
RSUP Haji Adam Malik
PENDAHULUAN
Platelet merupakan komponen sentral dari segala proses restoratif fisiologis, termasuk
didalamnya hemostasis. Dalam keadaan hemostasis, subendotelium yang rusak akan
mengeluarkan protein adhesif (mis. Kolagen dan tromboplastin) dan fibrinogen, yang akan
mengikat platelet teragregasi ke daerah injury, sehingga membentuk sumbatan platelet.
Kemudian platelet akan membentuk permukaan dan sumber fosfolipid untuk tempat
menempelnya kofaktor koagulasi. Aktivasi yang berlanjut dari jalur koagulasi akan
menyebabkan fibrin melekat kepada platelet yang teraktivasi, dan membentuk trombus.
Adanya gangguan terhadap fungsi platelet, apakah itu didapat atau diturunkan, akan
menyebabkan perdarahan.
Gangguan platelet yang didapat lebih sering dijumpai pada praktik klinik
dibandingkan gangguan platelet yang diturunkan, dan sering sekali merupakan akibat dari
medikasi atau dari keadaan medis yang mendasarinya. Dengan kata lain, gangguan platelet
yang diturunkan sangat jarang, dan hingga kini, hal tersebut kurang diamati dengan teliti.
Salah satu gangguan hemostasis abnormal yang diturunkan telah dikenal dan teliti adalah Glanzmann’s thrombasthenia (GT), sebuah penyakit yang telah membantu membuka jalan bagi penemuan penelitian kunci di bidang hematologi.
Eduard Glanzmann merupakan seorang dokter spesialis anak dari Swiss yang pertama
tersebut tidak disebabkan oleh jumlah platelet yang abnormal, melainkan karena kegagalan
dari retraksi bekuan darah.
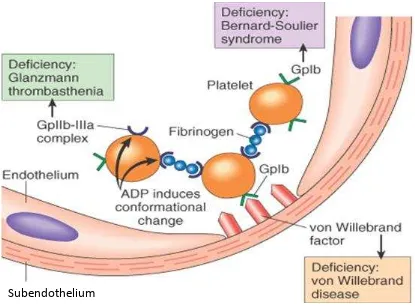
Gambar 1. Skema Molekul Adhesif pada Platelet dan gangguannya.
Glanzmann menemukan seorang pasien, perempuan berusia 7 tahun dengan
perdarahan berulang, dan dilakukan penelitian penyakit tersebut ke keluarganya. Dengan
ditemukannya pola familial dan gejala tersebut bermanifestasi pada anak-anak, Glanzmann
menyatakan adanya kemungkinan hal tersebut merupakan suatu komponen yang diturunkan.
Penyakit tersebut kemudian ditetapkan sebagai gangguan platelet sekunder yang diturunkan
akibat dari disfungsi kompleks GPIIb/IIIa. (Gambar 1)
Saat ini, GT sudah mulai banyak dikenali, dan merupakan penyakit pertama yang
menjelaskan bahwa terdapat molekul GPIIb/IIIa pada platelet, yang merupakan reseptor
platelet untuk molekul adhesif (Seperti VWF dan fibrinogen). Penyakit tersebut juga
merupakan cikal bakal untuk mengetahui dan memahami proses dari agregasi platelet dan
PATHOGENESIS
GT merupakan gangguan autosomal resesif reseptor permukaan platelet dari
GPIIb/IIIa (Integrin αIIbβ3), baik secara kuantitatif maupun kualitatif, yang akan menyebabkan kegagalan agregasi platelet dan menurunnya retraksi koagulasi.
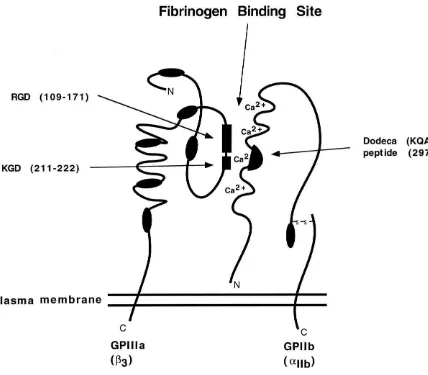
GPIIb/IIIa atau Integrin αIIbβ3 merupakan reseptor sel transmembran heterodimer berukuran besar yang terdiri dari subunit αIIb berukuran besar dan subunit β3 berukuran kecil. Subunit ini berikatan secara non-kovalen, yang dapat memberikan sinyal ganda antara
membran sel dan matriks ekstraseluler, yang juga membentuk jalur sinyal intraseluler.
Gambaran mikroskop elektron dari heterodimer menunjukkan sebuah kepala noduler
berukuran 8 x 12 nm dan dua buah ekor berukuran 18 nm.12 Ekor tersebut tertanam dan
menembus kedalam sel, dan mengandung domain sitoplasma dan transmembran yang
berfungsi sebagai titik ikatan untuk sinyal intraseluler dari molekul dan protein, dimana
kepala noduler yang membengkok mengandung lokasi tempat ligand berikatan.12 Subunit β3 terdiri dari domain- epidermal growth factor (EGF) disulfida berukuran besar yang
bertanggung jawab terhadap aktivasi dari Integrin αIIbβ3 secara keseluruhan. Lokasi berikatannya kalsium terlibat dalam formasi kompleks dan berikatan platelet berlokasikan
Gambar 2. GPIIb/IIIa atau Integrin αIIbβ3
100.000 kopi dari reseptor GPIIb/IIIa diekspresikan sepanjang permukaan platelet,
dan dapat berbeda hingga dua kali lipat pada setiap individu.6,23 Gen ITGA2B berlokasi di
kromosom 17q21.31, yang merupakan kode untuk GPαIIb pada platelet, sementara gen ITGB3 mengkode untuk glikoprotein subunit IIIa yang berada pada kromosom 17q21.32.
Mutasi telah ditemukan lebih sering pada gen ITGA2B, yang mungkin akibat dari banyak
jumlah exon dibandingkan gen ITGB3 (30 exon dibanding 15 exon)6,10 Delesi, insersi,
frameshift, nonsense dan missense mutasi telah sering dikenali. Mutasi missense telah
dipelajari lebih lanjut, dan menunjukkan adanya maturasi yang terhambat pada integrin
dengan proses transport dan distribusi dari berbagai jaringan.10 Kedua subunit tersebut
terhimpun dari prekursor retikulum endoplasmik, dengan proses yang lebih lanjut pada
aparatus golgi. Reseptor αvβ3 akan menjadi berlimpah pada platelet dengan mutasi pada ITGA2B. Kedua subunit αIIbβ3 dan αvβ3 akan hilang saat terjadi mutasi dengan mencegah sintesis β3, akan tetapi mutasi missense dari β3 dapat memiliki efek yang berbeda. Sebagai contoh, mutasi pada β3 Leu262Pro dan Ser162Leu telah menunjukkan memiliki efek residual terhadap kompleks platelet αIIbβ3 dengan kemampuan untuk mengikat fibrin dan melengketkan bekuan, akan tetapi saat terjadi stimulasi tidak memiliki kemampuan
memfungsikan fibrinogen. Secara garis besar, mutasi pada β3 Leu196Pro memiliki kemampuan retraksi bekuan secara parsial.2,6 Sebuah makalah oleh Nurden dkk menceritakan
tentang pemeriksaan mutasi β-propeller ectodomain pada subunit αIIb. Nurden et al, berkesimpulan bahwa banyaknya mutasi mempengaruhi β-propeller domain yang mengganggu pengikatan kalsium dan banyaknya jumlah efek delesi pada ekspresi dan fungsi αIIbβ3, menghasilkan tipe yang berbeda dari GT.5 Mutasi pada subunit αIIb yang memungkinkan untuk pembentukan kompleks parsial ditemukan berhubungan antara αIIb dan β3, yang menunjukkan varian dari bentuk GT. Efek yang berbeda ditemukan pada mutasi yang terjadi pada subunit αIIbβ3 dan antara αIIbβ3 dan αvβ3, namun αvβ3 lebih mudah berubah dibanding kan αIIbβ3. Beberapa mutasi dari αIIbβ3 tidak akan menjadi GT. Sebagai contoh, Kashiwagi et al beberapa waktu ini merumuskan 3 buah mutasi fungsi, ITGA2B
p.Gly991Cys, ITGA2B p.Phe993del, dan ITGB3 p.(Asp621_Glu660del), yang mengarah ke
pembentukan αIIbβ3 yang teraktivasi secara tinggi dan fosforilasi tyrosine spontan dari FAK di sel yang bertransformasi. Mutasi ini menghasilkan abnormalitas dari kedua morfologi dan
jumlah platelet, dengan gangguan ekspresi permukaan αIIbβ3, akan tetapi tidak menjadi GT.9
Mutasi homozigot atau heterozigot ditemukan pada kedua lokus gen yang
menentukan keparahan abnormalitas pada GT. Mutasi dapat menghentikan pembentukan
dengan keparahan perdarahan.10 Namun, Fiore et al menunjukkan perdarahan fenotipe lebih
dipengaruhi oleh mutasi pada gen ITGB3.6
GT yang didapat lebih sering merupakan akibat dari serangan autoantibody pada αIIbβ3 platelet, atau isoantibodi yang mengganggu fungsi yang seharusnya. Produksi dari autoantibodi berhubungan dengan transfusi platelet, seiring dengan jumlah kondisi
hematologis, meliputi immune thrombocytopenic purpura, non-Hodgkin’s lymphoma, multiple myeloma, myelodysplastic syndrome, hairy cell leukemia, dan acute lymphoblastic
leukemia. Pada sebuah laporan kasus yang dilaporkan oleh Blickstein et al, seorang pasien
dengan systemic lupus erythematosus pada masa dewasa dengan perdarahan mukokutaneus
sekunder akibat produksi antibodi terhadap GPIIb/IIIa.5 Pada keadaan beberapa penggunaan
anti-trombotik αIIbβ3 antagonis, seperti abciximab, eptifibatide, dan tirofiban, untuk pengobatan kejadian koroner akut, dapat mencetuskan keadaan transien seperti GT.10
INSIDENSI DAN PREVALENSI
Di estimasikan bahwa 1 dari 1.000.000 individu memiliki GT, akan tetapi angka
pastinya belum diketahui.14 Beberapa studi menunjukkan adanya sedikit dominasi pada
perempuan dibandingkan laki-laki (58% vs 42%), konsisten dengan adanya faktor yang
diturunkan.7 GT dapat ditemukan pada setiap individu seluruh dunia, namun lebih sering
ditemukan pada kelumpok etnis yang menunjukkan tingginya insidensi hubungan dari
keturunan darah yang sama, seperti Yahudi Iraq, Populasi arab selektif (Palestina), dan Gypsi
Perancis. Menurut dari sebuah studi, penyakit tersebut memiliki prevalensi tinggi pada
komunitas Gypsi Perancis Manouche, dengan sekitar 150 kasus dari 300 orang. Banyaknya
jumlah pada populasi tersebut menggambarkan adanya efek yang diturunkan.2
GAMBARAN KLINIS
GT dapat bermanifestasi segera setelah lahir, yang diawali dengan purpura pada
neonatus, dan diikuti dengan episode perdarahan mukokutaneus dan perdarahan spontan.
Mayoritas pasien terdiagnosa sebelum usia 5 tahun, dengan episode epistaksis dan perdarahan
ginggival yang rekuren merupakan manifestasi yang paling sering. Pada sebuah studi di
sering dari epistaksis pada anak-anak adalah karena manipulasi tangan (korek hidung);
namun, pada pasien dengan GT, perdarahan berat dapat terjadi pada daerah yang
hipervaskular tersebut, dan dapat berakibat fatal. Perdarahan yang fatal dapat terjadi kapan
saja selama hidup dengan pasein GT, akan tetapi prevalensi perdarahan berat berkurang
seiring bertambahnya usia.7
Terdapat sedikit bukti yang mendukung adanya korelasi antara defek gen pada GT
dengan tingkat keparahan perdarahan, dimana diketahui setiap individu menunjukkan
perbedaan kecenderungan perdarahan, bahkan pada yang satu keluarga atau kelompok etnis.10
Pada beberapa kasus, keadaan perdarahan berat yang terjadi setelah trauma minor atau
operasi minor mungkin menjadi suatu gejala yang bisa diketahui untuk penyakit GT.
Perdarahan berlebihan setelah tingakan sirkumsisi telah dinyatakan dan sering dijadikan
alasan untuk melakukan investigasi dan diagnosis terhadap GT pada laki-laki. Pada beberapa
kasus, wanita sering tidak terdiagnosis hingga menstruasi, dimana terjadi kehilangan darah
yang banyak akibat menorrhagia yang membutuhkan transfusi, seperti yang dilaporkan oleh
studi dari George et al. Kehamilan dan melahirkan merupakan keadaan khusus, dimana
wanita menjadi beresiko tinggi untuk terjadinya perdarahan yang berat atau fatal pada saat
ini.7
DIAGNOSIS
Diagnosis dari GT terkadang tidak disadari, karena kondisi tersebut mirip dengan
keadaan klinis dan laboratorium dari gangguan platelet didapat lainnya. Satu hal yang harus
diingat untuk memasukkan GT dalam diagnosis banding adalah dengan cara hati-hati
menganalisa riwayat medis (seperti, menanyakan apakah ada riwayat terjadi perdarahan
spontan, atau episode perdarahan hebat setelah trauma minor), riwayat keluarga (seperti,
menanyakan tentang kemungkinan perkawinan sedarah), dan gambaran klinis (seperti,
pemeriksaan adanya purpura dan ekimosis)
Saat ingin menyatakan diagnosis GT, memilih pemeriksaan laboratorium sangat
penting. Sebagai contoh, jumlah normal platelet pada pemeriksaan darah yang rutin tidak
dapat serta merta menyingkirkan diagnosis GT, dimana pasien dengan GT biasanya
normal, atau hanya menunjukkan gambaran defisiensi besi. Prothrombin time dan activated
partial thromboplastin time juga dapat normal. Namun, bleeding time akan memanjang,
dimana menunjukkan untuk pemeriksaan lebih lanjut.
Light transmission aggregometry (LTA) secara luas telah diterima sebagai alat
diagnostik gold standard untuk menilai fungsi platelet. Sampel plasma kaya akan platelet
yang disentrifugasi dimonitor pada saat sebelum dan setelah penambahan agonis (ADP,
collagen, epinephrine, arachidonic acid, ristocetin, thrombin receptor activating peptide, and
thromboxane A2 mimetic), menilai perubahan bentuk, fase lag, persentase agregasi,
lengkungan agregasi, dan deagregasi. Pemeriksaan ini sangat spesifik dalam menilai GT,
dimana agregasi platelet gagal terjadi dengan adanya agonis, kecuali ristocetin, dimana reaksi
tersebut tidak terjadi. Walaupun pemeriksaan ini menghasilkan data yang spesifik,
pemeriksaan LTA sangat membutuhkan waktu yang lama dan personel dependen,
membutuhkan ahli laboratoriun yang berpengalaman. Jauh lebih susah dalam mendapatkan
platelet-rich plasma pada pasien dengan trombositopenia dan pada pasien pediatrik.
Platelet function analyzer (PFA) merupakan pemeriksaan yang tinggi sensitivitasnya
dalam mendeteksi GT. Pemeriksaan PFA menggunakan collagen+ADP- dan
collagen+epinephrine-embedded cartridges untuk menirukan kerusakan endotelium vaskular.
Whole blood yang mengandung citrat dialirkan dengan shear stress yang tinggi melalui
cartridges tersebut, platelet berikatan, akan menjadi sumbatan platelet. Pemeriksaan PFA
akan memanjang pada pasien dengan GT.6
Flow cytometri dapat bermanfaat, hal ini dikarenakan pada GT didapati defisiensi
dan/atau disfungsi reseptor glikoprotein. Flow cytometri akan mengukur perbedaan densitas
reseptor platelet menggunakan variasi dari antibodi monoklonal untuk reseptor tersebut,
menentukan defisiensi αIIbβ3. Dalam analisa flow cytometri, kadar CD41 dan CD61 berkurang atau absen, sementara kadar CD42 dalam batas normal, dan indentifikasi dari
defisiensi dan non-fungsional αIIbβ3 dapat diekspresikan, sesuai dengan diagnosis dari GT.10
Cara terbaik dalam mendiagnosis GT adalah dengan cara analisa mutasi yang
potongan lokasi dari gen ITGB3 dan ITGA2B, hal tersebut harus diinvestigasi, dan
ditentukan mutasinya sesuai dengan konfirmasi dari analisa DNA kedua.
Secara garis besar, diagnosis dari GT meliputi jumlah platelet yang normal (biasanya
dalam batas bawah normal), pemanjangan waktu perdarahan, dan pemanjangan waktu PFA.
Platelet gagal mengalami kegagalan agregasi dalam penilaian dari LTA, dimana secara unik
yang mengindikasikan terjadinya GT.
PENGOBATAN
Semua pasien dengan GT memerlukan penanganan oleh seorang spesialis, dan harus
teregistrasi dalam 24 jam untuk mencapai penetapan diagnosis dan pengobatan.5,6 Pasien
dengan GT tidak memerlukan terapi dalam keadaan yang normal, akan tetapi selalu
memerlukan terapi pengobatan saat akan melakukan prosedur bedah, pengendalian
perdarahan setelah injury, dan selama terjadinya episode perdarahan spontan.
Edukasi Pasien
Semua pasien setidaknya pernah mendapatkan satu kali transfusi dari salah satu
produk darah selama hidupnya, semua pasien seharusnya mendapatkan imunisasi dari
hepatitis B. pasien juga seharusnya disarankan untuk menghindari olah raga berat, begitu
juga dengan penggunaan aspirin dan obat anti inflamasi non steroid.6 Dalam hal untuk
mencegah terjadinya resiko perdarahan di gusi, pasien sebaiknya mempertahankan oral
hygiene dan melakukan kunjungan rutin ke dokter gigi. Wanita membutuhkan monitoring
defisiensi besi dikarenakan adanya resiko terjadi menorrhagia, dan sebaiknya diberikan
suplementasi zat besi jika dibutuhkan. Pasien sebaiknya diperiksakan HLA nya pada saat
mendiagnosis, dan dimonitoring untuk HLA dan antibodi anti-platelet secara reguler.6 Pasien
sebaiknya dikonseling bahwa perdarahan pada luka kecil, gusi, atau dari hidung dapat
dihentikan dengan memberikan penekanan, dan/atau dengan mendapatkan antifibrinolitik
oral, akan tetapi diharuskan mencari pengobatan medis apabila perdarahan tetap terjadi.
Terapi standard saat ini dari pengobatan episode perdarahan pada pasien GT adalah
dengan memberikan penekanan lokal pada lokasi luka, atau dengan tambahan obat
antifibrinolitik oral dahulu, yang diikuti dengan transfusi platelet, dan rFVIIa jika perdarahan
tetap berlanjut.7 Pengobatan lokal meliputi tindakan kompresi, pelapis fibrin, dan thrombin
topikal.3 Apabila memungkinkan, platelet konsentrat sebaiknya dihasilkan dari single-donor
dan cocok HLA dengan adanya resiko terbentuknya alloantibodi terhadap glikoprotein
platelet, αIIbβ3, atau αIIbβ3, dan/atau terhadap antigen HLA pada transfusi berulang. Apabila platelet yang cocok HLA tidak tersedia, pasien sebaiknya mendapatkan platelet sedikit
leukosit (leukocyte-reduced platelets), dimana hal ini telah menunjukkan penurunan tingkat
dari imunisasi HLA. Pasien dengan episode perdarahan berat sebaiknya diberikan transfusi
platelet dalam 48 jam setelah penghentian perdarahan, dan hingga penyembuhan luka pada
pasien yang menjalani pembedahan. Penilaian waktu PFA akan normal dengan transfusi yang
adekuat.2
Penatalaksanaan Perdarahan Minor Hingga Moderat
Untuk episode perdarahan minor hingga moderat, penanganan lokal, dan/atau obat
antifibrinolitik dapat menghentikan perdarahan. Obat antifibrinolitik oral dapat bekerja
dengan baik pada perdarahan mukokutaneus, dan telah menunjukkan keberhasilan
menurunkan perdarahan selama prosedur gigi, dalam kombinasi dengan penanganan lokal.
Penanganan lokal meliputi kompresi, spons gelatin, pelapis fibrin, dan thrombin topical.6
Agen antifibrinolitik meliputi asam traneksamat dan asam aminocaproic epsilon. Obat
tersebut, digunakan sebagai terapi tunggal atau sebagai terapi tambahan yang digunakan
bersamaan dengan rFVIIa, dan telah terbukti bermanfaat dan aman dalam meminimalkan atau
menghentikan perdarahan pada pasien dengan GT. Kedua obat tersebut dapat diberikan
secara oral atau intravena, dan telah digunakan dengan baik dalam menangani epistaksis,
perdarahan gusi, dan menorrhagia, dan juga sebagai profilaksis pada tindakan ekstraksi gigi
dan prosedur bedah minor lainnya. Penggunaan antifibrinolitik dalam kasus hematuria harus
dihindarkan mengingat terjadinya resiko pembentukan clot pada saluran kencing, dan
sebaiknya digunakan dalam penuh perhatian pada pasien yang akan menjalani prosedur
dengan resiko tinggi terjadinya trombus.6
Epistaksis merupakan satu dari manifestasi yang paling umum terjadinya pada pasien
GT.1,2,5 Pasien mungkin respon terhadap kompresi, trombin topikal, antifibrinolitik, tampon
nasal, atau kombinasi dari ini semua, akan tetapi metode tersebut tidak selalu sepenuhnya
efektif.12 Sebuah studi retrospektif membandingkan metode yang metode yang berbeda dalam
mengontrol perdarahan nasal lokal pasien GT pada anak-anak, dan ditemukan penggunaan
hanya tampon anterior dan posterior, tanpa pemberian tambahan agen protrombin paling
sedikit efektifitasnya dibandingkan dengan penggunaan agen protrombin. Jika metode
konvensional gagal dalam mengendalikan perdarahan, penanganan lebih lanjut dengan
transfusi platelet dan/atau rFVIIa perlu dipertimbangkan.12 Menariknya, tampon nasal yang
terbuat dari bahan babi yang diasinkan telah menunjukkan keberhasilan dalam
mengendalikan perdarahan nasal yang mengancam jiwa pada pasien GT anak-anak dengan
hemodinamik yang tidak stabil, setelah pemberian antifibrinolitik, rFVIIa, kauter nasal, dan
tampon nasal dari bahan sintetik telah gagal dalam menangani perdarahan.11
Penanganan Menorrhagia
Agen antifibirinolitik merupakan terapi lini pertama dalam mengendalikan
menorrhagia. Jika obat tersebut gagal, suplementasi hormon dengan progesteron tunggal
ataupun progesteron dan estrogen dapat digunakan. Pemberian terus menerus dari regimen
agen kontraseptik estrogen-progestin oral atau pemberian depot medroxyprogesterone acetate
intramuskular dapat diberikan 3 bulan sekali, dan menunjukkan keberhasilan dalam pasien
GT wanita. Terapi hormonal intrauterin juga dapat digunakan untuk menurunkan perdarahan,
dengan atau tanpa penggunaan antifibrinolitik.3
Menorrhagia berat, yang dapat menyerang semua wanita dengan GT dan dapat
dialami pada saat menstruasi, dapat diterapi dengan pemberian estrogen konjugat dosis tinggi
secara intravena selama 24-48 jam, diikuti dengan kombinasi estrogen-progestin oral dosis
tinggi. Namun, perdarahan menstruasi yang intensif tidak selalu respon terhadap terapi yang
tipikal. rFVIIa telah dinyatakan sukses dalam GT saat antifibrinolitik dan transfusi platelet
tidak dapat mengendalikan perdarahan yang berlebih.4 Terapi bedah seperti histerektomi atau
ablasi endometrial juga merupakan pilihan terapi untuk menorrhagia berat, tetapi sebaiknya
Penanganan Perdarahan Postpartum
Kehamilan pada pasien GT berhubungan dengan peningkatan resiko terjadinya
perdarahan postpartum primer dan sekunder, seiring dengan peningkatan resiko terjadinya
perdarahan fetal.5 Guideline telah menyarankan penggunaan transfusi platelet atau rFVIIa
dengan kombinasi dengan antifibrinolitik, sebagai profilaksis dari partus pervaginam. Sebuah
sistematik review dari penanganan dan keberhasilan dari 35 wanita hamil dengan GT
menunjukkan perdarahan selama atau setelah melahirkan umum terjadi dan berat, dan terjadi
hingga 20 hari postpartum. Pasien yang tidak diberikan transfusi platelet sebagai profilaksis
lebih mengalami peradarahan postpartum dibandingkan pasien yang diberikan transfusi
platelet sebagai profilaksis (63% versus 38%). Penggunaan rFVIIa sebagai profilaksis telah
didokumentasikan pada 3 kasus kehamilan, apakah itu tunggal maupun kombinasi dengan
platelet, dan tidak dapat mencegah perdarahan pada kasus tersebut.5 Namun, keberhasilan
penggunaan rFVIIa pada perdarahan postpartum yang resisten telah dilaporkan pada literatur
lainnya.6 Alloantibodi platelet maternal telah didokumentasikan pada 16 kehamilan, dan
plasma exchange secara sukses dalam menurunkan alloantibodi titer pada satu kasus. 4 dari
16 kasus mengalami kematian neonatal, 3 mengalami perdarahan intrakranial antara masa
gestasi 24 dan 31 minggu. Semua wanita dengan GT sebaiknya dilakukan pemeriksaan
alloantibodi platelet saat sedang hamil.5
Penanganan Dengan Desmopressin
Desmopressin (DDAVP) akan menyebabkan pelepasan VWF, FVIII, dan t-PA
kedalam plasma. DDAVP tidak memiliki efek langsung terhadap platelet, dan sampel dari
pasien yang diterapi dengan DDAVP tidak menunjukkan efek yang signifikan dari deposisi
platelet pada kolagen secara ex vivo.1 Walaupun DDAVP berhasil dalam mengobati
gangguan platelet lainnya, masih terdapat sedikit data yang mendukung penggunaannya pada
GT.6 Pada sebuah seri kasus kecil, DDAVP berhasil dalam terapi tunggal untuk menangani 1
dari 9 pasien dengan GT.1
Transfusi platelet memberikan perbaikan parsial dari gangguan fungsional platelet
pada pasien GT dan dinyatakan sebagai terapi standar pada pasien dengan kegagalan
penanganan lokal dan/atau antifibrinolitik dalam pengendalian perdarahan.4 Transfusi platelet
juga sebagai standard profilaksis pada pasien GT yang akan menjalani bedah mayor.3 Tidak
lazim pasien dengan perdarahan berat setelah trauma atau melahirkan yang membutuhkan
transfusi platelet multipel dan/atau sel darah merah. Pemberian transfusi platelet berulang
berhubungan dengan pembentukan isoantibodi terhadap GPIIb/IIIa isotop dan/atau HLA
isotop, dan hal tersebut telah diestimasikan sekitar 30% dan 70% dari pasien akan
membentuk alloantibodi setelah transfusi platelet.2,3 Sebuah studi oleh Santoro et al yang
diikuti oleh 17 pasien GT selama 30 tahun, 16 pasien diantaranya yang telah ditransfusi
setidaknya satu kali dengan platelet dan/atau sel darah merah. Alloantibodi dibentuk pada
25% pasien yang ditransfusi; 2 pasien positif terhadap anti-HLA antibodi, 1 pasien positif
terhadap anti-ITG αIIbβ3, dan 1 pasien membentuk kedua tipe alloantibodi.5
Pada survey internasional yang dilakukan oleh Poon et al, sebuah prevalensi yang
mirip dari anti-HLA antibodi telah dilaporkan, dan 17 dari 23 pasien dengan platelet refrakter
dalam survey tersebut memiliki alloantibodi anti-platelet.7 Alloimunisasi platelet dapat
menyebabkan refrakter platelet yang relatif atau absolut, menghasilkan peningkatan
penghancuran platelet dan kegagalan transfusi platelet. Maka, platelet yang cocok HLA
direkomendasikan untuk menghindari kemungkinan alloimunisasi.5 Sebelum maraknya
penggunaan rFVIIa, refrakter absolut akibat alloantibodi platelet dapat diatasi dengan
plasmaferesis atau dengan IVIG, yang diikuti dengan transfusi platelet.2 rFVIIa sekarang
direkomendasikan untuk digunakan pada pasien yang tidak respon dengan transfusi platelet,
dengan atau tanpa adanya alloantibodi platelet.6
Alloantibodi platelet telah berhasil dalam dihilangkan pada pasien yang akan
menjalani pembedahan dengan imunoadsorpsi pada protein A Sepharose.4,5 Pada sebuah seri
kasus dari 3 pasien GT tipe I dengan alloantibodi, imunoadsorpsi pada protein A Sepharose
telah berhasil dalam membersihkan anti-GPIIb/IIIa antibodi pada 5 keadaan yang berbeda,
meliputi episode perdarahan mengancam jiwa. Namun, efek tersebut bersifat sementara;
Penggunaan prosedur tersebut memiliki keterbatasan karena membutuhkan akses vaskular
yang besar dan prosedur tersebut harus dilakukan pada sentra tertentu.4
rFVIIa
rFVIIa berhasil digunakan pertama kali dalam kasus perdarahan berat yang tak
terkendali pada seorang anak laki-laki 2 tahun dengan GT pada tahun 1996.1,2 Sejak itu,
penggunaannya diperluas ke seluruh dunia, dan walaupun berhasil dalam menangani
perdarahan pada kebanyakan pasien dengan GT, namun tidak efektif pada semua pasien.
NovoSeven RT merupakan salah satu FVII rekombinan yang teraktivasi digunakan
secara komersial yang tersedia di Ameriak Utara, Eropa, Australia, dan Jepang. Pertama kali
disetujui penggunaan nya di Amerika sebagai agen hemostatik pada pasien dengan hemofilia
A dan B, antibodi terhadap faktor VIII atau IX, dan defisiensi kongenital dari FVII. Pada
tahun 2014, FDA Amerika menyetujui NovoSeven RT dalam pengobatan episode perdarahan
dan penanganan perioperatif pada pasien dengan GT yang telah refrakter terhadap transfusi
platelet, dengan atau tanpa adanya alloantibodi anti-platelet.4
Mekanisme dari rFVIIa dalam mengendalikan perdarahan pada pasien GTT tidak
sepenuhnya digambarkan. Melalui mekanisme tissue factor-independent, pengikatan terhadap
permukaan platelet sangat lemah dan meningkatkan aktivasi dari faktor IX dan X, dengan
demikian meningkatkan pembentukan thrombin. Dosis 90 mcg/kgBB keatas telah
menunjukkan peningkatan pembentukan thrombin yang signifikan. Peningkatan jumlah
thrombin meningkatkan adhesi platelet dan mencetuskan agregasi platelet, termasuk yang
kekurangan GPIIb/IIIa.3 hal tersebut telah didemonstrasikan pada model perfusi, dimana
rFVIIa meningkatkan pembentukan thrombin dan deposisi fibrin, dan secara parsial
mengembalikan agregasi platelet.7
Walaupun tidak 100% berhasil, tingginya keberhasilan dan rendahnya resiko
berhubungan dengan penggunaan rFVIIa sebagai pengobatan atau pencegahan dari
perdarahan pada pasien dengan GT telah terdokumentasikan, terutama pada mereka yang
refrakter terhadap transfusi platelet atau memiliki antibodi antiplatelet.1,5,7,13 Penggunaan
pembedahan mayor, termasuk seksio caesar. rFVIIa dapat digunakan untuk mencegah
transfusi platelet multipel, dimana akan mencegah terjadinya resiko alloimunisasi platelet,
pada kasus perdarahan yang tidak mengancam jiwa saat penanganan lokal dan antifibrinolitik
gagal.3 Keadaan ini dapat menjadi perhatian khusus pada wanita yang sedang hamil dimana
dapat mentransfer alloantibodi platelet kedalam sirkulasi fetal, yang menyebabkan fetal
trombositopenia, yang berhubungan dengan kematian intrauterin dan perdarahan
intrakranial.7
Dosis optimal yang digunakan pada pasien GT belum sepenuhnya ditetapkan, dan
hingga saat ini juga belum dicapai penetapan dosis optimal atau regimen dosis. Namun, dosis
yang direkomendasikan adalah 90 mcg/kgBB secara bolus intravena setiap 2 jam selama 3
dosis atau hingga perdarahan berhenti, yang diikuti dengan dosis satu atau lebih dosis
maintenans.3,6,7 Dosis pengulangan kadang dibutuhkan dikarenakan waktu paruh yang pendek
dari rFVIIa.
Hingga saat ini belum ada RCT yang menguji penggunaan rFVIIa pada pasien GT.
Namun, keamanan dan keberhasilan dari rFVIIa pada pasien GT telah terdokumentasikan.
Investigasi tunggal terbesar yang dipublikasikan dalam menginvestigasi keberhasilan rFVIIa
pada pasien GT dilaporkan oleh Poon et al melalui international survey. Survey tersebut
terdiri dari 59 pasien GT yang diberikan rFVIIa sebagai terapi perdarahan atau profilaksis
bedah. Keberhasilan rata-rata adalah 64% pada episode perdarahan, dan 94% pada prosedur
bedah. Tingkat keberhasilan lebih tinggi pada pasien yang menerima bolus 80 mcg/kgBB
atau lebih rFVIIa, diberikan secara intravena, tidak lebih dari 2,5 jam pemberian. 2 dari 59
pasien diberikan dosis tinggi rVIIa sebagai infus berkelanjutan, yang dikombinasi dengan
obat antifibrinolitik, selama prosedur bedah dan kejadian tromboemboli: emboli paru dengan
DVT, ureteric clot.7 pada pasien yang yang diberikan dosis bolus dari rFVIIa, tidak dijumpai
kejadian buruk atau tromboembolik yang dilaporkan.1,2 Pada sebuah studi open-label dengan
28 pasien GT, ditemukan sebanyak 93% pasien dengan episode perdarahan yang merespon
terhadap rFVIIa.4 Sebagai tambahan, sebanyak total 40 publikasi laporan kasus menunjukkan
69% pasien selama episode perdarahan dan 96% pasien yang akan menjalani prosedur
yang diterapi dengan rFVIIa tidak diketahui; studi uji klinik terkontrol diperlukan untuk
menilai resikonya.
rFVIIa sebaiknya diberikan sesegera mungkin pada kejadian perdarahan, sebuah
studi di Inggris menyatakan bahwa penggunaan rFVIIa berhasil 71% pada pasien yang
diterapi dalam 12 jam onset, tetapi hanya 18% yang respon terhadap rFVIIa setelah 12 jam
onset berlalu.1-3 Bedah minor pada pasien GT telah menunjukkan keberhasilannya tanpa
transfusi platelet apabila diberikan rFVIIa sebagai profilaksis, dan direkomendasikan oleh the United Kingdom Haemophilia Centre Doctors’ Organisation untuk profilaksis tindakan bedah minor termasuk pencabutan gigi.5
Rituximab
Rituximab (anti-CD20) merupakan antibodi monoclonal human-mouse chimeric yang
mentarget sel B CD20 antigen, dan telah digunakan sebagai pengobatan dari sitopenia imun
yang didapat dan juga pada gangguan hemostasis yang dimediasi antibodi.
Penggunaan kortikosteroid sistemik, kemoterapi, penggantian plasma, protein A
Sepharose immunoadsorption, IVIG, rFVIIa, dan rituximab telah dilaporkan sebagai terapi
yang sukses pada GT yang didapat.4,5,8 Banyak laporan kasus mendemonstrasikan
keberhasilan dari rituximab pada pasien GT yang didapat dan manifestasi perdarahan atau
ekimosis yang refrakter terhadap terapi kortikosteroid sistemik, siklofosfamid, azatioprin,
plasmaferesis, dan IVIG. Pemberian rituximab adalah 375 mg/m2/minggu selama 4 minggu
menunjukkan agregasi platelet yang normal dan penurunan gejala dari pasien.8
Bevacizumab
Bevacizumab (avastin) merupakan anti-VEGF antibodi yang telah digunakan sebagai
pengobatan kanker dalam tambahan kemoterapi.2 Penggunaan bevacizumab dapat sebagai
potensi pilihan pengobatan dari perdarahan gastrointestinal yang berat pada pasien GT
refrakter yang perlu penelitian lebih lanjut. Sebuah laporan kasus menyatakan penggunaan
bevacizumab pada pasien GT tipe I, yang mengalami perdarahan berat dan berulang akibat
angiodiplasia. Pasien tersebut refrakter terhadap transfusi platelet, asam traneksamat, dan
diberikan setiap 2 minggu sebagai terapi penyelamat, yang diikuti dengan setiap 4 minggu
sebagai maintenans, dan menghasilkan penurunan perdarahan.2
Transplantasi Stem Sel Hematopoetik
Hematopoietic stem cell transplantation (HSCT) menawarkan kesembuhan pada
pasien dengan perdarahan berat, berulang, dan/atau dengan alloantibodi platelet yang
refrakter terhadap transfusi platelet.4-6 Hingga saat ini masih belum jelas algoritme untuk
transplantasi pada GT, dan HSCT pada GT sangat langka. Transplantasi sumsum tulang
pertama kali berhasil pada GT terjadi pada tahun 1985, pada seorang laki-laki berusia 4 tahun
dengan anti-GPIIb/IIIa antibodi.6 Hingga saat ini, terdapat sedikitnya 19 pasien yang
dilaporkan pada pasien GT berat yang berhasil dalam transplantasi stem sel dari darah
umbilikal cord, saudara yang identik HLA-nya, donor lain yang cocok, atau donor keluarga
yang cocok.3,4 Kebanyakan pasien yang menerima stem sel dari saudara juga diberikan obat
busulfan dan siklofosfamid untuk menekan reaksi penolakan.4,5
Terapi Masa Depan
Pemahaman dalam patogenesis GT dan fungsi dari αIIbβ3 telah meningkatkan semua kemampuan sejak Glanzmann pertama kali menemukan penyakit tersebut; namun,
pengobatan GT masih belum sepenuhnya memuaskan. Kualitas hidup dari pasien GT tetap
terganggu oleh beberapa hal, episode perdarahan mukokutaneus spontan, dan resiko tinggi
dari perdarahan akibat pembedahan atau trauma. Terapi yang tersedia, selain dari
transplantasi stem sel allogenik yang mahal dan beresiko tinggi, pengobatan difokuskan pada
penanganan episode perdarahan, dan tidak satu pun dari semua itu yang dapat
menyembuhkan.
Terapi gen telah menyita banyak perhatian dalam dekade terakhir, dan konsep
tersebut telah dicobakan pada model binatang.11 Penggunaan αIIb promoter-driven murine leukemia retrovirus vectors sebagai pengirim transfer sel CD34+ untuk target ekspresi
transgen dalam pembentukan megakariosit telah dilakukan oleh Wilcox et al.11 Keberhasilan
transduksi sel CD34+ telah diuji secara in vitro dari 2 pasien GT menggunakan murine
Hal tersebut akan mengkoreksi keadaan GT. Defisiensi αIIb pada model anjing untuk GT, Fang et al menunjukkan perbaikan dalam hemostasis dan restorasi dari αIIbβ3 pada permukaan platelet oleh lentivirus transduksi untuk memobilisasi CD34+ stem sel.14 Pada
studi belakangan ini, Sullivan et al mengembangkan strategi untuk mencapai ekspresi protein
yang tinggi pada megakariosit manusia. Insersi hemizygous dari Gp1ba promotor-driven human αIIb complementary DNA ke dalam lokus AAVS1 yang diinduksi pada pluripoten stem sel menghasilkan kadar tinggi dari αIIb mesengger RNA dan ekspresi protein, dan menghasilkan koreksi dari αIIbβ3 pada megakariosit.5 Studi tersebut menjanjikan terapi kuratif pada pasien GT, dan akan membantu mengembalikan kualitas hidup pada pasien
tersebut.
DAFTAR PUSTAKA
1. Diz-Kucukkaya R. Inherited platelet disorders including Glanzmann thrombasthenia and Bernard-Soulier syndrome. Hematology Am Soc Hematol Educ Program. 2013;2013:268–275.
2. Stevens RF, Meyer S. Fanconi and Glanzmann: the men and their works. Br J Haematol. 2002;119(4):901–904.
3. Bennett JS. Structure and function of the platelet integrin alphaIIbbeta3. J Clin Invest. 2005;115(12):3363–3369.
4. Nurden AT, Pillois X, Wilcox DA. Glanzmann thrombasthenia: state of the art and future directions. Semin Thromb Hemost. 2013;39(6):642–655.
5. Nurden AT, Fiore M, Nurden P, Pillois X. Glanzmann thrombasthenia: a review of ITGA2B and ITGB3 defects with emphasis on variants, phenotypic variability, and mouse models. Blood. 2011;118(23): 5996–6005.
6. Fiore M, Nurden AT, Nurden P, Seligsohn U. Clinical utility gene card for: Glanzmann thrombasthenia. Eur J Hum Genet. 2012;20(10).
7. Nurden AT, Ruan J, Pasquet KM, et al. A novel 196Leu to Pro substitution in the beta3 subunit of the alphaIIbbeta3 integrin in a patient with a variant form of Glanzmann thrombasthenia. Platelets. 2002;13(2):101–111.
9. Kashiwagi H, Kunishima S, Kiyomizu K, et al. Demonstration of novel gain-of-function mutations of alphaIIbbeta3: association with macrothrombocytopenia and glanzmann thrombasthenia-like phenotype. Mol Genet Genomic Med. 2013;1(2):77–86.
10.George JN, Caen JP, Nurden AT. Glanzmann’s thrombasthenia: the spectrum of clinical disease. Blood. 1990;75(7):1383–1395.
11.Blickstein D, Dardik R, Rosenthal E, et al. Acquired thrombasthenia due to inhibitory effect of glycoprotein IIbIIIa autoantibodies. Isr Med Assoc J. 2014;16(5):307–310. 12.Levy JM, Mayer G, Sacrez R, et al. [Glanzmann-Naegeli thrombasthenia. Study of a
strongly endogamous ethnic group]. Ann Pediatr (Paris). 1971;18(2):129–137.
13.Cattaneo M, Cerletti C, Harrison P, et al. Recommendations for the Standardization of Light Transmission Aggregometry: A Consensus of the Working Party from the Platelet Physiology Subcommittee of SSC/ISTH. J Thromb Haemost. Epub April 10, 2013.