ENTALPI DAN PROSES PADA TEKANAN KONSTAN
Entalpi adalah istilah dalam termodinamika yang menyatakan jumlah energi dari suatu sistem termodinamika. Entalpi terdiri dari energi dalam sistem, termasuk satu dari lima potensial termodinamika dan fungsi keadaan, juga volume dan tekanannya (merupakan besaran ekstensif). Satuan SI dari entalpi adalah joule, namun digunakan juga satuan British thermal unit dan kalori.
Total entalpi (H) tidak bisa diukur langsung. Sama seperti pada mekanika klasik, hanya perubahannya yang dapat dinilai. Entalpi merupakan potensial termodinamika, maka untuk mengukur entalpi suatu sistem, kita harus menentukan titik reference terlebih dahulu, baru kita dapat mengukur perubahan entalpi ΔH. Perubahan ΔH bernilai positif untuk reaksi endoterm dan negatif untuk eksoterm.
Untuk proses dengan tekanan konstan, ΔH sama dengan perubahan energi dalam sistem ditambah kerja yang dilakukan sistem pada lingkungannya. Maka, perubahan entalpi pada kondisi ini adalah panas yang diserap atau dilepas melalui reaksi kimia atau perpindahan panas eksternal.
Entalpi gas ideal, solid, dan liquid tidak tergantung pada tekanan. Benda nyata pada temperatur dan tekanan ruang biasanya kurang lebih mengikuti sifat ini, sehingga dapat menyederhanakan perhitungan entalpi.
Entalpi didefinisikan sebagai :
Keterangan : H = Entalpi (Joule) E = energi (joule) V = volume (liter) P = tekanan (atm)
Perubahan dalam Entalpi
Hukum kekekalan energi menjelaskan bahwa energi tidak dapat diciptakan dan tidak dapat dimusnahkan, tetapi hanya dapat diubah dari bentuk energi yang satu menjadi bentuk energi yang lain. Nilai energi suatu materi tidak dapat diukur, yang dapat diukur hanyalah perubahan energi (ΔE). Demikian juga halnya dengan entalpi, entalpi tidak dapat diukur, kita hanya dapat mengukur perubahan entalpi (ΔH).
ΔH = Hp – Hr
Keterangan:
ΔH = perubahan entalpi
Hp = entalpi produk
Hr = entalpi reaktan atau pereaksi
Bila H produk > H reaktan, maka ΔH bertanda positif, berarti terjadi penyerapan kalor dari lingkungan ke sistem.
Bila H reaktan > H produk, maka ΔH bertanda negatif, berarti terjadi pelepasan kalor dari sistem ke lingkungan.Secara matematis, perubahan entalpi (ΔH) dapat diturunkan sebagai berikut.
H = E + W Pada tekanan konstan :
ΔH = ΔE + PΔV
Jadi, pada tekanan tetap, perubahan entalpi (ΔH) sama dengan kalor (q) yang diserap atau dilepas.
Jika suhu sistem turun maka dikatakan bahwa reaksi tersebut eksoterm. Reaksi endoterm adalah kebalikan dari reaksi eksoterm.
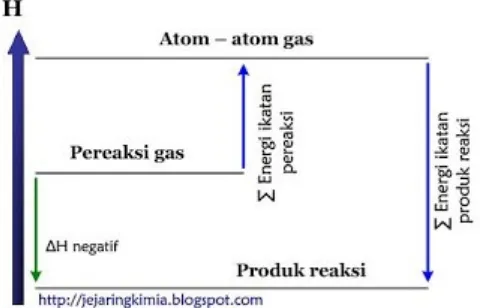
Hubungan antara reaksi eksoterm/endoterm dan perubahan entalpi : Dalam reaksi kimia yang melepaskan kalor (eksoterm), energi yang terkandung dalam zat-zat hasil reaksi lebih kecil dari zat-zat-zat-zat pereaksi. Oleh karena itu, perubahan entalpi reaksi berharga negatif.
ΔH = Hproduk – Hpereaksi < 0
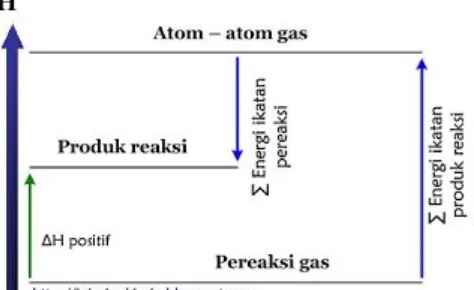
Pada reaksi endoterm, perubahan entalpi reaksi akan berharga positif.
ΔH= Hproduk – Hpereaksi > 0
Pada reaksi endoterm, entalpi sesudah reaksi menjadi lebih besar, sehingga ΔH positif. Sedangkan pada reaksi eksoterm, entalpi sesudah reaksi menjadi lebih kecil, sehingga ΔH negatif. Perubahan entalpi pada suatu reaksi disebut Kalor reaksi. Kalor reaksi untuk reaksi-reaksi yang khas disebut dengan nama yang khas pula, misalnya kalor pembentukan,kalor penguraian, kalor pembakaran, kalor pelarutan dan sebagainya.
Menurut Hukum I Termodinamika
Suatu reaksi kimia dapat dipandang sebagai suatu sistem yang terdiri dari dua bagian yang berbeda, yaitu pereaksi dan hasil reaksi atau produk. Perhatikan suatu reaksi yang berlangsung pada sistem tertutup dengan volume tetap (ΔV = 0), maka sistem tidak melakukan kerja, w = 0. Jika kalor reaksi pada volume tetap dinyatakan dengan qv , maka persamaan hukum I termodinamika dapat ditulis:
q reaksi disebut sebagai kalor reaksi. Hal ini berarti bahwa semua
perubahan energi yang menyertai reaksi akan muncul sebagai kalor. Misal: suatu reaksi eksoterm mempunyai perubahan energi dalam sebesar 100 kJ. Jika reaksi itu berlangsung dengan volume tetap, maka jumlah kalor yang dibebaskan adalah 100 kJ. Kebanyakan reaksi kimia berlangsung dalam sistem terbuka dengan tekanan tetap (tekanan atmosfir). Maka sistem mungkin melakukan atau menerima kerja tekanan – volume, w = 0). Oleh karena itu kalor reaksi pada tekanan tetap dinyatakan dengan qp , maka hukum I termodinamika dapat ditulis sebagai berikut:
ΔU = qp + w atau qp = ΔU – w = q reaksi s
Dalam termokimia ada dua kondisi khusus yang penting, yaitu volume tetap dan tekanan tetap, oleh karena pada kedua kondisi ini kalor reaksi dapat dikaitkan dengan fungsi-fungsi termodinamika tertentu. Bila reaksi dikerjakan pada volume tetap (misalnya dalam kalorimeter bom), maka kalor reaksinya sama dengan perubahan energi dalam sistem, qp = ∆U, sedangkan pada tekanan tetap, kalor reaksi sama
HUBUNGAN ANTARA ENTALPI DAN ENERGI
Kimia berhubungan dengan interaksi antara dua zat atau hubungan antara materi dan energy, terutama dalam hubunganya dengan hukum pertam termodinamika dan dapat mengubah suatu zat menjadi zat lain. Energy merupakan
kemampuan untuk melakukan usaha.
Suatu reaksi kimia melibatkan pemutusan dan pembentukan ikatan kimia. Pemutusan ikatan kimia menyebabkan zat-zat pereaksi terpisah menjadi atom-atom penyusunnya. Atom-atom-atom ini akan disusun ulang dan bergabung kembali membentuk ikatan kimia dalam zat-zat produk reaksinya. Pemutusan suatu ikatan memerlukan energi. Sebaliknya, suatu pembentukan ikatan akan melepaskan sejumlah energi. Energi yang terkait dengan pemutusan atau pembentukan ikatan kimia ini disebut energy ikatan. Energi ikatan dibedakan menjadi energi disosiasi untuk senyawa molekul, dan energi kisi untuk senyawa ion. Energi disosiasi (D) terkait dengan energi yang diperlukan untuk memutuskan ikatan senyawa molekul/kovalen. Sedangkan energi kisi terkait dengan energi yang dilepas untuk pembentukan ikatan senyawa ion. Pada bahasan berikutknya lebih difokuskan pada energi disosiasi.
Energi Ikatan untuk Menghitung Perubahan Entalpi Reaksi Seperti yang dijelaskan di atas, reaksi kimia akan melibatkan energi untuk pemutusan ikatan antar atom pereaksi dan pembentukan ikatan antar atom produk reaksi. Selisih antara energi untuk pemutusan dan pembentukan ikatan ini adalah ∆H. Dapat dirumuskan sebagai berikut:
∆Hreaksi = ∑ (Energi ikatan pereaksi) - ∑ (Energi ikatan produk reaksi)
Simak contoh reaksi peruraian H2O (reaksi endoterm) dan pembentukan CH4 (reaksi
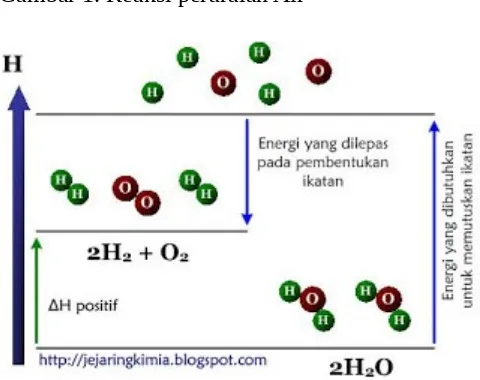
1. Reaksi Peruraian H2O
H2O dapat terurai menjadi gas H2 dan gas O2, dengan bantuan energi yang diperoleh
dari arus listrik.
Gambar 1. Reaksi peruraian Air
Gambar 2. Diagram tingkat energi peruraian air
Ada 2 tahapan dalam reaksi seperti yang ditunjukkan pada diagram entalpi pada gambar 2:
Pemutusan 2 ikatan H - O menjadi atom-atom H dan O. energi yang diperlukan adalah sebesar ∑ (energi ikatan pereaksi)
Dari diagram, terlihat bahwa ∑ (energi ikatan pereaksi) < ∑ (energi ikatan produk reaksi). Dengan menggunakan rumus ∆H di atas, maka diperoleh ∆H reaksi adalah positif (+) atau reaksi bersifat endoterm.
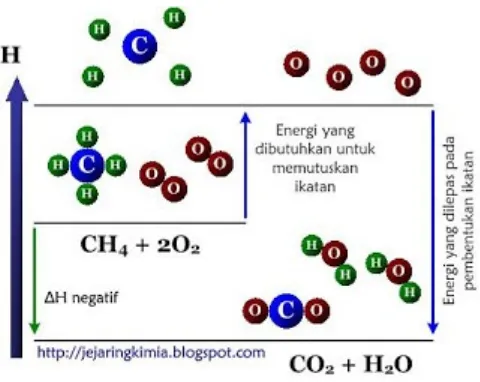
Reaksi pembentukan CH4
Reaksi pembakaran CH4 dengan O2, dihasilkan gas CO2 dan gas H2O. raeksinya
adalah sebagai berikut:
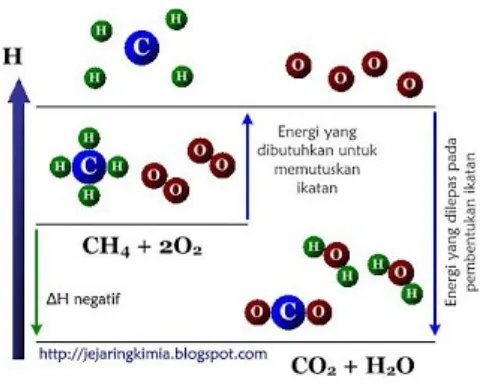
Gambar 3. Reaksi pembakaran gas metana
Ada 2 tahapan dalam reaksi seperti yang ditunjukkan pada diagram entalpi pada gambar 4:
Pemutusan 4 ikatan C - H dan ikatan rangkap O = O menjadi menjadi atom-atom C, H dan O. Energi yang diperlukan adalah sebesar ∑ (energi ikatan pereaksi)
Pembentukan 2 ikatan C = O dan 2 ikatan H - O dari atom-atom C, H, dan O. Energi yang dilepas adalah sebesar ∑ (energi ikatan produk reaksi).
Dari diagram, terlihat bahwa ∑ (energi ikatan pereaksi) > ∑ (energi ikatan produk reaksi). Dengan menggunakan rumus ∆H di atas, maka diperoleh ∆Hreaksi adalah negative (-) atau reaksi bersifat eksoterm.
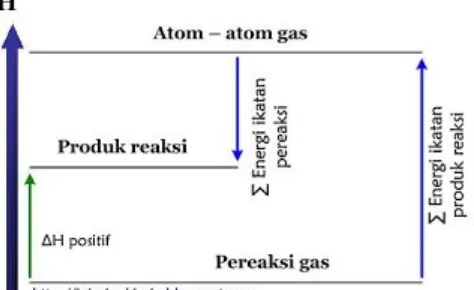
Secara umum, hubungan antara ∆H reaksi dengan ∑ (energi ikatan pereaksi) dan ∑ (energi ikatan produk reaksi) untuk reaksi endoterm dan reaksi eksterm dapat dilihat pada gambar berikut.
Gambar 6. Diagram tingkat energi reaksi eksot Energi Ikatan
Suatu reaksi kimia melibatkan pemutusan dan pembentukan ikatan kimia. Pemutusan ikatan kimia menyebabkan zat-zat pereaksi terpisah menjadi atom-atom penyusunnya. Atom-atom ini akan disusun ulang dan bergabung kembali membentuk ikatan kimia dalam zat-zat produk reaksinya. Pemutusan suatu ikatan memerlukan energi. Sebaliknya, suatu pembentukan ikatan akan melepaskan sejumlah energi. Energi yang terkait dengan pemutusan atau pembentukan ikatan kimia ini disebut energy ikatan. Energi ikatan dibedakan menjadi energi disosiasi untuk senyawa molekul, dan energi kisi untuk senyawa ion. Energi disosiasi (D) terkait dengan energi yang diperlukan untuk memutuskan ikatan senyawa molekul/kovalen. Sedangkan energi kisi terkait dengan energi yang dilepas untuk pembentukan ikatan senyawa ion. Pada bahasan berikutknya lebih difokuskan pada energi disosiasi. Energi Ikatan untuk Menghitung Perubahan Entalpi Reaksi
Seperti yang dijelaskan di atas, reaksi kimia akan melibatkan energi untuk pemutusan ikatan antar atom pereaksi dan pembentukan ikatan antar atom produk reaksi. Selisih antara energi untuk pemutusan dan pembentukan ikatan ini adalah ∆H. Dapat dirumuskan sebagai berikut:
Simak contoh reaksi peruraian H2O (reaksi endoterm) dan pembentukan CH4 (reaksi
eksoterm) berikut ini.
1. Reaksi Peruraian H2O
H2O dapat terurai menjadi gas H2 dan gas O2, dengan bantuan energi yang diperoleh
dari arus listrik.
Gambar 1. Reaksi peruraian Air
Gambar 2. Diagram tingkat energi peruraian air
Ada 2 tahapan dalam reaksi seperti yang ditunjukkan pada diagram entalpi pada gambar 2:
Pembentukan 2 ikatan H - H dan 1 ikatan O = O dari atom H dan O. energi yang dilepas adalah sebesar ∑ (energi ikatan produk reaksi).
Dari diagram, terlihat bahwa ∑ (energi ikatan pereaksi) < ∑ (energi ikatan produk reaksi). Dengan menggunakan rumus ∆H di atas, maka diperoleh ∆H reaksi adalah positif (+) atau reaksi bersifat endoterm.
Reaksi pembentukan CH4
Reaksi pembakaran CH4 dengan O2, dihasilkan gas CO2 dan gas H2O. raeksinya
adalah sebagai berikut:
Gambar 3. Reaksi pembakaran gas metana
Ada 2 tahapan dalam reaksi seperti yang ditunjukkan pada diagram entalpi pada gambar 4:
Pemutusan 4 ikatan C - H dan ikatan rangkap O = O menjadi menjadi atom-atom C, H dan O. Energi yang diperlukan adalah sebesar ∑ (energi ikatan pereaksi)
Pembentukan 2 ikatan C = O dan 2 ikatan H - O dari atom-atom C, H, dan O. Energi yang dilepas adalah sebesar ∑ (energi ikatan produk reaksi).
Dari diagram, terlihat bahwa ∑ (energi ikatan pereaksi) > ∑ (energi ikatan produk reaksi). Dengan menggunakan rumus ∆H di atas, maka diperoleh ∆Hreaksi adalah negative (-) atau reaksi bersifat eksoterm.
Secara umum, hubungan antara ∆H reaksi dengan ∑ (energi ikatan pereaksi) dan ∑ (energi ikatan produk reaksi) untuk reaksi endoterm dan reaksi eksterm dapat dilihat pada gambar berikut.
CONTOH SOAL
Contoh Soal Menghitung ΔH dari Energi Ikatan Rata-Rata :
Gunakan data energi ikatan rata-rata pada Tabel 2. untuk menghitung ΔH reaksi pembentukan amonia dari unsur-unsurnya
Pembahasan :
1. Tuliskan persamaan reaksi dan setarakan
2. Tentukan ikatan apa yang putus pada pereaksi, dan hitung jumlah energi ikatan rata-rata yang diperlukan
3. Tentukan ikatan apa yang terbentuk pada hasil reaksi, dan hitung jumlah energi ikatan rata-rata yang dilepaskan.
4. Hitung selisih energi yang terlibat dalam reaksi. Persamaan reaksinya:
N2(g) + 3H2(g) → 2NH3(g)
Ikatan yang putus pada pereaksi: N N 1 mol × 418 kJ mol–1 = 418 kJ
H–H 3 mol × 432 kJ mol–1= 1.296 Kj
Total energi yang diperlukan = 1714 kJ Ikatan yang terbentuk pada hasil reaksi: N – H 2 mol × 386 kJ mol–1 = 1.158 kJ
Total energi yang dilepaskan = 1158 kJ
Perubahan entalpi reaksi pembentukan amonia:
ΔHreaksi =ΣD(pemutusan ikatan) – ΣD(pembentukan ikatan) = 1.714 kJ – 1.158 kJ = 556 kJ
Oleh karena ΔH positif maka pembentukan 2 mol amonia menyerap energi sebesar 556 kJ atau sebesar 278 kJ mol–1