5 BAB II
TINJAUAN PUSTAKA
A. Nyeri 1. Definisi
Menurut The International Association for The Study of Pain (IASP) (1979), nyeri adalah pengalaman sensorik dan emosional yang tidak menyenangkan akibat kerusakan jaringan baik aktual maupun potensial atau yang digambarkan seperti itu. Dari definisi tersebut di atas, didapat dua hal penting yang dapat disimak yaitu yang pertama adalah adanya komponen inderawi yang melibatkan susunan sarat (fisik) dan yang kedua adalah komponen emosional yang melibatkan kejiwaan (psikologis). Hal ini sering dilupakan oleh dokter yang umumnya menganggap nyeri hanya bersifat inderawi sehingga dengan memotong alur perambatan nyeri maka selesailah persoalannya, padahal kenyataannya tidak demikian (Tanra AH,2005).
Skala Analog Visual / Visual Analog Scale (VAS) adalah skala untuk mengukur intensitas nyeri secara obyektif, diukur dengan nilai 0 – 10 dengan memberi katagori nilai sebagai berikut:
Tabel 2.1 Skala Analog Visual
Skala Interprestasi
0 Sama sekali tidak nyeri 1 - 3 Nyeri ringan
4 – 6 Nyeri sedang
7 - 9 Nyeri berat
10 Nyeri tak tertahankan
Berikut ini obat obat yang dapat digunakan untuk penanganan nyeri pasca bedah :
a. Gabapentin
Gabapentin [1-(aminomethyl) cyclohexane acetic acid] adalah analog struktural dari gamma-aminobutyric acid (GABA) yang pertama kali diperkenalkan tahun 1994 sebagai obat antiepilepsi, selanjutnya diketahui efektif untuk terapi nyeri kronik, penanganan nyeri akut periode perioperatif, mencegahan nyeri kronik paska operasi, ansiolisis, mencegah postoperative nausea and vomiting (PONV). Hal tersebut menunjukkan pentingnya gabapentin dalam penelitian dibidang anestesi dan menarik bahwa satu obat dapat memiliki efek multimodal (Kong dan Irwin, 2007)
Gabapentin memiliki formula molekuler C6H17NO2 dengan berat molekul 171.237 g/mol. Struktur gabapentin adalah sebagai berikut:
Gambar 2.1 Struktur gabapentin
Gabapentin adalah kristal solid putih dengan pKal: 3.7 dan pKa2: 10.7. Gabapentin larut dalam air, larut dalam basa dan asam. Koefisien partisi (n-octanol/0.05M phosphate buffer) pada pH 7.4 adalah -1.25 ( Kong dan Irwin, 2007).
CH2NH2
1) Mekanisme kerja
Gabapentin mempunyai struktur analog dari GABA dan dapat menembus sawar darah otak ketika diberikan secara sistemik. Gabapentin secara struktur berkaitan dengan neurotransmitter gamma-aminobutyric acid (GABA) tetapi tidak memodifikasi ikatan radioligand GABAAdan GABAB. Gabapentin tidak berubah
secara metabolisme menjadi GABA atau agonis GABA dan tidak menghambat uptake atau degradasi GABA (Kong dan Irwin, 2007; Usha et al, 2011).
Gabapentin mempunyai mekanisme kerja alternatif dalam sistem saraf pusat dengan berikatan pada subunit 2 voltage dependent calcium channels (VDCC), menghambat influk Ca2+ pada postsinaps atau menghambat influk Ca2+presinaps, selanjutnya menghambat pelepasan neurotransmiter eksitatori sehingga menumpulkan transmisi sinaptik. Penurunan pelepasan neurotransmiter eksitatori pada neuron yaitu neurotransmiter glutamate dan neurotransmiter noradrenalin. Glutamate merupakan neurotransmiter eksitatori paling penting dalam sistem saraf pusat. Penurunan glutamat menyebabkan penurunan aktivasi reseptor alpha-qmino-3-hydroxy-5-methyl-4-isoxazole propionic acid (AMPA) di otak. Noradrenlin merupakan neurotransmiter dalam SSP dan sebagai hormon ketika dilepaskan dari glandula medula adrenal. Noradrenergik pathways menghubungkan kortek serebal,
sistem limbik dan batang otak. Noradrenalin berperan dalam menentukan tingkat kewaspadaan dan mengatur sekresi glandula pituitary. Penurunan noradrenalin diotak akan menurunkan tingkat kewaspadaan dan berkurangnya kemampuan untuk bereaksi terhadap stres (Martini, 2006b) Gabapentin menghambatan pelepasan glutamate, aspartat, substansi P dan calcitonin gene -related peptide dari medulla spinalis tikus (Kong dan Irwin, 2007). 2) Farmakokinetik
Absorpsi gabapentin bersifat dose-dependent dengan mekanisme saturale L-amino acid transport dalam usus halus. Setelah pemberian gabapentin dosis 300 mg dosis tunggal per oral bioavaibilitasnya sekitar 60% dan dosis 600 mg bioavaibilitasnya sekitar 40%. Gabapentin didistribusikan luas pada jaringan dan cairan tubuh manusia, tidak terikat pada protein dan mempunyai volume of distribution 0,6-0,8 liter/kg. Gabapentin terionisasi pada pH fisiologi sehingga konsentrasi pada jaringan lemak rendah. Setelah minum satu kapsul gabapentin 300mg, konsentrasi puncak di plasma (C max) 2,7 ug/ml tercapai dalam 2-3 jam. Konsentrasi pada cairan serebrospinal sekitar 5-35% dari plasma sedangkan kosentrasi pada jaringan otak sekitar 80% dari plasma. Lama kerja gabapentin sekitar 8 jam dan dosis 900 – 1800 mg per hari terbagi dalam 3 dosis pemberian (Kong dan Irwin, 2007).
Gabapentin tidak dimetabolisme, tidak menginduksi enzim mikrosomal hepar, dieliminasi tanpa perubahan ke dalam urine dan obat yang tidak diabsopsi dikeluarkan kedalam feses. Pada pasien dengan fungsi renal normal, waktu paruh eliminasi gabapentin pada pemberian monoterapi antara 4,8-8,7 jam (Kong dan Irwin, 2007). 3) Farmakodinamik
Pada sistem kardiovaskuer: hanya sedikit data yang ada pada literature tentang pengaruh gabapentin pada sistem kardiovaskuler. Pemberian gabapentin 1200 mg 1 jam sebelum operasi tidak menunjukan efek TAR selama 0-24 jam. Pada sistem saraf pusat, gabapentin menimbulkan efek analgesia, ansiolisis dan sedasi (Kong dan Irwin, 2007).
4) Efek samping
Gabapentin umumnya ditoleransi baik. Evaluasi keamanan dan toleransi gabapentin dievaluasi pada 2216 pasien yang mendapat terapi kejang dilaporkan efek samping somnolen (15%), dizziness (10,9%), asthenia (6%), nyeri kepala (4,8%), nausea (3,2%), ataxia (2,6%), penambahan berat badan (2,6%) dan amblyopia (2,1%). Efek samping yang sama juga terjadi pada pasien nyeri kronis yang mendapat terapi gabapentin (Kong dan Irwin, 2007).
5) Interaksi obat
Secara klinis tidak ada interaksi gabapentin dengan obat lain, tidak dimetabolisme di hepar dan tidak menginduksi atau menghambat aktivitas enzim hepar dan tidak berikatan dengan protein. Interaksi obat dari gabapentin meliputi: alkohol, hydrocodone, morphine dan naproxene dapat meningkatkan resiko terjadinya efek samping seperti drowsiness atau dizziness
Cimetidine menurunkan kliren renal gabapentin sekitar 12% bila diberikan bersama. Antasid mengurangi bioavaibilitas gabapentin sekitar 10% (diberikan 2 jam sebelum gabapentin) sampai 20% (diberikan bersama atau 2 jam setelah gabapentin pada individu sehat (Kong dan Irwin, 2007).
b. Celecoxib
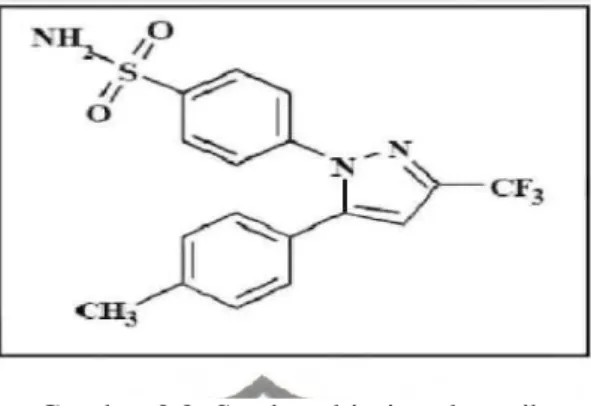
Celecoxib (kapsul Celebrex) adalah penghambat selektif COX-2 dengan desain kimiawi 4-[5-(4-methylpheriyl)-3-(trifluoromethyl)-lH-pyrazol-l-Yl] benzenesulfonamide dan struktur kimianya seperti tampak pada gambar 2. Rumus kimia celecoxib adalah C17H14F2N3O2S
Gambar 2.2. Struktur kimia celecoxib. 1) Mekanisme kerja
Celecoxib merupakan OAINS yang menunjukkan aktivitas anti inflamasi. analgesik. dan antipiretik pada model binatang. Mekanisme kerja dari obat ini adalah melalui penghambatan terhadap sintesis prostaglandin, utamanya melalui hambatan pada COX-2. Pada kadar terapeutik tidak akan menghambat COX-1 . 2) Retensi cairan
Penghambatan terhadap sintesis PGE2 dapat menyebabkan
retensi natrium dan cairan melalui peningkatan reabsorbsi pada medula ginjal dan segmen distal nefron. Di duktus koledukus. PGE2 akan menghambat reabsorbsi dengan cara kerja berlawanan aksi hormon anti diuretik .
3) Platelet
Celecoxib pada dosis tunggal sampai dengan 800 mg dan dosis multipel 600 mg 2 kali perhari selama 7 hari (lebih tinggi dari dosis terapi yang dianjurkan) tidak memiliki efek pada reduksi agregasi platelet atau peningkatan pada waktu perdarahan. Karena
lemahnya efek ini maka celecoxib tidak dapat digunakan sebagai pengganti aspirin untuk pencegahan kardiovaskular . 4) Farmakokinetik
a) Absorbsi
Kadar puncak plasma (Cm) celecoxib ± 3 jam setelah pemberian peroral. Kadar puncak ini akan memanjang 1-2 jam ketika diberikan bersama dengan makanan tinggi lemak. dan absorbsi totalnya akan meningkat 10-20%. Pemberian bersama-sama dengan antasid yang mengandung alumunium dan magnesium akan menyebabkan penurunan konsentrasi plasma celecoxib sebanyak 37%. Konsumsi celecoxib sampai dengan dosis 200 mg 2 kali perhari dapat diberikan tanpa mempertimbangkan waktu makan. Pada dosis yang lebih ringgi (400 mg 2 kali perhari) harus diberikan bersama makan untuk meningkatkan absorbsi (Stoelting, 2006).
b) Distribusi
Pada subyek normal celecoxib berikatan sangat kuat dengan protein (97%). Dalam penelitian in vitro berikatan primer pada albumin, dan sangat sedikit dengan a 1-acid glycoprotein. Celecoxib tidak berikatan dengan sel darah merah (Stoelting, 2006).
c) Metabolisme
Metabolisme celecoxib dimediasi melalui sitokrom P450 2C9. Ada 3 macam metabolit yang telah diketahui pada plasma manusia yaitu alkohol, asam karboksilik, dan glukorinid. Ketiga metabolit ini akan menjadi inaktif oleh penghambat COX-1 atau COX-2 (Stoelting, 2006).
d) Ekskresi
Eliminasi utama celecoxib predominan oleh metabolisme hepatik. Setelah pemberian oral, ± 57% dari dosisnya akan diekskresi di feses dan 27% nya di urin. Metabolit utama yang diekskresikan di feses dan urin adalah asam karboksilik (73% dosis). Waktu paruh efektif celecoxib ± 11 jam (Stoelting, 2006).
5) Indikasi dan penggunaan
Mengingat keuntungan dan resikonya maka harus dipertimbangkan secara hati-hati sebelum penggunaan celecoxib. Gunakan dosis efektif terkecil dalam jangka pendek dengan tujuan secara individu pada tiap pasien (Stoelting, 2006)
Celecoxib diindikasi untuk: 1) mengurangi tanda dan gejala osteoarthritis dosis oral 200 mg/hari sebagai dosis tunggal atau terbagi 100 mg/12 jam; 2) mengurangi tanda dan gejala arthritis reumatoid pada dewasa dosis oral 100-200 mg/12 jam; 3) mengurangi tanda dan gejala arthritis reumatoid juvenil pada
pasien usia >2 tahun, dosis oral dengan berat badan >10 kg sampai <25 kg adalah 50 mg. 12 jam. berat badan >25 kg adalah 100 mg/12 jam: 4) mengurangi tanda dan gejala spondilitis ankilosing, dosis 200-400 mg/hari tunggal atau terbagi dan diobservasi selama 6 minggu. jika tidak membaik gunakan pilihan terapi lain; 5) manajemen nyeri akut pada dewasa, dosis initial 400 mg dapat diikuti 200 mg pada hari yang sama hari selanjutnya 200 mg/12 jam jika dibutuhkan; 6) mengobati dismenore primer, dosis sama seperti pada nyeri akut; dan 7) mengurangi jumlah adenomatous colorectal polyp pada familial adenomatous polyposis, sebagai tambahan pada perawatan sebelumnya (misalnya surveilan endoskopik, pembedahan), dosis oral 400 mg 12 jam diberikan bersama makanan (Stoelting, 2006).
c. Asetaminofen
Parasetamol banyak digunakan sebagai obat analgetik dan antipiretik, dimana kombinasi parasetamol dengan opioid dapat digunakan untuk penanganan nyeri berat paska pembedahan dan terapi paliatif pada pasien-pasien penderita kanker. Onset analgesia dari parasetamol 8 menit setelah pemberian intravena, efek puncak tercapai dalam 30 – 45 menit dan durasi analgesia 4 – 6 jam serta waktu pemberian intravena 2 – 15 menit. Parasetamol termasuk dalam kelas “aniline analgesics” dan termasuk dalam golongan obat antiinflamasi non steroid (masih ada perbedaan pendapat). Parasetamol
memiliki efek anti inflamasi yang sedikit dibandingkan dengan obat AINS lainnya. Akan tetapi parasetamol bekerja dengan mekanisme yang sama dengan obat AINS lainnya (menghambat sintesa prostaglandin). Parasetamol juga lebih baik ditoleransi dibandingkan aspirin dan obat AINS lainnya pada pasien-pasien dengan sekresi asam lambung yang berlebihan atau pasien dengan masa perdarahan yang memanjang.
Gambar 2.3 Rumus Bangun Paracetamol
Dosis pada orang dewasa sebesar 500 – 1000 mg, dengan dosis maksimum direkomendasi 4000 mg perhari. Pada dosis ini parasetamol aman digunakan untuk anak-anak dan orang dewasa. Mekanisme kerja utama dari parasetamol adalah menghambat siklooksigenase (COX) dan selektif terhadap COX-2. Analgetik dan antipiretik dari parasetamol sebanding dengan aspirin dan obat AINS lainnya, akan tetapi aktifitas anti inflamasi perifernya dibatasi oleh beberapa faktor, dimana diantaranya terdapat kadar peroksida yang tinggi di lesi inflamasi. Oleh karena itu selektifitas akan COX-2 tidak secara signifikan menghambat produksi pro-clotting tromboxane. Parasetamol menurunkan bentuk oksidasi dari
enzim COX, yang melindungi dari pembentukan kimiawi bentuk pro-inflammatory. Ini juga akan di SSP, akibatnya menurunkan batas menurunkan jumlah dari prostaglandin E2 ambang
hipotalamus di pusat termoregulasi (Goodman dan Gilman, 2007). Parasetamol menghambat kerja COX dengan dua jalur, yang pertama bekerja dengan cara menghambat COX-3 (variant dari COX-1). Enzim COX-3 ini hampir sama dengan enzim COX lainnya dengan menghasilkan kimiawi pro-inflammatory dan penghambat selektif oleh parasetamol. Jalur kedua bekerja seperti aspirin dengan memblok siklooksigenase, dimana didalam lingkungan inflamasi dengan konsentrasi peroksida yang tinggi dan melindungi aksi kerja parasetamol dalam keadaan oksidasi tinggi. Ini berarti bahwa parasetamol tidak memiliki efek langsung pada tempat inflamasi, akan tetapi bereaksi di SSP dimana keadaan lingkungan tidak teroksidasi. Namun mekanisme kerja pasti dari parasetamol di COX-3 masih diperdebatkan.
Bioavailibilitas dari parasetamol adalah 100%. Parasetamol dimetabolisme di hati dengan tiga jalur metabolik, yakni glucuronidation 40%, sulfation 20-40% dan N-hydroxylation serta GSH konjugasi 15%, dengan obat dan metabolitnya diekskresikan melalui ginjal.
Pada dosis yang direkomendasikan, parasetamol tidak mengiritasi lambung, tidak mempengaruhi koagulasi darah atau
fungsi ginjal. Parasetamol dipercaya aman digunakan pada wanita hamil (tidak mempengaruhi penutupan ductus arteriosus), tidak seperti efek yang ditimbulkan oleh penggunaan obat AINS. Tidak seperti aspirin, parasetamol tidak berhubungan dengan resiko penyebab sindroma Reye pada anak-anak dengan penyakit virus . Satu-satunya efek samping dari penggunaan parasetamol adalah resiko terjadi hepatotoksik dan gangguan gastrointestinal pada penggunaan dosis tinggi, yaitu diatas 20.000 mg perhari (Goodman dan Gilman, 2007).
B. Nyeri Pasca Bedah
Dari segi perjalanan waktu, nyeri terbagi atas nyeri akut dan nyeri kronik, di mana nyeri pascabedah, termasuk dalam nyeri akut. Nyeri akut selalu disebabkan oleh adanya kerusakan jaringan (nosiseptif), sedangkan nyeri kronik tidak selalu disebabkan adanya nosiseptif ini. Nyeri akut yang tidak diatasi secara baik bisa berkembang menjadi nyeri kronik. Oleh sebab itu, ada yang membagi nyeri ini atas nyeri nosiseptif dan nyeri nonnosiseptif (Dellemijn PLI., 2006).
Woolf membedakan nyeri atas nyeri fisiologik dan nyeri patologik. Nyeri fisiologik dikategorikan sebagai suatu sensasi normal, yang terjadi karena ada rangsang noksius misalnya karena kita meraba benda panas atau dingin dan kalau ada cubitan. Sementara itu, nyeri patologik dikategorikan
sebagai akibat dari suatu sensasi abnormal, yang terjadi karena ada kerusakan jaringan (Tanra AH, 2005).
Merskey menggunakan istilah nyeri neuropatik yang dijelaskannya sebagai nyeri yang disebabkan oleh lesi primer dan disfungsi pada sistem saraf (Merskey H.1994).Oleh sebab itu, Vadivelu memberikan klasifikasi nyeri atas nyeri fisiologis, nyert nosiseptif (nyeri inflamasi), dan nyeri neuropatik. Nyeri nosiseptif adalah nyeri yang disebabkan oleh rangsang noksius akibat kerusakan jaringan, misalnya sesudah pembedahan, trauma, atau perlukaan. Nyeri nosiseptif disebut juga nyeri inflamasi karena penyebabnya juga karena proses inflamasi dan mediator inflamasi yang memulai dan melanjutkan proses inflamasi. Intensitas nyeri nosiseptif tergantung luasnya kerusakan jaringan dan jumlah mediator inflamasi yang dihasilkan (Vadivelu N,Whitney C,Sinatra R.,www.cambridge.org).
Nyeri neuropatik adalah suatu nyeri yang disebabkan oleh suatu lesi patologik ataupun disfungsi pada saraf perifer dan atau saraf sentral. Nyeri neuropatik dibagi lagi atas nyeri neuropatik perifer untuk nyeri yang lesi primer dan disfungsinya terjadi pada susunan saraf perifer, dan nyeri neuropatik sentral untuk nyeri yang lesi primer dan disfungsinya terjadi pada susunan saraf sentral (Tanra AH, 2005).
Sebagaimana telah diutarakan di atas, nyeri karena pembedahan atau nyeri pascabedah termasuk dalam nyeri nosiseptif karena kerusakan jaringan dan karena adanya proses inflamasi. Nyeri pascabedah dimulai primer karena adanya nosisepsi yang timbul akibat kerusakan jaringan atau perlukaan.
Nosisepsi ini diterima oleh nosiseptor yang terdapat dan tersebar di seluruh tubuh kita, misalnya kulit, subkutis, pembuluh darah, otot, fasia, periosteum, visera, dan lain-lain. Nosiseptor ini adalah reseptor penerima nyeri, yang bentuknya hanya merupakan simple nerve ending (Tanra AH, 2005).
Nosisepsi yang menyebabkan rangsangan nyeri pada nosiseptor ini bisa disebabkan oleh rangsang mekanis dan rangsang termal, tetapi bisa juga karena substansi algogenik, yaitu beberapa mediator yang diproduksi oleh jaringan yang rusak dan yang mengalami inflamasi (Tanra AH, 2005)
Kerusakan jaringan tubuh karena pembedahan dan reaksi inflamasi pada jaringan tersebut akan mengeluarkan beberapa mediator antara lain H+, K+, ATP, asetilkolin, serotonin, histamin, bradikinin, dan prostaglandin. Mediator ini akan menyebabkan sensitisasi sistem saraf sensorik (Tanra AH, 2005).
Di perifer terjadi penurunan nilai ambang reseptor nyeri (nosiseptor) yang disebut sensitisasi perifer, sedangkan di sentral terjadi peningkatan eksitabilitas neuron spinal yang disebut sensitisasi sentral. Dengan demikian, nyeri di sini terjadi karena adanya sensitisasi perifer dan sentral. (Tanra AH.2005).
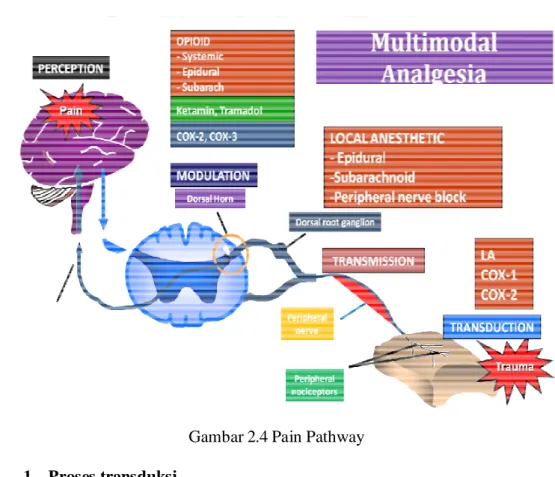
Mekanisme Persepsi Nyeri
Rangsangan nyeri dari perifer yang mengakibatkan sensitisasi perifer melalui proses elektrofisiologik akan menyebabkan sensitisasi sentral dan akan menimbulkan persepsi nyeri di sentral melalui 4 proses, yaitu:
1. Proses transduksi, di mana suatu rangsang nyeri (noksius) diubah menjadi suatu aktivitas listrik yang akan diterima oleh ujung-ujung saraf (nerve endings).
2. Proses transmisi, di mana rangsang merambat melalui saraf sensorik. 3. Proses modulasi, di mana terjadi interaksi antara rangsang nyeri yang tiba
pada kornu posterior dengan sistem analgetik endogen seperti endorfin. 4. Proses persepsi, merupakan hasil akhir dari interaksi tadi dengan
dihasilkannya suatu perasaan subjektif yang disebut nyeri.
Gambar 2.4 Pain Pathway 1. Proses transduksi
Proses transduksi dijelaskan sebagai reaksi dari nosiseptor perifer terhadap rangsang trauma berupa mekanik, termal, atau kimiawi yang berpotensi merusak. Rangsang noksius akan menyebabkan depolarisasi
listrik pada ujung nosiseptor. Sebagai mediator noksius perifer di sini bisa karena bahan yang dilepaskan dari sel-sel yang rusak selama perlukaan, ataupun sebagai akibat reaksi humoral dan neural karena perlukaan (Tanra AH, 2005).
Kerusakan selular pada kulit, fasia, otot, tulang, dan ligamentum mengakibatkan dari intraselular dilepaskan ion hidrogen (H+) dan ion kalium (K+) serta arachidonic acid (AA = asam arakidonat) sebagai akibat lisis dari membran sel. Penumpukan asam arakidonat memicu pengeluaran enzim cyclooxygenase-2 (COX-2), yang akan mengubah asam arakidonat menjadi prostaglandin E2, prostaglandin G2, dan prostaglandin H2. Prostaglandin E2 dan mediator yang lain ini akan menyebabkan sensitisasi saraf perifer (Vadivelu N, Whitney C,Sinatra R.www.cambridge.org).
Selain prostaglandin, dari jaringan yang mengalami kerusakan juga dilepaskan leukotrien, 5-hydroxytryptamine (5-HT), bradikinin (BK), dan histamin yang banyak berpengaruh pada terjadinya sensitisasi primer dan sekunder (Pogatzki E, 2007).
Pada daerah lokal dengan dilepaskannya substansi tersebut di atas akan terjadi peningkatan permeabilitas pembuluh darah, mulai terjadi edema neurogenik, iritabilitas nosiseptor meningkat, dan menyebabkan aktivasi ujung nosiseptor yang berdekatan. Semua ini akan menghasilkan suatu keadaan sensitisasi perifer yang disebut hiperalgesia primer. Hal ini lebih ditingkatkan dengan mediator noksius humoral dan reaksi neural.
Hiperalgesia adalah gejala di mana stimulus noksius yang dalam keadaan normal menyebabkan nyeri, tetapi dalam keadaan ini stimulus tersebut menyebabkan perasaan sangat nyeri. Akibat stimulus ini ada juga gejala yang disebut alodinia. Alodinia adalah gejala di mana stimulus yang dalam keadaan normal tidak menyebabkan nyeri, tetapi dalam keadaan ini stimulus tersebut menyebabkan nyeri. Hiperalgesia diklasifikasikan atas:
a. Hiperalgesia primer, di mana terjadi sensitisasi pada nosiseptor perifer.
b. Hiperalgesia sekunder, di mana terjadi sensitisasi di spinal cord dan susunan saraf pusat dan menyebabkan gejala alodinia.
Bradikinin, 5-HT, dan mediator primer lainnya akan menstimulasi sensitisasi ujung saraf dan menyebabkan pelepasan peptida dan neurokinin seperti calcitonin gene related protein (CGRP), substance P (sP), dan cholecystokinin (CCK) di tempat dan di sekitar perlukaan. Substansi P, sebaliknya, akan meningkatkan sensitisasi perifer dengan meningkatkan pelepasan bradikinin, histamin, dan 5-HT (Woolf CJ,1999)
Substansi P dan CGRP dihasilkan dari sel tubuh pada nosiseptor primer yang berlokasi pada akar dari ganglion dorsal. Substansi ini melalui transpor aksonal diteruskan ke ujung saraf perifer dan ujung saraf sentral, dan akan memulai proses hiperalgesia (Woolf CJ, 1999).
Bila dilepas diujung saraf perifer CGRP akan meningkatkan prostaglandin E dan histamin, yang menyebabkan terjadinya proses inflamasi berupa vasodilatasi pembuluh darah, peningkatan permeabilitas
kapiler, serta ekstravasasi protein plasma. Dia juga memperpanjang efek dari substansi P dengan menghambat hancurnya metabolik perifer (Cousins MJ.Cited at http://www.wfsa.ox.ac.uk)
Refleks eferen simpatis juga akan melakukan reaksi terhadap sensitisasi nosiseptor dengan melepaskan norepinefrin yang menyebabkan vasokonstriksi pembuluh darah pada tempat perlukaan. Norepinefrin ini juga akan menstimulasi pelepasan bradikinin dan substansi P (Woolf CJ,1999)
Perlukaan jaringan akut juga menyebabkan peningkatan sintesis dan ekstravasasi sitokin proinflamasi dari humoral, seperti interleukin-16 (IL-1B), interleukin-6 (IL-6), tumor necrosis factor a (TNF-a tumor), dan nerve growth factor (NGF). Sitokin ini juga berperan pada eksaserbasi edema dan juga merupakan salah satu komponen iritatif dari nyeri inflamasi. Dari penelitian didapatkan bahwa peningkatan kadar interleukin-lB ditemukan pada keadaan alodinia, dan pemberian analgesia pascabedah yang efektif ternyata menurunkan kadar sitokin proinflamasi. Juga didapatkan bahwa polimorfisme genetik mempengaruhi produksi sitokin proinflamasi, dan oleh karena itu, intensitas nyeri serta kebutuhan analgetik pascabedah berbeda bagi setiap individu (Vadivelu N et all.www.Cambridge.org).
Interleukin-lB ini juga akan menginduksi enzim COX-2. Sementara itu, pembentukan prostaglandin dari asam arakidonat memerlukan bantuan enzim COX-2 ini. Dengan demikian, interleukin-lB
juga menyebabkan peningkatan pembentukan prostaglandin E2 (Lelo A, Ichwan M.2004) .
Mediator inflamasi dan sitokin proinflamasi tersebut melakukan aktivasi terhadap ion channel dari transient receptor potential (TRP). Ada 4 unit reseptor yang mengandung ion channel sentral dan memungkinkan masuknya Ca2+dan\Na+. Masuknya Ca2+ melalui ion channel TRP menimbulkan potensi elektrik, yang menyebabkan depolarisasi segmen aksonal distal dan menghasilkan potensial aksi yang akan diteruskan ke sentral. Dengan demikian, rangsang nyeri pada nosiseptor dihantar oleh serabut perifer ke sistem saraf pusat (Woolf CJ, 1999).
Serabut saraf penghantar nyeri ini dibedakan atas serabut saraf yang diameternya besar dan yang kecil, serta serabut saraf yang bermielin dan yang tidak. Konduksi nyeri lebih cepat pada serabut saraf yang besar dan bermielin, dan lebih lambat pada serabut saraf yang kecil dan tidak bermielin. Aferen dari serabut saraf perifer dibagi atas 3 kelompok, yaitu kelompok A, B, dan C. Kelompok A adalah serabut saraf yang bermielin dan berdiameter lebih besar, kelompok B merupakan serabut saraf bermielin dari preganglionik saraf otonom, sedangkan kelompok C merupakan serabut saraf tak bermielin. Kelompok A ini sesuai besarnya dibagi lagi atas 4 subkelompok, yaitu alfa, beta, gama dan delta. Dari seluruh kelompok serabut saraf ini, hanya serabut saraf A delta dan C yang membawa konduksi nyeri (Pogatzki E, 2007).
Konduksi nyeri yang dihantar oleh serabut saraf A delta lebih cepat dan terasa sebagai nyeri yang tajam, jitu, dan lokalisasinya jelas, serta tidak berlangsung lama, disebut sebagai fast conduction, sedangkan nyeri yang dihantar oleh serabut saraf C lebih lambat dan terasa sebagai nyeri yang tumpul dan lokalisasinya samar-samar, serta berlangsung lebih lama, disebut sebagai slow conduction (Pogatzki E, 2007)
Aferen dari kedua saraf ini menuju sentral dan melakukan sinaps dengan sel second order pada kornu dorsalis medula spinalis. Dari kornu dorsalis impuls ini melalui aferen ascending menuju thalamus (Vadivelu N,www.cambridge.org).
2. Proses transmisi
Pada proses transmisi impuls noksius dari nosiseptor primer diteruskan ke sel di dalam kornu dorsalis medula spinalis. Serabut saraf A delta dan serabut saraf C memiliki proyeksi di distal yang dikenal sebagai ujung nosiseptif, sedangkan ujung proksimalnya akan masuk ke dalam kornu dorsalis medula spinalis dan bersinaps dengan second-order neuron yang berlokasi dominan dalam lamina II (substantia gelatinosa) dan dalam lamina V (nucleus proprius). Neuron kornu dorsalis terdiri dari first-order neuron yang merupakan akhir dari serabut aferen pertama (presinaptik), dan second-order 1 neuron yang menerima rangsang dari neuron pertama (pascasinaptik). Proses modulasi nyeri diperankan oleh second-order neuron ini, yang memfasilitasi atau menghambat masuknya suatu rangsang noksius (Turan A, 2004).
Second-order neuron juga terdiri atas 2 jenis, yaitu:
a. Nociceptive-specific neuron (NS) yang berlokasi dalam lamina I dan bereaksi terhadap rangsang dari I serabut saraf A delta dan serabut saraf C.
b. Wide-dynamic range neuron (WDR) yang berlokasi dalam lamina V dan bereaksi terhadap rangsang noksius ataupun rangsang nonnoksius, dan yang menyebabkan menurunnya respond threshold serta meningkatnya receptive field, sehingga terjadi peningkatan sinyal transmisi ke otak dan terjadi persepsi nyeri. Perubahan ini terjadi karena perubahan pada kornu dorsalis sebagai akibat kerusakan jaringan serta proses inflamasi, dan disebut sensitisasi sentral.
Sensitisasi sentral ini akan menyebabkan neuron- neuron menjadi lebih sensitif terhadap rangsang lain dan menimbulkan gejala-gejala hiperalgesia dan alodinia (Turan A, 2004).
Hal ini menunjukkan bahwa susunan saraf pusat tidak bersifat kaku, tetapi bersifat seperti plastik (plastisitas) yang dapat berubah sifatnya karena ada kerusakan jaringan atau inflamasi (Woolf CJ, 1999) Stimulus dengan frekuensi rendah menghasilkan reaksi dari neuron WDR berupa transmisi sensoris tidak nyeri, tetapi stimulus dengan frekuensi yang lebih tinggi akan menghasilkan transmisi sensoris nyeri. Neuron WDR ini dihambat oleh sel inhibisi lokal di substansia gelatinosa dan dari sinaptik desendens. Impuls noksius dari nosiseptor perifer akan diteruskan sampai ke neuron presinaptik. Di neuron presinaptik impuls ini akan
mengakibatkan Ca2+ akan masuk ke dalam sel melalui Ca2+ channel. Masuknya Ca2+ ke dalam sel ini menyebabkan dari ujung neuron presinaptik dilepaskan beberapa neurotransmiter seperti glutamat dan substansi-P (neurokinin). Dari ujung presinaptik serabut saraf A delta dilepaskan neurotransmiter golongan asam amino seperti glutamat dan aspartat, sedangkan dari ujung presinaptik serabut saraf C dilepaskan selain neurotransmiter golongan asam amino, juga neurotransmiter golongan peptida seperti substansi-P (neurokinin), calcitonin gene related protein (CGRP), dan cholecystokinin (CCK). Selama pembedahan stimulus noksius dihantar melalui kedua serabut saraf tersebut, sedangkan pada periode pascabedah dan pada proses inflamasi stimulus noksius didominasi penghantarannya melalui serabut saraf C (Woolf CJ,1999)
Neurotransmiter seperti glutamat dan substansi-P yang dilepaskan di presinaptik ini akan berperan pada transmisi sinaptik. Asam amino yang menyebabkan eksitasi dan berperan pada transmisi sinaptik dan depolarisasi neuronal yang cepat, seperti glutamat dan aspartat akan melakukan aktivasi terhadap reseptor amino-3-hydroxyl-5-methyl-4-proprionic acid (AMPA) dan reseptor kainite (KAR). Reseptor AMPA terdiri dari 4 subunit dengan lokasi pengikatan glutamat yang mengelilingi cation channel di sentral (Woolf CJ,1999).
Pengikatan glutamat ini akan menyebabkan aktivasi reseptor, membuka channel, dan memungkinkan berpindahnya ion Na+ ke dalam sel. Meningkatnya perpindahan ion Na+ akan menyebabkan depolarisasi
neuron second-order dan memungkinkan sinyal noksius berpindah secara cepat ke lokasi supraspinal dari persepsi. Reseptor KAR juga ikut dalam eksitasi pascasinaptik, tetapi dibandingkan dengan AMPA sedikit peranannya dalam sinyal sinaptik sesudah stimulus noksius. Dalam keadaan stimulasi noksius frekuensi tinggi yang terus-menerus aktivasi reseptor AMPA dan KAR akan merangsang reseptor N-methyl-D-aspartic acid (NMDA) (Woolf CJ, 1999).
Bila reseptor non-NMDA memegang peranan pada informasi sensoris yang fisiologis, reseptor NMDA memegang peranan pada perubahan patofisiologis seperti pada mekanisme yang disebut wind-up, yaitu ia melakukan fasilitasi sehingga terjadi sensitisasi sentral. Oleh karena itu, obat-obat seperti ketamin dan dekstrometorfan yang mempunyai efek menghambat reseptor NMDA bila diberikan pada penderita yang mengalami pembedahan dapat membantu mengurangi pemakaian obat analgetik pascabedah (Woolf CJ,1999).
Reseptor NMDA terdiri dari 4 subunit, yaitu 2 subunit NR1, 1 subunit NR2A, dan 1 subunit NR2B yang mengatur masuknya Na+ dan Ca2+ ke dalam sel dan keluarnya K+ melalui suatu ion channel. Bagian ekstraselular subunit NR2 mempunyai tempat pengikatan glutamat sedangkan glycine mengikat pada subunit NR1 (Woolf CJ, 1999).
Aktivasi reseptor NMDA memerlukan induksi depolarisasi membran dari reseptor AMPAdan pengikatan glutamat atau aspartat pada reseptor. Aktivasi reseptor AMPA akan memulai suatu excitatory postsynaptic
potentials (EPSPs) dan menghasilkan suatu depolarisasi yang cukup dan mampu untuk mengeluarkan sumbatan ion magnesium yang dalam keadaan normal menutup ion channel NMDA. (Woolf CJ,1999).
Pemindahan ion Mg2+akan menyebabkan masuknya ion Ca2+ ke dalam sel. Aktivasi reseptor NMDA lebih lanjut karena sensitisasi oleh pengikatan glutamat pada tempat pengikatannya. Akumuiasi penumpukan Ca2+ intraselular akan mempengaruhi perubahan neurochemical dan neurofisiologi yang akan mempengaruhi proses nyeri akut. Neuron spinal second-order akan menjadi sangat sensitif dan cepat terangsang oleh rangsang sensoris selanjutnya, dan proses ini disebut wind-up. Aktivasi NMDA, wind-up, dan sensitisasi sentral menjadi penyebab dari hiperalgesia sekunder (Dahl JB,2004).
Neurotransmiter golongan peptida seperti substansi-P berperan pada lama dan panjangnya waktu depolarisasi dari neuron second-order komu dorsalis. Substansi-P terikat pada reseptor metabotropik neurokinin-1 (NK-neurokinin-1) dan sinergis melakukan aktivasi neuron NMDA serta diperlukan untuk terjadinya potensi yang lebih lama (Dahl JB,2004).
Masuknya ion Ca2+ ke dalam intraselular juga menyebabkan aktivasi enzim seperti nitric oxide synthese (NOS) dan COX-2. Ca2+ intraselular akan berikatan dengan kalmodulin menjadi Ca-kalmodulin. Ca-kalmodulin akan mengaktivasi enzim NOS yang berperan dalam merubah arginin menjadi sitrulin dan nitric oxyde (NO). Dalam keadaan normal NO dibutuhkan untuk mempertahankan fungsi sel yang normal,
tetapi dalam keadaan yang berlebihan NO dapat bersifat neurotoksik yang akan merusaksel saraf itu (Dahl JB, 2004).
Sintesis protein pada fase akut bersama dengan meningkatnya prostaglandin-E dan NO intra- dan ekstraselular berperan pada sensitisasi sentral dan plastisitas neural serta melakukan fasilitasi transmisi nyeri (Dahl JB, 2004).
3. Proses modulasi
Proses modulasi dinyatakan sebagai mekanisme hambatan (inhibisi) terhadap nyeri di dalam kornu dorsalis medula spinalis dan di tingkat lebih tinggi di brain stem dan mid brain. Di dalam medula spinalis mekanisme inhibisi terhadap transmisi nyeri terjadi pada sinaps pertama antara aferen noksius primer dan sel -sel WDR dan NS dari second-order, dengan demikian mengurangi penghantaran spinotalamus dari impuls noksius. Modulasi spinal dimediasi oleh kerja inhibisi dari senyawa endogen yang mempunyai efek analgetik, yang dilepaskan dari interneuron spinal dan dari ujung terminal akson yang mempunyai sifat inhibisi yang turun (desendens) dari central gray locus ceruleus dan dari supraspinal yang lain. Analgesik endogen itu adalah enkephalin (ENK), norepinephrine (NE), dan gamma aminobutyric acid (GABA). Analgesik endogen ini akan mengaktifkan reseptor opioid, alpha adrenergic, dan reseptor yang lain, yang bekerja melakukan inhibisi pelepasan glutamat dari aferen nosiseptif primer atau mengurangi reaksi post sinaptik dari neuron second-order NS atau WDR. Proses modulasi adalah proses
interaksi antara mediator yang menyebabkan eksitasi dan efek inhibisi dari analgesik endogen (Turan A, 2004).
Opioid endogen seperti enkephalin dan endorphin akan melakukan modulasi transmisi nyeri. Selain itu, sebagian sitokin seperti interleukin-lB yang terbentuk di perifer, bersama aliran darah akan sampai ke sistem saraf pusat, dan dia juga akan menginduksi COX-2 di dalam neuron otak sehingga terbentuk juga prostaglandin E-2 yang juga mengakibatkan perasaan nyeri (Turan A, 2004).
Namun, di dalam sistem saraf pusat sitokin interleukin-lB memberikan efek yang berbeda,tergantung besamya jumlah sitokin tersebut. Sitokin dalam jumlah yang sedikit justru akan merangsang efek hiperalgesia, tetapi dalam jumlah yang banyak/besar akan memberikan efek analgesia. Selain itu, sitokin dalam jumlah yang besar akan berpotensiasi dengan pengeluaran endorfin dalam darah, yang akan memberikan efek analgesia (Lelo A,2004).
4. Proses Persepsi
Proses persepsi noksius adalah hasil dari proses-proses sebelumnya, yaitu yang dimulai dari perifer dan meluas ke atas ke neuraksis dan berakhir di regio supraspinalis untuk dilakukan interpretasi.
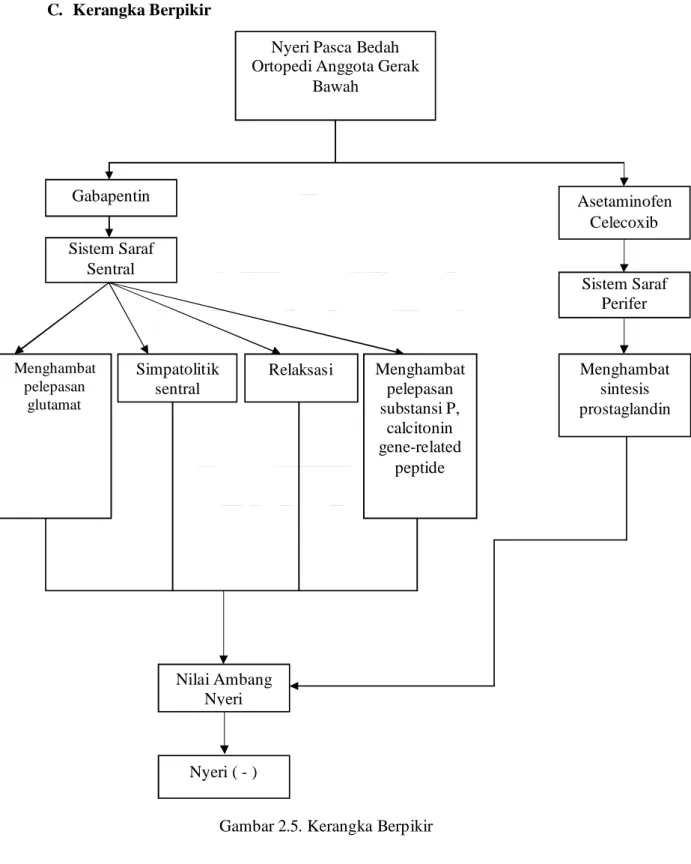
C. Kerangka Berpikir
Gambar 2.5. Kerangka Berpikir Gabapentin Nilai Ambang Nyeri Nyeri ( - ) Asetaminofen Celecoxib Sistem Saraf Sentral Sistem Saraf Perifer Nyeri Pasca Bedah
Ortopedi Anggota Gerak Bawah Menghambat pelepasan glutamat Simpatolitik sentral Relaksasi Menghambat sintesis prostaglandin Menghambat pelepasan substansi P, calcitonin gene-related peptide
D. Hipotesis
Ada perbedaan efektivitas pada kombinasi gabapentin dan celecoxib dengan kombinasi gabapentin dan asetaminofen untuk nyeri pasca bedah ortopedi anggota gerak bawah.