BAB I
BAB I
PENDAHULUAN
PENDAHULUAN
1 1..11.. LLaattaar r BBeellaakkaannggPeran sektor industri di
Peran sektor industri di IndonIndonesia selalu esia selalu mengamengalami lami peninpeningkatangkatan. . Hal iniHal ini di
disesebababkbkan an kakarerena na pepembmbanangugunanan n papada da sesektktor or ininduduststri ri diditutujujukakan n ununtutuk k memperkokoh struktur ekonomi nasional dengan keterkaitan yang kuat dan saling memperkokoh struktur ekonomi nasional dengan keterkaitan yang kuat dan saling men
mendukdukung ung antantar ar seksektortor, , menmeningingkatkatkan kan daydaya a daldalam am perperekoekonomnomian ian nasnasionional,al, me
mempmperlerluauas s laplapanangagan n kekerjrja a dadan n kekesemsempapatatan n ususahaha a seksekalaligigus us memendndororonongg berkembangnya kegiatan berbagai sektor lainnya. Salah satu contoh produk sektor berkembangnya kegiatan berbagai sektor lainnya. Salah satu contoh produk sektor
industri adalah senyawa asetanilida. industri adalah senyawa asetanilida.
Asetanilida memiliki beragam manfaat, baik sebagai bahan baku maupun Asetanilida memiliki beragam manfaat, baik sebagai bahan baku maupun bahan
bahan penunjang penunjang industri industri kimia kimia seperti seperti sebagai sebagai bahan bahan baku baku pembuatan pembuatan obat- obat-ob
obatatan an sasalalah h sasatutunynya a papararasesetatamomol. l. BaBahahan n babaku ku yayang ng didigugunanakakan n dadalalamm memproduksi asetanilida adalah anilin dan asetat anhidrat yang ketersediaannya di memproduksi asetanilida adalah anilin dan asetat anhidrat yang ketersediaannya di Indonesia cukup memadai. Bahan baku tersebut dapat bereaksi membentuk reaksi Indonesia cukup memadai. Bahan baku tersebut dapat bereaksi membentuk reaksi asi
asilalasisi. . KeKebubututuhahan n asasetaetaninililida da di di InIndodonenesisia a papada da tatahuhun n 202012 12 didipeperkrkirirakakanan mencapai 49.271.000. Angka tersebut sangat tinggi jika dilihat dari asetanilida mencapai 49.271.000. Angka tersebut sangat tinggi jika dilihat dari asetanilida yang telah diproduksi di Indonesia. Pasokan asetanilida di Indonesia didapatkan yang telah diproduksi di Indonesia. Pasokan asetanilida di Indonesia didapatkan dari kegiatan import.
dari kegiatan import. PadahPadahal al bahan baku bahan baku pembupembuatan asetanilida di atan asetanilida di IndonIndonesiaesia cukup memadai. Salah satu kendalanya adalah kemampuan sumber daya manusia cukup memadai. Salah satu kendalanya adalah kemampuan sumber daya manusia yang masih terbatas.
yang masih terbatas. De
Dengngan an adadananya ya pepermrmasaasalahlahan an tetersersebubut t mamaka ka didipeperlrlukukan an pepembmbuauatantan asetanilida dalam skala labor untuk menghasilkan asetanilida yang nantinya dapat asetanilida dalam skala labor untuk menghasilkan asetanilida yang nantinya dapat dil
dilanjanjutkutkan an ke ke skaskala la yanyang g leblebih ih besbesar. ar. SehSehingingga ga dapdapat at memmemenuenuhi hi kebkebutuutuhanhan produksi
produksi asetanilida asetanilida serta serta dapat dapat mengamati mengamati reaksi reaksi yang yang terjadi terjadi pada pada prosesproses pembuatan asetanilida.
pembuatan asetanilida.
1
1..22.. TTuujjuuaan n PPeerrccoobbaaaann Mem
Mempelpelajarajari i pempembutbutan an turturunaunan n amiamida da aroaromatmatik ik melmelalualui i reareaksi ksi amiaminana aromatik dengan turunan asam karboksilat, yaitu anhidrida asam.
BAB II BAB II
LANDASAN TEORI LANDASAN TEORI
2.1.
2.1. Pengertian Pengertian AsetanilidaAsetanilida
Asetanilida mempunyai nama lain yaitu N-phenylacetamide atau asetanil. Asetanilida mempunyai nama lain yaitu N-phenylacetamide atau asetanil. Asetanilida merupakan senyawa turunan asetil amina aromatis yang digolongkan Asetanilida merupakan senyawa turunan asetil amina aromatis yang digolongkan sebaga
sebagai i amida primer, dimana satu amida primer, dimana satu atom hidrogatom hidrogen en pada anilin digantikpada anilin digantikan an dengadengann satu gugus asetil.
satu gugus asetil. Asetan
Asetanilida berbentuk butiran berwarna putih ilida berbentuk butiran berwarna putih (krista(kristal) l) tidak larut tidak larut dalamdalam minyak parafin dan larut dalam air dengan bantuan kloral anhidrat. Asetanilida minyak parafin dan larut dalam air dengan bantuan kloral anhidrat. Asetanilida atau sering
atau sering disebudisebut t pheniphenilasetamlasetamida ida mempumempunyai rumus nyai rumus molekmolekul ul CC66HH55 NHCOCH NHCOCH33
dan berat molekul 135,16 g/gmol (Irdoni &
dan berat molekul 135,16 g/gmol (Irdoni & Nirwana, 2013).Nirwana, 2013).
Gambar 2.1
Gambar 2.1 Asetanilida (Pudjaatmaka, 1992)Asetanilida (Pudjaatmaka, 1992) 2.2.
2.2. Amida Amida PrimerPrimer Ami
Amida da terbterbententuk uk dardari i asam asam karkarbokboksilsilat, at, disdisebuebutt carboxamidescarboxamides, , adadalaalahh padatan
padatan kecuali kecuali untuk untuk yang yang paling paling sederhana, sederhana, formamida formamida yang yang dalam dalam bentuk bentuk cairan. Amida tidak menghantarkan listrik, memiliki titik didih tinggi, dan (ketika cairan. Amida tidak menghantarkan listrik, memiliki titik didih tinggi, dan (ketika cair) adalah pelarut yang baik. Tidak ada sumber-sumber alam praktis amida cair) adalah pelarut yang baik. Tidak ada sumber-sumber alam praktis amida kov
kovalen alen sedesederharhana, na, tettetapi api peppeptidtida a dan dan proproteitein n daldalam am sistsistem em kehkehiduidupan pan adaadalahlah rantai panjang (polim
rantai panjang (polimer) er) dengadengan n ikatan peptidikatan peptida. a. Urea adalah Urea adalah suatu amida dengansuatu amida dengan dua kelompok amino.
dua kelompok amino. Amida komersial, termasuk beberapa kovalen Amida komersial, termasuk beberapa kovalen digudigunakannakan sebagai pelarut, sedangkan yang lainnya adalah obat sulfa dan nilon. Kelas kedua, sebagai pelarut, sedangkan yang lainnya adalah obat sulfa dan nilon. Kelas kedua, ion amida (seperti garam), dibuat dengan memperlakukan sebuah amida kovalen, ion amida (seperti garam), dibuat dengan memperlakukan sebuah amida kovalen, amina atau amonia dengan reaktif logam (misalnya natrium) dan basa kuat.
amina atau amonia dengan reaktif logam (misalnya natrium) dan basa kuat. Seb
Sebuah uah turturunaunan n dardari i asam asam karkarbokboksilsilat at dendengan gan RCORCONHNH22 sebagasebagai i rumurumuss
umu
umum, m, di di manmana a R R adaadalah hidrolah hidrogen atau gen atau alkalkil il atau aril atau aril radradikaikal. l. AmiAmida da dibdibagiagi menjadi beberapa sub kelas, tergantung pada jumlah substituen pada nitrogen. menjadi beberapa sub kelas, tergantung pada jumlah substituen pada nitrogen.
Yang sederhana atau primer, yaitu amida dibentuk oleh penggantian gugus hidroksil karboksilat oleh gugus amino, NH2. Senyawa ini diberi nama dengan
menjatuhkan asam "-ic" atau "-OKI" dari nama asam karboksilat asal dan menggantinya dengan akhiran "amida"(Austin, 1984).
Gambar 2.2 Amida primer (Austin, 1984). 2.3. Sifat Asetanilida
2.3.1. Sifat Fisika Asetanilida
1. Rumus Molekul : C6H5 NHCOCH3
2. Berat Molekul : 135,16 g/gmol
3. Titik Didih Normal : 305oC (1 atm) ; 415,21oC (2,5 atm) 4. Berat Jenis : 1,21 gr/ml
5. Titik Kristalisasi : 113-60oC (1 atm)
6. Wujud : Padat
7. Warna : Putih
8. Bentuk : Butiran (kristal)
2.3.2. Sifat - sifat kimia
1. Pirolisa dari asetanilida menghasilkan N–diphenil urea, anilin, benzen dan asam hidrosianik.
2. Asetanilida merupakan bahan ringan yang stabil dibawah kondisi biasa, hidrolisa dengan alkali cair atau dengan larutan asam mineral cair dalam kedaan panas akan kembali ke bentuk semula.
3. Adisi sodium dalam larutan panas Asetanilida didalam xilena menghasilkan C6H5 NH2.
4. Bila dipanaskan dengan phospor pentasulfida menghasilkan thio Asetanilida dengan rumus molekul C6H5 NHC5CH3.
5. Bila di-treatment dengan HCl, asetanilida dalam larutan asam asetat menghasilkan 2 garam ( 2C6H5 NHCOCH3).
6. Dalam larutan yang mengandung pottasium bikarbonat menghasilkan N-bromo asetanilida
7. Nitrasi asetanilida dalam larutan asam asetat menghasilkan P-nitro asetanilida
( Amalia, 2012) 12.4. Proses Pembuatan Asetanilida dan kegunaannya
2.4.1.Pembuatan Asetanilida
Dalam proses pembuatan asetanilida bisa dilakukan dengan 4 cara yaitu sebagai berikut.
1. Pembuatan asetanilida dengan mereaksikan asam asetat anhidrat dengan anilin.
1 Larutan benzen dalam satu bagian anilin dan ¼ bagian asam asetat anhidrat kemudian direfluks dalam sebuah kolom yang dilengkapi jaket sampai tidak ada anilin yang tersisa. Campuran hasil reaksi disaring kemudian kristal dipisahkan dari air panasnya dengan pendinginan. Filtratnya di recycle kembali. Pemakaian asam asetat anhidrat dapat diganti dengan asetil klorida. Reaksi yang terjadi adalah sebagai berikut. 2C6H5 NH2 + (CH3CO)2O C6H5 NHCOCH3+ CH3COOH
32. Pembuatan asetanilida dengan mereaksikan anilin dengan asam asetat Metode ini merupakan metode awal yang masih digunakan karena lebih ekonomis. Anilin dan asam asetat berlebih direaksikan dalam sebuah tangki yang dilengkapi dengan pengaduk. Reaksi ini berlangsung selama 6 jam pada suhu 150oC - 160oC. Produk dalam keadaan panas
dikristalisasi dengan menggunakan kristalizer. Reaksi yang berlangsung adalah sebagai berikut.
3. Pembuatan asetanilida dengan mereaksikan anilin dengan ketene
Keten (gas) dicampur kedalam anilin di bawah kondisi yang tertentu akan menghasilkan asetanilida. Reaksi pembentukan dapat dilihat seperti di bawah ini.
C6H5 NH2 + H2C = C = O C6H5 NHCOCH3
4. Pembuatan asetanilida dengan mereaksikan asam thioasetat dengan anilin
Asam thioasetat direaksikan dengan anilin dalam keadaan dingin akan menghasilkan asetanilida dengan membebaskan H2S.
C6H5 NH2+ CH3COSH C6H5 NHCOCH3+ H2S
Dalam percobaan asetanilida ini digunakan proses antara asetat anhidrat dengan anilin. Pertimbangan dari pemilihan proses ini adalah reaksinya sederhana, tidak menggunakan katalis sehingga tidak memerlukan alat untuk regenerasi katalis dan tidak perlu menambah biaya yang digunakan untuk membeli katalis sehingga biaya produksi
lebih murah.
2.4.2. Mekanisme Reaksi Pembuatan Asetanilida
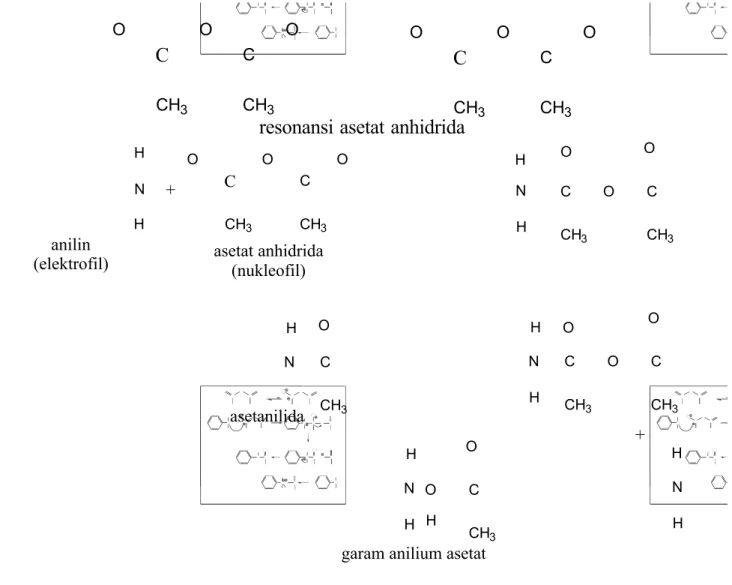
Secara garis besar reaksi antara anilin dengan asetat anhidrat akan menghasilkan asetanilida dan asam asetat. Sintesis asetanilida sebagai suatu amida merupakan suatu reaksi substitusi nukleofilik asil (addition/ elimination) di antara anilin. Amina bersifat sebagai nukleofil, dan gugus asil dari asetat anhidrat bersifat sebagai elektofil.
Gambar 2.3 Mekanisme Reaksi Asilasi (Synyster, 2006)
Sintesis asetanilida sebagai suatu amida adalah merupakan suatu reaksi Substitusi Nukleofilik (S N ) Asil (addition/elimination) diantara anilin. Amina
bersifat sebagai nukleofil, dan gugus Asil dari asetat anhidrida bersifat sebagai elektofil. Asetat anhidrida mengalami delokalisasi/resonansi membentuk struktur 2, dengan atom O memiliki muatan negatif (O-) dan atom C memiliki muatan
positif (C+) akibat dari ion H+ dari pelarutnya (asam asetat glasial ). C+
(karbokation) sekunder ini lebih stabil daripada karbokation primer, karena terdapat halangan sterik yang lebih kecil, sehingga pada stuktur ini tidak mengalami penataan ulang (rearrangement ). Pasangan elektron bebas dari atom nitrogen dari suatu amida tidak suka untuk melakukan delokalisasi/resonansi disekitar cincin aromatis. Suatu amida distabilkan oleh resonansi yang menyertakan pasangan elektron nonbonding dari atom Nitrogen dan yang kuat menarik elektron yang merupakan akibat dari adanya gugus karbonil. Elektron
C O O C O CH3 CH3 C O O C O CH3 CH3
resonansi asetat anhidrida
N H H + C O O C O CH3 CH3 N H H C O CH3 O C O CH3 N H H C O CH3 O C O CH3 N H C O CH3 + N H H O C O CH3 N H H H anilin (elektrofil) asetanilida
garam anilium asetat asetat anhidrida
dari oksigen yang kuat yang menarik gugus karbonil memiliki muatan parsial negatif.
Protonisasi dari suatu Amida terjadi pada Oksigen dibanding Nitrogen, amida ini tersubstitusi pada orto-para. Sehingga elektron bebas Nitrogen dari anilin ( sebagai nukleofil = pecinta nukleus ) lebih memilih menyerang karbokation sekunder dari asetat anhidrida yang bersifat sebagai elektrofil (pecinta elektron), dan menyebabkan perpindahan muatan dari atom C ke atom N yang kemudian N memiliki muatan + (positif), kemudian elektron bebas dari O membentuk ikatan rngkap dua dengan C bersamaan ketika atom C melepas sepasang elektron ke atom O untuk membentuk struktur yang paling stabil yaitu dengan terbentuklah asetanilida dan ion asetat. Ion asetat tersebut diserang oleh anilin yang lain dan terbentuklah ikatan ionik antara keduanya membentuk garam anilium asetat (Synyster, 2006).
2.5. Kegunaan Produk Asetanilida
Asetanilida memiliki beragam manfaat, baik sebagai bahan baku maupun bahan penunjang industri kimia, seperti :
a. Sebagai bahan baku pembuatan obat–obatan seperti parasetamol (keperluan analgesik dan antipretik), lidokain (keperluan anestesi), obat sulfa dan penisilin
b. Bahan pembantu dalam industri cat dan karet c. Bahan intermediet pada sulfon dan asetilklorida d. Sebagai inhibitor dalam industri peroksida
e. Sebagai stabilizer pada selulosa ester varnis seperti tinner
f. Sebagai pewarna buatan dan sebagai intermediet pada pembuatan pewarna buatan
2.6. Karakteristik Bahan Baku Pembuatan Asetanilida 2.6.1. Anilin
a. Sifat – sifat fisis:
1. Rumus Molekul : C6H5 NH2
2. Berat Jenis : 1,024 gr/cm3
3. Berat Molekul : 93,12 g/gmol 4. Bentuk : Butiran (kristal) 5. Titik Didih Normal : 184,4oC
6. Tekanan Kritis : 54,4 atm 7. Suhu Kritis : 426oC
8. Wujud : Cair
9. Warna : Jernih
b. Sifat – sifat kimia:
1. Halogenasi senyawa anilin dengan brom dalam larutan sangat encer menghasilkan endapan 2,4,6-tribromo anilin
2. Pemanasan anilin hipoklorid dengan senyawa anilin sedikit berlebih pada tekanan sampai 6 atm menghasilkan senyawa diphenylamine 3. Hidrogenasi katalitik pada fase cair pada suhu 135oC - 170oC dan
tekanan 50-500 atm menghasilkan 80% cyclohexamine (C6H11 NH2).
Sedangkan hidrogenasi anilin pada fase uap dengan menggunakan katalis nikel menghasilkan 95% cyclohexamine.
4. Nitrasi anilin dengan asam nitrat pada suhu -20oC menghasilkan mononitroanilin dan nitrasi anilin dengan nitrogen oksida cair pada suhu 0oC menghasilkan 2,4-dinitrophenol.
(Amalia, 2012) 2.6.2.Asam Asetat
a. Sifat - sifat fisis:
1. Rumus Molekul : CH3COOH
2. Berat Jenis : 1,08 gr/cm3
4. Panas Pembakaran : 208,34 kkal/mol 5. Panas Penguapan : 96,8 kal/gr (118oC) 6. Titik Didih Normal : 117,9 oC 7. Titik Leleh : 16,7oC
8. Tekanan Kritis : 57,2 atm 9. Suhu Kritis : 321,6 oC
10. Wujud : Cair
11. Warna : Jernih
b. Sifat – sifat kimia:
1. Dengan alkohol menghasilkan proses esterifikasi R-OH + CH3COOH CH3COOR + H2O
2. Pembentukan garam keasaman
2CH3COOH + 2Zn (CH3COO)2ZN2+ 2H+
3. Konversi ke klorida-klorida asam
CH3COOH + PCl3 3CH3COOCl +H3PO3
4. Pembentukan ester
CH3COOH + CH3CH2OH + H+ CH3COOC2H5+ H2O
5. Reaksi dari halide dengan ammoniak
CH3COOHCl + ClCH2COOHNH3 NH2CH2COONH2+ NH2CH2COOH
(Amalia, 2012)
2.7. Reaksi Asilasi dan Asetilasi
Sebuah asil merupakan alkil yang terikat pada ikatan rangkap oksigen dan karbon. Jika R mewakili alkil, maka asil mempunyai formula.
Gambar 2.4 Gugus Asil (Pudjaatmaka, 1992).
Asil yang umum dipakai adalah CH3CO-. Ini disebut sebagai etanoil.
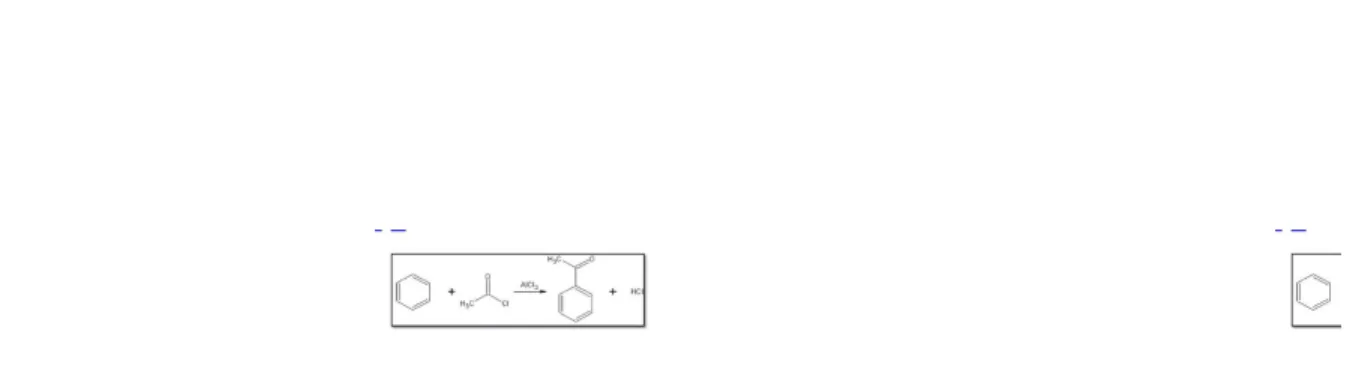
Dalam kimia, asilasi (secara formal, namun jarang digunakan: alkanoilasi) adalah proses adisi gugus asil ke sebuah senyawa. Senyawa yang menyediakan gugus asil disebut sebagai agen pengasil.Asil halida sering digunakan sebagai agen pengasil karena dapat membentuk elektrofil yang kuat ketika diberikan beberapa logam katalis. Sebagai contoh pada asilasi Friedel-Crafts menggunakan asetil klorida, CH3COCl, sebagai agen dan aluminium klorida (AlCl3) sebagai katalis untuk adisi
gugus asetil ke benzena:
Gambar 2.5 Contoh Reaksi Asilasi (Pudjaatmaka, 1992)
Asil halida dan anhidrida asam karboksilat juga sering digunakan sebagai agen pengasil untuk mengasilasi amina menjadi amida atau mengasilasi alkohol menjadi ester . Dalam hal ini, amina dan alkohol adalah nukleofil; mekanismenya adalah adisi-eliminasi nukleofilik . Asam suksinat juga umumnya digunakan pada beberapa tipe asilasi yang secara khusus disebut suksinasi. Oversuksinasi terjadi ketika lebih dari satu suksinat diadisi ke sebuah senyawa tunggal. Contoh industri asilasi adalah sintesis aspirin, di mana asam salisilat diasilasi oleh asetat anhidrat.
Reaksi asetilasi merupakan suatu reaksi memasukkan gugus asetil kedalam suatu subtrat yang sesuai.
Gugus asetil adalah R – C – OO’ (dimana R = alkil atau aril). Asam Salisilat merupakan senyawa turunan Asam benzoat yang dikenal juga dengan nama Asam orto-hidroksi benzoat. Perbedaan Reaksi Asilasi dan Asetilasi adalah pada senyawa yang disutitusi pada senyawa,pada reaksi asilasi yang di substitusikan adalah gugus asil, sedangkan pada asetilasi yang direaksikan adalah gugus asetil (Pudjaatmaka, 1992).
a. Rekristalisasi
Rekristalisasi merupakan proses pengkristalan kembali, yang bertujuan mendapatkan kristal yang lebih murni dan bentuk kristalnya lebih bagus. Syarat untuk rekristalisasi adalah menggunakan pelarut, dimana pelarut yang dipakai harus dapat melarutkan kristal tersebut. Terdapat beberapa definisi tentang rekristalisasi menurut Williamson (1999), yaitu sebagai berikut:
a. Rekristalisasi adalah suatu proses dimana butir logam yang terdeformasi
digantikan oleh butiran baru yang tidak terdeformasi yang intinya tumbuh sampai butiran asli termasuk didalamnya.
b. Perubahan struktur kristal akibat pemanasan pada suhu kritis.
c. Terbentuknya struktur butiran baru melalui tumbuhnya inti dengan pemanasan. Besarnya suhu rekristalisasi adalah setengah sampai dengan
sepertiga dari suhu logam.
Pelarut adalah suatu zat yang mengandung beberapa bahan (material) yang digunakan untuk melarutkan bahan (material) lainnya. Pelarut, terutama pelarut organik mempunyai potensi bahaya terhadap kesehatan, produktifitas, dan efisiensi di lingkungan kerja atau industri. Menurut Fessenden and Fessenden (1982) pelarut diklasifikasikan menjadi dua yaitu :
1. Pelarut aqueous (Pelarut Air)
Dasar dari pelarut jenis ini adalah air. Sebagai contoh larutan asam, larutan basa dan deterjen yang dilarutkan di dalam air. Umumnya sistem pelarut air memiliki tekanan uap yang rendah pada suhu kamar sehingga bahaya potensial oleh penghirupan dan sistemik toxicity tidak besar.
Contoh dari pelarut air adalah asam-asam organik biasa seperti hidrogen halida (HF, HCl, HI, dan HBr), asam-asam oksigen seperti nitrat/HNO3, fosfat/H3PO4, dan sulfat/H2SO4, dan lain-lain seperti hidrogen
sulfida/H2S, dan hidrogen sianida/HCN.
Pengaruh pelarut ini bagi kesehatan berubah-ubah sesuai dengan konsentrasinya. Hal yang sering terjadi yaitu kontak terhadap jaringan tubuh termasuk iritasi (mucous membrane) selaput lendir atau saluran pernapasan. Seperti iritasi yang disebabkan oleh oksidasi HCl dan dehidrasi oleh H2SO4, HCN, dan H2S. Asam-asam tersebut sangat beracun
dengan akibat yang berbeda dibanding dengan asam lainnya. Asam tersebut dapat membentuk senyawa kompleks dengan logam yang ada dalam enzyme (Cytochrome) yang dapat mencegah terjadinya metabolisme oksigen dalam sel.
2. Pelarut Non Aqueous (Pelarut Organik)
Pelarut organik sangat berbahaya bagi kesehatan karena pelarut organik adalah pelarut yang mengandung bahan kimia yang dapat menguap dengan cepat di udara dan menghasilkan kadar uap yang tinggi pada keadaan tertentu. Bahaya terhadap kesehatan yang ditimbulkan oleh pelarut organik tidak hanya ditentukan oleh sifat-sifatnya yang khusus atau karakteristik pelarut, namun juga ditentukan oleh cara-cara penggunaannya. Pelarut organik mempunyai sifat yang sebagian besarnya dapat menyebabkan hilangnya kesadaran (pengaruh narkosis).Untuk mengidentifikasi potensi bahaya suatu senyawa, diperlukan data karakteristik sifat fisis dan kimiawi senyawa tersebut, diantaranya TVL, VHR, Auto Ignition Temperature, Minimum Ignition Energy, dan Flammable Limit (Sulsilo, 2006).
. Syarat-syarat pelarut untuk rekristalisasi antara lain :
1. Mempunyai kekuatan yang tinggi untuk melarutkan pada temperatur tinggi dan mempunyai kekuatan rendah pada temperatur rendah.
2. Pelarut tidak menimbulkan reaksi terhadap padatan organik yang dimurnikan.
3. Mudah dipisahkan dari kristal yang terbentuk dengan cara penguapan.
4. Kelarutan pengotor ke dalam pelarut sangat kecil terutama pada temperatur tinggi.
5. Murah dan tidak berbahaya. (Kirk dan Othmer, 1981)
Menurut Fessenden and Fessenden (1982) ukuran kristal yang terbentuk selama proses rekristalisasi tergantung pada dua faktor penting yaitu :
1. Laju pembentukan inti (nukleasi) dapat dinyatakan dengan jumlah inti yang terbentuk dalam satuan waktu. Jika laju inti tinggi, maka terbentuk banyak kristal tetapi tidak satupun kristal ini menjadi besar. Laju ini
tergantung pada daerah lewat jenuh larutan.
2. Laju pertumbuhan kristal merupakan factor lainnya yang mempengaruhi ukuran kristal yang terbentuk selama pengendapan berlangsung. Jika laju ini tinggi, kristal yang terbentuk besar. Laju ini tergantung pada daerah lewat jenuh larutan.
BAB III
METODOLOGI PERCOBAAN
3.1. Alat yang digunakan1. Corong
2. Erlenmeyer
3. Gelas piala
4. Gelas ukur
5. Kertas saring
6. Labu didih dasar datar
7. Lemari asam
8. Oven
9. Pipet tetes
10. Satu set alat pompa vakum
11. Timbangan analitik
12. Waterbatch
13. Tisu
15. Timbangan analitik
16. Batang pengaduk 3.2. Bahan yang digunakan
1. Anilin
2. Asetat anhidrat 3. Asam asetat glasial 4. Aquades
5. Etanol 6. Tisu
7. Aluminium Foil 3.3. Prosedur percobaan
1. Asam asetat glasial sebanyak 5 ml dimasukkan ke dalam labu didih dasar datar.
2. Kemudian ke dalam labu didih dasar datar tersebut ditambahkan 5 ml anilin di ikuti dengan penambahan asetat anhidrat sebanyak 5 ml di dalam lemari asam dengan hati-hati karena reaksi eksoterm yang terjadi.
3. Campuran tersebut di aduk sempurna dan didiamkan pada suhu kamar selama 5 menit.
4. Selanjutnya aquades sebanyak 75 ml di tambahkan ke dalam labu didih dasar datar tersebut, sehingga terbentuk kristal asetanilida.
5. Kertas saring yang akan di gunakan di timbang terlebih dahulu.
6. Selanjutnya apabila pembentukan kristal asetanilida telah sempurna, di saring dengan pompa vakum.
7. Kristal asetanilida kemudian dikeringkan pada udara bebas.
9. Selanjutnya kristal tersebut direkristalisasi dengan 25 ml etanol dan 25 air yang telah dihangatkan.
10. Kemudian setelah kristal asetanilida larut, pengotor yang tertinggal di dasar labu didih dasar datar dibuang.
11. Di dinginkan dalam batu es selama 2 jam.
12. Apabila kristal telah terbentuk kembali kemudian di saring kembali dengan pompa vakum, lalu dikeringkan di dalam oven.
13. Kristal yang di peroleh di timbang dan dihitung kadar air serta rendemennya. 3.4 Rangkaian Alat 4 5 6 7 Pompa Vakum Corong Biuchner 1 2 3
(A) (B)
Gambar 3.1 Rangkaian alat percobaaan asetanilida (A) Pemanasan etanol dan aquades dan (B) Pengeringan kristal di dalam pompa
Keterangan :
1. Statif
2. Termometer
3. Penangas Air
4. Pompa Penghisap/Vakum
5. Selang Pembuangan Gas
6. Corong Buchner
3.1 Blok Diagram
Asetat Anhidrat 5 ml +
Anilin 5 ml +
Asam Asetat Glasial 3 ml
Aquades 75 ml Kristal Asetanilida Pengotor Aquades 25 ml + air panas Etanol 50 ml 25 ml
Aquades dan etanol
Air Pencampuran Pengenceran Penyaringan Rekristalisasi Pendinginan Penyaringan Kembali Rekristalisasi Di ovenkan Pemisahan Dipanaskan
Asetanilida murni 1.42 gram
BAB IV
HASIL DAN PEMBAHASAN
4.1 Proses Pencampuran
Pada proses pencampuran ini, kita mencampurakan 5 ml asetat anhidrat, 5 ml anilin, dan 3 ml asam asetat Glasial yang dilakukan di dalam lemari asam. Setelah pencampuran, lalu di dinginkan di dalam water batch selama 5 menit menghasilkan warna larutan merah tua dengan sedikit endapan berwarna putih-kecoklatan. Reaksi antara anilin dengan asetat anhidrida merupakan reaksi eksotermis, karena reaksi ini menghasilkan panas, dan dilepas ke lingkungan. Campuran antar reaktan tersebut berwarna kuning kecolatan dan menghasilkan panas.
4.2 Proses Pengenceran
Setelah 5 menit, lalu ditambahkan dengan 75 ml akuades menghasilkan banyak endapan berwarna putih yang merupakan Asetanilida yang masih belum murni. Pengenceran juga bertujuan untuk memisahkan pengotor yang ada agar yang tidak ada pengotornya dapat langsung disaring ke pompa vakum. Dan pengotornya ditambahkan dengan air panas dengan suhu 88oC.
4.3 Proses Penyaringan
Sebelum masuk ke proses penyaringan, jika ada pengotornya, pisahkan terlebih dahulu ke dalam erlemeyer. Pada proses penyaringan ini, kita saring dengan menggunakan pompa vakum yang bertujuan untuk mendapatkan endapannya saja, tetapi kita harus menimbang terlebih dahulu kertas saringnya
yaitu 1,89 gram. Maka didapat berat asetanilida hasil penyaringan pertama adalah sebesar 3.35 gram. Berat ini dicatat sebagai berat reaktannya.
4.4 Rekristalisasi
Setelah didapat endapan pertama hasil penyaringan, kemudian kita rekristalisasi agar asetanilida yang di dapat lebih murni yaitu dengan cara memanaskan campuran akuades dan etanol masing 25 ml pada suhu 700C. Setelah
suhu pelarut sudah 700C, langsung masukkan endapan tadi kedalamnya, aduk
sempurna agar semuanya larut. Kita memakai etanol karena telah memenuhi syarat – syarat pelarut untuk rekristalisasi antara lain menurut (Rahman et all, 2011) :
1. Mempunyai kekuatan yang tinggi untuk melarutkan pada temperature tinggi dan mempunyai kekuatan rendah pada temperature rendah.
2. Etanol tidak menimbulkan reaksi terhadap padatan organik yang dimurnikan.
3. Mudah dipisahkan dari kristal dengan cara penguapan.
4. Kelarutan pengotor ke dalam etanol sangat kecil terutama pada temperature tinggi.
5. Murah dan tidak berbahaya.
4.5 Pendinginan
Karena endapan larut dengan pelarut, kita dinginkan dengan batu es selama 1 jam agar asetanilidanya mengendap dan membentuk suatu kristal berwarna putih. Kita menggunakan batu es agar diperoleh kristal asetanilidanya. Jika tidak
menggunakan batu es, maka proses pendinginan akan berlangsung lama.
4.6 Penyaringan Kembali
Setelah didinginkan selama 1 jam, kita saring lagi dengan menggunakan pompa vakum, tetapi terlebih dahulu kita timbang kertas saringnya. Setelah
penyaringan, didapat asetanilida yang murni, tetapi masih ada kadar air di dalamnya. Untuk itu dilakukan pemanasan dengan menggunakan oven.
4.7 Di oven
Karena masih terdapatnya kadar air di endapan, lalu kita oven kristal tersebut berulang-ulang sampai berat asetanilida konstan, setelah itu barulah kita dapatkan kristal asetanilida yang murni, yaitu melalui percobaan sebesar 1,42 gram. Setelah itu kita hitung rendemen dan kadar airnya dan didapat rendemen sebesar 42.3 % dan kadar air 49.4 %.
4.8. Data Pengamatan
4.8.1. Pembuatan Asetanilida
Tabel 4.1Komposisi Bahan Baku dan Asetanilida yang didapatkan.
No. Bahan Komposisi
1 AsetatAnhidrat 5 ml
2 Anilin 5 ml
3 Asam Asetat Glasial 3 ml
4 Aquadest 75ml
4.8.2 Rekristalisasi
Tabel 4.2Komposisi Bahan untuk proses Rekristalisasi.
No. Bahan Komposisi Treatment 1 1 Etanolpanas 25ml 2 Aquadestpanas 25ml 3 EsBatu 3 bungkus
Asetanilida yang dihasilkan 2.81 gram
4.8.3. Penghilangan Kadar Air
Tabel 4.3. Perbedaan Berat Hasil pengeringan
No. Perlakuan Berat Asetanilida 1 1 1.97 2 2 1.42 KadarAir 49.4% 4.8.4. Pengamatan
Tabel 4.4Hasil Pengamatan sewaktu percobaan
No Perlakuan Pengamatan
1
5 ml anilin + 5 ml asetat anhidrida + 3 ml asam asetat glasial dalam labu didih dasar datar, yang dilakukan di
dalam lemari asam. Larutan dibiarkan pada suhu kamar selama 5
menit sambil diaduk dengan sempurna.
Larutan berwarna coklat, dan terdapat sedikit endapan.
2 Larutan + 75 ml aquadest.
Larutan berwarna putih kecoklatan dan terbentuk asetanilida berupa Kristal, dan
pengotor yang menggumpal.
3
Kristal disaring dengan vakum (kertas saring ditimbang terlebih dahulu), lalu dikeringkan di udara
bebas, dan ditimbang berat yang diperoleh.
Diperoleh kristal asetanilida dengan berat 3.35 gram.
4
Rekristalisasi : -asetanilida yang didapat
ditambahkan campuran 25 ml alcohol dan aquadest hangat
-Pengotor ditambahkan 20 ml aquadest hangat
-kristal asetanilida larut -terbentuk sedikit kristal
asetanilida
5
Kedua larutan rekristalisasi sisinginkan dengan batu es selama 2
jam
Kristal kembali terbentuk.
6 Kristal yang terbentuk disaring lagi dengan saringan vakum.
Didapat berat kristal asetanilida 2.81 gram.
7
Dilakukan penghilangan kadar air dengan cara pengovenan 2x10
menitpada suhu 107oC
Berat asetanilida 2.81 gram Pengovenan 1 : 1.97 Pengovenan 2 : 1.42
8 Timbang hasil akhir dan hitung kadar air serta rendement.
Berat akhir = 1.42 Kadar air = 49.4% Rendement = 42.3%
BAB V
KESIMPULAN DAN SARAN
5.1 Kesimpulan
1. Asetanilida dapat dibuat dari reaksi antara anilin dengan asetat anhidrat.
2. Berat asetanilida yang diperoleh dari percobaan ini yaitu 1.42 gram, dengan rendemen sebesar 42.3%.
5.2 Saran
1. Proses rekristalisasi perlu dilakukan berulang-ulang apabila kristal yang didapat belum murni.
2. Proses rekristalisasi perlu dilakukan berulang-ulang apabila kristal yang didapat belum murni.
3. Reaktan berlebih yang digunakan jangan terlalu besar perbedaannya dengan reaktan lain, agar perbedaan berat asetanilida yang didapat tidak terlalu besar. 4. Sebaiknya sebelum rekristalisasi, asetanilida yang sudah disaring dengan pompa
DAFTAR PUSTAKA
Amalia, Rizki, 2012, Asetanilida, Laporan Kimia Organik, Universitas Surabaya. Armico, Wien, 2010, Lapoan Resmi-Asetanilida, http://www.scribd.com. Diakses
tanggal 23 April 2013
Austin, George T, 1984, Shreve’s Chemical Process Industries, 5th ed. McGraw-Hill Book Co, Singapura
Fessenden, Ralph J dan Joan S, Fessenden, 1982, Kimia Organik , Jakarta , Erlangga.
Fessenden, Ralph J dan Joan S. Fessenden, 1990, Kimia Organik Edisi 1, Terjemahan Hadyana Pujaatmadja, Jakarta , Erlangga.
Irdoni dan Nirwana, 2012, Modul Kimia Organik , Pekanbaru, Fakultas Teknik Universitas Riau.
Kirk dan Othmer, 1981, Rekristalisasi, http://chemistry.org/materi_kimia/ rekristalisasi/.com, 23 April 2013
Sulsilo, Cahyo Condro, 2006, Pencegahan pencemaran lingkungan di pertamina UP IV Cilacap, http://eprmts.undip.ac.id/16890/I.cahyo-condro-susilo.pdf, 21 April 2013
Synyster, 2006, Sintesis Asetanilida, http://www.scribd.com/doc/54194580/ LAPORAN-RESMI - ASETANILIDA , 21 April 2013
Williamson, 1999. Macroscale and Microscale Organic Experiments. 3rd Edition, Boston
LAMPIRAN A
DOKUMENTASI PERCOBAAN
Gambar A.2 Pencampuran Bahan Baku Asetanilida
Gambar A.3 Penambahan Aquades pada Bahan Baku
Gambar A.4. Campuran Setalah Direaksikan selama 5 menit
Gambar A.5. Kristal Asetanilida Setelah Penyaringan
Gambar A.6.Pemanasan Etanol dan Aquadesh
Gambar A.7. Proses Pendinginan dalam Rekristalisasi
LAMPIRAN B
PERHITUNGAN
1. Pembuatan Asetanilidaa. Berat Kertas saring : 1.89 gram b. Berat Kertas saring + Asetanilida : 5.24 gram
c. Netto Asetanilida : 5.24 – 1.89 = 3.35 gram
2. Rekristalisasi
Pelarutan 3.35 gram Asetanilida dengan 25 ml etanol hangat dan 25 ml aquadest hangat.
Gambar A.9 Kristal Asetanilida Setelah Rekristalisasi
Gambar A.10. Kristal Asetanilida Setelah Pengovenan
Gambar A.8. Penyaringan Dengan Corong Buchner
a. Berat Kertas saring : 1.94 gram
b. Berat Kertas saring + Asetanilida : 4.75 gram
c. Netto Asetanilida : 4.75– 1.94 = 2.81 gram
3. Kadar Air
Kadar air = 2.81-1.42 gram 2.81 gram Kadar air = 49.4 % 4. Rendemen Rendemen = X 100 % rendemen = X 100% rendemen = 42.3 % x 100 % x 100 %