LAPORAN PRAKTIKUM SATUAN PROSES 2 SEMESTER GANJIL TAHUN AJARAN 2015/2016
Modul : Sulfonasi
Pembimbing : Rintis Manfaati, ST., MT
Oleh : Kelompok : VII
Nama : 1. Nur Afinayani Linawati (141424024) 2. Rd Ahmad Fadhilah (141424025) 3. Rizka Rismayani Setiawan (141424027) Kelas : 2A- TKPB
PROGRAM STUDI DIPLOMA IV TEKNIK KIMIA PRODUKSI BERSIH JURUSAN TEKNIK KIMIA
POLITEKNIK NEGERI BANDUNG 2016
Tanggal Praktikum : 22 Desember 2015 Tanggal Penyerahan : 5 Januari 2016
BAB I PENDAHULUAN 1.1 Latar Belakang
Sulfonates biasanya digunakan dalam bentuk asam atau garamnya. Industry yang mengaplikasikan proses sulfonasi cukup luas terutama industru kertas, dengan produk utama yang dihasilkan adalah lignin sulfonates. Detergent (dodecyl benzene sulfonate) dihasilkan dengan cara menggabungkan gugus aktif –SO2OH- sebagai kutub polar hidrofilik dengan senyawa organic rantai panjang sebagai kutub non polar hidrofobik. Toluenesulfonic acid digunakan sebagai katalis, phenolsulfonic acid digunakan sebagai bahan aditif pada proses electroplating.
Aromatic sulfonil chlorides –RSO2Cl- digunakan sebagai bahan baku pembuatan sulfoamides seperti obat-obatan sulfa, zat pewarna tekstil, zat penyamak kulit, plasticizers, pemanis buatan sakarin dan sulfonate ester (insektisida). Herbisida, pemanis buatan dan antikoagulan darah merupakan jenis sulfamates.
1.2 Tujuan Percobaan
1. Memahami karakteristik reaksi sulfonasi naftalen, kondisi operasi, rangkaian peralatan proses dan penanganannya yang tepat.
2. Melakukan tahapan-tahapan proses sulfonasi.
3. Melakukan tahapan-tahapan proses purifikasi dan pemurnian produk sulfonasi yang tepat.
BAB II DASAR TEORI
Bahan baku yang biasanya digunakan pada proses sulfonasi adalah senyawa aromatik seperti benzene dan turunannya, naftalen dan turunannya, antraquinon dan turunannya, senyawa alifatik dan turunannya seperti alkohol, eter. Agents yang digunakan untuk proses sulfonasi adalah:
Grup sulfur trioksida:
Sulfur trioksida (SO3), oleum, dan concentrated sulfuric acid (SO3 + water)
Chlorosulfonic acid (SO3 + HCl)
Sulfur trioksida yang digabungkan dengan senyawa organik
SO3-oleum-concentrated sulfuric acid memiliki kedekatan sifat fisik dan bisa saling menggantikan. Grup sulfur trioksida (terutama oleum) merupakan agent utama yang digunakan untuk menghasilkan sulfonates secara langsung dengan bahan baku aromatik.
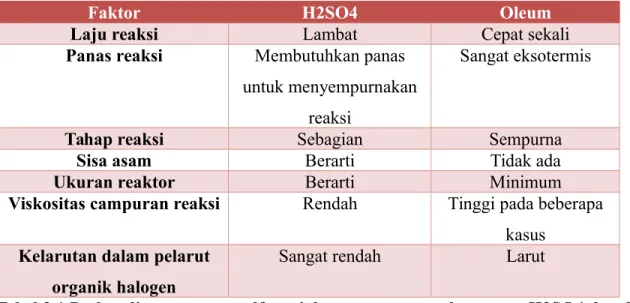
SO3 memiliki daya afinitas yang tinggi terhadap air. Bentuk hidrat dari SO3 adalah oleum dan concentrated sulfuric acid. Monohidrat SO3.H2O adlah 100% H2SO4; dihidrat SO3.2H2O atau 84.5% H2SO4; dan pyrosulfuric acid 2SO3.H2O atau 45% oleum. SO3 merupakan bagian yang reaktif dalam oleum dan concentrated sulfuric acid (H2SO4 92-98%). Hidrat dari SO3 pada suhu rendah berbentuk kristal, namun dengan kenaikan suhu akan semakin tidak stabil dan akhirnya pada suhu 450°C akan terurai sempurna menjadi SO3 dan H2O. Perbandingan proses sulfonasi dengan menggunakan agent H2SO4 dan oleum ditunjukkan pada Tabel. 2.1
Faktor H2SO4 Oleum
Laju reaksi Lambat Cepat sekali
Panas reaksi Membutuhkan panas untuk menyempurnakan
reaksi
Sangat eksotermis
Tahap reaksi Sebagian Sempurna
Sisa asam Berarti Tidak ada
Ukuran reaktor Berarti Minimum
Viskositas campuran reaksi Rendah Tinggi pada beberapa kasus
Kelarutan dalam pelarut organik halogen
Sangat rendah Larut
Tabel 2.1 Perbandingan proses sulfonasi dengan menggunakan agent H2SO4 dan Oleum Persamaan reaksi sulfonasi senyawa aromatik RH keseluruhan jika menggunakan agent oleum adalah:
RH + SO3 H2SO4 RSO3H + H2SO4 Kinetika reaksi sulfonasi jika menggunakan agent oleum adalah:
Rate = k2 [ArH][SO3]
Kecepatann reaksi berbanding lurus dengan konsentrasi bahan baku (ArH) dan konsentrasi SO3. Sedangkan persamaan reaksi sulfonasi senyawa aromatik jika menggunakan agent concentrated sulfuric acid (H2SO4 pekat) adalah:
RH + H2SO4 RSO3H + H2O
Kinetika reaksi sulfonasi pada pemakaian agent concentrated sulfuric acid (H2SO4 pekat) adalah:
Rate = k2 [ArH]/[w]²
Karena dihasilkan H2O di akhir proses maka kecepatan reaksi berbanding terbalik dengan kuadrat konsentrasi air, sehingga kecepatan reaksi akan berkurang secara berarti.
Sulfonasi senyawa hidrokarbon aromatik merupakan salah satu jenis sulfonasi yang paling penting. Pada proses sulfonasi senyawa aromatik dengan menggunakan sulfonating agent concentrated H2SO4 dapat merupakan reaksi endoterm. Sulfonasi anilin, berlangsung pada temperatur 180-195°C sehingga akan sulit jika diaplikasikan pada skala laboratorium, sementara untuk proses sulfonasi naftalen menggunakan concentrated H2SO4 dapat berlangsung pada temperatur kurang dari 50°C dengan tekanan 1 atm. Naftalen merupakan salah satu senyawa yang cukup aman digunakan jika dibandingkan senyawa hidrokarbon aromatik lainnya. Oleh karena itu, reaksi sulfonasi naftalen merupakan reaksi sulfonasi yang cocok dan aman diterapkan di laboratorium Satuan Proses Teknik Kimia Politeknik Negeri Bandung.
Reaksi sulfonasi naftalen menjadi α-naftalen sulfonat dengan menggunakan sulfonating agent concentrated H2SO4 merupakan reaksi substitusi elektrofilik yang berlangsung pada temperatur operasi yang lebih rendah dibandingkan dengan reaksi sulfonasi naftalen menjadi β-naftalen sulfonat (Groggins, 1958). Struktur α-naftalen dan β-naftalen sulfonat disajikan pada Gambar. 2.1
Gambar 2.1 (a) α-naftalen sulfonat dan (b) β-naftalen sulfonat Mekanisme Reaksi Sulfonasi Naftalena
Mekanisme reaksi sulfonasi dengan sulfonating agent concentrated H2SO4 diawali dengan pembentukan elektrofilik (SO3). Pada tahap ini terjadi penguraian asam sulfat.
2H2SO4 → SO3 + H3O+ + HSO4
-Pada tahap selanjutnya, terjadi proses penyerangan senyawa naftalen oleh elektofilik yang terbentuk (Solomons, 1978).
Reaksi secara keseluruhan :
C10H8 + H2SO4 → C10H8SO3 + H2O
Faktor-faktor yang mempengaruhi Sulfonasi Faktor-faktor yang mempengaruhi proses sulfonasi:
1. Konsentrasi SO3 pada Sulfonating Agent dalam reaktor
Proses sulfonasi dapat berlangsung dengan baik tergantung pada konsentrasi SO3 dalam Sulfonating Agent H2SO4 akan menghasilkan air sebagai produk sampingnya. Terbentuknya air selama proses, akan menurunkan konsentrasi asam yang akan menyebabkn kecepatan reaksi sulfonasi menurun, saat kandungan SO3 habis, reaksi akan terhenti.
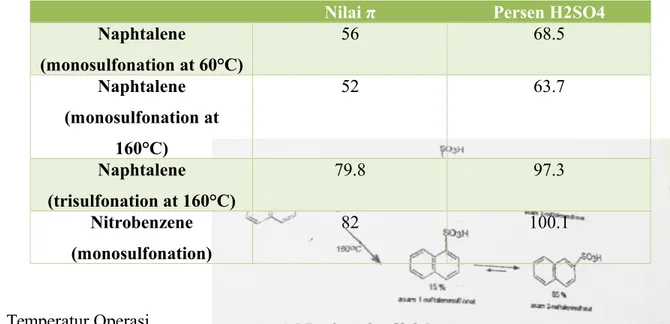
Konsentrasi SO3 minimum yang diperlukan agar reaksi sulfonasi tetap berlangsung didefinisikan sebagai π. Persamaan yang menyatakan kebutuhan asam untuk mensulfonasi 1 mol senyawa organik diuraikan pada persamaan 1.
Xα 100=80+( X−80) π 100 atau X =80 100−π α−π . . . . (1)
Dengan X adalah berat asam dalam gram dan α adalah banyaknya SO3 dalam H2SO4 dalam persen. Setiap senyawa organik memiliki nilai π yang berbeda-beda seperti ditunjukkan Tabel 2.2. Semakin mudah suatu bahan organik disulfonasi semakin rendah nilai π nya (Groggins, 1958).
Tabel 2.2 Nilai π beberapa senyawa organik
Nilai π Persen H2SO4
Naphtalene (monosulfonation at 60°C) 56 68.5 Naphtalene (monosulfonation at 160°C) 52 63.7 Naphtalene (trisulfonation at 160°C) 79.8 97.3 Nitrobenzene (monosulfonation) 82 100.1 2. Temperatur Operasi
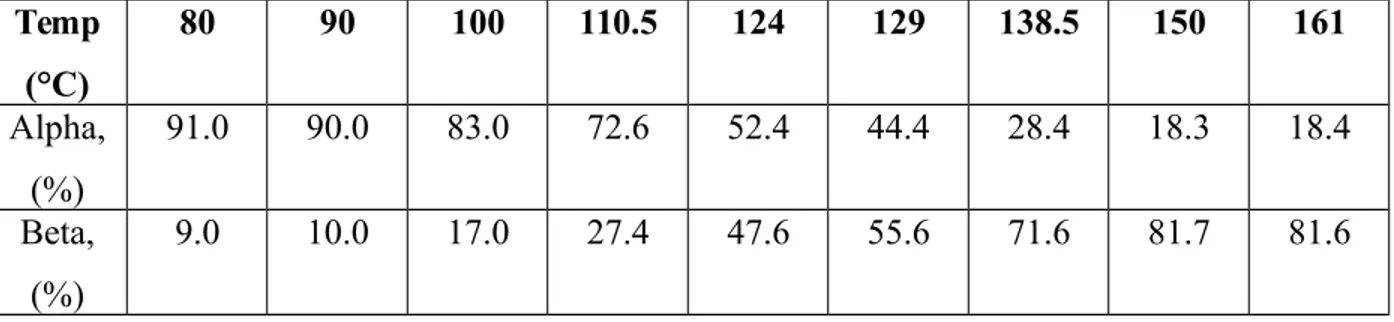
Proses sulfonasi naftalen membentuk 2 jenis naftalen sulfonat, yaitu α dan β-naftalen sulfonat. Kedua jenis naftalen sulfonat tersebut berbeda pada penempatan gugus –SO3H pada naftalennya. Pengaruh temperatur terhadap pembentukan naftalen sulfonat dan distribusi pembentukan α dan β-naftalen sulfonat disajikan pada Gambar 2.2 dan Tabel 2.3
Tabel 2.2 Pengaruh Temperatur terhadap Sulfonasi Naftalen (Groggins, 1958) Temp (°C) 80 90 100 110.5 124 129 138.5 150 161 Alpha, (%) 91.0 90.0 83.0 72.6 52.4 44.4 28.4 18.3 18.4 Beta, (%) 9.0 10.0 17.0 27.4 47.6 55.6 71.6 81.7 81.6
Pada temperatur rendah, reaksi dikendalikan oleh faktor kinetika atau faktor cepat lambatnya reaksi. α-naftalen sulfonat akan lebih cepat terbentuk pada kondisi ini karena reaksi berlangsung pada jalur energi aktivasi yang lebih rendah. Reaksi yang berlangsung pada temperatur yang lebih tinggi akan dikendalikan oleh faktor termodinamika atau faktor kestabilan produk. Pada kondisi ini reaksi akan menghasilkan β-naftalen sulfonat yang lebih stabil meskipun memiliki energi aktivasi yang lebih tinggi (Weininger, 1984).
BAB III PERCOBAAN 3.1 Alat dan Bahan
Alat
Nama Alat Jumlah Nama Alat Jumlah
Gelas kimia 1000 ml 2 buah Waterbatch 1 buah Erlenmeyer 250 ml 2 buah Erlenmeyer 50 ml 3 buah
Hot plate 1 buah Bola hisap 1 buah
Pipet ukur 25 ml 1 buah Kaca arloji 1 buah Pipet ukur 10 ml 1 buah Kertas saring 2 lembar Pipet ukur 1 ml 1 buah Thermometer 1 buah Stirrer magnetic 1 buah Pipet tetes 2 buah Statif dan klem 2 pasang Botol semprot 1 buah Corong Buchner 1 buah Gelas ukur 50 ml 1 buah Selang silicon 1 buah Digital melting point 1 unit Batang pengaduk 1 buah Neraca analitis 1 unit
Diklorometana 15mL 5 gram naftalen
Dilarutkan dalam Erlenmeyer
Larutan
Dipanaskan, Larutan kuning jernih
Didinginkan,
Ditambahkan etanol dan air mendidih, disaring
Produk dikeringkan dalam desikator Naftalen sulfonat murni dicek titik lelehnya Buret 1 buah Sarung tangan karet 2 pasang
Kondensor 1 buah
3.2 Prosedur Percobaan
Bahan
Nama bahan Jumlah Nama bahan
Jumlah
Naftalen teknis 5 gram Etanol 96% 25 ml
H2SO4 98% 3,15 ml Aquades 100 ml Diklorometana
teknis
3.3 Hasil Data Pengamatan
Massa Naftalen sulfonat = 4,51 gram Yiled Naftalen sulfonat= 55,6%
Titik Leleh Produk yang dihasilkan = 750C
3.4 Pembahasan
Nama : Nur Afinayani Linawati NIM : 141424024
Pada praktikum ini dilakukan sulfonasi naftalen menggunakan pelarut diklorometana. Bahan baku naftalen sebanyak 5 gram dilarutkan dalam 15 ml diklorometana. Dalam proses sulfonasi, diklorometana tidak ikut beraksi namun hanya berfungsi sebagai pelarut saja. Sulfonating agent yang digunakan adalah concentrated sulfuric acid (H2SO4 98%) sebanyak 2,9 ml. Proses sulfonasi berlangung pada temperatur 70°C selama 60 menit. Temperatur dapat memberikan pengaruh bukan hanya terhadap laju reaksi, tetapi juga terhadap sifat dari produk yang dihasilkan. Jika proses berlangsung pada temperatur yang lebih tinggi maka yang akan terbentuk adalah β-naftalen sulfonat, sehingga selama proses sulfonasi temperaturnya harus dijaga pada kisaran 70°C. Mekanisme reaksi yang terjadi dalam proses sulfonasi ini adalah:
C10H8(s) + H2SO4(l) → C10H8SO3(s) + H2O
α-naftalen sulfonat yang terbentuk belum murni, masih terdapat pengotor berupa sisa-sisa asam, sisa-sisa bahan baku yang tidak beraksi dan pelarut diklorometana. Kemudian ditambahkan etanol dan dibiarkan selama 30 menit. Etanol ditambahkan untuk memurnikan produk dari sisa bahan baku yang tidak bereaksi. Selanjutnya ditambahkan air mendidih untuk proses pemurnian dari sisa asam. Larutan tersebut disaring dan dicuci dengan aquades dan etanol untuk memurnikan
dari sisa-sisa pengotor yang mungkin masih terdapat dalam produk tersebut. Produk α-naftalen sulfonat yang dihasilkan dikeringkan dalam desikator untuk menghindari penguapan yang berlebihan yang mengakibatkan kehilangan produk. Didapat massa α-naftalen sulfonat percobaan sebesar 4,51 gram sedangkan massa teoritisnya sebesar 8,112 gram. Persen perolehan produk adalah 55,6%. Nilai yield yang rendah dapat disebabkan bahan baku tidak terkonversi seluruhnya menjadi produk karena konsentrasi asam (sulfonating agent) yang rendah akibat terbentuknya air pada proses sulfonasi, dan produk yang dihasilkan masih belum murni. Dapat dilihat juga dari nilai titik lelehnya, berdasarkan percobaan titik leleh produk adalah 75°C sedangkan berdasarkan literature titik lelehnya adalah 77-79°C.
Nama : Raden Ahmad Fadhilah NIM : 141424025
Pada praktikum kali ini dilakukan percobaan membuat α-naftalen sulfonat. Pembuatan senyawa α-naftalen sulfonat inidilakukan dengan melakukan reaksi sulfonasi pada senyawa naftalen dengan pelarut diklorometan. Reaksi sulfonasi tersebut menggunakan sulfonating agent concentrated. Bahan baku yang digunakan ialah 5 gram naftalen dan agentnya berupa concentrated sulfuric acid (H2SO4 pekat 98%). Pemilihan bahan baku tersebut berdasarkan tingkat keamanannya serta reaksi yang dapat berlangsung pada suhu kurang dari 50o C dengan tekanan 1 atm.
Naftalen padat dilarutkan dengan diklorometan terlebih dahulu kemudian ditambahkan H2SO4 pekat sesuai dengan kebutuhan. Reaksi sulfonasi ini berlangsung dengan menggunakan reaktor sebuah labu erlenmeyer yang dilengkapi kondensor disertai dengan magnetic stirrer sebagai pengaduk dan dipanaskan dengan hotplate untuk menjaga suhu reaktor, karna reaksi berlangsung secara endotermis.. Penggunaan kondensor berfungsi untuk menghindari penguapan pada saat reaksi berlangsung. Reaksi dilakukan pada kondisi konstan pada suhu 700C selama 45 menit. Selama reaksi berlangsung, pastikan waterbatch dalam keadaan dingin.
Pada reaksi terjadi beberapa tahapan, pertam adalah pembentukan elektrofilik (SO3) yaitu penguraian asam sulfat menjadi SO3. Selanjutnya elektrofilik tersebut akan menyerang senyawa naftalen sehingga terjadilah sulfonasi nafalen. Berikut adalah reaksi sulfonasi naftalen secara menyeluruh.
Pada saat reaksi berlangsung, terjadi penguapan senyawa-senyawa didalam reaktor tetapi kembali mencair ketika masuk ke dalam kondensor. Hasil reaksi tersebut berupa kristal berwarna putih. Hasil reaksi tersebut dicuci dengan menggunakan air panas untuk menghilangkan asam sisa kemudian dicuci dengan etanol untuk melarutkan naftalen sisa yang tidak bereaksi.
Penyaringan produk dilakukan dengan menggunakan corong bucner serta dibilas dengan menggunakan aquadest. Produk naftalen sulfonat yang didapat kemudian dikeringkan di dalam desikator. Setelah produk terssebut kering, produk tersebut ditimbang kemudian didapat berat naftalen sulfonat sebesar 4,51 gram. Berat produk secara teoritis adalah 8,112 gram, sehingga perolehan yield yang didapat sebesar 55,6%.
Dilakukan pengujian titik leleh pada produk dan didapat titik leleh dari produk sebesar 75oC. Hal tersebut mendekati data yang terdapat pada literatur dimana titil leleh naftalen sulfonat adalah 77-79oC. Berdasarkan perbandingan tersebut, dapat diketahui bahwa dalam produk tersebut masih terdapat pengotor yang membuat tingkat kemurnian produk menurun dan menyebabkan titik leleh produk tidak sama dengan literatur. Hal tersebut dapat disebabkan oleh beberapa faktor diantaranya adalah reaksi yang tidak sempurna serta pencucian produk yang kurang optimal.
Nama : Rizka Rismayani Setiawan NIM : 141424027
Praktikum kali ini bertujuan untuk membuat menjadi α-naftalen sulfonat melalui proses sulfonasi. Bahan baku dalam proses pembuatannya, yaitu naftalen dan diklorometan sebagai pelarutnya. Naftalen digunakan karena reaksi dapat berlangsung kurang dari 500C dengan tekanan 1 atm, berbeda halnya dengan senyawa aromatic lainnya yang harus direaksikan dengan suhu tinggi. Pada reaksi ini dilibatkan pula sulfonating agent concentrated
yaitu H2SO4 pekat dengan konsentrasi 98% yang digunakan sebagai agentnya.
Proses sulfonasi dilakukan dengan mereaksikan padatan naftalen dengan diklorometan dalam reaktor. Kemudian ketika telah mencapai temperature operasi ditambahkan H2SO4 pekat yang disesuaikan dengan kebutuhan konsentrasi SO3 minimum yang diperlukan agar reaksi sulfonasi tetap berlangsung. Kondisi reaksi berlangsung pada suhu 70oC selama ± 60 menit. Reaksi yang terjadi adalah sebagai berikut:
Reaksi dilakukan pada temperatur rendah, hal ini karena α-naftalen sulfonat akan lebih cepat terbentuk karena reaksi berlangsung pada jalur energy aktivasi yang lebih rendah. Reaksi tersebut merupakan reaksi substitusi elektofilik. Mekanisme reaksi sulfonasi yaitu diawali dengan pembentukan elektrofilik (SO3), terjadi penguraian asam sulfat yang menghasilkan SO3. Selanjutnya terjadi proses penyerangan senyawa naftalen oleh elektrofilik yang terbentuk. Sehingga reaksi secara keseluruhan adalah :
C10H8 + H2SO4 → C10H8SO3 + H2O
Produk yang dihasilkan berupa α-naftalen sulfonat yang masih mengandung pengotor sisa asam dan bahan baku yang tidak bereaksi. Kemudian dilakukan pemurnian terhadap α-naftalen sulfonat dari sisa bahan baku yang tidak bereaksi menggunakan etanol dan didiamkan selama 30 menit. Selanjutnya dilakukan pemurnian α-naftalen sulfonat dari sisa asam menggunakan air panas. Kemudian produk disaring, dicuci dan dikeringkan dalam desikator.
Berat α-naftalen sulfonat yang dihasilkan dari percobaan sebesar 4,51 gram. Sehingga dihasilkan yield sebesar 55,6%. Tidak tercapainya yield 100% karena suhu
operasi yang kurang optimal, reaksi yang tidak sempurna (masih terdapat bahan baku yang belum bereaksi), terdapatnya produk yang tertinggal (menempel) dalam reactor dan penyaring Buchner.
Titik leleh α-naftalen sulfonat yang didapat pada percobaan ini adalah sebesar 750C. Berdasarkan literatur, titik leleh α-naftalen sulfonat adalah 77-79oC. Perbedaan titik leleh tersebut karena α-naftalen sulfonat yang didapat dari praktikum belum α-naftalen sulfonat murni sehingga didalamnya masih terdapat zat pengotor dan zat lainnya.
LAMPIRAN Mol naftalena
n= m BM n= 5 g 128 g/mol n=0,039 mol %SO3 dalam H2SO4 H2SO4 98% (1 + x) H2O : 1 SO3 x= BM H 2 SO 4 (1+ x)BM H 2 O+BM SO 3 0,98= 98 18+18 x +80 x=0,11 H2SO4 98% (1 + 0,11) H2O : 1 SO3 ∝=%SO3= BM SO 3 1,11 x 18+1 x 80 ∝= 80 100 ∝=80 X =80100−56 80−56
X =146,4 gram untuk 1 mol Naftalen
Untuk 0,039 mol naftalena m=n x 146,4 gram/mol
m=0,039 mol x 146,4 gram/mol m=5,71 gram
V =m ρ
V = 5,71 gram 1,81 gram/mL V =3,15 mL
Mol Asam Sulfat
n= 5,17 gram 98 gram/mol n=0,053 mol
Stoikiometri :
Naftalena + Asam Sulfat Naftalen sulfonat + H2O Mula-mula 0,039 0,053 - -Reaksi 0,039 0,039 0,039 0,039 Kesetimbangan 0 0,014 0,039 0,039
Berat Produk Teoritis
Massa Naftalen sulfonat = mol Naftalen sulfonat x BM Naftalen sulfonat = 0,039 mol x 208g/mol
= 8,112 gram
Yield α-Naftalen Sulfonat
Yield = massa Naftalen sulfonat hasil percobaanmassa Naftalen sulfonat teoritis x 100%
= 8,1124,51 x 100 = 55,6%
Titik Leleh α-Naftalen Sulfonat yang dihasilkan = 750C
Titik Leleh α-Naftalen Sulfonat berdasarkan literatur= 77-790C Titik Leleh α-Naftalen Sulfonat Berdasarkan Literatur: