1 BAB II
KAJIAN PUSTAKA
2.1 Human Immunodeficiency Virus 2.1.1 Definisi dan Etiologi HIV/AIDS
Acquired Immunodeficiency Syndrome (AIDS) adalah penyakit yang
menyerang sistem imun manusia yang disebabkan oleh Human Immunodeficiency Virus (HIV), yaitu HIV-1 dan HIV-2. HIV-1 merupakan penyebab terbanyak dari
AIDS, yang mana virus tersebut menyebabkan tubuh kehilangan mekanisme pertahanan alamiah dalam melawan penyakit, sehingga tubuh menjadi rentan terhadap berbagai penyakit. Kemudian Retrovirus yang kedua, HIV-2, juga disebutkan sebagai agen penyebab AIDS yang endemis di Afrika Barat. Selain itu, HIV-2 juga ditemukan di Brazil, Eropa dan Amerika Utara (Gibbs et al., 2008;
Hammili et al., 2004).
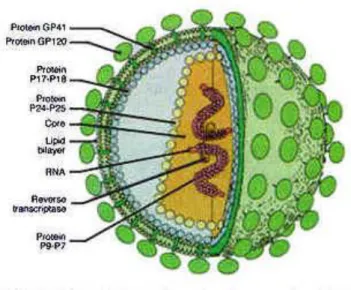
HIV adalah lentivirus yang merupakan anggota dari Retrovirus, yang memiliki genom Ribo Nucleic Acid (RNA) yang terdiri dari core (p18, p24 dan p27) dan protein surface (gp120 dan gp41), enzim reverse transcriptase, serta lipid sebagai envelope. Virion mengandung tiga struktur gen (gag, pol dan env) juga kompleks gen regulatory (termasuk tat,vif, nef, vpu dan ref) yang mengontrol produksi virion. Retrovirus terdiri dari sejumlah besar anggota virus RNA ber- envelope yang berfungsi mengkode enzim reverse transcriptase, yang menyebabkan DNA double-stranded ditranskripsi dari virion RNA. Kemudian virus tersebut akan
menimbulkan replikasi DNA dan berintegrasi pada genom dari sel host. Maka dari itu, infeksi sel oleh Retrovirus akan membentuk suatu sumber potensial untuk masuknya virus baru. HIV lebih menginfeksi sel sel yang memiliki CD4+
glycoprotein surface antigen, khususnya limfosit T-helper, makrofag, sel di susunan saraf pusat dan sel plasenta. Spesifisitas tersebut disebut dengan viral trophism dan hal tersebut timbul akibat HIV protein gp 120 yang secara spesifik mengikat molekul CD4+ dan menyebabkan masuknya virus tersebut ke dalam sel. Dan paling sedikit dibutuhkan dua molekul sel permukaan lain yang membantu HIV memasuki sel sel tersebut atau yang dikenal dengan istilah Koreseptor, Koreseptor tersebut adalah CXCR4 dan CCR5 yang merupakan reseptor kemokin yang paling sering diidentifikasi. Kedua koreseptor tersebut ada di dalam sel host dan digunakan oleh virus untuk membawa envelope virus dan membrane sel host. Strain HIV dapat secara luas terbagi menjadi dua kategori, yaitu Makrofag tropic (M-tropic) dan T-cell tropic (T-tropic). Strain M-Tropic memakai CCR5 sebagai koreseptor dan disebut sebagai virus R5, yang lebih menginfeksi makrofag, sel T dan menginfeksi CD4+
pada garis sel T yang lebih buruk. Selain itu, virus virus tersebut cenderung lebih mudah ditularkan lewat hubungan seksual. Strain T-Tropic memakai CXCR4 sebagai koreseptor, yang kebanyakan diekspresikan di CD4+ sel T, yang disebut dengan virus X4.
Gambar 1.1 Human Immunodeficiency Virus (Flexner, 1998)
Koreseptor CXCR4 terutama berinteraksi dengan CD4+ dari limfosit T pada stadium infeksi yang advance. Virus X4 menginduksi pembentukan sinsitium dari sel yang terinfeksi. Pada infeksi awal, strain virus R5 mendominasi, namun meskipun demikian baik virus X4 maupun R5 sama sama dapat kembali pulih (Cunningham et al., 2010; Gibbs et al., 2008).
2.1.2 Transmisi HIV
Infeksi HIV dapat ditularkan melalui 3 rute, yaitu : Jalur yang pertama adalah lewat hubungan sexual, yang merupakan jalur transmisi utama HIV, khususnya jika didapati luka atau laserasi pada alat genitalia. Diperkirakan kemungkinan terinfeksi HIV lewat hubungan heterosexual antara 0,03% hingga 0,09%. Kemungkinan penularan juga dipengaruhi oleh subtipe virus, immunitas host dan faktor lingkungan (DeCherney et al., 2005; Hammilil, 2004).
Seperti yang telah dijelaskan dalam bab sebelumnya bahwa prosentase infeksi HIV pada wanita lebih tinggi dari pada pria, yang mana kemungkinan ini disebabkan karena transmisi virus lebih mudah terjadi pada wanita dibandingkan pada pria. Hal ini disebabkan oleh, pertama, konsentrasi HIV di semen yang tinggi, kedua, coitus menyebabkan mukosa introitus vagina lebih mudah robek dibandingkan dengan kulit penis. Traktus genitalia wanita berperan baik sebagai barrier maupun jalur masuknya HIV. Dinding vagina terdiri dari epithel squamous stratified non-keratinizing dan mucous servix yang menyediakan barrier mekanik terhadap masuknya virus. Namun, dengan adanya gangguan pada barrier pelindung tersebut, baik itu fisiologis maupun psikologis, akan menyebabkan masuknya virus. Hydrogen peroksida yang memproduksi lactobaccilus akan membuat pH vagina asam, sehingga dapat menghambat masuknya HIV-1. Mukosa genitalia memiliki imunitas aktif. Sel dendritik saling mengadakan hubungan dengan sel epithel untuk membiarkan lewatnya antigen, sekaligus sebagai sel target untuk masuknya HIV. Sel T yang teraktivasi dan makrofag juga banyak ditemukan di mukosa dan diantara sel sel pertama yang terinfeksi saat hubungan sexual. Namun, sel T Helper, sel T sitotoksik, sel NK dan antibodi neutralizing dan non neutralizing juga ada di mukosa untuk mencegah infeksi atau mengeliminasi sel yang terinfeksi. Sitokin seperti interferon dan kemokin seperti Makrofag Inflammatory Protein (MIP)-1a, MIP-1b dan ekspresi Regulated on Activation Normal T Cell (RANTES) juga berperan penting dalam mencegah masuknya HIV-1, meskipun sitokin proinflamasi lainnya dapat menstimulasi masuknya HIV (Sheffield et al., 2009).
Tingginya kadar virus dalam darah (viral load) berhubungan dengan peningkatan jumlah virus di genitalia. Viral load cenderung meningkat pada fase infeksi akut dan selama fase immunosupresi. Peningkatan HIV pada lavage cervicovaginal sering kali berhubungan dengan penurunan kadar CD4+ dan peningkatan viral load. Ulserasi genitalia yang disebabkan oleh berbagai penyakit menular seksual atau sexually transmitted disease (STDs) tampak meningkatkan risiko transmisi, begitu pula dengan hubungan seksual tanpa pelindung pada saat menstruasi. Adanya peningkatan HIV di genitalia telah dibuktikan pada kejadian STDs ulcerative maupun non-ulcerative (Gibbs et al., 2008).
Penyakit menular seksual seperti Gonorrhea, Clamydia atau trichomoniasis telah diidentifikasi menjadi faktor risiko dalam transmisi HIV. Mekanismenya adalah penarikan CD4+ ke area tersebut. Inflamasi yang berhubungan dengan STDs akan memicu peningkatan produksi sitokin pro-inflamasi (Interleukin (IL) 1, IL 6 dan Tumor Necrosis Factor (TNF) α) yang mana akan meningkatkan replikasi HIV
(Gibbs et al., 2008).
Rute yang kedua adalah lewat jalur parenteral, yaitu lewat kontak dengan jarum, infus atau produk yang terkontaminasi darah, jarum yang dipakai bergantian untuk memasukkan obat kedalam tubuh, dan transfusi darah yang tidak di screening (DeCherney et al., 2005; Gibbs et al., 2008)
Sedangkan rute yang ketiga adalah lewat transmisi perinatal, yaitu transmisi vertikal (Mother to Child Transmission/MTCT) baik antepartum, intrapartum maupun postpartum (menyusui). Pada penelitian cohort tahun 2001 oleh Kourtis and
colleagues, mereka memperkirakan 20% transmisi terjadi sebelum usia kehamilan 36
minggu, 50% pada beberapa hari sebelum persalinan, dan 30% saat intrapartum.
Transmisi lewat menyusui cukup tinggi yaitu 30-40%. Transmisi vertikal lebih sering terjadi pada persalinan preterm, khususnya pada ketuban pecah dini. Pada ibu yang tidak menyusui, risiko MTCT saat dalam kandungan adalah sebesar 80%, namun dengan pemberian ARV maka risiko MTCT dapat ditekan. Sebelum dikenalkan terapi intrapartum tersebut, angka penularan perinatal secara keseluruhan yang tercatat di negara maju 14-25% dan 25-40% di Negara berkembang (Cunningham et al., 2010;
DeCherney et al., 2005).
Hanya 15-23% kasus infeksi HIV pada neonatus dianggap sebagai akibat penularan intrapartum. Penularan utama terjadi saat persalinan dan awal periode postpartum. Sedangkan sisanya terjadi akibat penularan dari menyusui di periode akhir postpartum. Dengan Terapi ARV, angka transmisi ibu ke janinnya sangat menurun. Transmisi HIV perinatal paling akurat berhubungan dengan kadar HIV RNA plasma maternal atau viral load. Seperti yang telah dibuktikan pada penelitian cohort tahun 2002 oleh Cooper and colleagues, infeksi neonatus hanya 1% dengan
kadar HIV RNA ibu < 400 kopi/ml, dan infeksi neonatus makin meningkat menjadi 30% pada kadar HIV RNA ibu yang > 100.000 kopi/ml. Yang terlebih penting lagi, terapi dengan Zidovudine (ZDV) yang dapat menurunkan level HIV RNA ibu menjadi < 500 kopi/ml, juga dapat meminimalkan risiko transmisi. Selain itu, kadar CD4+ juga memberi pengaruh, hal ini dibuktikan dari peningkatan angka transmisi yang berhubungan dengan penurunan kadar CD4+. Pada penelitian European
Collaborative, didapatkan korelasi yang berbanding terbalik antara jumlah CD4+
absolut dibawah 200 sel/mm3 dengan peningkatan transmisi dan pada jumlah CD4+
absolut diatas 800 sel/mm3, transmisi neonatal masih terjadi namun jumlahnya lebih sedikit. Secara garis besar jumlah CD4+ absolut dan p24 antigenemia cenderung menggambarkan viral load (Gibbs et al., 2008).
2.1.3 Patogenesis infeksi HIV
Infeksi diinisiasi oleh pengikatan protein pada permukaan virus (glikoprotein 120 Env Protein) pada reseptor spesifik molekul Cluster of Diffrentiation 4 (CD 4) yang ditemukan di beberapa sel Limfosit T, sel makrofag dan sel microglial. Ekspresi reseptor CD 4 membutuhkan stimulasi antigen, contoh HIV berpotensi menginfeksi sel B hanya jika didapati infeksi EBB sebelumnya. Cluster of Diffrentiation 4 pertama kali dibuktikan berperan sebagai reseptor virus pada beberapa penelitian, yang menandakan kerentanan sel yang memiliki CD 4 untuk mengalami infeksi dan sekaligus memiliki kemampuan untuk memblok infeksi lewat antibodi monoclonal anti CD 4 pada kultur. Sedangkan koreseptor CCR5 and CXCR4 diperlukan agar virus dapat memasuki sel. Pada saat infeksi awal, kadar viremia umumnya menurun, namun setelah beberapa waktu, kadar sel Limfosit T akan menurun drastis, sehingga menimbulkan kondisi imunosupresi (Fauci & Lane, 2007; Kahn & Walker, 1998)
Pada penelitian penderita HIV yang asimptomatis dan memiliki jumlah CD4+
absolut yang normal tanpa pengobatan telah menunjukkan beberapa mekanisme sistem imun yang signifikan dalam mengkontrol infeksi HIV. Meskipun demikian, virus HIV tetap memiliki strategi yang saling berhubungan erat untuk menghindari
sistem imun yang baik dan terus bereplikasi. Yang terbanyak dipelajari dari strategi tersebut adalah variasi antigen, down regulation ekspresi permukaan molekul major histocompability complex (MHC), dan penurunan sel T CD8+ spesifik. Suatu ketika
jika HIV berhasil menyebabkan penurunan jumlah CD4+ absolut, maka penurunan kadar Limfosit T tersebut, yang seharusnya berperanan penting dalam respon sistem imun akan menyebabkan sistem imunitas tubuh melemah, sehingga, individu yang terinfeksi akan rentan mengalami infeksi opportunistic (contoh : Pneumocystis Carinii Pneumonia (PCP) dan Toxoplasmosis Susunan Saraf Pusat) dan Neoplasia
(contoh : Sarcoma Kaposi). Penyakit penyakit tersebut jarang mengenai individu terinfeksi dengan sistem imunitas yang baik. Mekanisme penurunan jumlah CD4+
absolut pada fase akut berbeda dengan fase kronik. Pada fase akut, HIV menginduksi lisisnya sel dan mematikan sel yang terinfeksi lewat sel T Sitotoksik, sehingga terjadi penurunan kadar sel T CD4+. Walaupun dalam hal ini, proses apoptosis juga memegang peranan. Selain itu, penurunan jumlah CD4+ absolut disebabkan oleh karena peranannya sebagai reseptor virus agar virus dapat memasuki sel, sehingga dengan peningkatan HIV dalam darah (viremia), kadar CD4+ akan makin menurun.
Pada fase kronis, akibat dari aktivasi sistem imun general bersamaan dengan berangsur angsur hilangnya kemampuan sistem imun untuk membentuk sel T baru tampaknya menyebabkan penurunan perlahan dari jumlah CD4+ absolut (Gibbs et al., 2008).
Penyebab utama hilangnya sel T CD4+ tampak berasal dari kerentanannya yang tinggi terhadap proses apoptosis pada saat sistem imun teraktivasi. Meskipun sel
T baru terus diproduksi oleh tymus untuk menggantikan yang hilang, kemampuan beregenerasi dari tymus dihancurkan secara perlahan lahan pada tymosit oleh HIV.
Dan jika jumlah minimal dari sel T CD4+ yang diperlukan untuk mempertahankan respon imun utama hilang, maka AIDS akan berkembang. (Gibbs et al.,2008)
Individu yang terinfeksi HIV yang disertai dengan salah satu di antara infeksi opportunistic, neoplasia, dementia, encephalopathy atau wasting syndrome yang lain
didiagnosis dengan AIDS. Diagnosis AIDS dapat dibuat walau tanpa bukti infeksi secara laboratoris. Namun pada tahun 1993, CDC merubah definisi tersebut menjadi semua individu terinfeksi HIV dengan kadar CD4+ di bawah 200 sel/mm3 disertai salah satu dari antara tuberculosis pneumonia, kanker servix advanced dan pneumonia recurrent (Gibbs et al., 2008)
Antibodi dapat terdeteksi pada semua individu yang baru terinfeksi dalam waktu 6 hingga 12 minggu setelah paparan, namun ada beberapa yang lebih lama dari pada itu. Setelah terjadi serokonversi, umumnya diikuti dengan periode asimptomatis yang durasinya bervariasi. Rata rata periode laten tersebut, tanpa disertai dengan terapi yang efektif diperkirakan 11 tahun. Penderita yang terinfeksi HIV yang langsung berkembang jadi AIDS sangat jarang terjadi (<5%). Namun, meskipun tanda tanda klinis defisiensi sistem imun dari AIDS tidak berlangsung dalam beberapa tahun setelah terinfeksi, sejumlah besar sel T CD4+ yang hilang terjadi dalam beberapa minggu setelah infeksi, khususnya di mukosa intestinal, yang merupakan labuhan utama limfosit yang ada dalam tubuh. Alasan hilangnya sel T CD4+ dalam jumlah besar di mukosa karena mayoritas sel T CD4+ di mukosa
mengekspresikan koreseptor CCR5, sedangkan hanya sebagian kecil dari sel T CD4+
yang ada dalam darah yang mengekspresikan koreseptor yang sama. HIV mencari dan menghancurkan sel CD4+ yang mengekspresikan CCR5 selama infeksi akut.
Respon imun yang baik dapat mengkontrol infeksi dan menginisiasi fase laten seperti yang telah dijabarkan sebelumnya. Akan tetapi, sel CD4+ di mukosa jaringan tetap menurun selama proses infeksi, meskipun tetap masih ada untuk melawan infeksi awal yang mengancam nyawa (Gibbs et al., 2008).
Replikasi HIV yang berkelanjutan akan menyebabkan aktivasi sistem imun yang bertahan selama fase kronis. Aktivasi sistem imun yang dimaksudkan adalah peningkatan aktivasi sel imun dan pelepasan sitokin pro-inflamasi, akibat dari aktivasi produk gen dari HIV dan respon imun terhadap replikasi HIV yang berkelanjutan. Penyebab lainnya adalah rusaknya sistem imunitas pada barrier mukosa yang disebabkan oleh penurunan sel T CD4+ di mukosa selama fase akut penyakit. Hal tersebut menyebabkan paparan sistem imun sistemik terhadap komponen mikroba pada normal flora usus. Aktivasi dan proliferasi sel T yang ditimbulkan oleh aktivasi sistem imun akan menyediakan target untuk infeksi HIV.
Namun, penghancuran sel secara langsung oleh HIV saja tidak dapat menghitung penurunan sel T CD4+ jika hanya 0,01-0,1 % sel T CD4+ didalam darah yang terinfeksi (Gibbs et al., 2008)
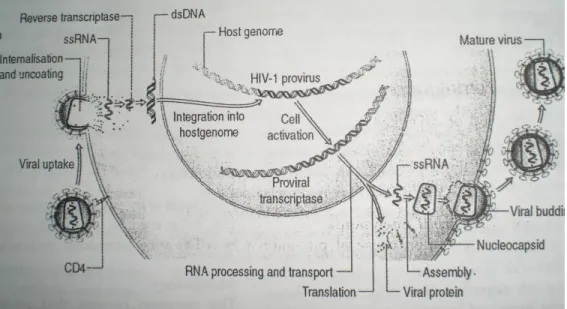
Gambar 2.1 Siklus Hidup Partikel Human Immunodeficiency Virus (Edgar, 2006) 2.2 Infeksi HIV selama kehamilan
2.2.1 Efek kehamilan terhadap fungsi imunitas penderita AIDS
Secara klinis, progresivitas dari infeksi AIDS yang asymptomatis selama kehamilan jarang terjadi. Namun, 45-75% dari wanita yang terinfeksi akan mengalami gejala klinis dari AIDS dalam 2-3 tahun pasca melahirkan jika anaknya terinfeksi. Respon dari kadar sel T CD4+ terhadap kehamilan bervariasi, dikatakan dalam beberapa penelitian bahwa terjadi penurunan absolut dari kadar sel T CD4+
selama kehamilan yang disebabkan oleh karena efek hemodilusi akibat kehamilan, dan kadar sel T CD4+ akan kembali ke kadar semula pada akhir kehamilan atau saat postpartum. Apakah kadar sel T CD4+ selama hamil bisa dipakai sebagai marker dalam memulai obat AntiRetroVirus (ARV) masih belum jelas, namun dari beberapa
penelitian menyarankan bahwa kadar sel T CD4+ dan CD4+% dapat menjadi marker yang baik untuk memulai pengobatan ARV (Miotti et al, 1999).
Bessinger et al juga melaporkan hal yang serupa pada penelitian meta analisisnya pada tahun 1998 bahwa kadar sel T CD4+ selama hamil hingga aterm sedikit lebih rendah dibandingkan dengan wanita yang abortus (Bessinger et al., 1998).
Kadar HIV RNA masih tetap stabil selama hamil meskipun tidak dalam fase pengobatan. Namun, dari data terbaru menunjukkan Viral Load (VL) meningkat pada saat post partum tanpa memperhatikan terapi AntiRetroViral. Aktivasi sistem imun yang disebabkan oleh perubahan hormonal atau efek unmasking selama hamil berhubungan dengan supresi Viral Load. Selain itu, pada penelitian cohort yang dilakukan oleh Ilaria Izzo and collegeas pada bulan Januari 1998 sampai Mei 2008 didapatkan hubungan yang signifikan antara rendahnya jumlah CD4+ absolut yang didapatkan selama kehamilan dengan risiko terdeteksinya HIV RNA saat persalinan (Bessinger et al., 1998)
Pada tahun 2009, Sheffield and collegeas meneliti adanya efek hormon Progesteron terhadap koreseptor HIV-1, yaitu CCR5 dan CXCR4. Hasil yang menarik didapatkan bahwa pada salah satu kondisi tinggi kadar Progesteron seperti pada kehamilan ternyata juga memiki hubungan dengan peningkatan masuknya infeksi HIV. Pada awal kehamilan, corpus luteum memproduksi Progesteron untuk mempertahankan kehamilan. Kemudian, plasenta menggantikan fungsi corpus luteum dalam menghasilkan progesteron, yang jumlahnya makin meningkat sejalan dengan
meningkatnya usia kehamilan. Beberapa laporan mencatat adanya peningkatan masuknya HIV selama kehamilan. Akhir akhir ini penelitian besar di Rakai, Uganda menunjukan risiko meningkatnya masuknya HIV dua kali lipat selama kehamilan, meskipun telah dilakukan control terhadap pola hubungan sexual. Namun, ada hal penting yang harus digaris bawahi adalah faktor biologis selama kehamilan, seperti perubahan hormonal tampaknya menjadi peran penting dalam menarik masuknya HIV. Mekanisme yang menjelaskan bagaimana hormon sex steroid khususnya Progesteron mempengaruhi masuknya HIV masih membingungkan dan cukup kontroversial. Progesteron memiliki efek multiple pada sistem imunitas manusia termasuk salah satunya adalah immunitas mukosa. Progesteron meningkatkan munculnya sel inflamasi pada traktus genitalia bawah wanita. Namun, Progesteron juga menurunkan sel yang memediasi aktivitas sel NK (Natural Killers) dan aktivitas sel T sitotoksik. Selain itu juga mempengaruhi sekresi kemokin oleh limfosit T.
Mekanisme lain progesteron dalam mempengaruhi masuknya HIV adalah dengan merubah ekspresi koreseptor HIV-1. Meskipun CD4+ merupakan reseptor sel primer untuk HIV-1, namun telah diketahui bahwa dalam memasuki sel manusia secara efektif juga tergantung dari koreseptor, yaitu CCR5 dan CXCR4. (Sheffield et al., 2009).
Tanpa memandang reseptor HIV, infeksi HIV membutuhkan marker CD4+ di permukaan sel sebagai reseptor utama dan molekul reseptor kemokin (khususnya CCR5 atau CXCR4) sebagai koreseptor. Perubahan ekspresi koreseptor HIV-1 pada intinya mempengaruhi efisiensi dari masuknya sel HIV. Adanya hubungan antara
ekspresi CCR5 pada sel yang terinfeksi dengan progesteron masih dalam perdebatan.
Namun, Vassiliadou et al membuktikan dengan memakai sistem model in vitro bahwa progesteron dapat menghambat interleukin (IL)-2 yang menginduksi upregulasi reseptor CCR5 dan CXCR4 pada sel T yang teraktivasi tapi tidak memiliki efek terhadap sel T maupun makrofag yang tidak teraktivasi. Pada penelitian lain di lakukan evaluasi terhadap wanita premenepause dan postmenepause, dan wanita dengan berbagai tahap siklus menstruasi, peningkatan progesteron berhubungan dengan peningkatan ekspresi CCR5 dan CXCR4 pada jaringan genitalia. Pada studi invitro menggunakan sel T CD4+ positif juga menunjukkan peningkatan ekspresi CCR5 dan CXCR4 ketika sel T diterapi dengan hormon sex sintetis. Walau bagaimanapun, peneliti lain juga melaporkan hubungan yang berbanding terbalik antara terapi progesteron pada sel servix dan endometrium dengan ekspresi koreseptor HIV-1 invitro. Hasil yang tidak sesuai diantara model in vivo dan in vitro kebanyakan mencerminkan kompleks seluler dan atau lingkungan jaringan yang mempengaruhi ekspresi koreseptor secara in vivo. Contohnya, sel traktus genitalia wanita atas dan bawah meskipun secara in vivo juga mengekspresikan koreseptor HIV-1 dalam jumlah yang berbeda. Upregulasi ekspresi koreseptor HIV-1 selama kondisi klinis tertentu seperti kehamilan dapat menjelaskan predisposisi individu untuk terpapar HIV-1. Selain itu, pada beberapa penelitian telah menunjukkan peningkatan ekspresi CCR5 oleh sel endometrium pada lingkungan yang rendah progesteron pada fase proliferasi siklus menstruasi, namun dari penelitian lain
menunjukkan peningkatan ekspresi CCR5 pada lingkungan yang tinggi progesteron pada fase luteal (Sheffield et al., 2009).
Selain memiliki efek terhadap sistem imunitas mukosa, Progesteron juga menyebabkan penipisan vagina pada primate selain manusia, sehingga dari pengamatan tersebut sangat mungkin penipisan epithel vagina dapat menyebabkan virion HIV melewati epithel. Penellitian lain juga melaporkan penipisan vagina yang sama setelah paparan progesteron. Penelitian lain pada manusia lebih bervariasi.
Ildgruben et al melaporkan penebalan epithel vagina dengan penggunaan DMPA, sekaligus juga dilaporkan banyaknya sel imun yang rentan terhadap infeksi HIV-1 yang berada di jaringan genitalia wanita yang diberikan DMPA tersebut. Penebalan vagina yang sama juga dilaporkan oleh kelompok peneliti lainnya, selain itu juga dicatat bahwa meskipun penebalan vagina terjadi di lapisan vagina intermediate, maturasi epithel tidak terjadi secara sempurna. Kebalikan dari dua penelitian tersebut, Patton et al melaporkan penurunan signifikan jumlah lapisan sel epithel vagina pada
fase post ovulasi yang tinggi kadar progesteronnya. Efek menonjol dari progesteron pada masuknya HIV-1 kebanyakan berhubungan dengan efek immunomodulasinya.
Didapatkan bukti yang menarik bahwa sel CD8 positif dan fungsi sitokin begitu pula dengan respon imun humoral ada di bawah pengaruh hormonal. Kontrasepsi hormonal dan siklus menstruasi juga dapat mengubah produksi antimikroba peptide.
Progesteron dilaporkan dapat meningkatkan banyak sel radang (sel PMN, makrofag), menyebabkan migrasi dan proliferasi limfosit juga sekaligus merubah respon
imunologis. Oleh karena itu, progesteron dapat memicu sel menjadi kaya akan reseptor untuk HIV, sehingga memudahkan transmisi HIV (Sheffield et al., 2009).
2.2.2 Efek HIV/AIDS terhadap kematian maternal
Infeksi HIV dapat mempengaruhi kematian maternal dalam beberapa cara.
Wanita hamil yang terinfeksi HIV/AIDS akan lebih rentan mengalami kematian langsung maupun kematian obstetric seperti perdarahan post partum, sepsis puerpuralis dan komplikasi dari sectio caesaria. Kematian yang disebabkan oleh karena AIDS bisa terjadi secara langsung saat kehamilan maupun sebagai penyebab tidak langsung akibat infeksi opportunistic seperti tuberculosis yang berkembang lebih cepat saat hamil. Namun, United States Public Health Service Task Force pada tahun 2009 melaporkan angka morbiditas dan mortalitas tidak meningkat pada wanita seropositif yang asimptomatis (Sheffield et al., 2010)
Di masa lampau, penyebab obstetrik langsung bertanggung jawab terhadap sebagian besar kemaatian ibu, dimana penyebab utamanya adalah perdarahan, hipertensi, persalinan macet dan komplikasi abortus. Pola penyebab tersebut berubah di banyak tempat sejak munculnya komplikasi AIDS yang saat ini banyak terjadi sebagai penyebab kematian ibu. Trio penyakit yang juga jadi penyebab penting kematian ibu adalah AIDS, Tuberkulosis dan malaria. AIDS juga menjadi factor yang ikut berperan sebagai penyebab kematian ibu di negara berkembang, meskipun masih dalam jumlah yang kecil, oleh karena banyak didapatkan akses yang mudah dalam pengobatan dan perawatan ibu yang terkena AIDS. Sebelum penyebarluasan kemampuan highly active antiretroviral therapy (HAART), AIDS masih menjadi
penyebab utama kematian ibu di beberapa area di Amerika Serikat. Dengan akses yang mudah untuk mendapatkan HAART, kematian penderita AIDS dapat ditekan, dan juga baru baru ini direkomendasikan pengobatan antiretroviral secara tepat untuk wanita hamil dengan AIDS, yang mana dapat menurunkan angka komplikasi AIDS selama kehamilan. Namun demikian, pada beberapa negara yang sumber daya manusianya masih buruk, akses untuk medapatkan HAART masih banyak mendapat kendala, sehingga HIV/AIDS masih menjadi masalah utama (McIntyre, 2003).
Pada penelitian sekitar tahun 1990 di beberapa negara negara di Afrika dan Asia menunjukkan peningkatan peranan AIDS dan komplikasi yang berhubungan sebagai penyebab kematian maternal. Maternal Mortality Rate (MMR) pada penelitian tersebut berkisar antara 400 hingga 900 per 100.000 kelahiran hidup. Pada penelitian di Zambia, menunjukkan angka kematian maternal meningkat delapan kali lipat lebih tinggi pada dua decade terakhir, meskipun pelayanan obstetrik telah diwujudkan. Penyebab tidak langsung dari kematian maternal, 58% nya adalah karena malaria dan tuberculosis sebagai komplikasi dari AIDS. Di daerah Rakai di Uganda, kematian maternal lima kali lebih tinggi pada wanita yang positif terinfeksi HIV, mencapai angka lebih dari 1600 per 100.000 kelahiran hidup pada kelompok yang terinfeksi. Di Malawi dan Zimbabwe, kematian yang berhubungan dengan kehamilan telah meningkat menjadi 1,9 dan 2,5 kali setara dengan peningkatan epidemiologi AIDS (McIntyre , 2003).
Kematian maternal yang berhubungan dengan AIDS juga menjadi penyebab utama kematian ibu di Brazzaville tahun 1993, selain itu, AIDS juga menjadi
peringkat keempat tertinggi penyebab kematian maternal di area Tanzania. Di India, penelitian mengenai wanita yang terinfeksi HIV menunjukkan angka kematian maternal yang tinggi. Pneumocystis carinii pneumonia (PCP) yang diikuti oleh tuberculosis milier merupakan penyakit komplikasi tersering AIDS dan menjadi penyebab dari kematian maternal. Di Afrika Utara pada tahun 1998, AIDS merupakan penyebab kedua kematian maternal, dengan 13% diantaranya meninggal di tahun pertama. Pada tahun 1999 hingga 2001, AIDS tercatat sebagai penyebab kematian maternal sebanyak 17 kasus (McIntyre, 2003).
Defisiensi intake maternal dapat menyebabkan eksaserbasi dari progresivitas HIV. Defisiensi vitamin A telah dibuktikan berhubungan dengan progresivitas penyakit yang lebih cepat terhadap wanita yang terinfeksi HIV, peningkatan transmisi HIV dari ibu ke janin serta peningkatan kadar viral load di air susu ibu. Akan tetapi pemberian suplemen vitamin A tidak menunjukkan penurunan risiko transmisi ibu ke janin, tapi mengurangi efek buruk dari penyakitnya terhadap kesehatan ibu. Pada penelitian dengan jumlah sampel yang besar di Nepal, menunjukkan pemberian suplemen Vitamin A atau beta carotene dapat menurunkan kematian maternal sebanyak 44%. Di Tanzania, pemberian suplemen multivitamin, yang tidak hanya mengandung vitamin A, secara signifikan dapat meningkatkan jumlah absolut CD4+, CD3+, dan CD8+ (McIntyre , 2003).
2.2.3 Efek kehamilan terhadap progresivitas penyakit HIV/AIDS
Data yang didapat dari negara berkembang menunjukkan bahwa kehamilan tidak meningkatkan progresivitas dari penyakit HIV/AIDS. Pada penelitian
prospective lebih dari 4000 wanita di Malawi, MMR adalah sebesar 370 per 100.000
wanita dan angka kematian diantara 6 minggu dan 1 tahun post partum adalah 341 per 100.000 kelahiran hidup. AIDS dan anemia merupakan faktor utama kematian post kehamilan. Di Zaire, angka kematian maternal ibu yang terinfeksi HIV 10 kali lebih tinggi dibandingkan ibu yang tidak terinfeksi HIV, dimana 22% dari ibu yang terinfeksi tersebut ada pada kondisi tubuh yang sangat menurun selama di follow up dalam periode 3 tahun (Hammilil et al., 2004; McIntyre, 2003).
John dan kawan kawan telah menunjukkan adanya hubungan yang menarik antara polimorfisme CCR5 dengan peningkatan kematian pasca kehamilan pada penelitian cohort di Kenya. Pada penelitian tersebut, ibu dengan genotip 5936 C/T memiliki risiko meninggal hingga 3,1 kali lipat dalam periode 2 tahun dan peningkatan jumlah HIV-1 secara signifikan di vagina, dibandingkan dengan wanita dengan genotip 59356 C/C. Hal ini menandakan bahwa banyak faktor seperti nutrisi dan genetika, yang berpengaruh terhadap progresivitas infeksi HIV selama dan sesudah kehamilan (Lambert et al, 2005)
Bessinger et al melaporkan hasil penelitian meta analisis cohortnya pada tahun 1998, bahwa kehamilan yang aterm dengan infeksi HIV tidak memberikan dampak yang signifikan pada progresivitas penyakit HIV. Penelitian tersebut mempelajari hubungan antara kehamilan aterm dengan progresivitas penyakit HIV, dimana setelah ditetapkan jumlah CD4+ absolut pada wanita terinfeksi HIV yang tidak hamil kemudian diikuti jumlah CD4+ absolutnya hingga hamil aterm, didapatkan hasil peningkatan progresivitas HIV/AIDS selama hamil, namun secara
statistika kurang signifikan. Selain itu, hanya ada satu wanita dengan jumlah CD4+
absolut yang menurun dibawah 200 sel/ml pada saat hamil. Pada penelitian ini dipilih sebagai kriteria inklusi adalah wanita hamil yang aterm, oleh karena pada beberapa penelitian yang dilakukan oleh Dinsmoor MJ and collegeas menunjukkan bahwa immunosupresi paling sering terjadi di akhir kehamilan, sehingga wanita pada kehamilan aterm lebih berisiko tinggi terhadap progresivitas penyakit. Meskipun tidak didapatkan peningkatan progresivitas penyakit yang signifikan, pada penelitian ini masih belum didapati kejelasan apakah AIDS saat hamil dapat meningkatkan risiko kematian. Selain itu, penelitian ini belum menjawab pertanyaan apakah wanita hamil yang terinfeksi HIV akan mengalami episode penyakit yang lebih berat dari pada wanita terinfeksi HIV yang tidak hamil (Bessinger et al., 1998).
2.2.4 Efek HIV/AIDS terhadap komplikasi kehamilan
Penyebab obstetric dari morbiditas dan mortalitas maternal bisa lebih berat pada wanita yang terinfeksi HIV, dan lebih rentan terhadap infeksi serta komplikasi post operasi. Termasuk dalam hal ini adalah lebih tingginya kejadian kehamilan ektopik, early abortus, bacterial pneumonia, infeksi saluran kencing, oral dan vaginal thrush berulang serta infeksi infeksi yang lain. Malaria dan Tuberkulosis telah menjadi komplikasi HIV yang paling sering terjadi pada wanita yang terinfeksi.
Anemia juga lebih sering terjadi dan tampak lebih berat pada wanita yang terinfeksi HIV, khususnya yang mengalami komplikasi dari penyakit AIDS seperti Malaria (McIntyre, 2003).
Komplikasi pasca persalinan maupun pasca sectio caesaria telah dijabarkan dalam banyak penelitian. Perdarahan post partum sering terjadi, dan kejadiannya lebih serius jika disertai dengan anemia pada wanita yang terinfeksi HIV. Morbiditas pasca melahirkan terjadi pada 15% diantara 1186 persalinan selama tahun 1990-1998 pada penelitian transmisi wanita dan anak anak di Amerika Serikat. Kejadian morbiditas pasca melahirkan yang paling sering dilaporkan adalah demam tanpa sumber infeksi. Perdarahan atau anemia berat, endometritis, infeksi saluran kencing dan komplikasi luka operasi. Komplikasi pasca sectio caesaria juga dilaporkan cukup tinggi, khususnya pada wanita yang mengalami immunosupresi berat, namun hal ini jarang terjadi jika antibiotika profilaksis tersedia untuk diberikan (McIntyre , 2003).
Selain itu, dilaporkan juga angka kejadian preeclampsia juga lebih rendah pada wanita yang terinfeksi HIV yang tidak mendapatkan pengobatan ARV dibandingkan dengan wanita terinfeksi HIV yang mendapatkan pengobatan maupun yang tidak terinfeksi HIV. Namun, hubungan tersebut belum dapat diujikan oleh penelitian cohort lainnya (McIntyre, 2003).
2.2.5. Manifestasi klinis infeksi HIV
Periode inkubasi dari paparan virus hingga timbul gejala klinis adalah beberapa hari hingga minggu, dengan rata rata adalah 2 minggu hingga 4 minggu.
Sedangkan, serokonversi untuk antibodi dari HIV pada umumnya terjadi dalam waktu tiga hingga enam minggu setelah infeksi. Rata rata 80% hingga 90% dari individu yang terinfeksi merupakan carier asimptomatis. Infeksi akut HIV sama dengan sindroma infeksi virus lainnya dan umumnya bertahan kurang dari 10 hari.
Pada saat gejala dan tanda klinis penyakit muncul, infeksi awal ditandai oleh demam, malaise, eritema makulopapular rash, myalgia, arthralgia, sakit kepala, fotofobia dan limfadenopati yang umumnya terjadi pada minggu kedua setelah infeksi. Jika secara bersamaan didapatkan penurunan tajam dari jumlah CD4+ absolut, infeksi opportunistic bisa terjadi yaitu candidiasis oral. Adapun infeksi opportunistic lainnya
yang juga bisa terjadi antara lain adalah, candidiasis pulmonary atau esophageal, lesi persisten herpes simplex atau zoster, condyloma accuminata, tuberculosis paru, pneumonia cytomegalovirus, retinitis atau penyakit gastrointestinal, molluscum contagiosum, Pneumocystis jiroveci pneumonia, toxoplasmosis dan lain lain.
Penyakit neurologis juga sering terjadi, dan rata rata sebagian penderita timbul gejala gangguan susunan saraf pusat. Sindroma tersebut bisa dikatakan sebagai Acute Retroviral Syndrome, yang mana sering terjadi dalam beberapa minggu awal setelah
infeksi HIV, sebelum tes antibodinya menjadi bernilai positif. Sindroma tersebut rata rata terjadi pada 70% individu. Pencatatan bahwa penyakit tersebut disebabkan oleh Acute Retroviral Syndrome harus didukung dengan menilai jumlah HIV RNA dalam
plasma. Hasil yang positif untuk selanjutnya harus dikonfirmasi dengan Enzim Immunoassay dan tes Western Blots. Rute infeksi, patogenitas strain virus, inokulasi
awal virus dan status imunologis host sangat mempengaruhi kecepatan progresivitas penyakit. Selain itu, guideline terbaru menyarankan dengan penanganan sedini mungkin terhadap sindroma akut tersebut menggunakan terapi ARV, maka prognosa yang lebih baik bisa didapatkan. (DeCherney et al., 2005; Hammili et al, 2004, Cunningham et al, 2010)
Setelah fase akut lewat, bentuk penyakit yang lebih berat dapat terjadi.
Manifestasi klinisnya antara lain adalah limfadenopati general, keringat dingin di malam hari, demam, diare, penurunan berat badan, dan kelelahan. Selain itu, infeksi seperti herpes zoster dan candidiasis oral dapat terjadi. Dalam tempo 4 hingga 5 tahun setelah itu, 30 % kasus akan berkembang menjadi AIDS. Sedangkan progresivitas mulai dari viremia asimptomatis menjadi AIDS memiliki rata rata waktu 10 tahun, dengan kisaran waktu antara beberapa bulan hingga 17 tahun. Individu yang terinfeksi HIV pada akhirnya akan menunjukkan bukti adanya disfungsi sistem imun yang progresif, dan kondisi tersebut berkembang menjadi AIDS, sejalan dengan supresi sistem imun serta organ sistemik yang terlibat makin bertambah banyak dan bertambah berat. AIDS merupakan tahap akhir dari infeksi HIV dan pada umumnya berkembang pada sebagian besar individu terinfeksi HIV yang tidak mendapatkan pengobatan dalam 17 tahun setelah terinfeksi. Dengan adanya supresi sistem imun tersebut, maka, tanda dan gejala klinis AIDS akan mudah berkembang jika didapatkan pathogen sekunder. Sindroma yang muncul akibat ketidakmampuan tubuh dalam melawan infeksi, atau melawan reaktivasi infeksi yang dorman, antara lain adalah :
1. Kelelahan hebat, yang terkadang disertai dengan pusing, sakit kepala
2. Demam terus menerus yang juga disertai dengan keringat di malam hari yang berlebihan
3. Berat badan menurun hingga 10 kg, yang bukan disebabkan oleh diet maupun peningkatan aktivitas fisik
4. Pembesaran kelenjar di leher, lengan dan di lipat paha
5. Pertumbuhan warna keunguan pada kulit atau mukosa membrane (didalam mulut, anus dan hidung)
6. Batuk kering ringan yang kontinyu yang bukan berasal dari asap rokok, atau bisa akibat flu yang tidak juga sembuh.
7. Diare kronis
8. Leukoplakia oral yang disertai dengan sakit tenggorokan
9. Perdarahan dari rongga tubuh yang terbuka yang tidak jelas penyebabnya serta mudah memar
10. Sesak nafas yang progresif
Sindroma tersebut umumnya membaik dalam waktu beberapa minggu, dan penderita akan menjadi asimptomatis (DeCherney et al., 2005; Hammilil, 2004, Cunningham et al, 2010).
Center Disease of Control and Prevention (CDC) memberikan definisi AIDS
berupa penderita terinfeksi HIV dengan infeksi opportunistic, neoplasia (contoh : Sarcoma Kaposi), dementia, encephalopathy, progresivitas memburuk dysplasia cervical menjadi kanker, atau jumlah CD4+ absolut < 200/mm3. Penderita yang dinyatakan secara klinis terinfeksi tanpa didukung oleh bukti infeksi secara laboratories juga bisa terdiagnosis AIDS jika didapat salah satu dari indikator penyakit serta tidak ditemukan penyebab disfungsi sistem imun. Seluruh wanita yang terdiagnosis HIV akan membutuhkan konseling, evaluasi dan penanganan penyakit menular sexual, pap smear, darah lengkap, kimia darah, antibodi toxoplasma, panel
hepatitis, dan foto thorax. Selain itu, seluruh pasien perlu mendapatkan tawaran untuk vaksinasi hepatitis B, influenza dan pneumococus (DeCherney et al., 2005).
2.2.6 Skrining HIV prenatal
Pengawasan selama kehamilan penderita terinfeksi HIV harus di lakukan secara terpisah dan dengan penanganan khusus. Skrining untuk penyakit menular seksual lainnya (siphilis, gonorrhea, dan infeksi HSV) penting untuk dilakukan.
Infeksi lain yang berhubungan dengan HIV juga harus dicari, seperti P Carinii pneumonia, Mycobacterium tuberculosis, infeksi citomegalovirus, toksoplasmosis dan candidiasis. Sedikitnya, penderita terinfeksi HIV harus dilakukan pemeriksaan foto rontgen thorax, tes tuberculin kulit dengan kontrol, serta pemeriksaan serologi toksoplasmosis. Penderita yang rentan mengalami infeksi sekunder perlu mendapatkan vaksin hepatitis B, pneumococus, dan influenza. Jumlah CD4+ absolut perlu dimonitor setiap trimester. Jumlah CD4+ absolut kurang dari 200/mm3 merupakan indikasi profilaksis terhadap P carinii pneumonia. Jumlah Viral Load (HIV-1 RNA) dalam plasma juga perlu dimonitor selama kehamilan. Kadar HIV-1 RNA harus dimonitor tiap 3-4 bulan atau tiap trimester dan pada saat usia kehamilan 34-36 minggu untuk menentukan rute persalinannya (DeCherney et al., 2005;
Hammili et al., 2004)
Skrining dilakukan dengan menggunakan tes Enzime Linked Immunosorbent Assay (ELISA) yang memiliki sensitivitas lebih dari 99,5%. Hasil yang positif perlu dilakukan konfirmasi ulang kembali dengan ELISA, lalu dilanjutkan dengan menggunakan Western blot atau Immunofluoresence Assay (IFA), yang mana
keduanya memiliki spesifitas yang tinggi. Berdasarkan CDC tahun 2001, antibodi dapat terdeteksi pada sebagian besar penderita dalam kurun waktu 1 bulan setelah infeksi awal. Untuk infeksi awal HIV primer, identifikasi virus RNA atau DNA mungkin untuk dilakukan. Hasil konfirmasi yang false positif jarang terjadi (Cunningham et al., 2010).
2.2.7 Diagnosis infeksi HIV
Diagnosis infeksi HIVdapat ditegakkan dengan melakukan pemeriksaan pemeriksaan sebagai berikut :
1. Pemeriksaan Antibodi HIV
Diagnosis HIV pada umumnya dengan tes antibodi HIV-1, yang mendeteksi antibodi dari bagian membrane atau envelope dari virus. Tes rutin HIV-2, terkecuali untuk bank darah, baru baru ini tidak direkomendasikan oleh karena berdasarkan data epidemiologi, angka kejadian infeksi HIV-2 masih rendah, kecuali jika ditemukan penderita berisiko terinfeksi HIV-2 atau memiliki tanda klinis penyakit HIV dan pernah memiliki hasil tes antibodi HIV-1 yang negatif (DeCherney et al., 2005; Piercy, 2006).
Seperti yang telah dijelaskan pada bagian skrining HIV prenatal, pemeriksaan ELISA memiliki fungsi sebagai tes skrining pada wanita yang terpapar HIV.
Sebagian besar penderita yang terpapar HIV akan menunjukkan kadar antibodi HIV yang ada di darah dalam tempo 12 minggu setelah paparan.
Adanya antibodi tersebut mengindikasikan infeksi baru, meskipun penderita bisa mengalami gejala asimptomatis selama bertahun tahun. Pemeriksaan
antibodi HIV akan bernilai positif sejalan dengan penurunan kadar antigen core p24. Sensitivitas dan spesifitas dari ELISA adalah 99% bila reaktif secara berulang. Oleh karena itu, tes antibodi HIV adalah negatif jika ELISA nya non reaktif, dan hal ini mengindikasikan rendahnya infeksi HIV kecuali jika periode waktu dalam mendeteksi produksi antibodi terlalu dini (DeCherney et al., 2005; Piercy, 2006)
Hasil tes yang positif timbul jika ELISA reaktif secara berulang yang diikuti dengan hasil tes yang positif dari pemeriksaan Western Blot. Western blot mendeteksi antigen virus spesifik dan bernilai positif jika didapatkan dua dari tiga antigen yang teridentifikasi yaitu : p24 (capsid), gp41 (envelope) dan gp120/160 (envelope). Kebanyakan tes serologis yang digunakan saat ini mendeteksi antibodi spesifik untuk HIV-1 dan HIV-2, dan juga didapatkan beberapa tes darah “rapid” yang memiliki efektivitas yang sama dengan pemeriksaan ELISA. Pada penderita yang dicurigai terinfeksi HIV, tes antibodi HIV dapat bernilai negatif. Oleh karena itu jumlah asam nukelat HIV, deteksi antigen p24, atau isolasi HIV lewat kultur virus perlu dipakai dalam proses diagnosis. (Adams et al., 2007; DeCherney et al., 2005; Piercy, 2006).
2. Pemeriksaan HIV RNA atau DNA
Pada infeksi awal dapat didiagnosis dengan mengidentifikasi P24 core antigen virus atau adanya HIV RNA atau DNA didalam darah. Pemeriksaan HIV RNA atau DNA dapat dilakukan dengan Polymerase Chain Reaction (PCR).
HIV RNA atau Viral Load merupakan prediktor utama dari kecepatan progresivitas penyakit. Selain itu, progresivitas penyakit juga berhubungan dengan rendahnya kadar antibodi p24 dan rekurensi dari antigen p24 (Piercy, 2006)
3. Pemeriksaan jumlah CD4+ absolut
Jumlah CD4+ absolut mengindikasikan derajat immunosupresi. Tanda dari infeksi HIV adalah penurunan progresif dari jumlah CD4+ absolut yang mana tanpa pengobatan, kadarnya menurun hingga rata rata 60 sel/mm3/tahun (Piercy, 2006)
Tanpa pengobatan, HIV akan menginfeksi lebih dan lebih banyak lagi sel. Hal tersebut menyebabkan jumlah CD4+ absolut menurun, umumnya 50 hingga 100 sel/mm3 per tahunnya pada sebagian besar individu dengan HIV positif.
Dengan penurunan jumlah CD4+ absolut individu yang positif HIV akan mudah mengalami infeksi opportunistik dan kanker, dengan ketentuan nilai sebagai berikut :
Jumlah CD4+ absolut diatas 500 sel/mm3 : individu terinfeksi HIVdengan kadar sel T CD4+ diatas 500 sel/mm3 pada umumnya memiliki sistem imun cukup normal dan risiko rendah mengalami infeksi opportunistic.
Jumlah CD4+ absolut dibawah 200 sel/mm3: individu terinfeksi HIV yang memiliki kadar sel T CD4+ dibawah 200 sel/mm3 merupakan individu yang terdiagnosis AIDS dan berisiko untuk mengalami infeksi opportunistic yang
serius seperti Pneumocystis pneumonia (PCP), Mycobacterium avium complex (MAC), dan citomegalovirus (CMV) (Piercy, 2006)
2.2.8 Diagnosis AIDS
Diagnosis definitif AIDS hingga saat ini masih belum ditetapkan, namun, diagnosis AIDS dibuat berdasarkan gejala klinis. Center for Disease Control’s (CDC) awalnya membuat definisi AIDS berdasrkan adanya Kaposi Sarcoma yang terbukti dengan biopsy pada individu yang berusia kurang dari 60 tahun dan atau dengan adanya Pneumocystis carinii Pneumonia (PCP) atau infeksi opportunistic lainnya pada individu dengan penyakit mendasar immunosupresif yang belum jelas dan positif terinfeksi HIV. Kemudian, definisi AIDS diperluas menjadi beberapa penyakit berikut ini yang disertai dengan adanya antibodi HIV-1, yaitu : histoplasmosis disseminated, isosporia yang menyebabkan diare lama lebih dari satu bulan, candidiasis pulmonary, atau infeksi paru yang disebabkan oleh jamur tertentu, nonHodgkin’s lymphoma, dan pneumonia tertentu (Hammili et al., 2004).
Definisi AIDS terbaru berdasarkan revisi CDC terbaru adalah sebagai berikut :
1. Jika tanpa disertai bukti laboratoris infeksi HIV, baik itu pemeriksaan laboratorium tidak dilakukan maupun tidak memberikan hasil yang dapat disimpulkan dan juga tidak didapatkan penyebab lain dari immunodeficiency, maka berikut salah satu dari penyakit di bawah ini yang mengindikasikan AIDS :
a. Candidiasis Esofagus, trachea, bronchus, atau paru paru b. Cryptococcosis, extrapulmonal
c. Cryptosporidiosis dengan diare yang berlangsung hingga 1 bulan d. Penyakit cytomegalovirus yang mengenai organ tubuh selain liver,
limpha, atau limfonodi pada penderita dengan usia lebih dari 1 bulan
e. Infeksi Herpes Simplex Virus yang menyebabkan ulserasi mukokutan yang bertahan lebih dari 1 bulan ; atau bronchitis, pneumonia, atau esofagitis dengan variasi durasi yang mengenai penerita lebih dari usia 1 bulan
f. Sarcoma Kaposi yang mengenai penderita berusia kurang dari 60 tahun
g. Limfoid interstitial pneumonia dan atau pulmonary lymphoid hyperplasia (LIP/PLH complex) mengenai anak usia dibawah 13 tahun
h. Mycobacterium avium complex atau penyakit M kansasii i. Pneumocystis carinii pneumonia
j. Leukoencephalopaty multifocal progresif
k. Toksoplasmosis otak yang mengenai penderita berusia lebih dari 1 bulan.
2. Jika disertai dengan bukti laboratoris infeksi HIV, tanpa memandang adanya penyebab lain dari immunodefisiensi, berikut salah satu dari penyakit yang mengindikasikan AIDS :
a. Infeksi bakteri, multiple atau berulang (atau kombinasi keduanya dalam tempo 2 tahun), dari tipe tipe penyakit berikut ini yang mengenai anak berusia dibawah 13 tahun : septicemia, pneumonia, meningitis, infeksi tulang atau sendi, atau abses organ internal atau rongga tubuh (tidak termasuk otitis media atau abses mukosa atau kulit superficial), yang disebabkan oleh Haemophillus,
Streptococcus (termasuk Pneumococcus), atau bakteri piogenik
lainnya.
b. Coccidiodomycosis, disseminated
c. HIV enscephalopaty (atau disebut juga dengan HIV dementia, AIDS dementia, atau encephalitis subakut yang disebabkan oleh HIV)
d. Histoplasmosis, disseminated
e. Isosporiasis dengan diare lebih dari 1 bulan f. Sarcoma Kaposi pada usia berapapun
g. Limfoma dari otak (primer) pada usia berapapun h. Penyakit mikrobakterial apapun yang disebabkan oleh
mycobacteria selain M. tuberculosis, disseminated
i. Penyakit yang disebabkan oleh M. tuberculosis, extrapulmonary (melibatkan sedikitnya satu sisi diluar paru paru, tanpa memadang apakah ada bagian paru paru yang terlibat)
j. Salmonella (nontyphoid) septicemia, berulang
k. HIV wasting syndrome (kurus,“slim disease”)
l. Limfoma non-Hodgkin lainnya dari sel B atau fenotip immunologis yang tidak diketahui dan berikut beberapa tipe histologist :
Burkitt dan non-Burkitt lymphoma
sarcoma immunoblastic (yang ekuivalen dengan : limfoma immunoblastik, limfoma large-cell, diffuse histiocytic lymphoma, diffuse undifferentiated lymphoma, atau high-grade lymphoma)
(Hammili et al., 2004).
Jumlah CD4+ absolut dikategorikan ke dalam 3 bagian yaitu :
Kategori I : ≥ 500 sel/μl
Kategori II : 200 – 499 sel/μl
Kategori III : < 200 sel/μl
Kategori kategori tersebut sesuai dengan jumlah CD4+ absolut per mikroliter darah dan menjadi indikator klinis serta terapeutik dalam manajemen individu yang terinfeksi HIV. Oleh karena itu, individu yang terinfeksi HIV perlu diklasifikasikan ke dalam kategori tersebut dalam manajemen HIV (Hammili et al., 2004).
2.2.9 Manajemen infeksi HIV/AIDS selama kehamilan
Penanganan wanita hamil yang terinfeksi HIV membutuhkan perhatian khusus dan juga perlu dilakukan oleh tenaga medis khusus yaitu ahli kebidanan dan ahli penyakit tropic dan infeksi khususnya infeksi HIV. Berikut ini adalah langkah langkah dalam manajemen infeksi HIV/AIDS selama kehamilan :
1. Pengawasan (Monitoring)
Langkah awal dalam perawatan adalah dengan mengawasi status imun lewat pemeriksaan kadar CD4+ dan viral loads. Meninjau resistensi virus terhadap obat obatan juga merupakan kunci utama dalam mengawasi regimen atau dosis. Pemeriksaan viral load dapat dilakukan tiap 3 hingga 4 bulan. Begitu keputusan untuk memulai pengobatan telah dimulai, pemeriksaan terhadap viral load harus dilakukan tiap bulan sampai virus tidak lagi terdeteksi dalam
darah dan kemudian frekuensi pemeriksaan viral load bisa dilanjutkan tiga hingga empat kali dalam kurun waktu 1 tahun. (Gibbs et al., 2008).
Rekomendasi waktu untuk memulai pengobatan telah banyak mengalami perubahan demi perubahan selama beberapa tahun terakhir, oleh karena tingkat kepedulian yang sangat tinggi selain keuntungan dari pengobatan, namun juga pengenalan yang baik terhadap toksisitas obat tersebut. Guidelines terbaru menyebutkan pengobatan awal Highly Active AntiRetroViral Treatment (HAART) dimulai pada wanita yang tidak hamil jika jumlah viral load > 100.000 kopi, atau ketika jumlah CD4+ absolut < 350 sel/mm3 (Gibbs et al., 2008)
Meskipun dikatakan bahwa secara garis besar pengobatan wanita hamil sama dengan wanita yang tidak hamil, namun ada beberapa terapi antivirus yang perlu dimodifikasi atas dasar pertimbangan perkembangan janinnya. Salah satunya adalah Efavirenz yang merupakan golongan non- nucleoside reverse transcriptase harus diganti. Pada penelitian experimental dengan monyet betina hamil didapatkan janin yang mengalami anensephaly, anophtalmia dan bibir sumbing yang diamati 3 dari 13 binatang coba. Selain itu, Amprenavir juga dikontraindikasikan sebab mengandung propylene glycol yang sulit dimetabolisme oleh ibu hamil. Namun, potensi dari antivirus juga perlu dipertimbangkan dalam melawan risiko transmisi intrauterine, serta progresifitas dari imunodefisiensi dan atau rebound dari titer HIV. Maka dari itu dalam mengulang kembali pengobatan, dosis harus dibagi lagi secara simultan. (Gibbs et al., 2008)
2. Pemeriksaan Resistensi
Pemeriksaan resistensi telah menjadi hal yang pokok dalam perawatan penderita yang terinfeksi HIV. Virus RNA di reverse transkripsi kan oleh virus reverse transcriptase lewat penggunaan molekul tRNA lysine di sel sebagai primernya, kemudian aktivasi RNAase dari reverse transcriptase mendegradasi template dari virus RNA. Reverse transcriptase menggabungkan nukleotida secara tidak benar pada tiap 1500 hingga 4000 basa, yang menjelaskan proses mutasi yang dapat terjadi secara cepat.
Beberapa dari hasil mutasi menyediakan beberapa keuntungan yang
menyebabkan strain strain yang resisten terhadap obat. Banyak bukti bahwa mutan yang resisten dapat bertahan selama kurun waktu yang tidak dapat ditentukan setelah infeksi awal, varian virus tersebut dapat terdeteksi lewat pemeriksaan standart yang digunakan dalam praktek sehari hari. Maka dari itu, pemeriksaan resistensi HIV sekarang direkomendasikan pada semua penderita sebelum memulai pengobatan (Gibbs et al., 2008)
Pemeriksaan resistensi direkomendasikan pada individu sebelum pengobatan dimulai atau setelah gagal dalam pengobatan. Kegagalan dalam pengobatan didefiniskan sebagai kegagalan untuk mencapai kadar virus yang tidak terdeteksi atau virus yang muncul kembali setelah tidak terdeteksi (Gibbs et al., 2008).
Baru baru ini didapatkan 2 jenis pemeriksaan resistensi yaitu tes fenotip dan genotip yang masing masing mempunyai keuntungan dan kerugian masing masing. Pemeriksaan fenotip membandingkan kemampuan virus dalam bereplikasi dalam konsentrasi yang berbeda beda pada obat antiretrovirus dengan kemampuannya bereplikasi saat ditidak di beri obat. Sedangkan pada pemeriksaan genotip, secara langsung dapat mendeteksi mutasi gen yang mengkode enzim reverse transcriptase dan pembentukan protease oleh virus.
Sehingga inti mutasi virus akan menghasilkan substitusi asam amino dalam protein yang diproduksi, contohnya reverse transcriptase atau protease (Gibbs et al., 2008).
Selama kehamilan, pemeriksaan resistensi obat anti HIV direkomendasikan pada beberapa wanita. Seluruh wanita hamil yang baru baru ini tidak mendapatkan pengobatan antiretrovirus harus dilakukan pemeriksaan sebelum memulai pengobatan baru atau profilaksis. Selain itu, seluruh wanita hamil yang menerima terapi antiretrovirus selama antenatal dan mengalami kegagalan virologist dengan terdeteksinya HIV RNA yang persisten atau yang mengalami supresi virus suboptimal setelah dimulainya terapi antiretrovirus harus melakukan pemeriksaan tersebut. Namun, dalam beberapa kasus tertentu seperti diagnosis HIV yang terlambat, inisiasi empiris dari terapi antiretrovirus sebelum pemeriksaan resistensi boleh dilakukan. Penggunaan HAART kombinasi untuk memaksimalkan supresi replikasi virus selama kehamilan merupakan strategi paling efektif untuk mencegah perkembangan resistensi dan untuk meminimalkan risiko transmisi perinatal (Gibbs et al., 2008).
3. Terapi AntiRetroVirus
Pengobatan dianjurkan pada seluruh wanita hamil yang terinfeksi HIV, termasuk bagi mereka yang belum pernah mendapatkan pengobatan sebelum hamil. Pengobatan dengan Antiretrovirus akan menurunkan risiko transmisi perinatal tanpa memandang jumlah CD4+ absolut atau HIV RNA. Namun, ada satu literature menyebutkan bahwa terapi ARV baru diberikan jika kadar HIV-1 RNA lebih dari 1000 kopi/ml. (Cunningham, 2010).
Menurut Guideline pokok yang dikeluarkan oleh U.S.Public Healths Service Task force tahun 2009, ibu hamil yang telah mengkonsumsi HAART saat
hamil didorong untuk melanjutkan regimen jika didapati supresi virus yang adekuat. Namun, seperti yang dijelaskan sebelumnya, ada perkecualian jenis HAART yang tidak boleh dikonsumsi saat hamil oleh karena efek teratogeniknya yaitu efavirenz. Hingga saat ini, penambahan zidovudine pada seluruh regimen di rekomendasikan. Zidovudine diberikan secara intravena pada seluruh wanita, saat inpartu dan saat persalinan (Cunningham, 2010).
4. Penilaian Laboratoris
Pengukuran jumlah sel Limfosit T CD4+, viral load HIV RNA, darah lengkap dan tes fungsi liver dilakukan dalam waktu 4 minggu setelah terapi dimulai atau perubahan terapi untuk menilai respon serta bukti dari toksisitas. Oleh karena itu, pemeriksaan HIV RNA viral load dilakukan tiap trimester. Jika HIV RNA viral load meningkat atau tidak menurun, maka perlu dinilai kepatuhan dalam pengobatan dan resistensi obat (Cunningham et al, 2010).
5. Pemilihan Rute Persalinan
Dari beberapa penelitian didapatkan rute persalinan dengan sectio caesaria elektif sebelum muncul tanda inpartu maupun sebelum pecah ketuban dapat menurunkan secara signifikan kejadian transmisi perinatal HIV-1.
Dan mengingat setidaknya 40% hingga 80% transmisi HIV perinatal terjadi saat intrapartum, maka berdasarkan data tersebut, ACOG menyimpulkan
bahwa wanita hamil terinfeksi HIV wajib dijadwalkan untuk sectio caesaria elektif untuk menurunkan transmisi perinatal, meskipun telah mendapatkan regimen ZDV. ACOG juga menyarankan penjadwalan sectio caesaria pada usia kehamilan 38 minggu dan amniosintesis tidak boleh dilakikan untuk mencegah kontaminasi cavum amnion oleh antigen virus dari darah ibu.
Mereka juga menyarankan pemberian antibiotika profilaksis oleh karena tingginya risiko infeksi paska operasi (Gibbs et al., 2008; Hammilil et al., 2004).
2.2.10 Komplikasi HIV/AIDS
Manajemen terhadap komplikasi HIV dapat berubah akibat kehamilan. Jika jumlah CD4+ absolut < 200 sel/mm3, profilaksis utama terhadap P.carinii Pneumonia direkomendasikan dengan sulfomethoxazole-trimethoprim atau dapson. Gejala infeksi opportunistik lainnya yang dapat berkembang adalah dari infeksi laten atau infeksi baru toksoplasmosis, herpes virus, mycobacteria dan candida (Cunningham et al., 2010).
2.3 Limfosit T Cluster Diffrentiation 4+ (CD4+) 2.3.1 Definisi
CD (Cluster Diffrentiation) 4+ adalah klasifikasi mayor dari limfosit T, yang terdapat pada sel yang membawa antigen CD4+, kebanyakan adalah sel T helper.
Atau dari literatur lain menyebutkan CD4+ sebagai suatu glikoprotein yang diekspresikan pada permukaan sel T helper, sel T regulatory, monosit, makrofag dan sel dendritik. Protein CD4+ dikode oleh gen CD4+ (Anonymus, 2009)
Atau dari literatur lain disebutkan bahwa CD4+ merupakan sistem imun manusia yang bersifat general. Sel sel tersebut menghantarkan sinyal untuk mengaktivasi respon imun tubuh ketika mendeteksi adanya “ penyusup “ seperti virus dan bakteri (anonymus, 2010)
2.3.2 Struktur
Seperti kebanyakan dari reseptor atau marker dari permukaan sel lainnya, CD4+
merupakan anggota dari superfamily immunoglobulin. CD4+ memiliki 4 domain immunoglobulin (D1 hingga D4) yang berada di permukaan ekstraselluler dari sel, yaitu :
D1 dan D3 yang menyerupai domain immunoglobulin variable (IgV)
D2 dan D4 yang menyerupai domain immunoglobulin constant(IgC)
CD4+ menggunakan domain D1 nya untuk berinterakasi dengan β-2 domain dari molekul MHC kelas II. Sel T hanya mengekspresikan molekul CD4+ pada permukaannya (tidak mengekspresikan CD8), oleh karena itu, CD4+ spesifik untuk antigen yang dipresentasikan oleh MHC II dan tidak oleh MHC kelas I. Ekor pendek sitoplasmik/intraselluler dari CD4+ mengandung urutan spesifik asam amino yang berfungsi untuk berinteraksi dengan molekul moleku seperti yang telah dijelaskan diatas (Anonymus, 2010).
2.3.3 Fungsi
CD4+ merupakan koreseptor yang membantu reseptor sel T atau T cell receptor (TCR) dengan Antigen Presenting Cell (APC). Dengan menjalankan perannya saat berada dalam sel T, CD4+ memperkuat sinyal yang dibentuk oleh TCR dengan
menarik enzim yang dikenal sebagai tyrosine kinase Ick, yang penting untuk mengaktivasi banyaknya molekul yang terlibat dalam sinyal cascade pada sel T yang teraktivasi. CD4+ juga berinteraksi secara langsung dengan molekul MHC kelas II pada permukaan APC menggunakan domain ekstrasellulernya. Dengan begitu CD4+
berperan penting bagi tubuh untuk melawan infeksi. Selain itu juga membantu mencegah infeksi opportunistic dan komplikasi yang terjadi akibat infeksi HIV (Anonymus, 2010).
2.3.4 Jumlah CD4+ Absolut
Oleh karena peranannya yang besar dalam imunitas tubuh, maka penting bagi tubuh untuk mempertahankan jumlah CD4+ absolut dalam batas normal. Adapun batasan normal jumlah CD4+ absolut adalah 500 sel/mm3 sampai 1000 sel/mm3. Batasan tersebut dipakai sebagai tolak ukur CDC untuk merekomendasikan pengobatan HIV, kecuali jika didapatkan kondisi khusus seperti kehamilan, usia muda, acute retroviral syndrome, dll. (Anonymus, 2010)
Berdasarkan guideline terbaru dari U.S. Department of Health and Human Services menyarankan pengobatan ARV pada jumlah CD4+ absolut < 350 sel/mm3.
Hal ini disebabkan karena infeksi opportunistic dapat mengenai individu pada kadar CD4 tersebut. Maka atas dasar itu jumlah CD4+ absolut dipakai sebagai penentu staging dari HIV. Namun, pada pendekatan terapi yang lebih agresif disarankan pengobatan ARV dimulai pada saat jumlah CD4+ absolut < 500 sel/mm3. (Irwin, 2001).
Jumlah CD4+ absolut < 200 sel/mm3 merupakan salah satu kualifikasi dalam mendiagnosis AIDS. Jumlah CD4+ absolut dapat bervariasi dari hari ke hari, dan sangat dipengaruhi oleh waktu pengambilan sampel atau adanya penyakit infeksi lain seperti flu atau penyakit menular seksual (Anonymus, 2010).
2.3. 5 Faktor Faktor yang mempengaruhi penurunan jumlah CD4+ absolut Rendahnya jumlah CD4+ absolut sangat berhubungan dengan kondisi kondisi klinis sebagai berikut yaitu, infeksi virus seperti mononucleosis yang disebabkan oleh citomegalovirus (CMV), hepatitis B, herpes simplex virus, mumps, measles, respiratory synctyial virus, rubella, parvovirus, infeksi bakteri seperti pneumonia,
pyelonefritis, abses, luka infeksi, sellulitis dan sepsis, tuberculosis pneumonia, infeksi parasit seperti malaria, multiple organ failure, hipertensi, obat obatan antihipertensi, penyakit jantung, luka bakar, trauma, injeksi protein asing intravena, hemofillia, malnutrisi, kelelahan, dan kehamilan. (Bruder et al.,2004;Kenneth et al., 2010; Irwin, 2001)
Pada kehamilan, Burns et al menggunakan prosentase CD4+ dalam penelitiannya dalam membandingkan CD4+ wanita hamil yang terinfeksi dan tidak terinfeksi HIV oleh karena nilai yang didapatkan lebih akurat dibandingkan dengan jumlah CD4+ absolut sebab adanya peningkatan volume darah selama kehamilan yang merupakan faktor perancu dalam penelitiannya. Dan dari penelitian tersebut ditemukan bahwa prosentase CD4+ pada wanita hamil yang tidak terinfeksi HIV mengalami penurunan dibanding sebelum hamil, namun pada wanita hamil yang
terinfeksi HIV, penurunan prosentase CD4+ jauh lebih banyak dibandingkan dengan wanita hamil normal yang sulit untuk terkoreksi saat pasca persalinan (Irwin, 2001).
2.3.5 Perubahan fungsi hematologis selama kehamilan 2.3.5.1 Volume darah
Selama kehamilan, terjadi peningkatan volume darah yang diawali pada trimester pertama, kemudian pada usia kehamilan 12 minggu, volume darah meningkat sebesar 15 % dibandingkan dengan sebelum hamil. Kemudian meningkat secara cepat selama trimester kedua dan meningkat secara perlahan pada trimester ketiga hingga mencapai puncaknya pada usia kehamilan 32-34 minggu. Rata rata total peningkatannya adalah sebesar 40 hingga 45% yang sebagian besar dari peningkatan tersebut tersebut terjadi akibat cascade effect yang dipicu oleh perubahan hormonal selama kehamilan. Contohnya, peningkatan produksi estrogen oleh plasenta merangsang sistem renin angiotensin, yang akhirnya memicu peningkatan kadar aldosterondalam darah. Aldosteron memicu reabsorbsi natrium oleh ginjal dan retensi air. Progesteron juga disebut berperan dalam peningkatan volume darah meskipun mekanisme penyebabnya masih belum jelas, walaupun peningkatan kapasitas vena menjadi factor penting yang ikut berperan. Human chorionic somatomammotropin, progesteron, dan beberapa hormon lainnya juga berperan dalam memicu eritropoeisis sehingga menyebabkan peningkatan jumlah eritrosit sebanyak 30%. Oleh karena itu, peningkatan volume darah terjadi bukan hanya karena peningkatan jumlah plasma darah saja, namun juga peningkatan eritrosit, meskipun jumlah plasma yang bertambah lebih banyak dari pada jumlah eritrosit. Peningkatan volume eritrosit
berkisar 450 ml. Jumlah peningkatan volume darah bervariasi tergantung pada index massa tubuh wanita, jumlah kehamilan sebelumnya dan jumlah janin. Hipervolemia tersebut akan mengkompensasi jumlah darah yang hilang saat persalinan, yang berkisar antara 500-600 ml untuk persalinan pervaginam dan 1000 ml untuk persalinan sectio caesaria (Cunningham et al., 2010; DeCherney et al, 2006)
2.3.5.2 Konsentrasi hemoglobin dan hematokrit
Oleh karena banyaknya penambahan plasma darah, konsentrasi hemoglobin dan hematokrit agak menurun selama kehamilan. Akibatnya, viskositas darah menurun. Konsentrasi hemoglobin saat aterm rata rata 12,5 g/dl, dan rata rata 5%
wanita dibawah 11.0 g/dl (Cunningham et al., 2010; DeCherney et al, 2006) 2.3.7 Perubahan fungsi hematologis saat pasca persalinan
2.3.7.1 Volume darah
Lekositosis dan trombositosis dapat terjadi saat dan setelah persalinan. Sel darah putih kadang kadang dapat mencapai 30.000/μl. Selain itu juga didapatkan limfopenia relative dan eosinopenia absolut. Secara normal, selama beberapa hari awal paska persalinan, konsentrasi hemoglobin dan hematokrit mengalami fluktuasi sedang. Jika kedua kadar tersebut menurun hebat, maka didapatkan banyak darah yang hilang saat persalinan (Cunningham et al., 2010)
Meskipun belum secara luas diteliti, pada sebagian besar wanita, volume darah hampir mencapai kadar sebelum hamil pada saat 1 minggu pasca persalinan. Curah jantung umumnya tetap meningkat saat 24 hingga 48 jam pasca persalinan dan menurun seperti kadar sebelum hamil dalam waktu 10 hari. Denyut jantung juga
berubah mengikuti pola tersebut. Resistensi pembuluh darah sistemik pun juga masih tetap pada kadar yang rendah dalam tempo 2 hari paska persalinan, kemudian meningkat perlahan setelah itu (Cunningham et al., 2010)
Volume darah total secara normal menurun dari volume sebesar 5-6 L saat antepartum menjadi 4 L pada minggu ketiga paska persalinan. Sepertiga dari penurunan tersebut terjadi saat persalinan dan segera setelah itu dalam jumlah yang sama hilang pada akhir minggu pertama paska persalinan. Selain itu ada pula variasi yang terjadi saat laktasi. Hipervolemia kehamilan dianggap sebagai mekanisme pelindung yang menyebabkan sebagian besar wanita untuk dapat mentoleransi hilangnya darah yang banyak saat persalinan. Jumlah darah yang hilang saat persalinan umumnya menentukan volume darah dan hematokrit saat masa nifas.
Seperti yang dijelaskan sebelumnya, bahwa persalinan normal bayi tunggal akan mengeluarkan darah sebayak 500-600 ml, dan dari literature lain ada yang menyebutkan 400 ml. Sedangkan sectio caesaria akan menyebabkan hilangnya darah hampir mencapai 1 L. Jika dilakukan histerektomi total pada saat persalinan sectio caesaria, rata rata kehilangan darah dapat mencapai 1500 ml. Kelahiran kembar dua dan tiga akan menyebabkan kehilangan darah yang sama dengan persalinan operatif, namun hilangnya darah tersebut juga dikompensasi dengan peningkatan volume darah maternal dan massa sel darah merah pada kehamilan multiple yang lebih banyak dibandingkan dengan kehamilan tunggal (DeCherney et al., 2007)
Penyesuaian yang cepat dan tertata terjadi pada pembuluh darah maternal setelah persalinan, sehingga respon terhadap hilangnya darah selama awal nifas