4 BAB II
TINJAUAN PUSTAKA
2.1 Tanaman Nagasari (Calophyllum nagassarium Burm.f.)
Nagasari merupakan tanaman hijau, berupa pohon berukuran sedang, tinggi dapat mencapai 36 m, batang lurus, diameter dapat mencapai 95 cm, sering bercabang di bagian bawah. Permukaan batang beralur panjang, terdapat sisik dan retakan yang tidak beraturan berwarna coklat pudar hingga abu-abu dengan sedikit warna ungu, terdapat eksudat berwarna putih hingga kuning pucat dan menjadi lebih gelap jika terpapar lama (Yuniarti et al, 2001).
Nagasari memiliki cabang mendatar atau merunduk, arah daun mendatar atau bergantung, daun muda terlihat seperti merah bersinar. Daun bersilangan, tunggal, tepi daun rata, berbentuk lonjong, berukuran 4,5-12,5 x 1-4 cm, pangkal daun runcing, berwarna hijau kebiru-biruan dengan bagian bawah putih, urat daun tidak jelas, panjang tangkai daun 4-8 mm. Bunga tunggal atau sepasang, diameter hingga 9 cm, terdapat di ujung ranting atau di ketiak daun, daun mahkota berjumlah 4, berwarna putih atau merah muda, daun kelopak berjumlah 4, berwarna hijau, menempel kuat, beberapa membesar dan menebal pada buah, benang sari banyak, bakal buah menumpang pada dasar bunga, terdapat 1-2 rongga, setiap rongga terdiri dari 1-2 bakal biji (Yuniarti et al., 2001).
Berdasarkan sistem klasifikasi, tumbuhan nagasari dapat diklasifikasikan sebagai berikut:
Kingdom : Plantae (Tmbuhan)
Divisio : Spermatophyta (Tumbuhan berbunga) Sub Divisio : Angiospermae (Tumbuhan berbiji tertutup)
Kelas : Dicotyledoneae (Tumbuhan berkeping dua / dikotil)
Ordo : Theales
Suku : Gutiferrea Marga : Mesua
Jenis : Mesua ferrea L sinonim Calophyllum nagassarium Burm.f.
Tumbuhan nagasari sering dimanfaatkan sebagai sebagai tanaman obat seperti antiseptik, pencahar, pembersih darah, kontrol cacing, tonik. Di Thailand tumbuhan nagasari di manfaatkan untuk mengobati demam, dingin, asma, ekspektoran, kardiotonik, diuretik dan agen antipiretik, sedangkan daunnya sering digunakan sebagai obat sengatan kalajengking dan gigitan ular.
2.2 Kandungan Kimia dalam Daun Nagasari
Kandungan kimia daun nagasari hasil uji pendahuluan adalah saponin, polifenol, alkaloid dan terpenoid.
2.2.1 Saponin
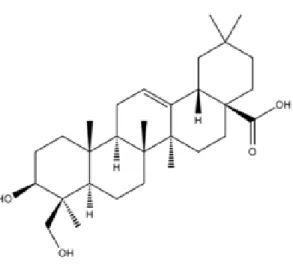
Saponin merupakan glikosida tumbuhan baik dari triterpen maupun sterol. Saponin merupakan glikosida tumbuhan yang dapat membentuk busa dalam air. Saponin berdasarkan golongan sapogeninnya diklasifikasikan menjadi 2 yaitu saponin steroid dan saponin triterpen. Adanya saponin dalam sampel dapat dilihat dari terbentunya busa yang stabil. Salah satu contoh saponin dapat dilihat pada Gambar 2.1. Saponin bersifat racun masuk ke dalam pembuluh darah akan mengalami hemolisis karena bereaksi dengan kolesterol pada membran sel darah merah. (Harbone, 1987)
Hederagenin
Gambar 2.1 Struktur Sapogenin ( Harbone, 1987)
Saponin yang memberikan aktivitas antikanker adalah Saponin ginsenosides, dengan menghambat penyebaran melalui pembuluh darah dengan mekanisme supresi inducer dalam sel endotel sehingga mencegah pelekatan (adhering), invasi, dan metastasis. Tubeimoside II mempunyai aktivitas anti kanker lebih besar dan
mempunyai efek samping yang lebih ringan dibandingkan dengan tubeimoside I karena tubeimoside II mempunyai gugus OH pada C 16, sedangkan tubeimoside I tidak. Dioscin merupakan suatu saponin steroid dan aglycone diosgenin mempunyai efek anti tumor dengan menghentikan siklus sel dan apoptosis (Robinson, 1995).
2.2.2 Polifenol
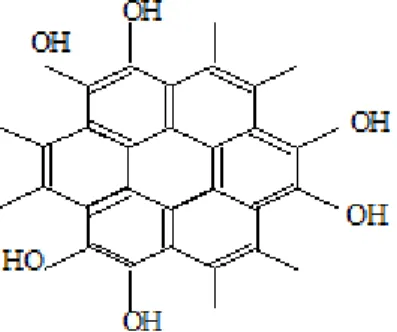
Senyawa fenolik merupakan senyawa yang memiliki inti aromatik yang terikat dengan satu atau lebih substituen hidroksil. Beribu-ribu senyawa fenol alam telah diketahui strukturnya dan senyawa ini memiliki struktur yang mirip dengan alkohol. Flavonoid merupakan golongan terbesar dari senyawa polifenol (Surveswaran, 2007 ; Harbone, 1987). Beberapa golongan primer yang termasuk senyawa polifenol adalah lignin, melanin, dan tanin. Tanin merupakan salah satu golongan senyawa polifenol yang tersebar luas dalam tumbuhan berpembuluh khususnya dalam jaringan kayu. Tanin dapat bereaksi dengan protein membentuk polimer yang stabil yang tak larut dalam air (Suradikusumah, 1989). Contoh senyawa polifenol tertera pada Gambar 2.2
2.2.3 Alkaloid
Alkaloid adalah senyawa bersifat basa yang mengandung satu atau lebih atom nitrogen dengan struktur lingkar (siklik). Pada umumnya alkaloid ditemukan dalam tumbuhan, tetapi tidak semua senyawa yang mengandung cincin heterosiklik nitrogen adalah alkaloid.
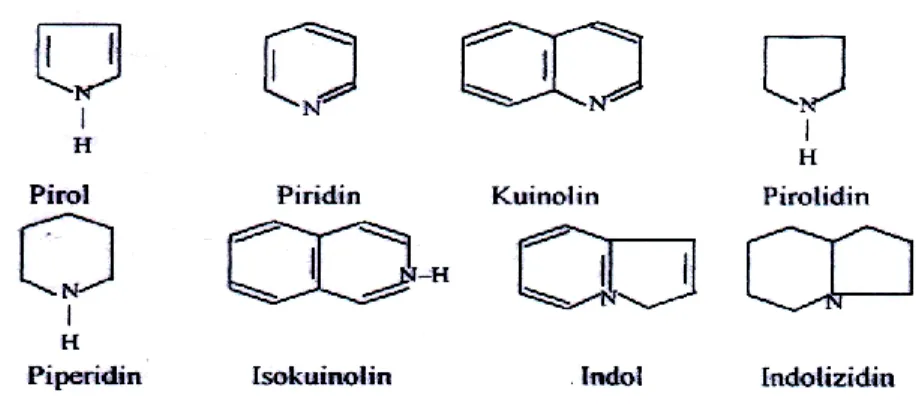
Klasifikasi alkaloid berdasarkan jenis cincin heterosikliknya terdiri atas : pirol, piridin, kuinolin, pirolidin, piperidin, isokuinolin, indol, dan indolizidin. Struktur alkaloid dapat dilihat pada Gambar 2.2 .
Gambar 2.3 Kerangka penyusun alkaloid
2.2.4 Terpenoid
Terpenoid adalah senyawa yang berasal dari molekul isopren dan kerangka karbonnya dibentuk dari gabungan dua atau lebih unit isoprennya. Senyawa ini diklasifikasikan menurut jumlah isoprennyamenjadi monoterpenoid, seskuiterpenoid, diterpenoid, triterpenoid dan politerpenoid (Soetarno, 1990). Struktur unit isopren dapat dilihat pada Gambar 2.4.
Gambar 2.4 Struktur unit isoprene
Terpenoid merupakan senyawa yang sebagian besar mempunyai struktur siklik dengan satu atau lebih gugus fungsionalnya yang kebanyakan merupakan suatu alkohol, aldehid atau asam karboksilat. Asam abisat merupakan terpenoid karboksilat yang mempunyai peranan penting pada tanaman yaitu sebagai regulator pertumbuhan. Asam Absisat seperti dipaparkan pada pada Gambar 2.5 berfungsi dalam menghambat pertumbuhan, hal ini dilakukan untuk membantu tumbuhan untuk bertahan dalam kondisi yang sulit, sehingga hormon absisat hanya diproduksi jika tumbuhan mengalamai kondisi seperti kekurangan air, pada musim dingin, musim kering, dan musim gugur sehingga terjadi proses-proses untuk menghambat pertumbuhan.
Gambar 2.5 Struktur asam absisat
2.3 Metode Analisis Tanaman
Isolasi senyawa metabolit sekunder yang terdapat dalam tanaman dilakukan melalui beberapa tahapan analisis meliputi: ekstraksi, pemisahan, pemurnian dan identifikasi (Harbone, 1987).
2.3.1 Ekstraksi
Ekstraksi merupakan suatu cara untuk menarik atau memindahkan sebagian atau seluruh komponen kimia yang terdapat dalam suatu sampel tumbuhan dengan pelarut yang sesuai (berdasarkan polaritas pelarut). Pemilihan metode ekstraksi yang tepat untuk bahan alam tergantung pada kandungan kimia tumbuhan dan jenis senyawa yang akan diisolasi (Harborne, 1987; Suradikusumah, 1989). Hal-hal yang harus diperhatikan pada pengambilan, penyimpanan, dan pengeringan sampel yang harus diperhatikan. Hal ini dimaksudkan agar tidak terjadi kontaminasi maupun degradasi senyawa yang akan diisolasi. Jaringan tanaman kering dihancurkan hingga berbentuk serbuk sebelum diekstraksi (Harborne, 1987). Pada tahap ekstraksi dapat dilakukan dengan metode maserasi, perkolasi atau sokhletasi. Teknik ekstraksi yang digunakan dalam penelitian ini adalah teknik maserasi. Maserasi adalah proses perendaman sampel untuk memisahkan komponen yang kita inginkan dengan kondisi dingin diskontinyu. Keuntungan dari maserasi adalah lebih praktis dan tidak memerlukan pemanasan sedangkan kekurangannya adalah pelarut yang digunakan relatif banyak. Filtrat yang diperoleh dari proses tersebut kemudian diuapkan dengan alat penguap putar vakum (rotary vacuum evaporator) pada tekanan rendah hingga menghasilkan ekstrak kental (Harborne, 1987; Suradikusumah, 1989).
2.3.2 Pemisahan dan pemurnian
Pemisahan dilakukan untuk memisahkan senyawa-senyawa yang terkandung dalam suatu sampel, sedangkan pemurnian bertujuan untuk memurnikan senyawa yang diperoleh dari hasil pemisahan. Ekstrak kental yang paling toksik dipisahkan
dan dimurnikan dengan teknik-teknik kromatografi. Umumnya pemisahan dan pemurnian dilakukan dengan menggunakan kromatografi lapis tipis (KLT) atau kromatografi kolom (Gritter et al., 1991; Hendayana, 2006).
Pemisahan kandungan kimia tumbuhan dapat dilakukan dengan beberapa metode di antaranya adalah partisi dan kromatografi kolom, sedangkan pemurnian dapat dilakukan dengan menggunakan kromatografi lapis tipis (KLT). Kromatografi adalah suatu proses pemisahan berdasarkan distribusi diferensial dari komponen sampel diantara dua fase yaitu fase diam (stationer phase), dan fase gerak (mobile phase). Fase gerak akan bergerak diantara sela-sela fase diam. Pergerakan fase ini mengakibatkan pergerakan diferensial dari komponen-komponen sampel (Gandjar, 2012).
2.3.2.1 Partisi (fraksionasi)
Partisi adalah suatu metode pemisahan yang digunakan untuk mengelompokkan senyawa-senyawa yang terdapat dalam ekstrak kasar berdasarkan tingkat kepolarannya. Partisi umumnya dimulai dengan pelarut nonpolar, kemudian dilanjutkan dengan pelarut semi polar dan terakhir dengan pelarut polar. Senyawa-senyawa non polar akan larut ke dalam pelarut non polar sedangkan Senyawa- senyawa-senyawa polar akan larut ke dalam pelarut polar (Harborne, 1987). Teknik yang paling umum untuk metode partisi adalah menggunakan corong pemisah dengan menggunakan dua pelarut yang tidak saling bercampur (Sudjadi, 1992).
2.3.2.2 Kromatografi lapis tipis (KLT)
Kromatografi Lapis Tipis (KLT) merupakan suatu teknik kromatografi yang sering digunakan dalam pemisahan campuran senyawa organik. KLT memiliki kelebihan yang nyata yaitu peralatan yang digunakan sederhana, waktu analisis yang cepat, ketajaman pemisahan yang besar dan kepekaan yang tinggi serta hanya menggunakan sampel dalam jumlah sedikit (Sudjadi, 1992).
Kromatografi Lapis Tipis merupakan suatu teknik pemisahan campuran senyawa dimana pemisahan terjadi karena adanya perbedaan afinitas masing-masing komponen terhadap fase diam dan fase gerak. Jenis interaksi yang terjadi pada teknik ini adalah adsorpsi. Komponen-komponen akan teradsorpsi diantara dua fase dan pemisahannya tergantung pada koefisien distribusi masing-masing komponen. Senyawa yang teradsorpsi lebih kuat dalam fase diam tidak akan bergerak jauh dibandingkan dengan senyawa yang teradsorpsi lebih lemah (Gritter et al., 1991).
Kromatografi Lapis Tipis adalah metode pemisahan fisikokimia. Fase diam pada KLT terdiri atas partikel-partikel halus yang ditempatkan pada penyangga berupa pelat gelas, logam, atau lapisan yang cocok. Campuran yang akan dipisahkan, berupa larutan, ditotolkan berupa bercak. Plat atau lapisan ditaruh di dalam bejana tertutup rapat yang berisi larutan pengembang yang cocok (fase gerak), pemisahan terjadi selama perambatan kapiler (pengembangan). Selanjutnya, senyawa yang tidak berwarna harus dideteksi dengan menggunakan sinar UV atau pereaksi penampak noda (Anwar, 2004).
Fase diam yang digunakan sebagai adsorben berupa partikel halus yang dilapiskan pada lempeng penyangga kaca, logam, atau plastik. Adsorben yang dapat
digunakan diklasifikasikan berdasarkan sifat kimia atau daya ikatannya. Adsorben pada KLT adalah analog dengan yang digunakan pada kromatografi kolom, hanya berbeda ukuran partikelnya. Fase diam yang bisa digunakan pada KLT antara lain silika gel, alumina, kieselguhr, selulosa, dan poliamida (Sudjadi, 1992).
Fase gerak ialah medium angkut dan terdiri atas satu atau beberapa pelarut, dimana pelarut multikomponen ini harus berupa satu campuran sesederhana mungkin yang terdiri atas maksimum tiga komponen (Anwar, 2004). Setelah elusi selesai, noda diamati dengan lampu UV atau pereaksi penampak noda. Noda-noda yang terbentuk diberi tanda dan karena pengaruh adsorpsi masing-masing senyawa berbeda-beda, maka hambatan pergerakan juga berbeda. Besarnya hambatan ditentukan dengan harga Retardation factor (Rf) (Gritter et al., 1991; Sudjadi, 1992).
pelarut uh Jarak temp komponen masing -masing uh Jarak temp Rf
Kromatografi lapis tipis selain digunakan pada proses pemurnian, sering juga digunakan untuk memilih pelarut atau kombinasi pelarut dalam kromatografi kolom yang dilakukan dengan membandingkan hasil kromatografi lapis tipis dari beberapa eluen. Eluen yang memberikan hasil pemisahan terbaik digunakan sebagai eluen dalam kromatografi kolom (Sudjadi, 1992)
2.3.2.3 Kromatografi kolom
Kromatografi kolom disebut juga kromatografi adsorpsi atau kromatografi elusi karena senyawa yang terpisah akan terelusi dari kolom. Kromatografi ini membutuhkan penyerap (fase diam) dalam jumlah relatif besar. Kromatografi ini
bertujuan untuk memisahkan komponen senyawa yang terkandung dalam suatu ekstrak ke dalam beberapa fraksi (Robinson, 1991).
Teknik kromatografi kolom didasarkan pada pemisahan komponen senyawa organik karena adanya perbedaan serapan masing-masing komponen zat pada fase diam. Sebagai fase diam biasanya digunakan silika atau alumina. Pada proses pemisahan ini, kolom diletakkan pada posisi vertikal dan dimasukkan glasswool untuk menyangga zat penyerap yang digunakan. Selanjutnya dimasukkan fase gerak terbaik yang diperoleh dari hasil KLT. Fase gerak dicampur dengan silika gel, diaduk hingga homogen dan menjadi bubur. Bubur ini dimasukkan ke dalam kolom sambil mengalirkan fase gerak sampai terjadi pemampatan sempurna (Sudjadi, 1992).
Zat yang akan dianalisis dimasukkan ke dalam kolom dengan pipet tetes melalui bagian atas kolom, kemudian dialiri fase gerak yang akan membawa komponen-komponen turun. Perbedaan serapan masing-masing komponen terhadap fase diam, menyebabkan terjadi pemisahan komponen. Komponen yang diserap lemah oleh fase diam akan keluar lebih cepat bersama fase gerak, sebaliknya komponen yang diserap kuat akan keluar lebih lambat. Idealnya zat yang terpisah membentuk pita-pita yang perlahan-lahan menuruni kolom dan akhirnya ditampung ke dalam sejumlah botol kecil, komponen dianalisis dengan KLT. Komponen yang memiliki pola noda dengan Rf yang sama dapat digabungkan dalam satu fraksi (Sudjadi, 1992).
2.4 Uji Toksisitas terhadap Larva Udang (Artemia salina L.)
Metode Brine Shrimp Lethality Test (BSLT) merupakan salah satu metode skrining untuk mengetahui toksisitas suatu ekstrak ataupun senyawa bahan alam (Sukardiman, 2004). Uji toksisitas ini dapat diketahui dari jumlah kematian larva
Artemia salina L. karena pengaruh perubahan ekstrak atau senyawa bahan alam pada
konsentrasi tertentu (McLaughlin et al., 1998). Penggunaan larva Artemia salina L. sebagai bioindikator pertama kali dilakukan pada tahun 1956. Penggunaan larva digunakan sebagai skrining umum untuk substansi bioaktif yang terdapat pada ekstrak tanaman (Meyer et al., 1982).
Uji toksisitas akut dengan hewan uji Artemia salina Leach dapat digunakan sebagai uji pendahuluan pada penelitian yang mengarah ke uji sitotoksik, karena ada kaitan antara uji toksisitas akut dengan uji sitotoksik jika harga LC50 dari toksisitas
akut < 1000 μg/mL (Meyer et al., 1982).
Toksisitas terhadap Artemia salina Leach yaitu merupakan uji toksisitas akut. Parameter yang digunakan untuk menunjukkan adanya aktivitas biologi suatu senyawa terhadap Artemia salina Leach adalah kematian. Senyawa-senyawa yang menunjukkan toksisitas yang tinggi dalam BSLT sering dikaitkan dengan potensinya sebagai antikanker. Penelitian menggunakan Artemia salina Leach sebenarnya tidak spesifik untuk antitumor atau aksi fisiologis tertentu, namun demikian jumlah yang signifikan dari sampel yang bersifat toksik terhadap Artemia salina Leach ternyata juga mempunyai aktivitas sitotoksik (Santi, 2009).
Metode pengujian dengan larva Artemia salina Leach merupakan cara yang paling efektif dan sederhana karena ketersediaan telur-telur larva yang mudah menetas,
pertumbuhannya cepat dan relatif mudah pengaturan populasinya pada kondisi laboratorium. Pengembangan metode ini didasarkan pada sifat khas dari larva udang yang dapat menerima segala jenis zat dan bahan tanpa seleksi terlebih dahulu, pengerjaannya mudah, cepat serta menggunkan sampel yang relatif sedikit. Metode ini dapat digunakan sebagai metode awal untuk menemukan komponen antikanker pada tumbuhan tingkat tinggi (Mclaughlin,1991 ; Santi, 2009).
Uji ini menggunakan larva Artemia salina L. yang telah berumur 48 jam yang diuji pada konsentrasi ekstrak 10 ppm, 100 ppm, dan 1000 ppm selama 24 jam. Pengulangan sebanyak 3 kali dilakukan setiap pengujian. Data mortalitas larva selanjutnya digunakan untuk mencari nilai LC50 (konsentrasi yang menyebabkan
kematian 50% larva). Apabila LC50 kurang dari 1000 ppm, maka dikatakan mempunyai
potensi bioaktivitas sebagai antikanker (Meyer et al., 1982).
2.5 Metode Identifikasi
Identifikasi suatu senyawa hasil isolasi (isolat) dilakukan dengan uji fitokimia dan analisis data fisikokimia dilakukan dengan mengukur spektrum-spektrum yang khas dengan menggunakan spektrofotometer. Dalam penelitian ini uji fisikokimia dilakukan dengan menggunakan spektrofotometer UV-Vis dan IR.
2.5.1 Identifikasi dengan uji fitokimia
Uji fitokimia terhadap isolat aktif dilakukan dengan menggunakan pereaksi-pereaksi yang spesifik terhadap suatu golongan senyawa. Pengerjaannya dapat dilakukan pada plat tetes atau tabung pereaksi yaitu dengan mereaksikan sedikit isolat dengan
pereaksi golongan senyawa tertentu. Perubahan warna yang terjadi tergantung dari pereaksi yang digunakan dan golongan senyawa apa yang terkandung didalamnya. Adapun pereaksi yang digunakan yaitu :
a. Pereaksi untuk golongan senyawa flavonoid.
- Pereaksi Wilstater, reaksi positif jika terjadi perubahan warna dari orange menjadi merah atau merah krimsom dan atau krimsom menjadi magenta tergantung jenis flavonoidnya.
- Peraksi Bate Smith-Metacalfe, reaksi positif jika terjadi perubahan warna merah yang konsisten.
b. Pereaksi untuk golongan saponin dilakukan dengan uji busa
- Positif saponin ditunjukkan dengan timbulnya busa yang stabil setelah pengocokkan dengan air panas dan penambahan HCL pekat.
c. Pereaksi untuk golongan senyawa fenolik
- Pereaksi FeCl3, reaksi positif jika terjadi perubahan warna dari hijau sampai
biru.
d. Pereaksi untuk golongan senyawa alkaloid
- Pereaksi Dragendorff, reaksi positif jika terbentuk endapan merah pada plat tetes atau tabung reaksi.
- Pereaksi Meyer, reaksi positif jika terbentuk endapan berwarna putih pada plat tetes atau tabung reaksi.
- Pereaksi Wagner, reaksi positif jika terbentuk endapan berwarna coklat pada plat tetes atau tabung reaksi.
e. Pereaksi untuk golongan senyawa steroid atau triterpen
- Pereaksi Lieberman-Bruchard, apabila terjadi perubahan warna hijau-biru menunjukkan positif steroid, dan perubahan warna merah ungu menunjukkan positif triterpenoid.
2.5.2. Identifikasi senyawa dengan spektrofotometer inframerah (IR)
Spektrofotometri inframerah merupakan suatu metode yang mengamati interaksi molekul dengan radiasi elektromagnetik pada daerah panjang gelombang 0,75 – 1.000 µm atau pada bilangan gelombang 13.000 – 10 cm-1. Spektrum inframerah dilihat dari segi aplikasi dan instrumentasinya dibagi dalam tiga jenis radiasi yaitu inframerah dekat dengan panjang gelombang 0,78 – 25 µm atau bilangan gelombang antara 12800 – 4000 cm-1, inframerah pertengahan mempunyai kisaran panjang gelombang di 2,5 – 50 µm atau bilangan gelombang antara 4000 – 200 cm-1, dan inframerah jauh antara 50 – 1000 µm atau kisaran bilangan gelombang antara 200 – 10 cm-1 (Silverstain et al.,1991).
Aplikasi spektrofotometri inframerah sangat luas baik untuk analisis kualitatif maupun kuantitatif. Penggunaaan yang paling banyak adalah pada daerah pertengahan dengan kisaran bilangan gelombang 4000 sampai 670 cm-1 atau dengan panjang gelombang 2,3 sampai 15 µm. Kegunaan yang paling penting dari spektrofotometri inframerah adalah untuk mengidentifikasi senyawa organik karena spektrum inframerah dari senyawa organik mempunyai sifat fisik yang karakteristik artinya senyawa mempunyai spektrum yang berbeda dengan lainnya. Pengukuran
dengan spektrofotometri inframerah adalah pengukuran frekuensi dimana vibrasi dan rotasi yang terjadi berhubungan dengan jumlah energi yang terserap pada frekuensi tersebut. Pengukuran energi yang terserap direkam sebagai transmitan sebagai fungsi panjang gelombang. Spektra setiap komponen senyawa adalah unik sehingga spektra inframerah disebut juga sebagai sidik jari dari komponen senyawa (Sastrohamidjojo, 1991 ; Silverstain et al.,1991).
Pada spektrofotometri inframerah terdapat 2 daerah serapan yaitu daerah gugus fungsi (stretching) dan daerah sidik jari (bending). Daerah serapan gugus fungsi pada 4000-1500 cm-1 sedangkan daerah serapan sidik jari pada 1500-800 cm-1. Ikatan dengan H seperti C-H, O-H, N-H berada pada serapan 3800-2700 cm-1, ikatan rangkap tiga seperti C≡C, C≡N berada pada serapan 2300-2000 cm-1
, ikatan rangkap dua seperti C=O, C=C, C=N, N=O berada pada serapan 1900-1500 cm-1, dan ikatan tunggal seperti C-C, C-O, C-N berada pada serapan 1300-800 cm-1 (Silverstain et al.,1991).
Senyawa terpenoid dapat dibagi menjadi tiga yaitu terpenoid alkohol, tepenoid aldehid dan terpenoid karboksilat. Terpenoid alkohol memberikan serapan O-H pada daerah bilangan gelombang 3550-3200 cm-1 dan serapan kuat C-O alkohol pada daerah bilangan gelombang 1260-1000 cm-1. Terpenoid aldehid mempunyai serapan khas C=O pada daerah bilangan gelombang 1740-1720 cm-1 dan serapan C-H aldehid pada daerah bilangan gelombang 2830-2695 cm-1. Terpenoid karboksilat memberikan serapan O-H pada daerah bilangan gelombang 3300-3200 cm-1, serapan
C=O pada daerah bilangan gelombang 1710-1680 cm-1 dan serapan C-H alifatik pada daerah bilangan gelombang 1440-1395 cm-1(Silverstain et al.,1991).
2.5.3 Identifikasi senyawa dengan spektrofotometer ultraviolet-sinar tampak (UV-VIS)
Spektrofotometri ultraviolet merupakan suatu metode analisis berdasarkan atas pengukuran serapan suatu larutan yang dilalui radiasi monokromatis ultraviolet. Apabila suatu molekul menyerap radiasi ultraviolet, di dalam molekul tersebut terjadi perpindahan elektron dari tingkat energi lebih rendah ketingkat energi yang lebih tinggi (terseksitasi). Panjang gelombang cahaya ultraviolet tergantung pada mudahnya promosi elektron akan menyerap radiasi ultraviolet pada panjang gelombang yang lebih pendek. Molekul yang memerlukan energi lebih sedikit akan menyerap pada panjang gelombang yang lebih panjang (Fessenden dan Fessenden, 1995).
Panjang gelombang cahaya UV dan tampak jauh lebih pendek daripada panjang gelombang radiasi inframerah. Satuan yang digunakan untuk panjang gelombang ini adalah nanometer ( 1 nm = 10-7 cm ). Spektrum tampak terentang dari sekitar 400 nm (ungu) sampai 750 nm (merah). Sedangkan spektrum ultraviolet terentang dari 200 sampai 400 nm (Fessenden dan Fessenden, 1995).
Spektra UV-vis dari senyawa – senyawa organik berkaitan erat dengan transisi – transisi diantara tingkatan energi elektronik tersebut. Transisi elektronik melibatkan orbital ikatan, orbital pasangan elektron bebas, dan orbital anti ikatan. Transisi – transisi yang biasanya terjadi yaitu σ→ σ* yang memerlukan energi lebih
tinggi, π → π*
, n → σ*, dan n → π*. Terjadinya transisi sangat dipengaruhi oleh adanya kromofor dan auksokrom. Kromofor digunakan untuk menyatakan gugus tak jenuh kovalen yang dapat menyerap radiasi dalam daerah UV-Vis. Auksokrom merupakan gugus jenuh yang terikat pada kromofor yang dapat mengubah panjang gelombang dan intensitas serapan maksimum (Cresswell et al.,1982; Silverstain et al.,1991).