ii
EFEK HIPOGLIKEMIK EKSTRAK DAUN BINAHONG
(Anredera baselloides Baill.) PADA TIKUS PUTIH JANTAN
TERBEBANI GLUKOSA
SKRIPSI
Diajukan untuk Memenuhi Salah Satu Syarat Memperoleh Gelar Sarjana Farmasi (S.Farm.)
Program Studi Farmasi
Oleh : Dessy Roseta Wijaya
NIM : 038114085
FAKULTAS FARMASI
UNIVERSITAS SANATA DHARMA
YOGYAKARTA
iii S K R I P S I
EFEK HIPOGLIKEMIK EKSTRAK DAUN BINAHONG
(Anredera baselloides Baill.) PADA TIKUS PUTIH JANTAN
TERBEBANI GLUKOSA
Oleh
Dessy Roseta Wijaya NIM : 038114085
Telah disetujui oleh
Dosen Pembimbing
iv S K R I P S I
EFEK HIPOGLIKEMIK EKSTRAK DAUN BINAHONG
(Anredera baselloides Baill.) PADA TIKUS PUTIH JANTAN TERBEBANI GLUKOSA
Dipersiapkan dan ditulis oleh Dessy Roseta Wijaya
v
HALAMAN PERSEMBAHAN
Ketika kuhadapi kehidupan ini, jalan mana yang harus kupilih,
kutahu kutak mampu, kutahu kutak sanggup,
hanya Kau Tuhan tempat jawabanku
Aku pun tahu ku tak pernah sendiri, sbab Engkau Allah yang menggendongku
tangan-Mu membelaiku, cinta-Mu memuaskanku,
Kau mengangkatku ke tempat yang tinggi
JanjiMu sperti fajar pagi hari, yang tiada pernah terlambat bersinar
Cinta-Mu sperti sungai yang mengalir, dan kutahu betapa dalam Kasih-Mu
Skripsi ini kupersembahkan untuk My Lord, Jesus Christ
Papa, Mama, O’oh Chandra, Lie-lie, Oyin, Riko,
vi
KATA PENGANTAR
Puji syukur penulis naikkan kepada Tuhan Yesus Kristus atas kasih dan hikmat-Nya sehingga penyusunan laporan skripsi ini dapat terselesaikan dengan baik. Laporan skripsi dengan judul “Efek Hipoglikemik Ekstrak Daun Binahong pada Tikus Putih Jantan Terbebani Glukosa” ini diajukan untuk memenuhi salah satu persyaratan mencapai gelar sarjana farmasi Program Studi Farmasi.
Keberhasilan penyusunan skripsi ini juga tidak lepas dari dukungan dari berbagai pihak yang telah membantu penulis hingga akhir penulisan laporan skripsi. Pada kesempatan ini penulis mengucapkan terima kasih kepada:
1. Ibu Rita Suhadi, M.Si., Apt., selaku Dekan Fakultas Farmasi Universitas Sanata Dharma Yogyakarta
2. Bapak Dr. Sabikis, Apt., selaku dosen pembimbing dalam penyelesaian skripsi. Bimbingan, nasihat, dan ilmu yang telah diberikan menjadi semangat dan sumber inspirasi seperti air yang mengalir dan tak pernah berhenti
3. Bapak Yosef Wijoyo, M.Si., Apt yang telah memberikan saran, semangat dan bersedia meluangkan waktu sebagai ketua panitia penguji dan dosen penguji
vii
5. Bapak Ign. Y. Kristio Budiasmoro, M.Si., dan Bapak Yohanes Dwiatmaka, M.Si., yang telah sangat membantu penulis selama determinasi tanaman 6. Bapak Ipang Djunarko S.Si., Apt dan Bapak Nunut R, S.Si, Apt yang telah
memberi saran dan membantu dalam pencarian bahan penelitian
7. Bapak Ir. Ig. Aris Dwiatmoko, M.Sc., yang telah membantu penulis dalam pengolahan statistik data.
8. Mas Kayat, mas Heru, mas Parjiman, mas Wagiran, mas Sarwanto, mas Andre, mas Sigit, mas Parlan, mas Kunto, mas Agung, dan mas Yuwono selaku laboran dan karyawan Fakultas Farmasi USD yang telah membantu penulis selama pelaksanaan penelitian di laboratorium
9. Keluarga tercinta: papa yang telah memberikan inspirasi judul skripsi ini, mama yang selalu setia mendampingi penulis, Chan-chan, Lie-lie dan Oyin yang telah memberi dukungan, serta semua keluarga besar dari pihak mama dan papa untuk doa yang telah diberikan kepada penulis
10. Riko Setyana Kurniawan dan keluarga yang telah memberikan ketenangan hati, semangat menulis dan belajar, serta fasilitas selama penulis menyelesaikan skripsi ini
viii
12. “XtraOrdinary Youth Zone”, khususnya Samuel untuk terjemahannya, Alex untuk statistiknya, Erick dan Ariyanto
13. Bp Pdt. Yusak Benyamin sekeluarga, yang selalu mendoakan penulis 14. Semua pihak yang tidak dapat penulis sebutkan satu-persatu.
Penulis berharap skripsi ini dapat berguna bagi pembaca sekalian. Akhir kata, penulis menyadari bahwa saran yang membangun akan bermanfaat untuk perbaikan bagi penulis. Terima kasih dan Tuhan Yesus memberkati.
ix
PERNYATAAN KEASLIAN KARYA
Saya menyatakan dengan sesungguhnya bahwa skripsi yang saya tulis ini tidak memuat karya atau bagian karya orang lain, kecuali yang telah disebutkan dalam kutipan dan daftar pustaka, sebagaimana layaknya karya ilmiah.
Yogyakarta, 11 Februari 2007
Penulis
x
INTISARI
Diabetes melitus merupakan salah satu penyakit yang cukup berbahaya. Selama ini pengobatan yang dilakukan dengan obat hipoglikemik oral membutuhkan biaya yang tidak murah dan digunakan dalam jangka waktu yang cukup lama sehingga tidak semua masyarakat dapat menjangkaunya. Sementara itu, fenomena ‘back to nature’ saat ini semakin berkembang luas di masyarakat. Maka muncullah pemikiran untuk membuktikan kebenaran manfaat ekstrak daun binahong sebagai obat diabetes melitus.
Penelitian ini merupakan penelitian eksperimental murni dengan rancangan acak lengkap pola searah. Efek hipoglikemik ekstrak daun binahong pada tikus putih jantan yang dibebani glukosa ditetapkan melalui uji toleransi glukosa oral (UTGO). Tiga puluh ekor tikus dibagi kedalam enam kelompok perlakuan. Kelompok I diberi aquadest 5 ml/kgBB sebagai kontrol negatif, kelompok II diberi larutan glibenklamida 0,45 mg/kgBB sebagai kontrol positif, dan kelompok III sampai VI diberi perlakuan ekstrak daun binahong dengan peringkat dosis 1,20 g/kgBB, 1,80 g/kgBB, 2,70 g/kgBB, dan 4,05 g/kgBB secara per-oral. Kadar glukosa darah ditetapkan dengan metode enzimatik Glucose Oxidase Phenol Antipirin (GOD-PAP). Data kadar glukosa darah pada tiap waktu sampling pada tiap kelompok dianalisis secara statistik menggunakan metode
GLM Repeated Measure. Sedangkan nilai LDDK0-300 glukosa darah dianalisis secara statistik menggunakan uji Kruskal Wallis dan kemudian dilanjutkan dengan uji Mann Whitney bertaraf kepercayaan 95%.
Hasil penelitian menunjukkan bahwa ekstrak daun binahong dengan dosis 1,20 g/kgBB sampai 4,05 g/kgBB memberikan penurunan kadar glukosa darah sebesar 10,85% sampai 23,67% terhadap kontrol negatif. Peringkat dosis 3 dan 4 memberikan efek penurunan kadar glukosa darah secara bermakna terhadap kontrol negatif. Dengan demikian dapat disimpulkan bahwa ekstrak daun binahong mempunyai efek hipoglikemik.
xi
ABSTRACT
Diabetes mellitus was one of those quite dangerous diseases. So far the use of oral hypoglycemic medicine as the treatment costs very much and it has to be used in long period so not all of people can afford it. Meanwhile, the phenomenon of “back to nature” has now been very popular in the society. As the result, came the research to prove the truth about the capability of the extract of Anredera baselloides Baill leave to be the alternative treatment to the disease.
This research was purely experimental with complete random pattern design. The hypoglycemic effect on male rat which had been given glucose was tested through Oral Glucose Tolerance Test (OGTT). Thirty mice were divided into six groups with six different kinds of treatment for each group. Group I was treated by aquadest 5 ml/kg bw as negative control, group II was treated by glibenclamide 0,45 mg/kg bw as positive control, group III, IV, V, and VI were treated extract of the leaves of Anredera baselloides Baill which have equivalent dosage 1,20 g/kg bw, 1,80 g/kg bw, 2,70 g/kg bw, and 4,05 g/kg bw, and all the dispention were per os. Blood glucose level was assayed with Glucose Oxidase Phenol Antipirin (GOD-PAP) enzymatic method. The data of blood glucose level from each sampling time on each group was statistically analyzed using GLM Repeated Measure design. The AUC0-300 of blood glucose was statistically analyzed using Kruskal Wallis test and then continued with Mann Whitney test with 95% level of convidence.
The result indicated that extract of the leaves of Anredera baselloides Baill with 1,2 g/kg bw until 4,05 g/kg bw dosages decreased the concentration of blood glucose from 10,85% until 23,67% to negative control. Level dosage 2,70 g/kg bw, and 4,05 g/kg bw decreased the concentration of blood glucose significantly to negative control. Thus, it can be concluded that extract of the leaves of
Anredera baselloides Baill has hypoglycemic effect.
xii
DAFTAR ISI
HALAMAN JUDUL ... ii
HALAMAN PERSETUJUAN PEMBIMBING ... iii
HALAMAN PENGESAHAN ... iv
HALAMAN PERSEMBAHAN... v
KATA PENGANTAR ... vi
PERNYATAAN KEASLIAN KARYA ... ix
INTISARI ... x
ABSTRACT ... xi
DAFTAR ISI ... xii
DAFTAR TABEL ... xvii
DAFTAR GAMBAR ... xix
DAFTAR LAMPIRAN ... xx
ARTI LAMBANG, SINGKATAN DAN ISTILAH ... xxi
BAB I PENGANTAR ... 1
A. Latar Belakang ... 1
1. Permasalahan ... 3
2. Keaslian penelitian ... 3
3. Manfaat penelitian ... 4
a. Manfaat teoritis ... 4
xiii
B. Tujuan Penelitian ... 4
1. Tujuan Umum ... 4
2. Tujuan Khusus ... 4
BAB II PENELAHAN PUSTAKA ... 5
A. Tanaman Binahong ... 5
1. Sinonim ... 5
2. Klasifikasi tanaman binahong ... 5
3. Morfologi tanaman binahong ... 6
B. Karbohidrat ... 7
C. Diabetes Melitus ... 8
1. Definisi ... 9
2. Gejala ... 11
3. Klasifikasi ... 12
4. Cara dan kriteria diagnosis ... 13
D. Teknik Uji Diabetik dan Metode Penetapan Kadar Glukosa Darah ... 15
1. Teknik uji diabetik ... 15
2. Metode penetapan kadar glukosa darah ... 16
E. Glibenklamida ... 17
F. Ekstrak ... 18
G. Spektrofotometri ... 19
xiv
BAB III METODOLOGI PENELITIAN ... 21
A. Jenis dan Rancangan Penelitian ... 21
B. Variabel Penelitian ... 21
1. Variabel utama ... 21
2. Variabel pengacau terkendali ... 21
3. Variabel pengacau tak terkendali ... 22
C. Bahan dan Alat Penelitian ... 22
1. Bahan penelitian ... 22
2. Alat penelitian ... 23
D. Jalannya Penelitian ... 23
1. Determinasi tanaman binahong ... 23
2. Pembuatan simplisia uji ... 24
a. pengolahan bahan ... 24
b. pembuatan ekstrak daun binahong ... 24
c. pascapengolahan ... 25
d. penetapan dosis ekstrak daun binahong ... 25
3. Preparasi bahan ... 26
a. pembuatan larutan asam benzoat 0,1% b/v ... 26
b. pembuatan larutan stock glukosa 10 mg/ml ... 26
c. sodium oksalat 2% b/v ... 26
d. penentuan keseragaman bobot kaplet glibenklamida ... 26
e. penentuan dosis glibenklamida ... 26
xv
4. Percobaan pendahuluan ... 27
a. penetapan waktu resapan stabil larutan glukosa murni ... 27
b. penetapan panjang gelombang maksimum ... 27
c. pembuatan kurva baku ... 27
d. penetapan waktu pemberian glibenklamida ... 28
e. penetapan waktu pemberian ekstrak daun binahong ... 28
f. pengelompokan dan perlakuan hewan uji ... 29
5. Penetapan kadar glukosa darah ... 30
E. Analisis Hasil ... 31
BAB IV HASIL DAN PEMBAHASAN ... 33
A. Determinasi Tanaman Binahong ... 33
B. Pembuatan Simplisia Uji dan Preparasi Bahan ... 33
C. Percobaan Pendahuluan ... 33
1. Waktu resapan stabil glukosa ... 33
2. Penetapan panjang gelombang maksimum ... 36
3. Pembuatan kurva baku ... 37
4. Penetapan waktu pemberian glibenklamida ... 39
5. Penetapan waktu pemberian ekstrak daun binahong ... 41
D. Efek Hipoglikemik Ekstrak Daun Binahong... 42
BAB V KESIMPULAN DAN SARAN ... 53
xvi
LAMPIRAN ... 57
xvii
DAFTAR TABEL
Tabel I. Nilai glukosa plasma puasa dan toleransi glukosa oral ... 14
Tabel II. Diagnosis GDM dengan pemberian glukosa oral 100 g atau 75 g ... 15
Tabel III. Isi pereaksi enzim glucose GOD-PAP ... 22
Tabel IV. Keseragaman bobot tablet ... 26
Tabel V. Volume pengukuran kadar glukosa darah ... 30
Tabel VI. Data hasil penetapan waktu resapan stabil larutan glukosa standar ... 35
Tabel VII. Hubungan kadar dan resapan glukosa pada λ maksimum 504 nm ... 38
Tabel VIII. Hasil UTGO dan perhitungan prosentase selisih LDDK0-300 larutan glibenklamida ... 39
Tabel IX. Hasil UTGO dan LDDK0-300 ekstrak daun binahong ... 41
Tabel X. Data kadar glukosa darah rata-rata dan LDDK0-300 setiap kelompok perlakuan ... 43
Tabel XI. Hasil analisis GLM Repeated Measure kadar glukosa darah ... 46
Tabel XII. Pengaruh praperlakuan ekstrak daun binahong terhadap LDDK0-300 kadar glukosa darah tikus putih jantan dan prosentase perbedaan terhadap kelompok negatif dan positif .... 48
xviii
Tabel XIV. Test Mean LDDK0-300keenam kelompok perlakuan dengan uji
Kruskal-Wallis ... 50 Tabel XV. Hasil uji Mann-Whitney LDDK0-300 glukosa darah tikus putih
xix
DAFTAR GAMBAR
Gambar 1. Metabolisme glukosa pada individu normal dan penderita
diabetes ... 7
Gambar 2. Transpor glukosa ... 8
Gambar 3. Rumus struktur glibenklamida ... 17
Gambar 4. Bagan alur analisis hasil kadar glukosa darah ... 32
Gambar 5. Bagan alur analisis hasil LDDK0-300 glukosa darah ... 32
Gambar 6. Reaksi enzimatik antara glukosa dan reagen GOD-PAP ... 34
Gambar 7. Grafik hubungan antara resapan dan waktu resapan stabil reaksi glukosa standar pada λ 500 nm ... 35
Gambar 8. Kurva hubungan antara λ dan resapan maksimum glukosa standar selama operating time ... 36
Gambar 9. Kurva baku glukosa pada λ maksimum 504 nm selama operating time ... 39
Gambar 10. Diagram pengaruh waktu pemberian glibenklamida terhadap % selisih LDDK ... 40
Gambar 11. Diagram pengaruh waktu pemberian ekstrak daun binahong ... 41
Gambar 12. Kurva hubungan antara waktu sampling dan kadar rata-rata glukosa darah akibat pemberian aquadest, glibenklamida, dan ekstrak daun binahong ... 44
xx
DAFTAR LAMPIRAN
Lampiran 1. Determinasi tanaman binahong ... 57
Lampiran 2. Foto tanaman binahong ... 58
Lampiran 3. Foto daun, umbi, dan bunga binahong ... 59
Lampiran 4. Foto herbarium kering dan ekstrak daun binahong ... 60
Lampiran 5. Foto hewan uji percobaan (tikus putih jantan) ... 61
Lampiran 6. Foto alat penelitian ... 62
Lampiran 7. Preparasi bahan ... 64
Lampiran 8. Data kadar glukosa darah darah pada tiap perlakuan dan waktu sampling ... 68
Lampiran 9. Hasil uji distribusi data dengan test Kolmogorov Smirnov ... 70
Lampiran 10. Hasil uji GLM Repeated Measure kadar glukosa darah ... 72
Lampiran 11. Hasil uji Kruskal Wallis ... 75
Lampiran 12. Hasil uji Mann Whitney ... 76
Lampiran 13. Hasil uji Anova One Way ... 84
xxi
ARTI LAMBANG, SINGKATAN DAN ISTILAH
ad libitum : tanpa batas
Antikoagulan : bekerja untuk mencegah pembekuan darah; berbagai substansi yang menekan, memperlambat atau meniadakan pembekuan darah
DMTI : Diabetes Melitus Tergantung Insulin DMTTI : Diabetes Melitus Tidak Tergantung Insulin
Geoxalated : darah yang mengandung oksalat sebagai antikoagulan GOD–PAP : Glucose Oxidase Phenol Antipirin atau Glukosa Oxidase
Phenol p-aminophenazone
Hipoglikemi(k) : penurunan kadar glukosa dalam darah secara abnormal
HMP : Heksosa Mono Phospat
LDDK : Luas Daerah di Bawah Kurva
BAB I
PENGANTAR
A. Latar Belakang
"Back To Nature" atau kembali ke alam merupakan fenomena di masyarakat yang saat ini terasa semakin berkembang. Fenomena ini menunjukkan bahwa masyarakat sudah semakin peduli dalam melakukan upaya menjaga kesehatan tubuhnya. Hal inilah yang menjadi motivasi penulis untuk memperkenalkan bahan alam sebagai bahan pengobatan penyakit.
Dewasa ini, angka prevalensi terjadinya suatu penyakit semakin meningkat bahkan beberapa penyakit dapat berakibat kematian. Salah satu contoh penyakit yang banyak diderita oleh masyarakat sekarang ini adalah diabetes melitus. Apa itu “Diabetes Melitus”?. Diabetes melitus merupakan penyakit kronik yang sudah mendunia dan menimbulkan komplikasi yang merugikan. Diabetes melitus disebut juga The Great Imitator karena penyakit ini dapat mengenai semua organ tubuh dan menimbulkan berbagai macam keluhan. Diabetes melitus menempati urutan ke-4 prioritas penelitian nasional untuk penyakit degeneratif (Suyono dkk, 2006). Penyakit yang ditakuti oleh manusia di seluruh dunia ini, semakin merajalela terutama karena kurangnya kontrol pola hidup manusia terhadap asupan makanan. Oleh karena itu, penyakit ini perlu diwaspadai dan dicegah terhadap terjadinya komplikasi penyakit pada berbagai organ yang semakin parah.
Selama ini pengobatan diabetes melitus biasanya dilakukan dengan diet saja atau dengan gabungan antara diet dengan pemberian obat hipoglikemik oral (OHO) dan ada kalanya juga dengan gabungan antara diet dengan suntikan insulin. Berbagai jenis obat hipoglikemik oral banyak ditemukan di apotek dan biasanya tergolong obat dengan harga yang tidak murah dan digunakan dalam jangka waktu lama, sehingga tidak semua masyarakat dapat menjangkaunya. Selain itu kondisi masyarakat desa yang jauh dari kota atau belum tersedianya jasa apotek dapat mengakibatkan obat hipoglikemik ini sulit untuk diperoleh. Oleh karena itu perlu adanya suatu alternatif untuk mengupayakan pengobatan diabetes melitus seperti memanfaatkan tanaman obat atau bahan alam dari lingkungan sekitar, yang telah dipercaya dapat berkhasiat sebagai obat hipoglikemik.
Binahong tergolong tanaman yang masih asing bagi masyarakat Indonesia. Tanaman ini dipercaya oleh masyarakat tertentu dapat digunakan untuk pengobatan diabetes melitus dan penyakit lainnya. Kepercayaan masyarakat tersebut terus berkembang dari mulut ke mulut bahkan tak jarang pengalaman orang-orang yang menggunakannya semakin meyakinkan akan manfaat tanaman tersebut. Tanaman yang baru dikenal oleh masyarakat Indonesia dalam tiga tahun terakhir ini tampaknya semakin diburu dan dibudidayakan untuk keperluan pengobatan penyakit.
ilmiah maka penggunaan tanaman binahong sebagai obat hipoglikemik oral dapat dijamin kebenarannya.
Penelitian pengaruh tanaman binahong terhadap kadar glukosa darah dapat dilakukan dengan cara mengukur kadar glukosa darah dari hewan coba seperti tikus, yaitu dengan memberikan beban glukosa dan diamati pengaruh terhadap toleransi glukosa.
1. Permasalahan
Permasalahan yang diangkat penulis pada penelitian ini adalah apakah ekstrak daun binahong mempunyai efek hipoglikemik (penurunan kadar glukosa darah) pada tikus putih jantan terbebani glukosa?
2. Keaslian Penelitian
Sejauh penelusuran penulis, penelitian menggunakan tanaman binahong masih jarang dilakukan di Indonesia. Penelitian menggunakan daun binahong pernah dilakukan oleh Joan W. Nowickeyang berjudul Pollen Morphology, Exine Structure and the Relationships of Basellaceae and Didiereaceae to Portulacaceae; dan oleh Espada A., Riguera R., dan Jimenez, C yang berjudul Boussingoside E, a new triterpenoid suponin from the tubers of Boussingaultia baselloides. Penelitian ini berbeda dengan penelitian yang telah ada karena melihat aspek dari segi farmakologik yaitu efek hipoglikemik ekstrak daun binahong terhadap kadar glukosa darah tikus putih jantan terbebani glukosa.
3. Manfaat Penelitian
a. Manfaat teoritis
Penelitian ini diharapkan dapat mengembangkan manfaat daun binahong sebagai obat tradisional yang berkhasiat sebagai obat hipoglikemik.
b. Manfaat praktis
Penelitian ini diharapkan dapat memberikan sumbangan pemikiran, informasi, dan masukan kepada masyarakat pada umumnya dan khususnya para penderita diabetes melitus mengenai penggunaan daun binahong sebagai obat hipoglikemik.
B. Tujuan
Penelitian ini bertujuan untuk :
1. Tujuan Umum
Tujuan penelitian ini secara umum adalah untuk membuktikan kebenaran efek hipoglikemik ekstrak daun binahong.
2. Tujuan Khusus
BAB II
PENELAAHAN PUSTAKA
A. Tanaman Binahong
1. Sinonim
Berdasarkan Bihrmann’s Caudiciform, tanaman binahong atau Anredera baselloides Baill., memiliki sinonim Boussingaultia baselloides Kunth, Anredera weberbaueri (Ulbr.) Soukup, dan Boussingaultia weberbaueri Ulbr. Anredera baselloides Baill ini memiliki beberapa nama umum antara lain Gulf Madeira vine, Bridal wreath, Cascade creeper, Lamb's tail, dan Madeira vine (Anonim, 2003 a).
2. Klasifikasi tanaman binahong
Berdasarkan Bihrmann’s Taxonomy klasifikasi tanaman binahong yaitu: Kingdom : Plantae
Divisi : Magnoliophyta Kelas : Magnoliopsida Subclass : Caryophyllidae Bangsa : Caryophyllales Suku : Basellaceae Marga : Anredera
Jenis : Anredera baselloides Baill.
(Anonim, 2003 b).
3. Morfologi tanaman
Berdasarkan Bihrmann’s Caudiciform, tanaman binahong termasuk golongan famili Basellaceae yang digambarkan oleh Baill pada tahun 1888. Tanaman yang ditemukan di Amerika Selatan sekitar Ekuador ini membutuhkan drainasi tanah yang baik, beberapa air dan banyak cahaya matahari. Rhizoma akan tumbuh sampai 4 cm dan tingginya mencapai 6 m. Bunganya putih dan tanaman ini dapat dikembangbiakan baik dengan dipotong, benih atau umbinya (Anonim, 2003 a).
B. Karbohidrat
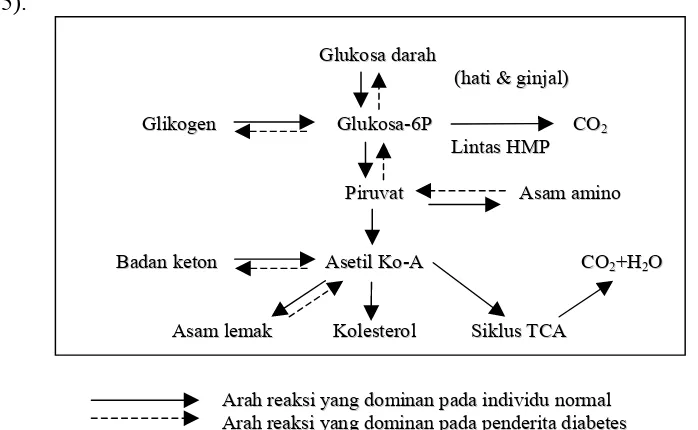
Karbohidrat setelah dikunyah, ditelan dan dicerna, di usus akan menjadi monosakarida dan diabsorpsi. Setelah diabsorpsi masuk ke dalam sel, glukosa yang masuk ke dalam sel mengalami fosforilasi membentuk glukosa-6-fosfat, di mana enzim yang mengkatalisis reaksi ini adalah heksokinase dan atau glukokinase. Glukosa-6-fosfat kemudian dipolimerisasi menjadi glikogen atau dikatabolisme. Proses pembentukan glikogen disebut glikogenesis dan pemecahan glikogen disebut glikogenolisis. Glikogen, bentuk simpanan glukosa, terdapat banyak dalam jaringan tubuh terutama dalam hati dan otot rangka (Ganong, 1995).
Gambar 1. Metabolisme glukosa pada individu normal dan penderita diabetes (Handoko dan Suharto, 1995)
residu asam amino dalam siklus asam trikarboksilat menjadi CO2 dan H2O (Ganong, 1995).
Gambar 2. Transpor glukosa (Marks et al, 1996; Moran, et al, 1994)
Peristiwa transpor glukosa dari lumen usus ke dalam sel dibantu oleh pompa Na+, K+-ATPase. Sel ini menciptakan gradien dalam Na+ dan kemudian menggunakan gradien ini untuk mendorong transpor glukosa dari lumen usus ke dalam sel. Satu ion natrium berikatan dengan protein pembawa di membran luminal, yang akan merangsang pengikatan glukosa. Protein pembawa melepaskan Na+ dan glukosa masuk ke dalam sel. Sedangkan sistem transpor
aktif, Na+, K+-ATPase, akan memompa Na+ melawan gradien konsentrasi dari dalam sel ke cairan ekstrasel. Peristiwa ini diawali dari ikatan tiga ion natrium dengan protein pembawa yang akan menstimulasi fosforilasi oleh ATP. Fosforilasi ini menyebabkan perubahan konformasi protein sehingga ion natrium akan dilepaskan ke dalam cairan ekstrasel. Kemudian dua ion kalium berikatan di sisi lain ekstrasel yang akan memicu pelepasan gugus fosfat. Defosforilasi protein pembawa ini akan membentuk kembali konformasi aslinya dan menyebabkan ion kalium dilepaskan ke dalam sel. Protein pembawa yang telah kembali ke konformasi semula ini siap untuk mengikat ion natrium lagi, demikian seterusnya. Sistem transpor glukosa dari lumen usus ke dalam sel tersebut disebut transpor aktif sekunder, yaitu perpindahan suatu bahan melawan gradien elektrokimia dan digabungkan dengan pemindahan bahan lain mengikuti penurunan gradien elektrokimianya yang dibentuk dan dipertahankan oleh transpor aktif primer. Sementara itu glukosa dari dalam sel akan bergerak mengikuti penurunan gradien konsentrasinya ke sel lainnya secara difusi terfasilitasi yang melibatkan protein pembawa (carrier) (Campbell, 2002; Marks et al, 1996; Moran, et al, 1994). Persamaan reaksi Na+, K+-ATPase menurut Lehninger (1975) dapat ditulis : 3Na+intrasel + 2K+ekstrasel + ATP4- + H2O 3Na+ekstrasel + 2K+intrasel + ADP3- + Pi2- + H+
C. Diabetes melitus
1. Definisi
karbohidrat, lemak, dan protein dan menghasilkan komplikasi meliputi gangguan mikrovaskuler, dan makrovaskuler (Triptitt et al, 2005). Komplikasi mikrovaskuler meliputi retinopati, neuropati, dan nefropati. Komplikasi makrovaskuler meliputi panyakit jantung koroner, stroke, dan penyakit pembuluh darah perifer. Diabetes melitus dihasilkan dari kurangnya sekresi insulin, kurangnya sensitivitas insulin atau keduanya (Wells, 2003). Insulin merupakan hormon yang dibutuhkan untuk menkonversi gula dan makanan yang lain menjadi energi yang dibutuhkan untuk kehidupan sehari-hari. Penyebab diabetes ini masih merupakan misteri, meskipun baik genetik dan faktor lingkungan seperti obesitas dan kurangnya kegiatan tampak memainkan peranan (Anonim, 2006 a).
2. Gejala
Gejala klasik penyakit diabetes melitus, dikenal dengan istilah trio-P, yaitu poliuria (banyak kencing), polidipsi (banyak minum), dan polifagia (banyak makan).
a. Poliuria (banyak kencing) merupakan gejala umum pada penderita diabetes melitus. Banyaknya kencing ini disebabkan kadar gula yang berlebihan, sehingga merangsang tubuh untuk berusaha mengeluarkannya melalui ginjal bersama air kencing. Gejala banyak kencing ini terutama menonjol pada waktu malam hari, yaitu saat kadar gula dalam darah relatif tinggi.
b. Polidipsi (banyak minum) sebenarnya merupakan akibat (reaksi tubuh) dari banyak kencing tersebut. Untuk menghindari tubuh kekurangan cairan (dehidrasi), maka secara otomatis akan timbul rasa haus atau kering yang menyebabkan timbulnya keinginan untuk terus minum selama kadar gula dalam darah belum terkontrol baik. Sehingga dengan demikian akan terjadi banyak kencing dan banyak minum.
c. Polifagia (banyak makan) merupakan gejala yang tidak menonjol. Terjadinya banyak makan ini disebabkan oleh berkurangnya cadangan gula dalam tubuh meskipun kadar gula dalam darah tinggi. Sehingga dengan demikian tubuh berusaha untuk memperoleh tambahan cadangan gula dari makanan yang diterima. Badan kehilangan 4 kalori untuk setiap gram glukosa yang diekskresi. Polifagia timbul karena perangsangan pusat nafsu makan di hipotalamus oleh kurangnya pemakaian glukosa di kelenjar itu
3. Klasifikasi
Klasifikasi diabetes melitus menurut American Diabetes Association, dibagi menjadi empat kelompok utama yaitu:
a. diabetes tipe-1
Diabetes tipe-1 biasanya didiagnosis pada anak-anak dan dewasa muda, dan sebelumnya dikenal sebagai diabetes juvenil. Diabetes tipe-1 disebabkan oleh masalah kegagalan autoimun pada sistem imun tubuh. Pada tubuh sehat, dikhususkan sel (dinamakan sel beta) pada pankreas akan memproduksi insulin. Insulin adalah hormon tubuh yang dibutuhkan untuk mengambil glukosa dari darah ke sel. Pada diabetes tipe-1, sistem imun mengalami kegagalan pada sel beta dan ketika sel beta rusak maka gejala diabetes akan nampak.
b. diabetes tipe-2
Diaberes tipe-2 merupakan bentuk umum dari diabetes. Pada diabetes tipe-2, sel beta masih memproduksi insulin. Akan tetapi, dapat dikarenakan baik sel tidak dapat merespon insulin dengan baik atau insulin yang diproduksi tubuh tidak mencukupi yang dibutuhkan oleh tubuh. Sehingga insulin biasanya masih ada pada orang dengan diabets tipe-2, tetapi tidak bekerja dengan baik sebagaiman mestinya.
c. pre-diabetes
menunjukkan bahwa beberapa kerusakan jangka lama pada tubuh khususnya jantung dan sistem sirkulasi dapat terjadi selama pre-diabetes.
d. diabetes melitus gestational (DMG)
Diabetes melitus saat kehamilan merupakan istilah yang digunakan untuk wanita yang menderita diabetes selama kehamilan. Penyebab gestational diabetes belum diketahui, tetapi ada beberapa petunjuk. Plasenta mendukung bayi untuk pertumbuhannya. Hormon dari plasenta membantu bayi berkembang. Tetapi hormon ini juga memblok aksi insulin ibu di dalam tubuhnya. Masalah ini disebut resistensi insulin. Resistensi insulin membuat tubuh ibu sulit menggunakan insulin, dan membutuhkan tiga kali lipat lebih banyak insulin. Gestational diabetes dimulai ketika tubuh tidak mampu untuk memproduksi dan menggunakan semua insulin yang tersedia. Tanpa insulin yang cukup, glukosa tidak dapat meninggalkan darah dan diubah menjadi energi. Glukosa berada pada kadar yang tinggi di dalam darah, dan disebut hiperglikemia.
(Anonim, 2006 a)
4. Cara dan Kriteria Diagnosis
Cara dan kriteria diagnosis diabetes melitus adalah sebagai berikut:
a. Berdasarkan glukosa plasma puasa
sedangkan antara 110-126 mg/dl disebut glukosa darah puasa terganggu atau
impaired fasting glucose (IFG).
b. Berdasarkan tes toleransi glukosa oral
Sesuai dengan kesepakatan WHO maka tes toleransi glukosa oral harus dilakukan dengan beban 75 gram setelah berpuasa minimal 8 jam. Penilaian adalah sebagai berikut: toleransi glukosa normal bila <140 mg/dl, toleransi glukosa terganggu atau impaired glucose tolerance (IGT) bila kadar glukosa 140 mg/dl - 200 mg/dl, dan kadar glukosa ≥200 mg/dl disebut diabetes melitus. Pasien dengan IFG dan IGT secara umum mengacu pada ‘prediabetes’ yang mempunyai resiko besar berkembang menjadi diabetes di masa depan.
c. HbA1c
Rekomendasi determinasi HbA1c ini untuk memonitor kontrol glikemik pada pasien diabetes. Karena tidak adanya standar baik dan beberapa negara belum siap untuk mengakses tes ini, maka determinasi HbA1c tidak direkomendasikan untuk mendiagnosis diabetes sewaktu-waktu.
(Triptitt et al, 2005)
Tabel I. Nilai glukosa plasma puasa dan toleransi glukosa oral (Triptitt et al, 2005)
Glukosa plasma puasa
- Normal < 100 mg/dl (5,6 mmol/L)
- Glukosa plasma puasa terganggu 100 -125 mg/dl (5,6 – 6,9 mmol/L) - Diabetes melitus ≥ 126 mg/dl (7,0 mmol/L)
Hasil tes toleransi glukosa oral, glukosa plasma 2 jam
- Normal < 140 mg/dl (7,8 mmmol/L)
- Toleransi glukosa terganggu 140 - 200 mg/dl (7,8 - 11,1 mmol/L)
Tabel II. Diagnosis GDM dengan pemberian glukosa oral (Triptitt et al, 2005)
Pemberian glukosa oral 100g
- Puasa ≥ 95 mg/dl (5,3 mmol/L)
- 1 jam ≥ 180 mg/dl (10 mmol/L)
- 2 jam ≥155 mg/dl (8,6 mmol/L)
- 3 jam ≥ 140 mg/dl (7,8 mmol/L)
Pemberian glukosa oral 75g
- Puasa ≥ 95 mg/dl (5,3 mmol/L)
- 1 jam ≥ 180 mg/dl (10 mmol/L)
- 2 jam ≥155 mg/dl (8,6 mmol/L)
C. Teknik Uji Diabetik dan Metode Penetapan Kadar Glukosa Darah
1. Teknik Uji Diabetik
2. Metode Penetapan Kadar Glukosa Darah
Secara umum menurut Widowati dkk (1997) metode penentuan glukosa darah dapat ditentukan dengan beberapa cara yaitu:
a. metode kondensasi dengan gugus amina
Prinsip: aldosa dikondensasikan dengan orto-toluidin dalam suasana asam dan menghasilkan larutan berwarna hijau setelah dipanaskan. Kadar glukosa darah dapat ditentukan sesuai dengan intensitas warna yang terjadi diukur secara spektrofotometri.
b. metode enzimatik
Glukosa dapat ditentukan secara enzimatik, dengan menggunakan enzim glukosa oksidase (GOD). Dengan adanya glukosa oksidase, maka glukosa dioksidasi oleh udara (O2) menjadi asam glukuronat disertai pembentukan hidrogen peroksida. Dengan adanya enzim peroksidase (POD), H2O2 akan membebaskan O2 yang mengoksidasi akseptor kromogen yang sesuai serta memberikan warna merah. Akseptor kromogennya dapat berupa senyawa aminoantipirin dan fenol atau orthodianisidin, kadar glukosa darah ditentukan berdasarkan intensitas warna yang terjadi, diukur secara spektrofotometri.
c. metode oksidasi-reduksi
E. Glibenklamida
Menurut Anonim (1995), rumus struktur glibenklamida sebagai berikut:
Gambar 3. Rumus struktur glibenklamida
Glibenklamida merupakan obat hipoglikemik oral yang digunakan secara luas di dalam pengobatan diabetes melitus tidak tergantung insulin (tipe-2). Glibenklamida merupakan sulfonilurea paling poten dan dikenal sebagai sulfonilurea “generasi kedua” (Dollery, 1999).
Glibenklamida mempunyai aksi farmakologi yang umum seperti semua obat sulfonilurea. Efek utamanya adalah menstimulasi pelepasan insulin dengan meningkatkan fungsi sel-sel islet β pankreas. Pada terapi jangka pendek, hal ini signifikan dengan peningkatan sirkulasi konsentasi insulin, tetapi dengan penggunaan berkelanjutan biasanya terjadi penurunan kadar insulin tanpa merusak kontrol glikemik. Sebagai tambahan terdapat bukti bahwa glibenklamida mempunyai aksi pada jaringan perifer. Sulfonilurea menunjukkan peningkatan sintesis glikogen dan penghambatan glikogenolisis dan glukoneogenesis pada hati. Pada subyek normal puasa, peningkatan konsentrasi insulin dalam plasma dan penurunan glukosa plasma terjadi 15-60 menit setelah pemberian glibenklamida oral dan mencapai maksimum setelah 1-2 jam sebelum kembali ke nilai dasar setelah 3 jam (Dollery, 1999).
CO Cl
OCH3
NH CH2 S
O2 NH NH
Glibenklamida dimetabolisme dalam hati menjadi produk dengan aktivitas hipoglikemik yang sangat rendah. Meskipun analisis spesifik untuk senyawa yang tidak dimetabolisme menimbulkan dugaan terdapatnya suatu waktu-paruh plasma yang singkat, tetapi efek biologis glibenklamida jelas bertahan selama 24 jam setelah pemberian satu dosis tunggal yang diberikan pada pagi hari pada pasien diabetes. Awal dosis pemberian yang biasa adalah 2,5 mg/hari atau kurang,dan rata-rata dosis pemeliharaan adalah 5-10 mg/hari yang diberikan sebagai dosis tunggal pada pagi hari; tidak dianjurkan untuk memberikan dosis pemeliharaan lebih dari 20 mg/hari (Nolte and Karam, 2002).
F. Ekstrak
Ekstrak merupakan sediaan kering, kental atau cair dibuat dengan menyari simplisia nabati atau hewani menurut cara yang cocok, di luar pengaruh cahaya matahari langsung. Sebagai cairan penyari digunakan air, eter atau campuran etanol dan air (Anonim, 1979).
G. Spektrofotometri
Spektrofotometri UV-Vis adalah salah satu teknik analisis fisika-kimia yang mengamati tentang interaksi atom atau molekul dengan radiasi elektromagnetik pada panjang gelombang 190 - 380 nm (UV) dan 380 - 780 nm (Vis) dengan memakai instrumen spektrofotometer (Mulja dan Suharman, 1995). Prinsip kerja spektrofotometri adalah berdasarkan atas interaksi antara radiasi elektromagnetik dengan materi. Materi dapat berupa atom, ion, atau molekul, sedang radiasi elektromagnetik merupakan salah satu jenis energi yang ditransmisikan dalam ruang dengan kecepatan tinggi (Khopkar, 1990). Interaksi antara molekul yang mempunyai gugus kromofor dan radiasi elektromagnetik pada daerah sinar ultraviolet dan sinar tampak (200-800 nm) akan menghasilkan spektra serapan elektronik. Spektra serapan ini dapat digunakan untuk analisis kuantitatif karena jumlah radiasi elektromagnetik yang diserap ada hubungannya dengan jumlah molekul penyerap (Skoog, 1985).
Panjang gelombang dimana terjadi eksitasi elektronik yang memberikan serapan maksimum disebut sebagai panjang gelombang serapan maksimum. Penentuan panjang gelombang pada saat serapan maksimum dapat digunakan untuk mengidentifikasi molekul (Mulja dan Suharman, 1995). Pada analisis kuantitatif, pengukuran serapan dilakukan pada panjang gelombang saat serapan maksimum, disebabkan dua alasan:
1. Sensitivitas maksimum diperoleh dengan mengerjakan pada pita maksimum karena pada konsentrasi yang diberikan maka pada panjang gelombang tersebut memberikan respon yang paling kuat.
2. Pada pita maksimum, perubahan yang kecil pada panjang gelombang akan memberikan perubahan serapan yang minimal (kecuali kalau pita absorpsi sangat tajam). Dengan demikian kesalahan kecil dalam meletakan tanda pemilih panjang gelombang pada instrumen tidak akan mengakibatkan kesalahan besar pada pengukuran serapan.
(Fatah, 1989).
H. Keterangan Empiris
BAB III
METODOLOGI PENELITIAN
A. Jenis dan Rancangan Penelitian
Jenis penelitian yang dilakukan termasuk jenis penelitian eksperimental murni dan dikerjakan mengikuti rancangan acak lengkap pola searah. Penelitian ini dilakukan di Laboratorium Biokimia-Mikrobiologi Fakultas Farmasi Universitas Sanata Dharma.
B. Variabel Penelitian
1. Variabel utama
a. Variabel bebas : Dosis ekstrak daun binahong
Dosis ekstrak daun binahong adalah jumlah gram (g) ekstrak daun binahong tiap satuan kilogram (kg) berat badan subjek uji yang bersangkutan.
b. Variabel tergantung : LDDK0-300 kadar glukosa dalam darah
LDDK0-300 kadar glukosa dalam darah adalah besaran yang menggambarkan jumlah kadar glukosa dalam darah pada rentang waktu mulai menit ke-0 sampai menit ke-300 yang dihitung menggunakan metode trapezoid.
2. Variabel pengacau terkendali
a. Jenis kelamin : jantan
b. Galur spesies subjek uji : galur Wistar
c. Warna : putih
d. Berat badan subjek uji : 175 - 225 gram
e. Umur subjek uji : antara 2 – 3 bulan
f. Cara Pemberian : peroral
3. Variabel pengacau tak terkendali : kandungan dalam daun binahong
C. Bahan dan Alat Penelitian
1. Bahan penelitian
a. hewan uji
Tikus putih jantan galur Wistar, umur 2 - 3 bulan, berat badan 175 - 225 gram, dari Laboratorium Farmakologi dan Toksikologi Fakultas Farmasi USD. b. bahan uji
Daun binahong (Anredera baselloides Baill.) yang diperoleh dari Muntilan. Daun binahong dipilih daun yang berwarna hijau.
c. senyawa pembanding
Senyawa pembanding berupa kaplet generik glibenklamida yang diproduksi oleh PT. Indofarma
d. pereaksi untuk pengukuran kadar glukosa darah
Pereaksi yang digunakan adalah enzim Glucose GOD FS* (DiaSys, Germany) yang terdiri atas:
Tabel III. Isi pereaksi enzim Glucose GOD-PAP
Reagen:
Phosphate buffer pH 7,5 250 mmol/l
Phenol 5 mmol/l
4-aminoantipyrine 0,5 mmol/l
Glukosa oksidase (GOD) ≥ 10 kU/l
Peroksidase (PAP) ≥ 1 kU/l
e. lain-lain
1) natrium oksalat p.a darah sebagai antikoagulan pada waktu pengambilan darah
2) glukosa monohidrat p.a, merk Germany E Damstat sebagai larutan untuk uji toleransi glukosa oral
3) asam benzoat p.a, sebagai pengawet larutan glukosa monohidrat
4) aquades yang diperoleh dari Laboratorium Fakultas Farmasi Universitas Sanata Dharma
5) etanol p.a sebagai cairan penyari ekstrak
2. Alat penelitian
Alat-alat penelitian yang digunakan antara lain seperangkat alat gelas (pyrex), seperangkat alat ekstrak dan vaccum rotary evaporator, oven (Marius), jarum suntik peroral, mikropipet (Socorex acura 200-1000μl, Swiss dan Biohit PLC 10-100 μl, Finland), microtube, sentrifuge (Hettich WBA SS, Germany), spektrofotometri visible (Optima®SP300, Japan) dan kuvet, vortex (Janke-Kankel IKA®-Labortechnik), alat timbang elektrik (Mettler Toledo AB204, Switzerland).
D. Jalannya Penelitian
1. Determinasi tanaman binahong
Determinasi daun binahong (Anredera baselloides Baill) mengikuti
2. Pembuatan simplisisa uji
a. pengolahan bahan
1) mempersiapkan bahan mentah
Pengambilan daun binahong dilakukan pada bulan Agustus dan dipilih daun yang berwarna hijau.
2) pembersihan
Daun binahong yang akan diolah harus bebas dari debu, kotoran, pasir atau tanah. Oleh karena itu daun harus dicuci dengan air bersih secara berulang-ulang paling tidak sampai tiga kali kemudian ditiriskan. Air yang digunakan adalah air mengalir.
3) pengeringan
Daun tanaman yang akan digunakan sesudah dibersihkan dimasukkan dalam oven pada suhu 500 C sampai kering sehingga bahan tersebut tidak mudah rusak dan dapat bertahan lama.
b. pembuatan ekstrak daun binahong
Menimbang lima puluh gram serbuk simplisia dalam kantong kertas saring dan dimasukkan dalam alat sokhlet. Kemudian ditambahkan etanol 70% p.a untuk dua kali sirkulasi. Pada labu alas bulat diberi tiga sampai lima batu didih. Penyarian dilakukan hingga tampak jernih. Setelah dingin disaring melalui kertas saring. Filtrat diuapkan dalam vaccum rotary evaporator
c. pasca pengolahan
Simpan dalam wadah tertutup yang tidak berhubungan langsung dengan udara. Penyimpanan ini bertujuan untuk menghindari gangguan serangga dan pertumbuhan jamur yang akan merusak bahan obat tersebut.
d. penetapan dosis ekstrak daun binahong
Berdasarkan pengalaman empiris di masyarakat, penggunaan daun binahong untuk menurunkan kadar glukosa darah yaitu sebanyak ± 10 lembar atau ± 14,30 g/50kgBB. Untuk manusia 70 kg dibutuhkan 20 g daun binahong dan dikonversikan ke tikus 200 gram dengan faktor konversi 0,018.
20g daun binahong x 0,018 = 0,36 g / 200 g = 1,80 g/kgBB
Berdasarkan perhitungan maka besarnya dosis binahong pada hewan uji tikus yaitu 1,80 g/kgBB. Untuk selanjutnya digunakan satu dosis dibawah dan dua diatas dosis orientasi dengan faktor perkalian 1,5 sehingga didapat rentang dosis terapi yang digunakan adalah 1,20 g/kgBB, 1,80 g/kgBB, 2,70 g/kgBB, dan 4,05 g/kgBB.
3. Preparasi bahan
a. pembuatan larutan asam benzoat p.a. 0,1% b/v
Serbuk asam benzoat p.a. ditimbang sebanyak 0,5 gram dan dilarutkan dengan aquades panas dalam labu takar 500,0 ml sampai tanda.
b. pembuatan larutan stok glukosa monohidrat p.a. 1% b/v
c. pembuatan larutan natrium oksalat p.a. 2% b/v
Natrium oksalat p.a. ditimbang sebanyak 1 g dan dilarutkan dengan aquades dalam labu takar 50,0 ml sampai tanda.
d. penentuan keseragaman bobot kaplet glibenklamida
Penentuan keseragaman bobot kaplet glibenklamida mengacu pada Anonim 1979. Timbang 20 tablet, hitung bobot tablet. Jika ditimbang satu-satu, tidak boleh lebih dari dua tablet yang masing-masing bobotnya menyimpang dari bobot rata-ratanya lebih besar dari harga yang ditetapkan kolom A, dan tidak satu tabletpun menyimpang dari bobot rata-ratanya lebih dari harga yang ditetapkan kolom B. Nilai penyimpangan bobot rata-rata kolom A dan B dapat dilihat pada tabel IV.
Tabel IV. Keseragaman bobot tablet
e. penentuan dosis glibenklamida
Dosis glibenklamida yaitu 5 mg pada manusia dengan berat badan 70 kg, dikonversikan ke tikus 200 gram dengan faktor konversi 0,018
5 mg glibenklamida x 0,018 = 0,09 mg glibenklamida/ 200 gram = 0,45 mg glibenklamida/ kg BB
Penyimpangan bobot rata-rata dalam % Bobot rata-rata
A B
25 mg atau kurang 15 % 30 %
26 mg sampai dengan 150 mg 10 % 20 %
151 mg sampai dengan 300 mg 7.5 % 15 %
Berdasarkan perhitungan maka besarnya dosis glibenklamida pada hewan uji tikus yaitu 0,45 mg/ kgBB.
f. pembuatan larutan glibenklamida 0,1125 mg/ml
Timbang serbuk glibenklamida setara dengan 25 mg glibenklamida murni, larutkan dengan aquades dalam labu takar 10,0 ml sampai tanda sebagai larutan induk glibenklamida. Buat dengan konsentrasi 0,1125 mg/ml dalam labu ukur 10 ml dari larutan induk glibenklamida tersebut.
4. Percobaan pendahuluan
a. penetapan waktu resapan stabil glukosa murni
Sebanyak 25 μl larutan glukosa standar direaksikan dengan 2,5 ml pereaksi GOD-PAP. Campuran larutan tersebut kemudian divortex dan segera diukur resapannya pada panjang gelombang 500 nm (sesuai dengan yang tertulis dalam leaflet Glucose GOD FS*) selama 60 menit. Waktu resapan stabil yang digunakan adalah waktu inkubasi yang memberikan resapan stabil.
b. penetapan panjang gelombang maksimum
Sebanyak 25 μl larutan glukosa standar direaksikan dengan 2,5 ml pereaksi GOD-PAP. Campuran larutan tersebut kemudian divortex dan diukur pada rentang panjang gelombang 400 - 600 nm.
c. pembuatan kurva baku
d. penetapan waktu pemberian glibenklamida
Tujuan dari penetapan pemberian glibenklamida adalah untuk melihat pengaruh waktu pemberian terhadap efek hipoglikemik glibenklamida, agar pada saat uji toleransi glukosa oral (UTGO) glibenklamida sudah memberikan efek penurunan kadar glukosa darah. Orientasi ini menggunakan 6 ekor tikus yang terbagi dalam 3 kelompok dimana masing-masing kelompok diberi perlakuan perlakuan kontrol positif dan kontrol negatif. Perlakuan tersebut dilakukan terhadap masing-masing kelompok yaitu pada menit ke-15 sebelum UTGO untuk kelompok kesatu, menit ke-30 sebelum UTGO untuk kelompok kedua, dan menit ke-45 sebelum UTGO untuk kelompok ketiga.
Semua pemberian dilakukan secara peroral, selanjutnya dilakukan UTGO dengan diberikan larutan glukosa monohidrat 15% b/v; 1,75 g/kgBB. Pengambilan cuplikan darah dilakukan sesaat sebelum perlakuan sebagai menit ke-0 dan pada menit ke-15, 30, 45, 60, 90, 120, 180, 240, dan 300 setelah UTGO. Pengukuran kadar glukosa darah dilakukan dengan menggunakan metode GOD-PAP. Selanjutnya dibuat kurva UTGO dan perhitungan LDKK0-300. Penentuan waktu pemberian ekstrak daun binahong didasarkan pada selisih LDKK0-300 kontrol positif dan negatif tertinggi.
e. penetapan waktu pemberian ekstrak daun binahong
menggunakan 3 ekor tikus yang masing-masing diberi ekstrak daun binahong pada menit ke-15, 30, dan 45 sebelum UTGO.
Semua pemberian dilakukan secara peroral, selanjutnya dilakukan UTGO dengan diberikan larutan glukosa monohidrat 15% b/v; 1,75 g/kgBB. Pengambilan cuplikan darah dilakukan sesaat sebelum perlakuan sebagai menit ke-0 dan pada menit ke-15, 30, 45, 60, 90, 120, 180, 240, dan 300 setelah UTGO. Pengukuran kadar glukosa darah dilakukan dengan menggunakan metode GOD-PAP. Selanjutnya dibuat kurva UTGO dan perhitungan harga LDKK0-300. Penentuan waktu pemberian ekstrak daun binahong didasarkan pada harga LDKK0-300 terendah.
f. pengelompokan dan perlakuan hewan uji
Penelitian ini mengikuti rancangan acak lengkap pola searah, yang mana 30 ekor tikus dibagi secara acak menjadi 6 kelompok, masing-masing kelompok terdiri dari 5 ekor. Tiap hewan uji diadaptasikan dengan kondisi yang sama, jauh dari kebisingan dan dihindarkan dari stres. Sebelum mendapat perlakuan, masing-masing kelompok dipuasakan selama 18 jam dengan tetap diberi minum ad libitum, dan perlakuan sebagai berikut:
1) Kelompok I : aquades 5 ml/kgBB (kontrol negatif)
Semua pemberian dilakukan secara peroral, selanjutnya dilakukan UTGO dengan diberikan larutan glukosa monohidrat 15% b/v; 1,75 g/kgBB. Pengambilan cuplikan darah dilakukan sesaat sebelum UTGO sebagai menit ke-0 dan pada menit ke-15, 30, 45, 60, 90, 120, 180, 240, dan 300 setelah UTGO. Pengukuran kadar glukosa darah dilakukan dengan menggunakan metode GOD-PAP. Selanjutnya dibuat kurva UTGO dan perhitungan harga LDKK0-300.
5. Penetapan kadar glukosa darah
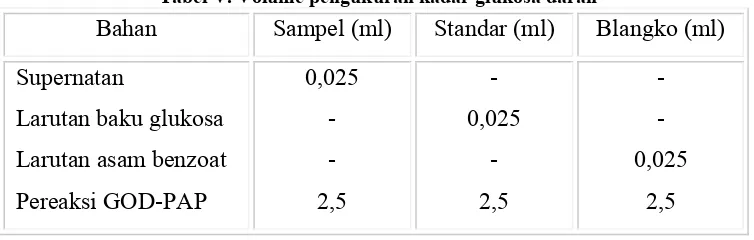
Kadar glukosa darah ditetapkan dengan metode GOD-PAP. Pada tiap kelompok dilakukan pengambilan cuplikan darah sebanyak 0,5 ml melalui
vena lateralis ekor dan ditampung dalam microtube yang berisi 50 μl natrium oksalat 2% b/v. Pengambilan cuplikan darah dilakukan sesaat sebelum perlakuan sebagai menit ke-0 dan pada menit ke-15, 30, 45, 60, 90, 120, 180, 240, dan 300 setelah UTGO. Kemudian darah geoxalated ini dipusingkan 3000 rpm selama 10 menit. Selanjutnya diambil 25 μl plasma darah, kemudian dilakukan pengukuran sebagai berikut:
Tabel V. Volume pengukuran kadar glukosa darah
Bahan Sampel (ml) Standar (ml) Blangko (ml) Supernatan
Larutan baku glukosa Larutan asam benzoat Pereaksi GOD-PAP
menggunakan metode GOD-PAP. Resapan diukur pada panjang gelombang maksimum. Kemudian kadar glukosa darah dihitung dengan rumus:
Kadar glukosa = (As / Ast) x 100 mg%
Keterangan : As = resapan sampel Ast = resapan standar Selanjutnya dibuat kurva dengan mem-plot-kan nilai kadar glukosa darah lawan waktu ke-0 sampai menit ke-300 dengan metode trapezoid (LDDK0-300) dan rumus yang digunakan adalah sebagai berikut:
LDDK
to-tn=
t
1– t
ox (C
o+ C
1) +
t
2– t
1x (C
2+ C
1) +
2 2
t
3– t
2x (C
3+ C
2)
+
t
n– t
n-1x (C
n+ C
n-1)
2 2
Keterangan:
t = waktu (jam-1/menit-1)
C = konsentrasi zat dalam darah (mg/dl)
LDDKto-tn = luas daerah di bawah kurva dari waktu ke-0 sampai ke-n
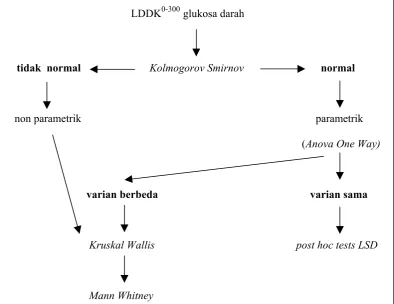
E. Analisis Hasil
Data kadar glukosa darah pada tiap kelompok dianalisis secara statistik menggunakan metode General-Linier Model Repeated Measured. Dari harga LDDK0-300 glukosa darah dilakukan uji distribusi menggunakan uji Kolmogorov Smirnov kemudian jika distribusinya normal dilanjutkan dengan analisis Anova One Way dan post hoc tests LSD dengan tingkat kepercayaan 95%. Jika nilai LDDK0-300 glukosa darah mempunyai variansi yang berbeda maka dilakukan uji
95% untuk mengetahui perbedaan masing-masing kelompok. Berikut adalah ringkasan untuk analisis hasil:
Kadar glukosa darah
General-Linier Model Repeated Measured
interaksi waktu pengambilan cuplikan dan perlakuan terhadap kadar glukosa
darah
Gambar 4. Bagan alur analisis hasil kadar glukosa darah
LDDK0-300glukosa darah
tidak normal Kolmogorov Smirnov normal
non parametrik parametrik
(Anova One Way)
varian berbeda varian sama
Kruskal Wallis post hoc tests LSD
Mann Whitney
BAB IV
HASIL DAN PEMBAHASAN
A. Determinasi Tanaman
Tanaman binahong yang digunakan dalam penelitian ini dideterminasi terlebih dahulu agar tidak terjadi kesalahan dalam mengidentifikasi tanaman binahong sehingga pada akhirnya dapat dikonfirmasi bahwa tanaman yang dipakai memang benar binahong. Hasil determinasi tanaman berdasarkan
Bihrmann’s Caudiciforms menunjukkan ciri-ciri yang serupa. Gambaran lengkap tanaman binahong dapat dilihat pada lampiran 1 - 3.
B. Pembuatan Simplisia Uji dan Preparasi Bahan
Pembuatan simplisia uji sesuai dengan tata cara yang tertera pada halaman 24 dan gambar hasil pembuatan simplisia dapat dilihat di lampiran 4. Preparasi bahan sesuai dengan tata cara yang tertera pada halaman 25 - 27 dan untuk lebih lengkapnya dapat dilihat pada lampiran 7.
C. Percobaan Pendahuluan
1. Waktu resapan stabil glukosa
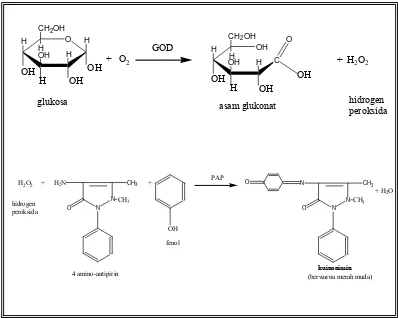
Reaksi antara glukosa dan reagen GOD-PAP merupakan reaksi enzimatis yang menghasilkan senyawa berwarna. Oleh karena itu perlu dilakukan uji stabilitas glukosa untuk mengetahui operating time (OT) dari reaksi tersebut. Penentuan operating time bertujuan untuk mengetahui waktu resapan saat
H O H
asam glukonat hidrogen peroksida
4 amino-antipirin (berwarna merah muda)kuinonimin
senyawa berwarna yang terbentuk memberikan resapan yang stabil pada pengukuran menggunakan spekrofotometri visible. Pengukuran dilakukan pada panjang gelombang 500 nm (sesuai pada leaflet enzim GOD-PAP) selama 60 menit.
Reagen GOD-PAP bekerja secara enzimatik dengan prinsip adanya GOD (glucose oxidase) akan mengkatalisis oksidasi glukosa menjadi asam glukonat dan hidrogen peroksida. Hidrogen peroksida akan bereaksi, dengan adanya enzim peroksidase, bersama dengan fenol dan 4-amino-antipirin membentuk senyawa kuinonimin yang berwarna merah muda. Intensitas warna merah muda yang terbentuk sebanding dengan konsentrasi glukosa. Reaksi yang terjadi sebagai berikut:
Data penetapan waktu resapan stabil larutan glukosa standar 100 mg/dl tampak dalam tabel VI.
Tabel VI. Data hasil penetapan waktu resapan stabil larutan glukosa standar
Grafik hubungan resapan glukosa murni dengan waktu inkubasi seperti berikut:
Gambar 7. Grafik hubungan antara resapan dan waktu resapan stabil reaksi glukosa standar pada λ 500 nm
Dari gambar grafik di atas dapat dilihat bahwa pada menit 10 sampai menit ke-45 memberikan grafik yang relatif datar, artinya pada menit tersebut terjadi reaksi yang stabil dan sempurna antara glukosa murni dengan pereaksi GOD-PAP. Hal ini berarti penetapan kadar glukosa darah dapat dilakukan pada menit ke-10 – 45 setelah pemberian pereaksi GOD-PAP. Akan tetapi untuk lebih meminimalkan
Waktu (menit) Resapan
5 0,320
Waktu (menit) Resapan
35 0,331
Grafik Waktu Resapan Stabil Glukosa
Panjang Gelombang Maksimum Glukosa Standar
0 0.05 0.1 0.15 0.2 0.25 0.3 0.35 0.4
400 416 432 448 464 480 492 498 504 508 512 528 544 560 576 592
λ (nm) Resapan
100 mg/dl 50 mg/dl
perbedaan resapan, maka pengerjaan operating time dilakukan dari menit ke-10 sampai 30.
2. Penetapan panjang gelombang maksimum
Instrumen ukur (spektrofotometer visible) serta kondisi yang digunakan dalam penelitian ini berbeda dengan instrumen yang digunakan oleh DiaSys. Oleh karena itu perlu dilakukan pengujian untuk mengetahui besar panjang gelombang yang memberi resapan yang maksimum. Penetapan panjang gelombang maksimum diukur pada rentang panjang gelombang 400 - 600 nm.
Berdasarkan gambar di atas dapat kita lihat bahwa resapan maksimum terjadi pada panjang gelombang 504 nm. Pada leaflet DiaSys tertera bahwa panjang gelombang saat resapan maksimum terjadi pada panjang gelombang 500 nm. Perbedaan panjang gelombang ini dikarenakan instrumentasi yang digunakan belum tentu sama. Oleh karena itu pada pengukuran kadar glukosa pada percobaan ini dilakukan pada panjang gelombang 504 nm.
3. Pembuatan kurva baku
Pada penelitian ini penetapan kadar glukosa darah dilakukan secara spektrofotometri sehingga harus memenuhi persyaratan hukum Lambert-Beer. Hukum Lambert-Beer menjelaskan bahwa resapan akan meningkat seiring dengan meningkatnya kadar. Oleh karena itu perlu dilakukan pembuatan kurva baku untuk menunjukkan bahwa penetapan kadar glukosa dan secara spektrofotometri ini telah memenuhi hukum Lambert-Beer.
Pembuatan kurva baku menggunakan larutan glukosa monohidrat 10mg/ml sebagai larutan stok glukosa. Pelarut yang digunakan ditambah larutan asam benzoat dengan tujuan untuk mengawetkan glukosa selama kurun waktu tertentu. Pengawetan ini dilakukan karena glukosa merupakan media yang baik untuk pertumbuhan mikroorganisme sehingga dengan penggunaan asam benzoat diharapkan dapat meminimalkan faktor-faktor yang dapat mengganggu penetapan kadar glukosa darah.
dan waktu resapan maksimum pada menit ke 10-30 menit sesuai dengan percobaan pendahuluan yang telah dilakukan di atas.
Dari hasil pengukuran resapan larutan glukosa standar pada panjang gelombang 504 nm diperoleh data sebagai berikut:
Tabel VII. Hubungan kadar dan resapan glukosa pada λ maksimum 504 nm
Kadar (mg/dl) Resapan Persamaan Regresi Linear
74,76
Dari tabel VII. di atas terlihat bahwa harga koefisien regresi hubungan kadar dan resapan glukosa pada λ 504 nm mendekati ±1, dan setelah dibandingkan dengan r tabel dengan taraf kepercayaan 95% dengan df3 (df: degree of freedom, yaitu jumlah sampel dikurangi dua) didapat bahwa r tabel sebesar 0,878. Dapat dilihat bahwa harga r hitung lebih besar dari r tabel. Hal ini berarti bahwa persamaan kurva baku tersebut memiliki linieritas yang baik.
Gambar 9. Kurva baku glukosa pada λ maksimum 504 nm selama operating time
4. Penetapan waktu pemberian larutan glibenklamida
Waktu pemberian larutan glibenklamida didasarkan pada prosentase penurunan harga luas daerah di bawah kurva dari menit ke-0 sampai menit ke-300 (LDDK0-300). Hasil UTGO dan perhitungan prosentase selisih LDDK0-300 teringkas pada tabel VIII.
Tabel VIII. Hasil UTGO dan perhitungan prosentase selisih LDDK0-300larutan glibenklamida
15 41733,23 30114,60 11318,63 27,84
30 40906,80 30153,00 10753,80 26,29
45 35718,68 34301,93 1416,75 3,97
27.84
Diagram pengaruh waktu pemberian glibenklamida
Dari tabel VIII, dapat kita lihat bahwa larutan glibenklamida yang diberikan secara per-oral pada menit ke-15 sebelum UTGO dapat menurunkan harga LDDK0-300 sebesar 27,84% yang nilainya paling besar dibandingkan pemberian pada menit yang lain sehingga ditetapkan pemberian ekstrak daun binahong yang digunakan yaitu 15 menit sebelum UTGO. Untuk lebih jelasnya dapat dilihat pada gambar 10.
% Selisih LDDK
(menit)
Gambar 10. Diagram pengaruh waktu pemberian glibenklamida terhadap % selisih LDDK
29329.46
Diagram pengaruh waktu pemberian ekstrak daun binahong 5. Penetapan waktu pemberian ekstrak daun binahong
Waktu pemberian ekstrak daun binahong didasarkan pada prosentase penurunan harga luas daerah di daerah kurva dari menit ke-0 sampai menit ke-300 (LDDK0-300). Hasil UTGO dan perhitungan prosentase selisih LDDK0-300 teringkas pada tabel IX.
Tabel IX. Hasil UTGO dan LDDK0-300ekstrak daun binahong
Waktu pemberian ekstrak daun
binahong sebelum UTGO (menit ke-) LDDK
0-300
(mg.menit /dl)
15 29329,46
30 30969,38
45 30269,85
Dari tabel IX, dapat kita lihat bahwa ekstrak daun binahong yang diberikan secara per-oral pada menit ke-15 sebelum UTGO memberikan harga LDDK0-300 sebesar 29329,46 mg.menit/dl yang nilainya paling kecil dibandingkan pemberian pada menit yang lain sehingga ditetapkan pemberian ekstrak daun binahong adalah 15 menit sebelum UTGO. Untuk lebih jelasnya dapat dilihat pada gambar 11.
LDDK (mg.menit/dl)
(menit)
Pada gambar 11 tersebut dapat kita amati bahwa pada menit ke-15 ekstrak
daun binahong telah mencapai onset sehingga kemampuan untuk menurunkan kadar glukosa dalam darah paling tinggi dibandingkan dengan yang lainnya. Jadi, kemampuan ekstrak daun binahong yang paling efektif dalam menurunkan kadar glukosa darah adalah pada menit ke-15.
D. Efek Hipoglikemik Ekstrak Daun Binahong
Pada penelitian ini dilakukan penetapan kadar glukosa darah dengan kontrol negatif diberi aquades; kontrol positif diberi larutan glibenklamida 0,45 mg/kgBB; dan empat kelompok perlakuan yaitu kelompok I diberi ekstrak daun binahong dengan dosis 1,20 g/kgBB, kelompok II diberi ekstrak daun binahong dengan dosis 1,80 g/kgBB, kelompok III diberi ekstrak daun binahong dengan dosis 2,70 g/kgBB, dan kelompok IV diberi ekstrak daun binahong dengan dosis 4,05 g/kgBB.
Tabel X. Data kadar glukosa darah rata-rata dan LDDK0-300 setiap kelompok perlakuan
Kadar glukosa darah rata-rata (mg/dl) tikus putih jantan
Kelompok perlakuan
0 15 30 45 60 90 120 180 240 300
Kurva hubungan antara waktu sampling dan kadar glukosa darah
W aktu sampling (me nit)
K
Kontrol Negatif Kontrol Positif Perlakuan I Perlakuan II Perlakuan III Perlakuan IV
Selanjutnya grafik hubungan antara kadar glukosa darah dan waktu sampling dari tiap-tiap kelompok perlakuan yaitu aquades, larutan glibenklamida dan ekstrak daun binahong dapat dilihat pada gambar 12.
Gambar 12. Kurva hubungan antara waktu sampling dan kadar rata-rata glukosa darah akibat pemberian aquades, glibenklamida, dan ekstrak daun binahong
Keterangan :
aquades yang tidak memiliki efek terapetik, sehingga kadar glukosa darah ditentukan oleh kemampuan tubuh tikus untuk menurunkan kadar glukosa, akibatnya kelompok kontrol negatif memberikan rata-rata kadar glukosa paling tinggi jika dibandingkan dengan kelompok perlakuan yang lain.
Hasil percobaan menunjukkan bahwa pada kadar glukosa darah mencapai maksimum pada menit ke-30 sampai menit ke-45, kemudian kadar glukosa darah menurun kembali setelah dua sampai tiga jam setelah pemberian glukosa oral. Hal ini sesuai dengan teori menurut Mayes (1990) dimana kadar glukosa darah pada individu normal meningkat dalam satu jam setelah pemberian glukosa oral. Absorpsi glukosa menjadi normal kembali setelah dua sampai tiga jam setelah pemberian glukosa. Ini berarti tubuh hewan uji tersebut dalam keadaan sehat karena masih dapat menoleransi pembebanan glukosa UTGO pada tingkat normal.
Kontrol positif memberikan rata-rata kadar glukosa yang paling rendah diantara kelompok perlakuan lainnya. Hal ini disebabkan pada kontrol positif diberi perlakuan larutan glibenklamida yang merupakan obat hipoglikemik oral golongan sulfonilurea yang memiliki efek terapetik menurunkan kadar glukosa darah.
2,70 g/kgBB, kelompok IV (ekstrak daun binahong dengan dosis sebesar 4,05 g/kgBB), kelompok II (ekstrak daun binahong dengan dosis sebesar 1,80 g/kgBB), dan kelompok I (ekstrak daun binahong dengan dosis sebesar 1,20 g/kgBB). Semua perlakuan dengan ekstrak daun binahong memberikan kurva yang relatif sama dengan kurva kelompok kontrol positif. Ini dimungkinkan mekanisme kerja ekstrak daun binahong tersebut hampir sama dengan mekanisme kerja kontrol positif dalam menurunkan kadar glukosa darah.
Data kadar glukosa darah kemudian dianalisis mengikuti tata cara rancangan GLM Repeated Measure untuk melihat perbedaan harga kadar glukosa darah pada setiap waktu cuplikan akibat berbagai perlakuan. Hasil analisis statistik secara GLM Repeated Measure menunjukkan adanya perbedaan yang bermakna apabila probability (p) < 0,05 dan perbedaan yang tidak bermakna apabila p > 0,05.Hasil analisis dapat dilihat pada lampiran 10 dan teringkas pada tabel XI.
Tabel XI. Hasil analisis GLM Repeated Measure kadar glukosa darah
Subjek variasi Jumlah kuadrat Db Rata-rata
kuadrat F p
Tes antar subjek
- Periode (waktu) 310475,68 9 34497,30 313,97 0,000BB
- Periode perlakuan 18042,92 45 408,95 3,727 0,000BB
Di antara subjek
- Perlakuan (dosis) 32488,34 5 6497,67 14,58 0,000BB
Pada tabel XI dapat kita lihat adanya perbedaan yang bermakna (p < 0,05) antara purata kadar glukosa darah hewan uji yang dipengaruhi oleh periode waktu (p = 0,000). Hal ini menunjukkan bahwa secara statistik terjadi perbedaan kadar glukosa darah yang bermakna (signifikan) dari setiap waktu sampling darah (menit ke 0-300) pada taraf kepercayaan 95%. Juga terlihat perbedaan yang bermakna (p < 0,05) antara purata kadar plasma hewan uji yang dipengaruhi oleh perlakuan (dosis), sehingga perlakuan antar kelompok terbukti memberi pengaruh signifikan terhadap perbedaan kadar glukosa darah pada menit ke 0-300 dengan taraf kepercayaan 95%.
Kemampuan ekstrak daun binahong dalam menurunkan kadar glukosa darah dapat diperjelas dengan membandingkan nilai LDDK0-300 glukosa darah dari masing-masing kelompok. LDDK0-300 merupakan besaran yang menggambarkan jumlah glukosa darah yang diamati pada menit ke-0 sampai menit ke-300 pada setiap kelompok perlakuan.
Tabel XII. Pengaruh praperlakuan ekstrak daun binahong terhadap LDDK0-300 kadar glukosa darah tikus putih jantan dan prosentase perbedaan terhadap kelompok negatif dan positif
prosentase perbedaan terhadap Kelompok
perlakuan N
Mean LDDK0-300 ± SE
(mg.menit/dl) kontrol negatif kontrol positif
Kontrol negatif 5 32300,64 ± 1104,79 - 35,13
Kontrol positif : glibenklamida dosis 0,45 mg/kgBB Perlakuan I : ekstrak daun binahong dosis 1,20 g/kgBB Perlakuan II : ekstrak daun binahong dosis 1,80 g/kgBB Perlakuan III : ekstrak daun binahong dosis 2,70 g/kgBB Perlakuan IV : ekstrak daun binahong dosis 4,05 g/kgBB
32300.64
Dosis I Dosis II Dosis III Dosis IV Perlakuan
Diagram LDDK0-300 glukosa darah masing-masing perlakuan
Gambar 13. Diagram LDDK0-300 glukosa darah masing-masing perlakuan
Keterangan :
Tabel XIII. Hasil analisis homogenitas variansi menggunakan uji Anova One Way
Levene Statistic df1 df2 Sig.
5,742 5 24 0,001
Oleh karena itu data LDDK0-300 dianalisis menggunakan uji Kruskal-Wallis untuk mengetahui apakah ada perbedaan nilai LDDK0-300 yang bermakna dari kelompok-kelompok perlakuan. Berdasarkan tabel XIV dapat diketahui bahwa keenam kelompok perlakuan memiliki rata-rata LDDK0-300 (Mean) yang memang berbeda. Hal ini disebabkan berdasarkan nilai probabilitasnya, data LDDK0-300 tersebut menunjukkan nilai probabilitas sebesar 0,001 atau p < 0,05.
Tabel XIV. Test Mean LDDK0-300 keenam kelompok perlakuan dengan uji Kruskal-Wallis
LDDK
Chi-Square
df
Asymp. Sig
20,174
5
0,001
Setelah diketahui bahwa ada perbedaan LDDK0-300 yang signifikan di antara keenam kelompok perlakuan, masalah yang timbul adalah kelompok perlakuan mana yang berbeda dan tidak berbeda. Untuk itu analisis Kruskal-Wallis ini dilanjutkan dengan uji Mann-Whitney untuk mengetahui pengaruh peringkat dosis ekstrak daun binahong pada masing-masing kelompok. Hasil uji dinyatakan berbeda bermakna antar kelompok perlakuan bila nilai p < 0,05.Hasil ini dapat dilihat pada lampiran12dan secara ringkas dapat dilihat pada tabel XV.
positif, kelompok perlakuan III dan IV. Hal ini berarti kontrol positif, kelompok perlakuan III, dan IV dapat menurunkan kadar glukosa darah bila dibandingkan dengan kontrol negatif. Sedangkan kelompok perlakuan I dan II menunjukkan perbedaan yang tidak bermakna terhadap kontrol negatif yang berarti kelompok perlakuan tersebut tidak memiliki efek penurunan glukosa darah.
Tabel XV. Hasil uji Mann-Whitney LDDK0-300 glukosa darah tikus putih jantan terbebani glukosa
Kelompok Kontrol
negatif TB : berbeda tidak bermakna (p >0,05) Kontrol negatif : aquades
Kontrol positif : glibenklamida dosis 0,45 mg/kgBB Perlakuan I : ekstrak daun binahong dosis 1,20 g/kgBB Perlakuan II : ekstrak daun binahong dosis 1,80 g/kgBB Perlakuan III : ekstrak daun binahong dosis 2,70 g/kgBB Perlakuan IV : ekstrak daun binahong dosis 4,05 g/kgBB
BAB V
KESIMPULAN DAN SARAN
A. Kesimpulan
Hasil penelitian menunjukkan bahwa ekstrak daun binahong dengan dosis 1,20 g/kgBB sampai 4,05 g/kgBB memberikan penurunan kadar glukosa darah sebesar 10,85% sampai 23,67% terhadap kontrol negatif. Dosis 2,70 g/kgBB dan 4,05 g/kgBB memberikan efek penurunan kadar glukosa darah secara bermakna terhadap kontrol negatif. Dari hasil penelitian tersebut dapat diambil kesimpulan bahwa ekstrak daun binahong dapat menurunkan kadar glukosa darah tikus percobaan.
B. Saran
Perlu dilakukan penelitian lebih lanjut tentang toksisitas akut dan kandungan kimia ekstrak daun binahong.