AKTIVITAS RESIDU EKSTRAK BUAH Piper cubeba L.
(PIPERACEAE) DAN DAUN Tephrosia vogelii HOOK. F.
(LEGUMINOSAE) TERHADAP LARVA Crocidolomia
pavonana (F.) (LEPIDOPTERA: CRAMBIDAE)
DIMAS ALIT NUGROHO
PROGRAM STUDI HAMA DAN PENYAKIT TUMBUHAN
FAKULTAS PERTANIAN
INSTITUT PERTANIAN BOGOR
BOGOR
ABSTRAK
DIMAS ALIT NUGROHO. Aktivitas Residu Ekstrak Buah Piper cubeba L. (Piperaceae) dan Daun Tephrosia vogelii Hook. f. (Leguminosae) terhadap Larva Crocidolomia pavonana (F.) (Lepidoptera: Crambidae). Dibimbing oleh DJOKO PRIJONO.
Penelitian ini bertujuan menentukan aktivitas residu ekstrak buah Piper cubeba dan ekstrak daun Tephrosia vogelii, serta campuran dua jenis ekstrak tersebut terhadap larva Crocidolomia pavonana (F.) di laboratorium dan rumah kaca. Ekstrak yang diuji lengkap sampai dengan pengujian persistensi di rumah kaca adalah fraksi heksana (f.h.) padatan P. cubeba, f.h. T. vogelii, dan campuran f.h. padatan P. cubeba + f.h. T. vogelii. Formulasi insektisida berbahan aktif Bacillus thuringiensis (Turex WP) dan profenofos (Curacron 500 EC) digunakan sebagai pembanding. Pengujian di laboratorium dilakukan dengan metode celup daun. Pada perlakuan ekstrak P. cubeba dan T. vogelii serta B. thuringiensis, mortalitas larva masih rendah pada 24 jam sejak awal perlakuan (JAP) dan mulai meningkat pada 48 JAP. Berdasarkan nilai LC50 pada 72 JAP, urutan toksisitas
bahan uji terhadap larva C. pavonana ialah B. thuringiensis = profenofos > campuran f.h. padatan P. cubeba + f.h. T. vogelii≥ f.h. T. vogelii > f.h. padatan P. cubeba, dengan nilai LC50 berturut-turut 0,010%; 0,013%; 0,112%; 0,14%; dan
0,341%. Campuran f.h. padatan P. cubeba + f.h. T. vogelii bersifat sinergistik lemah pada taraf LC50 untuk pengamatan 48 dan 72 JAP, sedangkan pada taraf
LC95 campuran tersebut bersifat aditif pada 48 JAP dan sinergistik lemah pada 72
JAP. Perlakuan dengan residu B. thuringiensis mengakibatkan mortalitas larva yang masih tinggi hingga 7 HSP (>85%), sedangkan f.h. T. vogelii memiliki persistensi yang cukup baik (mortalitas >70% pada 7 HSP) dan campuran f.h. padatan P. cubeba + f.h. T. vogelii memiliki persistensi sedang (mortalitas >50% pada 7 HSP). Secara umum aktivitas residu bahan uji mulai menurun pada 3 HSP. Aktivitas residu profenofos menurun tajam dari 3 HSP ke 5 HSP dan 7 HSP, yaitu mortalitas larva menurun dari sekitar 70% menjadi 18% dan 0%. Dengan demikian, f.h. T. vogelii dan campurannya dengan f.h. padatan P. cubeba berpotensi untuk dimanfaatkan sebagai bahan insektisida alternatif untuk mengendalikan hama C. pavonana.
AKTIVITAS RESIDU EKSTRAK BUAH Piper cubeba L.
(PIPERACEAE) DAN DAUN Tephrosia vogelii HOOK. F.
(LEGUMINOSAE) TERHADAP LARVA Crocidolomia
pavonana (F.) (LEPIDOPTERA: CRAMBIDAE)
DIMAS ALIT NUGROHO
A44104030
Skripsi
Sebagai salah satu syarat untuk memperoleh gelar
Sarjana Pertanian pada Fakultas Pertanian, Institut Pertanian Bogor
PROGRAM STUDI HAMA DAN PENYAKIT TUMBUHAN
FAKULTAS PERTANIAN
INSTITUT PERTANIAN BOGOR
BOGOR
Judul Skripsi : Aktivitas Residu Ekstrak Buah Piper cubeba L. (Piperaceae) dan Daun Tephrosia vogelii Hook. f.
(Leguminosae) terhadap Larva Crocidolomia pavonana (F.) (Lepidoptera: Crambidae).
Nama Mahasiswa : Dimas Alit Nugroho
NIM : A44104030
Menyetujui, Pembimbing
Ir. Djoko Prijono, MAgrSc. NIP 131284820
Mengetahui, Dekan Fakultas Pertanian
Prof. Dr. Ir. Didy Sopandie, MAgr. NIP 131124019
RIWAYAT HIDUP
Penulis dilahirkan di Jakarta pada tanggal 28 Agustus 1986 sebagai anak pertama dari empat bersaudara dari pasangan Bapak Bambang Nugroho dan Ibu Eka Hujannia.
Penulis menyelesaikan pendidikan lanjutan atas di SMAN 6 Bekasi pada tahun 2004. Pada tahun yang sama penulis diterima di Jurusan Hama dan Penyakit Tumbuhan, Fakultas Pertanian, Institut Pertanian Bogor melalui jalur Undangan Seleksi Masuk Institut Pertanian Bogor (USMI).
PRAKATA
Puji dan syukur penulis panjatkan ke hadirat Allah SWT karena berkat rahmat dan karunia-Nya penulis dapat melaksanakan penelitian dan menyelesaikan penulisan skripsi yang berjudul “Aktivitas Residu Ekstrak Buah Piper cubeba L. (Piperaceae) dan Daun Tephrosia vogelii Hook. f. (Leguminosae) terhadap Larva Crocidolomia pavonana (F.) (Lepidoptera: Crambidae)”. Penelitian dan penulisan skripsi ini merupakan salah satu syarat untuk memperoleh gelar Sarjana Pertanian pada Fakultas Pertanian, Institut Pertanian Bogor. Penelitian dilaksanakan sejak September 2007 hingga Mei 2008. Sumber dana yang digunakan untuk penelitian ini merupakan bagian dari Research Grant Program B kepada pembimbing penelitian dan skripsi.
Pada kesempatan ini penulis mengucapkan terima kasih kepada:
1. Ir. Djoko Prijono, MAgrSc., selaku dosen pembimbing yang telah memberi-kan masumemberi-kan-masumemberi-kan serta informasi baru kepada penulis.
2. Dr. Ir. Widodo, MS., selaku dosen penguji tamu.
3. Dr. Ir. Hermanu Triwidodo, MSc., selaku dosen pembimbing akademik. 4. Keluarga, Bapak Bambang Nugroho, Ibu Eka Hujannia, Bunda, Eyang, Bayu,
Iyo dan Rayhan yang telah memberikan semangat, perhatian, dan kasih sayang.
5. Rekan-rekan penelitian, Ferdi, Alfi, dan Dewi, yang telah banyak membantu. 6. Astrid Riska Poetri yang selalu memberikan semangat, pengertian, dan
kesabaran.
7. Teman-teman yang bekerja di Laboratorium Fisiologi dan Toksikologi Serangga, Siti, David, Zulfirman, Manda, Maria, Intan, Mathilda, Heni, Fitri, Budi, Herma, Mika, Fariza, dan Bapak Agus Sudrajat yang telah menyemarakkan suasana penelitian.
8. Seluruh teman-teman saya, khususnya HPT’41, atas kerja samanya selama ini. Penulis berharap semoga penelitian ini dapat bermanfaat bagi perkembangan ilmu pengetahuan.
Bogor, Mei 2008
DAFTAR ISI
Halaman
DAFTAR TABEL ... viii
DAFTAR GAMBAR ... ix
DAFTAR LAMPIRAN ... x
PENDAHULUAN ... 1
Latar Belakang ... 1
Tujuan Penelitian ... 3
Manfaat Penelitian ... 3
TINJAUAN PUSTAKA ... 4
Sifat Insektisida Piper cubeba ... 4
Sifat Insektisida Tephrosia vogelii ... 5
Insektisida Pembanding Bacillus thuringiensis ... 7
Insektisida Pembanding Profenofos ... 8
Crocidolomia pavonanaSebagai Hama Tanaman Brassicaceae ... 9
Arti Ekonomi ... 9
Siklus Hidup ... 10
Pengendalian ... 10
BAHAN DAN METODE ... 12
Tempat dan Waktu Penelitian ... 12
Perbanyakakan Tanaman Pakan ... 12
Pembiakan Serangga Uji ... 12
Tumbuhan Sumber Ekstrak ... 13
Insektisida Pembanding ... 13
Ekstraksi Buah P. cubeba ... 13
Metode Pengujian ... 14
Pengujian di Laboratorium ... 14
Pengujian Persistensi di Rumah Kaca ... 17
HASIL DAN PEMBAHASAN ... 18
Pengaruh Bahan Uji terhadap Mortalitas Larva C. pavonana . 18
vii
Halaman Persistensi Bahan Uji di Rumah Kaca ... 22
Pembahasan Umum ... 25
KESIMPULAN DAN SARAN ... 29
DAFTAR PUSTAKA ... 30
DAFTAR TABEL
Halaman 1 Penduga parameter hubungan konsentrasi-mortalitas bahan uji
terhadap larva instar II C. pavonana dengan metode celup daun ... 21 2 Sifat aktivitas campuran fraksi heksana padatan P. cubeba dan fraksi
heksana T. vogelii (8:3) terhadap larva instar II C. pavonana dengan
metode celup daun ... 22 3 Pengaruh bahan ujiterhadap perkembangan larva C. pavonana ... 23 4 Mortalitas larva C. pavonana akibat perlakuan residu ekstrak P.
cubeba dan T. vogelii, serta insektisida pembanding B. thuringiensis
DAFTAR GAMBAR
Halaman 1 Perkembangan mortalitas larva C. pavonana yang diberi pakan daun
brokoli dengan perlakuan fraksi heksana (f.h.) padat P. cubeba, f.h. T. vogelii, campuran f.h. padatan P. cubeba dan f.h. T. vogelii, B.
thuringiensis, dan profenofos ... 19 2 Aktivitas bahan uji terhadap larva C. pavonana setelah dipaparkan
DAFTAR LAMPIRAN
Halaman 1 Hasil uji pendahuluan pengaruh ekstrak Piper cubeba terhadap
mortalitas dan perkembangan larva instar II Crocidolomia pavonana...
36 2 Hasil uji lanjutan pengaruh ekstrak P. cubeba (fraksi heksana
padatan) terhadap mortalitas dan perkembangan larva instar II C.
pavonana... 38 3 Hasil uji pendahuluan pengaruh ekstrak campuran fraksi heksana
minyak P. cubeba dan fraksi heksana T. vogelii terhadap mortalitas
dan perkembangan larva instar II C. pavonana ... 40 4 Hasil uji pendahuluan pengaruh campuran fraksi heksana padatan P.
cubeba dan fraksi heksana T. vogelii terhadap mortalitas dan
perkembangan larva instar II C. pavonana………. 41 5 Hasil uji lanjutan pengaruh campuran fraksi heksana padatan P.
cubeba dan fraksi heksana T. vogelii terhadap mortalitas dan
perkembangan larva instar II C. pavonana………. 42 6 Hasil uji pendahuluan pengaruh formulasi Bacillus thuringiensis
(Turex WP) terhadap mortalitas dan perkembangan larva instar II
C. pavonana………... 44 7 Hasil uji pendahuluan pengaruh formulasi profenofos terhadap
mortalitas dan perkembangan larva instar II C. pavonana………… 45 8 Hasil uji lanjutan pengaruh formulasi B. thuringiensis terhadap
mortalitas dan perkembangan larva instar II C. pavonana... 46 9 Hasil uji lanjutan pengaruh formulasi profenofos terhadap
mortalitas dan perkembangan larva instar II C. pavonana... 48 10 Hasil uji aktivitas residu ekstrak P. cubeba dan T. vogelii serta
PENDAHULUAN
Latar Belakang
Serangan organisme pengganggu tanaman (OPT) sampai saat ini masih menjadi masalah penting dalam setiap usaha pertanian. Berbagai macam cara telah dilakukan petani untuk mengendalikan OPT, salah satu di antaranya yang paling sering diterapkan ialah pengendalian kimia dengan insektisida sintetik. Aplikasi insektisida sintetik dapat dilakukan dengan mudah dan hasilnya dapat dilihat dengan cepat. Namun demikian, penggunaan insektisida secara berlebihan dan terus-menerus dapat menimbulkan berbagai masalah, di antaranya resistensi dan resurjensi hama, keracunan pada makhluk hidup bukan sasaran termasuk musuh alami hama, residu pestisida pada hasil panen, dan pencemaran lingkungan (Perry et al. 1998). Untuk mengurangi berbagai masalah akibat penggunaan insektisida sintetik, perlu dikembangkan sarana pengendalian alternatif yang efektif terhadap hama sasaran serta relatif aman terhadap lingkungan.
Bahan insektisida yang berasal dari tumbuhan (insektisida botani) merupakan sarana pengendalian alternatif yang umumnya lebih aman dibandingkan dengan insektisida sintetik sehingga sesuai untuk digunakan sebagai komponen pendukung pengendalian hama terpadu (PHT) (Prijono 2006). Tiga jenis insektisida botani, yaitu piretrin dari Tanacetum cinerariifolium (Asteraceae), nikotin dari Nicotiana spp. (Solanaceae), serta rotenon dari Derris spp. dan Lonchocarpus spp. (Leguminosae), umum digunakan dalam pengendalian hama sebelum insektisida sintetik digunakan secara luas (Prakash & Rao 1997). Sekarang insektisida botani berbahan aktif piretrin dan rotenon sering digunakan untuk mengendalikan hama pada pertanian organik selain insektisida botani berbahan aktif azadiraktin dari Azadirachta indica (Meliaceae) (Isman 2006).
kumbang gudang Sitophilus oryzae dan Callosobruchus maculatus. Di Ceko dilaporkan bahwa tiga senyawa lignan yang terdapat dalam buah kemukus, yaitu hinokinin, kubebin, dan yatein, bersifat menghambat makan (antifeedant) terhadap kumbang gudang Sitophilus granarius, Tribolium castaneum, dan Trogoderma granarium (Harmatha & Nawrot 2002). Senyawa sekunder yang umum ditemukan di dalam buah P. cubeba termasuk dalam kelompok lignan (Elfahmi et al. 2007). Buah P. cubeba dilaporkan mengandung sekurang-kurangnya 27 jenis senyawa lignan, termasuk tiga jenis senyawa yang telah disebutkan, tetapi belum semuanya telah diuji sifat insektisidanya. Senyawa lignan dari buah P. cubeba, seperti klusin, dihidroklusin, dan yatein, memiliki aktivitas yang kuat dalam menghambat kerja enzim sitokrom P450 yang dapat menguraikan senyawa asing termasuk insektisida (Usia et al. 2005). Terhambatnya kerja enzim tersebut memungkinkan insektisida yang dikombinasikan dengan senyawa lignan tadi dapat tetap bekerja. Dengan demikian ekstrak P. cubeba atau senyawa lignannya berpotensi memberikan efek sinergistik bila dicampurkan dengan insektisida lain.
Leguminosae juga merupakan famili tumbuhan yang beberapa spesiesnya telah lama diketahui bersifat insektisida, salah satu di antaranya yang terkenal ialah tuba (Derris elliptica). Akar tuba merupakan sumber insektisida botani rotenon yang banyak digunakan (Isman 2006). Tanaman Leguminosae lain yang mengandung rotenon ialah Tephrosia vogelii. Pada tanaman ini rotenon lebih banyak terdapat di bagian daun dibandingkan dengan bagian tangkai daun, batang, dan akar (Delfel et al. 1970; Hagemann et al. 1972). Dengan demikian penggunaan daun T. vogelii sebagai sumber rotenon akan lebih praktis dibandingkan dengan akar tuba.
7%. Di Indonesia, T. vogelii sering ditanam di lahan pertanian organik untuk dimanfaatkan sebagai bahan insektisida botani. Namun demikian, penelitian yang sistematis mengenai insektisida botani dari T. vogelii di Indonesia masih terbatas.
Serangga uji yang digunakan pada penelitian ini, yaitu Crocidolomia pavonana, merupakan hama penting pada tanaman Brassicaceae seperti kubis, sawi, petsai, brokoli, dan lobak. Larva C. pavonana biasanya menyerang daun tanaman hingga habis dan hanya meninggalkan tulang-tulang daun. Kerusakan yang ditimbulkan mencapai 100% bila upaya pengendalian tidak dilakukan (Sastrosiswojo & Setiawati 1993). Pengendalian yang umum dilakukan oleh petani ialah pengendalian secara kimiawi karena dapat memberikan hasil yang nyata dalam waktu singkat.
Pemanfaatan insektisida botani di tingkat petani masih terbatas karena beberapa kendala, antara lain insektisida sintetik masih lebih disukai karena mudah didapat, praktis, dan hasilnya cepat terlihat, ketersediaan bahan insektisida botani relatif terbatas; persistensi insektisida botani lebih singkat daripada insektisida sintetik; dan biaya produksi insektisida botani tidak selalu lebih murah daripada biaya produksi insektisida sintetik. Untuk mengatasi kendala tersebut, perlu dilakukan pencarian secara lebih luas jenis-jenis tumbuhan sumber insektisida botani yang efektif dan upaya untuk meningkatkan persistensinya.
Tujuan Penelitian
Penelitian ini bertujuan menentukan aktivitas residu ekstrak buah P. cubeba dan daun T. vogelii serta campuran kedua jenis ekstrak tersebut terhadap larva C. pavonana di laboratorium dan rumah kaca.
Manfaat Penelitian
TINJAUAN PUSTAKA
Sifat Insektisida Piper cubeba
Kemukus (Piper cubeba L.) merupakan perdu merambat dengan tinggi sampai 15 m. Di Jawa Tengah, tumbuhan tersebut telah lama dibudidayakan sebagai bahan ramuan obat tradisional untuk mengobati gangguan pernafasan, gangguan pencernaan, dan penyakit kelamin (Heyne 1987). Selain itu, buah kemukus juga digunakan sebagai rempah-rempah.
Penelitian tentang sifat insektisida buah kemukus masih terbatas. Di Amerika Serikat, Su (1990) melaporkan bahwa ekstrak heksana buah kemukus bersifat toksik dan repelen terhadap kumbang gudang Sitophilus oryzae dan Callosobruchus maculatus. Pada penelitian lain, Harmatha dan Nawrot (2002) di Ceko melaporkan bahwa tiga senyawa lignan yang terdapat dalam buah kemukus, yaitu hinokinin, kubebin, dan yatein, bersifat menghambat makan (antifeedant) pada kumbang gudang Sitophilus granarius, Tribolium castaneum, dan Trogoderma granarium. Pada metode dengan pilihan, penghambatan makan oleh hinokinin terhadap imago S. granarius, imago dan larva T. confusum, dan larva T. granarium berturut-turut 94,5%, 100%, 82,2%, dan 64%; penghambatan oleh kubebin 100%, 74,2%, 100%, dan 92,2%; dan penghambatan oleh yatein 100%, 100%, 83%, dan 100%.
Penyulingan buah kemukus menghasilkan minyak atsiri sebanyak 11,8% (w/w) dan dari minyak atsiri tersebut berhasil diidentifikasi 105 senyawa yang termasuk dalam golongan terpen dan seskuiterpen (Bos et al. 2007). Senyawa dalam dua kelompok tersebut banyak yang bersifat sebagai penghambat makan atau repelen terhadap serangga (Jacobson 1990). Buah kemukus juga dilaporkan mengandung senyawa amida/alkaloid piperin yang juga terdapat pada biji lada (Piper nigrum) dan tumbuhan Piperaceae lainnya serta telah dilaporkan bersifat insektisida (Parmar et al. 1997; Scott et al. 2008).
sitokrom P450 yang dapat mendegradasi insektisida (Matsumura 1985). Tiga senyawa lignan (hinokinin, kubebin, dan yatein) yang bersifat sebagai penghambat makan di atas juga mengandung gugus tersebut (Harmatha & Nawrot 2002). Campuran tiga macam amida tak jenuh dari biji lada yang mengandung gugus metilendioksifenil, yaitu piperisida, dihidropiperisida, dan guininsin, menunjukkan sinergisme tinggi terhadap kumbang Callosobruchus chinensis (Miyakado et al. 1989).
Bernard et al. (1989) melaporkan bahwa kubebin dapat menghambat aktivitas enzim mikrosoma (sitokrom P450) dari saluran pencernaan ulat penggerek batang jagung Ostrinia nubilalis. Beberapa senyawa lignan dari buah kemukus dilaporkan menghambat aktivitas sitokrom P450 3A4 (CYP3A4) dari mikrosoma hati manusia yang berperan dalam mendegradasi senyawa asing termasuk obat-obatan (Usia et al. 2005). IC50 (konsentrasi yang menghambat
aktivitas enzim sebesar 50%) klusin dan yatein terhadap CYP3A4 masing-masing
0,83 dan 1 µM, yang setara dengan kontrol positif (ketokonazol, IC50 0,72 µM).
Dengan memperhatikan kemampuan senyawa aktif buah kemukus untuk menghambat aktivitas enzim pendegradasi senyawa asing, ekstrak buah kemukus juga akan diuji dalam bentuk campuran dengan ekstrak T. vogelii dengan harapan terjadi sinergisme di antara kedua jenis ekstrak tersebut. Penggunaan campuran insektisida botani yang bersifat sinergis dapat menghemat bahan insektisida karena komponen dalam campuran akan digunakan dalam dosis yang rendah daripada dosis masing-masing komponen secara terpisah.
Sifat Insektisida Tephrosia vogelii
Kacang babi (Tephrosia vogelii) merupakan tumbuhan perdu tahunan yang tumbuh dengan cepat, bercabang agak banyak, dan tinggi mencapai 2–3 m. Di Jawa, kacang babi sering ditanam di perkebunan cokelat, karet, kina, dan kopi sebagai pupuk hijau dan penahan angin (Heyne 1987).
tanah Caryedon serratus sebesar 98,8% (kontrol 14%). Serbuk daun T. vogelii dilaporkan bersifat repelen terhadap kumbang C. maculatus (Boeke et al. 2004). Koona dan Dorn (2005) melaporkan bahwa perlakuan ekstrak heksana daun T. vogelii pada biji kacang-kacangan dengan konsentrasi 1% mengakibatkan kematian kumbang Acanthoscelides obtectus, C. maculatus, dan C. chinensis sebesar 18%–23% dan menurunkan peneluran sebesar 92%–94%, sehingga kerusakan biji dapat ditekan menjadi 7,1% (kerusakan biji pada kontrol rata-rata 99,8%). Baru-baru ini, Reuben et al. (2006) melaporkan bahwa pencampuran tepung daun T. vogelii 2% pada biji kapri dapat menurunkan kerusakan biji oleh kumbang C. maculatus dari 33,1% menjadi 7%.
Daun dan bagian lain tanaman T. vogelii mengandung senyawa rotenoid yang bersifat insektisida, seperti rotenon, deguelin, dan tefrosin (Delfel et al. 1970; Marston et al. 1984; Lambert et al. 1993; Koona & Dorn 2005). Pada tanaman T. vogelii yang ditanam di beberapa lokasi di wilayah timur Amerika Serikat, kandungan rotenon pada daun (0,5%–1,3%) lebih tinggi dibandingkan dengan pada tangkai daun, batang, dan akar (Delfel et al. 1970). Peneliti tersebut juga melaporkan bahwa kandungan deguelin pada daun 4–7 kali lebih tinggi daripada rotenon. Pada penelitian selanjutnya, Hagemann et al. (1972) melaporkan bahwa kandungan rotenon pada daun meningkat dengan bertambahnya umur tanaman. Pada salah satu galur T. vogelii, kandungan rotenon daun meningkat dari 0,3% (tanaman umur 42 hari) menjadi 1,1% (140 hari) dan kandungan deguelin meningkat dari 1,1% menjadi 1,9%. Rotenoid juga dapat dihasilkan oleh kultur kalus yang berasal dari eksplan hipokotil bibit T. vogelii. Lambert et al. (1993) melaporkan bahwa konsentrasi rotenon pada kultur kalus T. vogelii yang mengandung klorofil dapat mencapai 570 µg per g bobot kering setelah inkubasi selama 20 hari.
elektron antara NADH dehidrogenase dan koenzim Q di kompleks I pada rantai transpor elektron di dalam mitokondria (Hollingworth 2001). Hambatan terhadap proses respirasi sel ini menyebabkan produksi ATP menurun sehingga kekurangan energi yang selanjutnya dapat menyebabkan kelumpuhan berbagai sistem otot dan kematian.
Insektisida Pembanding Bacillus thuringiensis
Bacillus thuringiensis termasuk dalam ordo Eubacteriales, famili Bacillaceae, kelas Schizomycetes. Bakteri tersebut berbentuk batang dan bersifat gram positif (Balitbiogen 2008). Pada habitat yang banyak menghasilkan nutrisi, B. thuringiensis dapat melakukan reproduksi secara vegetatif, namun pada saat kekurangan nutrisi dapat membentuk spora dorman yang mengandung satu atau lebih jenis kristal protein. Kristal δ-endotoksin bersifat letal jika termakan oleh serangga yang rentan sehingga dapat digunakan untuk mengendalikan hama (Glare & O’Callahan. 2000; Bahagiawati 2002).
Racun yang diproduksi oleh B. thuringiensis antara lain δ-endotoksin yang menunjukkan aktivitas insektisida, eksotoksin yang beracun bagi mamalia jika digunakan dengan dosis yang tinggi, hemolisin, dan enterotoksin. Protein kristal yang dihasilkan oleh B. thuringiensis lebih ramah lingkungan karena mempunyai sasaran yang spesifik sehingga tidak mematikan serangga bukan sasaran dan mudah terurai sehingga tidak menumpuk dan mencemari lingkungan. Salah satu kelemahan bioinsektisida B. thuringiensis adalah kepekaan bioinsektisida tersebut terhadap sinar ultraviolet, sehingga keefektifannya di lapangan tidak bertahan lama (Bahagiawati 2002).
meningkatkan tingkat mortalitas serangga, dan kristal tanpa spora hanya akan menyebabkan mortalitas yang rendah (Glare & O’Callahan 2000).
Bioinsektisida B. thuringiensis merupakan 90–95% dari bioinsektisida yang dikomersialkan dan dipakai petani di berbagai negara. B. thuringiensis aktif untuk mengendalikan berbagai jenis hama, terutama dari ordo Lepidoptera (Glare & O’Callahan 2000). Di Indonesia sekarang terdaftar 13 formulasi yang berbahan aktif B. thuringiensis, antara lain Agrisal WP, Bacillin WP, Bite WDG, Bite FC, dan Turex WP (Ditsarpro 2006).
Insektisida Pembanding Profenofos
Profenofos merupakan insektisida sintetik yang termasuk dalam golongan organofosfat. Nama kimia profenofos ialah o-(4 bromo-2-klorofenil)-o-etil-S-propil fosforotioat. Profenofos diperkenalkan oleh Ciba-Geigy pada tahun 1975 sebagai insektisida untuk mengendalikan hama sayuran dan kapas (Cremlyn 1991).
Profenofos berbentuk cair dengan warna kuning pucat, dengan titik didih 110 ºC (0,001 mmHg) dan tekanan uap 1,3 mPA pada 20 ºC. Massa jenis profenofos 1,455 g/cm3 pada 20 ºC. Kelarutan profenofos dalam air 20 mg/l, tetapi insektisida tersebut lebih mudah larut dalam pelarut organik. Profenofos terhidrolisis pada 20 ºC dan sifat racunnya akan hilang sebesar 50% dalam waktu 93 hari pada pH 5, dalam waktu 14,6 hari pada pH 7, dan dalam waktu 5,7 hari pada pH 9 (Worthing 1991).
Profenofos bersifat sebagai racun kontak dan racun perut yang tidak sistemik (Worthing 1991). Insektisida tersebut bekerja sebagai racun saraf dengan menghambat kerja enzim asetilkolinesterase di daerah sinapsis sistem saraf pusat serangga. Penumpukan asetilkolin di daerah pascasinapsis mengakibatkan kekacauan penghantaran impuls saraf. Keadaan ini menyebabkan pesan-pesan berikutnya tidak dapat diteruskan, otot kejang, dan berakhir dengan kelumpuhan dan kematian (Matsumura 1985). Peracunan oleh insektisida tersebut dapat menimbulkan kematian yang cepat pada serangga, yaitu dalam waktu 24–48 jam (Worthing 1991).
Profenofos efektif digunakan dengan metode semprot terhadap hama menusuk-mengisap seperti kutu daun, tungau dan trips dengan dosis bahan akif 250–500 g/ha dan serangga menggigit-mengunyah dengan dosis bahan aktif 400– 1200 g/ha (Worthing 1991). Formulasi profenofos yang sekarang beredar di Indonesia berjumlah sekitar 12, di antaranya Anwavin 500 EC, Akron 500 EC, Curacron 500 EC, dan Seledol 450 EC (Ditsarpro 2006).
Crocidolomia pavonana Sebagai Hama Tanaman Brassicaceae Arti Ekonomi
C. pavonana merupakan hama penting pada tanaman Brassicaceae (Cruciferae), seperti kubis, sawi, dan lobak. Serangga yang bersifat oligofag ini tersebar di wilayah Asia Tenggara dan Selatan, Afrika Selatan, Australia tropik, dan Kepulauan di Samudera Pasifik, sedangkan di Indonesia persebarannya meliputi Sumatera Utara, Sumatera Selatan, Jawa Barat, Jawa Tengah, Jawa Timur, Bali, Nusa Tenggara Barat, Sulawesi Selatan, dan Sulawesi Utara (Kalshoven 1981; Deptan 2007).
Larva instar awal memakan daun dan hanya meninggalkan lapisan epidermis. Bagian yang diserang terutama bagian dalam yang terlindung daun hingga mencapai titik tumbuh (Sastrosiswojo & Setiawati 1993). Larva makan pada permukaan bawah daun atau bagian yang tertutup, karena larva C. pavonana menghindari sinar matahari. Larva menyerang secara berkelompok dan makan daun dengan rakus dan hanya menyisakan tulang daun. Dalam populasi yang tinggi terdapat kotoran berwarna hijau bercampur dengan benang-benang sutera di sekitar daun. Pada kubis, larva dapat menyerang sejak fase sebelum pembentukan krop (0–49 hari setelah tanam [HST]) hingga fase pembentukan krop (49–85 HST) (Deptan 2007).
Siklus Hidup
sampai 12 hari. Larva instar I berwarna kuning kehijauan dengan kepala cokelat tua dan lama stadium rata-rata sekitar 2 hari. Instar II berwarna hijau muda, dengan panjang 5,5–6,1 mm dan lama stadium rata-rata sekitar 2 hari. Instar III berwarna hijau, dengan panjang 1,1–1,3 cm dan lama stadium rata-rata 1,5 hari. Larva instar IV berwarna hijau dengan tiga titik hitam dan tiga garis memanjang pada bagian dorsal serta satu lainnya di sisi lateral. Menjelang berpupa larva akan berhenti makan dan terdapat perubahan warna tubuh dari hijau menjadi cokelat. Lama stadium larva instar IV berkisar 3–6 hari. Larva C. pavonana berpupa di dalam kokon sutera yang diselimuti dengan butiran tanah. Pupa berwarna cokelat dengan lama stadium 10–14 hari. Lama perkembangan keseluruhan dari telur hingga menjadi imago betina berkisar 23–28 hari, sedangkan untuk imago jantan berkisar 24–29 hari (Prijono & Hassan 1992).
Pengendalian
BAHAN DAN METODE
Tempat dan Waktu Penelitian
Penelitian dilaksanakan di Laboratorium Fisiologi dan Toksikologi Serangga, Departemen Proteksi Tanaman, Fakultas Pertanian, dan rumah kaca University Farm Institut Pertanian Bogor (IPB), sejak September 2007 hingga Mei 2008.
Perbanyakan Tanaman Pakan
Tanaman brokoli (Brassica oleracea L. var. italica Plenck) digunakan untuk penyediaan pakan serangga uji serta sebagai medium perlakuan pada uji hayati di laboratorium dan percobaan persistensi di rumah kaca. Untuk keperluan pakan serangga uji, tanaman brokoli diperbanyak secukupnya. Benih brokoli cv. Liberty (Petoseed, Oxnard, California) disemai pada nampan semai 50 lubang dengan media semai campuran tanah dan kompos (Super Metan, PT. Enka Saritani, Jakarta). Satu butir pupuk majemuk pelepasan perlahan NPK 22-8-4 (”Dekastar”) ditambahkan pada setiap lubang semai pada saat penyemaian benih. Bibit brokoli yang telah memiliki sekurang-kurangnya empat daun yang telah membuka sempurna dipindahkan ke polybag (5 L) yang berisi media tanam tanah dan pupuk kandang dengan perbandingan 3:1 (v/v). Setiap polybag berisi satu bibit brokoli. Tindakan pemeliharaan yang dilakukan meliputi penyiraman, penyiangan, pemupukan, dan pengendalian hama secara mekanis. Daun dari tanaman brokoli yang berumur sekitar 2 bulan digunakan sebagai pakan serangga uji dan medium perlakuan pada uji hayati di laboratorium.
Pembiakan Serangga Uji
Menjelang berpupa, larva dipindahkan ke dalam wadah plastik lain dengan dialasi dua lembar kertas stensil sebagai kertas hisap dan diberi serbuk gergaji sebagai medium berpupa. Pupa-pupa yang sudah terbentuk dipindahkan ke dalam kurungan plastik-kasa berbingkai kayu (50 cm x 50 cm x 50 cm) hingga menjadi imago. Imago diberi pakan larutan madu 10% yang diserapkan pada kapas. Daun brokoli bertangkai dimasukkan ke dalam botol film berisi air dan diletakkan di dalam kurungan sebagai tempat peletakan telur. Kelompok telur pada daun tersebut dikumpulkan setiap hari. Menjelang menetas, kelompok telur dipindahkan ke dalam wadah plastik seperti di atas yang berisi daun brokoli bebas pestisida. Larva instar II yang baru ganti kulit digunakan untuk pengujian. Jika tidak digunakan untuk pengujian, larva dipelihara lebih lanjut dengan pakan daun brokoli bebas pestisida.
Tumbuhan Sumber Ekstrak
Bahan tumbuhan yang digunakan sebagai sumber ekstrak adalah buah kemukus (Piper cubeba) dan daun kacang babi (Tephrosia vogelii) yang masing-masing diperoleh dari Sdr. Pranowo (Muntilan, Jawa Tengah) dan Lembaga Pertanian Sehat, Dompet Dhuafa Republika di Kecamatan Caringin, Kabupaten Bogor (636 m dpl, 60 44’ 44,7” LS dan 1060 49’ 57,5” BT).
Insektisida Pembanding
Insektisida pembanding yang digunakan ialah formulasi berbahan aktif Bacillus thuringiensis (Turex WP, bahan aktif delta-endotoksin B. thuringiensis var. aizawai strain GC-91 3,8%, 25.000 IU/mg) dan profenofos (Curacron 500 EC, bahan aktif 499,53 g/l), yang masing-masing diperoleh dari PT. Tanindo Subur Prima dan PT. Syngenta Indonesia, Jakarta.
Ekstraksi Buah P. cubeba
cubeba sebanyak 400 g direndam dalam 2 l pelarut heksana selama sekurang-kurangnya 24 jam. Cairan hasil rendaman disaring menggunakan kertas saring Whatman No. 41 yang diletakkan pada corong kaca dan ditampung dalam labu penguap. Cairan hasil saringan diuapkan dengan rotary evaporator pada suhu 50
0
C dan tekanan 335 mbar. Ampas serbuk P. cubeba yang tertinggal setelah penyaringan direndam ulang sebanyak delapan kali masing-masing dengan 1,5 l heksana. Pada perendaman terakhir, larutan hasil penyaringan berwarna sangat muda (mendekati tidak berwarna). Ekstraksi pada tahap pertama menghasilkan ekstrak yang berwujud campuran minyak dan padatan, yang kemudian dipisahkan menjadi fraksi minyak dan padatan.
Pada tahap kedua, ampas P. cubeba setelah perendaman terakhir dengan heksana dikeringkan di dalam kamar asap (fume hood), kemudian direndam berulang-ulang dengan etil asetat sebanyak tujuh kali, masing-masing sebanyak 1,5 l. Cairan hasil rendaman disaring dan diuapkan seperti pada tahap pertama dengan tekanan 240 mbar. Ampas P. cubeba setelah perendaman terakhir dengan etil asetat direndam berulang-ulang dengan metanol sebanyak delapan kali masing-masing sebanyak 1,5 l. Cairan hasil rendaman disaring dan diuapkan seperti pada tahap sebelumnya dengan tekanan 337 mbar.
Ekstraksi bertahap di atas menghasilkan fraksi heksana minyak, fraksi heksana padatan, fraksi etil asetat, dan fraksi metanol P. cubeba berturut-turut 74,49; 2,72; 4,31; dan 20,21 g. Pada ekstraksi bertahap daun T. vogelii (300 g) dengan tiga jenis pelarut yang sama diperoleh fraksi heksana yang paling aktif (14,17 g) (Wulan 2008) sehingga hanya fraksi tersebut yang digunakan dalam penelitian ini. Setiap ekstrak disimpan di dalam lemari es pada suhu 4 0C hingga digunakan untuk pengujian.
Metode Pengujian
Pengujian di Laboratorium
thuringiensis (Turex WP) dan profenofos (Curacron 500 EC). Pengujian dilakukan melalui uji pendahuluan untuk semua jenis ekstrak uji dan insektisida pembanding. Pada uji pendahuluan, setiap jenis ekstrak diuji pada konsentrasi 0,5% dan 0,1% (w/v). Konsentrasi B. thuringiensis untuk uji pendahuluan ialah 0,05%, 0,01%, dan 0,005% (% formulasi, w/v), sedangkan profenofos 0,02%, 0,004%, dan 0,002% (% formulasi, v/v).
Semua pengujian dilakukan dengan menggunakan metode celup daun. Semua fraksi P. cubeba dan T. vogelii, kecuali fraksi metanol P. cubeba dicampur dengan campuran aseton, metanol, dan Tween-80 (5:5:2) kemudian diencerkan dengan air suling sesuai dengan konsentrasi yang diinginkan. Konsentrasi akhir aseton, metanol, dan Tween-80 dalam suspensi ekstrak uji berturut-turut 0,5%, 0,5%, dan 0,2% (v/v). Air yang mengandung aseton 0,5%, metanol 0,5%, dan Tween-80 0,2% digunakan sebagai larutan kontrol. Fraksi metanol P. cubeba dicampur dengan campuran metanol dan Tween-80 (5:1, konsentrasi akhir 1% dan 0,2%) kemudian diencerkan dengan air suling hingga diperoleh konsentrasi yang diinginkan. Larutan kontrol berupa air yang mengandung metanol dan Tween-80 masing-masing 1% dan 0,2%. Formulasi B. thuringiensis dan profenofos diencerkan dengan air yang mengandung 80 0,2% (kontrol: air + Tween-80 0,2%).
Daun brokoli dipotong bujursangkar 4 cm x 4 cm kemudian dicelup dalam sediaan bahan uji dan larutan kontrol yang sudah disiapkan hingga basah merata, lalu dikeringkan di atas kertas stensil. Satu potong daun perlakuan atau kontrol diletakkan dalam cawan petri (diameter 9 cm) yang dialasi tisu dengan ukuran melebihi diameter cawan petri sehingga cawan petri tertutup rapat dan larva tidak dapat keluar dari cawan petri. Selanjutnya 15 ekor larva instar II C. pavonana yang baru ganti kulit dimasukkan ke dalam cawan petri tersebut. Larva diberi makan daun perlakuan selama 2 x 24 jam, dan 24 jam berikutnya larva diberi makan daun tanpa perlakuan. Mortalitas larva diamati setiap hari sampai hari ke-3 (72 jam sejak awal perlakuan [JAP]). Pada uji pendahuluan setiap perlakuan dan kontrol diulang tiga kali.
pavonana antara 0% dan 100% (eksklusif). Cara pengujian dan pengamatan sama seperti pada uji pendahuluan. Data mortalitas larva C. pavonana diolah dengan analisis probit menggunakan program POLO-PC (LeOra Software 1987). Data lama perkembangan larva berdasarkan data persentase larva yang berhasil berkembang menjadi instar III pada 72 JAP diolah dengan sidik ragam berdasarkan rancangan acak lengkap, yang dilanjutkan dengan uji selang berganda Duncan untuk pembandingan nilai tengah antarperlakuan. Sidik ragam tersebut dilakukan dengan menggunakan paket program SAS (SAS Institute 1990).
Sifat aktivitas campuran f.h. padatan P. cubeba dan f.h. T. vogelii dianalisis berdasarkan model kerja bersama berbeda dengan menghitung indeks kombinasi (IK) pada taraf LC50 dan LC95 (Chou & Talalay 1984):
vogelii pada pengujian secara terpisah;
LCx1(cm) dan LCx2(cm) masing-masing merupakan LCx komponen f.h. P. cubeba
dan f.h. T. vogelii dalam campuran yang mengakibatkan mortalitas x (contoh 50% dan 95%). Nilai LCx dalam campuran diperoleh berdasarkan pengalian LCx
campuran dengan proporsi konsentrasi komponen P. cubeba dan T. vogelii dalam campuran.
Kategori sifat interaksi campuran adalah sebagai berikut (Gisi 1996; Kosman & Cohen 1996):
a. bila IK < 0,5, komponen campuran bersifat sinergistik kuat; b. bila IK 0,5-0,77, komponen campuran bersifat sinergistik lemah; c. bila IK > 0,77-1,43, komponen campuran bersifat aditif;
d. bila IK > 1,43, komponen campuran bersifat antagonistik.
Pengujian Persistensi di Rumah Kaca
Percobaan disusun dalam rancangan acak kelompok dengan enam perlakuan dan empat ulangan. Perlakuan yang dicobakan adalah (1) f.h. padatan P. cubeba, (2) f.h. T. vogelli, (3) campuran f.h. P. cubeba padat + f.h. T. vogelii, (4) B. thuringiensis, (5) profenofos, dan (6) kontrol.
Cara penyiapan bahan uji sama seperti penyiapan bahan pada pengujian di laboratorium. Konsentrasi bahan yang dicobakan adalah 2 x LC95 berdasarkan
hasil pengujian di laboratorium. Konsentrasi tersebut merupakan hasil penggandaan dua kali lipat dari LC95 untuk mempertimbangkan kemungkinan
terjadinya degradasi oleh faktor-faktor lingkungan.
Metode yang digunakan adalah metode penyemprotan pada tanaman brokoli dalam polybag di rumah kaca. Sediaan ekstrak dan insektisida pembanding serta larutan kontrol disemprotkan pada tanaman brokoli yang berumur kurang lebih 3 bulan dengan menggunakan hand sprayer. Untuk setiap perlakuan digunakan satu tanaman brokoli yang telah memiliki sekurang-kurangnya enam daun yang seragam. Daun brokoli diambil dari setiap tanaman brokoli perlakuan pada 0, 1, 3, 5, dan 7 hari setelah penyemprotan. Daun brokoli yang diambil dipotong menjadi bagian yang lebih kecil dan dimasukkan ke dalam cawan petri (diameter 9 cm) dengan metode yang sama seperti pengujian di laboratorium. Ke dalam setiap cawan petri tersebut dimasukkan 15 larva instar II C. pavonana yang baru ganti kulit. Pengamatan mortalitas larva dilakukan pada 72 jam sejak awal perlakuan. Data mortalitas larva diolah dengan sidik ragam menggunakan paket program SAS (SAS Institute 1990), yang dilanjutkan dengan uji selang berganda Duncan pada taraf nyata 5% untuk mengetahui perbedaan nilai tengah antarperlakuan.
HASIL DAN PEMBAHASAN
Pengaruh Bahan Uji terhadap Mortalitas Larva C. pavonana
Pada uji pendahuluan, perlakuan dengan f.h. padatan P. cubeba, f.h. T. vogelii, campuran f.h. padat P. cubeba + f.h. T. vogelii, B. thuringiensis, dan profenofos pada konsentrasi tertinggi mengakibatkan mortalitas larva instar II C. pavonana ≥ 80%. Fraksi heksana minyak, fraksi etil asetat, dan fraksi metanol P. cubeba pada konsentrasi sampai 0,5% tidak aktif (mortalitas antara 0% dan 2,3%) Ekstrak yang aktif diuji lebih lanjut pada lima taraf konsentrasi yang diharapkan dapat mematikan larva antara 0% sampai 100% (eksklusif).
Perlakuan dengan f.h. padatan P. cubeba, f.h. T. vogelii, campuran f.h. padat P. cubeba + f.h. T. vogelii, dan B. thuringiensis umumnya belum mengakibatkan kematian atau mengakibatkan kematian larva C. pavonana yang sangat rendah pada 24 JAP. Kematian serangga uji mulai tampak nyata pada 48 JAP dan makin meningkat pada 72 JAP (Gambar 1). Berbeda dengan pengaruh ekstrak bahan tumbuhan uji dan B. thuringiensis, profenofos telah mengakibatkan kematian serangga uji yang cukup tinggi pada 24 JAP dan hanya terjadi peningkatan kematian yang relatif rendah pada 48 dan 72 JAP. Pengaruh kematian dari profenofos yang terlihat cukup cepat sesuai dengan sifat insektisida tersebut sebagai racun perut dan racun kontak, serta cara kerja racun tersebut sebagai racun saraf. Sementara itu, ekstrak P. cubeba dan T. vogelii memiliki efek kontak terbatas dan B. thuringiensis hanya bersifat sebagai racun perut.
0
>50% diolah dengan analisis probit untuk menentukan hubungan konsentrasi-mortalitas, termasuk menentukan LC50 dan LC95.
0
Waktu penga matan (J AP )
Ko ntro l tidak ada kematian serangga kontrol.
D A
E
B
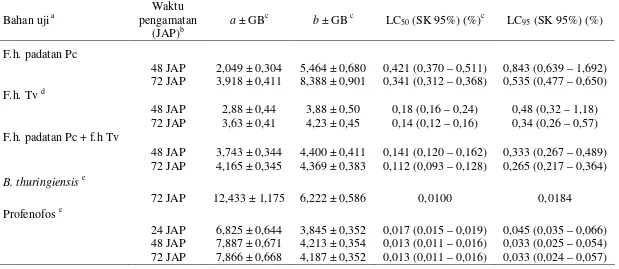
Berdasarkan nilai LC95 pada 72 JAP, f.h. T. vogelii serta campurannya
dengan f.h. padatan P.cubeba aktif terhadap larva C. pavonana (LC95 lebih kecil
dari 0,5%) dan f.h. padatan P. cubeba cukup aktif (SK 95% dari LC95 mencakup
angka 0,5%) (Tabel 1). Insektisida pembanding B. thuringiensis dan profenofos masih efektif terhadap larva C. pavonana karena LC95 B. thuringiensis hanya
sekitar sepertiga sampai seperlima konsentrasi anjurannya (0,05%-0,1%) dan LC95
profenofos hanya sekitar seperenam konsentrasi anjurannya (0,2%). Berdasarkan nilai LC50 pada 72 JAP, urutan toksisitas bahan uji terhadap larva C. pavonana
ialah B. thuringiensis = profenofos > campuran f.h. padatan P. cubeba + f.h. T. vogelii ≥ f.h. T. vogelii > f.h. padatan P. cubeba, sedangkan berdasarkan nilai LC95, urutan toksisitas bahan uji ialah B. thuringiensis ≥ profenofos > campuran
f.h. padatan P. cubeba + f.h. T. vogelii = f.h. T. vogelii ≥ f.h. padatan P. cubeba. Campuran f.h. padatan P. cubeba + f.h. T. vogelii memiliki nilai LC50 dan LC95
yang lebih rendah dibandingkan dengan LC50 dan LC95 komponen campuran
tersebut yang diuji secara terpisah (Tabel 1). Berdasarkan indeks kombinasi, campuran tersebut bersifat sinergistik lemah pada taraf LC50 untuk pengamatan 48
dan 72 JAP, sedangkan pada taraf LC95 campuran tersebut bersifat aditif pada 48
JAP dan sinergistik lemah pada 72 JAP (Tabel 2).
Pengaruh Bahan Uji terhadap Perkembangan Larva C. pavonana Data lama perkembangan larva C. pavonana yang dianalisis berasal dari perlakuan konsentrasi yang menyisakan larva yang bertahan hidup ≥ 30 ekor pada 72 JAP. Perbedaan jumlah larva yang dapat bertahan hidup hingga 72 JAP dipengaruhi oleh cara kerja racun yang terkandung dalam setiap bahan uji. Perlakuan dengan campuran f.h. P. cubeba dan f.h. T. vogelii 0,10% menghambat perkembangan larva C. pavonana menjadi instar III sebesar 98% dan perlakuan dengan f.h. T. vogelii 0,04%–0,16% menghambat perkembangan larva sebesar 95,8%–100% dibandingkan dengan kontrol. Fraksi heksana padatan P. cubeba 0,3% menghambat perkembangan larva lebih dari 92%. Ekstrak yang tidak aktif dalam mematikan larva C. pavonana, yaitu f.h. minyak, fraksi etil asetat, dan fraksi metanol P. cubeba, hingga konsentrasi 0,5% juga tidak menunjukkan efek
Bahan uji a
Waktu pengamatan
(JAP)b
a ± GBc b ± GB c LC50 (SK 95%) (%)c LC95 (SK 95%) (%)
F.h. padatan Pc
48 JAP 2,049 ± 0,304 5,464 ± 0,680 0,421 (0,370 – 0,511) 0,843 (0,639 – 1,692) 72 JAP 3,918 ± 0,411 8,388 ± 0,901 0,341 (0,312 – 0,368) 0,535 (0,477 – 0,650) F.h. Tv d
48 JAP 2,88 ± 0,44 3,88 ± 0,50 0,18 (0,16 – 0,24) 0,48 (0,32 – 1,18) 72 JAP 3,63 ± 0,41 4,23 ± 0,45 0,14 (0,12 – 0,16) 0,34 (0,26 – 0,57) F.h. padatan Pc + f.h Tv
48 JAP 3,743 ± 0,344 4,400 ± 0,411 0,141 (0,120 – 0,162) 0,333 (0,267 – 0,489) 72 JAP 4,165 ± 0,345 4,369 ± 0,383 0,112 (0,093 – 0,128) 0,265 (0,217 – 0,364) B. thuringiensis e
72 JAP 12,433 ± 1,175 6,222 ± 0,586 0,0100 0,0184 Profenofos e
24 JAP 6,825 ± 0,644 3,845 ± 0,352 0,017 (0,015 – 0,019) 0,045 (0,035 – 0,066) 48 JAP 7,887 ± 0,671 4,213 ± 0,354 0,013 (0,011 – 0,016) 0,033 (0,025 – 0,054) 72 JAP 7,866 ± 0,668 4,187 ± 0,352 0,013 (0,011 – 0,016) 0,033 (0,024 – 0,057) a
F.h. padatan Pc = fraksi heksana padatan Piper cubeba, f.h. Tv = fraksi heksana T. vogelii.
b
JAP = jam sejak awal perlakuan.
c
a = intersep garis regresi probit, b = kemiringan garis regresi probit, GB = galat baku, SK = selang kepercayaan.
d
Sumber : Wulan (2008).
e
Konsentrasi dalam % formulas
Tabel 2 Sifat aktivitas campuran fraksi heksana padatan P. cubeba dan fraksi heksana T. vogelii (8:3) terhadap larva instar II C. pavonana dengan metode celup daun
a
Jam sejak awal perlakuan.
penghambatan perkembangan terhadap larva C. pavonana. Perlakuan dengan B. thuringiensis 0,003%–0,009% mengakibatkan penghambatan perkembangan larva C. pavonana sebesar 24%–78%, sedangkan perlakuan profenofos 0,005%– 0,0125% tidak menunjukkan efek penghambatan perkembangan yang nyata (Tabel 3). Profenofos merupakan racun saraf yang bekerja cepat yang pengaruhnya dapat terlihat segera setelah aplikasi dan setelah daun perlakuan diganti dengan daun tanpa perlakuan pengaruhnya sudah tidak tampak nyata.
Persistensi Bahan Uji di Rumah Kaca
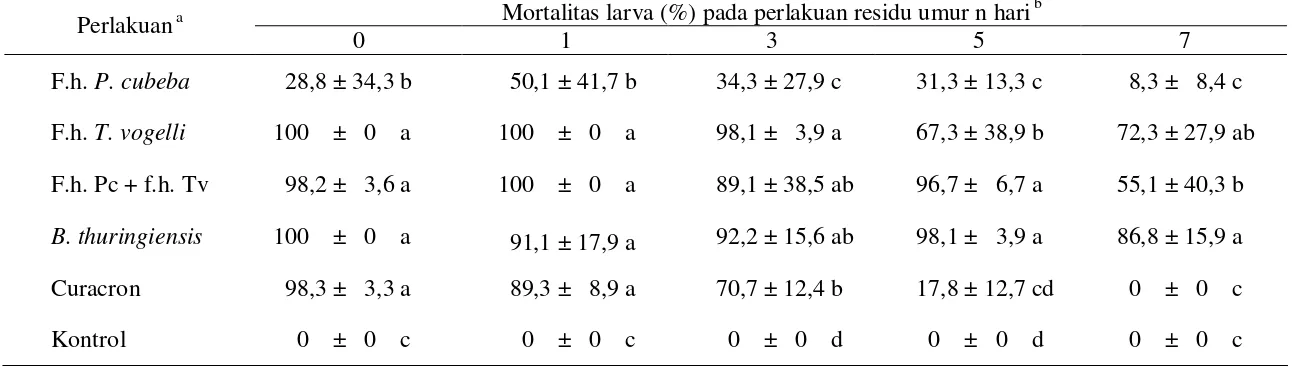
Pada perlakuan 0 hari setelah penyemprotan (HSP), semua bahan uji menyebabkan mortalitas larva C. pavonana >95%, kecuali perlakuan f.h. padatan P. cubeba yang hanya menyebabkan mortalitas sebesar 28,8%. Mortalitas larva pada perlakuan dengan semua bahan uji berbeda nyata dengan kontrol, kecuali pada perlakuan f.h. P. cubeba dan profenofos pada 7 HSP, serta mortalitas larva pada perlakuan P. cubeba lebih rendah dibandingkan dengan empat perlakuan lainnya (Tabel 4). Secara umum residu bahan uji menunjukkan penurunan aktivitas yang cukup nyata mulai 3 HSP. Penurunan aktivitas secara nyata terjadi pada residu profenofos yang pada perlakuan 7 HSP sudah tidak aktif (mortalitas larva 0%). Mortalitas akibat perlakuan dengan residu f.h. padatan P. cubeba pada 2 HSP sempat meningkat dari 28,8% menjadi 50,1%, namun pada 3–5 HSP mengalami penurunan secara nyata (Gambar 2).
Indeks kombinasi Sifat Interaksi Waktu
pengamatan
(JAP)a LC50 LC95 LC50 LC95
48 0,506 0,781 Sinergistik lemah Aditif 72 0,500 0,659 Sinergistik lemah Sinergistik lemah
Tabel 3 Pengaruh bahan ujiterhadap perkembangan larva C. pavonana
Konsentrasi Rata-rata instar III ± SB Bahan uji
(%) (%) (N)a
F.h. padatan Pc 0,30 7,4 ± 7,3c (46) 0,20 77,4 ± 14,03b (72) 0,10 100 ± 0a (73) Kontrol 100 ± 0a (73) F.h. minyak Pc 0,1 97,6 ± 4,12a (44) 0,5 97,8 ± 3,85a (44) Kontrol 100 ± 0a (45)
F.e. Pc 0,1 100 ± 0a (44)
0,5 100 ± 0b (44) Kontrol 100 ± 0c (44)
F.m. Pc 0,1 100 ± 0a (43)
0,5 100 ± 0b (46) Kontrol 100 ± 0c (45) F.h. Tv 0,16 2,5b (32) 0,12 0b (56) 0,08 1,5b (59) 0,04 4,2b (72) Kontrol 100a (74) F.h. padatan Pc + f.h. Tv 0,10 2,0 ± 4,5c (33)
0,05 10,8 ± 5,9b (74) Kontrol 100 ± 0a (75) F.h. minyak Pc + f.h. Tv 0,1 70,4 ± 12,7b (32) 0,5 0 ± 0c (0) Kontrol 100 ± 0a (46) B. thuringiensis 0,009 12,3 ± 18,1c (60) 0,006 63,9 ± 35,1b (66) 0,003 75,8 ± 25ab (72) Kontrol 100 ± 0a (74) Profenofos 0,0125 95 ± 7,5a (32) 0,008 98,5 ± 3,4a (69) 0,005 100 ± 6,7a (69) Kontrol 100 ± 6,7a (77) a
Untuk setiap kelompok ekstrak, rataan selajur yang diikuti oleh huruf yang sama tidak
berbeda nyata (uji selang berganda Duncan, = 0,05); SB = simpangan baku; N =
jumlah larva yang bertahan hidup.
Tabel 4 Mortalitas larva C. pavonana akibat perlakuan dengan residu ekstrak P. cubeba dan T. vogelli, serta insektisida pembanding B. thuringiensis dan profenofos
Mortalitas larva (%) pada perlakuan residu umur n hari b Perlakuan a
0 1 3 5 7
F.h. P. cubeba 28,8 ± 34,3 b 50,1 ± 41,7 b 34,3 ± 27,9 c 31,3 ± 13,3 c 8,3 ± 8,4 c
F.h. T. vogelli 100 ± 0 a 100 ± 0 a 98,1 ± 3,9 a 67,3 ± 38,9 b 72,3 ± 27,9 ab
F.h. Pc + f.h. Tv 98,2 ± 3,6 a 100 ± 0 a 89,1 ± 38,5 ab 96,7 ± 6,7 a 55,1 ± 40,3 b
B. thuringiensis 100 ± 0 a 91,1 ± 17,9 a 92,2 ± 15,6 ab 98,1 ± 3,9 a 86,8 ± 15,9 a
Curacron 98,3 ± 3,3 a 89,3 ± 8,9 a 70,7 ± 12,4 b 17,8 ± 12,7 cd 0 ± 0 c
Kontrol 0 ± 0 c 0 ± 0 c 0 ± 0 d 0 ± 0 d 0 ± 0 c
a
F.h. Pc = fraksi heksana padatan P. cubeba, f.h. Tv = fraksi heksana T. vogelii.
Konsentrasi uji = 2 x LC95 masing-masing bahan uji.
b
Rataan selajur yang diikuti oleh huruf yang sama tidak berbeda nyata (uji selang berganda ganda Duncan, = 0,05).
0 20 40 60 80 100
0 1 3 5 7
Umur res idu (hari)
M
o
rt
al
it
a
s
(%
)
P. cubeba
T. vogelii
F.h. Pc + f.h. Tv
B. thuringiensis
Profenofos
Gambar 2 Aktivitas bahan uji terhadap larva C. pavonana setelah dipaparkan 0-7 hari di rumah kaca
Perlakuan dengan residu B. thuringiensis mengakibatkan mortalitas larva yang masih tinggi hingga 7 HSP (>85%), sedangkan f.h. T. vogelii memiliki persistensi yang cukup baik (mortalitas >70% pada 7 HSP) dan campuran f.h. padatan P. cubeba + f.h. T. vogelii memiliki persistensi sedang (mortalitas >50% pada 7 HSP). Pada beberapa perlakuan terjadi fluktuasi mortalitas larva, yang kemungkinan disebabkan oleh perbedaan kondisi larva saat pengujian. B. thuringiensis memiliki persistensi terbesar di rumah kaca, diikuti dengan f.h. T. vogelii dan campuran f.h. padatan P. cubeba + f.h. T. vogelii. Dengan demikian, ekstrak T. vogelii berpotensi untuk digunakan sebagai insektisida alternatif untuk pengendalian hama C. pavonana pada tanaman brokoli, di samping insektisida berbahan aktif B. thuringiensis.
Pembahasan Umum
sedangkan pada ekstraksi tahap berikutnya dengan etil asetat dan metanol hanya sedikit atau sudah tidak ada lagi senyawa aktif yang dapat diekstrak dari ampas buah P. cubeba yang tersisa. Keaktifan fraksi heksana P. cubeba yang terungkap pada penelitian ini sesuai dengan hasil penelitian Su (1990) yang melaporkan bahwa ekstrak heksana buah P. cubeba toksik dan bersifat repelen terhadap kumbang Sitophilus oryzae dan Callosobruchus maculatus.
Fraksi heksana padatan P. cubeba aktif terhadap larva C. pavonana sedangkan fraksi heksana minyaknya tidak aktif. Hal ini mencerminkan bahwa senyawa aktif P. cubeba terdapat dalam komponen padatan dari fraksi heksana tersebut. Usia et al. (2005) mengisolasi 18 senyawa lignan dari fraksi etil asetat buah P. cubeba (pelarutan dengan etil asetat dari ekstrak air). Pada penelitian lain, Elfahmi et al. (2007) mendapatkan 13 senyawa lignan dari fraksi CH2Cl2
buah P. cubeba (pemisahan dalam campuran CH2Cl2 dan air dari ekstrak
metanol). Tiga dari senyawa lignan tersebut, yaitu hinokinin, kubebin, dan yatein, dapat menghambat makan kumbang S. granarius, T. confusum, dan T. granarium (Harmatha & Nawrot 2002).
Fraksi heksana padatan P. cubeba bersifat sinergistik dalam campurannya dengan ekstrak T. vogelii. Sifat sinergistik tersebut dapat disebabkan oleh senyawa lignan yang mengandung gugus metilendioksifenil, yang merupakan ciri penting dari sejumlah sinergis insektisida yang dapat menghambat enzim polysubstrate monooxygenase (PSMO). Enzim tersebut dapat mengoksidasi senyawa asing termasuk insektisida (Matsumura 1985), sehingga dengan terhambatnya kerja enzim tersebut, senyawa insektisida dapat tetap bekerja dalam meracuni organ sasaran di dalam tubuh serangga. Buah P. cubeba mengandung setidaknya 18 senyawa lignan yang mengandung gugus metilendioksifenil, termasuk tiga senyawa yang telah disebutkan sebelumnya (Usia et al. 2005; Elfahmi et al. 2007). Bernard et al. (1989) melaporkan bahwa kubebin dapat menghambat aktivitas enzim PSMO dari saluran pencernaan ulat penggerek batang jagung Ostrinia nubilalis.
Fraksi heksana padatan P. cubeba cukup aktif terhadap larva C. pavonana dalam pengujian di laboratorium tetapi kurang aktif pada pengujian di rumah kaca. Fraksi tersebut pada konsentrasi 2 x LC95 hanya mengakibatkan kematian
paling tinggi 50,1% di rumah kaca. Hal tersebut kemungkinan karena komponen aktif fraksi tersebut kurang menempel pada daun brokoli dengan cara aplikasi penyemprotan sehingga perlu dikembangkan formulasi yang lebih baik. Namun demikian, f.h. P. cubeba masih dapat digunakan dalam bentuk campuran dengan ekstrak daun T. vogelii karena campuran tersebut bersifat sinergis terhadap larva C. pavonana di laboratorium dan memiliki persistensi yang lebih baik daripada f.h. P. cubeba tunggal.
Ekstrak T. vogelii memiliki aktivitas yang lebih baik daripada ekstrak P. cubeba terhadap larva C. pavonana. Daun T. vogelii mengandung rotenon (Delfel et al. 1970) yang bekerja sebagai racun respirasi sel dengan cara menghambat transfer elektron dari NADH ke koenzim Q reduktase pada kompleks I di mitokondria (Hollingworth 2001). Ekstrak T. vogelii juga memiliki persistensi yang cukup tinggi di rumah kaca.
Residu profenofos pada tanaman brokoli di rumah kaca lebih mudah hilang dibandingkan dengan residu B. thuringiensis. Penurunan aktivitas residu dapat dipengaruhi oleh faktor-faktor cuaca seperti sinar matahari dan hujan (Matsumura 1985). Suhu di rumah kaca yang mencapai 35,5 ºC juga mempengaruhi ketahanan residu bahan uji. Curah hujan tidak diperhitungkan pada penelitian ini karena penelitian dilakukan di dalam rumah kaca.
Fraksi heksana T. vogelii selain memiliki aktivitas insektisida yang kuat terhadap larva C. pavonana di laboratorium, juga memiliki persistensi yang baik pada tanaman brokoli di rumah kaca. Hal ini menunjukkan bahwa insektisida yang berasal dari makhluk hidup juga berpotensi untuk mengendalikan hama dibandingkan dengan insektisida sintetik. Meskipun persisitensinya lebih lama dibandingkan profenofos (sebagai pembanding), insektisida dari bahan-bahan alami tidak terlalu berbahaya bagi lingkungan dan makhluk hidup bukan sasaran dibandingkan dengan insektisida sintetik.
alam, proses pembuatan tidak sederhana, biaya produksi kadang-kadang lebih mahal, dan kurangnya minat petani dalam memanfaatkan tanaman sebagai sumber insektisida. Untuk meningkatkan pemanfaatan insektisida botani sebagai komponen pendukung PHT, perlu dilakukan pemasyarakatan insektisida botani di kalangan petani secara lebih luas, antara lain melalui kaji tindak di Stasiun Lapangan PHT dan penyediaan bibit tanaman insektisida botani. Tanaman sumber insektisida botani sebaiknya dapat dibudidayakan di wilayah dengan kisaran iklim dan kondisi geografi yang cukup luas agar mudah diperoleh petani di berbagai daerah. Pengenalan cara-cara yang praktis dan efisien dalam memproduksi insektisida botani juga perlu dilakukan dalam memasyarakatkan insektisida botani tersebut.
KESIMPULAN DAN SARAN
Ekstraksi bertahap buah P. cubeba menghasilkan fraksi heksana (f.h.) padatan, f.h. minyak, fraksi etil asetat, dan fraksi metanol P. cubeba. Pada pengujian dengan metode celup daun dan konsentrasi tertinggi 0,5%, hanya f.h. padatan P. cubeba yang aktif terhadap larva C. pavonana. Fraksi heksana T. vogelli pada taraf LC50 dan LC95 masing-masing sekitar 2,4 dan 1,6 kali lebih
toksik daripada f.h. padatan P. cubeba.
DAFTAR PUSTAKA
Bahagiawati. 2002. Penggunaan Bacillus thuringiensis sebagai bioinsektisida. AgroBio 5(1): 21-28. [jurnal on-line]. http://www.indobiogen.or.id/ terbitan/agrobio/abstrak/agrobio_vol5_nol_2002_21-28.php [27 Mei 2008]. [Balitbiogen] Balai Besar Penelitian dan Pengembangan Bioteknologi dan
Sumberdaya Genetik Pertanian. 2008. Bacillus thuringiensis, bioinsektisida alternatif. http://www.indobiogen.or.id/produk/bacillus.php [27 Mei 2008].
Basana IR, Prijono D. 1994. Insecticidal activity of aqueous seed extracts of four species of Annona (Annonaceae) against the cabbage head caterpillar, Crocidolomia binotalis Zeller (Lepidoptera: Pyralidae). Bul HPT 7: 50-60. Bernard CB, Arnason JT, Philogene BJR, Lam J, Waddell T. 1989. Effect of
lignans and other secondary metabolites of the Asteraceae on the mono-oxygenase activity of European corn borer. Phytochemistry 28: 1373–1377. Bernard CB, Krishnamurty HG, Chauret D, Durst T, Philogene BJR, Sanchez-Vindas P, Hasbun C, Poveda L, San Roman L, Arnason JT. 1995. Insecticidal defenses of Piperaceae from the Neotropics. J Chem Ecol 21: 801-814.
Boeke SJ, Barnaud C, Loon JJAV, Kossou DK, Huis AV, Dicke M. 2004. Efficacy of plant extracts against the cowpea beetle, Callosobruchus maculatus. Int J Pest Manage 50(4): 251-258.
Bos R, Woerdenbag HJ, Kayser O, Quax WJ, Ruslan K, Elfami. 2007. Essential oil constituents of Piper cubeba L. fils. from Indonesia. J Essential Oil Res 19: 14-17.
Cabizza M, Angioni A, Melis M, Cabras M, Tuberoso CV, Cabras P. 2004. Rotenone and rotenoids in cube resins formulations, and residues on olives. J Agric Food Chem 52: 288-293.
Chou TC, Talalay P. 1984. Quantitative analysis of dose-effect relationship: the combined effect of multiple drugs or enzyme inhibitors. Adv Enzyme Regl 22: 27-55.
[CIIFAD] Cornell International Institute for Food, Agriculture, and Development. 2007. Croci or cabbagehead caterpillar (CHC). http://www.nysaes.cornell. edu/ent/hortcrops/english/croci.html [27 Mei 2008].
Cremlyn RJ. 1991. Agrochemicals: Preparation and Mode of Action. Chichester: John Wiley & Sons.
Delfel NE, Tallent WH, Carlson DG, Wolff IA. 1970. Distribution of rotenone and deguelin in Tephrosia vogelii and separation of rotenoid-rich fraction. J Agric Food Chem 188(3): 385-390.
[Deptan] Departemen Pertanian. 2007. Ulat krop (large cabbage heart caterpillar): Crocidolomia binotalis Zell. http://www.deptan.go.id/ ditlinhorti/opt/kubis/ulat_krop.htm - 8k [17 April 2007].
[Ditjen Tanaman Pangan] Direktorat Jenderal Pertanian Tanaman Pangan. 1994. Pengelolaan Organisme Pengganggu Tumbuhan Secara Terpadu pada Tanaman Kubis. Jakarta : Direktorat Bina Perlindungan Tanaman.
[Ditsarpro] Direktorat Sarana Produksi. 2006. Pestisida Terdaftar (Pertanian dan Kehutanan). Jakarta: Ditsarpro, Direktorat Jenderal Tanaman Pangan, Departemen Pertanian.
Edwards CA. 1976. Persistent Pesticides in the Environment. Ed ke-2. Ohio: CRC Press.
Elfahmi, Ruslan K, Batterman S, Bos R, Kayser O, Woerdenbag HJ, Quax WJ. 2007. Lignan profile of Piper cubeba, an Indonesian medicinal plant. Biochem System Ecol 35: 397-402.
Ferdi. 2008. Aktivitas insektisida ekstrak buah cabai jawa (Piper retrofractum Vahl.) terhadap larva Crocidolomia pavonana (F.) (Lepidoptera: Pyralidae) [skripsi]. Bogor: Fakultas Pertanian, Institut Pertanian Bogor.
Gisi U. 1996. Synergistic interaction of fungicides in mixtures. Phytopathology 86: 1273-1279.
Glare RT, O’Callaghan M. 2000. Bacillus thuringiensis: Biology, Ecology, and Safety. Chichester: John Wiley & Sons.
Hagemann JW, Pearl MB, Higgins JJ, Delfel NE, Earle FR. 1972. Rotenone and deguelin in Tephrosia vogelii at several stages of maturity. J Agric Food Chem 20: 906-908.
Harmatha J, Nawrot J. 2002. Insect feeding deterrent activity of lignans and related phenylpropanoids with a methylenedioxyphenyl (piperonyl) structure moiety. Entomol Exp Appl 104: 51-60.
Heyne K. 1987. Tumbuhan Berguna Indonesia. Jilid 2. Badan Litbang Kehutanan, penerjemah. Jakarta: Yayasan Sarana Wana Jaya. Terjemahan dari: De Nuttige Planten van Indonesie.
Hollingworth RM. 2001. Inhibitors and uncouplers of mitochondrial oxidative phosphorylation. Di dalam: Krieger R, Doull J, Ecobichon D, Gammon D, Hogson E, Reiter L, Ross J, editor. Handbook of Pesticide Toxicology. Vol 2. San Diego: Academic Press. hlm : 1169-1227.
Isman MB. 2006. Botanical insecticides, deterrents, and repellents in modern agriculture and an increasingly regulated world. Annu Rev Entomol 51: 45– 66.
Jacobson M. 1990. Glossary of Plant-derived Insect Deterrents. Boca Raton: CRC Press.
Koona P, Dorn S. 2005. Extracts from Tephrosia vogelii for the protection of stored legume seeds against damage by three bruchid species. Ann Appl Biol 147: 43–48.
Kosman E, Cohen Y. 1996. Procedures for calculating and differentiating synergism and antagonism in action of fungicide mixtures. Phytopathology 86: 1255-1264.
Lambert N, Trouslot MF, Campa CN, Chrestin H. 1993. Production of rotenoids by heterotrophic and photomixotrophic cell cultures of Tephrosia vogelii. Phytochemistry 34: 1515-1520.
LeOra Software. 1987. POLO-PC User’s Guide. Petaluma (CA): LeOra Software.
Marston A, Msonthi JD, Hostettmann K. 1984. On the reported moluscicidal activity from Tephrosia vogelii leaves. Phytochemistry 23: 1824-1825. Matsumura F. 1985. Toxicology of Insecticides. Ed ke-2. New York: Plenum
Press.
Miyakado M, Nakayama I, Ohno N. 1989. Insecticidal unsaturated isobutylamides. Di dalam: Arnason JT, Philogene BJR, Morand P, editor. Insecticides of Plant Origin. Washington DC: ACS. hlm 73-187.
Parmar VS, Jain SC, Bisht KS, Jain R, Taneja P, Jha A, Tyagi OD, Prasad AK, Wengel J, Olsen CE, Boll PM. 1997. Phytochemistry of the genus Piper. Phytochemistry 46: 597-673.
Perry AS, Yamamoto I, Ishaaya I, Perry RY. 1998. Insecticides in Agriculture and Environment: Retrospects and Prospects. Berlin: Springer.
Prabaningrum L, Sastrosiswojo S. 1995. Penggunaan sawi jabung dan rape sebagai tanaman perangkap bagi Plutella xylostella L. dan Crocidolomia binotalis Zell. pada tanaman kubis. Di dalam: Duriat AS, Basuki RS, Sinaga RM, Hilman Y, Abidin Z, editor. Prosiding Seminar Ilmiah Komoditas Sayuran; Lembang, 24 Oktober 1995. Bandung: Balitsa Lembang. hlm 378-383.
Prakash A, Rao J. 1997. Botanical Pesticides in Agriculture. New York: Lewis Publ.
Prijono D. 2002. Pengujian Keefektifan Campuran Insektisida: Pedoman bagi Pelaksana Pengujian Efikasi untuk Pendaftaran Pestisida. Bogor: Jurusan Hama dan Penyakit Tumbuhan, Fakultas Pertanian, Institut Pertanian Bogor. Prijono D. 2006. Peranan pestisida botani dalam pengendalian hama terpadu. Makalah disampaikan pada Pertemuan Koordinasi Pengembangan Pertanian Ramah Lingkungan & Organik; Bogor, 17-18 Maret 2006. Bogor: Departemen Proteksi Tanaman, Fakultas Pertanian, Institut Pertanian Bogor.
Prijono D, Hassan E. 1992. Life cycle and demography of Crocidolomia pavonana Zeller (Lepidoptera: Pyralidae) on broccoli in the laboratory. Indon J Trop Agric 4: 18-24.
Reuben SOWM, Masunga M, Makundi R, Misangu RN, Kilonzo B, Mwatawala M, Lyimo HF, Ishengoma CG, Msuya DG, Mulungu LS. 2006. Control of cowpea weevil (Callosobruchus maculatus L.) in stored cowpea (Vigna unguiculatus L.) grains using botanicals. Asian J Plant Sci 5: 91-97.
SAS Institute. 1990. SAS/STAT User’s Guide, Version 6, Vol 2. Ed ke-4. Cary (North Carolina): SAS Institute.
Sastrosiswojo S, Setiawati W. 1993. Hama-hama kubis dan pengendaliannya. Di dalam: Permadi AH, Sastrosiswojo S, editor. Kubis. Bandung: Balithor Lembang. hlm 39-50.
Scott IM, Jensen HR, Philogene BJR, Arnason JT. 2008. A review of Piper spp. (Piperaceae) phytochemistry, insecticidal activity and mode of action. Phytochem Rev 7: 65–75.
Su HCF. 1990. Biological activities of hexane extract of Piper cubeba against rice weevils and cowpea weevils (Coleoptera: Curculionidae). J Entomol Sci 25:16–20.
Syahputra E, Prijono D, Dono D. 2007. Sediaan insektisida Calophyllum soulatri: aktivitas insektisida dan residu terhadap larva Crocidolomia pavonana dan keamanan pada tanaman. JHPT Trop 7: 21–29.
Usia T, Watabe T, Kadota S, Tezuka Y. 2005. Potent CYP3A4 inhibitory constituents of Piper cubeba. J Nat Prod 68: 64-68.
Worthing RC. 1991. The Pesticide Manual: A World Compendium. Ed ke-9. Farnham: The British Crop Protection Council.
Wulan RDR. 2008. Aktivitas insektisida ekstrak daun Tephrosia vogelii Hook. f. (Leguminosae) terhadap larva Crocidolomia pavonana (F.) (Lepidoptera: Pyralidae) [skripsi]. Bogor: Fakultas Pertanian, Institut Pertanian Bogor.
35
Lampiran 1 Hasil uji pendahuluan pengaruh ekstrak Piper cubeba terhadap mortalitas dan perkembangan larva instar II Crocidolomia pavonana.
36
Lampiran 1 lanjutan
Mortalitas (%) pada JAPa Jenis ekstrak Konsentrasi
JAP = jam sejak awal perlakuan.
b
37
Lampiran 2 Hasil uji lanjutan pengaruh ekstrak P. cubeba (fraksi heksana padatan) terhadap mortalitas dan perkembangan larva instar II C. pavonana.
38
Lampiran 2 lanjutan
Mortalitas (%) pada JAPa Konsentrasi
JAP = jam sejak awal perlakuan.
b
39
Lampiran 3 Hasil uji pendahuluan pengaruh ekstrak campuran fraksi heksana (f.h.) minyak P. cubeba dan f.h. T. vogelii terhadap mortalitas dan perkembangan larva instar II C. pavonana.
Mortalitas (%) pada JAPa Jenis ekstrak Konsentrasi
JAP = jam sejak awal perlakuan.
b
40
Lampiran 4 Hasil uji pendahuluan pengaruh campuran fraksi heksana (f.h.) padatan P. cubeba dan f.h. T. vogelii terhadap mortalitas dan perkembangan larva instar II C. pavonana.
Mortalitas (%) pada JAPa Jenis ekstrak Konsentrasi
JAP = jam sejak awal perlakuan.
b