i
PHYSICOCHEMICAL PROPERTIES AND FUNCTIONAL QUALITIES OF
HIGH PROTEIN MUCUNA BEAN (
Mucuna pruriens
L.) FLOUR
Ary Kristianto1, Made Astawan1
1
Department of Food Science and Technology, Faculty of Agricultural Engineering and Technology, Bogor Agricultural University, IPB Darmaga Campus, PO BOX 220, Bogor, West Java, Indonesia
Phone: +6285649112400, email: ary.kristianto45@yahoo.com
ABSTRACT
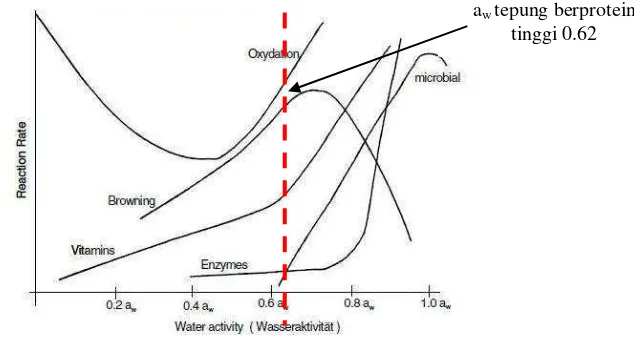
One of food sources that can be potentially developed as high protein food product is mucuna bean. However, nowadays it is still under-utilized. This research aimed to determine the most appropriate process to produce ‘mucuna bean flour’ as material source of high protein flour, to find new method to increased protein content in mucuna flour using enzyme, and to studies its physicochemicals and functional properties. This research was divided into two stages: (1) preliminary research and (2) main research. At the preliminary research, the treatment design to decrease cyanide, (the natural toxin in mucuna seed) was determined using complete randomized experimental design with eight kinds of treatment to two mucuna bean varieties (white and motted). Whereas the main research was the production of high protein flour by enzymatic method with α-amylase enzyme and optimized its production process by the optimal-working-enzyme-factors-base method. After the selection of the best process, the next step was the physicochemical properties and functional quality analysis. At the preliminary research, the white mucuna bean, after going through dehulling treatment continued with 24-hour soaked water treatment, was chosen as the main research sample because it contains cyanide less than 10 ppm (CODEX standard for cyanide) and it contains the highest protein as much as 32%. Results of the main research shows that five factors (initial substrate concentration, enzyme activity, temperature, pH, and time) influenced the optimization process. Enzyme method was successfully lowered nonprotein components. So that, by calculation, protein increased by 28% from 32% to 41%. Mucuna high protein flour bulk density was 0.43 g/ml, the color was brownish white, while the water activity was 0.62. Mucuna high protein flour WAC and OAC were 1.67 ml/g and 1.83 ml/g respectively. The emulsion capacity and stability were 32% and 56%. Foam capacity and stability were 64% and 67%. The best concentration for gelling is 15% and the in vitro protein digestibility is 79%. Mucuna high protein flour has potential to be developed as ingredient for food products especially sausage, bakery and meat analog.
ii
Ary Kristianto. F24080038. Karakteristik Fisikokimia dan Sifat Fungsional Tepung Koro Benguk (Mucuna pruriens L.) Berprotein Tinggi. Di bawah bimbingan Made Astawan. 2012.RINGKASAN
Koro benguk (Mucuna pruriens L.) adalah kacang-kacangan lokal Indonesia yang berpotensi sebagai bahan pangan sumber protein nabati. Namun, hingga saat ini pengolahannya belum optimal. Salah satu tantangan pemanfaatan tanaman ini adalah adanya senyawa toksik glukosida sianogenik. Kandungan senyawa ini harus dikurangi agar tidak membahayakan kesehatan. Berdasarkan kandungan gizinya, koro benguk mengandung dua komponen gizi dominan yaitu protein dan karbohidrat. Protein dalam tepung dapat ditingkatkan dengan cara mengurangi komponen karbohidrat. Oleh karena itu, penelitian ini bertujuan menentukan perlakuan pendahuluan yang paling tepat untuk menghasilkan tepung koro benguk yang memiliki kandungan sianida dalam batas aman, proses efisien, dan kandungan protein tertinggi. Di samping itu, penelitian ini juga bertujuan untuk mengetahui faktor-faktor yang memengaruhi proses pembuatan tepung koro benguk berprotein tinggi dari tepung koro benguk, serta menguji karakteristik fisikokimia dan sifat fungsionalnya.
Penelitian ini terdiri atas dua tahap, yaitu penelitian pendahuluan dan penelitian utama. Penelitian pendahuluan dilakukan untuk menentukan varietas dan perlakuan terpilih yang menghasilkan tepung dengan kandungan sianida dalam batas aman, protein tertinggi dan daya cerna pati tertinggi. Varietas yang digunakan adalah varietas koro benguk putih dan belang. Adapun perlakuan yang ditentukan antara lain mentah utuh, kupas kulit, kupas kulit dan dilanjutkan perebusan 30 menit, kupas kulit dan dilanjutkan pengukusan 30 menit, kupas kulit dan dilanjutkan perendaman dalam air (6, 12, dan 24 jam), dan germinasi. Penelitian utama dilakukan untuk menentukan proses terbaik guna meningkatkan kadar protein pada tepung koro benguk, sekaligus mengetahui karakteristik fisikokimia dan fungsional tepung berprotein tinggi yang dihasilkan.
Penelitian pendahuluan menunjukkan bahwa varietas dan perlakuan berpengaruh nyata pada komponen gizi dan senyawa sianida tepung koro benguk. Tepung koro benguk varietas putih dengan perlakuan perendaman 24 jam dipilih sebagai bahan baku untuk penelitian utama karena tepung tersebut memenuhi standar keamanan kandungan sianida (10mg/kg), memiliki kandungan protein tertinggi, dan daya cerna pati tertinggi.
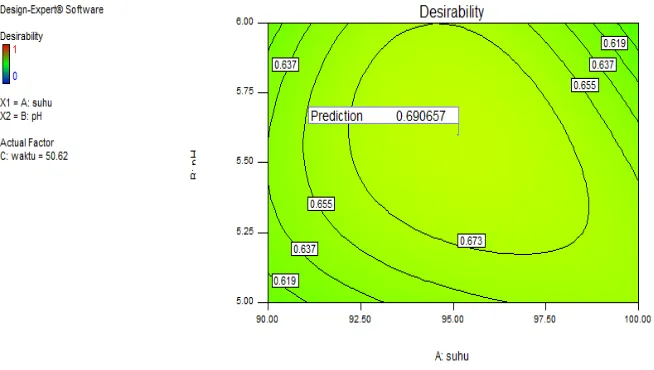
Pada penelitian utama, peningkatan protein pada tepung koro benguk dilakukan dengan proses likuifikasi yaitu pendegradasian molekul karbohidrat menggunakan enzim α-amilase. Hasil optimasi menunjukkan bahwa proses tersebut dipengaruhi oleh lima faktor yaitu konsentrasi substrat awal, dosis enzim yang digunakan, suhu, pH, dan waktu proses. Konsentrasi substrat awal terbaik sebesar 10% dan enzim yang ditambahkan sebesar 0.3 ml per 15 gram tepung koro benguk. Sedangkan suhu, pH, dan waktu proses terbaik berturut-turut adalah 95.15 °C, 5.6, dan 50.32 menit dari hasil percobaan menggunakan rancangan response suface methodology (RSM) Box Behnken.
1
I.
PENDAHULUAN
A.
LATAR BELAKANG
Protein adalah salah satu komponen zat gizi makro yang sangat penting. Secara biologis protein berperan sebagai enzim, antibodi, kolagen, maupun protein otot. Selain itu, protein juga berperan dalam pengolahan pangan berkaitan dengan karakteristik fisikokimia dan sifat fungsional yang dimilikinya.
Penggunaan protein pada pengolahan pangan semakin berkembang, baik dari segi asal bahan baku maupun peruntukannya. Sayangnya sampai saat ini masih banyak produsen, terutama industri pangan yang mengimpor bahan baku maupun bahan penunjang berbasis protein dari negara lain. Salah satu jenis bahan pangan yang menjadi primadona sumber protein adalah kedelai. Ketergantungan pemenuhan sumber protein dari luar negeri tersebut dapat dilihat dari tingginya nilai impor kedelai yang mencapai angka 1.74 juta ton pada tahun 2011 (BPS 2012). Hal ini membawa pengaruh negatif seperti terhambatnya pengembangan bahan pangan lokal Indonesia.
Sebenarnya selain kedelai, Indonesia memiliki jenis kacang-kacangan lokal yang kaya protein namun belum dimanfaatkan secara optimal. Salah satu jenis kacang tersebut adalah koro benguk (Mucuna pruriens L.). Menurut Kala dan Mohan (2010) biji koro benguk segar mengandung protein sebesar 28-30%. Selain itu, kacang ini memiliki produktivitas tinggi dan tidak memerlukan perawatan dan kondisi khusus untuk penanamannya (Rahardi 2008). Koro benguk dimanfaatkan sebagai tempe dalam skala terbatas oleh sebagian penduduk Indonesia. Pengolahan koro benguk yang telah ada saat ini adalah perendaman selama tiga hari untuk menghilangkan senyawa toksik glukosida sianogenik yang secara alami terdapat dalam bijinya. Perendaman dalam waktu tiga hari dirasakan tidak efisien apabila diaplikasikan pada industri karena membutuhkan banyak air dan waktu lama sehingga diperlukan cara lain untuk penghilangan sianida seperti penggunaan panas basah, baik perebusan maupun pengukusan, atau germinasi.
Penelitian ini difokuskan pada pembuatan tepung koro benguk berprotein tinggi. Teknologi tepung dipilih karena memiliki beberapa keunggulan yaitu penanganannya lebih mudah, baik pengolahan maupun penyimpanan. Peningkatan kandungan protein pada tepung koro benguk perlu dilakukan karena banyaknya kebutuhan terhadap bahan baku berprotein tinggi untuk pembuatan produk pangan. Aplikasi tepung koro benguk berprotein tinggi ini bergantung pada sifat fungsional protein yang dimilikinya, seperti daya serap air, daya serap minyak, daya emulsi, gelasi, dan daya busa. Sifat fungsional ini ditandai dengan karakteristik fisikokimia protein pangan yang dapat menentukan perilakunya selama pengolahan, penyimpanan, dan pemanfaatan.
Penelitian tentang tepung koro benguk berprotein tinggi belum banyak dilakukan di Indonesia. Dari segi teori dan asumsi yang diajukan, tepung koro benguk berprotein tinggi memiliki potensi yang besar untuk digunakan sebagai alternatif peningkatan konsumsi protein masyarakat. Bentuk tepung dapat diintroduksi untuk pelengkap pangan berbasis daging yang berfungsi untuk menyeimbangkan sumber protein hewani dan nabati, serta menurunkan harga jual produk berbasis protein, sehingga meningkatkan daya beli masyarakat terhadap pangan sumber protein.
2
B.
TUJUAN PENELITIAN
Penelitian ini bertujuan menentukan perlakuan pendahuluan yang paling tepat untuk menghasilkan tepung koro benguk yang memiliki kandungan sianida dalam batas aman, proses efisien, dan kandungan protein tertinggi. Di samping itu, penelitian ini juga bertujuan untuk mengetahui faktor-faktor yang memengaruhi proses pembuatan tepung koro benguk berprotein tinggi dari tepung koro benguk, serta menguji karakteristik fisikokimia dan sifat fungsionalnya.
C.
MANFAAT PENELITIAN
3
II. TINJAUAN PUSTAKA
A.
KORO BENGUK
Kacang koro benguk (Mucuna pruriens L.) termasuk dalam famili Fabaceae. Di Indonesia, budidaya kacang ini masih terbatas. Koro benguk dapat tumbuh di daerah yang kurang subur, kering, serta kondisi cuaca ekstrim (Rahardi 2008). Penanamannya banyak dilakukan di huma-huma atau di tanah tegal. Menurut Syam (2003) produktivitas koro benguk cukup tinggi mencapai 0.51 ton per hektar. Daerah penghasil koro benguk berpusat di Jawa, terutama yang memiliki daerah pertanian kering seperti Jawa Timur, Jawa Tengah, dan Yogyakarta. Koro benguk dalam jumlah yang lebih sedikit juga ditemukan di Jawa Barat dengan nama kacang kowas. Selain di pulau Jawa, koro benguk juga ditemukan di Sumatera khususnya di lahan-lahan perkebunan. Tanaman koro benguk digunakan sebagai land covering crops (LCC) yang berguna untuk rehabilitasi lahan. Namun sayangnya, bagian biji koro benguk belum dimanfaatkan secara khusus sebagai bahan pangan yang bernilai tambah.
Dari sisi morfologi, koro benguk tergolong tanaman semak yang merambat dengan panjang lebih dari 15 m. Tanaman ini memiliki bunga yang tersusun aksial. Bunga koro benguk berwarna putih, lavender atau ungu. Buahnya berupa polong yang dilindungi kulit berbulu. Rata-rata dalam setiap polong mengandung sekitar lima sampai tujuh biji. Polong berbentuk seragam elipsoid dengan panjang 1 sampai 1.9 cm, lebar 0.8-1.3 cm dan tebal 4-6.5 cm (Atun 2009). Koro benguk memiliki beberapa varietas yang dibedakan berdasarkan warna kulit bijinya yaitu putih, belang, dan hitam (Gambar 1).
Gambar 1. Koro benguk (Mucuna pruriens L.) Sumber gambar: www.tanijaya.com
4
Tabel 1. Perbandingan komposisi zat gizi koro benguk, kedelai, dan kacang hijauSumber: aWanjecke E et al. (2010), bKumar S et al. (2010), cBlessing dan Gregory (2010)
Salah satu tantangan pemanfaatan kacang koro benguk adalah adanya toksin yang terkandung secara alami pada bijinya. Toksin tersebut adalah sianida. Sianida mencakup senyawa-senyawa yang mengandung ion sianida (CN-), di mana satu atom karbon berikatan rangkap tiga dengan nitrogen. Sianida umumya ditemukan berikatan dengan unsur lain membentuk suatu senyawa. Contoh senyawa sianida sederhana yang sering ditemukan antara lain hidrogen sianida (HCN), natrium sianida (NaCN), kalium sianida (KCN), kalsium sianida (Ca(CN)2) dan sianogen (suatu senyawa dalam bentuk NC-CN atau X-CN, di mana X adalah
suatu halogen).
Menurut WHO (2004) senyawa sianida terdapat pada bahan pangan sebagai bagian dari komponen gula (sianogenik glukosida) ataupun sebagai suatu senyawa yang terbentuk secara alami. Konsentrasi sianogenik glukosida pada tanaman dapat bervariasi, yang disebabkan oleh genetik dan faktor lingkungan seperti lokasi, musim, dan jenis tanah (JECFA 1993 diacu dalam WHO 2004). Hidrogen sianida dapat diproduksi melalui reaksi hidrolisis yang dikatalis oleh enzim endogenous pada tanaman yang mengandung senyawa sianogenik glukosida.
Sianida bersifat racun bagi manusia. Gejala khas keracunan sianida akut diantaranya tachypnoea, sakit kepala, vertigo, koordinasi gerak menurun, denyut nadi melemah, cardiac arrhythmias, muntah, pingsan, dan koma. Gettler dan Braine (1938) diacu dalam WHO (2004) memperkirakan bahwa kematian terjadi setelah menyerap rata-rata 1.4 mg hidrogen sianida/kg berat badan, di mana dosis terendah yang menyebabkan efek fatal sebesar 0.54 mg/kg berat badan. Konsumsi bahan pangan yang mengandung senyawa sianogenik glukosida dikaitkan dengan beberapa penyakit yang memengaruhi sistem saraf (WHO 2004).
Paparan sianida terhadap manusia melalui asupan makanan ditentukan dengan melihat konsumsi populasi terhadap singkong. Hal ini disebabkan singkong telah menjadi makanan pokok bagi 500 juta penduduk dunia. Namun, data konsentrasi sianida pada makanan secara keseluruhan tidak cukup sehingga asupan harian untuk sianida melalui bahan pangan tidak dapat ditentukan. Meskipun demikian, Codex (1989) telah menetapkan kadar hidrogen sianida pada tepung singkong tidak melebihi 10 mg/kg.
Kacang koro benguk segar mengandung sianida sebesar 17.72 mg/kg (Handajani et al. 2008). Proses pengolahan pendahuluan sering dilakukan untuk mengurangi kandungan sianida. Salah satu proses pengolahan untuk mengurangi kandungan sianida dalam bahan pangan yaitu dengan melakukan perendaman di dalam air. Sianida merupakan senyawa yang larut air sehingga pencucian ataupun perendaman bahan pangan sering dilakukan untuk mengurangi kadarnya. Handajani et al. (2008) melaporkan bahwa tidak hanya perlakuan perendaman, tetapi perlakuan pengukusan, perebusan, dan presto juga dapat menurunkan kadar sianida koro benguk segar.
Komponen (% bk) koro benguk utuh
a
kedelaib Kacang hijau utuhc Putih Hitam Belang
Protein 28.81 25.42 25.50 45.76 26.83
Karbohidrat 54.38 50.80 58.10 25.26 62.10
5
B.
TEPUNG BERPROTEIN TINGGI
Protein merupakan polipeptida yang tersusun oleh lebih dari 100 buah asam amino yang berikatan satu sama lain melalui ikatan peptida dengan urutan yang khas. Damodaran (1996) menyatakan protein merupakan sumber gizi utama yaitu sebagai sumber delapan asam amino esensial yang diperlukan tubuh, yaitu lisin, triptofan, fenilalanin, metionin, treonin, leusin, isoleusin, dan valin. Di samping memberikan nilai gizi, protein juga memberikan sifat fungsional yang penting dalam membentuk karakteristik produk pangan. Sifat fungsional ini berperan penting dalam pengolahan pangan, penyimpanan, dan penyajian yang memengaruhi karakteristik yang diinginkan, mutu makanan, dan penerimaannya oleh konsumen (seperti penampakan, warna, tekstur, dan cita rasa). Protein memerlukan pemekatan atau pemurnian untuk memperoleh sifat fungsional agar memberikan kinerja yang optimal, sehingga munculah proses pemekatan protein yang menghasilkan tepung berprotein tinggi.
Pada dasarnya pembuatan tepung berprotein tinggi dari koro-koroan sama dengan pembuatan tepung berprotein tinggi dari beras, yaitu dengan memanfaatkan enzim α-amilase untuk memecah sebagian komponen pati (Hansen et al. 1989). Dengan bantuan enzim tersebut, pati dalam tepung koro akan dipecah acak menjadi dekstrin dan maltosa, sedangkan protein akan terkonsentrasi pada bagian yang tidak terurai oleh enzim. Suatu produk, baik tepung atau produk olahan lainnya, dapat diklaim berprotein tinggi apabila kandungan proteinnya lebih tinggi 25% dari produk acuannya (BPOM 2011). Menurut Zayas (1997), tepung berprotein tinggi termasuk dalam pekatan protein dengan konsentrasi kurang dari 60%, sedangkan produk pekatan protein lain seperti konsentrat dan isolat protein memiliki konsentrasi berturut-turut 60-70% (bk) dan lebih dari 90% (bk).
C.
SIFAT FISIK DAN KIMIA TEPUNG BERPROTEIN TINGGI
1.
Densitas kamba (
Bulk Density
)
Densitas kamba adalah sifat penting tepung-tepungan karena sangat berperan pada transportasi, penyimpanan, dan pengemasan. Pengetahuan tentang karakteristik kamba suatu bahan sangat penting. Ketika sejumlah padatan dituang ke dalam container, total volume yang ditempati mengandung sejumlah substansi udara (Lewis 1996).
Densitas kamba didefinisikan sebagai massa partikel yang menempati suatu unit volume tertentu. Densitas kamba ditentukan oleh bahan yang diketahui volumenya dan merupakan hasil pembagian dari berat bahan dan volume wadah. Porositas merupakan bagian yang tidak ditempati oleh partikel atau bahan padatan.
Bubuk digolongkan dalam dua tingkat, yaitu bubuk sebagai partikel dan bubuk sebagai suatu kesatuan (kamba). Sifat-sifat kamba dipengaruhi oleh sifat-sifat partikel, dimana hubungan keduanya tidak sederhana dan meliputi faktor-faktor eksternal, seperti sistem geometris, proses mekanis dan proses panas dari bubuk, sehingga untuk menentukan sifat-sifat bubuk dari partikel agak sulit (Wirakartakusumah et al. 1992).
6
2.
Derajat warna dan derajat putih
Warna diukur secara umum menggunakan Cromameter Minolta dan dinyatakan sebagai nilai L, a, b. Nilai L adalah ukuran sejumlah cahaya yang direfleksikan atau ditransmisikan oleh obyek (0=hitam, 100=putih). Nilai a adalah ukuran warna merah ketika positif dan hijau ketika negatif. Nilai b adalah warna kuning ketika positif dan biru ketika negatif. Sedangkan derajat putih adalah atribut untuk menduga obyek mendekati warna referensi yang lebih putih (Waggle et al. 1989).
Menurut Waggle et al. (1989) pada konsentrasi tetap, nilai L meningkat dengan penurunan kelarutan protein karena peningkatan kecerahan dipengaruhi oleh protein yang tidak larut. Jika ada dua sampel yang memiliki nilai b setara, sampel yang kurang larut akan tampak putih.
3.
Aktivitas air (a
w)
Kerusakan yang terjadi pada bahan pangan pada umumnya merupakan kerusakan kimiawi, enzimatik, mikrobiologis, atau kombinasi antar ketiga macam kerusakan tersebut. Semua jenis kerusakan ini memerlukan air selama prosesnya. Oleh karena itu, banyaknya air dalam bahan pangan ikut menentukan kecepatan terjadinya kerusakan.
Menurut Fennema (1996) air terikat dapat dibagi ke dalam empat tipe berdasarkan derajat keterikatan airnya. Tipe 1 adalah molekul air yang terikat pada molekul-molekul lain melalui suatu ikatan hidrogen berenergi besar. Tipe II yaitu molekul-molekul air membentuk ikatan-ikatan hidrogen dengan molekul air lain yang terdapat dalam mikrokapiler dan sifatnya berbeda dari air murni. Tipe III air yang secara fisik terikat dalam jaringan matriks bahan seperti membran, kapiler, serat, dan lain-lain. Tipe IV adalah air yang tidak terikat dalam jaringan suatu bahan atau air murni yang memiliki sifat-sifat air seperti biasa dengan keaktifan penuh.
Aktivitas air (aw) adalah sejumlah air bebas di dalam media pertumbuhannya dan bahan
pangan yang dinyatakan sebagai perbandingan antara tekanan uap air larutan dan tekanan uap air murni. Aktivitas air juga dapat diartikan sebagai sejumlah air bebas di dalam bahan pangan yang pada kondisi tertentu mikroba dapat tumbuh dan memungkinkan bahan pangan tersebut tidak layak untuk dikonsumsi (Fardiaz et al. 1992).
Dengan meningkatnya aktivitas air, air menjadi lebih tersedia sebagai pelarut dan medium untuk reaksi, kecepatan enzimatik, dan degradasi mikrobiologi juga meningkat. Rata-rata batas terendah aktivitas air untuk pertumbuhan mikroba adalah >0.90 (bakteri), 0.80-0.90 (khamir), dan 0.60-0.70 (kapang) (Fennema 1996). Meningkatnya ketersediaan air juga mempercepat pencoklatan enzimatik dan berkurangnya nilai gizi (Pomeranz 1991).
D.
SIFAT FUNGSIONAL TEPUNG BERPROTEIN TINGGI
1.
Daya serap air
7
air dipengaruhi oleh jenis dan jumlah dari gugus polar pada rantai polipeptida protein (Zayas 1997).Asam amino diklasifikasikan berdasarkan kemampuannya untuk mengikat air yaitu : 1) Asam amino polar dengan daya pengikatan air paling tinggi, 2) asam amino yang tidak mengion, mengikat sejumlah air dalam jumlah yang medium. 3) asam amino hidrofobik yang hanya dapat mengikat sedikit air atau tidak sama sekali. Gugus asam amino polar pada molekul protein adalah sisi utama dalam interaksi protein-air (Zayas 1997).
Pengikatan air dapat disebabkan oleh kemampuan matriks protein untuk mengembang dan menyerap air tanpa pelarut. Viskositas tinggi dihasilkan dari protein yang larut atau mengembang dan pembentukan gel selama persiapan sampel (Waggle et al. 1989). Penyerapan air oleh beberapa jenis protein dapat mengakibatkan pembengkakan. Pembengkakan mencerminkan pengambilan air oleh jaringan protein sambil melonggarkan jaringan polipeptida. Tingkat pembengkakan dipengaruhi oleh gaya-gaya antar molekul, ikatan hidrogen, interaksi elektrostatik antara polipeptida yang berdekatan, dan fasilitas tertentu yang dengannya air akan memberikan gangguan dan menggantikan ikatan protein-protein dengan protein-protein-air (Muchtadi 1991).
2.
Daya serap minyak
Daya serap minyak suatu protein dipengaruhi oleh sumber protein, ukuran partikel protein, kondisi proses pengolahan, zat tambahan lain, suhu, dan derajat denaturasi protein. Partikel yang berukuran kecil mampu menyerap minyak 65-130% dari berat keringnya, lebih banyak jika dibandingkan dengan partikel yang berukuran besar. Denaturasi protein dapat meningkatkan kemampuan protein untuk mengikat lemak dikarenakan terbukanya struktur protein memaparkan asam amino yang bersifat non-polar.
Kemampuan protein untuk menahan lemak dipengaruhi oleh interaksi protein-lipid. Ikatan yang ikut berperan dalam interaksi protein-lipid adalah ikatan hidrofobik elektrostatik, ikatan hidrogen, dan ikatan non-kovalen. Ikatan hidrofobik penting dalam stabilitas kompleks protein-lipid. Interaksi antara protein dan anion asam lemak dapat mengubah struktur protein dengan cara menurunkan ikatan hidrofobik intramolekul (Zayas 1997).
Protein hidrofobik efektif pada tegangan permukaan yang lebih rendah dan mengikat lebih banyak materi lipofilik seperti lipid, emulsifier, dan materi flavor. Kapasitas protein untuk mengikat lemak sangat penting dalam produksi meat extender atau replacer, dimana penyerapan lemak oleh protein meningkatkan retensi flavor dan meningkatkan mouthfeel. Lemak diserap terutama melalui pemerangkapan secara fisik. Penyerapan lemak dapat ditingkatkan jika protein dimodifikasi secara kimia untuk meningkatkan densitas kambanya (Pomeranz 1991).
3.
Daya emulsi
8
Daya emulsi merupakan kemampuan protein untuk menurunkan tegangan permukaan antara kedua fase (tegangan interfasial) sehingga mempermudah terbentuknya emulsi. Kemampuan ini disebut kemampuan protein sebagai emulsifier. Menurut Subarna et al. (1990) daya emulsi ini dipengaruhi oleh konsentrasi protein, kecepatan pencampuran, jenis protein, jenis lemak, dan sistem emulsi. Daya kerja emulsifier disebabkan oleh bentuk molekulnya yang dapat terikat, baik pada minyak (non-polar) maupun air (polar).Emulsifier mengandung dua gugus, yaitu gugus hidrofilik dan gugus lipofilik. Di dalam molekul emulsifier, salah satu gugus harus lebih dominan jumlahnya. Bila gugus polar lebih dominan, maka molekul emulsifier tersebut akan diadopsi lebih kuat oleh air dibandingkan dengan minyak. Akibatnya tegangan permukaan air menjadi lebih rendah sehingga mudah menyebar dan menjadi fase kontinyu. Demikian juga sebaliknya jika gugus non-polar lebih dominan, maka molekul emulsifier akan lebih kuat diikat oleh minyak dibandingkan dengan air (Muchtadi 1991).
Apabia emulsifier tersebut lebih larut dalam air (polar) maka dapat lebih membantu terjadinya dispersi minyak dalam air sehingga terjadilah emulsi minyak dalam air (o/w). Sebagai contoh adalah susu. Sebaliknya bila emulsifier lebih larut dalam minyak (non-polar) terjadilah emulsi air dalam minyak (w/o). Contohnya adalah mentega dan margarin (Winarno 2002).
4.
Daya busa
Busa merupakan struktur terdispersi dimana cairan koloid seperti larutan protein bertindak sebagai medium pendispersi dan gas sebagai fase terdispersi. Mekanisme pembentukan busa diawali dengan terbukanya ikatan dalam molekul protein sehingga rantai protein menjadi lebih panjang. Kemudian udara masuk di antara molekul protein yang terbuka dan bertahan sehingga volume protein mengembang (Cherry dan Watters 1980). Busa pangan umumnya sangat kompleks, termasuk campuran dari gas-gas, cairan-cairan, padatan-padatan, dan surfaktan-surfaktan. Protein berkontribusi pada distribusi merata dari sel-sel udara dalam struktur pangan. Menurut Elizalde et al. (1991) kapasitas pembusaan sangat kritis dalam aplikasi pangan. Protein dari sumber berbeda memiliki kemampuan yang berbeda dalam menstabilkan busa karena perbedaan dalam komposisi, konformasi, fleksibilitas molekuler, dan sifat-sifat fisikokimianya.
Kemampuan membentuk busa dipengaruhi oleh sumber protein alami, metode, dan suhu selama proses. Kemampuan pembusaan meningkat jika konsentrasi protein meningkat dikarenakan meningkatnya ketebalan lapisan film pada interfasial. Foam inhibitor adalah bahan yang tidak larut air dan dapat mengganggu film protein di gelembung-gelembung udara. Zat yang termasuk foam inhibitor adalah lemak dengan aktivitas permukaan yang tinggi. Lemak melemahkan interaksi protein-protein dengan mengganggu permukaan hidrofobik (Zayas 1997).
Faktor-faktor yang memengaruhi pembentukan dan stabilitas busa protein meliputi kelarutan, laju difusi ke arah permukaan, dan penyerapan. Faktor-faktor tersebut bergantung pada sifat-sifat hidrofobik, orientasi, dan asosiasi polipeptida, viskoelastisitas, kesetimbangan agregasi-konjugasi, muatan permukaan, dan hidrasi (Pomeranz 1991).
9
permukaan lebih tebal (Kinsella dan Damodaran 1981). Film-film dengan viskositas permukaan yang tinggi membentuk busa yang kuat sebagai hasil dari gaya kohesif antar molekul-molekul protein. Stabilitas busa mencapai maksimal saat elastisitas permukaan juga maksimal. Sifat daya busa dapat diaplikasikan pada pembuatan whipped toppings, chiffon dessert, dan minuman.5.
Daya gelasi
Gelasi merupakan salah satu sifat protein yang berkaitan dengan penarikan air dari lingkungan oleh molekul-molekul protein. Sifat gelasi berfungsi untuk pembentukan dan pengendapan matriks protein. Gelasi protein adalah sifat yang kompleks dan sulit diinterpretasikan karena membutuhkan kondisi tertentu yang sangat ekstrim untuk pembentukan gel. Faktor-faktor yang memengaruhi gelasi adalah kekuatan gel, pelekatan antara agregat protein, pelekatan dengan zat lain, dan elastisitas (Widowati et al. 1998). Kemampuan gelasi dari protein-protein dipengaruhi juga oleh konsentrasi protein, komposisi asam amino, berat molekul, dan hidrofobisitas protein-protein.
Gel dapat terbentuk karena pemanasan dan penambahan kapur. Mekanisme pembentukan gel karena pemanasan terjadi pada dua tahap, yaitu tahap asosiasi dan agregasi yang mengakibatkan terbentuknya formasi gel di bawah kondisi yang sesuai. Suhu gelasi bergantung pada karakter protein di dalam sistem. Waktu dan suhu pemanasan untuk terbentuknya gel umumnya menurun dengan meningkatnya konsentrasi protein. Peningkatan suhu juga akan meningkatkan kekeruhan gel (Schmidt 1981). Pembentukan gel protein merupakan hasil dari interaksi-interaksi intermolekuler yang menghasilkan jaringan tiga dimensi serat-serat protein. Dalam sebuah gel, cairan mencegah matriks tiga dimensi dari collapsing (melipat), dan matriks mencegah cairan keluar. Gel-gel dibentuk saat protein-protein membuka sebagian, mengembangkan segmen-segmen polipeptida terurai yang berinteraksi pada titik-titik spesifik untuk membentuk jaringan ikatan silang tiga dimensi.
Pembentukan gel adalah hasil dari ikatan hidrogen, interaksi ionik dan hidrofobik, gaya-gaya van der walls, dan ikatan disulfida kovalen. Gel dengan kekuatan dan stabilitas tinggi dapat dibentuk dari ikatan silang yang memberi fluiditas, elastisitas, dan perilaku aliran dari gel-gel (Zayas 1997). Interaksi molekuler dimungkinkan pada konsentrasi protein yang meningkat, menghasilkan gel-gel lebih kuat, seiring dengan banyaknya air yang diikat ke molekul protein. Matriks gel dibentuk sebagai hasil dari asosiasi terdenaturasi dengan pembentukan agregat-agregat.
Gel bervariasi dalam sifat misalnya kekerasan dan kelekatan. Sifat unik dari gel adalah perilaku seperti bahan padat, namun sekaligus memiliki ciri-ciri cairan. Sifat-sifat protein untuk membentuk gel dan menahan jumlah tertentu dari gula, flavor, dan bahan baku pangan lainnya dalam matriks tiga dimensi dipakai secara luas dalam pengolahan pangan dan pengembangan makanan baru.
E.
DAYA CERNA PROTEIN
10
Suhu (°C)A
kti
vit
as
r
elati
f
(%
)
pH
L
aju
re
aks
i
digestibility) dan daya cerna sejati (true digestibility). Daya cerna sejati memperhitungkan nitrogen metabolik, sedangkan daya cerna semu mengasumsikan nitrogen yang terbuang seluruhnya berasal dari makanan (WHO 2007). Sementara itu, pengukuran daya cerna protein in vitro dapat dilakukan dengan menggunakan multienzim pankreatik protease yang kondisi reaksinya disesuaikan dengan kondisi fisiologis. Pengukuran daya cerna protein in vitro relatif lebih cepat dan hasilnya merupakan persen relatif terhadap kasein standar.
F.
LIQUOZYME SUPRA
(
α
-AMILASE)
Liquozyme supraadalah suatu cairan dari α-amilase yang sangat termostabil (EC 3.2.1.1) yang digunakan untuk likuifikasi pati. Enzim α-amilase diproduksi oleh Bacillus licheniformis. Liquozyme supra mempunyai keuntungan unik untuk operasi pada pH rendah. Liquozyme supra adalah suatu cairan berwarna coklat dengan kepadatan sekitar 1.25 g/mL dan umumnya memiliki penurunan aktivitas 90 KNU (T)/g dan 45 KNU (S)/g (Novozyme 2001).
Liquozyme supra mematuhi FAO/WHO IECEA dan direkomendasikan oleh ECC. Enzim ini telah dikembangkan untuk likuifikasi yang beroperasi pada temperatur 90-110 °C (221-230 °F). Liquozyme supra dapat beroperasi pada pH 5.1-5.6 dan dengan waktu proses 60-180 menit. Aplikasi penggunaan yang direkomendasikan adalah dengan dosis 0.25-0.65 kg per ton pati pada pH 5.3 pada bubur pati. Kondisi-kondisi penyimpanan yang direkomendasikan adalah 0-2 °C (32-77 °F) di tempat yang tidak rusak dan terlindungi dari matahari. Bagaimanapun, enzim secara berangsur-angsur dapat hilang aktivitasnya dari waktu ke waktu. Penyimpanan dengan kondisi kurang baik, seperti temperatur lebih tinggi, akan mendorong ke arah suatu kebutuhan dosis lebih tinggi (Novozyme 2001). Menurut Naz (2002) Enzim ini memiliki aktivitas terbaik pada rentang suhu 90-105 °C dan pH 5-6. Gambar 2 menunjukkan kondisi pengaruh lingkungan (suhu, pH) terhadap aktivitas enzim.
(a) (b)
Gambar 2. (a) Pengaruh suhu terhadap aktivitas enzim α-amilase dari Bacillus licheniformis (b) Pengaruh pH terhadap aktivitas enzim α-amilase dari Bacillus licheniformis
Mekanisme kerja α-amilase terjadi melalui dua tahap. Tahap pertama adalah degradasi amilosa menjadi maltosa dan maltotriosa yang terjadi secara acak. Degradasi ini terjadi sangat
100
11
cepat dan diikuti dengan menurunnya viskositas dengan cepat pula. Tahap kedua adalah terjadinya pembentukan glukosa dan maltosa sebagai hasil akhir secara spesifik. Pada tahap ini pembentukan relatif sangat lambat. Keduanya merupakan kerja enzim α-amilase pada molekulamilosa saja. Sedangkan pada molekul amilopektin, kerja α-amilase akan menghasilkan glukosa,
maltosa, dan berbagai jenis α limit dekstrin, yaitu oligosakarida yang terdiri dari 4 atau lebih
residu gula yang semuanya mengandung ikatan a-(1,6) (Winarno 2002).
G.
HIDROLISIS PATI SECARA ENZIMATIS
Hidrolisis adalah proses dekomposisi kimia menggunakan air untuk memisahkan ikatan kimia dan substansinya. Hidrolisis pati merupakan proses pemecahan molekul amilum menjadi bagian-bagian penyusunnya yang lebih sederhana seperti dekstrin, isomaltosa, maltosa, dan glukosa (Rindit et al. 1998 dalam Purba 2009). Proses hidrolisis pati menurut Kearsley (1995) pada dasarnya adalah pemutusan rantai polimer pati (C6H10O5)n menjadi unit-unit dekstrosa
(C6H12O6) dengan menggunakan air.
Pemutusan rantai polimer pati dapat dilakukan dengan berbagai metode, misalnya secara enzimatis, asam, ataupun kombinasi keduanya. Hidrolisis secara enzimatis memiliki perbedaan mendasar dibandingkan hidrolisis secara asam dalam hal pemutusan rantai polimer pati. Hidrolisis secara kimiawi dan fisik akan memutuskan rantai secara acak, sedangkan hidrolisis enzimatis akan memutuskan rantai polimer pati secara spesifik pada percabangan tertentu (Norman 1981).
Proses hidrolisis dipengaruhi oleh beberapa faktor, yaitu enzim, ukuran partikel, temperatur, pH, waktu hidrolisis, perbandingan cairan terhadap bahan baku (volume substrat), dan pengadukan (Purba 2009). Hidrolisis enzimatis memiliki beberapa keuntungan yaitu lebih spesifik prosesnya dan produk yang dihasilkan sesuai yang diinginkan. Kondisi prosesnya dapat dikontrol dan produk sampingnya lebih sedikit serta tahap pemurnian (menghilangkan abu) dan pembentukan warna dapat ditekan sedikit mungkin (Jariyah 2002).
Menurut Palmer (1991) reaksi hidrolisis dengan menggunakan enzim memiliki persamaan reaksi :
A-X + H2O X-OH+ HA
Sedangkan hidrolisis secara asam lebih mudah dilaksanakan dan lebih murah biayanya namun memiliki kekurangan dibandingkan hidrolisis enzimatis yaitu timbulnya warna dan rasa yang tidak diinginkan sehingga dapat menurunkan mutu produk (Chaplin dan Buckle 1990).
H.
LIKUIFIKASI
Likuifikasi merupakan proses pencairan gel pati yang memiliki viskositas tinggi ke viskositas yang lebih rendah dengan menghidrolisis pati menjadi molekul-molekul yang lebih
12
Menurut Alan dalam Schenck (1992) likuifikasi terbaik digambarkan sebagai kombinasi dua proses sebagai berikut.1. Gelatinisasi (mencakup hidrasi) pada polimer pati untuk memastikan keadaan padat masuk ke serangan hidrolisis.
2. Dekstrinisasi sampai batas tertentu untuk mencegah retrogradasi pada proses lebih lanjut. Aktivitas enzim α-amilase menentukan cepat lambatnya proses likuifikasi dimana enzim
α-amilase akan aktif terhadap substrat yang berbentuk gel. Hal ini ditunjukkan pada proses likuifikasi yang dilakukan tanpa gelatinisasi terlebih dahulu memerlukan waktu beberapa jam, tetapi pada likuifikasi yang dilakukan pada pati yang digelatinisasi terlebih dahulu ternyata hanya memerlukan waktu beberapa menit sesuai dengan konsentrasi enzim yang digunakan (Whitaker 1996).
13
III.
METODOLOGI PENELITIAN
A.
BAHAN DAN ALAT
Bahan baku yang digunakan dalam pembuatan tepung adalah biji kacang koro benguk (Mucuna pruriens L.) varietas putih dan belang yang diperoleh dari Kulonprogo, Daerah Istimewa Yogyakarta dan Ponorogo, Jawa Timur. Bahan baku dipisahkan dari kotoran lalu dimasukkan ke dalam plastik dan disimpan di dalam freezer untuk mencegah kerusakan akibat hama serangga. Bahan-bahan yang digunakan dalam analisis adalah asam pikrat, H2SO4, akuades,
multienzim protease (1.6 mg tripsin (SIGMA), 3.1 mg kimotripsin (Merck), dan 1.3 mg peptidase (Fluka) per ml akuades), α-amilase (Fluka), Liquozyme Supra enzim α-amilase termamyl dari Bacillus licheniformis (Novozyme), Na-K tartarat, 3.5-asam dinitrosalisilat, bufer Na-fosfat, maltosa standar, K2SO4, HgO, Na2S2O3.5H2O, H3BO3, NaOH, HCl, NH4OH, KI, kalium hidrogen
ftalat, indikator fenolftalein, indikator campuran metilen merah dan metilen biru dalam etanol, heksana, KH2PO4, HNO3, NH3, dan minyak jagung.
14
B.
METODE PENELITIAN
Penelitian ini dibagi menjadi dua tahap, yaitu: (1) penelitian pendahuluan dan (2) penelitian utama. Secara garis besar, penelitian ini dilakukan seperti pada Gambar 3.
Gambar 3. Diagram alir penelitian tepung koro benguk berprotein tinggi
1
2
PenepunganTepung koro benguk
Penentuan perlakuan terpilih dengan pertimbangan kadar HCN, kadar protein, dan daya cerna pati
Tepung koro benguk terpilih
Proses Likuifikasi dengan RSM
Tepung koro benguk berprotein tinggi
Analisis Karakteristik Fisikokimia dan Sifat
Fungsional
Rebus 30’ Kukus 30’ Rendam 6 jam Rendam 12 jam Rendam 24 jam Koro benguk mentah
utuh (putih dan belang)
Direbus 30 menit lalu dikuliti secara manual
germinasi
15
1.
Tahap Penelitian Pendahuluan
1.
Rancangan perlakuan pendahuluan penurunan sianida menggunakan
rancangan acak lengkap
Rancangan perlakuan pendahuluan untuk menurunkan sianida menggunakan Rancangan Acak Lengkap (RAL) dengan delapan macam perlakuan, yaitu: mentah utuh (P0), tanpa kulit (P1), tanpa kulit dan dilanjutkan dengan perebusan 30 menit (P2), tanpa
kulit dan dilanjutkan dengan pengukusan 30 menit (P3), tanpa kulit dan dilanjutkan
dengan perendaman 6 jam (P4), tanpa kulit dan dilanjutkan dengan perendaman 12 jam
(P5), tanpa kulit dan dilanjutkan dengan perendaman 24 jam (P6), dan germinasi (P7).
Perendaman menggunakan air bersih (1:10 b/v) tanpa dilakukan pergantian air. Masing-masing perlakuan dilakukan sebanyak dua kali ulangan.
Yij= μ + τi+ εij ; i = 1,2,3...,8 dan j = 1,2
Di mana: Yij = Nilai pengamatan
μ = Nilai tengah umum
τi = Pengaruh perlakuan ke-i
εij = Pengaruh acak pada sampel ke-j
yang memperoleh perlakuan ke-i
Tabel 2. Rancangan percobaan acak lengkap perlakuan pendahuluan
Perlakuan germinasi mengacu pada Mugendi et al. (2010). Sejumlah koro benguk disterilkan dengan merendamnya dalam etanol 70% selama satu menit. Kacang kemudian direndam dalam air (1:10, b/v) selama 12 jam pada suhu ruang. Setelah itu, kacang ditiriskan lalu disebar pada kapas di dalam suatu wadah. Germinasi dilakukan di ruang gelap selama tiga hari. Setelah tiga hari, kacang yang bergerminasi dibekukan untuk menghentikan proses germinasi sebelum ditepungkan.
Sampel biji koro benguk dengan berbagai perlakuan tersebut, kemudian ditepungkan. Tepung biji koro benguk dengan berbagai perlakuan tersebut kemudian dianalisis kadar sianida dan kadar gizinya. Hasil analisis akan menunjukkan ada atau tidaknya pengaruh perlakuan terhadap kadar sianida dan kadar gizi pada tepung koro benguk. Proses penepungan mengacu pada metode Harnani (2009) yang modifikasi seperti pada Gambar 4.
Varietas koro benguk
Perlakuan (P)
P0 P1 P2 P3 P4 P5 P6 P7
Putih (K1) P0K1 P1K1 P2K1 P3K1 P4K1 P5K1 P6K1 P7K1
16
Gambar 4. Metode penepungan koro benguk2.
Penentuan perlakuan terpilih perlakuan pendahuluan sebagai bahan baku
penelitian utama
Penentuan perlakuan terpilih dilakukan dengan mempertimbangkan tiga parameter terpenting yaitu kadar sianida, kadar protein tertinggi, dan daya cerna pati. Kadar HCN menjadi faktor kunci karena prioritas pertama dalam penggunaan bahan makanan adalah faktor keamanan yaitu kadar sianida pada tepung di bawah 10 mg/kg bahan. Metode pembobotan juga digunakan untuk membantu penentuan perlakuan terpilih. Parameter yang dipilih adalah kandungan gizi yaitu kadar protein. Pada tepung perlakuan terpilih, protein diharapkan memiliki kadar tertinggi sehingga meningkatkan ketercapaian target protein pada produk akhir. Selain kadar protein, parameter lain yang digunakan untuk menentukan perlakuan terpilih adalah daya cerna pati yang diacu dari penelitian Saputra (2012). Daya cerna pati tertinggi akan diutamakan untuk penentuan perlakuan terpilih karena proses yang digunakan untuk meningkatkan protein adalah
dengan mendegradasi sebagian komponen karbohidrat menggunakan enzim α-amilase. Kadar protein dan daya cerna pati masing-masing memiliki bobot 50% sehingga penghitungan nilai total dilakukan dengan menjumlahkan nilai masing-masing parameter tersebut.
Koro benguk hasil perlakuan
pendahuluan
Penirisan
Pengeringan dalam cabinet dryer 50 °C selama 24 jam
Penggilingan dengan disc mill dan pin disc mill 60 mesh
Pengayakan 60 mesh
Tepung koro benguk ukuran 60
17
Pada setiap parameter, dicari nilai minimum dan maksimumnya kemudian dibagi dengan faktor pembagi yang ditetapkan secara subjektif yaitu lima. Skor ditetapkan sebanyak lima rentang nilai, dimana rentang nilai tertinggi bernilai lima, dan semakin kecil hingga satu. Perlakuan yang memenuhi persyaratan aman dari kadar sianida, dan memiliki bobot total tertinggi dipilih untuk menjadi sampel pada penelitian utama.2.
Tahap Penelitian Utama
1.
Rancangan pembuatan dan pengoptimalan proses pembuatan tepung
berprotein tinggi menggunakan
response surface methodology
program
Design Expert
®Rancangan metode yang digunakan adalah response surface methodology dengan rancangan Box Behnken. Tahap ini diawali dengan penetapan komponen proses yang digunakan sebagai variabel tetap dan variabel berubah. Komponen proses yang termasuk ke dalam variabel tetap adalah konsentrasi substrat yang akan diperoleh dari pengujian viskositas tepung koro benguk menggunakan Brookfield Viscometer dan jumlah enzim yang ditambahkan dari uji aktivitas enzim α-amilase. Sedangkan komponen proses yang termasuk dalam variabel berubah adalah suhu, pH, dan waktu likuifikasi. Variabel tetap tidak dimasukkan dalam perancangan design, sedangkan variabel berubah akan menjadi input RSM dan akan dianalisis pengaruhnya terhadap respon.
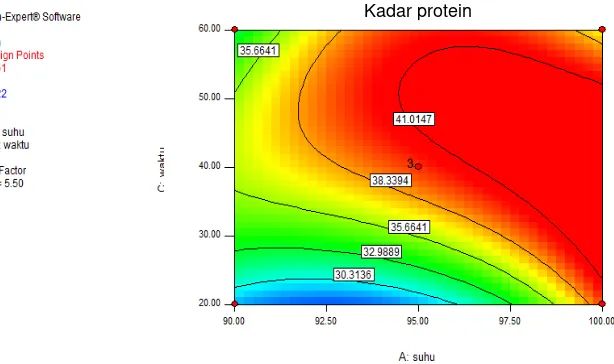
Perancangan design dimulai dengan menentukan batas atas dan batas bawah dari masing-masing variabel. Variabel suhu ditetapkan pada batas atas 100 °C dan batas bawah 90 °C, variabel pH ditetapkan pada batas atas 6 dan batas bawah 5, sedangkan variabel waktu ditetapkan pada batas atas 60 menit dan batas bawah 20 menit. Program Design Expert® kemudian memberikan rancangan berdasarkan komponen yang terdiri dari tiga faktor atau variabel bebas (x1,x2,x3) dan tiga taraf (-1,0,+1) dengan tiga ulangan
pada titik tengah, dan 15 kombinasi perlakuan, dimana masing-masing hasil perlakuan dianalisis kandungan proteinnya. Variabel bebas (xi) pada percobaan ini adalah suhu
proses likuifikasi (x1) dalam taraf 90 °, 95 °, dan 100 °C, pH substrat tepung koro benguk
(x2) dalam taraf 5.0, 5.5, dan 6.0, dan lama likuifikasi (x3) dalam taraf 20, 40, dan 60
18
Tabel 3. Rancangan penelitian utama menggunakan response surfacemethodology Box Behnken Program Design Expert ®2.
Pembuatan tepung koro benguk berprotein tinggi
Pembuatan tepung koro benguk berprotein tinggi dilakukan dengan cara menghidrolisis komponen karbohidrat pada tepung koro benguk. Proses yang digunakan adalah likuifikasi. Likuifikasi adalah proses pencairan gel pati yang memiliki viskositas tinggi ke viskositas yang lebih rendah dengan menghidrolisis pati menjadi molekul-molekul yang lebih kecil (oligosakarida atau dekstrin) dengan menggunakan enzim α -amilase. Proses pembuatan diawali dengan melarutkan tepung koro benguk dalam air dengan konsentrasi yang ditentukan dari pengujian viskositas. Selanjutnya dilakukan pengaturan pH suspensi tepung koro benguk, penambahan enzim, pengaturan suhu proses likuifikasi dan waktu likuifikasi. Nilai suhu, pH, dan lama waktu hidrolisis, didapatkan dari program Design Expert®. Suspensi tepung yang sudah mengalami perlakuan kemudian dinaikkan pH-nya untuk inaktivasi enzim dan diturunkan kembali pH-nya untuk menetralkan warna. Suspensi kemudian didinginkan dan disentrifugasi 3000 rpm selama 15 menit. Setelah itu supernatan dibuang dan endapan diambil untuk dikeringkan menggunakan spray dryer. Tepung berprotein tinggi dalam bentuk bubuk tersebut kemudian diukur kandungan proteinnya sebagai respon.
3.
Pengujian kandungan gizi, karakteristik fisikokimia, dan sifat fungsional
tepung berprotein tinggi koro benguk
Tepung koro benguk berprotein tinggi dengan proses paling optimum kemudian dianalisis kandungan gizinya (analisis proksimat), karakteristik fisikokimianya (densitas kamba, warna, aktivitas air), sifat fungsionalnya (kapasitas absorbsi air dan minyak, kapasitas dan stabilitas emulsi, kekuatan gel, kapasitas dan stabilitas busa), serta daya cerna protein in vitro.
Std Suhu (°C) pH Waktu (Menit)
1 90 5 40
2 100 5 40
3 90 6 40
4 100 6 40
5 90 5.5 20
6 100 5.5 20
7 90 5.5 60
8 100 5.5 60
9 95 5 20
10 95 6 20
11 95 5 60
12 95 6 60
13 95 5.5 40
14 95 5.5 40
19
(1)C.
TAHAP ANALISIS
1.
Analisis HCN secara kualitatif (AOAC 915.03 tahun 2005)
Sampel ditimbang sebanyak 20 gram lalu dimasukkan ke dalam labu Erlenmeyer 200 ml, lalu ditambahkan 50 ml larutan buffer sitrat. Kertas pikrat sebagai indikator digantungkan pada bibir labu Erlenmeyer. Labu Erlemenyer kemudian ditutup rapat-rapat dengan tutupnya. Sampel dibiarkan pada suhu 25-30 °C selama 3 jam sambil sesekali dikocok putar. Selajutnya ditambahkan 2 gram asam tartarat dan labu Erlenmeyer segera ditutup kembali. Sampel dipanaskan pada suhu 50-60 °C selama 1 jam sambil sewaktu-waktu dikocok. Bila sianida positif, kertas pikrat akan berwarna coklat kemerah-merahan.
2.
Analisis HCN secara kuantitatif (AOAC 915.03 tahun 2005)
Sebanyak 10-20 gram sampel dimasukkan ke dalam labu Kjeldahl 800 ml, ditambah dengan 200 ml akuades dan dibiarkan selama 2-4 jam. Setelah itu, sampel didestilasi uap. Destilasi dihentikan setelah diperoleh destilat sebanyak 150-160 ml di dalam larutan NaOH (0.5 gram NaOH di dalam 20 ml akuades). Kemudian, ke dalam destilat ditambahkan 8 mL NaOH 6 M dan 2 ml 5% larutan KI dan dititrasi menggunakan larutan AgNO3 0.02 M. Titik
akhir titrasi ditunjukkan dengan timbulnya kekeruhan permanen
.
3.
Analisis kadar air (AOAC 925.10 tahun 2005)
Cawan aluminium kosong dikeringkan dalam oven suhu 105 oC selama 15 menit, lalu didinginkan dalam desikator selama 5 menit atau sampai tidak panas lagi. Cawan ditimbang dan dicatat beratnya. Sejumlah sampel (sekitar 1 gram) dimasukkan ke dalam cawan kosong yang telah diketahui beratnya. Cawan beserta isi dikeringkan di dalam oven bersuhu 105 oC. Pengeringan dilakukan sampai diperoleh bobot konstan. Setelah dikeringkan, cawan dan isinya didinginkan di dalam desikator, ditimbang berat akhirnya, dan dihitung kadar airnya dengan persamaan (1).
4.
Analisis kadar abu (AOAC 923.03 tahun 2005)
Cawan porselin dikeringan dalam oven selama 15 menit kemudian didinginkan dalam desikator selama 5 menit dan ditimbang. Sebanyak 2-3 gram sampel ditimbang dan dimasukkan ke dalam cawan porselin. Selanjutnya, sampel dipanaskan di atas hot plate sampai tidak berasap lagi, kemudian dilakukan pengabuan di dalam tanur pada suhu 400-600
o
C selama 4-6 jam atau sampai terbentuk abu berwarna putih. Sampel kemudian didinginkan dalam desikator, selanjutnya ditimbang dan dihitung kadar abunya sesuai persamaan (1 dan 2).
20
(2)(1)
(2)
(3) (1)
(1)
(2)
5.
Analisis kadar protein (AOAC 960.52 tahun 2005)
Sampel sebanyak 0.1 – 0.2 gram dimasukkan ke dalam labu Kjedahl 100 ml, lalu ditambahkan 1 g K2SO4, 40 mg HgO, dan 3.5 ml H2SO4 pekat. Setelah itu, didestruksi
sampai cairan berwarna jernih, kemudian didinginkan. Tahap selanjutnya adalah destilasi. Larutan sampel hasil destruksi dibilas dengan akuades dan ditambahkan 8 ml larutan NaOH-Na2S2O3.5H2O, kemudian didestilasi. Hasil destilasi ditampung dalam labu Erlenmeyer 125
ml yang berisi H2BO3 dan indikator. Hasil destilasi tersebut kemudian dititrasi dengan HCl
0.02 N yang sudah distandardisasi hingga terjadi perubahan warna menjadi abu-abu. Larutan blanko juga dianalisis seperti sampel. Kadar nitrogen dihitung berdasarkan persamaan (1, 2, dan 3).
6.
Analisis kadar lemak (AOAC 963.15 tahun 2005)
Sampel ditimbang sebanyak 1-2 gram lalu ditambah 30 ml HCl 25% dan 20 ml air. Sampel didihkan selama 15 menit di ruang asam kemudian disaring dengan kertas saring dalam keadaan panas. Selanjutnya, kertas saring dicuci dengan air panas hingga tidak asam lagi. Kertas saring berikut isinya dikeringkan pada suhu 105 oC. Selanjutnya, kertas saring dilipat dan analisis dilanjutkan pada tahap ekstraksi. Labu lemak yang akan digunakan untuk mengekstraksi dikeringkan di dalam oven bersuhu 100-110 oC selama 15 menit, didinginkan dalam desikator selama 5 menit, kemudian ditimbang. Kertas saring hasil hidrolisis sebelumnya dimasukkan ke dalam selongsong kertas saring baru dan disumbat kapas pada sisi atas dan bawahnya, kemudian dimasukkan ke dalam alat ekstraksi yang telah berisi pelarut hexana. Refluks dilakukan selama 6 jam dan pelarut yang ada di dalam labu lemak didistilasi. Selanjutnya, labu lemak yang berisi lemak hasil ekstraksi dipanaskan dalam oven bersuhu 105 oC hingga beratnya konstan, didinginkan dalam desikator, dan ditimbang. Penghitungan kadar lemak berdasarkan persamaan (1 dan 2).
Keterangan: a = berat cawan dan sampel akhir (g) b = berat cawan kosong (g)
21
7.
Analisis kadar karbohidrat
by difference
Pengukuran kadar karbohidrat menggunakan metode by difference.
Kadar karbohidrat (% bb) = 100% - (kadar air (%bb) + kadar protein (%bb) + kadar
lemak (%bb) + kadar abu (%bb))
8.
Densitas kamba (
bulk density
) (Narayana dan Narasinga 1984 diacu
dalam Adebowale
et al
. 2005)
Gelas ukur 10 ml ditimbang, kemudian sampel dimasukkan ke dalamnya sampai volumenya mencapai 10 ml. Pengisian diusahakan tepat tanda tera dan tidak dipanaskan. Gelas ukur berisi sampel ditimbang dan selisih berat sampel menyatakan berat sampel per 10 ml. Densitas kamba dinyatakan dalam g/ml atau g/cm3.
10
)
/
(
g
cm
3a
b
kamba
Denstitas
Keterangan : a = berat gelas ukur berisi sampel 10 ml (g) b = berat gelas ukur kosong (g)
9.
Derajat warna dan derajat putih dengan Chromameter CR-310 Minolta
(Mugendi
et al
. 2010a)
Pengukuran dilakukan dengan meletakkan sampel di dalam wadah berukuran seragam dan selanjutnya dilakukan pengukuran pada skala nilai L, a, dan b. nilai L menyatakan parameter kecerahan (lightness) yang mempunyai nilai dari 0 (hitam) sampai 100 (putih). Nilai a menyatakan cahaya pantul yang menghasilkan warna kromatik campuran merah-hijau dengan nilai +a (positif) dari 0-100 untuk warna merah dan nilai –a (negatif) dari 0-(-80) untuk warna hijau. Notasi b menyatakan warna kromatik campuran biru-kuning dengan nilai +b (positif) dari 0-70 untuk kuning dan nilai –b (negatif) dari 0-(-70) untuk warna biru. Derajat putih dapat diperoleh dengan cara mengkonversi nilai L, a, dan b yang diperoleh menjadi derajat putih dalam bentuk % dengan rumus berikut.
Derajat putih (%)=100-[(100-L)2+(a2+b2)]0.5
10.
Kapasitas absorpsi air dan minyak (Lin
et al
. 1974 di dalam Mugendi
et
al
. 2010a)
Sampel sejumlah 0.5 gram dicampur dengan 5 ml akuades pH 7.0 (kapasitas absorpsi air) atau 5 ml minyak jagung (kapasitas absorpsi minyak), lalu diaduk selama 1 menit. Setelah itu didiamkan selama 30 menit pada suhu 25 oC. Campuran kemudian disentrifus pada kecepatan 3000 rpm selama 25 menit. Volume cairan bebas diukur dan cairan yang tertahan dinyatakan sebagai ml air atau minyak per gram sampel.
Keterangan: a = berat labu dan sampel akhir (g) b = berat labu kosong (g)
22
11.
Analisis Kapasitas dan Stabilitas Emulsi (Modifikasi Franzen dan
Kinsella, 1976)
Sampel sebanyak 2 gram ditambah 100 ml air, diatur pH 8. Penentuan pH penting dilakukan karena untuk membentuk emulsi yang stabil maka molekul protein lebih awal harus menjangkau permukaan air, lemak, kemudian membentang sehingga kelompok hidrofobik dapat berhubungan dengan fase lemak. Sisi protein penstabil yang disajikan ke fase air harus bersifat hidrofilik dan memiliki asam amino polar yang bermuatan dimana pada pH 8 memiliki nilai yang stabil (Bian et al. 2003). Sampel diaduk dengan magnetic stirrer selama 5 menit. Sebanyak 25 ml sampel ditambah 25 ml minyak jagung. Campuran didispersikan dengan blender selama 1 menit, kemudian disentrifus 3000 rpm selama 10 menit. Volume emulsi diukur.
% 100 campuran total volume eremulsi campuran t (%) Emulsi
Aktivitas Volume x
Untuk mengamati stabilitas emulsi selama waktu tertentu, emulsi yang sudah terbentuk disimpan beberapa lama pada suhu ruang. Volume emulsi diamati pada jam ke-0.5, 1, 2, 4, 6 kemudian dicatat dan dibuat kurva kestabilan emulsinya (Okezie dan Bello 1988). Percobaan kapasitas dan stabilitas emulsi ini dilakukan sebanyak dua kali ulangan.
12.
Penentuan kapasitas dan stabilitas busa (Widowati
et al
. 1998)
Kapasitas busa merupakan perbandingan antara volume busa setelah 30 detik dengan volume awal. Sedangkan stabilitas busa merupakan perbandingan antara volume busa setelah satu jam dengan volume busa setelah 30 detik. Sampel sebanyak 2 gram dilarutkan dalam 100 ml akuades dan diaduk dengan magnetic stirrer. Larutan diatur pH-nya menjadi 8 dengan NaOH 2 N. volume awal dicacat, kemudian diblender selama 2 menit. Volume busa setelah 30 detik dan setelah 1 jam diukur.
% 100 detik 30 setelah busa volume jam 1 setelah busa volume (%) % 100 awal volume detik 30 setelah (%) busa Kapasitas x busa stabilitas x busa volume
13.
Kekuatan gel ( Schmidt 1981 di dalam Widowati
et al
. 1998)
Sampel sebanyak 0.75, 1.00, 1.25, dan 1.50 gram dilarutkan dalam 10 ml akuades sehingga diperoleh konsentrasi larutan 7.5, 10, 12.5 dan 15%. Larutan ditepatkan hingga pH 8 menggunakan NaOH 2 N. larutan tersebut dipipet sebanyak 3.0 ml ke dalam tabung reaksi. Tabung reaksi dimasukkan ke dalam penangas air bersuhu 100 oC selama 15 menit. Tabung dikeluarkan dan disimpan pada suhu 4 oC selama 2 jam. Kekuatan gel diukur secara kualitatif.
Skala yang digunakan untuk pengukuran gel adalah 0 = tidak berbentuk gel
1 = gel sangat lemah, yaitu bila dimiringkan gel jatuh 2 = bila tabung dibalik vertikal gel tidak jatuh
23
14.
Analisis daya cerna protein
in vitro
(Hsu
et al
. 1977 di dalam Mugendi
et
al
. 2010)
Sebelumnya, larutan multienzim dibuat dalam air destilata. Larutan multienzim terdiri dari campuran 1.6 mg tripsin, 3.1 mg kimotripsin, dan 1.3 mg peptidase per ml akuades. Larutan multienzim ini ditepatkan pH-nya menjadi pH 8.00 menggunakan NaOH 0.1 N atau HCl 0.1 N. Larutan multienzim selanjutnya disimpan dalam lemari pendingin. Sejumlah sampel disuspensikan dalam akuades sampai konsentrasi 6.25 mg protein/ml. Sebanyak 25 ml suspensi sampel ditaruh dalam gelas piala kecil, kemudian diatur pH-nya menjadi pH 8.00 dengan menambahkan NaOH 0.1 N atau HCl 0.1 N. Selanjutnya sampel dimasukkan dalam penangas air 37 oC selama 5 menit sambil diaduk. Sebanyak 2.5 ml larutan multienzim ditambahkan (saat penambahan enzim dicatat sebagai waktu ke nol) ke dalam suspensi sampel sambil tetap diaduk dalam penangas air 37 oC. Nilai pH suspensi sampel dicatat pada tepat menit ke-10. Daya cerna protein dinyatakan dengan persamaan berikut.
Y = 210.464 - 18.103x
D.
ANALISIS STATISTIKA
Data hasil penelitian dianalisis menggunakan One-Way-ANOVA (Analysis of Variance) dengan taraf kepercayaan 99% (α = 0.01) untuk mengetahui pengaruh perlakuan pendahuluan terhadap parameter yang ditetapkan. Jika ada pengaruh sangat nyata maka dilanjutkan dengan uji lanjut Duncan(α = 0.01) untuk mengetahui apakah terdapat perbedaan yang nyata antarperlakuan. Uji independent sample t-test dengan taraf kepercayaan 99% digunakan untuk mengetahui apakah terdapat perbedaan antarvarietas pada perlakuan yang sama. Analisis data dilakukan dengan mengaplikasikan perangkat lunak SPSS versi 20 dan Ms.Office Excel 2010.
Data hasil penelitian utama yang diperoleh menggunakan response surface methodology dianalisis menggunakan program Design Expert®. Program ini dilengkapi dengan ANOVA untuk mengetahui signifikansi pengaruh variabel terhadap respon yang telah ditentukan pada model polinomial. Taraf signifikansi untuk model ditetapkan pada mode 1% dan untuk pembabatan variabel ditetapkan pada mode default 10% sedangkan pada tahap verifikasi selang kepercayaan ditetapkan sebesar 99%.
24
IV.
HASIL DAN PEMBAHASAN
PENELITIAN PENDAHULUAN
A.
Tepung Koro Benguk
Kacang koro benguk adalah tanaman musiman. Pada masa panen, keberadaannya sangat melimpah sehingga harganya jatuh dan pada saat masa tanam keberadaannya sangat langka sehingga harganya melambung tinggi. Pada penelitian ini, dilakukan proses penepungan untuk menjamin ketersediaan dan keamanan bahan baku untuk pembuatan tepung berprotein tinggi. Menurut Fellows (2000) proses penepungan juga berfungsi memperluas bidang permukaan sehingga akan mempermudah pengolahan lebih lanjut.
Kulit biji koro benguk lebih tebal dari jenis kacang lainnya sehingga penghilangan lapisan kulit pada koro benguk tidak semudah pada kedelai atau pada kacang-kacangan lain. Pada penelitian ini dilakukan perebusan selama 30 menit untuk memudahkan penghilangan kulit. Sudiyono (2010) melaporkan bahwa perebusan selama 30 menit memudahkan penghilangan kulit koro benguk yang tebal dan keras. Perebusan menyebabkan disintegrasi jaringan dan kerusakan dinding sel sehingga kulit menjadi lunak dan pengulitan mudah dilakukan.
Koro benguk memiliki bagian yang dapat dimakan (edible portion) sebesar 95% dari kacang segar utuh (Depkes RI 2004). Jika efisiensi penggilingan sempurna maka akan dihasilkan tepung dengan bobot yang tidak berbeda dengan bobot edibleportion. Secara umum, rendemen tepung koro benguk tanpa kulit yang dihasilkan dari perlakuan pendahuluan sebesar 54–69% dari berat total biji koro benguk mentah. Besar kecilnya rendemen tepung bergantung pada efisiensi proses penggilingan yang ditentukan dari kemampuan mesin penggiling. Persentase rendemen dalam pembuatan tepung ini dapat dilihat pada Tabel 4.
Tabel 4. Persentase rendemen pembuatan tepung koro benguk berdasarkan koro benguk mentah utuh
Dari semua perlakuan pendahuluan, rendemen tepung paling rendah ditemukan pada perlakuan germinasi, yaitu 40%. Rendahnya rendemen tepung disebabkan oleh rendahnya viabilitas perkecambahan koro benguk. Menurut Vidal-Valverde (1998) viabilitas kacang famili Fabaceae sebesar 90%. Namun pada penelitian ini, viabilitas koro benguk tidak lebih dari 50%. Diduga rendahnya viabilitas koro benguk karena kondisi lingkungan yang tidak sesuai. Suatu
Perlakuan Rendemen (%)
koro benguk putih koro benguk belang
Mentah (utuh) 76.10 79.60
Tanpa kulit 66.35 67.71
Tanpa kulit + rebus 30 menit 61.79 54.05
Tanpa kulit + kukus 30 menit 63.80 65.84
Tanpa kulit + rendam 6 jam 62.30 63.68
Tanpa kulit + rendam 12 jam 62.04 69.89
Tanpa kulit + rendam 24 jam 54.04 61.25
25
perkecambahan dipengaruhi beberapa faktor seperti suhu, oksigen, cahaya, air, dan dormansi agar memiliki tingkat keberhasilan viabilitas yang tinggi (Urbano et al. 2004). Di samping itu, faktor internal pun menentukan keberhasilan germinasi. Sebagai contoh, terdapat kacang yang mudah dan sulit berkecambah.Selain itu, tingkat keberhasilan germinasi juga dipengaruhi oleh fertilitas dan kualitas kacang setelah pemanenan seperti tingkat kemasakan dan dormansi (Smith 2011). Hal ini menunjukkan bahwa pemanfaatan kecambah koro benguk sebagai tepung akan menghasilkan rendemen yang bervariasi, bergantung pada keberhasilan proses germinasi tersebut. Oleh karena itu rendemen tepung koro benguk yang dikecambahkan tidak dapat diprediksi karena sangat bergantung dari viabilitas kacang koronya.
B.
Kandungan Asam Sianida sebagai Pembatas Faktor Keamanan
Koro benguk secara alami mengandung senyawa toksik glukosida sianogenik yang dapat terurai menjadi asam sianida. Asam sianida dalam dosis tertentu dapat menyebabkan keracunan pada tubuh manusia. Oleh karena itu, keberadaannya dalam bahan pangan diusahakan seminimal mungkin. Pada penelitian ini dilakukan beberapa perlakuan untuk menurunkan kadar senyawa sianida. Data penelitian kadar sianida tepung koro benguk varietas putih (Lampiran 1a), varietas belang (Lampiran 1c), dan hasil analisis ragamnya (Lampiran 1b dan 1d) menunjukkan bahwa perlakuan berpengaruh sangat nyata (p<0.01) terhadap kadar HCN. Tabel 5 menunjukkan kadar sianida pada tepung koro benguk yang dinyatakan sebagai HCN.
Tabel 5. Kadar HCN Tepung Koro Benguk
Perlakuan Kadar HCN (mg/kg basis kering) koro benguk putih koro benguk belang
Mentah (utuh) 19.88d 20.10c
Tanpa kulit 19.02d 2.95b
Tanpa kulit + rebus 30 menit 13.83c 2.32a,b
Tanpa kulit + kukus 30 menit 8.40b 1.83a,b
Tanpa kulit + rendam 6 jam 2.92a 1.50a
Tanpa kulit + rendam 12 jam 2.76a 1.66a,b
Tanpa kulit + rendam 24 jam 2.85a 1.64a,b
Germinasi 2.87a 1.62a,b
Nilai yang diikuti dengan huruf superskrip yang berbeda pada kolom yang sama menunjukkan perbedaan yang sangat nyata (p < 0.01)
26
Hasil uji lanjut Duncan (Lampiran 1b) menunjukkan bahwa kandungan HCN pada tepung koro benguk putih tidak berbeda sangat nyata (p>0.01) antara koro benguk mentah utuh dan perlakuan tanpa kulit. Akan tetapi, perbedaan kadar HCN yang sangat nyata terlihat pada kacang yang telah dikupas kulitnya lalu dilanjutkan dengan perlakuan perebusan, pengukusan, atau perendaman. Data menunjukkan bahwa senyawa sianogenik glukosida pada koro benguk varietas putih diduga terkonsentrasi pada kotiledon, bukan pada lapisan kulitnya. Meskipun ada penurunan kadar sianida pada kacang tanpa kulit, namun besarnya penurunan tersebut tidak signifikan.Hasil berbeda ditemukan pada koro benguk varietas belang, hasil uji lanjut Duncan (Lampiran 1d) menunjukkan bahwa kadar HCN mengalami penurunan yang sangat nyata pada semua perlakuan jika dibandingkan terhadap kacang mentah. Berbeda dengan koro benguk varietas putih, senyawa sianogenik varietas belang diduga terkonsentrasi pada lapisan kulitnya. Perlakuan tanpa kulit menurunkan kadar HCN hingga 85.32% dibandingkan dengan kacang mentah utuh. Hal tersebut sama seperti pada ubi kayu, di mana menurut Heyne (1987) diacu dalam Yuningsih (2009) kandungan sianida pada kulit ubi kayu lebih tinggi dibandingkan dengan daging umbi. Konsentrasi sianogenik glukosida pada tanaman dapat bervariasi, salah satunya disebabkan oleh faktor genetik (JECFA 1993 diacu dalam WHO 2004). Perbedaan genetik diduga menjadi alasan perbedaan letak konsentrasi senyawa sianogenik pada koro benguk dengan varietas berbeda.
Penurunan kadar sianida relatif sederhana. Handajani et al. (2008) melaporkan bahwa perendaman koro benguk selama 24 jam dapat menurunkan kadar HCN sebesar 29%, sedangkan perendaman selama 48 dan 72 jam dapat menurunkan kadar asam sianida berturut-turut sebesar 62% dan 77%. Handajani et al. (2008) juga melaporkan bahwa perlakuan perebusan, pengukusan, dan presto dapat menurunkan kadar sianida. Perebusan dapat menurunkan kadar HCN sebesar 85%, sedangkan pengukusan dan presto berturut-turut sebesar 84% dan 91%. Hal ini menunjukkan bahwa hidrogen sianida tergolong faktor antinutrisi yang tidak tahan panas (Iorgyer et al. 2009). Iorgyer et al. (2009) melaporkan penurunan kadar HCN pada kacang gude yang direbus selama 30 menit mencapai 53.43%. Akan tetapi, Akinmutimi dan Ukpabi (2008) melaporkan bahwa perebusan selama 30 menit pada koro benguk hanya dapat menurunkan 1.93% kadar HCN dibandingkan dengan kacang mentah, meskipun penurunannya signifikan. Perebusan yang semakin lama dapat menurunkan kadar HCN hingga 66.45% pada waktu 60 menit dan 69.62% pada waktu 90 menit.
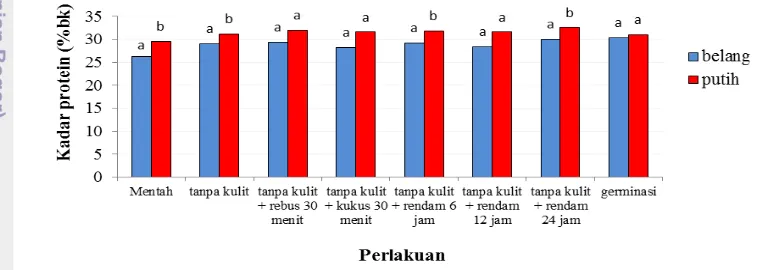
Koro benguk varietas putih dan belang memiliki pola penurunan kadar sianida yang hampir sama akibat adanya perlakuan. Pola penurunan dan perbandingan kadar HCN antara tepung koro benguk varietas putih dan belang dapat dilihat pada Gambar 5
.
27
Hasil uji t pada α 1% menunjukkan bahwa kadar HCN koro benguk varietas putih dan belang mentah tidak berbeda, sedangkan pada perlakuan lainnya terdapat perbedaan kadar HCN yang sangat nyata antara koro benguk putih dan belang. Hasil uji lanjut Duncan (Lampiran 1b) menunjukkan bahwa pada koro benguk varietas putih, perlakuan perebusan 30 menit, pengukusan 30 menit, perendaman, dan germinasi menurunkan kadar HCN kacang mentah sangat nyata jika dibandingkan terhadap perlakuan tanpa kulit. Hasil uji lanjut juga menunjukkan tidak terdapat perbedaan kadar HCN yang sangat nyata seiring dengan meningkatnya lama waktu perendaman. Selain itu juga terlihat bahwa antara perlakuan perendaman dan germinasi tidak menunjukkan adanya perbedaan yang sangat nyata dalam penurunan kadar HCN, tetapi kedua perlakuan tersebut berbeda sangat nyata terhadap perebusan dan pengukusan. Sementara itu, terdapat perbedaan yang sangat nyata antara perebusan dan pengukusan.Berdasarkan hasil uji lanjut Duncan (Lampiran 1d), pada koro benguk varietas belang, tidak ada perbedaan yang sangat nyata antara perlakuan perebusan, pengukusan, perendaman, dan germinasi. Sama halnya pada varietas putih, lamanya waktu perendaman tidak menunjukkan adanya perbedaan yang sangat nyata terkait penurunan kadar asam sianida. Hasil uji lanjut juga melaporkan bahwa pengaruh perlakuan perebusan, pengukusan, perendaman selama 12 dan 24 jam tidak menunjukkan perbedaan yang sangat nyata jika dibandingkan terhadap perlakuan tanpa kulit, sedangkan perlakuan perendaman 6 jam berbeda sangat nyata dengan perlakuan tanpa kulit.
Prinsip penurunan kadar senyawa sianogenik glukosida adalah reaksi hidrolisis senyawa sianogenik glukosida yang dikatalis oleh enzim endogenous pada tanaman yang mengandung senyawa tersebut. Sianogenik glukosida dihidrolisis menghasilkan glukosa, aldehida, dan asam sianida (WHO 2004). Enzim tersebut juga bertanggung jawab atas reaksi hidrolisis sianogenik glukosida pada produk tepung, meskipun aktivitasnya rendah (Panasiuk dan Bills 1984). Sianida dalam bentuk bebas maupun terikat mudah larut dalam air dan mudah menguap (EPA 2010, Udensi et al. 2007).
Perlakuan perebusan meningkatkan kecepatan reaksi hidrolisis senyawa sianogenik glukosida akibat adanya energi panas sehingga menghasilkan HCN yang kemudian larut ke dalam air rebusan. Sama halnya seperti perebusan, perlakuan pengukusan juga meningkatkan reaksi hidrolisis. Asam sianida hasil hidrolisis terbawa bersamaan dengan uap air dan kondensat. Sementara itu, pada proses perendaman, reaksi hidrolisis terjadi saat air meresap ke dalam kacang. Reaksi hidrolisis terkatalis enzim endogenous menyebabkan senyawa sianogenik glukosida terhidrolisis menghasilkan HCN yang larut air (WHO 2004).
Aktivitas enzim endogenous glukosidase meningkat saat proses germinasi. Panasiuk dan Bills (1984) melaporkan adanya kecenderungan peningkatan HCN pada kecambah sorghum seiring dengan lamanya proses germinasi. Proses germinasi meningkatkan aktivitas enzim hidrolitik termasuk glukosidase sehingga sianogenik glukosida dihidrolisis menghasilkan HCN yang mudah menguap pada suhu ruang. Pada penelitian ini menunjukkan perlakuan germinasi dapat menurunkan kadar HCN sangat nyata.
C.
Kandungan Protein sebagai Parameter Gizi
28
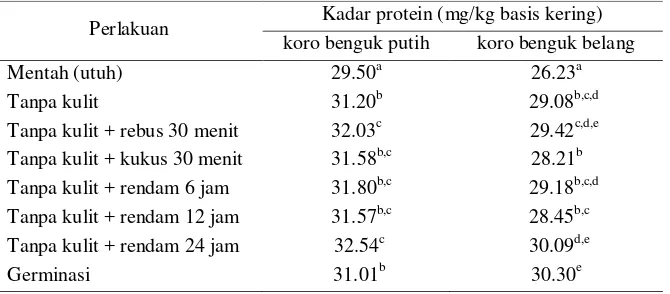
dan 2d) menunjukkan bahwa perlakuan berpengaruh sangat nyata (p<0.01) terhadap kadar protein. Tabel 6 berikut menunjukkan kadar protein dari masing-masing perlakuan dari varietas koro benguk belang dan putih.Tabel 6. Kadar Protein Tepung Koro Benguk
Nilai yang diikuti dengan huruf superskrip yang berbeda pada kolom yang sama menunjukkan perbedaan yang sangat nyata (p < 0.01)
Hasil penelitian menunjukkan bahwa terjadi peningkatan kadar protein akibat perebusan pada varietas putih dan belang masing-masing seb