10
III.
METODOLOGI PENELITIAN
A.
Bahan dan Alat
1.
Bahan
Bahan utama yang digunakan dalam penelitian ini adalah buah takokak segar yang diperoleh dari Desa Benteng Gunung Leutik dan salah satu pasar tradisional di kota Bogor. Bahan-bahan lain yang digunakan dalam ekstraksi, antara lain pelarut metanol Pro Analysis (PA) (Merck), pelarut etil asetat (Merck), dan pelarut heksan (Merck), aquades, dan gas nitrogen (N2). Bahan-bahan yang
digunakan untuk mengukur total fenol adalah etanol PA (Merck), etanol 95%, pereaksi Folin Ciocalteau 50%, Na2CO3 5%, standar asam galat (Sigma-Aldrich), dan aquades. Bahan-bahan yang
digunakan dalam analisis kualitatif komponen bioaktif (fitokimia), yaitu FeCl3 5%, kloroform,
Pb-asetat, gelatin 1%, amoniak, larutan H2SO4 2N, H2SO4 pekat, asam asetat glacial PA (Merck), larutan
HCl 2N, HgCl2, KI (Merck), bismuth subnitrat, iodium (Merck), etanol 95%, dan aquades.
Kemudian, bahan-bahan untuk menguji total antosianin, yaitu larutan HCl 5%, aquades, etanol 95%, dan HCl 1.5 N. Bahan-bahan yang digunakan untuk menguji total asam askorbat (vitamin C), antara lain aquades, KI (Merck), I2 (Merck), dan larutan amilum 1%. Bahan-bahan yang digunakan
untuk mengukur aktivitas Phenylalanine Amonnia Lyase (PAL), antara lain larutan buffer borat-HCl pH 8.8 (25 mM), larutan buffer borate ph 8.7 (0.2 M), NaOH 0.2 M, larutan mercaptoethanol 5 mM, larutan KOH 0.1 N, reagen A (0.81 M Na2CO3 dalam 500 ml NaOH 1 N, 7 mM K-Na Tartrate.4H2O,
H2O sampai 1 L ), reagen B (70 mM K-Na Tartrate.4H2O, 40 mM CuSO4.4 H2O dalam 10 ml NaOH 1
N, H2O sampai 100 ml), reagen C (1 ml Folin Ciocalteau dalam 15 ml H2O), larutan L-Phenylalanine
100 mM, dan larutan Tri Cloroacetic Acid (TCA) 1 M. Bahan yang digunakan untuk menguji aktivitas antioksidan, antara lain asam askorbat (vitamin C), metanol PA (Merck), larutan DPPH 1 mM, dan aquades.
2.
Alat
Alat-alat yang digunakan dalam penelitian ini adalah alat untuk perlakuan sampel dan ekstraksi buah takokak, serta alat untuk analisis. Alat-alat yang digunakan untuk perlakuan sampel segar dan ekstraksi bubuk buah takokak, antara lain blender basah dan kering, baskom, freezer, freeze dryer, plastik HDPE (bening), kemasan alumunium foil, ayakan 20 mesh, alat pengayak, botol-botol kaca gelap, shaker, penyaring vakum, Buchi rotavapor, cawan alumunium, oven, timbangan, neraca analitik, alat pengaduk gelas, sudip, gelas piala, gelas ukur, corong gelas, alumunium foil, dan kertas saring Whatman No.1. Alat-alat untuk analisis total fenol adalah neraca analitik, gelas piala, gelas ukur, tabung reaksi bertutup, labu takar, alat pengaduk gelas, sudip, pipet mohr, mikropipet 10-100 µL dan 500-5000 µL, tabung sentrifuse, vortex, sentrifuse, kuvet, dan spektrofotometer UV-VIS.
11 labu takar, corong gelas, erlenmeyer, pipet mohr, pompa vakum, kertas saring Whatman No.1, dan buret mikro. Alat-alat yang digunakan untuk analisis aktivitas Phenylalanine Amonnia Lyase (PAL), yaitu neraca analitik, alat pengaduk gelas, sudip, gelas piala, gelas ukur, tabung reaksi, labu takar, pipet tetes, mikropipet (10-100 µL, 100-1000 µL, 500-5000 µL, dan 1000-10000 µL), corong gelas, penangas air (inkubator), microtube, sentrifuse, kuvet, dan spektrofotometer UV-VIS. Alat-alat yang digunakan untuk analisis aktivitas antioksidan, antara lain neraca analitik, alat pengaduk gelas, sudip, gelas piala, gelas ukur, tabung reaksi bertutup, labu takar, pipet tetes, pipet Mohr, mikropipet (10-100
µL dan 100-1000 µL), corong gelas, alumunium foil, kuvet, dan spektrofotometer UV-VIS.
B.
Metode Penelitian
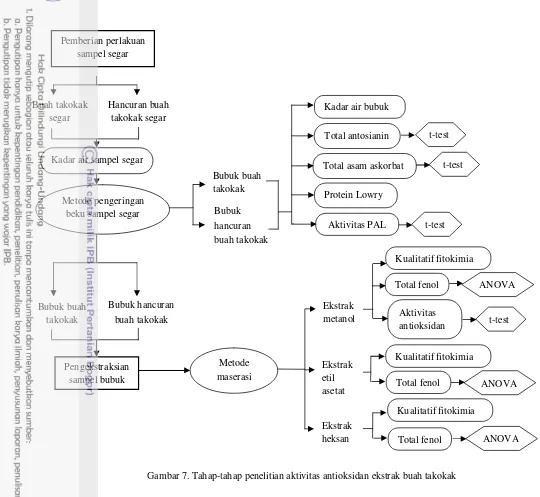
Metode penelitian yang dilakukan terdiri atas tahap pemberian perlakuan terhadap sampel segar dan tahap pengekstraksian sampel bubuk buah takokak. Tahap pemberian perlakuan sampel segar bertujuan untuk mengidentifikasi dan memperoleh komponen bioaktif buah takokak dengan memberikan pengaruh penghancuran pada sebagian sampelnya, sehingga dapat diketahui dampaknya dan perbedaannya terhadap kandungan komponen bioaktif dengan buah yang tidak mengalami proses penghancuran. Tahap ini dilakukan dengan membagi sampel menjadi dua perlakuan, yaitu sebagian sampel dalam kondisi buah takokak segar yang tidak dihancurkan dan sebagian lagi dalam kondisi buah takokak segar yang dihancurkan. Lalu, kedua sampel tersebut dianalisis kadar air segarnya. Selanjutnya, sampel buah takokak segar dan hancuran buah takokak segar mengalami proses pengeringan beku menjadi sampel bubuk dan dilakukannya beberapa analisis, seperti analisis kadar air sampel bubuk, total antosianin, total asam askorbat, protein Lowry, dan aktivitas PAL. Hasil analisis yang diperoleh ini untuk selanjutnya dianalisis secara statistik dengan uji t-test, sehingga diketahui perbedaan antara buah dan hancuran buah terhadap total antosianin, total asam askorbat, dan aktivitas PAL-nya.
12
1.
Pemberian Perlakuan Sampel Segar
Kondisi awal sampel buah takokak yang digunakan adalah sampel segar. Kemudian, sampel segar ini dibuat menjadi dua perlakuan berupa buah utuh atau tanpa proses penghancuran dan hancuran buah. Tujuannya untuk mengidentifikasi dan memperoleh komponen bioaktif buah takokak dengan memberikan pengaruh penghancuran pada sebagian sampelnya, sehingga dapat diketahui dampaknya dan perbedaannya terhadap kandungan komponen bioaktif dengan buah yang tidak mengalami proses penghancuran.
Tahap ini diawali dengan penimbangan sampel segar buah takokak yang telah dipisahkan dari tangkainya sebanyak 1-2 kg, lalu sampel dicuci bersih dan ditiriskan. Selanjutnya, buah takokak dibagi menjadi dua perlakuan, yaitu sebagian dalam keadaan buah utuh dan sebagian lagi dihancurkan dengan blender basah menjadi hancuran buah. Proses penghancuran buah takokak dengan menghancurkan sampel secara bertahap atau sedikit demi sedikit, yaitu sekitar 500 gram sampel
13 dihancurkan selama ± 10-15 menit tanpa penambahan air hingga keseluruhan bentuk hancuran sampel yang diperoleh relatif sama (homogen) untuk setiap kali proses penghancurannya.
Sampel buah utuh dan hancuran buah yang telah diperoleh dimasukkan ke dalam plastik HDPE (bening) ukuran 1 kg, dimana hingga ¾ bagian plastik diisi oleh sampel. Khusus sampel hancuran buah dibuat rata atau pipih sesaat setelah dimasukkan ke dalam plastik agar pembekuan sampel nantinya lebih merata. Setelah semua sampel dimasukkan ke dalam masing-masing plastik, secara bersamaan sampel lalu dimasukkan ke dalam freezer dan posisi sampel diletakkan dalam keadaan horizontal (mendatar). Selanjutnya, setiap sampel diukur pula kadar air segarnya, sehingga dapat diketahui kadar air buah segar dan hancuran buah segar takokak.
Sampel buah segar dan hancuran buah segar takokak dibekukan terlebih dahulu selama satu malam dalam freezer dan keesokan harinya dikeringkan dengan alat freeze dryer selama ± 48 jam. Sampel kering hasil pengeringan beku ini dihancurkan dengan blender kering untuk mendapatkan sampel bubuk takokak dan dimasukkan ke dalam kemasan alumunium foil. Lalu, sampel ini disimpan dalam freezer hingga diperoleh jumlah sampel yang relatif dapat mencukupi proses analisis sampel selanjutnya. Dengan kata lain, sampel diperoleh secara kumulatif dari hasil beberapa kali proses pengeringan beku. Sampel kering diayak dengan ayakan berukuran 20 mesh, sehingga diperoleh bubuk takokak berukuran homogen. Kemudian, sampel bubuk takokak dimasukkan kembali dalam kemasan alumunium foil dan disimpan dalam freezer, sehingga sampel lebih awet selama penyimpanan.
Sampel bubuk buah dan hancuran buah takokak ditentukan kadar airnya. Selain itu, beberapa analisis lainnya yang dilakukan dengan menggunakan sampel bubuk buah dan hancuran buah, antara lain analisis total antosianin, total asam askorbat, protein Lowry, dan aktivitas Phenylalanine Ammonia Lyase (PAL).
2.
Pengekstraksian Sampel Bubuk
Tahap berikutnya adalah tahap pengekstraksian sampel bubuk takokak dengan beberapa pelarut organik. Hal ini bertujuan untuk memperoleh zat atau senyawa kimia (fitokimia) yang berperan sebagai metabolit sekunder dari ekstrak, sehingga dapat diketahui pula perubahan senyawa tersebut dan kadar serta aktivitas antioksidan pada hancuran buah. Tahap ekstraksi sampel dilakukan dengan melarutkan bubuk buah dan hancuran buah takokak dalam pelarut organik dengan perbandingan sampel dan pelarutnya 1:10 (Batubara et al. 2009 yang dimodifikasi).
Sampel bubuk ditimbang sebanyak ± 10 gram, lalu dimasukkan ke dalam labu erlenmeyer dan ditambahkan pelarut yang berbeda, yaitu metanol PA, etil asetat, dan heksan, sebanyak 100 ml sehingga sampel terendam sempurna dan ditutup dengan aluminium foil dan disimpan di dalam
14
C.
Metode Analisis
1.
Analisis Kadar Air (AOAC 1984)
Penetapan kadar air merupakan cara untuk mengukur banyaknya air yang terdapat di dalam suatu bahan pangan. Analisis kadar air dilakukan pada sampel buah segar takokak (awal) dan pada sampel takokak setelah dikering bekukan. Penentuan kadar air ini dilakukan dengan metode pengeringan dengan oven biasa. Prinsip dari metode ini adalah air dikeluarkan dari sampel dengan cara menguapkan air yang terdapat dalam bahan pangan. Persiapan yang perlu dilakukan adalah cawan alumunium yang akan digunakan terlebih dahulu dikeringkan dalam oven pada suhu 1000C selama 15 menit kemudian didinginkan dalam desikator selama 10 menit. Selanjutnya cawan ditimbang dengan menggunakan neraca analitik. Sampel ditimbang sebanyak kurang lebih 2 gram kemudian dikeringkan dalam oven selama kurang lebih 6 jam. Setelah itu, didinginkan dalam desikator kemudian ditimbang. Pengeringan sampel kembali ke dalam oven hingga diperoleh berat kering yang relatif konstan (tetap). Berikut perhitungan kadar air berdasarkan % bb (basis basah), yaitu:
dimana: W = bobot contoh sebelum dikeringkan (g)
W1 = bobot (contoh + cawan) sesudah dikeringkan (g) W2 = bobot cawan kosong (g)
2.
Analisis Total Antosianin
a.
Ekstraksi Antosianin (Raharja dan Dianawati 2001)
Sebanyak ± 1 gram sampel bubuk diekstraksi dengan larutan HCl 5% dalam aquades. Ekstraksi dilakukan dengan merendam bahan didalam wadah botol kaca yang berwarna gelap dengan larutan HCl 5% tersebut (1:10), kemudian campuran disimpan di dalam lemari pendingin bersuhu 40C selama semalam. Setelah itu campuran tersebut disaring dengan kertas saring Whatman No.1 dengan menggunakan penyaring vakum dan filtrat yang diperoleh dianalisis kandungan antosianinnya dengan metode Less dan Francis (1972).
b.
Penentuan Konsentrasi Total Antosianin (Less dan Francis 1972 yang
dimodifikasi)
Sebanyak 0.5 ml filtrat hasil ekstraksi diencerkan hingga 5 ml dengan etanol 95 %: HCl 1.5 N (85:15). Filtrat kemudian diukur absorbansinya dengan spektrofotometer pada panjang gelombang 535 nm.
Total antosianin dihitung dengan rumus :
[ ] Antosianin (mg/ 100 g sampel) = (Absorbansi x Faktor Pengenceran) x 100 98.2 x Wsampel (g)
15 Faktor 98.2 adalah nilai ε (serapan molar) dari pigmen antosianin dalam pelarut etanol 95%:HCl 1.5 N (85:15).
3.
Analisis Total Asam Askorbat (Jacobs 1951 yang dimodifikasi)
a.
Ekstraksi Sampel
Sebanyak ± 5 gram sampel bubuk dimasukkan dalam labu takar 50 ml dan ditambahkan aquades sampai tera, kemudian disaring dengan penyaing vakum untuk memisahkan filtrat.
b.
Pembuatan Larutan Iodium
Larutan iodium 0.01 N dibuat dengan cara mencampurkan 2 gram KI dan 1.269 gram I2,
kemudian dilarutkan sampai volume 1 liter dengan aquades selama semalam untuk melarutkan iod secara sempurna.
c.
Penentuan Konsentrasi Asam Askorbat
Sebanyak 1 ml filtrat hasil ekstraksi diencerkan ke dalam 10 ml air dan diambil 2 ml filtrat hasil pengenceran yang dimasukkan ke dalam erlenmeyer, lalu ditambahkan dengan 0.4 ml larutan amilum (soluble starch) 1%. Larutan kemudian dititrasi dengan 0.01 N iodium. Titik akhir titrasi ditandai dengan perubahan warna larutan menjadi semburat biru. 1 ml 0.01 N iodium setara dengan 0.88 mg asam askorbat.
Konsentrasi asam askorbat dihitung dengan rumus:
[ ] vitamin C (mg/ 100 g sampel) = (titer (ml) x 0.88 mg x Faktor Pengenceran) x 100 Wsampel (g)
4.
Analisis Protein Lowry (Waterborg 2002 yang dimodifikasi)
a.
Ekstraksi
Homogenisasi 100 mg jaringan tumbuhan dengan 1 ml buffer. Sentrifuse sampai homogen pada kecepatan pada kecepatan 12000 g selama 20 menit, kemudian ambil bagian supernatannya. Buffer yang digunakan sama dengan buffer untuk analisis PAL.
b.
Pengukuran
Sebanyak 5-200 µl supernatan ditambahkan air sampai dengan 1 ml, lalu tambahkan sebanyak 0.90 ml reagen A dan kocok hingga homogen. Inkubasi larutan selama 10 menit dalam suhu 500 C dan dinginkan sejenak. Sebanyak 0.10 ml reagen B ditambahkan ke dalam larutan tersebut dan dikocok untuk kemudian diinkubasi selama 10 menit pada suhu ruang. Terakhir, larutan ditambahkan dengan 3 ml reagen C dan dikocok serta diinkubasi kembali selama 10 menit pada suhu 500 C. Larutan tersebut
16 Perhitungan protein dinyatakan dalam satuan µg per gram, seperti berikut ini:
Protein (µg/gram) = Protein ekstrak (µg/ml) x Volume ekstrak (ml) x Faktor Pengenceran
Bobot contoh (g)
5.
Analisis Aktivitas
Phenylalanine Ammonia Lyase
(PAL) (Sadasivam dan
Manickam 1996)
a.
Ekstraksi Enzim
Homogenisasi 500 mg bahan sampel (plant material) dalam 5 ml buffer borat-HCl 25 mM pH 8.8 dingin yang mengandung 5 mM mercaptoethanol (0.4 mL/L). Sentrifuse sampai homogen pada kecepatan 12000 g selama 20 menit. Supernatan digunakan sebagai sumber enzim.
b.
Penentuan Aktivitas
Phenylalanine Ammonia Lyase
(PAL)
Pencampuran 0.5 ml buffer borat, 0.2 ml larutan enzim (enzyme solution), dan 1.3 ml air dalam tabung uji. Reaksi dimulai dengan penambahan 1 ml larutan L-Phenylalanine. Inkubasi larutan selama 30-60 menit pada suhu 320C. Hentikan reaksi dengan menambahkan 0.5 ml Tricholoro Acetic Acid 1 M. Sementara itu, untuk perlakuan kontrol dilakukan dengan menambahkan L-Phenylalanine
setelah penambahan Tricholoro Acetic Acid. Pengukuran absorbansi sampel dilakukan pada 290 nm. Larutan standar yang digunakan adalah asam trans-cinnamic.
6.
Analisis Kualitatif Fitokimia
Tujuan tahap analisis kualitatif komponen bioaktif (fitokimia) untuk mengetahui jenis komponen bioaktif sampel ekstrak takokak secara kualitatif sebagai senyawa metabolit sekundernya. Sampel ekstrak yang diuji adalah ekstrak buah takokak (metanol PA, etil asetat, dan heksan) dan ekstrak hancuran buah takokak (metanol PA, etil asetat, dan heksan), sehingga total sampel ada enam jenis.
a.
Golongan Alkaloid (Houghton dan Raman 1998 yang dimodifikasi)
Sebanyak 1 ml ekstrak ditambahkan 10 ml kloroform dan beberapa tetes amoniak, lalu diasamkan dengan beberapa tetes asam sulfat 2 M. Hasilnya akan terbentuk 2 fase, fase asam diambil dan dibagi ke dalam 3 buah tabung reaksi. Tabung reaksi pertama ditambahkan 3 tetes pereaksi Dragendorf, tabung kedua ditambahkan 3 tetes pereaksi Mayer, dan tabung ketiga ditambahkan 3 tetes pereaksi Wagner. Hasil uji positif untuk peraksi Dragendorf jika terdapat endapan berwarna jingga. Hasil uji positif dengan pereaksi Mayer jika terdapat endapan berwarna putih. Hasil uji positif dengan pereaksi Wagner jika terdapat endapan berwarna merah kecoklatan.
Pembuatan pereaksi Mayer dengan melarutkan 1.36 g HgCl2 dalam 60 ml air suling. Pada
17 glacial dan 40 ml air suling. Kedua larutan dicampurkan. Pereaksi ini disimpan dalam botol berwarna coklat. Untuk penggunaannya satu larutan ini diencerkan dengan 2/3 bagian larutan 20 ml asam asetat glacial dalam 100 ml air suling. Pereaksi Wagner dibuat dari 1.27 g iodium dan 2 g KI yang dilarutkan dalam 5 ml air suling. Kemudian larutan ini diencerkan menjadi 100 ml dengan air suling. Jika terdapat endapan dilakukan penyaringan dan disimpan dalam botol yang berwarna coklat.
b.
Golongan Tanin (Harborne 1996)
Sebanyak 1 ml ekstrak (2 mg dalam 5 ml etanol) ditambahkan 2 tetes larutan FeCl3 5%.
Terbentuknya warna hijau atau hijau biru menunjukkan adanya senyawa fenol dalam bahan. Kemudian ditambahkan gelatin 1%. Jika terdapat endapan putih berarti positif tanin.
c.
Golongan Flavonoid (Harborne 1996)
Sebanyak 1 mg sampel dilarutkan dalam 2 ml kloroform, kemudian sebanyak 1 ml sampel cair ditetesi Pb-asetat. Hasil uji positif untuk flavon bila terbentuk warna jingga atau krem. Kalkon bila terbentuk warna jingga tua dan auron bila terbentuk warna merah.
d.
Golongan Terpenoid dan Steroid (Uji Lie-Bermann-Burchard) (Harborne
1996)
Sebanyak 1 ml ekstrak dilarutkan dalam 2 ml kloroform, lalu ditambahkan 10 tetes asam asetat glacial dan 3 tetes asam sulfat pekat. Larutan dikocok perlahan dan dibiarkan beberapa menit. Hasil uji positif terpenoid jika terbentuk warna merah atau ungu. Hasil uji positif steroid jika tebentuk warna merah yang lalu mengalami perubahan warna menjadi biru atau hijau.
e.
Golongan Saponin (Harborne 1996)
Sebanyak 1 ml ekstrak ditambahkan 10 ml air panas lalu didinginkan dan di-vorteks selama 10 detik. Apabila terbentuk buih yang mantap selama sekitar 10 menit, artinya ekstrak mengandung senyawa saponin. Buih yang mantap jika tingginya 1-10 cm dan tidak hilang jika ditambahkan HCl 2N.
7.
Analisis Total Fenolik (Folin Ciocalteau) (Shetty
et al
. 1995 yang
dimodifikasi)
18 dan 2.5 ml reagen Folin Ciocalteau 50%. Campuran tersebut didiamkan selama 5 menit, lalu ditambahkan 0.5 ml Na2CO3 5% dan divortex. Sampel kemudian disimpan di ruang gelap selama 1
jam. Pengukuran absorbansi sampel dilakukan pada 725 nm dengan larutan standar yang digunakan adalah asam galat dengan variasi konsentrasi 50, 100, 150, 200, dan 250 mg/L.
8.
Analisis Aktivitas Antioksidan Metode DPPH (Andarwulan
et al
. 2010 yang
dimodifikasi)
Sampel yang diuji berupa ekstrak metanol buah dan hancuran buah yang dibuat dalam konsentrasi 200 ppm berdasarkan nilai total fenolnya. Sebanyak 100 µl larutan sampel atau standar dimasukan ke dalam tabung reaksi, lalu ditambahkan 4 ml metanol (sebagai blanko adalah 4 ml metanol). Suspensi tersebut kemudian ditambahkan 1 ml larutan DPPH 0.5 mM dan dihomogenkan dengan menggunakan vortex. Seluruh reaksi dilakukan pada ruang gelap. Campuran tersebut diinkubasi selama 30 menit pada suhu ruang, kemudian diukur absorbansinya pada panjang gelombang 517 nm. Aktivitas antioksidan dinyatakan dalam bentuk persentase penghambatan (% inhibisi) terhadap radikal DPPH dengan perhitungan sebagai berikut:
(%) inhibisi = (Absorbansi blanko - Absorbansi sampel) x 100%
Absorbansi blanko
Aktivitas antioksidan dinyatakan dalam bentuk AEAC (Ascorbic Acid Equivalent Antioxidant Capacity), yaitu dengan menggunakan asam askorbat sebagai standar antioksidan. Nilai selisih absorbansi blanko dan absorbansi sampel disubstitusikan pada persamaan kurva standar asam askorbat untuk menentukan AEAC (Ascorbic Acid Equivalent Antioxidant Capacity). Nilai yang diperoleh menunjukkan jumlah mg asam askorbat yang ekivalen dengan 1 ml sampel.
9.
Analisis Data Statistik
Perhitungan data analisis total antosianin, total asam askorbat, dan total fenol buah takokak dinyatakan dalam buah segar (mg/100 gram fresh weight) danbasis kering sampel (mg/100 gram dry basis). Kemudian, beberapa data analisis terhadap total antosianin, total asam askorbat, aktivitas