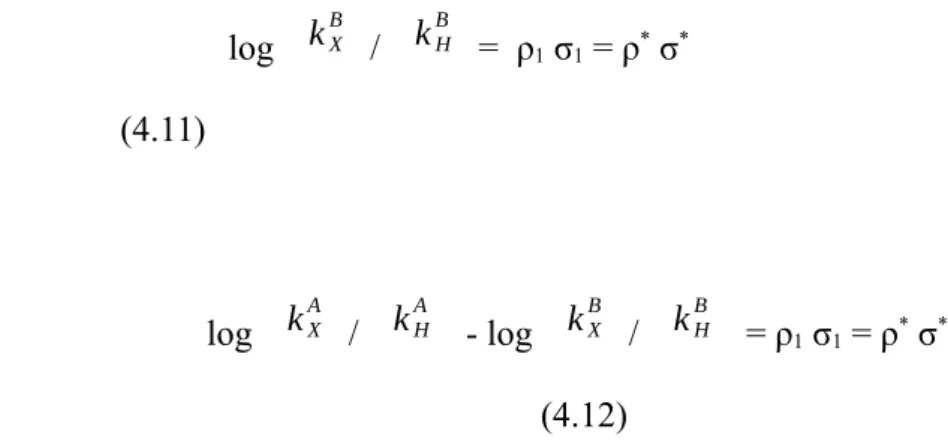BAB 4
KORELASI STRUKTUR DENGAN REAKTIVITAS
Senyawa organik mampu bervariasi struktural di sekitar pusat reaksi, memungkinkan variasi hampir terus-menerus yang sifatnya elektrofilik atau nukleofilik. Kapasitas ini kemudian dapat digunakan untuk menyelidiki secara halus ke dalam efek yang menghasilkan gangguan pada afinitas reaksi dan dari mana permintaan elektron reaksi dapat disimpulkan. Penggunaan informasi ini dalam mekanisme adalah seni yang sangat berkembang, berlaku untuk reaksi polar pada khususnya tetapi untuk tingkat yang lebih rendah untuk proses radikal atau perisiklik.
4.1 PERMINTAAN ELEKTRON
Fitur struktural yang meningkatkan nukleofilik dan elektrofilik yang (agak naif) digambarkan sebagai ‘penyumbang elektron’ dan ‘penarik elektron’. Sejauh mana diberikan respon reaksi terhadap gangguan elektron dengan substituen tergantung pada jenis reaksi dan permintaan elektron.
Perubahan struktural yang lazim digunakan untuk membawa gangguan elektron kelompok substituen yang mungkin diperkenalkan cocok dengan pusat reaksi dan yang tidak mengambil bagian secara langsung di reaksi inti dan hal tersebut menjadi pertimbangan. Substituen umum mungkin termasuk, misalnya, -OH, -Me, -Cl, - F, -NO2, -CN. Perubahan afinitas reaksi ditimbulkan oleh substitusi yang menarik, sehingga perubahan struktural harus dinilai relatif terhadap beberapa substituen standar yang secara elektron netral. Hidrogen biasanya diadopsi sebagai substituen dengan 'nol'; lain kemudian diperhitungkan penyumbang elektron atau penarik elektron yang relatif terhadap itu. Alasan untuk pilihan ini terletak pada kenyataan bahwa sebagian besar reaksi yang dipelajari terjadi pada karbon sebagai salah satu pusat reaksi, dan elektronegativitas karbon dan hidrogen yang hampir sama sehingga ikatan C-H tidak memiliki polaritas. Selanjutnya substituen H tidak memiliki pasangan bersama atau π elektron dan seperti itulah yang mudah bereaksi.
E X Nu E Nu H E Nu Z
Contoh berikut akan menggambarkan prosedur dan mengungkapkan masalah. Anggaplah jika yang diinginkan untuk menyelidiki permintaan elektron dari hidrolisis ester oleh alkali berair untuk mengidentifikasi inti nukleofil dan elektrofil dan sejauh mana ester merespon substituen perubahan.
p- X C6H4COOEt OH .A p- X C6H4COO + EtOH
Laju konstan diukur dalam kondisi pada suhu tunggal dan itu sesuai dalam rangkaian terkait erat seperti ini menganggap bahwa mekanisme yang sama yang beroperasi di seluruh dan yang ΔS+ sekitar konstan, dan akibatnya seri telah diperintahkan oleh meningkatnya ΔG+ masalah yang tersisa adalah bahwa secara resmi setidaknya kelompok subtituent X belum teridentifikasi dengan karakter elektron mereka, sebagai penyumbang elektron dan penarik elektron ? jika ester adalah kesatuan elektrofilik, maka membiarkan substituen adalah salah satu penurunan elektron penarik (atau meningkatkan sumbangan elektron). Jika ester adalah pasangan nukleofilik, maka interpretasi berlawanan akan sesuai. Perlu untuk memulai dengan reaksi yang permintaan elektron dapat disimpulkan secara apriori, teknik yang dikreditkan ke louis Hammett (tapi untuk yang kredit harus dibagi oleh Burckhardt) substitusi asam benzoat, dan diukur konstanta kesetimbangan, KA. Untuk efek penilaian, pengukuran keseimbangan adalah sebagai berlaku (lebih, mungkin) sebagai pengukuran tingkat. Ada nilai-nilai KA berlimpah asam dalam literatur dan yang paling penting, 'mekanisme' dari proses yang dikenal dalam disosiasi yang melibatkan transfer proton air. ini mengidentifikasi asam karboksilat sebagai elektrofil dan air sebagai nukleofil. Akibatnya KA akan meningkat sebesar substitusi untuk kelompok penarik elektron yang melemahkan ikatan O-H, dan sebaliknya menurun oleh substituen penyumbang elektron. Ukuran perubahan ΔG akan menjadi Δ (log KA), atau Δ (ln KA).
Gambar 4.1. Model efek pada reaktivitas inti nukleofilik dan elektrofilik pada sebuah molekul oleh substituen relatif penyumbang dan penarik elektron untuk hidrogen.
C C6H4 p- X O O - H O H H O p- X C6H4C O -H H O H
X : -NO2 -CN -Cl -H -Me -Ome
Log KA -3,45 -3,56 -4,00 -4,20 -4,37 -4,47 (pKA = -log KA )
σ +0.75 +0.64 +0.2 0.00 -0.17 -0.27
Sehubungan dengan hidrogen dalam rangkaian ini, substituen p-Cl, p-CN, p-NO2 kenaikan asam semakin kuat dan karenanya penarik elektron, sedangkan p-Me, p-OMe kenaikan penyumbang elektron atau asamnya melemah. Itu sangat penting bahwa penataan pasangan substituen adalah sama seperti pada hidrolisis ester.
4.2 PERSAMAAN HAMMETT
Hammett menarik perhatian pada fakta bahwa plot log KA untuk ionisasi asam benzoat terhadap log k untuk hidrolisis ester lebih banyak substituen cukup linear (gambar 4.2a), yang berarti bahwa semua substituen mengerahkan efek serupa di masing-masing cukup reaksi berbeda. Ada syarat yang, bagaimanapun, bahwa substituen berlokasi di meta atau para posisi dalam cincin benzena. Tarif dan konstanta kesetimbangan untuk orto diganti senyawa tidak jatuh di garis. alasan untuk ini adalah bahwa perubahan k atau KA (yaitu ∆G≠, ∆G) yang dibawa oleh substituen -m atau -p yang hampir berubahan ΔH ≠ atau ΔH karena substitusi tidak sangat mempengaruhi ΔS. orto substituen mempengaruhi ΔH dan ΔS, yang terakhir berbeda untuk dua reaksi yang dibandingkan sejak perubahan entropi tergantung pada ukuran dari kedua reagen dan substituen dan perubahan solvasi yang mereka hasilkan. Data hidrolisis sekarang dapat ditafsirkan. Tarif yang jelas meningkat penarik elektron substituen
pada ester, yang harus sesuai menjadi elektrofil, dan ada kemungkinan bahwa interaksi awal dapat dinyatakan pada struktur berikut.
X C
O OEt OH
Secara kuantitatif, efek masing-masing substituen relatif terhadap hidrogen, dapat diperoleh dengan perbandingan ∆G untuk disosiasi konstan asam benzoat tersubstitusi (KX) dengan senyawa induk,
Gambar 4.2 a.
Gambar 4.2 b.
Efek substituen =∆Gx - ∆GH =log (Kx/KH) = σx
Di mana σx dikenal sebagai konstanta substituen . Oleh karena itu elektron menarik substituen yang ditandai dengan nilai negatif yang σ dan penumbang elektron oleh nilai-nilai positif , besaran mereka menjadi ukuran kualitas ini . Hidrogen sebagai titik acuan , telah σ = 0,0 . Sekarang jelas bahwa hubungan linear ara . 4.2a menyiratkan
Log kx / KH α log Kx / KH α σ
Menulis kx / KH = Krel ,Kx.KH =Krel, dan memperkenalkan konstanta proporsionalitas ρ , yang dikenal sebagai reaksi konstan,
log krel α log Krel =ρα (4.1)
ungkapan ini telah menjadi dikenal sebagai persamaan Hammet dan dipatuhi dengan berbagai presisi oleh ribuan reaksi yang berlangsung di atau dekat cincin benzena yang substituen terletak di meta atau para posisi . Sebuah korelasi jenis ini adalah bukti yang jelas bahwa perubahan struktur menghasilkan perubahan proporsional dalam energi aktivasi (∆G ≠ ) untuk
semua reaksi tersebut . Oleh karena itu dikenal sebagai hubungan energi bebas linier (LFER). Persamaan Hammett adalah yang paling terkenal dari jenis ekspresi kesamaan . Ini adalah aturan daripada pengecualian bahwa persamaan Hammett dipatuhi dengan presisi moderat untuk reaksi polar . Hal ini memungkinkan permintaan elektron banyak reaksi yang akan diukur sebagai konstan , ρ , dengan skema yang mekanistik harus sesuai dan model gangguan elektron dapat diuji . LFER benar-benar menempati posisi sentral dalam teori kimia organik .
4.3 KONSTANTA SUBSTIUENT , σo
Plot log K terhadap σ (atau log) dari gambar 4.2a (mengabaikan poin orto) khas untuk perbandingan antara dua reaksi dan masih memiliki pencar cukup poin . Ada jelas efek yang berkaitan dengan perubahan solvasi yang mengurangi dari proporsionalitas yang tepat dalam gangguan relatif dihasilkan oleh masing-masing substituen dalam dua sistem. Situasi ini dapat sangat ditingkatkan dengan menggunakan, sebagai konstanta substituen, nilai-nilai yang telah rata-rata lebih banyak reaksi. Satu set dimodifikasi karakter substituen, didefinisikan oleh persamaan ( 4.2 ) dan ini selanjutnya akan digunakan daripada nilai-nilai yang didefinisikan oleh persamaan ( 4.1). Nilai-nilai σ0 dari kompilasi terbaru oleh Exner ditunjukkan
ln kx/kH =ρoσo (4.2)
Gambar 4.2 b menunjukkan perbaikan besar didapat. Tanda dan besarnya σ0 mengekspresikan kemampuan substituen untuk mengganggu lingkungan elektron . Namun, akan melihat bahwa persamaan Hammett membutuhkan nilai yang berbeda dari σ untuk ditugaskan ke kelompok yang sama tergantung pada orientasi mereka , meta atau para . Selain itu, bahkan tanda σ dapat berubah sesuai dengan lokasi: untuk m - OMe , σm = 0,10 (penarik elektron) ; untuk p-OMe , σp = -0,12 (penyumbang elektron) . Nilai-nilai σ kemudian hanya karakteristik dari substituen dalam konteks tertentu . Pengamatan ini dapat dijelaskan jika pertubartion elektron yang dihasilkan oleh substituen adalah resultan dari dua (atau lebih) efek independen yang beroperasi secara bersamaan.
Dalam setiap diskusi efek substituen pada tingkat reaksi dan kesetimbangan tiga komponen harus ditanggung ; substituen atau 'sumber' dari gangguan , X , situs reaksi atau 'detektor' dari gangguan , Y , dan kerangka molekul (inti) melalui mana efek ditransmisikan .
core
Y X
Ini adalah cincin benzena dalam sistem Hammett asli dan diskusi akan untuk pusat hadir pada sistem benzenoid . Dua efek elektron pada dasarnya berbeda dapat dihasilkan oleh substituen pada situs reaksi , dan dibahas di bawah .
4.4.1 Efek resonansi
Hal ini juga dikenal sebagai efek mesomerik, dan dilambangkan R. Banyak substituen menimbulkan gangguan yang lebih besar ketika mereka berada para kemudian ketika mereka meta ; ini menunjukkan mekanisme transmisi alam conjugative di mana biaya relay ke atom alternatif. Adalah efek ini dijelaskan di sini sebagai ' efek + R ' jika mengakibatkan sumbangan elektron dari substituen dengan pusat reaksi dan 'efek -R ' jika penarikan elektron menghasilkan . Efek ini akan ditandai dengan nilai-nilai negatif dan positif dari σ , masing-masing, sehingga tanda konvensi dikit membingungkan .
Untuk latihan efek resonansi , substituen harus memiliki ρ- atau π- orbital yang tersedia untuk konjugasi dengan mos π- dari sistem aromatik . Dua situasi yang penting.
(a) X-adalah kelompok donor dan biasanya memiliki pasangan elektron unshared atau elektron π- pada atom secara langsung melekat pada cincin . contoh adalah
-NR2,-OR,-SR,-PR2,-Hal,-CH=CH2
Kelompok-kelompok ini semua mampu mengerahkan efek + R yang menstabilkan pusat akseptor ( misalnya karbon bantalan beberapa derajat karakter karbokation ) ketika di ayat atau posisi orto σ . Situasi ekstrim digambarkan oleh struktur VB , 3a , 3b . Sedikit interaksi antara donor dan
C O Me O C Me C C O C C O C C O C X(Z) (- )
Pusat akseptor akan terjadi jika itu berada pada posisi meta karena struktur resonansi quinoid analog dengan 3b dan 3e tidak dapat ditarik dan struktur analog (3f) karena itu energi yang tinggi dan kurang penting.
b) Substituen Z memiliki pusat π-akseptor yang berdekatan dengan cincin. Karena tidak ada substituen biasa ditemui memiliki ikatan kosong orbital-p, ini berarti dalam kelompok praktek yang dapat bertindak sebagai akseptor elektron dengan secara simultan melepaskan π-elektron untuk heteroatom yang berdekatan dan yang VB kontribusi struktur memiliki bermuatan positif atom melekat cincin (3e-e). Contoh umum adalah
Semua kelompok tersebut cenderung untuk menerima muatan elektron dan menstabilkan pusat donor (misalnya karbon bantalan beberapa derajat dari karakter karbanion yang berdekatan dengan cincin), digambarkan dengan menyumbangkan struktur 3e. Sekali lagi, interaksi -R terkuat terjadi ketika subtituent dan reaksi pusat terletak orto atau para (3e).
Ini dapat diamati bahwa tidak ada perbedaan mendasar antara dua situasi ini; ada dalam setiap kasus transfer biaya antara dua pusat melalui konjugasi dan diferensiasi menjadi + R dan -R efek hanya tergantung pada yang tengah kita menunjuk substituen dan yang pusat reaksi.
4.4.2 Efek induktif
Tipe kedua gangguan terbukti dari hasil konstan substituen berlaku pada posisi meta yang lebih besar daripada di para orang. Ini jelas diamati di substituen seperti -NMe3 (4) dan -CF3 dan tergantung untuk kekuatan pada proximitv. Ini disebut effect induktif. ditunjuk I; +I berarti elektron menyumbangkan elektron -I menarik. Dasar perpindahan elektron ini mungkin kompleks tetapi berasal dari bagian perbedaan elektronegativitas yang menyebabkan polarisasi
kedua σ- dan π-ikatan dan juga dari efek elektrostatik alami di pusat reaksi karena biaya dan dipol penduduk di substituen tersebut. Dua mekanisme untuk polarisasi induktif dapat dipertimbangkan. Efek induktif klasik adalah polarisasi melalui ikatan, baik dari σ- dan π-jenis, menjadi semakin dilemahkan. Yang lainnya, yang dikenal sebagai efek medan, disebarkan melalui ruang dan lebih tergantung intensitas pada jarak dari pada jumlah ikatan yang memisahkan sumber dan reseptor. Dalam prakteknya sulit untuk memisahkan dua, yang mungkin baik menjadi komponen dari efek yang saya. Luasnya atenuasi efek induktif dapat diukur dengan nilai terus menurun dari σ dibawa oleh penempatan dari rantai metilen:
Penjajaran dari substituen dibebankan atau dipolar dekat pusat reaksi dapat memiliki efek mendalam pada laju reaksi yang melibatkan generasi biaya karena energi dari keadaan transisi akan mendorong hal elektrostatik tambahan diringkas dalam tabel 1.17. Misalnya, 5 mengalami D-tukar pada tingkat 10-5 kali dari benzena dan perbedaan ini hanya menjadi sebagian dijelaskan oleh halangan sterik. Interaksi melalui ruang harus terjadi di sini, resistin penciptaan muatan positif pada cincin benzena. Di sisi lain, kopling kuat antara pasangan
menyendiri dari Diazabicyclo-oktan, 6, yang terlalu jauh untuk interaksi langsung diklaim terjadi 'melalui ikatan'
Biaya pada karbon individu dapat diukur dengan pergeseran kimia 13C-NMR. Beberapa hasil yang ditunjukkan pada Gambar. 4.3. The α-karbon tampaknya mengambil muatan positif lebih mudah daripada muatan negatif tetapi efeknya cepat dilemahkan sehingga pembalikan sedikit biaya yang jelas pada karbon berturut-turut. Hal ini sesuai dengan α tidak-induktif polarisasi atau dengan efek medan. Yang terakhir harus berpengalaman lebih kuat di C4 dari C3 karena konformasi yang menguntungkan, 7. Memprediksi pergantian biaya sepanjang rantai karbon (satu konformasi dan tidak adanya pelarut): misalnya;
Beberapa data eksperimen tampaknya setuju dengan ini sementara data lainnya tidak. Sifat efek induktif karena itu tampaknya lebih kompleks daripada awalnya berpikir dan jelas mengandung efek lapangan, polarisasi obligasi dan diperpanjang polarisasi. Istilah 'efek π-induktif' digunakan untuk menunjukkan polarisasi umum dari π-sistem diperpanjang.
Tidak seperti efek resonansi itu dilemahkan dengan jarak, melalui falloff kurang cepat dari itu melalui kerangka σ-ikatan. Tingkat pembelahan serangkaian silane berkorelasi dengan baik dengan σ0 dan nilai-nilai ρ mengurangi mantap dengan n; falloff sensitivitas, diukur dengan ρn / ρn-1, memiliki nilai konstan. Ini adalah karakteristik tidak murni R atau σ-induktif efek dan mungkin menjadi contoh transmisi elektron oleh π-polarisasi.
4,5 INTERPRETASI σ-NILAI
Efek induktif cenderung di penarik elektron akal (-I) karena sebagian besar kelompok subtituent tersedia adalah lebih elektronegatif dari karbon. Efek resonansi dapat baik tanda.
Hal ini mudah untuk mempertimbangkan empat jenis struktural substituen sesuai dengan campuran I dan R pengaruh yang mereka mampu mengerahkan:
Substituen pasangan Tidak terbagi, -X +R, -I
Gugus alkil, -R +R
Kelompok akseptor, -Z -R, -I
Pusat kationik tanpa orbital kosong -I
4.5.1 Tidak dibagi-pasangan (n) substituen, -X
Para (dan orto) posisi
Semua mampu mengerahkan efek resonansi elektron-menyumbangkan (3a, b), menstabilkan pusat akseptor, tapi kapasitas untuk berbagi mereka n-elektron jatuh dengan meningkatnya elektronegativitas. Pada saat yang sama + I efek menjadi meningkat kuat. Efek yang dihasilkan daun σp negatif untuk -NR2, atau, -R dan -SR tapi positif untuk halogen sebagai perubahan efek dari + R> -I untuk + R <-I. ini ditunjukkan secara grafik pada Gambar. 4.4a dengan memplot individu R dan saya komponen dan resultan pada σ-skala
Modifikasi substituen ini oleh sekelompok -R seperti karbonil atau sulfonil (-NHCOCH3, -OCH3, -OSO2R) akan mengurangi kapasitas penyumbang elektron anionik (misalnya -O-) disertai dengan peningkatan besar dalam sumbangan elektron (seperti + R, +I) Posisi Meta
Efek lemah + R sehingga σ didominasi oleh efek + I, kuat posisi meta daripada posisi para dan meningkatkan elektronegativitas. Kecuali untuk -NR2 dan -R semua substituen jenis ini memiliki nilai positif dari σm begitu juga, secara keseluruhan, penarik elektron. 4.5.2. Gugus Alkil
Efek elektron gugus alkil seperti metil adalah eksperimen yang mudah substituen + R, yaitu mampu melepaskan elektron dengan mekanisme resonansi dan mampu menstabilkan inti positif ketika pososo orto atau para untuk 8. efek ini dikenal sebagai hiperkonjugasi sejak delokalisasi yang melibatkan σ terikat pada (n) atau π-elektron. Kation tert-butyl, C(Me)3+, (9), jauh lebih stabil daripada kation metil, CH3+, dan teori spektrum NMR menunjukan bahwa muatan positif terdelokalisasi ke hidrogen perifer. VB yang memiliki kontribusi pada struktur 10. C C0.34+ H H H0.064+ 0.083+ CH3 CH3 ( 9) CH3 CH3 H+ H H C C ( 10)
Dalam hal ini elektron ikatan sedikit berbeda. Hiperkonjugasi dimulai dari cincin benzena, tapi ada efek I diabaikan dari beberapa kelompok. Eksperimen, hiperkonjugasi dapat dilihat dengan spektroskopi foto elektron, yang mengukur energi ionisasi elektron dalam MOs. Hiperkonjugasi antara -CZ3 dan -CH = CH2 dalam senyawa alil menimbulkan kenaikan energi dari π-orbital (karena kedua komponen terisi penuh ikatan MOs) dengan jumlah yang sebanding dengan kekuatan interaksi. Hiperkonjugasi ikatan σ sebagai berikut.
C-I > C-Br > C-H ~ C-Cl ~ C-C ~ C-F
Hiperkonjugasi dari C-C lebih jelas daripada C-H, sehingga nilai σ untuk tert-butil (-0,15) lebih negatif daripada metil (-0.14).
4.5.3. Grup akseptor-Z
Dalam kategori ini, ditempatkan substituen yang mampu menerima muatan-oleh efek resonansi elektron. Semua memiliki π-sistem merangkul atom yang melekat langsung pada inti dan struktur VB berkontribusi penting yang memberikan muatan positif pada ini dan ligan kosong (3d). Contoh umum dari substituen karbonil adalah -CO-A; A = R, OR, NR2, H, dll,
siano (- C N)sulfonil & sulfonil derivatif
SO dan SO2
(
)
dan kelompok nitro (-NO2). Semua efek -R, menstabilkan muatan negatif di cincin dan destabilisasi muatan positif (3c-e). Di samping adanya efek induktif (-I), tetapi lebih besar efek resonansi karena adanya kemungkinan parsial dan elektronegativitas oksigen yang tinggi atau nitrogen pada kelompok substituen. Substituen ini dua kali lipat suka menarik elektron (Gambar. 4.4b).
4.5.4. Pusat Kationik
Substituen seperti
- NR3, - IR3
memiliki efek penarik elektron yang sangat kuat, yang ditunjukkan oleh konstanta substituen yang melebihi +1. Hal ini dapat dianggap sepenuhnya karena efek induktif muatan. Kontribusi dari hiperkonjugasi harus tetap ada tapi sulit untuk memisahkannya dari efek + I yang kuat.
Efek substituen dirangkum dalam Tabel 4.2.
Kemiringan plot Hammett log Kret terhadap σ adalah p, dan reaksi konstan. Ini adalah ukuran sensitivitas reaksi terhadap efek gangguan elektron. Dari definisi σ dan Persamaan. (4.1), p = 1000 untuk disosiasi asam benzoat dalam air pada 250C. Karena itu reaksi ini diatur sebagai standar yang digunakan untuk membandingkan elektron.
Besarnya ρ memberikan ukuran sejauh mana reaksi merespon substituen. Karena ini adalah pada skala logaritmik, ρ perubahan 1 menunjukkan perubahan 10 kali lipat tingkat. Sebuah panduan yang berguna untuk menafsirkan konstanta Hammett adalah sebagai berikut: perubahan dalam substituen dari p-OMe untuk p-NO2 (Δσ ~ 1) akan disertai dengan perubahan 10 kali lipat dalam tingkat konstan jika ρ = 10, 100 kali lipat jika ρ = 2 (10^ di mana ρ = n), meningkatkan jika ρ adalah positif, dan penurunan jika negatif. Nilai p untuk hidrolisis eter, ara. 4.2b, di 2,54. Reaksi ini lebih sensitif dibandingkan asam benzoat disosiasi oleh faktor 102,54-1,00 = 35, konsisten dengan langkah aktivasi di mana OH-menyerang gugus karbonil, pusat reaksi dua ikatan lebih dekat ke sumber.
4.7. PENYIMPANGAN DARI PERSAMAAN HAMMETT
Persamaan Hammett, seperti semua hubungan-energi bebas linier, adalah ekspresi dari kesamaan perilaku di antara dua atau lebih set reaksi. Seperti banyak yang bisa dipelajari dari mekanisme dari reaksi yang gagal untuk menyesuaikan diri sebagai dan mana yang. Beberapa jenis perilaku nonlinier antara tingkat dan α-nilai mungkin dialami.
4.7.1 Penyimpangan Acak
Terlepas dari kesalahan eksperimental di k-nilai, satu mungkin mengharapkan poin eksperimental untuk berbohong dari jalur terbaik lurus oleh beberapa 10-15%, ini menjadi
limie mana hubungan memegang pada rekening variasi kecil dalam keselamatan dan faktor-faktor luar lainnya. Sebaliknya, ini adalah batas reliablility untuk prediksi tingkat yang tidak diketahui konstan dari α dikenal dan. plot yang sangat acak, mencatat dalam beberapa reaksi radikal, merupakan indikasi bahwa faktor kutub sama sekali tidak mengendalikan laju reaksi. 4.7.2 Perubahan Mekanistik
Kadang-kadang mekanisme penuh semangat-disukai dari reaksi perubahan pada mengubah substituen a. Hal ini sering terjadi jika dua jalur energi aktivasi yang sama yang tersedia dan memiliki permintaan elektron yang sangat berbeda. Hasilnya akan menjadi perubahan mendadak dalam kemiringan Hammett plot (gambar 4.5). Perubahan pada langkah tingkat-menentukan reaksi multi-langkah juga akan menghasilkan diskontinuitas, atau bahkan pembalikan tanda, dari ρ (gambar 4.6) plot non-linear dapat menemukan sebuah reaksi yang mengambil menempatkan dua jalur bersamaan, ketika proporsi dua akan berbeda sesuai dengan substituen ini. Kadang-kadang kehadiran substituen tertentu memungkinkan jalur reaksi yang unik. Reaksi klorida cumyl, 11 (R = Me), dengan nukleofil seperti thiophenoxide adalah sangat terbelakang oleh
Ar CR2 Cl lambat CR2Cl
Nu- products Ar
kelompok penarik elektron. Nitro, bagaimanapun, adalah pengecualian dan perpindahan lancar diamati terhadap ekspektasi. Tampak bahwa ρ-nitrocumyl klorida lebih memilih untuk bereaksi dengan cara proses rantai radikal (bagian 15.3.4) dan oleh karena itu laju tidak sebanding dengan orang-orang dari analoginya, 12. Hidrolisis p-hidroksibenzoat. 13. Apakah biasa lancar karena kemungkinan penghapusan proton sebagai bagian dari kekuatan pendorong 44.
PhS O 2N C Cl 12 products C O2N Cl PhS
ArCH NR H k1 ArCH NHR H2OK2 ArCHO RNH2
HO C HOH O OAr HO O C O OAr 4.7.3 Peningkatan resonansi
Solvolisis halida tersier, 11, yang terjadi dengan tingkat-menentukan ionisasi, memberikan linier Hammett plot hanya untuk menonaktifkan -R dan substituen para -I dan untuk jenis lain hanya bila dalam posisi meta. Pasangan menyendiri dan alkil kelompok yang mengerahkan + eifects R menyampaikan reaktivitas lebih besar dari yang diharapkan dari nilai-nilai mereka dari α sehingga plot menjadi semakin melengkung (gambar 4.7). Alasannya terletak pada sifat keadaan transisi, di mana p-orbital kosong yang devoleping berdekatan dengan cincin aril. Interaksi conjugative terutama kuat dengan lone-pair substituen pada posisi para karenanya berkembang, jauh lebih besar daripada yang diukur dalam disosiasi dari
Gambar. 4.6 penyimpangan dari linieritas plot Hammett karena perubahan pada langkah mengendalikan laju; reaksi adalah hidrolisis imina; elektron-menyumbangkan kelompok membantu langkah 1 membuat langkah 2 lambat tapi penarik elektron kelompok akhirnya meningkatkan k2 sampai tidak lagi ditentukan.
Gambar 4.7 a. Hammett plot ionisasi Ar3C-Cl dalam SO2 cair. b. Brown-Okamoto plot reaksi yang sama
asam benzoat, dan permulaan dari linearitas adalah hasilnya. Ini berarti bahwa efek + R tidak hanya tergantung pada substituen tetapi juga pada reaksi. Pengobatan yang diadopsi oleh Brown dan Okamotoadalah untuk menentukan LFER dimodifikasi berlaku untuk keadaan ini
+¿
+¿σ¿
logkx¿kH=ρ¿ (4.3)
dimana +σ¿¿
adalah serangkaian baru konstanta substituen dinyatakan meningkat sifat resonansi (tabel 4.1). Skala didefinisikan untuk reaksi di atas (cumyl klorida; 11. R = Me) solvolyzing di 250C dalam aseton berair.
Ar N N + N3 Ar N N _ N3
Linear Hammett plot untuk meta
substituen (ρ = -4,54) telah dibuat dan +σ¿¿
-nilai dipasang pada garis. Persamaan (4.3), bukan (4.2), harus berlaku untuk semua reaksi di mana karakter akseptor kuat (dalam kebanyakan kasus, seperti ini, diperoleh karbokation) berkembang pada cincin. Tabel 4.4 daftar reaksi yang mematuhi persamaan Brown-Okamoto dan harus ada dari jenis mekanistik
tersebut. Masih kebanyakan memiliki nilai negatif besar +ρ¿¿
tapi keadaan berlangsung di mana reagen distabilkan oleh interaksi resonansi yang kuat untuk oxtent lebih besar
dibandingkan keadaan transisi. Dalam kasus tersebut, korelasi konstanta laju dengan +σ¿¿
masih ditemukan, tetapi dengan +ρ¿¿
positif. Contohnya adalah koordinasi nukleofil untuk
ion diazonium dan, tentu saja, kebalikan dari jenis ionisasi reaksi dimana +σ¿¿
O H NO2 O N O O N O O O
Secara permulaan analoginya dari perilaku Hammett terjadi ketika kekuatan donor inti berdekatan dengan cincin aromatik dalam bentuk reaktan atau dihasilkan sebagai produk (12). Dalam hal ini, konjugasi yang ekstra kuat mungkin dengan substituen -R sehingga plot non-linear yang diperoleh untuk substituen seperti p-nitro dan p-siano. Contoh perilaku ini terjadi dengan banyak reaksi dari fenol dan anilines (Gambar 4.8).
p-Nitrophenol. 14 misalnya, adalah asam jauh lebih kuat dan p-nitroaniline jauh lebih lemah dari yang diharapkan untuk nilai σp−NO2
0
, disebabkan oleh stabilisasi basa konjugat berturut-turut oleh resonansi. Sebuah skala konstanta substituen dapat dibuat secara analogi
ke +σ¿¿
berskala sehingga reaksi untuk kategori menurut Persamaan. (4.4):
−¿
−¿σ¿
4.7.4 Interaksi Resonansi Variabe Korelasi tingkat dengan +σ¿¿
dan −σ¿¿
bukan dengan σ0 merupakan indikasi bahwa kontribusi resonansi untuk efek substituen adalah variabel dan bereaksi lebih efektif daripada pengaruh induktif dengan permintaan elektron dari reaksi64. Untuk alasan praktis , jumlah skala substituen harus dibatasi dan maka untuk sebagian besar tujuan yang cukup untuk menentukan tiga jenis. Maka perilaku tingkat dapat dinilai menjadi 'paling menyerupai'
untuk dissosiasi asam benzoat
σ (¿¿0) ¿ , dissosiasi anilin σ ¿ −¿ ¿ ¿
atau cumyl klorida solvolisis
+¿ σ¿
¿ .
Gambar 4.9 Plot untuk reaksi Yukawa-Tsuno
Korelasi antara atau bahkan di luar kasus ini tidak dikesampingkan. misalnya, bromonolysis asam boron benzena begitu kuat dipercepat oleh p-OMe bahwa bahkan σ+ tidak cukup untuk mengungkapkan efeknya.
Ar B(OH)2+ Br2 Ar Br B(OH)+ 3+HBR
Metode fleksibel memperkenalkan variabilitas tersebut ke dalam efek resonansi dapat dicapai dengan penambahan parameter lanjut. Persamaan yukawatsuno, ( persamaan 4.5), mengungkapkan linear hubungan energi bebas sebagai mengandung kontribusi dari 'normal' dan 'ditingkatkan' efek resonansi.
Log kx/kH = ρ(σ0 + r(σ+ - σ-)) (4.5) Tidak mengherankan, korelasi yang lebih baik dapat diperoleh dengan penyesuaian r dari baik dari Hammet sederhana atau coklat-Okamoto plot (Gambar. 4.9, tabel 4.5). r konstan mengungkapkan tingkat enchanced resonansi interraction dalam kaitannya dengan dissociations asam benzoat (r = 0) dan hidrolisis cumylchloride (r = 1).
4.8 KORELASI DUA PARAMETER; THE FLOWERING OF LFER
Jelas keberhasilan persamaan Hammet dan recognisi dari kebutuhan untuk model efek substituen yang mencakup setidaknya dua fenomena fisik efek I dan R yng mendorong banyak pekerja untuk undartake pemisahan nilai σ ke dalam komponen berkontribusi mereka. Jika induktif yang universal (σ1) dan resonansi (σR) komponen dari bisa ditugaskan untuk setiap substituen, tidak hanya akan interaksi mereka mekanisme diklarifikasi tetapi pentingnya dua efek dalam menstabilkan keadaan transisi dapat dinilai dengan nilai relatif σ1 dan σR.
σ0 = σ
1 + σR (4.6)
Jika serangkaian tingkat akan dipasang ke persamaan dua-parameter seperti persamaan (4.7) : log kx/ kH = ρ1 σ1 + ρR σR (4.7) sejauh mana pendekatan ini telah berhasil akan dibahas.
4.8.1 Konstanta subtituen induktif
Sistem model di mana pusat reaksi dan substituen dipisahkan oleh cincin anaromatic sebagai, inti, misalnya sistem Hammet, memungkinkan campuran resonansi dan interraction induktif untuk ditransmisikan, lemah dari posisi meta. Model yang paling sederhana membuat asumsi dari mana, setelah menempatkan nilai ke (0,33 telah digunakan) penghapusan σR mungkin.
σ0p = σ1 + σR and σm0 = σ1 + ασR
Dengan demikian, keberatan untuk skala ini termasuk dari nilai bitrary dari dan asumsi nilai yang sama dari efek induktif pada posisi meta dan para.
σ= ( σm 0 - α σp 0 ) / (1-α) (4.8) 4.8.2. MODEL TAFT
Ester alifatik dapat dihidrolisis dalam kondisi baik asam atau basa; masing-masing kA dan kB, kemudian dapat diukur untuk serangkaian substituen etil asetat, tetapi tidak memberikan linear memuaskan plot Hammet.
X CH2COOEt COOH EtOH
H+
OH -ka
kb
X +
Sekarang masing-masing reaksi tunduk pada kombinasi tidak hanya efek induktif dan resonansi, tetapi juga perubahan 'sterik' pengaruh substituen, Es yang mempengaruhi △Sǂ . Yang terakhir ini mungkin termasuk halangan langsung akses ke pusat reaksi, terkait dengan ukuran x dan perubahan solvasi di sekitarnya; ketiga variabel sekarang harus disertakan pada LFER:
log kx/kH = ρ1 σ1 + ρR σR + Es (4.9) Itu diusulkan oleh Ingold bahwa efek elektron (I + R) adalah sedikit di hidrolisis asam-katalis (alasan dibahas dalam bagian 10.3.2) tapi diucapkan dalam reaksi dasar-katalis, yaitu:
log kXA / kHA = Es (4.10) Juga, dengan asumsi bahwa kelompok -CH2- tidak akan mengirimkan efek resonansi antara substituen dan pusat reaksi (C = O),
log kX B / kH B = ρ1 σ1 = ρ* σ* (4.11)
dan berikut ini
log kXA / kHA - log kXB / kHB = ρ1 σ1 = ρ* σ* (4.12)
yang mendefinisikan suatu substituen konstan σ baru untuk X, terutama yang bersifat induktif dan berlaku untuk seri reaksi dengan inti alifatik. Sekarang menugaskan ρ*= 2.54 (konstanta reaksi untuk hidrolisis dasar ester benzoat, ArCOOEt, dari persamaan Hammet) memungkinkan σ* dievaluasi. Persamaan (4.13) dikenal sebagai persamaan Taft-Ingold, dimana Me (bukan H) adalah substituen referensi:
log kx/kmc = ρ* σ* (+ ρsEs) (4.13) Swain dan Lupton diukur konstanta disosiasi asam asam bicyclooctanecarboxylic, 15, dan sistem alifatik lain yang patut di mana resonansi.
Table 4.7. beberapa reaksi berhubungan dengan persamaan taft-Ingold
kemungkinan efek menjadi potongan, untuk mendefinisikan induktif (baik bidang atau melalui ikatan) substituen konstan, F :
log kX/kX = F (4.14) Mereka kemudian menunjukkan bahwa berbagai nilai bisa diekspresikan secara konsisten sebagai kombinasi dari F dan resonansi substituen parameter R :
σ = aF + b R
(4.15)
F dan R (tabel 4.8) memiliki konotasi yang sama dengan p1 dan pr sehingga dapat digunakan dalam persamaan regresi (4.16) untuk mengkorelasikan tingkat banyak kimia dan reaksi biokimia dan data spektroskopi :
log kX/kX = f F + r R (4.16) di mana F, R adalah konstanta kerentanan reaksi. analisis swain-Lupton menunjukkan kontribusi dari F dan R yang membentuk umum σ-nilai :
4.8.3 Sistem model kimia lainnya : skala σI dan σR modern
Efek resonansi yang minimal dan geometri masingmasing mirip anggota dan sulit untuk mempertahankan, mirip efek 'sterik'. Selain itu senyawa yang lebih mudah untuk
mensintesis daripada kuban derivatif sesuai, 17. Dalam semua kasus σIσR dapat
didefinisikan menurut Persamaan(4.17) – (4.20) :
log KX/KH=α σI (4.17)
Setiap σI kemudian perlu ditingkatkan agar sesuai dengan nilainilai σo .
Dasarnya sama induktif konstanta hasil dari penerapan persamaan (4.17) untuk disosiasi asam
menggunakan F.NMR pergeseran kimia dari 3 substituen fluorobenzen untuk menentukan efek induktif.
σI=δX/3.71 + 0.084
(4.18)
Perselisihan kecil antara skala dapat ratarata untuk diproduksi skala universal
konstanta substituen induktif (tabel 4.9). Konstanta resonansi substituen , σR kemudian dapat diperoleh dari persamaan ( 4.19 ) dan ( 4.20 ) : σp=σI+σR, (4.19) σm=σI+α σR , (4.20) dimana dapat σ −¿ +¿σ¿ σ0σ¿ dan adalah skala konstanta. Nilai dari α σR 0 berlaku dengan tidak adanya konjugasi langsung antara substituen dan reaksi pusat jenis sistem yang akan sesuai dengan Hammett Persamaan . Sejak efek resonansi dipamerkan oleh substituen yang tidak merespon secara linear untuk elektron permintaan, fitur yang hilang dalam analisis Swain
Lupton ada kebutuhan untuk tambahan σR timbangan untuk mengatasi resonansi
enchanced dalam pendekatan dual parameter . Timbangan resonansi dilambangkan +σ¿R¿
+
dan −σ¿R¿
untuk digunakan dengan akseptor dan reaksi donor pusat dihasilkan dari
Persamaan ( 4.19 ) masingmasing menggantikan σP oleh
−¿
+¿dan σ¿
keempat, σR (BA) juga menganjurkan untuk ' moderat ' situasi resonansi mirip dengan
yang ditemui di benzoat asam (BA) dissosiasi . Untuk mendapatkan ganda parameter korelasi perlu untuk menyesuaikan tingkat atau ekuilibrium data untuk serangkaian reaksi
persamaan (4.21) menggunakan nilai σI dan mana resonansi skala yang cocok
memberikan yang terbaik :
kX/kH=¿ρIσI+ρRσR
log¿ (4.21)
Untuk meringkas:
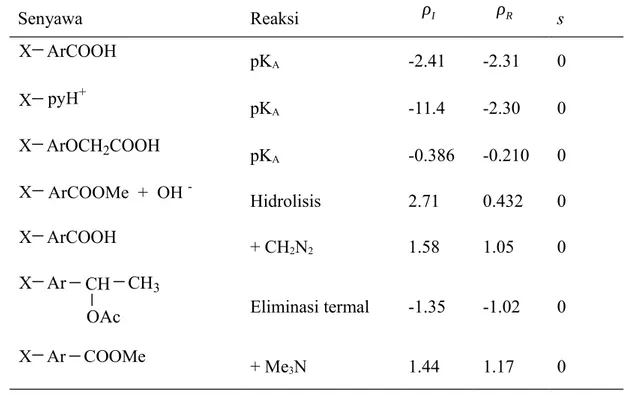
Contoh korelasi parameter ganda diberikan dalam tabel 4.10 . dua konstanta reaksi untuk setiap diperoleh , karakterisasi sensitivitas tarif mereka untuk induktif pengaruh dan mesoric efek . Dalam kebanyakan kasus kedua adalah besarnya sebanding , yaitu
ρR/ρI=λ 1I tetapi dalam beberapa kasus I atau R efek dapat mendominasi (misalnya entri
7,14 pada tabel 4.10) atau dua konstanta reaksi bahkan mungkin tanda berlawanan . Contoh perilaku yang terakhir ditemukan dalam dekomposisi alkali ion arildiazonium :
Ar N2 lambat Ar+ + N2 ArOH
Reaksi gagal untuk memberikan korelasi yang memuaskan dengan versi persamaan Hammet tapi dari persamaan (4.21) dan memadai sesuai diperoleh dengan
ρI=−4.09,ρR=+2.72 . Sebuah parameter tunggal LFER tidak dapat mengatasi dengan
reaksi memiliki karakteristik yang tidak biasa seperti (namun harus diakui bahwa interpretasi fisik korelasi ini tidak jelas).
1. Ionisasi ArCOOH (dioxane - air) 1.426 1.153 0.81 1.453
2. Ionisasi ArCH2COOH (metanol) 1.358 1.139 0.84 1.382
3. Ionisasi ArSO2NHPh (air) 1.140 0.943 0.83 1.062
4. Ionisasi ArSe(OH)2 (air) 1.068 0.812 0.76 0.827
5. Ionisasi (aq.etanol) 0.694 0.664 0.96 0.712 6. Hidrolisis alkalin ArCOOEt 2.602 2.307 0.89
2.593 7. transesterifikasi ArCOOC10H19 MeO, metanol 2.578 2.212 0.86 2.608 8. Hidrolisis ArS-CH2 Cl -2.576 -2.302 0.89 -2.618 9. Hidrolisis ArCOOEt (515oC) 0.215 0.112 0.96 1.361 10. Hidrolisis (ArCO)2O 3.107 2.925 0.94 1.361
11. 19F.NMR pergeseran kimia di ArCH F 9.297 16.811
a Reaksi berhubungan dengan σR 0 Reaksi ρI ρR0 λ logkH b Reaksi berhubungan dengan σR (BA) Reaksi ρI ρR0 λ logkH 26 1. Ionisasi ArCH2COOH (air) 0.484 0.433 0.90
0.481
2. Ionisasi ArCH2COOH (aq. Etanol) 0.755 0.646 0.86 0.562
3. Ionisasi ArCH2NH3+ (air) 1.082 1.057 0.98 0.908
4. Hidrolisis alkalin ArCH2COOEt 1.173 0.79 0.67 0.813
5. Hidrolisis alkalin CH3 COOAr 0.714 0.718 1.01 0.732
6. Perpindahan Cl oleh MeO- di ArCH
2Cl 5.961 -8.24 1.38 5.545
7. 19F.NMR pergeseran kimia di ArF -9.02 -31.2 3.46 -15.0
1. Ionisasi ArCOOH (dioxane - air) 1.426 1.153 0.81 1.453
2. Ionisasi ArCH2COOH (metanol) 1.358 1.139 0.84 1.382
3. Ionisasi ArSO2NHPh (air) 1.140 0.943 0.83 1.062
4. Ionisasi ArSe(OH)2 (air) 1.068 0.812 0.76 0.827
5. Ionisasi (aq.etanol) 0.694 0.664 0.96 0.712 6. Hidrolisis alkalin ArCOOEt 2.602 2.307 0.89
2.593 7. transesterifikasi ArCOOC10H19 MeO, metanol 2.578 2.212 0.86 2.608 8. Hidrolisis ArS-CH2 Cl -2.576 -2.302 0.89 -2.618 9. Hidrolisis ArCOOEt (515oC) 0.215 0.112 0.96 1.361 10. Hidrolisis (ArCO)2O 3.107 2.925 0.94 1.361
11. 19F.NMR pergeseran kimia di ArCH
2F 9.297 16.811 1.81 11.28
c Reaksi berhubungan dengan +σ¿R¿
Reaksi ρI ρR 0 λ logkH d Reaksi senyawa vinil Senyawa Reaksi ρI ρR s X COOH pKa -2.26 -2.09 0 X COOEt OH-, hidrolisis +2.83 +4.88 0 X CH2Cl etanolisis -5.19 -8.80 0 X CH2Cl 13-C pergeseran kimia 11.9 63.5 0 Lanjutan Tabel 4.10
1 Ionisasi dari Ar3C-OH(H2SO4) -11.10 -9.79 0.88 -9.861
(d) Reaksi senyawa vinil Senyawa Reaksi ρI ρR s seri cis X COOH pKA -2.28 -1.71 -0.313 X COOMe OH -, hidrolisis 2.81 1.91 -1.68 X COOH + PhCN2 1.98 1.97 -0.235 seri awal X COOH pKA -4.14 -0.873 0 X COOH Ph pKA -3.81 -1.22 0 X CH2Cl + I - -0.845 -1.23 0
reaksi pada ikatan π X Me + Ag + -3.6 -5.21 0 X + Br Br / AcOH -13.0 -3.56 0 X Me H OCOCF3 + -8.48 -13.7 0
Senyawa Reaksi ρI ρR s X ArCOOH pK A -2.41 -2.31 0 X pyH+ pK A -11.4 -2.30 0 X ArOCH2COOH pK A -0.386 -0.210 0 X ArCOOMe + OH - Hidrolisis 2.71 0.432 0 X ArCOOH + CH 2N2 1.58 1.05 0 X Ar CH CH3
OAc Eliminasi termal -1.35 -1.02 0
X Ar COOMe
+ Me3N 1.44 1.17 0
Evaluasi dari konstanta reaksi parameter ganda, ρI dan ρR
Korelasi dengan dua variabel independen yang diwakili oleh persamaan (4.16) dan (4.21) membutuhkan analisis komputer dari data; ini biasanya merupakan masalah rutin dari menggunakan program analisis multi-korelasi standar, biasanya dapat ditemukan di antara perangkat lunak standar untuk setiap mesin yang tersedia. Persamaan dua parameter tidak cocok untuk tampilan grafis, yang merupakan suatu fitur yang berguna dari persamaan Hammet, tetapi ni dapat dicapai dengan cara transformasi berikut:
logkX/k❑H=ρIσI+ρRσR= ´σ´ρ (4.22)
sehingga sehingga,
Gambar 4.10. a. plot LFER dari kesetimbangan ionisasi ArSH (EtOH, 25 ℃ dengan berbagai nilai σ. b . Sama, diplot terhadap σ´ menurut persamaan (4.22).
λ
⟩
1+⟨¿
¿
´
σ=
(
σI+λ σR)
/¿Memplotkan log kX / kH terhadap σ´ memberikan plot linear, dengan kemiringan = ´ρ , dimana λ
⟩
1+⟨¿dan ¿ λ⟩
1+⟨¿ ¿ ¿ ρI=´ρ/¿dimana λ = ρR / ρT. Gambar 4.10 memberikan contoh grafik seperti dibandingkan dengan plot parameter tunggal untuk reaksi yang sama. Perlu ditekankan bahwa nilai korelasi harus dinilai dengan kriteria statistik yang signifikan (koefisien korelasi, uji T atau F, misalnya) atau dengan formula matematika analisis faktor. Pendekatan parameter ganda, bagaimanapun, dapat digunakan untuk mengkorelasikan efek orto substituen, dan reaksi melalui heterosiklik, olefin dan inti alifatik.
Menentukan parameter elektronegativitas substituen
Seperti telah disebutkan, parameter induktif, σI, merupakan ukuran operasional efek non-resonansi dan hampir pasti campuran 'melalui-ikatan' (induktif benar atau elektronegatif) dan efek 'melalui-ruang' (bidang), yang mendominasi keduanya. Sulit untuk membayangkan metode eksperimen untuk mengukur efek elektronegativitas saja, tetapi baru-baru ini skala σX (tabel 4.9) telah diusulkan berasal dari perhitungan awal OM, didefinisikan sebagai
σX=
(
1−qH)
dimana qH adalah muatan listrik yang berlebihan pada hidrogen dalam senyawa H-X dan merupakan ukuran dari efek induktif murni kelompok X. Skala σ berbeda secara signifikan
dari skala σI, perbedaan yang berhubungan dengan efek medan. Efek medan dapat diperkirakan secara teoritis dengan menghitung perubahan energi, △E, untuk sistem:
CO2- CO2H H H X H H X CO2 -CO2H H H X H H X (4.23)
Molekul-molekul tersebut tetap jauh terpisah dan efek medan dari substituen, X, yang tersebar hanya melalui ruang. Nilai dari △E diberikan dalam Tabel 4.11.
4.9 PERTIMBANGAN ORBITAL MOLEKUL
Penggantian hidrogen dengan gugus substituen memiliki efek dari gangguan reaktivitas molekul dengan mengubah kekuatan sebagai nukleofil atau elektrofil. Hal ini disebabkan setidaknya sebagian untuk gangguan orbital perbatasan secara sistematis. Satu dapat memeriksa kualitatif efek substitusi pada reaktivitas benzena pada posisi para serangan elektrofilik. Menggunakan faktor koreksi heteroatom, δm dan ρm (tabel 1.2), energi lokalisasi, L+ , diperoleh untuk konversi :
X X
δM : 0 0.5 1.0 1.5 2.0
kira-kira sesuai untuk X : CH2- N O Cl H
E (HOMO) / β : 0 -0.28 -0.50 -0.66 -0.75
L + / β : 1.82 2.06 2.21 2.30 2.35 2.536
koefisien pada HOMO ( p-C : 0.377 0.397 0.443 0.489 0.520
o-C : 0.377 0.382 0.387 0.383 0.372 6π
8π
ψ4¿
{
Dibandingkan dengan benzena, energi lokalisasi berkurang dan karenanya reaktivitas harus meningkat dalam urutan
−¿
p−Cl<p−OH<p−N H2<p−C H2
¿
sesuai dengan pengamatan. Energi HOMO juga naik dalam urutan ini, menyiratkan peningkatan nukleofilisitas. Koefisien dari HOMO pada posisi reaktif (o- dan p-) cenderung berkurang dengan meningkatnya reaktivitas dan dapat diprediksi menjadi kurang penting, tapi besaran relatif mereka semakin menyatu dengan reaktivitas dan dapat menjadi faktor yang mempengaruhi rasio produk.
Asal-usul konstanta substituen dapat diperiksa oleh tingkat tinggi teori OM. Energi dari spesies yang terlibat dalam kesetimbangan dapat dihitung,
X H NH2+ NH2 + X H NH2+ NH2 +
dan karenanya satu memperoleh perubahan keseluruhan energi untuk pertukaran proton, yang dapat menyamakan dengan perbedaan keasaman dari asam tersubstitusi dan tidak tersubstitusi, δ△E. Parameter efek induktif/medan ini dapat dilambangkan, F (tabel 4.11).
Satu set serupa kesetimbangan untuk transfer proton antara anilin juga dapat dihitung, efek substituen sekarang menjadi kombinasi bidang, F, dan resonansi, R, efek yang kemudian dapat dipisahkan. Nilai-nilai dari F dan R setuju dengan sangat baik dengan nilai σI dan σ0R, menunjukkan kebenaran esensial dari pendekatan ini.
Resonansi ion siklotron (ICR; bagian 6.9) memungkinkan konstanta kesetimbangan dalam fase gas untuk dievaluasi untuk reaksi antara ion dan molekul netral, dan ideal untuk transfer proton. Sebagai contoh,
ROH2 + MeOH ROH + MeOH2 RO - + MeOH ROH + MeO
-(A) (B)
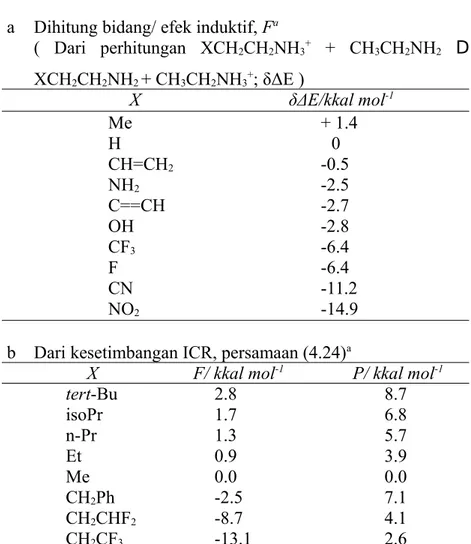
Tabel 4.11 Efek substituen dari kesetimbangan fase gas a Dihitung bidang/ efek induktif, Fa
( Dari perhitungan XCH2CH2NH3+ + CH3CH2NH2 D XCH2CH2NH2 + CH3CH2NH3+; δΔE ) X δΔE/kkal mol-1 Me + 1.4 H 0 CH=CH2 -0.5 NH2 -2.5 C==CH -2.7 OH -2.8 CF3 -6.4 F -6.4 CN -11.2 NO2 -14.9
b Dari kesetimbangan ICR, persamaan (4.24)a
X F/ kkal mol-1 P/ kkal mol-1
tert-Bu 2.8 8.7 isoPr 1.7 6.8 n-Pr 1.3 5.7 Et 0.9 3.9 Me 0.0 0.0 CH2Ph -2.5 7.1 CH2CHF2 -8.7 4.1 CH2CF3 -13.1 2.6
c Perhitungan efek bidang menggunakan persamaan (4.23)a X ΔE/ kkal mol-1 X ΔE/ kkal mol-1
H 0.0 CN 6.31 NH2 1.49 CF3 5.00 NMe2 1.59 CO•Me 2.63 OMe 3.34 COONe 2.59 F 5.51 NO2 8.30 Me -0.02 CHO 3.01
a Skala penulis alsi, yang mana nilai energi dalam kkal mol-1, telah dipertahankan.
Dalam sistem alifatik, efek resonansi tidaklah penting dan variasi stuktural mempengaruhi ΔG oleh bidang, F, dan polarisabilitas, P, berubah dalam struktur R. Permintaan elektron dari kedua reaksi tersebut berlawanan tetapi polarisabilitas membantu keduanya. Karenanya
ΔG (A) ≈ F + P
ΔG (B) ≈ - F + P
dan ΔG (A) - ΔG (B) = 2F, sesuai dengan
ROH2 + MeO- RO- + MeOH2 ; G = 2F (4.24)
yang mana P = ΔG (A) - F. Nilai F dan P konstant diberikan pada Tabel 4.11. Polarisabilitas tampak dominan untuk kelompok alkil tetapi efek bidang meningkat saat adanya substituen elektronegatif.
MASALAH
1 Tabel berikut merupakan ketetapan nilai pKA dari halogen – tersubstitusi asam benzoat
dan fenol.
o- m- p- o- m-
p-F 3.83 4.42 4.70 8.70 9.21 9.91
Cl 3.48 4.39 4.53 8.53 9.13 9.42
Br 3.41 4.37 4.49 8.54 9.03 9.36
I 3.42 4.41 4.6 8.51 9.06 9.30
Membangun alur Hammett dari nilai ini dan memeriksa kecocokan untuk rangkaian orto, meta, dan para. Menghitung konstanta reaksi, ρ, dan ukurannya.
2 Menggunakan nilai diatas untuk monoklorofenol dan nilai pKa berikut untuk
poliklorofenol, perkiraan postulat bahwa adanya penambahan efek subtstituen, yaitu pKa α Σ σ. 2,3-Dikloro 7.70 2,3,4-Trikloro 7.59 2,4-Dikloro 7.85 2,3,5-Trikloro 7.23 2,5-Dikloro 7.51 2,3,6-Trikloto 6.12 2,4,6-Trikloro 6.46 3,4,5-Trikloro 7.74 2,3,4,5-Tetrakloro 5.22 2,3,4,6-Tetrakloro 5.22 2,3,5,6-Tetrakloro 5.44 3 Untuk reaksi eliminasi,
X-PhCH=N-Cl + OH- → X-Ph-C≡N + H
2O + Cl-, laju konstan untuk X yang berbeda ditemukan sebagai berikut:
X p-MeO p-Me H p-Cl m-Br p-COOEt
103k/ M-1S-1 4.31 8.43 17.3 100 117 168 Laju ini sesuai dengan persamaan Hammett dan, jika begitu, tafsiran mekanistik apa yang mungkin ditempatkan? Perkiraan laju reaksi ketika X = p-CF3.
4 Laju konstan untuk brominasi p-bromofenol dan basa konjugasinya ditemukan sebagai berikut :
Br OH Br O
-k = 3.2 X 10-3 M-1 S-1 7.8 X 109 M-1 S-1
Perkiraan σ+ untuk substituen —O—jika reaksi diasumsikan memiliki ρ+= -10.
5 Iodin tidak lumayan bereaksi dengan benzena tersubstitusi kecuali ada substituen dengan aktifasi yang sangat tinggi. Ia akan segera lebih berekasi dalam keadaan elektrolitik:
ArH + I2/ MeCN elektrolisis ArI yang mana i ρ+ = -6.27. sarankan mekanisme reaksi ini. 6 Laju klorinasi dari arilasetilena,
X-C6H4C≡CH + Cl2 → X-C6H4CCl=CHCl Sensitif terhadap substituen :
X : p-OMe p-Me p-F H p-Cl p-Br m-NO2 p-NO2 k : 19,500 190 14.9 10.6 4.15 2.81 0.0165 0.00325 Menentukan apakah log k berkolerasi baik dengan σ atau dengan σ* dan karenanya disimpulkan sifat dari keadaan transisi. [J. Org. Chem. 45,2377 (1980).]