5
BAB II
TINJAUAN PUSTAKA
2.1 Aspek Kimia CO2
Karbon dioksida adalah produk akhir oksidasi senyawa organik dan karena itu dianggap sebagai senyawa yang stabil. Senyawa ini dapat diproses secara kimiawi untuk menghasilkan senyawa-senyawa organik yang lebih berguna. Salah satu ilustrasi yang berlangsung secara alamiah adalah proses foto-sintesis yang merupakan dasar kehidupan di bumi ini. Dalam reaksi ini CO2 ditangkap oleh
tumbuh-tumbuhan hijau dan mikroorganisme kemudian dengan bantuan energi matahari diubah menjadi karbohidrat. Sampai saat ini proses foto-sintesis tersebut masih merupakan inspirasi para ahli kimia untuk menirunya dalam tabung reaksi. Walaupun masih terbatas, CO2 sudah dipakai sebagai bahan baku untuk membuat
berbagai senyawa/bahan. Pemakaian CO2 terbesar dalam industri saat ini adalah
mereaksikan CO2 dengan amonia untuk sintesa urea. Pemakaian lain di industri
adalah untuk sintesis asam salisilat, karbonat organik dan gas CO. Usaha lebih lanjut untuk mencari kemungkinan pemanfaatan CO2 secara kimiawi terus
dilakukan. Beberapa kemungkinan pemanfaatan lain sudah terlihat walaupun masih memerlukan pengembangan lebih lanjut.
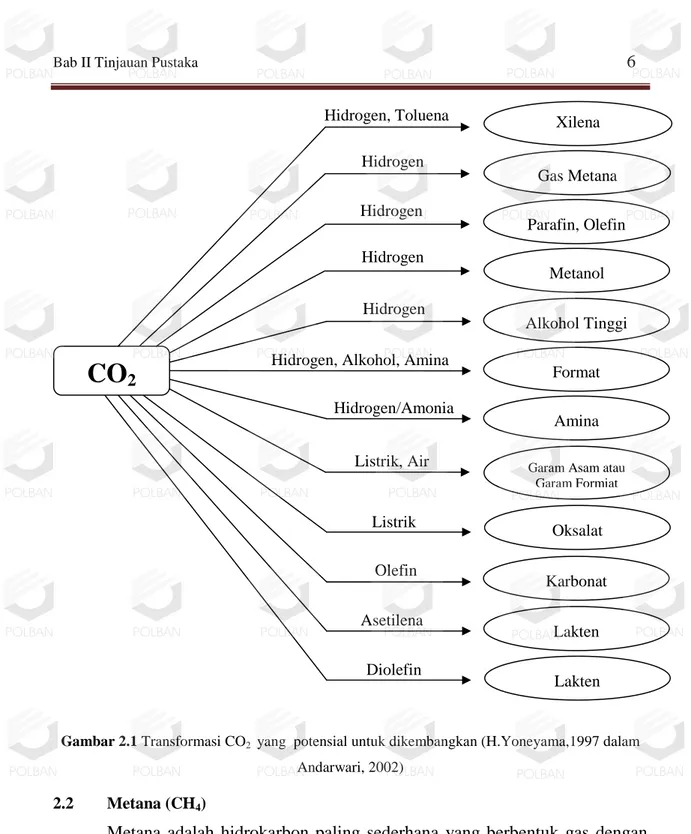
Beberapa sintesis dalam tahap laboratorium dengan memakai CO2 sudah
banyak dilaporkan seperti diilustrasikan dalam gambar 2.1. Dalam gambar skema ini terlihat bahwa pemanfaatan kembali CO2 sebagai sumber karbon memerlukan
masukan energi dalam bentuk panas, elektron, foton, hidrogen, dan lain-lain, karena CO2 secara termodinamis merupakan hasil akhir dari berbagai proses
kimia. Apabila tersedia CO2 dalam jumlah yang cukup besar, maka dapat
langsung digunakan sebagai sumber karbon (C1) untuk menghasilkan
produk-produk petrokimia yang bernilai tinggi asalkan tersedia energi yang cukup untuk mengubah CO2 tersebut.
Diolefin Listrik Olefin Asetilena Listrik, Air Hidrogen/Amonia Amina
Garam Asam atau Garam Formiat
Hidrogen, Alkohol, Amina Hidrogen Hidrogen Hidrogen Hidrogen Hidrogen, Toluena
CO
2 Xilena Gas Metana Parafin, Olefin Metanol Alkohol Tinggi Format Oksalat Karbonat Lakten LaktenGambar 2.1 Transformasi CO2 yang potensial untuk dikembangkan (H.Yoneyama,1997 dalam Andarwari, 2002)
2.2 Metana (CH4)
Metana adalah hidrokarbon paling sederhana yang berbentuk gas dengan rumus kimia CH4. Metana murni tidak berbau, tapi jika digunakan untuk
keperluan komersial, biasanya ditambahkan sedikit bau belerang untuk mendeteksi kebocoran yang mungkin terjadi.
Sebagai komponen utama gas alam, metana adalah sumber bahan bakar utama. Pembakaran satu molekul metana dengan oksigen akan melepaskan satu molekul CO2 (karbondioksida) dan dua molekul H2O (air):
Bab II Tinjauan Pustaka 7
Konversi Fotokatalitik CO2 Menjadi CH4 dengan Katalis CuO/TiO2 Menggunakan Sinar
Ultraviolet
CH4 + 2O2 → CO2 + 2H2O
Penelitian-penelitian yang dilakukan telah dapat menyimpulkan bahwa gas hidrat metana ini bisa dieksplorasi untuk diolah menjadi sumber energi baru masa depan , menggantikan sumber energi minyak (BBM).
Gas metana relatif mudah digunakan dalam industri otomotif, selain tanpa banyak modifikasi pada mesin. Dengan keunggulan yang dimiliki, gas metana, justru memberikan harapan yang lebih baik terhadap performa mesin, memperpanjang waktu penggunaan, dan kemudahan perawatan. Kecenderungan untuk beralih kepada gas-based economy juga dilakukan pemerintah Indonesia. Dengan demikian, pada saat teknologi eksploitasi gas hidrat juga telah kita kuasai, akan semakin mudah untuk melakukan proses peralihan ke penggunaan gas metana ini.
2.3 Metode Preparasi Katalis
Metode pembuatan katalis sangat penting karena katalis dengan komposisi yang sama tetapi dibuat dengan metode yang berbeda, menghasilkan sifat katalis yang berbeda pula (Amenomiya dalam Andawari,2002). Ada beberapa metode yang biasa dipakai dalam pembuatan katalis, yaitu:
a) impregnasi; b) presipitasi; dan c) pertukaran ion.
Dalam penelitian ini metode pembuatan katalis yang digunakan adalah metode impregnasi, karena metode ini mudah dilaksanakan dan paling banyak digunakan dalam industri pembuatan katalis. Kelebihan dari metode impregnasi dibandingkan dengan metode presipitasi adalah:
a) sedikit peralatan dan komponen karena tidak ada langkah pencucian, penyaringan; dan
b) sangat cocok untuk katalis dengan % berat prekursor kecil, misalnya Cu yang diinginkan terdistribusi sempurna sehingga diperoleh luas permukaan komponen aktif yang besar.
Menurut (Most,1976 dalam Andawari,2002), impregnasi dibagi menjadi dua, yaitu:
a) impregnasi basah; dan b) impregnasi kering.
Pada impregnasi basah katalis direndam atau dicelupkan dalam larutan impregnan yang berlebih. Kelemahan metode ini adalah konsentrasi logam yang terdispersi pada katalis jauh lebih kecil dari konsentrasi larutan impregnan dan terbentuknya lumpur (mude) sehingga sulit dalam pemanfaatan kembali larutan impregnan.
Sedangkan pada impregnasi kering, katalis dikontakkan dengan larutan impregnan dalam volume yang sama dengan volume pori katalis. Keuntungan dari metode ini adalah akurat dalam mengontrol komponen aktif yang akan digabungkan dalam katalis. Kelemahannya sulit melakukan pembuatan dengan persen berat prekursor yang besar.
2.4 Impregnasi
Menurut (Most,1976 dalam Andawari,2002), impregnasi adalah metode pembuatan katalis dengan cara pengisisan pori-pori, diikuti penguapan pelarut (biasanya air), dilanjutkan dengan dekomposisi atau reduksi dari garam logam. (Becker dalam Andawari,2002) menyimpulkan bahwa impregnasi adalah preparasi katalis yang diawali dengan pembasahan katalis dengan larutan impregnan yang mengandung garam logam, diikuti pengeringan.
Dalam metode impregnasi menurut (Most,1976 dalam Andawari,2002) tersebut, katalis dalam berat tertentu, dibasahi secara menyeluruh dengan larutan yang mengandung prekursor dalam jumlah yang telah disesuaikan yang akan memberikan kandungan prekursor yang diinginkan. Hal ini dengan alasan kandungan logam dari prekursor dapat diatur/direncanakan dengan pengaturan konsentrasi larutan impregnan.
Impregnasi tidak sesederhana namanya. Keseluruhan proses merupakan kombinasi dari proses adsorpsi, dalam hal ini adsorpsi dari larutan ke dalam
Bab II Tinjauan Pustaka 9
Konversi Fotokatalitik CO2 Menjadi CH4 dengan Katalis CuO/TiO2 Menggunakan Sinar
Ultraviolet
permukaan katalis, bersama-sama dengan pengendapan zat terlarut dalam pori-pori katalis pada saat pelarut diuapkan.
2.5 Perlakuan Panas
Setelah proses pengisian pori-pori katalis dengan larutan prekursor, diikuti dengan penguapan pelarut, dilanjutkan dekomposisi atau reduksi dari garam logam. Faktor pengeringan akan menentukan distribusi prekursor pada permukaan katalis.
Proses pengeringan adalah proses pengambilan pelarut. Proses ini dilakukan dengan cara penguapan larutan prekursor, bersamaan dengan dimulainya pengkristalan garam logam. Proses penguapan tidak seketika itu juga tetapi dimulai dari permukaan luar partikel katalis yang dilanjutkan pada daerah pori-pori yang lebar yang menghubungkan permukaan luar katalis dengan volume katalis. Daerah dengan diameter pori yang lebih besar lebih disukai karena pada daerah tersebut tekanan uapnya lebih besar. Cairan yang terdapat dalam pori-pori yang kecil diuapkan dengan aksi kapilaritas. Bersamaan dengan itu, terjadi proses pengkayaan zat terlarut dalam pori-pori katalis.
Perlakuan panas setelah pengeringan adalah kalsinasi. Fungsi utama kalsinasi adalah dekomposisi ke garam awal. Adapun fungsi lain dari kalsinasi adalah:
a) menghilangkan bahan tambahan yang keberadaannya tidak diinginkan; dan
b) kalau prekursor yang diiinginkan dalam bentuk oksida, kenaikan suhu pemanasan sangat diperlukan untuk membentuk komponen atau fasa kristal yang diinginkan.
Untuk menyempurnakan langkah kalsinasi, disamping pemanasan, sering dilakukan dengan alian gas H2, aliran gas H2 yang terlarut dalam N2, aliran
oksigen atau aliran udara.
2.6 Fotokatalis
Fotokatalis adalah suatu proses reaksi yang dibantu oleh adanya cahaya dan material katalis. Fotokatalisis merupakan suatu kombinasi proses antara
proses fotokimia dan katalisis. Yang dimaksud dengan fotokimia adalah suatu proses sintesis atau transformasi secara kimiawi dengan melibatkan cahaya sebagai pemicunya. Sedangkan katalis adalah substansi yang dapat mempercepat laju reaksi tanpa ikut bereaksi secara keseluruhan. Artinya, pada awal dan akhir reaksi, jumlah katalis adalah sama. Hal ini disebabkan katalis memiliki kemampuan untuk mengadakan interaksi dengan minimal satu molekul reaktan untuk menghasilkan senyawa antara yang lebih reaktif. Katalis dalam proses ini disebut sebagai fotokatalis karena memiliki kemampuan dalam menyerap energi foton.
Suatu bahan dapat dijadikan fotokatalis jika memiliki daerah energi kosong yang disebut celah pita energi (energy band gap). Dari pengertian tersebut dapat disimpulkan bahwa fotokatalitik adalah suatu proses transformasi kimia yang melibatkan unsur cahaya dan katalis sekaligus dalam melangsungkan dan mempercepat proses transformasi yang terjadi. Reaksi fotokatalitik dalam tahapan mekanismenya sama dengan reaksi katalitik konvensional. Hanya saja dalam reaksi fotokatalitik, aktivasi katalis berupa aktivasi oleh foton, berbeda dengan reaksi katalitik jenis konvensional dengan aktivasi katalis dilakukan secara termal. Proses fotokatalitik heterogen pada bahan semikonduktor diawali dengan fotoeksitasi sebagai akibat cahaya yang mengenai bahan semikonduktor. Cahaya yang mengenai bahan semikonduktor ini memiliki energi yang lebih besar daripada energi celah pita semikonduktor, sehingga akan mentransfer elektron dari pita valensi ke pita konduksi dan menghasilkan hole (h+) pada pita valensi. Jadi pada proses fotoeksitasi dihasilkan elektron pada pita konduksi dan hole pada pita valensi.
Berdasarkan jenis katalis yang digunakan, proses fotokatalitik terdiri dari fotokatalitik homogen dan fotokatalitik heterogen. Fotokatalitik homogen adalah proses fotokatalitik yang berlangsung pada suatu sistem dalam satu fasa, dan biasanya dengan bantuan zat pengoksidasi seperti ozon dan hidrogen peroksida, sedangkan fotokatalitik heterogen adalah proses fotokatalitik yang memanfaatkan bahan semikonduktor dalam bentuk serbuk/partikel dan penggunaannya sebagai
Bab II Tinjauan Pustaka
Konversi Fotokatalitik CO Ultraviolet
fotokatalis yang dilakukan dalam suspensi. Proses fotokatalitik yang kita gunakan dan akan lebih lanjut dibahas ialah proses fotokatalitik heterogen.
Pada proses fotokatalitik heterog
adalah bahan semikonduktor tipe
sulfida: ZnS, CdS). Semikonduktor dapat dimanfaatkan sebagai fotokatalis karena memiliki daerah energi yang kosong (
energi (energy band gap
valensi yang tidak menyediakan tingkat rekombinasi elektron dan
semikonduktor tersebut. Hal ini dapat dilihat pada Gambar 2.2.
Gambar 2.2 Daerah energi pada semikonduktor
Katalis semikonduktor ini akan berfungsi
dengan foton yang memiliki energi yang setara atau lebih dari
EG, (hv≥EG) semikonduktor yang bersangkutan. Induksi oleh sinar tersebut akan menyebabkan terjadinya eksitasi elektron (dari pita valensi ke pi
dalam bahan semikonduktor (Richardson, 1989). Hal ini dikarenakan, iluminasi foton akan mengakibatkan terbentuknya pasangan elektron (e
dipisahkan menjadi fotoelektron bebas pada pita konduksi dan
valensi.
Energi pita valensi dan pita konduksi semikonduktor akan mengontrol
kemampuan transfer
permukaan semikonduktor. Molekul penerima muatan (akseptor) harus memiliki
Konversi Fotokatalitik CO2 Menjadi CH4 dengan Katalis CuO/TiO2 Menggunakan
fotokatalis yang dilakukan dalam suspensi. Proses fotokatalitik yang kita gunakan dan akan lebih lanjut dibahas ialah proses fotokatalitik heterogen.
Pada proses fotokatalitik heterogen ini, semikonduktor yang digunakan bahan semikonduktor tipe chalgonide (oksida : TiO2, ZnO, ZrO, CeO
sulfida: ZnS, CdS). Semikonduktor dapat dimanfaatkan sebagai fotokatalis karena memiliki daerah energi yang kosong (void energi region) yang disebut celah pita
band gap), yang terletak diantara batas pita konduksi dan pita
valensi yang tidak menyediakan tingkat-tingkat energi untuk mempromosikan rekombinasi elektron dan hole yang diproduksi oleh suatu fotoaktivasi dalam
uktor tersebut. Hal ini dapat dilihat pada Gambar 2.2.
Daerah energi pada semikonduktor ( http://www.chem-is
Katalis semikonduktor ini akan berfungsi sebagai katalis jika diiluminasi dengan foton yang memiliki energi yang setara atau lebih dari energi band gap, EG) semikonduktor yang bersangkutan. Induksi oleh sinar tersebut akan menyebabkan terjadinya eksitasi elektron (dari pita valensi ke pi
dalam bahan semikonduktor (Richardson, 1989). Hal ini dikarenakan, iluminasi foton akan mengakibatkan terbentuknya pasangan elektron (e-) dan
dipisahkan menjadi fotoelektron bebas pada pita konduksi dan fotohole
Energi pita valensi dan pita konduksi semikonduktor akan mengontrol muatan yang diinduksi radiasi pada molekul teradsorbsi pada permukaan semikonduktor. Molekul penerima muatan (akseptor) harus memiliki
11
enggunakan Sinar
fotokatalis yang dilakukan dalam suspensi. Proses fotokatalitik yang kita gunakan
en ini, semikonduktor yang digunakan , ZnO, ZrO, CeO2 atau
sulfida: ZnS, CdS). Semikonduktor dapat dimanfaatkan sebagai fotokatalis karena disebut celah pita ), yang terletak diantara batas pita konduksi dan pita tingkat energi untuk mempromosikan yang diproduksi oleh suatu fotoaktivasi dalam
is-try.org )
sebagai katalis jika diiluminasi
energi band gap,
EG) semikonduktor yang bersangkutan. Induksi oleh sinar tersebut akan menyebabkan terjadinya eksitasi elektron (dari pita valensi ke pita konduksi)
dalam bahan semikonduktor (Richardson, 1989). Hal ini dikarenakan, iluminasi ) dan hole (h+) yang fotohole pada pita
Energi pita valensi dan pita konduksi semikonduktor akan mengontrol muatan yang diinduksi radiasi pada molekul teradsorbsi pada permukaan semikonduktor. Molekul penerima muatan (akseptor) harus memiliki
tingkat potensial yang lebih positif (terletak lebih di bawah pada kurva energi potensial) daripada tingkat energi potensial pita konduksi semikonduktor. Sedangkan untuk molekul donor muatan harus memiliki tingkat potensial yang lebih negatif (lebih atas pada kurva energi potensial) daripada tingkat potensial pita valensi semikonduktor tersebut.
2.6.1 Fotokatalis TiO2
Fotokatalis TiO2 merupakan semikonduktor yang memiliki berbagai
keunggulan, terutama untuk aplikasi produksi hidrogen. Keunggulan TiO2 antara
lain, memiliki kestabilan yang tinggi, ketahanan terhadap korosi, ketersediaan yang melimpah di alam, dan harga yang relatif murah. Disamping itu, TiO2 juga
memenuhi persyaratan khusus untuk water-splitting, yaitu posisi pita konduksi dan pita valensi tertentu agar dapat terjadi pembentukan hidrogen dan oksigen dari air (Radecka M, 2008 dalam Afrozi.A, 2010).
Salah satu faktor yang mempengaruhi aktivitas TiO2 sebagai fotokatalis
adalah bentuk kristalnya (Tjahjanto, 2001 dalam Afrozi.A, 2010). Katalis TiO2
memiliki 3 jenis struktur kristal yaitu anatase, rutile dan brookite. Struktur kristal brookite sulit untuk dipreparasi sehingga biasanya hanya struktur kristal rutile dan anatase yang umum digunakan pada reaksi fotokatalitik. Secara fotokatalitik, struktur anatase menunjukkan aktivitas yang lebih baik dari segi kereaktifan dibandingkan dengan struktur rutile (Su, 2004 dalam Afrozi.A, 2010). Struktur anatase merupakan bentuk yang paling sering digunakan karena memiliki luas permukaan serbuk yang lebih besar serta ukuran partikel yang lebih kecil dibandingkan dengan struktur rutile dan struktur ini muncul pada rentang suhu pemanasan dekomposisi senyawa titanium (400-650oC). Selain itu energy
bandgap anatase lebih besar daripada rutile sehingga memiliki aktivitas
fotokatalitik yang tinggi (Licciuli L, 2002 dalam Afrozi.A, 2010). Gambaran struktur anatase dan rutile dapat dilihat pada Gambar 2.3 dan 2.4.
Bab II Tinjauan Pustaka
Konversi Fotokatalitik CO Ultraviolet
Gambar 2.3 Struktur Kristal Anatase TiO
Gambar 2.4
Anatase merupakan tipe yang paling aktif karena memiliki
gap (celah pita energi yang menggambarkan energi cahaya minimum yang dibutuhkan untuk mengeksitasi elektron) sebesar 3,2 eV (lebih dekat ke sinar UV, panjang gelombang maksimum 388 nm), sedangkan rutile 3,0 eV (lebih dekat ke sinar tampak, panjang gelombang ma
semakin mudah pula fotokatalis menyerap foton dengan tingkat energi lebih kecil namun kemungkinan
Oleh karenanya, kedua aspek ini perlu dipertimbangkan dalam
semikonduktor TiO2.
TiO2 mempunyai energi celah sebesar 3,2 eV, hal ini mengindikasikan
bahwa h+pada permukaan TiO
mengoksidasi spesi kimia lainnya yang mempunyai potensial redoks lebih kecil, termasuk dalam hal ini molekul air dan/atau gugus hidroksil yang akan menghasilkan radikal hidroksil
potensial sebesar 2,8 V, dan kebanyakan zat organik mempunyai potensial redoks yang lebih kecil dari potensial
Konversi Fotokatalitik CO2 Menjadi CH4 dengan Katalis CuO/TiO2 Menggunakan
Struktur Kristal Anatase TiO2 (Licciulli L, 2002dalam Afrozi.A, 2010
2.4 Struktur Kristal Rutile TiO2 (Licciulli L, 2002dalam Afrozi.A, 2010
Anatase merupakan tipe yang paling aktif karena memiliki
(celah pita energi yang menggambarkan energi cahaya minimum yang dibutuhkan untuk mengeksitasi elektron) sebesar 3,2 eV (lebih dekat ke sinar UV, panjang gelombang maksimum 388 nm), sedangkan rutile 3,0 eV (lebih dekat ke sinar tampak, panjang gelombang maksimum 413 nm). Semakin kecil
semakin mudah pula fotokatalis menyerap foton dengan tingkat energi lebih kecil namun kemungkinan hole dan elektron untuk berekombinasi juga semakin besar. Oleh karenanya, kedua aspek ini perlu dipertimbangkan dalam
mempunyai energi celah sebesar 3,2 eV, hal ini mengindikasikan
pada permukaan TiO2 merupakan spesi oksidator kuat, karenanya akan
mengoksidasi spesi kimia lainnya yang mempunyai potensial redoks lebih kecil, termasuk dalam hal ini molekul air dan/atau gugus hidroksil yang akan menghasilkan radikal hidroksil. Radikal hidroksil ini pada pH
potensial sebesar 2,8 V, dan kebanyakan zat organik mempunyai potensial redoks yang lebih kecil dari potensial tersebut (Gunlazuardi, 2003).
13
enggunakan Sinar dalam Afrozi.A, 2010)
dalam Afrozi.A, 2010)
Anatase merupakan tipe yang paling aktif karena memiliki energy band
(celah pita energi yang menggambarkan energi cahaya minimum yang dibutuhkan untuk mengeksitasi elektron) sebesar 3,2 eV (lebih dekat ke sinar UV, panjang gelombang maksimum 388 nm), sedangkan rutile 3,0 eV (lebih dekat ke
ksimum 413 nm). Semakin kecil band gap,
semakin mudah pula fotokatalis menyerap foton dengan tingkat energi lebih kecil dan elektron untuk berekombinasi juga semakin besar. Oleh karenanya, kedua aspek ini perlu dipertimbangkan dalam pemilihan fasa
mempunyai energi celah sebesar 3,2 eV, hal ini mengindikasikan merupakan spesi oksidator kuat, karenanya akan mengoksidasi spesi kimia lainnya yang mempunyai potensial redoks lebih kecil, termasuk dalam hal ini molekul air dan/atau gugus hidroksil yang akan
. Radikal hidroksil ini pada pH=1 mempunyai
potensial sebesar 2,8 V, dan kebanyakan zat organik mempunyai potensial redoks
2.6.2 Mekanisme Fotokatalis TiO2
TiO2 mengabsorbs sinar UV dari cahaya matahari atau misalnya sumber
cahaya buatan (lampu ultraviolet), pada proses ini akan dihasilkan sepasang elektron dan hole. Elektron dari pita valensi titanium dioksida tereksitasi ketika disinari oleh cahaya. Energi yang dihasilkan dari elektron yang tereksitasi ini menyebabkan elektron berada pada pita konduksi TiO2 dan menghasilkan
pasangan elektron bermuatan negatif (e-) dan hole positif (h+) dan disebut sebagai
semiconductor photo-excitation state. Perbedaan energi antara pita valensi dan
pita konduksi inilah dikenal sebagai band-gap. Panjang gelombang cahaya yang dibutuhkan untuk photo-excitation adalah : 1240 (Planck's constant, h) / 3.2 ev (band gap energy) = 388 nm. Jika fotokatalis TiO2 teraktivasi oleh cahaya (energi
foton) yang besarnya setara dengan energy band gap, maka akan memiliki kemampuan untuk membentuk radikal hidroksil yang dapat mengoksidasi polutan organik.
Gambar 2.5 Mekanisme Fotokatalitik Semikonduktor TiO2 ( Power point oleh Amin Faturrakhman, dkk)
2.7 Penggunaan Dopan Untuk Meningkatkan Aktivitas Fotokatalis
Untuk meningkatkan aktivitas fotokatalis TiO2 dalam mendegradasi CO2,
perlu ditambahkan dopan dalam rangka untuk mendapatkan kinerjanya yang optimal. Dopan yang ditambahkan ke dalam sistem katalis, yaitu jenis dopan logam.
Penggunaan logam sebagai dopan fotokatalis untuk degradasi CO2 telah
banyak dilakukan, baik dopan logam mulia maupun ion logam. Logam mulia
Bab II Tinjauan Pustaka 15
Konversi Fotokatalitik CO2 Menjadi CH4 dengan Katalis CuO/TiO2 Menggunakan Sinar
Ultraviolet
yang banyak digunakan sebagai dopan fotokatalis diantaranya adalah Pt, Au, Pd, dan Rh. Logam mulia banyak digunakan karena memiliki level energi Fermi yang lebih rendah dibandingkan dengan TiO2 sehingga elektron tereksitasi dapat
ditransfer dari pita konduksi ke partikel logam yang terdeposit pada permukaan TiO2, sementara hole di pita valensi tetap bertahan di TiO2.
Logam lainnya yang dapat ditambahkan sebagai dopan adalah logam Cu. Logam Cu ditambahkan sebagai dopan karena lebih murah dan telah terbukti lebih aktif dari titania untuk mereduksi CO2 menjadi metana (Slamet dkk, 2005).
Aplikasi Cu, baik dalam bentuk logam maupun oksida logam CuOx, telah banyak digunakan sebagai electron-trapper untuk menghambat rekombinasi elektron-hole dalam berbagai aplikasi. Perannya sebagai electron-trapper ini disebabkan oleh tinggi dan positifnya potensial reduksi dari Cu (0.34 V). Selain sebagai
electron-trapper, penambahan dopan CuOx juga dapat meningkatkan absorbansi bagi
fotokatalis melalui mekanisme penyempitan band-gap (Slamet, 2005).
(Bokhimi,1999 dalam Slamet,2005) mengatakan bahwa penggunaan prekursor CuO yang berbeda memiliki pengaruh signifikan terhadap karakteristik dan aktivitas dari katalis semikonduktor TiO2. Selain penggunaan prekursor,
komposisi dari Cu berpengaruh pula terhadap karakteristik dan aktivitas dari katalis semikonduktor TiO2. Hal tersebut telah dibuktikan dalam penelitian yang
dilakukan oleh Slamet,dkk (2005).
2.7.1 Pengaruh Prekursor Terhadap Karakteristik dan Aktivitas Katalis Semikonduktor TiO2
Berdasarkan penelitian yang dilakukan oleh Slamet, dkk (2005) prekursor sebagai bahan awal pembuat dopan ternyata juga memiliki pengaruh terhadap aktivitas katalis CuO/TiO2. Berdasarkan pernyataan tersebut, dalam penelitian
Slamet, dkk dilakukan uji aktivitas terhadap katalis CuO/TiO2 untuk jenis
prekursor Cu-Nitrat, Cu-Asetat, Cu-Klorida dan Cu-Sulfat. Dari hasil penelitian oleh Slamet, dkk diketahui bahwa katalis CuO/TiO2 yang dipreparasi dari
prekursor Cu-Asetat dan Cu-Nitrat memiliki aktivitas lebih tinggi dibandingkan katalis CuO/TiO2 yang dipreparasi dari prekursor Cu-Klorida dan Cu-Sulfat. Hal
ini sesuai dengan data karakterisasi XRD yang menyatakan bahwa pada katalis yang berasal dari prekursor Cu-Asetat dan Cu-Nitrat telah terbentuk kristal CuO, sementara untuk Cu-Klorida dan Cu-Sulfat tidak.
Apabila dibandingkan antara Cu-Asetat dengan Cu-Nitrat, katalis yang dipreparasi dari prekursor Cu-Asetat memiliki aktivitas lebih tinggi dibandingkan dengan Cu-Nitrat. Hal ini disebabkan karena pada katalis yang dipreparasi dengan prekursor Cu-Asetat memiliki ukuran kristal CuO lebih kecil dibandingkan ukuran kristal CuO yang dipreparasi dengan prekursor Cu-Nitrat, sehingga luas permukaannya lebih besar dan permukaan TiO2 yang tertutupi tidak banyak. Hal
tersebut dapat dilihat pada tabel 2.1
Tabel 2.1 Data Karakterisai XRD Pada Katalis CuO/TiO2 (Slamet, dkk, 2005) Sampel Ukuran Kristal CuO (nm) 5% CuO/TiO 2 (Cu-Nitrat) 18 5% CuO/TiO 2 (Cu-Asetat) 10 5% CuO/TiO 2 (Cu-Klorida) 0 5% CuO/TiO 2 (Cu-Sulfat) 0 2.7.2 Pengaruh Komposisi Cu
Selain jenis prekursor, yang berpengaruh terhadap aktivitas katalis CuO/TiO2 adalah komposisi Cu yang ditambahkan pada katalis tersebut.
Cu-Asetat sebagai prekursor yang optimal selanjutnya diuji dengan variasi komposisi Cu. Dari hasil penelitian diperoleh bahwa katalis CuO/TiO2 dengan komposisi Cu 0,2% memiliki aktivitas optimal dibandingkan katalis lainnya. Semakin meningkat komposisi Cu pada katalis CuO/TiO2 menyebabkan aktivitasnya semakin menurun. Hal ini disebabkan karena pada katalis CuO/TiO2 dengan Cu di atas 0,2%, permukaan aktif dari TiO2 tertutupi oleh kristal CuO sehingga menurunkan aktivitas katalis. Dengan demikian, penambahan dopan CuO yang semula dapat mencegah terjadinya rekombinasi elektron-hole tidak berperan secara optimal (Slamet, dkk, 2005).
Bab II Tinjauan Pustaka 17
Konversi Fotokatalitik CO2 Menjadi CH4 dengan Katalis CuO/TiO2 Menggunakan Sinar
Ultraviolet
2.8 Reaksi Reduksi CO2
Reduksi adalah suatu reaksi yang menyebabkan bilangan oksida dari suatu senyawa berkurang karena proses perpindahan elektron. Pada reaksi reduksi ini terjadi proses penangkapan elektron, yaitu menerima elektron atom lain. Karena adanya usaha penangkapan elektron di satu sisi, maka ada usaha pelepasan elektron di sisi lain. Oleh karena itu, pada proses reduksi ini selalu dibarengi dengan proses oksidasi. CO2 adalah suatu gas dengan C dalam keadaan
teroksidasi sempurna, sehingga diperlukan energi luar untuk mereduksinya. Salah satu aplikasi pemanfaatan fotokatalitik TiO2 adalah mereduksi CO2 tersebut.
Reaksi reduksi dapat berlangsung dengan adanya elektron yang dihasilkan dari iluminasi terhadap fotokatalis TiO2.
Produk yang dihasilkan dari reaksi CO2 cukup beragam, mulai dari
senyawa turunan alkohol, aldehid, karboksilat, keton, sampai hidrokarbon yang berupa gas metana atau etana. Tahapan reaksi pembentukan produk tersebut sebagai berikut:
Elektron yang dihasilkan fotokatalis TiO2 bereaksi dengan ion H+ dari air hingga
menghasilkan radikal hidrogen.
H+ + e- H
Selanjutnya radikal hidrogen tersebut akan bereaksi dengan CO2 sehingga
menghasilkan berbagai macam produk.
CO2 + 2 H HCOOH HCOOH + 2 H H-CO-H + H2O H-CO-H + H H-C(OH)-H H- C(OH)-H + H CH3OH CH3OH + H CH3 + H2O CH3 + H CH4 CH3 + CH3 C2H6 OH + OH H2O + ½ O2 (Andawari,2001)
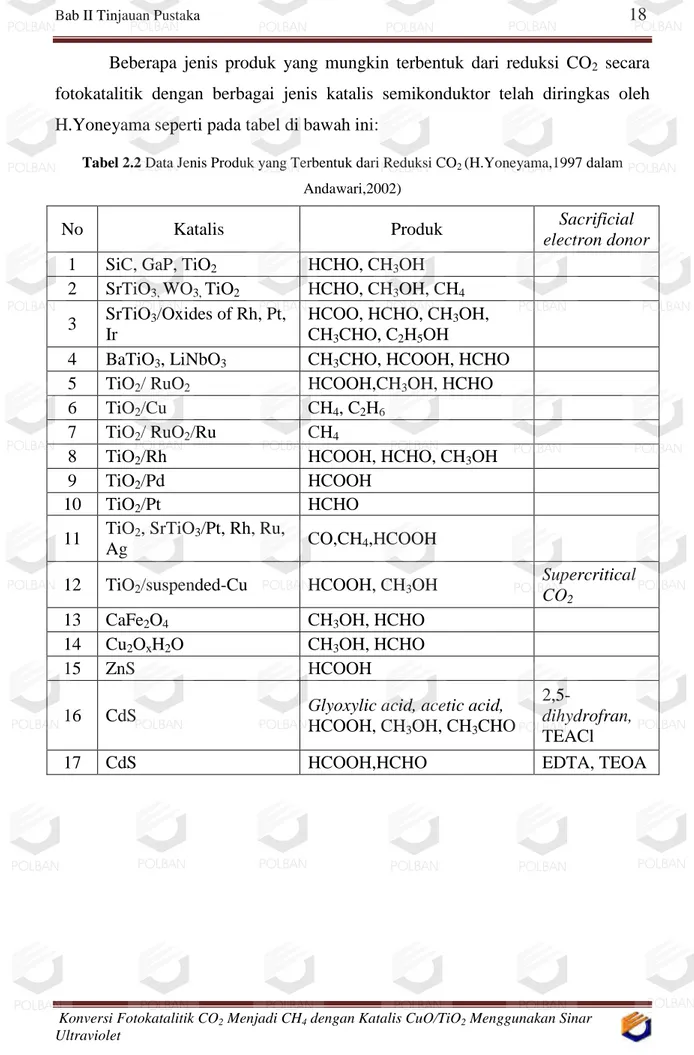
Beberapa jenis produk yang mungkin terbentuk dari reduksi CO2 secara
fotokatalitik dengan berbagai jenis katalis semikonduktor telah diringkas oleh H.Yoneyama seperti pada tabel di bawah ini:
Tabel 2.2 Data Jenis Produk yang Terbentuk dari Reduksi CO2 (H.Yoneyama,1997 dalam Andawari,2002)
No Katalis Produk Sacrificial
electron donor
1 SiC, GaP, TiO2 HCHO, CH3OH
2 SrTiO3, WO3, TiO2 HCHO, CH3OH, CH4
3 SrTiO3/Oxides of Rh, Pt, Ir
HCOO, HCHO, CH3OH,
CH3CHO, C2H5OH
4 BaTiO3, LiNbO3 CH3CHO, HCOOH, HCHO
5 TiO2/ RuO2 HCOOH,CH3OH, HCHO
6 TiO2/Cu CH4, C2H6
7 TiO2/ RuO2/Ru CH4
8 TiO2/Rh HCOOH, HCHO, CH3OH
9 TiO2/Pd HCOOH
10 TiO2/Pt HCHO
11 TiO2, SrTiO3/Pt, Rh, Ru,
Ag CO,CH4,HCOOH
12 TiO2/suspended-Cu HCOOH, CH3OH
Supercritical CO2
13 CaFe2O4 CH3OH, HCHO
14 Cu2OxH2O CH3OH, HCHO
15 ZnS HCOOH
16 CdS Glyoxylic acid, acetic acid, HCOOH, CH3OH, CH3CHO
2,5-dihydrofran,
TEACl
17 CdS HCOOH,HCHO EDTA, TEOA