1
BAB 1 PENDAHULUAN
A. Latar Belakang Masalah
Perkembangan zaman membuktikan pemanfaatan obat tradisional dalam populasi global dunia terus mengalami peningkatan. Badan Kesehatan Dunia (WHO) menyebutkan bahwa hingga 65% penduduk negara maju menggunakan obat tradisional sebagai pengobatan. Beberapa negara di Asia dan Afrika menyebutkan ada 80% dari penduduknya yang bergantung pada obat tradisional sebagai pengobatan primer (Anonim, 2005). Indonesia, melalui hasil riset kesehatan dasar (riskesdas) tahun 2010 menyatakan bahwa 55,3% penduduknya menggunakan ramuan obat tradisional (Jamu) untuk memelihara kesehatannya. Sebanyak 95,6% mengakui ramuan obat tradisional yang digunakan sangat bermanfaat bagi kesehatan.
Indonesia sebagai megacenter keragaman hayati dunia menduduki urutan terkaya kedua dunia setelah Brasil. Jika biota laut ikut diperhitungkan akan menjadi terkaya pertama di dunia. The Indonesian Country Study of Biodiversity memaparkan sejumlah 25.000 sampai 30.000 spesies tumbuhan yang sudah teridentifikasi di Indonesia. Zuhud dkk., (2003) mengidentifikasi ada 1845 spesies tumbuhan yang potensial berkhasiat obat. Sementara BPOM telah mencatat 283 tumbuhan yang secara resmi diregistrasi sebagai obat herbal untuk penggunaan medis.
Bungur atau Lagerstroemia speciosa Pers. merupakan salah satu tumbuhan yang hidup di Indonesia. Bungur termasuk dalam suku Lythraceae yang memiliki
nama umum queen of flower. Secara empiris bungur banyak dimanfaatkan dalam pengobatan berbagai penyakit (Ragasa dkk., 2005). Dekokta daun bungur digunakan sebagai pengobatan diabetes melitus, diuretik, demam, dan purgatif serta disfungsi saluran kencing. Bagian lain yang digunakan yaitu akar untuk mengobati ulser pada mulut. Sementara kulit batang bungur digunakan sebagai stimulan, penurun panas, dan untuk sakit perut (Chan dkk., 2014).
Penggunaan tumbuhan untuk pengobatan tidak bisa terlepas dari penelitian terhadap kandungan senyawanya. Tumbuhan memiliki kandungan senyawa berupa metabolit primer dan sekunder. Sebagian besar senyawa yang mempunyai efek terapi merupakan metabolit sekunder dalam tumbuhan, seperti alkaloid, flavonoid, tanin, terpenoid, dan saponin. Hasil penelitian tumbuhan bungur menyebutkan bahwa kandungan senyawa seperti tanin dan terpenoid bertanggung jawab dalam memberikan efek terapi. Kandungan lain dari bungur yaitu flavonoid belum banyak dilakukan penelitian. Flavonoid merupakan golongan besar dari suatu senyawa yang memiliki berbagai macam efek terapi. Beberapa diantaranya yaitu antibakteri (Ambujakshi dkk., 2009), hipoglikemik (Hernawan dkk., 2004), antioksidan, dan nefroprotektor (Priya dkk., 2007). Penelitian terhadap flavonoid yang sudah ada yaitu melakukan identifikasi golongan flavonoid pada kulit batangnya.
Berdasarkan uraian di atas, penelitian terkait flavonoid dalam tumbuhan bungur perlu diperdalam mengingat potensi aktivitasnya cukup beragam. Penelitian yang bisa dikembangkan yaitu melakukan eksplorasi flavonoid dalam daun bungur. Daun merupakan bagian tumbuhan yang mudah diperoleh dan tersedia dalam jumlah relatif banyak. Penyarian senyawa flavonoid yang optimal akan
memberikan pengaruh terhadap efek terapinya. Pemilihan metode penyarian yang tepat akan memberikan kadar flavonoid yang tinggi. Pengetahuan terkait golongan flavonoid memberikan andil besar dalam melakukan penyarian.
Oleh karena itu, fokus dalam penelitian ini ditujukan untuk menetapkan dan membandingkan kadar flavonoid total dari dua metode ekstrasi, yaitu maserasi dan infundasi. Selain itu juga melakukan identifikasi terhadap golongan senyawa flavonoid yang terkandung dalam daun bungur. Keduanya menggunakan metode spektrofotometri UV-Visibel.
B. Rumusan Masalah
Berdasarkan uraian di atas maka dapat dirumuskan 2 masalah, yaitu:
1. Apakah ekstrak kental daun bungur hasil maserasi memberikan kadar flavonoid total lebih tinggi dibandingkan ekstrak kental hasil infundasi?
2. Apa jenis golongan senyawa flavonoid yang terkandung dalam fraksi etil asetat daun bungur?
C. Tujuan Penelitian 1. Tujuan Umum
Mendapatkan data ilmiah daun bungur untuk keperluan penelitian lanjutan dalam pengembangan obat herbal.
2. Tujuan Khusus
a. Mengetahui metode ekstraksi yang efektif dalam mendapatkan kadar flavonoid total.
b. Mengetahui golongan flavonoid yang terkandung dalam fraksi etil asetat daun bungur.
D. Manfaat Penelitian
Penelitian ini akan memberikan inspirasi dan motivasi kepada mahasiswa dalam mencari dan mengeksplorasi penelitian tentang bahan alam. Bagi peneliti dan akademisi akan memberikan data ilmiah daun bungur untuk dijadikan referensi dalam melakukan penelitian lebih lanjut seperti melakukan isolasi dan elusidasi struktur. Bagi industri bisa menjadi referensi dalam pengembangan formulasi berbahan baku daun bungur supaya lebih efektif dan efisien.
E. Tinjauan Pustaka 1. Bungur
Bungur atau Lagerstroemia speciosa Pers. (sinonim dengan L. reginae, L. flos-reginae, dan L. loudoni ) adalah tumbuhan anggota suku Lythraceae. Di Indonesia jenis tumbuhan tersebut dikenal dengan nama bungur. Bungur mempunyai beberapa nama lokal, antara lain di Sumatera : bungur tekuyung (Palembang), bungur bener, bungur kuwal (Lampung); Jawa : bungur (Sunda), ketangi, laban, wungu (Jawa), dan bhungor (Madura) (Heyne, 1987). Nama umum di dunia internasional bagi bungur adalah queen of flowers (Orwa dkk., 2009), untuk menggambarkan menarik dan berwarnanya bunga yang dimiliki. Di India bungur dikenal dengan nama arjuna, bungur juga digunakan untuk menyebut nama L. speciosa di Malaysia, ta-bak di Thailand, dan banaba di Filipina.
a. Deskripsi
Tumbuhan ini banyak dijumpai sebagai peneduh jalan. Pohonnya setinggi 10-30 m. Di Jawa, bungur dapat tumbuh sampai ketinggian ±800 m di atas permukaan laut. Selain itu, bungur banyak ditemukan pada ketinggian di bawah 300 meter. Batang bulat dengan diameter kisaran 60 sampai 80 cm, percabangan mulai dari bagian pangkalnya, berwarna cokelat muda. Kayunya agak ringan hingga cukup berat dan berstruktur agak padat, berurat lurus, dan berwarna cokelat pudr hingga cokelat kemerah-merahan. Kayu ini tahan terhadap serangga dan pengaruh cuaca (Heyne, 1987).
Daun tunggal, bertangkai pendek. Helaian daun berbentuk oval, elips atau memanjang, tebal seperti kulit, panjang 9-28 cm, lebar 4-12 cm, berwarna hijau tua. Bunga majemuk berwarna ungu, tersusun dalam mulai yang panjangnya 10-50 cm, keluar dari ketiak daun atau ujung ranting. Buahnya berbentuk bola sampai bulat memanjang, panjang 2-3,5 cm dan beruang 3-7, buah yang masih muda berwarna hijau, setelah masak menjadi cokelat. Ukuran biji cukup besar, pipih, ujung bersayap berbentuk pisau, berwarna cokelat kehitaman (Dalimartha, 2003).
b. Taksonomi Bungur
Bungur dalam sistematika tumbuhan diklasifikasikan sebagai berikut:
Divisi : Spermatophyta Sub Divisi : Angiospermae Kelas : Dicotyledonae
Sub Kelas : Dialypetalae Bangsa : Myrtales Suku : Lythraceae Marga : Lagerstroemia
Jenis : Lagerstroemia speciosa Pers. (Heyne, 1987) c. Penggunaan Empiris
Secara tradisional, daun, akar, korteks batang bungur telah digunakan oleh nenek moyang kita sebagai obat untuk berbagai penyakit (Ragasa dkk., 2005). Dekokta daun bungur digunakan sebagai pengobatan diabetes melitus, diuresis, demam, dan purgatif serta disfungsi saluran kencing. Daun bungur digunakan untuk pengobatan tradisional dalam penyakit diabetes, poliurea, dan polidipsia (Garcia, 1940). Di Filipina, daun dikonsumsi sebagai teh herbal untuk menurunkan level gula darah dan penurun berat badan, sementara di India digunakan sebagai obat diabetes (Park, 2011). Biji tumbuhan digunakan untuk pengobatan tekanan darah tinggi, sedangkan kulit kayu bungur digunakan untuk pengobatan diare, disentri, dan kencing darah. Tumbuhan ini umumnya digunakan sebagai obat dalam bentuk rebusan atau infus (Dalimarta, 2000).
d. Kandungan Kimia
Berdasarkan hasil screening fitokimia kandungan dalam daun bungur meliputi alkaloid, tanin, flavonoid, triterpenoid, sterol, dan saponin (Trease dan Evans, 1989). Beberapa kandungan kimia dari daun bungur telah berhasil diidentifikasi dan diisolasi, diantaranya yaitu dari ekstrak
aseton ditemukan 6 monomerik dan dimerik elagitanin (Flosin A dan B, dan Reginin A, B, C, dan D), dan 3 elagitanin baru (lagerstanin A, B, dan C) (Xu dkk., 1991). Selain itu, dari daun L. speciosa berhasil diisolasi triterpenoid baru yaitu asam virgatat, asam korosolat, asam ursolat, dan β-sitosterol glukosida (Okada dkk., 2003). Sejauh ini, lebih dari 40 senyawa termasuk triterpen, tanin, asam elagat, glikosida, dan flavonoid telah diidentifkasi dari daun L. speciosa. Asih dan Setiawan (2008), berhasil mengisolasi dan mengidentifikasi senyawa flavonoid golongan flavanon pada ekstrak n-butanol kulit batang bungur. Struktur beberapa senyawa kandungan bungur bisa dilihat pada gambar 1 dan gambar 2.
e. Aktivitas Biologik
Ekstrak air panas daun bungur mempunyai kemampuan menangkal radikal bebas dan menghambat peroksidasi lemak dengan adanya kandungan tanin sebesar 37% (Unno dkk., 2004). Aktivitas antibakteri dari daun bungur telah dilaporkan mampu melawan S. aureus, B. subtilis, P. aeruginosa, dan E. coli (Ambujakshi dkk., 2009). Berdasarkan penelitian Hernawan dkk (2004), ekstrak air daun bungur menunjukkan aktivitas hipoglikemik pada dosis 0,2 g/200 g BB dan 0,5 g/200 g BB. Selain itu ekstrak air daun bungur juga menunjukkan aktivitas hipolipidemik pada semua dosis perlakuan yaitu 0,1 g/200 g BB; 0,2 g/200 g BB, dan 0,5 g/200 g BB. Priya dkk. (2007, 2009) melakukan penelitian bahwa ekstrak daun bungur dilaporkan memiliki aktivitas sebagai antioksidan, nefroprotektor, hepatoprotektor, dan memilik aktivitas penangkap radikal bebas.
(a) (b)
(c) (d)
Gambar 1. Kandungan kimia daun bungur golongan elagitanin.
(a) flosin A; (b) lagerstanin A; (c) lagerstanin B; (d) lagerstanin C
(c)
Gambar 2. Kandungan kimia daun bungur golongan triterpenoid.
(a) asam ursolat; (b) beta sitosterol; (c) asam korosolat 2. Flavonoid
Flavonoid merupakan salah satu komponen senyawa yang terkandung dalam tumbuhan dan dapat ditemukan pada semua tumbuhan vaskuler. Istilah flavonoid diberikan pada suatu golongan besar senyawa yang berasal dari kelompok senyawa yang paling umum ditemukan, yaitu senyawa flavon. Senyawa heterosiklik ini pada tingkat oksidasi yang berbeda terdapat dalam kebanyakan tumbuhan. Flavon adalah bentuk yang mempunyai cincin C dengan tingkat oksidasi paling rendah dan dianggap sebagai struktur induk dalam nomenklatur kelompok senyawa-senyawa ini (Manitto, 1981). Flavonol dan flavon merupakan senyawa yang tersebar luas dari semua pigmen tumbuhan kuning (Robinson, 1995). Flavonol dan flavon yang terdapat dalam tumbuhan, biasanya dalam bentuk O-glikosida. Kedua senyawa ini banyak terdapat pada bagian daun dan bagian luar tumbuhan, dan hanya sedikit yang ditemukan pada bagian tumbuhan yang ada di permukaan tanah (Hertog dkk., 1992).
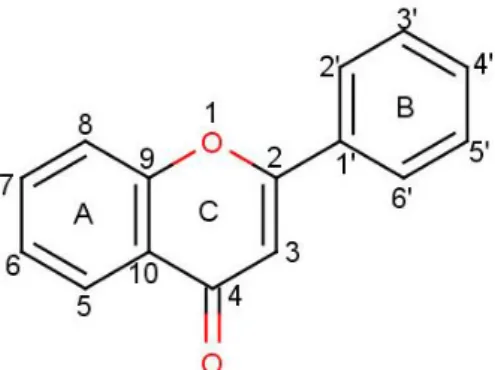
Flavonoid adalah komponen yang memiliki berat molekul rendah, dan pada dasarnya adalah phenylbenzopyrones (phenylchromones) dengan berbagai variasi pada struktur dasarnya, yaitu tiga cincin utama yang saling melekat. Struktur dasar ini terdiri dari dua cincin benzen (A dan B) yang dihubungkan melalui cincin heterosiklik piran atau piron (dengan ikatan ganda) yang disebut cincin “C” (Middleton dkk., 2000). Senyawa flavonoid adalah polifenol yang mengandung 15 atom karbon dalam inti dasarnya, yang tersusun dalam konfigurasi C6-C3-C6, yaitu 2 cincin aromatik yang dihubungkan oleh satuan tiga karbon yang dapat atau tidak dapat membentuk cincin ketiga (Manitto, 1981; Markham, 1988). Kelas-kelas yang berlainan dalam golongan flavonoid dibedakan berdasarkan cincin heterosiklik-oksigen tambahan dan gugus hidroksil yang tersebar menurut pola yang berlainan (Robinson, 1995).
Gambar 3. Struktur dasar flavonoid
b. Klasifikasi Flavonoid
Menurut Robinson (1995), falavonoid dapat dikelompokkan berdasarkan keragaman pada rantai C3 yaitu:
Flavonol paling sering terdapat dalam bentuk glikosida, biasanya 3-glikosida, dan aglikon flavonol yang umum yaitu kaemferol, kuersetin, dan mirisetin. Flavonol lain yang terdapat di alam bebas kebanyakan merupakan variasi struktur sederhana dari flavonol. Larutan flavonol dalam suasana basa dioksidasi oleh udara tetapi tidak begitu cepat sehingga penggunaan basa pada pengerjaannya masih dapat dilakukan.
Gambar 4. Struktur dasar flavonol 2) Flavon
Flavon berbeda dengan flavonol, pada flavon tidak terdapat gugusan 3-hidroksi. Bentuk glikosida flavon lebih sedikit dibandingkan dengan glikosida dari flavonol. Flavon yang umum dijumpai, yaitu apigenin dan luteolin. Flavon dianggap sebagai induk dalam nomenklatur kelompok senyawa flavonoid.
3) Isoflavon
Isoflavon merupakan isomer flavon dan jumlahnya sangat sedikit. Isoflavon berperan sebagai fitoaleksin yaitu senyawa pelindung yang terbentuk dalam tumbuhan sebagai pertahanan terhadap serangan penyakit. Isoflavon sukar dicirikan karena reaksinya tidak khas dengan berbagai jenis pereaksi warna. Beberapa isoflavon, misal daidzein, memberikan warna biru muda cemerlang dengan sinar UV bila diuapi amonia, tetapi kebanyakan yang lain tampak sebagai bercak lembayung yang pudar dengan amonia berubah menjadi cokelat.
Gambar 6. Struktur dasar isoflavon
4) Flavanon
Flavanon terdistribusi luas di alam. Flavanon terdapat di dalam kayu, daun, dan bunga. Flavanon glikosida merupakan konstituen utama dari marga prunus dan citrus. Glikosida yang paling lazim ditemukan yaitu naringenin dan hesperidin yang terdapat dalam buah anggur dan jeruk.
Gambar 7. Struktur dasar flavanon
5) Flavanonol
Senyawa ini berkhasiat sebagai antioksidan dan hanya terdapat sedikit sekali jika dibandingkan dengan flavonoid lainnya. Pada kebanyakan pustaka, flavanonol lebih sering disebut dihidroflavonol.
Gambar 8. Struktur dasar flavanonol
6) Katekin
Katekin terdapat dalam seluruh dunia tumbuhan, terutama pada tumbuhan berkayu. Senyawa ini mudah diperoleh dalam jumlah besar dari ekstrak kental Uncaria gambir dan daun teh kering yang mengandung kira-kira 30% senyawa ini. Katekin berkhasiat sebagai antioksidan.
Gambar 9. Struktur katekin
7) Leukoantosianidin
Leukoantosianidin merupakan senyawa tidak berwarna, terutama terdapat dalam tumbuhan berkayu. Senyawa ini jarang terdapat sebagai glikosida. Contohnya yaitu melaksidin dan apiferol.
Gambar 10. Struktur leukoantosianidin
8) Antosianin
Antosianin merupakan pewarna yang paling penting dan paling tersebar luas dalam tumbuhan. Pigmen yang berwarna kuat dan larut dalam air ini adalah penyebab hampir semua warna merah jambu, merah marak, ungu, dan biru dalam daun, bunga, dan buah pada tumbuhan tingkat tinggi. Secara kimia semua antosianin merupakan turunan suatu struktur aromatik tunggal yaitu sianidin, dan semuanya terbentuk dari
pigmen sianidin ini dengan penambahan atau pengurangan gugus hidroksil atau dengan metilasi atau glikosilasi.
Gambar 11. Struktur dasar antosianin
9) Khalkon
Khalkon adalah pigmen fenol kuning yang berwarna cokelat tua dengan sinar UV bila dianalisis dengan kromatografi kertas. Khalkon merupakan senyawa minor dari golongan flavonoid. Senyawa ini tidak memiliki cincin C seperti flavonoid pada umumnya.
Gambar 12. Struktur dasar khalkon
10) Auron
Auron berupa pigmen kuning emas yang terdapat dalam bunga tertentu dan bryophyta. Dalam larutan basa senyawa ini berwarna merah ros dan tampak pada kromatografi kertas berupa bercak kuning, dengan sinar ultraviolet warna kuning kuat berubah menjadi merah jingga bila diuapi amonia.
Gambar 13. Struktur dasar auron
c. Sifat Kelarutan Flavonoid
Aglikon flavonoid adalah polifenol yang memiliki sifat kimia senyawa fenol, yaitu bersifat agak asam sehingga dapat larut dalam basa. Tetapi harus diingat, bila dibiarkan dalam larutan basa, dan di samping itu terdapat oksigen maka banyak yang akan terurai. Flavonoid bersifat polar karena mempunyai sejumlah gugus hidroksil atau gula, maka pada umumnya flavonoid cukup larut dalam pelarut polar seperti etanol, metanol, butanol, aseton, dimetilsulfoksida (DMSO), dimetilformamida (DMF), air, dan pelarut polar lain. Adanya gula yang terikat pada flavonoid (bentuk yang umum ditemukan) cenderung menyebabkan flavonoid lebih mudah larut dalam air sehingga campuran pelarut yang disebut di atas dengan air merupakan pelarut yang lebih baik untuk glikosida. Sebaliknya, aglikon yang kurang polar seperti isoflavon, flavanon, dan flavon serta flavonol yang termetoksilasi cenderung mudah lebih larut dalam pelarut seperti eter dan kloroform.
d. Sifat Kimia Flavonoid
Flavonoid merupakan senyawa bersifat asam karena adanya gugus hidroksi. Gugus hidroksi ini akan bereaksi dengan basa membentuk garam fenolat, sehingga pada penambahan uap amonia atau Na+ warna berubah
menjadi kuning. Perubahan ini menyebabkan terjadinya pergeseran batokromik dari spektrum senyawa yang mempunyai gugus orto dihidroksi jika bereaksi dengan AlCl3 atau H3BO3 dan akan membentuk kompleks
khelat. Ion aluminium akan membentuk khelat berwarna kuning, ion besi akan membentuk khelat berwarna cokelat, dan sitroborat akan berwarna kuning. Kompleks yang terbentuk dari gugus orto dihidroksi bersifat reversibel dengan penambahan HCl, sedangkan kompleks hidroksi karbonil bersifat ireversibel (tetap). Gugus metoksi atau metil tidak dapat membentuk kompleks dengan AlCl3 sehingga tidak terjadi pergeseran
batokromik (Harborne dkk., 1975; Mabry dkk., 1970; Pramono, 1994). e. Isolasi Flavonoid
Isolasi flavonoid bisa dilakukan dengan menggunakan metode kromatografi kertas (KKt) dan kromatografi lapis tipis (KLT). Metode tersebut paling menguntungkan karena membutuhkan sampel yang relative sedikit dengan waktu yang cukup singkat. Pemilihan fase gerak dan fase diam dalam kromatografi dipengaruhi oleh tipe flavonoid (Markham, 1988). Pemisahan flavonoid yang relatif non polar seperti aglikon-aglikon dari isoflavon, flavon, dan flavonol yang termetoksilasi digunakan fase diam silika gel. Pemisahan flavonoid yang cenderung polar seperti glikosida menggunakan fase diam selulosa mikrokristal (Harborne, 1975).
f. Aktivitas Flavonoid
Flavonoid merupakan golongan senyawa fenol alam terbesar (Harborne, 1987). Flavonoid memiliki kontribusi yang penting dalam
kesehatan manusia. Sejumlah tumbuhan obat yang mengandung flavonoid telah dilaporkan memiliki aktivitas antioksidan, antibakteri, antivirus, antiradang, antialergi, dan antikanker (Miller, 1996). Beberapa penyakit seperti aterosklerosis, kanker, diabetes, parkinson, alzheimer, dan penurunan kekebalan tubuh telah diketahui dipengaruhi oleh radikal bebas dalam tubuh manusia (Amic dkk., 2003). Menurut Markham (1988) yang dikutip oleh Hertog dkk. (1992), disarankan agar mengkonsumsi beberapa gram flavonoid tiap harinya. Flavonoid merupakan senyawa pereduksi yang baik, menghambat banyak reaksi oksidasi, baik secara enzimatis maupun non-enzimatis. Flavonoid bertindak sebagai penampung yang baik bagi radikal hidroksi dan superoksida yang dengan demikian melindungi lipid membran terhadap reaksi yang merusak. Aktivitas antioksidannya dapat menjelaskan bahwa flavonoid tertentu merupakan komponen aktif tumbuhan yang digunakan secara tradisional untuk mengobati gangguan fungsi hati (Robinson, 1995).
3. Spektroskopi UV-Visibel pada Flavonoid
Teknik spektroskopi adalah salah satu teknik analisis kimia-fisika yang mengamati tentang interaksi atom atau molekul dengan radiasi elektromagnetik. Ada dua macam instrumen pada teknik spektroskopi yaitu spektrometer dan spektrofotometer. Instrumen yang memakai monokromator celah tetap pada bidang fokus disebut sebagai spektrometri. Apabila spektrometer tersebut dilengkapi dengan detektor yang bersifat fotoelektrik maka disebut spektrofotometer (Muldja, 1995).
Serapan molekul di dalam daerah ungu dan terlihat dari spektrum bergantung pada struktur ultra elektronik dari molekul. Penyerapan sejumlah energi menghasilkan percepatan dari elektron dalam orbital tingkat dasar ke orbital yang berenergi lebih tinggi di dalam keadaan tereksitasi (Silverstein, 1986).
Beberapa istilah yang perlu diketahui dalam spektroskopi adalah: a. Gugus kromofor
Merupakan suatu gugus kovalen tidak jenuh yang dapat menyerap radiasi dalam daerah UV dan tampak.
b. Gugus auksokrom
Merupakan suatu gugus fungsional bersifat jenuh yang jika berada pada suatu gugus kromofor akan menyebabkan timbulnya pergeseran puncak serapan ke panjang gelombang yang lebih besar dan dapat juga mempertinggi intensitasnya.
c. Pergeseran batokromik (pergeseran merah)
Merupakan pergeseran ke arah panjang gelombang yang lebih besar disebabkan karena adanya substituen atau pengaruh pelarut.
d. Pergeseran hipsokromik (pergeseran biru)
Merupakan pergeseran gelombang kea rah panjang gelombang yang lebih pendek.
e. Efek hiperkromik
Merupakan peristiwa bertambahnya intensitas serapan suatu gugus kromofor.
f. Efek hipokromik
Merupakan peristiwa berkurangnya intensitas serapan suatu gugus kromofor.
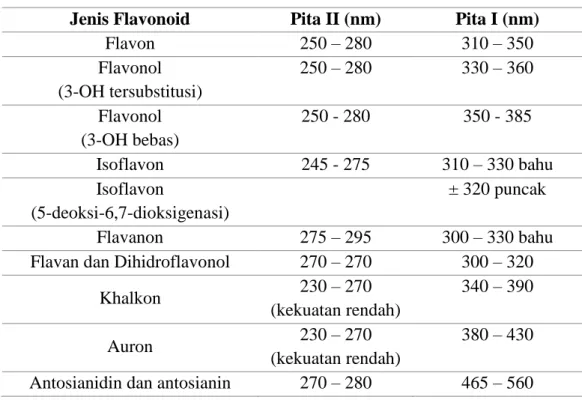
Flavonoid mempunyai sistem aromatik yang terkonjugasi sehingga menunjukkan pita serapan kuat pada daerah spectrum UV-Visibel (Harborne, 1987). Spektrum flavonoid biasanya ditentukan dalam larutan dengan pelarut metanol atau etanol. Spektrum khas terdiri atas dua panjang gelombang maksimal pada rentang 240 – 285 nm (pita II) dan 300 – 550 nm (pita I). Pita II merupakan serapan dari cincin A (cincin benzoil) dan pita I merupakan serapan dari cincin B (cincin sinamoil). Intensitas dari masing-masing serapan tergantung pada panjangnya sistem terkonjugasi serta adanya substitusi terutama pada kedudukan atom C3 dan C5.
Senyawa flavon yang mempunyai cincin sinamoil mengandung sistem konjugasi lebih panjang daripada sistem benzoil sehingga intensitas puncak I lebih kecil dibandingkan intensitas puncak II. Flavon dan flavonol yang tersubstitusi oksigen pada cincin A, dalam metanol cenderung memberikan spektra yang nyata pada pita II dan lemah pada pita I. Sebaliknya jika cincin B tersubstitusi oksigen menyebabkan pita I akan kelihatan lebih nyata (Mabry dkk., 1970). Daftar pita absorbsi UV dari semua flavonoid dapat dilihat dalam Tabel I.
Tabel I. Pita absorbsi UV dari Flavonoid (Markham, 1988; Sujata, 2005)
Jenis Flavonoid Pita II (nm) Pita I (nm)
Flavon 250 – 280 310 – 350 Flavonol (3-OH tersubstitusi) 250 – 280 330 – 360 Flavonol (3-OH bebas) 250 - 280 350 - 385 Isoflavon 245 - 275 310 – 330 bahu Isoflavon (5-deoksi-6,7-dioksigenasi) ± 320 puncak Flavanon 275 – 295 300 – 330 bahu
Flavan dan Dihidroflavonol 270 – 270 300 – 320
Khalkon 230 – 270 (kekuatan rendah) 340 – 390 Auron 230 – 270 (kekuatan rendah) 380 – 430 Antosianidin dan antosianin 270 – 280 465 – 560
4. Ekstraksi
Ekstraksi atau penyarian adalah proses penarikan zat yang dapat larut dari bahan yang tidak dapat larut menggunakan pelarut cair. Menurut Winarno dkk. (1973), ekstraksi merupakan cara untuk memisahkan campuran beberapa zat menjadi komponen yang terpisah. Simplisia yang diekstrak mengandung senyawa aktif yang dapat larut dan senyawa yang tidak larut seperti serat, karbohidrat, protein, dan lain-lain. Senyawa aktif yang terdapat dalam berbagai simplisia dapat digolongkan ke dalam golongan minyak atsiri, alkaloid, flavonoid, dan lain-lain. Struktur kimia yang berbeda-beda akan mempengaruhi kelarutan serta stabilitas senyawa-senyawa tersebut terhadap pemanasan, udara, cahaya, logam berat, dan derajat keasaman. Dengan diketahuinya senyawa aktif yang dikandung simplisia akan mempermudah pemilihan pelarut dan cara
ekstraksi yang tepat. Hasil dari ekstraksi ini dapat berupa ekstrak kering, ekstrak kental, atau ekstrak cair (Ditjen POM, 2000).
Proses penyarian dapat diefektifkan dengan pengadukan dan pemanasan. Pengadukan menyebabkan perataan pelarut untuk mencapai zat aktif dalam bahan. Sementara itu pemanasan menyebabkan pelarut lebih encer sehingga meningkatkan kemampuannya untuk melarutkan zat aktif (Pramono, 2012).
Pemilihan pelarut atau cairan penyari yang tepat menjadi salah satu faktor berhasilnya proses ekstraksi. Kriteria yang harus diperhatikan dalam pemilihan cairan penyari yaitu murah dan mudah diperoleh, stabil secara fisika dan kimia, bereaksi netral, tidak mudah menguap dan tidak mudah terbakar, dan selektif. Selektif mempunyai maksud pelarut mampu menarik hanya zat berkhasiat yang dikehendaki, tidak mempengaruhi zat berkhasiat, dan diperbolehkan oleh peraturan (Depkes, 1986).
Polaritas pelarut merupakan poin penting kaitannya dengan daya larut. Menurut Stahl (1969), indikator pelarutan pelarut dapat ditentukan dari nilai konstanta dielektrik dan nilai polaritas pelarut, dan perbandingan kedua nilai tersebut bersifat proporsional.
Tabel II. Nilai konstanta dielektrik berbagai zat pelarut
Konstanta Dielektrik Nama Zat Pelarut Polaritas 1,890 2,023 2,238 2,284 4,806 4,340 6,020 20,700 24,300 33,620 80,370 Petroleum ringan Sikloheksan Karbon tetraklorida Trikloroetilen Toluen Benzen Diklorometan Kloroform Etileter Etilasetat Aseton n-Propanol Etanol Metanol Air
Berbagai macam metode ekstraksi yaitu maserasi, infundasi, perkolasi, sokletasi, dan refluks. Maserasi dan infundasi merupakan metode ekstraksi yang cukup banyak digunakan baik skala kecil maupun besar (industri).
a. Maserasi
Istilah maserasi berasal dari bahasa latin macerace yang artinya mengairi, melunakkan dan merupakan metode ekstraksi paling sederhana. Maserasi merupakan cara penyarian yang dilakukan dengan cara merendam serbuk simplisia dalam cairan penyari. Maserasi termasuk metode ekstraksi cara dingin. Proses perendaman dibarengi dengan beberapa kali pengocokan atau pengadukan pada temperatur ruangan (kamar). Cairan penyari akan menembus dinding sel dan masuk ke dalam rongga sel yang mengandung zat aktif yang akan larut. Karena adanya perbedaan konsentrasi antara
larutan zat aktif di dalam sel dan di luar sel maka larutan terpekat didesak ke luar. Metode ini paling sering digunakan untuk ekstraksi senyawa bioaktif dalam tumbuhan. Umumnya digunakan untuk bahan tumbuhan yang kadar senyawa bioaktifnya tinggi. Volume pelarut umumnya sebanyak 80 kali bahan untuk merendam tergantung kepada sifat bahan. Waktu perendaman bervariasi tergantung sifat dari bahan apakah dari kategori lunak atau keras. Namun umumnya berkisar antara 18 jam dan pada 6 jam pertama dilakukan pengadukan. Proses penyarian diulangi sekurang-kurangnya dua kali dengan jenis dan pelarut yang sama. Kerugian dari metode ini yaitu ekstraksinya tidak dapat berjalan sempurna (Wahyono, 2012).
b. Infundasi
Infundasi adalah proses penyarian yang umumnya dilakukan untuk menyari zat kandungan aktif yang larut dalam air dari bahan-bahan nabati. Proses ini dilakukan pada suhu 900 C selama 15 menit. Jika pemanasan dilakukan selama 30 menit disebut dekokta. Infundasi termasuk metode ekstraksi cara panas (Ditjen POM, 2000). Infundasi menghasilkan sari yang tidak stabil dan sangat mudah tercemar oleh kapang dan kuman, sehingga sari yang diperoleh tidak boleh disimpan lebih dari 24 jam atau segera dibuat menjadi ekstrak kental. Metode ini lebih sederhana dan ekonomis dibanding metode ekstraksi lainnya (Depkes RI, 1986). Alat yang digunakan dalam proses infundasi adalah panci infusa. Panci infusa terdiri dari dua bagian,
yaitu panci A yang berisi bahan (simplisia) dan air dan panci B yang berisi air dengan fungsi sebagai penangas air.
5. Kromatografi Lapis Tipis pada Flavonoid
Kromatografi adalah proses yang digunakan untuk memisahkan campuran ke dalam komponennya untuk keperluan analisis, identifikasi kemurnian, dan/atau kuantifikasi suatu senyawa (Sampietro dkk., 2009). Kromatografi merupakan metode pemisahan komponen-komponen dari suatu campuran berdasarkan perbedaan kecepatan migrasi komponen-komponen tersebut, yang dibawa fase gerak, untuk melintasi fase diam (Skoog dkk., 2014).
KLT merupakan metode yang umum, sederhana, cepat, dan murah yang memberikan informasi berapa banyak komponen yang ada dalam campuran.. Sejak awal tahun 1960, kromatografi lapis tipis (KLT) sudah digunakan untuk analisis flavonoid. KLT menjadi metode pilihan dalam menganalisis herbal sebelum teknik instrumental seperti kromatografi gas dan kromatografi cair kinerja tinggi muncul. KLT sampai saat ini masih menjadi peralatan dasar dalam identifikasi senyawa alam yang ada di berbagai farmakope. KLT sering menyediakan informasi pertama dalam memberikan karakteristik khas suatu herbal.
Kromatografi lapis tipis digunakan untuk memisahkan senyawa-senyawa yang bersifat hidrofob seperti lipida-lipida ataupun hidrokarbon. Komponen dalam melakukan kromatografi lapis tipis membutuhkan fase gerak, fase diam, dan deteksi yang tepat.
a. Fase diam
Fase diam merupakan fase yang diam di tempat, baik pada kolom atau permukaan planar (Skoog dkk, 2014). Silika gel dan selulosa merupakan fase diam yang biasa digunakan dalam pemisahan kromatografi lapis tipis (Gandjar dan Rohman, 2010)
1) Silika gel
Silika gel merupakan fase diam yang paling banyak digunakan baik untuk kromatografi secara partisi maupun adsorpsi. Silika gel memiliki struktur ikatan silika dan oksigen (siloksan) dan pemisahan terjadi karena migrasi diferensial molekul sampel yang disebabkan oleh ikatan hidrogen, interaksi dipol-dipol dan interaksi elektrostatik dengan silanol (Si-OH).
Silika paling berguna untuk memisahkan aglikon yang kurang polar, misalnya isoflavon, flavanon, metil flavon, dan flavonol (Markham, 1988).
2) Selulosa
Selulosa merupakan penyerap yang sangat cocok untuk memisahkan senyawa yang bersifat hidrofilik. Mekanisme pemisahannya adalah partisi fase normal dengan menyerap air sebagai fase diam (Waksmundzka-Hajnos dkk., 2008).
Selulosa ideal untuk memisahkan glikosida yang satu dari glikosida yang lain, glikosida dari aglikon, dan untuk memisahkan aglikon yang
kurang polar. Selulosa sering digunakan untuk identifikasi flavonoid secara umum (Markham, 1988).
b. Fase gerak
Fase gerak dalam kromatografi lapis tipis bisa berupa pelarut tunggal atau campuran dari pelarut yang akan bergerak maju melewati pori-pori dari fase diam. Pelarut yang tepat untuk kromatografi dapat diklasifikasikan berdasarkan polaritasnya. Jika fase diam yang digunakan polar, fase gerak yang digunakan sebaiknya tidak lebih polar dari fase diamnya. Sistem ini dinamakan sistem fase normal. Jika fase diam bersifat non-polar, pemilihan fase geraknya baiknya lebih polar. Sistem ini disebut sistem fase terbalik (Waksmundzka-Hajnos dkk., 2008).
Fase gerak yang biasa digunakan pada KLT dengan fase diam selulosa yaitu metanol 5%, asam asetat 15%, dan kombinasi n-butanol-asam asetat glasial-air dalam berbagai perbandingannya (Markham, 1988).
c. Deteksi
Penampakan bercak setelah elusi menjadi data penting untuk menentukan golongan senyawa. Setiap golongan senyawa memiliki warna bercak yang khas.
Tabel III. Penafsiran warna becak dari segi struktur flavonoid (Markham, 1988)
Warna bercak di bawah sinar UV 366
Kemungkinan Jenis Flavonoid Tanpa Uap Amonia Dengan Uap Amonia Lembayung gelap Kuning, Hijau-kuning, hijau
a. Biasanya 5-OH flavon atau flavonol (tersulih pada 3-O dan mempunyai 4’-OH).
b. Kadang-kadang 5-OH flavanon dan 4’-OH khalkon tanpa 4’-OH pada cincin B. Perubahan
warna sedikit atau tanpa perubahan warna
a. Biasanya flavon atau flavonol tersulih pada 3-O mempunyai 5-OH tetapi tanpa 4’-OH bebas.
b. Beberapa 6- atau 8-OH flavon dan flavonol tersulih pada 3-O dan mengandung 5-OH.
c. Isoflavon, dihidroflavonol, biflavonil, dan beberapa flavanon yang mengandung 5-OH.
d. Khalkon yang mengandung 2’- atau 6’-OH tetapi tidak mengandung 2- atau 4-OH bebas.
Biru muda Beberapa 5-OH flavanon Merah atau
jingga
Khalkon yang mengandung 2- dan/atau 4-OH bebas
Fluoresensi biru muda
Fluoresensi hijau-kuning atau hijau biru
a. Flavon dan flavanon yang tak mengandung 5-OH
b. Flavonol tanpa 5-OH bebas tetapi tersulih pada 3-OH.
Perubahan warna sedikit atau tanpa perubahan
Isoflavon yang tak mengandung 5-OH bebas.
Fluoresensi mirip biru muda
Isoflavon yang tak mengandung 5-OH bebas.
Tak Nampak Fluoresensi biru muda
Isoflavon yang tak mengandung 5-OH bebas.
Tabel III. Penafsiran warna becak dari segi struktur flavonoid (Lanjutan)
Warna bercak di bawah sinar UV 366
Kemungkinan Jenis Flavonoid Tanpa Uap
Amonia
Dengan Uap Amonia
Kuning redup dan kuning atau fluoresensi jingga Perubahan warna sedikit atau tanpa perubahan
Flavonol yang mengandung 3-OH bebas dan ada atau tidak 5-OH bebas (kadang-kadang berasal dari dihidroflavonol)
Fluoresensi kuning
Jingga atau merah
Auron yang mengandung 4’-OH bebas dan beberapa 2- atau 4-OH khalkon Hijau-kuning, hijau-biru, hijau Perubahan warna sedikit atau tanpa perubahan
a. Auron yang tak mengandung 4’-OH bebas dan flavanon tanpa 5-OH bebas.
b. Flavonol yang mengandung 3-OH bebas dan disertai atau tanpa 5-OH bebas.
Merah jingga redup atau merah senduduk
Biru Antosianidin 3-glikosida Merah jambu atau
fluoresensi kuning
Biru Sebagian besar antosianidin3,5-glikosida
F. Data Empirik
Dari ekstrak kental daun bungur dapat diperoleh informasi tentang perbandingan kadar flavonoid total antara metode maserasi dan infundasi. Selain itu, dari fraksi larut etil asetat akan diketahui golongan senyawa flavonoid dan struktur parsialnya.