PENGARUH JENIS ASAM PADA SINTESIS SILIKA GEL DARI
PENGARUH JENIS ASAM PADA SINTESIS SILIKA GEL DARI ABU BAGASSEABU BAGASSE DAN UJI SIFAT ADSORPTIFNYA TERHADAP ION L
DAN UJI SIFAT ADSORPTIFNYA TERHADAP ION LOGAM TEMBAGA (II)OGAM TEMBAGA (II) Makalah ini Disusun Untuk Memenuhi Tugas Mata Kuliah Sintesis Anorganik
Makalah ini Disusun Untuk Memenuhi Tugas Mata Kuliah Sintesis Anorganik Diampu Oleh Pardoyo M.Si
Diampu Oleh Pardoyo M.Si
Disusun oleh : Disusun oleh : Pebriyani
Pebriyani Latifah Latifah NIM NIM 2403011113005324030111130053 Ninda Chrisandra
Ninda Chrisandra NIM 24030111130049NIM 24030111130049 Eka
Eka Sulistya Sulistya Hermawati Hermawati NIM NIM 2403011113005024030111130050 Aulia
Aulia Wulandari Wulandari NIM NIM 2403011113005124030111130051
JURUSAN KIMIA JURUSAN KIMIA
FAKULTAS SAINS DAN MATEMATIKA FAKULTAS SAINS DAN MATEMATIKA
UNIVERSITAS DIPONEGORO UNIVERSITAS DIPONEGORO SEMARANG SEMARANG 2013 2013
KATA PENGANTAR KATA PENGANTAR
Puji dan syukur kehadirat Tuhan Yang Maha Esa yang telah memberikan berkat-Nya, Puji dan syukur kehadirat Tuhan Yang Maha Esa yang telah memberikan berkat-Nya, sehingga penulis dapat menyelesaikan makalah ini. Penulisan makalah ini bertujuan untuk sehingga penulis dapat menyelesaikan makalah ini. Penulisan makalah ini bertujuan untuk memenuhi tugas mata kuliah Sintesis Anorganik.
memenuhi tugas mata kuliah Sintesis Anorganik.
Ucapan terima kasih penulis sampaikan kepada semua pihak yang telah membantu baik Ucapan terima kasih penulis sampaikan kepada semua pihak yang telah membantu baik secara langsung maupun tidak langsung sehingga makalah ini dapat terselesaikan. Ucapan terima secara langsung maupun tidak langsung sehingga makalah ini dapat terselesaikan. Ucapan terima kasih secara khusus penulis sampaikan kepada Bapak Pardoyo selaku dosen mata kuliah Sintesis kasih secara khusus penulis sampaikan kepada Bapak Pardoyo selaku dosen mata kuliah Sintesis Anorganik.
Anorganik.
Makalah ini membahas mengenai Silika Gel. Dengan adanya makalah ini, diharapkan Makalah ini membahas mengenai Silika Gel. Dengan adanya makalah ini, diharapkan mahasiswa akan mengerti lebih dalam tentang silika gel dan semua aspeknya.
mahasiswa akan mengerti lebih dalam tentang silika gel dan semua aspeknya.
Saran dan kritik dari semua pihak yang bersifat membangun selalu diharapkan demi Saran dan kritik dari semua pihak yang bersifat membangun selalu diharapkan demi kesempurnaan makalah ini. Semoga makalah ini dapat bermanfaat bagi pembaca dan dapat kesempurnaan makalah ini. Semoga makalah ini dapat bermanfaat bagi pembaca dan dapat menjadi sarana pembelajaran bagi pembaca di masa yang akan datang.
menjadi sarana pembelajaran bagi pembaca di masa yang akan datang.
Semarang, November 2013 Semarang, November 2013
Tim Penulis Tim Penulis
DAFTAR ISI
KATA PENGANTAR ………i
DAFTAR ISI………...ii
BAB I PENDAHULUAN I.1 Latar Belakang………...1
I.2 Rumusan Masalah………..2
I.3 Tujuan Penulisan………...3
I.4 Manfaat Penulisan……….3
BAB II TINJAUAN PUSTAKA II.1 Silika Gel………4
II.2 Abu Bagasse ( Ampas Tebu)………5
II.3 Logam Cu………..6
II.4 Adsorpsi……….6
II.4.1 Definisi Adsorpsi………..6
II.4.2 Jenis adsorpsi………...7
II.4.3 Faktor-faktor yang mempengaruhi adsorpsi ………8
II.5 Metode Sol-Gel………..9
II.5.1 Tahapan Proses Sol Gel……….9
II.6 Metode Volumetri………...10
II.7 Fourier Transform Infra Red (FTIR)………..11
II.8 Furnace………12
BAB III METODA PENELITIAN III.1 Alat……….13
III.2 Bahan………..13
III.3 Prosedur Penelitian………...13
III.3.1 Pengabuan dan pencucian……….13
III.3.6 Adsorpsi Ion Logam Cu(II)……….15 III.3.7 Teknik Analisis Data………...15 BAB IV HASIL PENELITIAN DAN PEMBAHASAN………...17 BAB V PENUTUP
V.1 Kesimpulan………..25 V.2 Saran………25 DAFTAR PUSTAKA………...26
BAB I
PENDAHULUAN I.1 Latar Belakang
Tebu (Saccharum officinarum) merupakan tanaman yang tumbuh subur di Indonesia. Tanaman ini hanya tumbuh di daerah beriklim tropis dan digunakan sebagai bahan baku untuk pembuatan gula (FAO, 2006). Proses ekstraksi cairan tebu yang diolah di pabrik gula memiliki hasil samping berupa ampas tebu (bagasse). Ampas tebu yang dihasilkan dari satu pabrik gula sekitar 35
–
40% dari berat tebu yang digiling. Hasil penelitian menunjukkan bahwa abu bagasse dari limbah pabrik gula dapat diolah menjadi silika. Bagassemengandung air 48
–
52%, gula 3,3% dan serat 47,7% (A.Hanafi dan A. Nandang, 2010). Dari hasil analisa XRF terhadap abu bagasse diketahui bahwa dalam abu bagasse mengandung mineral–
mineral yang berupa Si, K, Ca, Ti, V, Mn, Fe, Cu, Zn dan P. Kandungan yang paling besar dari mineral–
mineral tersebut adalah silikon (Si) sebesar 55,5%. Karena kandungan silika dalam abu bagasse besar maka abu bagasse berpotensi sebagai bahan baku pembuatan silika gel sehingga mempunyai nilai tambah yang lebih dengan memanfaatkan limbah padat yang dihasilkan oleh pabrik gula (http://adinfobogor.blogspot.com/2008/01/bahaya-pencemaran-logam-berat-dalamair_31.html). Adapun komposisinya disajikan dalam Tabel 1.
Silika gel merupakan salah satu padatan anorganik yang dapat digunakan untuk keperluan adsorpsi karena memiliki gugus silanol (Si-OH) dan siloksan (Si-O-Si) yang merupakan sisi aktif pada permukaannya. Di samping itu silika gel mempunyai pori-pori yang luas, berbagai ukuran partikel dan area permukaan yang khas. Menurut penelitian
Nunung (2010 : 3), abu bagasse memiliki kandungan silika yang cukup besar yakni berkisar 70% sehingga abu bagasse memungkinkan digunakan sebagai bahan baku pembuatan silika gel dengan ekstraksi silika gel dalam abu bagasse dengan larutan NaOH 1N kemudian dengan polimerisasi hydrogel dan pengeringan sampai menjadi silika gel dan menguji daya adsorpsi dan efisiensi adsorpsi terhadap ion logam Pb(II). Dari penelitian tersebut diharapkan menjadi solusi dalam pembuatan silika gel yang hemat energi dan ramah lingkungan.
Berdasarkan beberapa penelitian tersebut dapat diketahui bahwa silika gel dapat dibuat dari abu bagasse, sehingga penelitian tentang pembuatan silika gel dari abu bagasse masih perlu dikembangkan, yaitu dengan melanjutkan penelitian di atas dengan mempelajari
variabel-variabel penelitian. Dalam penelitian ini akan dilakukan kajian salah satu pemanfaatan abu bagasse sebagai sumber silika untuk adsorpsi ion logam Cu(II), di antaranya penggunaan asam kuat dan asam lemah. Penelitian ini difokuskan pada kajian pengolahan abu bagasse menjadi natrium silikat dengan variasi jenis asam (kuat dan lemah), yang kemudian dilanjutkan dengan karakterisasi silika gel, dan uji sifat adsorptifnya terhadap ion logam Cu(II).
I.2 Rumusan Masalah
Berdasarkan latar belakang diatas, dapat diperoleh beberapa rumusan masalah sebagai berikut.
I.2.1 Bagaimana karakter silika gel hasil sintesis?
I.2.2 Bagaimana pengaruh jenis asam yang digunakan dalam sintesis silika gel dari abu bagasse terhadap daya adsorpsi dan efisiensi adsorpsi pada ion logam Cu(II)?
I.2.3 Berapakah daya adsorpsi dan efisiensi adsorpsi dari silika gel yang paling optimal terhadap ion logam Cu(II)?
I.3 Tujuan Penulisan
Berdasarkan rumusan masalah di atas, diperoleh beberapa tujuan penulisan makalah ini adalah sebagai berikut:
I.3.1 Mengidentifikasi karakter silika gel hasil sintesis
I.3.2 Mengetahui pengaruh jenis asam yang digunakan dalam sintesis silika gel dari abu baggase terhadap daya adsorpsi dan efisiensi adsorpsi pada ion logam Cu(II)
I.3.3 Mengetahui daya adsorpsi dan efisiensi adsorpsi dari silika gel yang paling optimal terhadap ion logam Cu(II)
I.4 Manfaat Penulisan
Manfaat dari penulisan makalah ini adalah sebagai berikut: I.4.1 Dapat menambah wawasan mengenai silika gel.
I.4.2 Dapat menambah khazanah berpikir mahasiswa mengenai aplikasi silika gel dalam kehidupan sehari-hari.
BAB II
TINJAUAN PUSTAKA
II.1 Silika Gel
Salah satu bahan yang telah berhasil dibuat dengan bahan dasar abu sekam padi adalah silika gel. Kegunaan silika gel didasarkan pada keberadaan situs aktif berupa gugus silanol (Si
–
OH) dan siloksan (Si–
O–
Si) di permukaan dan sifat fisiknya seperti kestabilan mekanik, dan luas permukaan. Gugus silanol (Si–
OH) inilah yang memberikan sifat polar pada silika gel dan merupakan sisi aktif dari silika gel. Permukaan yang kompleks dari silikagel yakni terdiri atas lebih dari satu macam tipe gugus hidroksil
–
OH yang terikat pada permukaan silika gel (Narsito,2005).Luas permukaan silika gel yang besar 300- 800 m2/g, akibat dari banyaknya pori yang dimilikinya. Sifat yang paling penting dari silika gel adalah sebagai adsorben yang dapat diregenerasi. Silika gel memiliki kemampuan menyerap yang sangat besar terhadap molekul-molekul air. Dengan bertambahnya luas permukaan silika gel, porositas silika gel juga akan bertambah.
Gel silika adalah butiran seperti kaca dengan bentuk yang sangat berpori, silika dibuat secara sintetis dari natrium silikat. Walaupun namanya, gel silika padat. Gel silika adalah mineral alami yang dimurnikan dan diolah menjadi salah satu bentuk butiran atau manik-manik. Sebagai pengering, ia memiliki ukuran pori rata-rata 2,2- 2,6 nanometer dan memiliki afinitas yang kuat untuk molekul air. Silika gel merupakan suatu bentuk dari silika yang dihasilkan melalui penggumpalan sol natrium silikat (NaSiO2). Sol mirip agar
–
agar ini dapat didehidrasi sehingga berubah menjadi padatan atau butiran mirip kaca yang bersifat tidak elastis. Sifat ini menjadikan silika gel dimanfaatkan sebagai zat penyerap, pengering dan penopang katalis. Garam–
garam kobalt dapat diabsorpsi oleh gel ini (http://id.wikipedia.org/wiki/silika gel).Adanya gugus -OH yang mampu membentuk ikatan hidrogen dengan gugus yang sama dari molekul lain yang mengakibatkan silika dapat digunakan sebagai pengering dan fasa diam pada kolom kromatografi (Narsito, 2005).
II.2 Abu Bagasse ( Ampas Tebu)
Ampas tebu adalah suatu residu dari proses penggilingan tanaman tebu ( saccharum oficinarum) setelah diekstrak atau dikeluarkan niranya pada Industri pemurnian gula sehingga diperoleh hasil samping sejumlah besar produk limbah berserat yang dikenal sebagai ampas tebu (bagasse).
Abu pembakaran ampas tebu merupakan hasil perubahan secara kimiawi dari pembakaran ampas tebu murni.Ampas tebu digunakan sebagai bahan bakar untuk memanaskan boiler dengan suhu mencapai 5500-6000C dan lama pembakaran setiap 4-8 jam dilakukan pengangkutan atau pengeluaran abu dari dalam boiler,karena jika dibiarkan tanpa dibersihkan akan terjadi penumpukan yang akan mengganggu proses pembakaran ampas tebu berikutnya.(Mukmin Batubara,2009).
Komposisi kimia dari abu ampas tebu terdiri dari beberapa senyawa yang dapat dilihat pada tabel berikut :
II.3 Logam Cu
Tembaga adalah suatu unsur kimia dalam tabel periodik yang memiliki lambang Cu, berasal dari bahasa Latin Cuprum dan nomor atom 29. Bernomor massa 63,54, merupakan unsur logam, dengan warna kemerahan. Tembaga merupakan konduktor panas dan listrik yang baik. Selain itu unsur ini memiliki korosi yang cepat sekali. Tembaga murni sifatnya halus dan lunak, dengan permukaan berwarna jingga kemerahan. Tembaga mempunyai kekonduksian elektrik dan kekonduksian haba yang tinggi (diantara semua logam-logam tulen dalam suhu bilik, hanya perak mempunyai kekonduksian elektrik yang lebih tinggi daripadanya). Apabila dioksidakan, tembaga adalah besi lemah. Tembaga memiliki ciri warna kemerahan, hal itu disebabkan struktur jalurnya, yaitu memantulkan cahaya merah dan jingga serta menyerap frekuensi-frekuensi lain dalam spektrum tampak. Tembaga sangat langka dan jarang sekali diperoleh dalam bentuk murni. Mudah didapat dari berbagai senyawa dan mineral.
II.4 Adsorpsi
II.4.1 Definisi Adsorpsi
Adsorpsi adalah peristiwa penyerapan suatu zat, ion atau molekul yang melekat pada permukaan, dimana molekul dari suatu materi terkumpul pada bahan pengadsorpsi atau adsorben. Sifat adsorpsi partikel koloid banyak dimanfaatkan dalam proses penjernihan air
pada permukaan larutan disebabkan karena adanya kekuatan atau gaya tarik
–
menarik antara atom atau molekul pada permukaan larutan. Peristiwa penyerapan suatu zat pada permukaan zat lain disebut adsorpsi, zat yang diserap disebut fase terserap sedangkan zat yang menyerap disebut adsorben. Peristiwa adsorpsi disebabkan oleh gaya tarik molekul dipermukaan adsorben (Estein, 2005).II.4.2 Jenis adsorpsi
Berdasarkan daya tarik molekul adsorben dengan adsorbat, adsorpsi dibedakan menjadi dua, yaitu:
a. Adsorpsi fisika
Adsorpsi yang disebabkan oleh gaya Van Der Wall yang ada pada permukaan adsorben, panas adsorpsinya rendah dan lapisan yang terjadi pada permukaan adsorben biasanya
lebih kecil dari satu molekul. b. Adsorpsi kimia
Adsorpsi yang terjadi karena adanya reaksi antara zat yang diserap dengan adsorben panas adsorpsinya tinggi lapisan molekul pada adsorben hanya satu lapis, terbentuk ikatan kimia. Peristiwa adsorpsi disebabkan oleh daya tarik molekul di permukaan adsorben. Adsorpsi menurunkan ketidakseimbangan daya tarik yang terjadi di permukaan (Alberty, 1992).
Beberapa gaya yang dapat menyebabkan terjadinya adsorpsi diantaranya adalah : (1) interaksi non polar Van der Wall, (2) pembentukan ikatan hidrogen, (3) pertukaran ion dan (4) pembentukan ikatan kovalen. Adsorpsi fisika sering sekali menunjukkan adsorpsi dari adanya gaya Van der Wall, terjadi karena adanya gaya adhesi antara zat terlarut dengan adsorben. Gaya-gaya paling kuat yang ada dalam adsorpsi molekul-molekul kecil dari larutan cair yaitu pertukaran ion dan ikatan hidrogen. Adsorpsi zat terlarut oleh adsorben padat cenderung membentuk ikatan hidrogen jika salah satu mempunyai kelompok ikatan
hidrogen sebagai donor dan yang lainnya sebagai akseptor (Yun dkk., 2001 dan Alberty dkk, 1992).
II.4.3 Faktor-faktor yang mempengaruhi adsorpsi
Secara umum, faktor-faktor yang mempengaruhi dari proses adsorpsi adalah sebagai berikut:
a. Luas permukaan
Semakin luas permukaan adsorben, maka makin banyak zat yang teradsorpsi. Luas permukaan adsorben ditentukan oleh ukuran partikel dan jumlah dari adsorben.
b. Jenis adsorbat
Peningkatan polarisabilitas adsorbat akan meningkatkan kemampuan adsorpsi molekul yang mempunyai polarisabilitas yang tinggi (polar) memiliki kemampuan tarik-menarik terhadap molekul lain dibandingkan molekul yang tidak dapat membentuk dipol (nonpolar). Peningkatan berat molekul adsorbat dapat meningkatkan kemampuan adsorpsi. Adsorbat dengan rantai yang bercabang biasanya lebih mudah diadsorp dibandingkan rantai yang lurus.
c. Struktur molekul adsorbat
Hidroksil dan amino mengakibatkan mengurangi kemampuan penyisihan sedangkan nitrogen meningkatkan kemampuan penyisihan.
d. Konsentrasi adsorbat
Semakin besar konsentrasi adsorbat dalam larutan maka semakin banyak jumlah substansi yang terkumpul pada permukaan adsorben.
e. Temperatur
Pemanasan atau pengaktifan adsorben akan meningkatkan daya serap adsorben terhadap adsorbat menyebabkan pori-pori adsorben lebih terbuka. Pemanasan yang terlalu tinggi menyebabkan rusaknya adsorben sehingga kemampuan penyerapannya menurun.
II.5 Metode Sol-Gel
Proses sol gel dapat didefinisikan sebagai proses pembentukan senyawa anorganik melalui reaksi kimia dalam larutan pada suhu rendah, dimana dalam proses tersebut terjadi perubahan fasa dari suspensi koloid (sol) membentuk fasa cair kontinyu (gel).
Metoda sol gel memiliki beberapa keuntungan, antar lain: 1. Tingkat stabilitas termal yang baik.
2. Stabilitas mekanik yang tinggi. 3. Daya tahan pelarut yang baik.
4. Modifikasi permukaan dapat dilakukan dengan berbagai kemungkinan.
Prekursor yang biasa digunakan umumnya logam-logam anorganik atau senyawa logam organik yang dikelilingi oleh ligan yang reaktif seperti logam alkoksida (M(OR)z), dimana R menunjukkan gugus alkil (CnH2n+1). Logam alkoksida banyak digunakan karena sifatnya yang mudah bereaksi dengan air.
II.5.1 Tahapan Proses Sol Gel
Metoda sol gel sendiri meliputi hidrolisis, kondensasi, pematangan, dan pengeringan. Proses tersebut akan dibahas satu persatu pada subbab berikut.
A. Hidrolisis
Pada tahap pertama logam prekursor (alkoksida) dilarutkan dalam alkohol dan terhidrolisis dengan penambahan air pada kondisi asam, netral atau basa menghasilkan sol koloid. Hidrolisis menggantikan ligan (-OR) dengan gugus hidroksil (-OH) dengan reaksi sebagai berikut:
M(OR)z + H2O M(OR)(z-1)(OH) + ROH
Faktor yang sangat berpengaruh terhadap proses hidrolisis adalah rasio air/prekursor dan jenis katalis hidrolisis yang digunakan. Peningkatan rasio pelarut/prekursor akan meningkatkan reaksi hidrolisis yang mengakibatkan reaksi berlangsung cepat sehingga waktu gelasi lebih cepat.
Katalis yang digunakan pada proses hidrolisis adalah jenis katalis asam atau katalis basa, namun proses hidrolisis juga dapat berlangsung tanpa menggunakan katalis. Dengan adanya
katalis maka proses hidrolisis akan berlangsung lebih cepat dan konversi menjadi lebih tinggi.
B. Kondensasi
Pada tahapan ini terjadi proses transisi dari sol menjadi gel. Reaksi kondensasi melibatkan ligan hidroksil untuk menghasilkan polimer dengan ikatan M-O-M. Pada berbagai kasus, reaksi ini juga menghasilkan produk samping berupa air atau alkohol dengan persamaan reaksi secara umum adalah sebagai berikut:
M-OH + HO-M M-O-M + H2O (kondensasi air)
M-OR + HO-M M-O-M + R-OH (kondensasi alkohol) C. Pematangan (Ageing)
Setelah reaksi hidrolisis dan kondensasi, dilanjutkan dengan proses pematangan gel yang terbentuk. Proses ini lebih dikenal dengan proses ageing . Pada proses pematangan ini, terjadi reaksi pembentukan jaringan gel yang lebih kaku, kuat, dan menyusut didalam larutan.
D. Pengeringan
Tahapan terakhir adalah proses penguapan larutan dan cairan yang tidak diinginkan untuk mendapatkan struktur sol gel yang memiliki luas permukaan yang tinggi.
II.6 Metode Volumetri
Analisa volumetri merupakan bagian dari kimia analisa kuantitatif, di mana penentuan zat dilakukan dengan jalan pengukuran volume larutan atau berat zat yang diketahui konsentrasinya, yang dibutuhkan untuk bereaksi secara kuantitatif dengan larutan zat yang dibutuhkan.
Dalam volumetri, penentuan dilakukan dengan jalan titrasi yaitu, suatu proses di mana larutan baku (dalam bentuk larutan yang telah diketahui konsentrasinya) ditambahkan sedikit demi sedikit dari sebuah buret pada larutan yang ditentukan atau yang dititrasi sampai keduanya bereaksi sampai sempurna dan mencapai jumlah equivalen larutan baku sama dengan nol equivalen larutan yang dititrasi dan titik titrasi ini dinamakan titik equivalen atau titik akhir titrasi.
larutan yang dititrasi dengan larutan baku telah berlangsung sempurna, maka indikator harus memberikan perubahan visual yang jelas pada larutan (misalnya dengan adanya perubahan warna atau pembentukan endapan). Titik pada saat indikator memberikan perubahan disebut titik akhir titrasi dan pada saat itu titrasi harus dihentikan.
Dalam volumetri dikenal 2 macam larutan baku, yaitu baku primer dan baku sekunder. A. Baku Primer
Yaitu larutan dimana kadarnya dapat diketahui secara langsung, karena diperoleh dari hasil penimbangan. Pada umumnya kadarnya dapat dinyatakan dalam N (mol.Equivalen/L) atau M
(mol/L). Contoh larutan baku primer adalah : NaCl, asam oksalat, Natrium Oksalat. B. Baku Sekunder
Yaitu larutan dimana konsentrasinya ditentukan dengan jalan pembekuan, dengan larutan baku primer atau dengan metode gravimetri yang tepat. Contoh : NaOH (dibakukan dengan primer asam oksalat).
II.7 Fourier Transform Infra Red (FTIR)
Salah satu hasil kemajuan instrumentasi IR adalah pemrosesan data seperti Fourier Transform Infra Red (FTIR). Teknik ini memberikan informasi dalam hal kimia, seperti struktur dan konformasional pada polimer dan polipaduan, perubahan induksi tekanan dan reaksi kimia. Dalam teknik ini padatan diuji dengan cara merefleksikan sinar infra merah yang melalui tempat kristal sehingga terjadi kontak dengan permukaan cuplikan. Degradasi atau induksi oleh oksidasi, panas, maupun cahaya, dapat diikuti dengan cepat melalui infra merah. Sensitivitas FTIR adalah 80-200 kali lebih tinggi dari instrumentasi dispersi standar karena resolusinya lebih tinggi(Kroschwitz,1990).
Spektroskopi digunakan untuk maksud identifikasi daerah inframerah dalam pekerjaan kuantitatif. Daerah tengah inframerah diabsorbsi dalam kisaran frekuensi antara 400
–
4000 cm-1. Sampel yang biasa digunakan adalah dalam bentuk film tipis, dan dalam bentuk ion monokromatik yang tak terabsorbsi dalam inframerah. Gugus fungsi seperti rantaihidrokarbon, gugus karboksi dan rantai polioksietilen terabsorbsi pada frekuensi tertentu. Spektra inframerah dapat diperoleh hanya dalam beberapa menit dan dapat menghasilkan banyak sekali informasi tentang tipetipe gugus yang ada, tetapi tidak dapat menjelaskan apakah dua gugus yang berada ada dalam molekul yang sama atau berbeda. Alat ini dengan resolusi rendah cukup memadai untuk pekerjaan finger print (Albertson, 1995).
II.8 Furnace
Furnace merupakan suatu alat yang digunakan untuk pemanasan. Berasal dari bahasa latin yaitu fornax yang memiliki arti pemanas. Pertama kali ditemukan di Balakot, peradaban lembah Indus (2500
–
1900 SM), digunakan untuk pemanasan keramik. Dalam era modern, perkembangan teknologi furnace semakin pesat seiring dengan bertambahnya waktu. Penggunaan furnace sebagai alat untuk pemanas tidak lagi menggunakan sistem konvensional. Saat ini telah ditemukan dan dikembangkan penggunaan furnace dengan menggunakan sistem elektris dengan berbagai kelebihan yang dimiliki. Seperti penggunaan temperatur yang tinggi dalam waktu singkat, temperatur dapat diatur sesuai kebutuhan, kerugian akibat penguapan udara panas sangat kecil, serta pengaturan kestabilan temperatur yanglebih baik. Furnace memiliki tingkat derajat temperatur yang tinggi, dalam pemanasan cetakan emas yaitu sekitar 1200oC.BAB III
METODA PENELITIAN
III.1 Alat
Seperangkat alat spektometer serapan atom merk Perkin elmer 5100, Seperangkan alat FTIR merk Termonicolet Avatar 360, Tungku pembakaran(Muffle Furnace) merk Ucida IMF 72, Pengaduk magnet (stirer) merk Eyela, Teflon, Oven merk Eyla WFO-450 ND, Neraca analit merk AND HF 300, Ayakan ukuran 200 mesh“Fisher”, Pemanas listrik (hot plate), Shaker, Pemusing (sentrifuse), Ball pipet, Pompa vakum, Alat-alat dari plastik dan alat pendukung lain.
III.2 Bahan
Abu Bagasse, NaOH p.a Merck, H2SO4 p.a Merck, HCl p.a Merck, CH3COOH p.a Merck, C6H8O7 . H2O p.a Merck, Larutan induk Cu(II), KOH p.a Merck, Akuademineralisata, Na2B4O7 . H2O p.a Merck, Indikator PP, Indikator MO, kertas saring Whatman No. 42.
III.3 Prosedur Penelitian
III.3.1 Pengabuan dan pencucian
Sampel bagasse yang berasal dari Pabrik Gula Madukismo Yogyakarta dibakar dan dihasilkan arang bagasse kemudian arang bagasse ditimbang dan diabukan dalam muffle furnace pada temperatur 700 ºC selama 4 jam menggunakan krus porselin. Setelah itu
dimasukkan ke dalam desikator dan ditimbang. Abu bagasse tersebut kemudian digerus menggunakan mortar dan diayak menggunakan ayakan 200 mesh. Sebanyak 25 gram abu halus tersebut kemudian dicuci dengan 150 ml larutan HCl 0,1 M melalui pengadukan selama 1 jam dan didiamkan selama semalam kemudian disaring menggunakan kertas pH Universal Merck. Abu bagasse yang telah dicuci tersebut kemudian disaring menggunakan kertas saring Whatman No.42 dan dibilas dengan akuademineralisata hingga netral setelah itu dicek menggunakan kertas pH Universal Merck. Abu bagasse yang telah dicuci tersebut kemudian dikeringkan dalam oven pada temperature 110ºC selama 2 jam. Abu bagasse
kering tersebut ditimbang dan sebanyak 0,1 gram abu tersebut dikarakterisasi gugus fungsionalnya menggunakan alat FTIR.
III.3.2 Preparasi Larutan Natrium Silikat (Na2SiO3)
Sebanyak 6 gram abu bagasse kering yang telah dicuci, dilebur menggunakan 200 mL larutan NaOH 1M sambil diaduk sampai mendidih selama 1 jam kemudian didiamkan selama 18 jam. Larutan Natrium Silikat yang terbentuk disaring men ggunakan kertas saring
Whatman No.42.
III.3.3 Pembuatan Silika Gel
Sebanyak 20 mL larutan natrium silikat ditempatkan dalam wadah plastik dan ditambahkan H2SO4 3 M setetes demi tetes sambil diaduk dengan pengaduk magnet sehingga terbentuk gel dan diteruskan hingga pH 7 kemudian didiamkan selama 1 malam. Kemudian gel yang terbentuk disaring dengan kertas saring Whatman No.42 dan dilakukan pencucian dengan akuademineralisata sampai bersifat netral. Lalu dikeringkan dalam oven pada temperatur 120ºC selama 2 jam. Silika gel kemudian digerus menggunakan mortar dan diayak menggunakan ayakan 200 mesh. Prosedur diulang untuk asam klorida, asam asetat, dan asam sianida. Setelah itu silika gel dikarakterisasi gugus fungsionalnya menggunakan FTIR dan dibandingkan dengan spektra IR pada Kiesel Gel 60G Merck.
III.3.4 Penentuan Keasaman Silika Gel
Keasaman silika gel hasil sintesis dalam penelitian ini ditentukan dengan metode volumetri. Metode volumetri dilakukan dengan cara merendam 0,1 gram silika gel dalam 15 mL larutan NaOH 0,1 M (telah distandarisasi) selama 24 jam. Silika gel dipisahkan dari campuran dengan cara didekantir. Larutan NaOH yang telah bereaksi dengan silika gel dititrasi dengan larutan standar H2SO4 0,1 M (telah distandarisasi) menggunakan indikator fenolftalein. Keasaman satu gram sampel diperoleh dari selisih jumlah mmol NaOH awal dengan mmol NaOH setelah perendaman selama 24 jam. Penentuan keasaman ini dilakukan pada silika gel hasil sintesis dengan variasi jenis asam serta silika Kiesel gel 60G buatan
III.3.5 Penentuan Kadar Air Silika Gel
Sebanyak 0,1 gram silika gel dipanaskan dalam oven pada temperatur 100ºC selama 4 jam kemudian didinginkan dan ditimbang. Setelah itu, dipijarkan dalam muffle furnance pada
temperatur 600ºC selama 2 jam. Sampel kemudian didinginkan dan ditimbang kembali. Kadar air dihitung dengan mengurangkan berat silika gel sebelum pemijaran (sesudah pemanasan pada suhu 100ºC selama 4 jam) dengan berat silika gel setelah pemijaran dibagi berat silika gel awal dikali 100%. Penentuan kadar air ini dilakukan pada silika gel hasil
sintesis serta Kiesel gel 60G buatan Merck secara triplo.
III.3.6 Adsorpsi Ion Logam Cu(II)
Sebanyak 250 mg silika gel diinteraksikan dengan larutan Cu(II) 10 ppm dalam botol film gelap, kemudian diaduk dalam alat shaker selama 90 menit. Selanjutnya disentrifuse dengan kecepatan 2000 rpm selama 30 menit. Silika gel dan fitrat didekantir, filtrat yang diperoleh dianalisis konsentrasi ion Cu (II) dengan menggunakan SSA. Sedangkan endapan yang diperoleh dikarakterisasi dengan FTIR. Adsorpsi ini dilakukan pada silika gel hasil sintesis dengan variasi jenis asam serta Kiesel gel 60G buatan Merck secara triplo.
III.3.7 Teknik Analisis Data
Data yang diperoleh dalam penelitian ini dianalisis, yang meliputi:
1. Menghitung Keasaman silika gel
–
–
Dimana NaOH sisa ekivalen dengan mmol H2SO4 yang digunakan.
2. Menentukan Kadar Air Silika gel
–
Nilai x pada SiO2 . x H2O dihitung dengan rumus sebagai berikut :
3. Menghitung Daya Jerap dan Efesiensi Penjerapan Silika Gel terhadap ion logam Cu(II) Keterangan:
D = daya adsorpsi (daya jerap) (mg/g)
C0 = konsentrasi ion logam Cu mula-mula (ppm)
C1 = konsentrasi ion logam Cu setelah proses adsorpsi (ppm) V = volume ion logam Cu (L)
m = massa silika gel (g)
Ep = efisiensi adsorpsi (efisiensi penjerapan)
4. Pengukuran larutan standard dan larutan supernatan
a. Pengukuran absorbansi dari larutan ion logam Cu(II)
b. Mengukur absorbansi dari larutan supernatan dengan AAS c. Membuat grafik antara Konsentrasi (C) Vs Absorbansi (A)
d. Menentukan persamaan yang terbentuk dalam bentuk persamaanY= a + bX
BAB IV
HASIL PENELITIAN DAN PEMBAHASAN
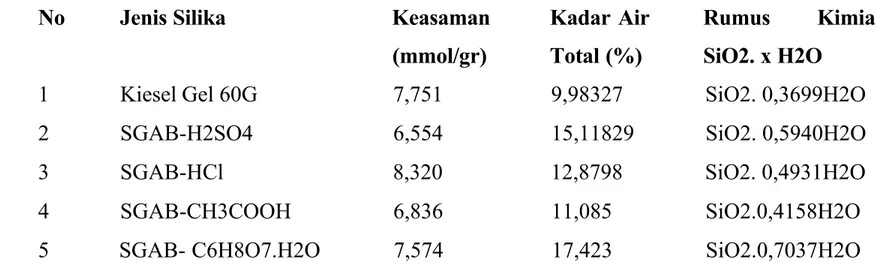
Penelitian ini bertujuan untuk mengetahui daya adsorpsi serta efisiensi adsorpsi silika gel dari abu bagasse terhadap ion logam Cu(II). Silika gel yang dihasilkan berwarna putih keras, dan halus. Kemudian dilakukan karakterisasi dan dibandingkan dengan karakterisasi silika gel pembanding yaitu Kisel gel 60G buatan E-Merck. Karakter silika gel yang dipelajari meliputi keasaman, kadar air, spektra infra merah (IR), daya adsorpsi silika gel serta efisiensi adsorpsi terhadap ion logam Cu(II). Dari uji kadar air dari silika gel maka akan didapatkan rumus kimia dari silika gel hasil sintesis dan pembandingnya. Keasaman dan kadar air dari silika gel hasil sintesis dan kiesel gel 60G dapat dilihat pada Tabel 1.
Tabel 1. Data Keasaman, Kadar Air dan Rumus Kimia SGAB Hasil Sintesis dan Pembanding
No Jenis Silika Keasaman
(mmol/gr)
Kadar Air Total (%)
Rumus Kimia
SiO2. x H2O
1 Kiesel Gel 60G 7,751 9,98327 SiO2. 0,3699H2O 2 SGAB-H2SO4 6,554 15,11829 SiO2. 0,5940H2O 3 SGAB-HCl 8,320 12,8798 SiO2. 0,4931H2O 4 SGAB-CH3COOH 6,836 11,085 SiO2.0,4158H2O 5 SGAB- C6H8O7.H2O 7,574 17,423 SiO2.0,7037H2O
Menurut Nuryono dkk (2005: 205), partikel silika gel dapat dipandang sebagai asam padatan karena memiliki gugus pada permukaan yang dapat dipandang terionisasi
menghasilkan proton dan partikel bermuatan negatif. Penentuan keasaman silika gel dalam penelitian ini dilakukan secara volumetri. Pengujian keasaman silika gel bertujuan untuk mengetahui kemampuan silika gel hasil sintesis dengan larutan asam klorida, asam sulfat, asam asam asetat dan asam sitrat masing-masing 3M dibandingkan dengan kiesel gel 60G dengan menggunakan metode volumetri yang dilakukan dengan titrasi.
Pada penelitian ini 0,1 gram silika gel hasil sintesis dan kiesel gel 60G direndam dalam 15 mL larutan NaOH 0,1 M (yang telah distandarisasi) selama 24 jam agar terjadi interaksi
antara ion OH- dari larutan NaOH dengan gugus Si-OH dari silika gel. Reaksi yang terjadi saat perendaman dimungkinkan sebagai berikut:
Si
–
OH (aq) + OH- (aq)→Si–
O- (aq) + H2O (l)Tahap selanjutnya campuran larutan NaOH dengan silika gel hasil sintesis didekantir sehingga menghasilkan larutan NaOH sisa. Larutan NaOH sisa dititrasi dengan larutan HCl 0,1 M (yang telah distandarisasi menjadi 0,0907 M dapat dilihat pada lampiran). Pada tahap ini terjadi reaksi penetralan H+ dari larutan HCl yang terbentuk oleh ion
–
OH dari larutan NaOH dengan reaksi sebagai berikut:H+ (aq) + -OH (aq)→H2O (l)
Semakin besar jumlah silanol yang dimiliki oleh silika gel maka kemampuanya untuk mendonorkan proton semakin besar sehingga keasamanya semakin meningkat. Dengan demikian peningkatan keasaman silika gel hasil sintesis diperkirakan berasal dari peningkatan jumlah gugus silanol yang disebabkan oleh meningkatnya ion H+ yang
digunakan pada pembuatan silika gel.
Keasaman diperoleh dari selisih mmol NaOH awal dengan mmol NaOH setelah perendaman dengan silika gel hasil sintesis selama 24 jam. Nilai keasaman silika gel hasil sintesis yang paling mendekati nilai keasaman kiesel Gel 60G yaitu nilai keasaman dari silika gel hasil sintesis dengan larutan asam sitrat 3M. Sedangkan keasaman yang paling tinggi dimiliki oleh silika gel dengan asam klorida 3M. Hal ini disebabkan karena pada asam klorida memiliki kadar asam yang paling tinggi. Semakin tinggi nilai keasaman maka semakin banyak jumlah silanol (Si-OH) yang telah dimiliki oleh silika gel sehingga kemampuan untuk mendonorkan proton semakin besar.
Dari hasil kadar keasaman SGAB-HCl, SGAB-CH3COOH, dan SGAB-C6H8O7.H2O yang hampir sama dengan Kiesel Gel 60G sehingga dapat dikatakan bahwa SGAB-HCl, SGAB-CH3COOH, SGAB-C6H8O7.H2O memiliki karakter yang hampir mirip dengan Kiesel Gel 60G. Karakterisasi silika gel dengan spektrofotometer infra merah bertujuan untuk mengetahui adanya gugus silanol (Si-OH), siloksan (Si-O-Si), gugus S-H dan gugus-gugus lain. Sebelum menganalisis spekta infra merah dari silika gel hasil sintesis sebelumnya dilakukan analisis spektra dari abu bagasse sebelum dan setelah pencucian diperoleh grafik
sintesis (SGAB-HCl, SGAB-H2SO4,SGAB-CH3COOH, dan SGAB-C6H8O7.H2O dapat dilihat dalam Gambar 2 (a,b,c,d,e).
Proses karakterisasi abu bagasse sebelum dan sesudah pencucian bertujuan untuk mengetahui pergeseran daerah hasil serapan antara gugus silanol (Si-OH), siloksan (Si-O-Si), gugus S-H dan gugus-gugus lain. Dari hasil karakterisasi dengan spektrofotometer infra merah didapatkan bahwa abu bagasse sebelum dan sesudah pencucian terlihat bahwa serapan karakteristik pada pita dengan bilangan gelombang masing-masing 3468,11 cm-1 dan 3462,41 cm-1 yang menunjukkan vibrasi regangan gugus
–
OH dari Si-OH. Pada bilangan gelombang 1641,20 cm-1 dan 1641,18 cm-1 masing-masing abu bagasse sebelum dan sesudah pencucian menunjukkan vibrasi bengkokan gugus–
OH dari Si-OH. Pita serapan pada bilangan gelombang 1092,41 cm-1 dan 1084,57 cm-1 menunjukkan vibrasi regangangugus Si
–
O dari Si-O-Si. Pita serapan pada bilangan gelombang 473,80 1 dan 474,38 cm-1 merupakan vibrasi bengkokan dari Si-O-Si dari masing-masing abu bagasse sebelum dan sesudah pencucian.Data spektrum dari abu bagasse sesudah pencucian menunjukkan adanya kenaikan intensitas pita serapan dibandingkan dengan intensitas sebelum pencucuian. Sedangkan pada bilangan gelombang dari abu bagasse sesudah pencucian menunjukkan adanya sedikit penurunan dari pada abu bagasse sebelum pencucian. Hasil spektra IR abu bagasse sebelum pencucian terdapat pita serapan di daerah 3857.65; 3717.44; 1462.07; 790.42; dan 619.11 cm-1 pada spektra IR abu bagasse sesudah pencucian pita serapan tersebut hilang. Pita serapan tersebut dimungkinkan gugus pengotor yang larut dalam larutan HCl 0,1 M.
Berdasarkan hasil spektra inframerah pada silika gel hasil sintesis dengan variasi asam kuat, spektra yang dihasilkan hampir mirip dengan kiesel gel 60G sebagai pembanding. Pada masing-masing pita serapan Kiesel-Gel 60G dan silika gel hasil sintesis (HCl, SGAB-H2SO4 dan SGAB- CH3COOH, dan SGAB-C6H8O7.H2O) menunjukkan serapan yang melebar di daerah 3469,34 cm-1 ; 3458,07 cm-1; 3466,91 cm-1 dan 3467,45 cm-1 yang menunjukkan vibrasi rentangan gugus
–
OH dari Si-OH. Adanya gugus–
OH dipertegas dengan adanya puncak pada spektra inframerah pada bilangan gelombang 1636,03 cm-1; 1638,80 cm-1; 1639,40 cm-1 dan 1637,39 cm-1 yang menunjukkan adanya bengkokan pada gugus–
OH dari Si-OH. Pada serapan 1111,12 cm-1; 1053,09 cm-1; 1066,99 cm-1 dan 1040,51 cm-1 yang menunjukkan vibrasi regangan Si–
O dari Si-O-Si. Pita serapan yang mendukung keberadaan ikatan Si-O muncul pada bilangan gelombang 602,31 cm-1, tetapi pada SGAB-HCl tidak terdapat serapan pada daerah ini, sedangkan untuk SGAB-H2SO4mempunyai serapan 670,91 cm-1 yang menunjukkan regangan asimetri Si-O-Si. Ketidak munculan pita serapan disebabkan karena intensitas pada pita serapan tersebut terlalu lemah sehingga tidak dapat terbaca pada spektrum IR. Pita serapan yang lain pada 471,50 cm-1; 460,51 cm-1; 476,82 cm-1; dan 456,78 cm-1 yang menunjukkan vibrasi bengkokan dari Si-O-Si (Hardjono S, 1991:102).
Secara umum silika gel hasil sintesis memberikan pola spektra infra merah yang mirip dengan pola spektra infra merah kiesel gel 60G buatan Merck setelah proses adsorpsi ion logam Cu(II). Kemiripan tersebut menunjukkan bahwa silika gel hasil sintesis memiliki kemiripan gugus-gugus fungsional dengan kiesel gel 60G buatan Merck.
Data kadar air dapat digunakan untuk penentuan rumus kimia silika gel yang dihasilkan dengan asumsi bahwa silika hanya terdiri dari SiO2 dan H2O. Rumus kimia Kiesel Gel 60 adalah SiO2. 0,3699H2O sedangkan untuk kadar air SGAB-HCl, SGAB-H2SO4 masing-masing adalah SiO2. 0,4931H2O, SiO2. 0,5940H2O, sehingga silika gel hasil sintesis yang memiliki kadar air mendekati dengan kiesel gel 60G adalah silika gel hasil sintesis SGAB-HCl 3M. Semakin banyak gugus silanolnya maka kemampuan mengikat molekul air melalui ikatan hidrogen juga semakin banyak. Molekul air dapat teradsorbsi pada permukaan silika gel dalam berbagai bentuk yang dapat dilihat pada Gambar 3 (Scoot, R. P. W., 1993: 8).
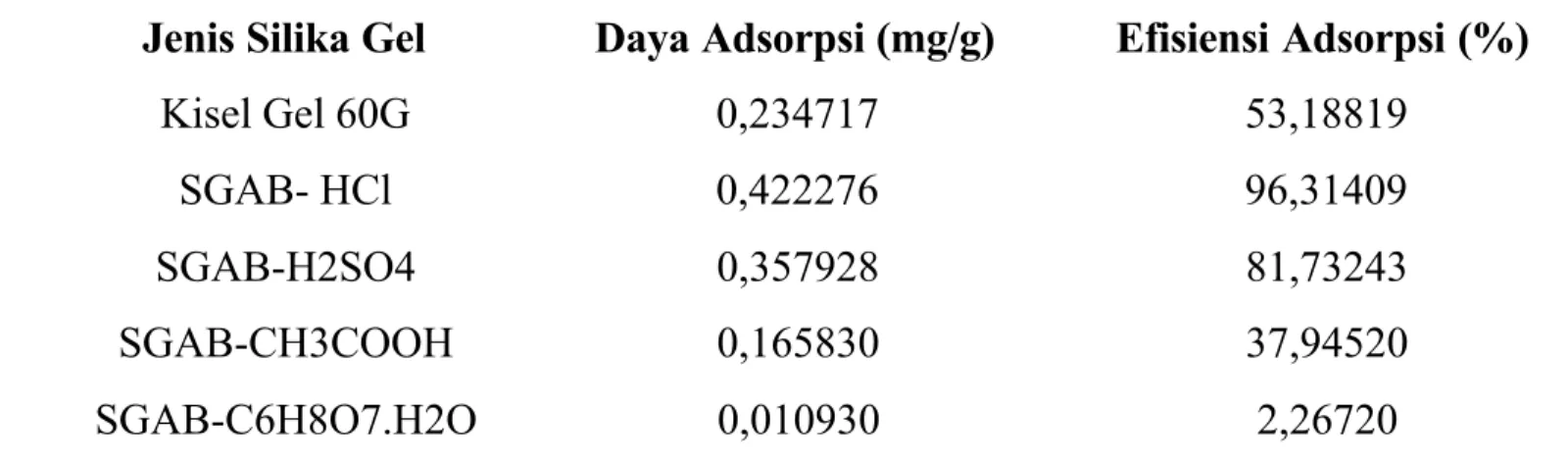
Data hasil perhitungan daya adsorpsi dan efisiensi adsorpsi silika gel terhadap ion logan Cu(II) dapat dilihat pada Tabel 2.
Tabel 2. Daya Adsorpsi dan Efisiensi Adsorpsi Silika Gel Terhadap Ion logam Cu(II)
Jenis Silika Gel Daya Adsorpsi (mg/g) Efisiensi Adsorpsi (%)
Kisel Gel 60G 0,234717 53,18819
SGAB- HCl 0,422276 96,31409
SGAB-H2SO4 0,357928 81,73243
SGAB-CH3COOH 0,165830 37,94520 SGAB-C6H8O7.H2O 0,010930 2,26720
Daya adsorpsi silika gel hasil sintesis terhadap ion logam Cu(II) yang paling mendekati kiesel gel 60G adalah silika gel sintesis dengan asam asetat 3M dan dipertegas dengan spektra inframerah untuk mengetahui pergeseran pita-pita serapan sebelum dan sesudah adsorpsi.
Menurut Oscik (1982) yang menyatakan bahwa kesetimbangan adsorpsi ion logam pada berbagai adsorben umumnya tercapai setelah kurang lebih satu menit kemudian diendapkan dengan alat sentrifuse selama 30 menit dengan kecepatan 2000 rpm. Hal ini dimaksudkan agar pengendapan lebih maksimal. Silika yang dihasilkan kemudian dianalisis menggunakan spektroskopi serapan atom untuk mengetahui logam yang tidak teradsorpsi. Silika gel yang digunakan adalah kiesel gel 60G sebagai pembanding, silika gel hasil sintesis SGAB-CH3COOH, dan SGAB- C6H8O7.H2O. Pada masing-masing silika gel dikontakkan dengan larutan ion logam Cu(II) untuk mengetahui pengaruh asam yang berbeda pada sintesis silika gel terhadap daya adsorpsi serta efisiensi adsorpsi silika gel terhadap Cu( II).
Berdasarkan data pada Tabel 3, terlihat bahwa silika gel hasil sintesis memiliki daya adsorpsi yang hampir sama dengan kiesel gel 60G buatan E-Merck, kecuali pada C6H8O7.H2O hasil yang didapatkan kurang baik. Hal ini dimungkinkan SGAB-C6H8O7.H2O kurang berpotensi jika digunakan sebagai adsorben karena tingkat asam yang terlalu tinggi. Asam sitrat (C6H8O7.H2O) merupakan asam lemah yang memiliki kadar keasaman yang cukup tinggi sehingga jika digunakan untuk silika gel hasilnya kurang baik. Keasaman asam sitrat terdapat tiga gugus karboksil COOH yang dapat melepas proton dalam larutan maka ion yang dihasilkan adalah ion sitrat. Ion sitrat dapat bereaksi dengan
pengkhelat sehingga digunakan sebagai pengawet dan penghilang kesadahan air. Asam sitrat bersifat sebagai chelating agent atau senyawa pembentuk kompleks. Chelating Agent adalah
senyawa yang dapat mengikat ion logam bervalensi dua atau lebih seperti Mn, Fe, Cu, Ni, Mg, dsb yang merupakan katalisator dalam proses oksidasi. Proses pembentukan senyawa kompleks terjadi karena adanya reaksi antara ion logam yang dinamakan ion inti dengan ion atau molekul yang disebut ligan dalam membentuk kompleks ion logam dan ligan yang berikatan melalui ikatan koordinat kovalen dimana donor elektron berasal dari ligan. Oleh
karena itu senyawa-senyawa yang mempunyai dua atau lebih gugus fungsional seperti
–
OH, -SH, -COOH dapat mengkhelat logam. Muatan senyawa kompleks ini dapat bermuatan positif, negatif atau pun netral (Winarno, 1991).Menurut Kirck & Othmer (1985), penggunaan senyawa pembentuk kompleks sebagai pengikat ion logam adalah untuk mengurangi aktivitas ion-ion logam di dalam produk dapat
menghilangkan ion-ion logam yang membentuk endapan yang tidak diinginkan dan mengurangi sifat racun dari logam berat seperti Pb, Hg, Zn, Cu, Ni, dsb. Berdasarkan sifat dari asam sitrat diatas didapatkan bahwa asam sitrat memang kurang cocok jika digunakan sebagai adsorben silika gel dikarenakan terjadinya pembentukkan senyawa kompleks dan memiliki gugus fungsional
–
COOH yang dapat mengkhelat logam.BAB V PENUTUP V.1 Kesimpulan
Berdasarkan hasil penelitian dapat diambil kesimpulan sebagai berikut:
1. Silika gel dapat disintesis dari abu bagasse yang berasal dari pabrik gula Madukismo Yogyakarta dengan menggunakan metode sol-gel. Hasil karakterisasi menunjukkan bahwa silika gel hasil sintesis dengan asam klorida, asam sulfat, asam asetat, dan asam sitrat 3M mempunyai nilai keasaman berturut-turut sebesar 8,320; 6,554; 6,836 dan 7,574 mmol/g. Sedangkan kadar air masing-masing 12,880; 15,118; 11,085 dan 17,423%. Hasil karakterisasi gugus fungsi dengan spektroskopi infra merah menunjukkan bahwa silika gel hasil sintesis mempunyai kemiripan dengan kiesel gel 60G.
2. Jenis asam kuat dan lemah yang digunakan dalam sintesis mempunyai nilai daya adsorpsi dan efisiensi adsorpsi ion logam tembaga(II) yang berbeda.
3. Daya adsorpsi dan efisiensi adsorpsi terhadap ion logam tembaga(II) optimal diperoleh pada SGAB- HCl.
V.2 Saran
Berdasarkan penelitian yang telah dilakukan, maka penulis memberikan saran sebagai berikut:
1. Perlu dilakukan pengembangan lebih lanjut tentang pembuatan silika gel dari bahan baku yang lain selain abu bagasse.
2. Perlu dilakukan pengembangan lebih lanjut tentang sifat adsorptif silika gel dengan jenis logam yang berbeda.