RESPON TANGGAP KEBAL BEBEK TERHADAP
VAKSIN AI H5N1 MONOVALEN (CLADE 2.3.2) DAN
VAKSIN AI H5N1 BIVALEN (CLADE 2.1.3 DAN CLADE 2.3.2)
AHMAD MUSTOFA
FAKULTAS KEDOKTERAN HEWAN INSTITUT PERTANIAN BOGOR
BOGOR 2014
PERNYATAAN MENGENAI SKRIPSI DAN
SUMBER INFORMASI SERTA PELIMPAHAN HAK CIPTA
Dengan ini saya menyatakan bahwa skripsi berjudul “Respon Tanggap Kebal Bebek terhadap Vaksin AI H5N1 Monovalen (Clade 2.3.2) dan Vaksin AI H5N1 Bivalen (Clade 2.1.3 dan Clade 2.3.2)” adalah benar karya saya dengan arahan dari dosen pembimbing dan belum diajukan dalam bentuk apa pun kepada perguruan tinggi mana pun. Sumber informasi yang berasal atau dikutip dari karya yang diterbitkan maupun tidak diterbitkan dari penulis lain telah disebutkan dalam teks dan dicantumkan dalam daftar pustaka di bagian akhir skripsi ini.
Dengan ini saya melimpahkan hak cipta dari karya tulis saya kepada Institut Pertanian Bogor.
Bogor, Agustus 2014 Ahmad Mustofa NIM B04100121
ABSTRAK
AHMAD MUSTOFA. Respon Tanggap Kebal Bebek terhadap Vaksin AI H5N1 Monovalen (Clade 2.3.2) dan Vaksin AI H5N1 Bivalen (Clade 2.1.3 dan Clade 2.3.2). Dibimbing oleh RETNO DAMAYANTI SOEJOEDONO dan NI LUH PUTU IKA MAYASARI
Bebek merupakan salah satu unggas air yang dikenal sebagai reservoir virus Avian Influenza (AI). Bebek yang terinfeksi tidak memperlihatkan gejala klinis dan memiliki titer antibodi yang rendah. Tujuan dari penelitian ini adalah mengetahui titer antibodi bebek yang divaksinasi menggunakan vaksin monovalen dan bivalen. Sembilan puluh bebek dibagi menjadi 3 kelompok dan setiap kelompok berisi 30 ekor. Kelompok pertama adalah bebek yang divaksinasi dengan AI H5N1 monovalen (clade 2.3.2), kelompok kedua adalah bebek yang divaksinasi dengan AI H5N1 bivalen (clade 2.1.3 dan 2.3.2), dan ketiga adalah kontrol. Vaksinasi dilakukan pada hari ke-10 dan 31. Sepuluh sampel serum dari masing-masing kelompok dikoleksi pada hari ke-17, 21, 28, 31, 38 dan 42 dilanjutkan dengan uji Hemaglutinasi Inhibisi. Hasil penelitian menunjukkan bahwa vaksin monovalen dapat menginduksi titer antibodi yang lebih tinggi dari pada vaksin bivalen pada bebek.
Kata kunci: bebek, hemaglutinasi inhibisi, vaksin, monovalen, bivalen.
ABSTRACT
AHMAD MUSTOFA. Immune Response of Duck against AI H5N1 Monovalent Vaccine (Clade 2.3.2.) and AI H5N1 Bivalent Vaccine (Clade 2.1.3 and Clade 2.3.2). Supervised by RETNO DAMAYANTI SOEJOEDONO and NI LUH PUTU IKA MAYASARI
Duck is one of waterfowl which is known as a reservoir of Avian Influenza (AI) virus. Infected ducks show asymptomatic sign of AI and low antibody titer. The aim of this research was to determine the antibody titer of ducks post vaccination. Ninety ducks were divided into 3 groups and each group contains 30 ducks. The first group was AI H5N1 monovalent (clade 2.3.2) vaccinated ducks, second group was AI H5N1 bivalent (clade 2.1.3 and 2.3.2) vaccinated ducks, and third was control. Vaccination was performed on day 10 and 31. Ten serum samples of each group were collected on day 17, 21, 28, 31, 38 and 42 followed by Haemagglutination Inhibition Test. The result showed that monovalent vaccine induced higher of antibody titer than bivalent vaccine in ducks.
RESPON TANGGAP KEBAL BEBEK TERHADAP
VAKSIN AI H5N1 MONOVALEN (CLADE 2.3.2) DAN
VAKSIN AI H5N1 BIVALEN (CLADE 2.1.3 DAN CLADE 2.3.2)
Skripsi
sebagai salah satu syarat untuk memperoleh gelar Sarjana Kedokteran Hewan
pada
Fakultas Kedokteran Hewan
FAKULTAS KEDOKTERAN HEWAN INSTITUT PERTANIAN BOGOR
BOGOR 2014
Judul Skripsi : Respon Tanggap Kebal Bebek terhadap Vaksin AI H5N1 Monovalen (Clade 2.3.2) dan Vaksin AI H5N1 Bivalen (Clade 2.1.3 dan Clade 2.3.2)
Nama : Ahmad Mustofa NIM : B04100121
Diketahui oleh
Drh Agus Setiyono, MS, PhD, APVet Wakil Dekan
Tanggal Lulus :
Disetujui oleh
Prof Dr Drh Retno D Soejoedono, MS Dosen Pembimbing I
Dr Drh Ni Luh Putu Ika Mayasari Dosen Pembimbing II
PRAKATA
Puji dan syukur penulis panjatkan kehadirat Allah Subhanahu Wa Ta’ala atas segala nikmat dan karuniaNya sehingga penulis dapat menyelesaikan skripsi yang berjudul “Respon Tanggap Kebal Bebek terhadap Vaksin AI H5N1 Monovalen (Clade 2.3.2) dan Vaksin AI H5N1 Bivalen (Clade 2.1.3 dan Clade 2.3.2)”. Ucapan terimakasih juga penulis sampaikan kepada semua pihak yang telah membantu baik secara langsung maupun secara tidak langsung khususnya kepada: 1. Prof Dr Drh Retno D Soejoedono MS selaku dosen pembimbing I yang selalu
memberikan pengarahan kepada penulis
2. Dr Drh Ni Luh Putu Ika Mayasari selaku dosen pembimbing II yang telah memberikan dukungan, motivasi sarana dan prasarana penelitian, waktu, tenaga, dan arahan selama penelitian dan penulisan.
3. Bapak Bayu Febram, M.Si. Apt selaku dosen pembimbing akademik yang telah membimbing selama menuntut ilmu di FKH.
4. Mamak Kasmi, Bapak Sartono, Adik Sitti Nurkhasanah, beserta seluruh keluarga tercinta atas doa, dorongan, motivasi tiada henti baik berupa material maupun spiritual.
5. Pak Nur, Pak Lukman, Mas Wahyu, Mba Ade, dan Mba Selyn yang telah membantu dalam penelitian.
6. Dedek Haryanto sebagai rekan kerja penelitian.
7. Saras, Laras, Rizka umi, Fahmi, Faris beserta kolega Acromion 47 yang selalu dihati
8. Sahabat Senior Resident angkatan 49 dan 50 yang selalu menginspirasi.
Semoga skripsi ini dapat bermanfaat bagi ilmu pengetahuan. Saran dan kritik yang bersifat membangun sangat penulis harapkan.
Bogor, Agustus 2014 Ahmad Mustofa
DAFTAR ISI
ABSTRAK i
HALAMAN JUDUL ii
HALAMAN PENGESAHAN iii
PRAKATA iv
DAFTAR ISI v
DAFTAR TABEL, GAMBAR, DAN LAMPIRAN vi
PENDAHULUAN 1
Perumusan Masalah 2
Tujuan Penelitian 2
TINJAUAN PUSTAKA 2
Sistem Kekebalan pada Unggas 2
Avian Influenza 3
Vaksin 5
MATERI DAN METODE 5
MATERI 5
Waktu dan Tempat Penelitian 5
Bahan Uji Laboratorium 6
Hewan Percobaan 6
Pakan dan Air Minum 6
Kandang dan Perlengkapannya 6
Alat 6
METODE 6
Vaksinasi 7
Penyediaan Sel Darah Merah 5% 7
Koleksi Serum 7
Uji Hemaglutinasi 7
Uji Hemaglutinasi Inhibisi 7
Penghitungan Rataan Titer Antibodi 8
Prosedur Analisis Data 8
HASIL DAN PEMBAHASAN 9
SIMPULAN DAN SARAN 13
DAFTAR PUSTAKA 13
LAMPIRAN 17
DAFTAR TABEL
1. Rataan titer antibodi bebek kelompok monovalen dan kelompok bivalen dengan antigen AI H5N1 clade 2.1.3
9 2. Rataan titer antibodi bebek kelompok monovalen dan kelompok bivalen dengan
antigen AI H5N1 clade 2.3.2
10
DAFTAR GAMBAR
1. Rataan titer antibodi bebek kelompok monovalen dan kelompok bivalen dengan antigen AI H5N1 clade 2.1.3
10 2. Rataan titer antibodi bebek kelompok monovalen dan kelompok bivalen dengan
antigen AI H5N1 clade 2.3.2
11 3. Rataan titer antibodi bebek kelompok monovalen dengan antigen penguji AI
H5N1 clade 2.1.3 dan clade 2.3.2
12 4. Rataan titer antibodi bebek kelompok bivalen dengan antigen penguji AI H5N1
clade 2.1.3 dan clade 2.3.2
12
DAFTAR LAMPIRAN
1. Jadwal Penelitian 17
PENDAHULUAN
Tubuh makhluk hidup mempunyai mekanisme yang berperan melakukan perlawanan terhadap mikroorganisme asing (antigen) yang masuk ke dalam tubuh. Peran pertahanan ini dilakukan oleh sistem imun yang memproduksi antibodi.
Antibodi merupakan protein (immunoglobulin) yang dihasilkan oleh tubuh sebagai respon terhadap masuknya antigen. Antibodi dapat mengenali dan mengikat antigen secara spesifik. Antigen adalah suatu senyawa atau substansi yang dapat menggertak sistem imun pada individu. Setiap antigen memiliki daerah spesifik yang disebut dengan determinant antigenic atau epitop. Bagian ini dapat dikenali oleh antibodi (Radji 2010).
Virus Avian Influenza (AI) merupakan salah satu virus yang dapat menyebabkan penyakit menular dari hewan ke manusia atau sebaliknya yang dikenal dengan zoonosis (Dharmayanti et al. 2005). Virus Influenza terdiri atas tiga tipe A, B, dan C. Perbedaan dari ketiga virus tersebut berdasarkan karakter protein M dari amplop virus dan nukleoprotein virus. Salah satu dari ketiga genera ini, tipe A, dapat menginfeksi berbagai hewan piaraan seperti ayam, itik, kalkun, burung puyuh, babi dan kuda. Virus tipe ini menyerang unggas dengan menginfeksi saluran pencernaan dan pernapasan (Fenner et al. 1995; Murphy et al. 2006). Virus AI tidak menyebabkan penyakit yang nyata pada unggas air (asymptomatic), titer antibodi sangat rendah terhadap virus AI, serta tidak memiliki sialic acid (sialiloligosacarida) pada dinding permukaan sel tubuhnya. Hal ini sesuai dengan Charlton (1996), Cardona (2005), WHO (2005), dan Dharmayanti et al. (2006) yang menyatakan bahwa unggas air juga sebagai reservoir alami virus AI.
Menurut Tumpey et al. (2003), Chen et al. (2004), dan Suarez et al. (2004), virus AI lebih banyak dideteksi pada unggas air dibandingkan dengan ayam kampung. Virus AI tersebut tidak menyebabkan penyakit yang nyata pada unggas air, namun virus AI pada unggas air dapat menjadi sumber penyebaran penyakit AI yang efektif sehingga dapat bertahan lama di alam (Stephenson dan Zanbon 2002; Kementan 2005)
Salah satu cara yang digunakan untuk melindungi tubuh terhadap paparan penyakit adalah vaksinasi. Vaksinasi merupakan tindakan yang dengan sengaja memasukkan agen penyakit yang berupa suspensi, substansi atau toksin mikroorganisme yang sudah dimatikan atau dilemahkan ke dalam tubuh hewan sehat agar merangsang pembentukan daya tahan atau daya kebal tubuh terhadap suatu penyakit tertentu, bersifat aman, serta tidak menimbulkan penyakit (Radji 2010; Akoso 2006).
Vaksin monovalen pernah digunakan pada tahun 2009 di Amerika Serikat untuk mencegah wabah dari virus flu babi H1N1 (Bateman et al. 2013). Penggunaan vaksin bivalen pernah digunakan pada manusia untuk mencegah Human Papiloma Virus (HPV). Kombinasi vaksin yang digunakan adalah vaksin inaktif HPV 16 dengan HPV 18. Vaksin bivalen tersebut berhasil merangsang antibodi terhadap salah satu dari ke dua antigen homolog dari tipe virus tersebut (Safeian et al. 2013). Menurut Uraki et al. (2013) penggunaan vaksin bivalen efektif digunakan karena mempunyai kemungkinan mendeteksi antigen homolog yang sesuai terhadap infeksi virus.
2
Perumusan Masalah
Bebek merupakan reservoir alami virus Avian Influenza. Berdasarkan hal tersebut ingin diketahui respon tanggap kebal bebek terhadap vaksin monovalen dan vaksin bivalen serta perbedaan respon tanggap kebal bebek antara vaksin monovalen dan vaksin bivalen.
Tujuan Penelitian
Penelitian ini bertujuan mengetahui respon tanggap kebal bebek terhadap vaksin monovalen dan vaksin bivalen serta mengetahui perbedaan respon tanggap kebal bebek terhadap pemberian vaksin monovalen dan vaksin bivalen.
Manfaat Penelitian
Penelitian yang telah dilakukan diharapkan mampu memberikan informasi tentang respon tanggap kebal bebek terhadap pemberian vaksin AI H5N1 monovalen (clade 2.3.2) dan bivalen (clade 2.1.3 dan 2.3.2).
TINJAUAN PUSTAKA
Sistem Kekebalan pada Unggas
Bebek berasal dari kingdom animalia, filum chordata, subfilum vertebrata, kelas aves, ordo anseriformes (Swartzentrover 2008). Bebek merupakan salah satu ternak yang berpotensi sebagai reservoir dalam penyebaran virus AI (Laudert et al. 1993; Sturm-Ramirez et al. 2004). Virus AI lebih banyak dideteksi pada unggas air dibandingkan dengan ayam (Tumpey et al. 2003; Chen et al. 2004; Suarez et al. 2004). Virus AI tersebut tidak menyebabkan penyakit yang nyata pada unggas air, namun unggas air dapat menjadi sumber penyebaran virus AI yang efektif sehingga dapat bertahan lama di alam (Stephenson dan Zanbon 2002; Kementan 2005).
Secara umum sistem kekebalan pada unggas tidak berbeda jauh dengan sistem kekebalan pada manusia dan mamalia. Unggas memiliki dua organ limfoid primer, yaitu timus dan bursa Fabricius. Bursa Fabricius berfungsi sebagai tempat pematangan dan diferensiasi bagi sel B (Tizard 2004). Unggas yang baru menetas memiliki antibodi asal induk. Penghambatan respon pembentukan antibodi oleh antibodi asal induk berlangsung sampai antibodi tersebut habis, yaitu sekitar 10 sampai 20 hari setelah menetas (Tizard 2004).
Antibodi merupakan protein (immunoglobulin) yang dihasilkan oleh tubuh sebagai respon terhadap masuknya antigen. Antibodi dapat mengenali dan
3 mengikat antigen secara spesifik. Terdapat 5 kelas utama immunoglobulin dalam serum, yaitu IgG, IgA, IgM, IgD dan IgE. Struktur dasar immunoglobulin terdiri atas 2 rantai berat (H-chain) identik dan 2 rantai ringan (L-chain) yang juga identik. Setiap rantai ringan terikat pada rantai berat melalui ikatan disulfida (S – S). Fragmen antigen binding (Fab), berfungsi mengikat antigen, oleh karena itu susunan asam amino di bagian ini berbeda antara molekul immunoglobulin satu dengan yang lain dan bervariasi sesuai dengan variabilitas antigen yang merangsang pembentukannya. Sebaliknya, constant region merupakan bagian dari antibodi yang konstan. Bagian ini tidak mempunyai kemampuan mengikat antigen tetapi dapat bersifat sebagai antigen (determinant antigenic). Bagian ini merupakan efektor sekunder dan menjadi tempat untuk melekat pada sel, serta fiksasi komplemen (Black 2011).
Antigen (antibody generating substances) adalah suatu senyawa atau substansi yang dapat menggertak sistem imun pada inang atau individu. Antigen dapat berupa polisakarida, protein, lemak, asam inti atau lipopolisakarida, maupun lipoprotein (Guyton dan Hall 2007). Setiap antigen memiliki daerah spesifik yang disebut dengan determinant antigenic atau epitop. Bagian ini dapat dikenali oleh antibodi (Radji 2010).
Antigen yang masuk ke dalam tubuh sebagai benda asing akan mendapatkan respon kekebalan. Materi yang telah diketahui sebagai bahan asing, kemudian oleh makrofag disampaikan ke sel limfosit melalui pembentukan berbagai sitokin ke sistem pembentuk antibodi atau ke sistem kebal berperantara sel. Sistem kekebalan ini menyimpan “ingatan” sehingga pada paparan berikutnya dengan antigen yang sama, respon yang ditimbulkan akan jauh lebih efisien (Tizard 2004). Antibodi bekerja melalui dua cara yang berbeda untuk mempertahankan tubuh terhadap agen penyakit yaitu: (1) dengan cara langsung menginaktivasi agen penyebab penyakit, (2) dengan mengaktifkan sistem komplemen yang akan menghancurkan agen penyakit tersebut (Hartati 2005).
Avian Influenza
Virus AI merupakan salah satu virus yang dapat menyebabkan penyakit menular dari hewan ke manusia atau sebaliknya yang dikenal dengan zoonosis (Dharmayanti et al. 2005). Virus AI merupakan virus RNA, yaitu Orthomyxovirus tipe A dari famili Orthomyxoviridae. Virus Influenza terdiri dari tiga tipe A, B, dan C. Perbedaan dari ketiga virus tersebut berdasarkan pada karakter protein M dari amplop virus dan nukleoprotein virus. Ketiga genera ini, tipe A dapat menginfeksi hewan piaraan seperti ayam, itik, kalkun, burung puyuh, babi dan kuda. Virus tipe ini menyerang unggas dengan menginfeksi saluran pencernaan dan pernapasan (Fener et al. 1995; Murphy et al 2006). Penyakit ini menjadi isu global pada saat ditemukan di manusia pada 1997 di Hongkong. Penyakit ini menyebabkan 18 orang dirawat di rumah sakit dan 6 orang diantaranya meninggal dunia pada awal terjadinya (WHO 2005). Hingga saat ini kasus yang ada di Indonesia mencapai 193 kasus dengan kematian mencapai 161 (WHO 2013)
Virion dari virus Influenza tipe A adalah bulat diameter 100 nm, terdapat delapan senyawa genom, lima diantaranya merupakan genom yang berstruktur
4
sedangkan tiga lainnya merupakan protein virus struktural yang berkaitan dengan enzim RNA polymerase. Protein terbanyak adalah protein matriks (M1). Protein ini tersusun dari banyak monomer kecil yang serupa. Monomer ini terikat dengan permukaan bagian dalam dari lapisan ganda lemak amplopnya (envelope). Protein M2 adalah protein kecil yang menonjol sebagai pori-pori atau kanal ion yang melalui membran. Virus ini mempunyai dua antigen permukaan yang disebut haemaglutinin (HA) dan neuraminidase (NA). Antigen ini merupakan molekul glikoprotein. Molekul HA berbentuk trimer batang, sedangkan molekul NA tetramer bentuk seperti jamur. Kedua antigen ini digunakan sebagai penanda dalam identifikasi subtipe virus karena membawa epitope khusus (Fenner et al. 1995).
Virus Influenza tipe A mempunyai 18 antigen H (hemaglutinin) yaitu H1– H18 dan 11 antigen NA (neuraminidase) yaitu N1–N11 (Tong 2013). Kombinasi antigen HA dan NA akan menghasilkan lebih dari 144 kombinasi subtipe virus AI, seperti H5N1, H7N9 dan kombinasi lainnya. Diantara 18 subtipe virus AI hanya H5 dan H7 yang bersifat ganas (virulen) pada unggas (Tong 2013). Berdasar pada tingkat keganasannya virus Influenza ini digolongkan menjadi dua yaitu Highly Pathogenic Avian Influenza (HPAI) dan Low Pathogenic Avian Influenza (LPAI) (Dharmayanti et al. 2006; Soejoedono dan Handharyani 2005; Akoso 2006).
Virus Influenza yang menyebar di kawasan Asia merupakan keturunan dari virus AI tipe A (H5N1) yang dibagi menjadi dua clades antigenic. Clade satu meliputi isolat manusia dan burung dari Vietnam, Thailand, Kamboja, Laos dan Malaysia, sedangkan clade dua pertama kali diidentifikasi pada isolat burung dari Cina, Indonesia, Jepang, dan Korea Selatan (WHO 2005).
Virus AI mempunyai kemampuan untuk menghindar dari respon humoral hospes melalui fenomena antigenic drift. Mutasi protein akan mengarah pada perubahan asam amino glikoprotein permukaan HA (Plotkin dan Dushoff 2003). Antigenic drift adalah perubahan secara periodik akibat mutasi genetik struktur protein permukaan virus AI sehingga antibodi yang terbentuk oleh tubuh akibat vaksinasi sebelumnya tidak dapat mengenali keberadaan virus tersebut (Munch et al. 2001). Selain itu virus juga mampu menghindari respon imun bawaan dan dapatan dengan reasorsi melalui fenomena antigenic shift (Coleman 2007)
Menurut Soejoedono dan Handharyani (2005) salah satu sifat virus AI adalah dapat mengaglutinasi sel darah merah unggas dan ditemukan pada dinding pembuluh darah inang. Virus juga peka terhadap lingkungan panas (50 °C, 30 menit), pH yang ekstrim (pH 3), kondisi nonisotonik, udara kering, relatif tidak tahan terhadap inaktivasi pelarut lemak seperti deterjen, selain itu virus juga dapat diinaktivasi dengan larutan ammonium 25%, LISOL 1–2%, kresol 0.1% dan formalin 20%. Virus Influenza mampu bertahan di lingkungan dengan suhu ruang selama tujuh hari dan di dalam feses pada 4 °C selama 30–35 hari. Berdasarkan analisis genetik dari virus ini terdapat tiga clade yang berbeda beserta penyebarannya. Clade 2.1.3 beredar di Vietnam dan Kamboja, clade 2.2 beredar di India, Bangladesh dan Mesir serta clade 2.3.2 beredar di negara-negara Asia meliputi China, Hongkong, Korea,Vietnam dan Laos (WHO 2013; ECDGH 2012).
Gejala klinis yang bisa diamati dari unggas terinfeksi virus AI adalah anoreksia, emisiasi, depresi, produksi telur menurun, sesak napas yang disertai
5 dengan eksudat yang keluar dari hidung, edema daerah wajah, konjungtivitis, jengger dan pial berwarna kebiruan. Beberapa tempat di bawah kulit mengalami perdarahan seperti tungkai dan apabila dilakukan pemeriksaan lebih lanjut terlihat adanya peradangan pada langit-langit mulut, trakea, dan laring. Pemeriksaan histopatologi terlihat adanya akumulasi sel-sel radang (limfosit) pada jengger ayam yang terinfeksi (Soejoedono dan Handharyani 2005).
Vaksin
Kata vaksin berasal dari bahasa latin vacca (sapi) dan vaccinia (cacar sapi). Vaksin merupakan bahan yang berasal dari mikroorganisme tertentu, yang dapat merangsang pembentukan kekebalan terhadap penyakit yang disebabkan oleh mikroorganisme tersebut (Malole 1988).
Vaksin dibedakan menjadi dua yaitu vaksin aktif dan vaksin inaktif. Vaksin aktif merupakan vaksin hidup yang mengandung mikroorganisme yang telah dilemahkan virulensinya (atenuasi), sedangkan vaksin inaktif adalah vaksin yang terkandung virus yang sudah mati melalui proses inaktivasi. Virus yang terkandung dalam vaksin inaktif telah kehilangan sifat infektifnya, namun antigenitasnya masih dipertahankan untuk menginduksi sistem kekebalan tubuh (Fenner et al. 1995).
Vaksin monovalen merupakan vaksin dengan antigen yang telah dilemahkan dari strain virus Influenza yang memiliki karakteristik yang sama untuk menanggulangi wabah serta dikombinasikan dengan adjuvan minyak dalam air, minyak emulsi, sterol serta tocopherol. Vaksin ini terdapat satu strain virus AI (Hanon dan Stephenne 2009). Vaksin bivalen adalah vaksin yang terdiri atas dua strain virus AI, sebagai contoh strain pertama memiliki hemaglutinin subtipe H5 maka strain kedua menggunakan hemaglutinin subtipe H7 dan salah satunya memiliki neuraminidase subtipe N4 atau neuraminidase N1 (Kumar dan Duran 2009).
MATERI DAN METODE
MATERI
Waktu dan Tempat Penelitian
Penelitian ini dilaksanakan dari Juli 2013 sampai dengan Maret 2014 bertempat di kandang hewan coba Fakultas Kedokteran Hewan Institut Pertanian Bogor (FKH IPB) dan Laboratorium Terpadu bagian Mikrobiologi Medik, Departemen Ilmu Penyakit Hewan dan Kesehatan Masyarakat Veteriner FKH IPB.
6
Bahan Uji di Laboratorium
Vaksin AI H5N1 monovalen (clade 2.3.2), vaksin AI H5N1 bivalen (clade 2.1.3 dan 2.3.2), antigen AI H5N1 clade 2.3.2, antigen AI H5N1 clade 2.1.3, alkohol 70%, Phosphate Buffer Saline 1× pH 7.2 (PBS), suspensi sel darah merah (SDM) 5%, virus antigen standar 4 HAU, serum kebal AI dan SDM 1%
Hewan Percobaan
Hewan yang digunakan dalam penelitian ini adalah bebek umur satu hari, day old duck (DOD) sebanyak 90 ekor tanpa pemberian vaksin AI sebelumnya. Bebek tersebut dibagi menjadi tiga kelompok. Setiap kelompok terdiri atas 30 ekor. Kelompok A diberikan vaksin monovalen, kelompok B diberikan vaksin bivalen, serta satu kelompok lagi sebagai kontrol. Kelompok kontrol digunakan sebagai acuan terhadap pengaruh pemberian vaksin monovalen dan vaksin bivalen.
Pakan dan Air Minum
Pakan yang diberikan adalah pakan konsentrat komersial diberikan setiap pagi dan sore. Air minum untuk hewan tersedia ad libitum.
Kandang dan Perlengkapannya
Penelitian ini menggunakan tiga kandang dengan ukuran 1×3 m terbuat dari tripleks serta dibatasi dengan kawat ram yang beralaskan sekam padi. Tempat minum dan tempat pakan dibersihkan setiap harinya. Kandang juga dilengkapi dengan lampu listrik.
Alat
Alat yang digunakan dalam penelitian ini adalah pelat mikro, spuit, tabung reaksi, sentrifus, dan tabung mikro.
METODE
VaksinasiVaksinasi dalam penelitian ini dilaksanakan sesuai jadwal yang tercantum pada Lampiran I. Vaksinasi dilakukan dua kali selama proses penelitian. Vaksinasi pertama pada saat bebek berumur 10 hari dengan dosis 0.2 mL/ekor secara subkutan dan vaksinasi kedua pada umur 31 hari dengan dosis 0.5 mL/ekor secara intramuskular. Pemeriksaan titer antibodi setelah vaksinasi dilakukan pada hari ke-17, 21, 28, 31, 38 dan 42.
7 Penyediaan Sel Darah Merah 5%
Darah utuh diambil dari ayam donor, ditambahkan antikoagulan Natrium Sitrat 3.8% dengan perbandingan 4:1, kemudian disentrifugasi selama 10–15 menit dengan kecepatan 1500–2000 rpm. Supernatan yang terbentuk dibuang, sedangkan endapannya dibilas dengan PBS kemudian disetrifugasi kembali. Proses ini dilakukan sebanyak tiga kali hingga terbentuk SDM murni, selanjutnya diencerkan menjadi 5%. Sel darah merah 5% diencerkan menjadi 1% untuk Uji Hemaglutinasi (HA) dan Uji Hemaglutinasi Inhibisi (HI).
Koleksi Serum
Koleksi serum darah maternal antibodi dilakukan pada bebek umur 1 hari. Koleksi serum selanjutnya dilakukan pada hari ke-17, 21, 28, 31, 38 dan 42 setelah vaksinasi (Lampiran I). Setiap 10 ekor bebek diambil secara acak pada masing-masing kandang untuk dikoleksi serum kemudian dilanjutkan dengan uji HI.
Pengambilan darah dari jantung untuk DOD dan dari vena brachialis atau vena axilaris untuk bebek yang berumur lebih dari 10 hari. Spuit yang berisi darah bebek diletakkan secara mendatar untuk memperluas bidang permukaan serta dibiarkan pada suhu ruang hingga darah membeku secara sempurna. Serum darah yang terbentuk dipisahkan ke dalam tabung mikro 1.5 mL dan diberi label serta disimpan pada suhu -20 °C.
Uji Hemaglutinasi
Uji Hemaglutinasi dilakukan dengan menggunakan pelat mikro berdasar V. Sebanyak 25 μL PBS dimasukkan ke dalam sumur A2 sampai A12. Sebanyak 50 μL antigen dimasukkan ke dalam sumur A1, kemudian 25 μL antigen dipindahkan dari sumur A1 ke sumur A2 dan dihomogenkan. Prosedur yang sama dilakukan pada sumur A3 sampai sumur A11. Sebanyak 25 μL SDM 1% ditambahkan ke semua sumur dan digoyang agar semua komponen yang dimasukkan homogen. Pelat mikro kemudian dibiarkan selama 30 menit pada suhu ruang (25 °C). Pengamatan dilakukan ketika kontrol negatif (A12) telah mengendap. Pembacaan dilakukan pada sumur yang menampakkan terjadinya aglutinasi sempurna. Titer HA unit dihitung berdasarkan pengenceran tertinggi yang memperlihatkan aglutinasi sempurna (OIE 2008).
Uji Hemaglutinasi Inhibisi
Sebanyak 25 μL PBS dimasukkan ke semua sumur pada pelat mikro dengan dasar V. Sumur pada kolom pertama diisi 25 μL serum dan diencerkan bertingkat kelipatan dua sampai sumur ke-12. Sebanyak 25 μL antigen (4 HAU) dimasukkan ke dalam semua sumur, kemudian dihomogenkan 10–15 detik dan diinkubasi pada suhu ruangan selama 15 menit atau 4 °C selama 45 menit. Sebanyak 25 μL suspensi SDM 1% ditambahkan ke dalam semua sumur, pelat mikro digoyang-goyangkan agar homogen kemudian diinkubasi pada suhu ruang selama 30 menit. Hasil uji HI positif ditandai dengan adanya endapan pada dasar
8
pelat mikro, tidak ada aglutinasi. Titer HI dihitung berdasarkan pengenceran tertinggi serum darah berikatan dengan isolat virus yang dapat mengendapkan SDM 1% (OIE 2008).
Penghitungan Rataan Titer Antibodi
Rataan titer antibodi dapat dihitung dengan menggunakan Geometric Mean Titre (GMT) dengan rumus:
Keterangan:
N : jumlah contoh serum yang diamati
t : titer antibodi pada pengenceran tertinggi (yang masih dapat menghambat aglutinasi sel darah merah)
S : jumlah contoh serum yang bertiter t n : titer antibodi pada sampel ke-n
Prosedur Analisis Data
Data yang diperoleh dianalisis secara deskriptif menggunakan perangkat lunak MS Exel 2007 dengan metode analisis statistika Analysis of Variance (ANOVA): single factor. dengan selang kepercayaan 95% dan dilanjutkan dengan uji Duncan apabila nilai p<0.05.
9
HASIL DAN PEMBAHASAN
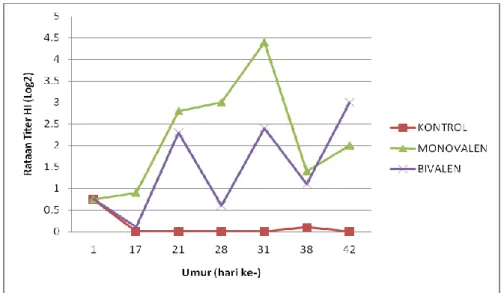
Perbandingan Rataan Titer Antibodi Bebek Kelompok Monovalen dan Kelompok Bivalen dengan Antigen AI H5N1 Clade 2.1.3
Hasil penelitian berupa rataan titer antibodi bebek sebagai respon terhadap vaksin monovalen dan vaksin bivalen dengan antigen uji AI H5N1 clade 2.1.3 disajikan pada Tabel 1.
Tabel 1 Rataan titer antibodi bebek kelompok monovalen dan kelompok bivalen dengan antigen AI H5N1 clade 2.1.3
Umur
(hari ke-) Kontrol Monovalen Bivalen
1 0.625a 0.625a 0.625a 17 0a 0.6a 0a 21 0a 2.8a 2.5a 28 0a 0.33a 0a 31 0.5a 1.8a 0a 38 0a 0.6a 0a 42 0a 1.4a 0a
Huruf superscript yang berbeda (a,b) pada baris yang sama menunjukkan hasil yang berbeda nyata (p<0.05)
Vaksin monovalen mengandung virus AI H5N1 clade 2.3.2 dan vaksin bivalen mengandung virus AI H5N1 clade 2.1.3 dan 2.3.2. Serum yang berasal dari kelompok bebek yang divaksinasi menggunakan vaksin monovalen diuji dengan antigen heterolog (clade 2.1.3) menunjukkan hasil yang lebih tinggi dari kelompok serum dengan vaksin bivalen (Tabel 1, Gambar 1). Hal ini terjadi karena adanya reaksi silang pada vaksin yang memiliki kesamaan jenis protein H terhadap antigen yang digunakan dalam uji HI (Lee et al. 2006). Adanya dua antigen berbeda yang terdapat pada vaksin bivalen akan memacu reaksi imun yang bersifat kompetitif terhadap antibodi yang dihasilkan. Berdasarkan analisis data yang dilakukan tidak terdapat perbedaan secara nyata (p>0.05) respon titer antibodi bebek yang divaksinasi dengan vaksin monovalen bila dibandingkan dengan kelompok bivalen (Tabel 1) dengan menggunakan antigen penguji AI H5N1 clade 2.1.3.
10
Gambar 1 Rataan titer antibodi bebek kelompok monovalen dan kelompok bivalen dengan antigen AI H5N1 clade 2.1.3
Perbandingan Titer Antibodi Bebek Kelompok Monovalen dan Kelompok Bivalen dengan Antigen AI H5N1 Clade 2.3.2
Hasil penelitian berupa rataan titer antibodi bebek sebagai respon terhadap vaksin monovalen dan vaksin bivalen dengan antigen uji AI H5N1 clade 2.3.2 disajikan pada Tabel 2.
Tabel 2 Rataan titer antibodi bebek kelompok monovalen dan kelompok bivalen dengan antigen AI H5N1 clade 2.3.2
Umur
(Hari ke-) Kontrol Monovalen Bivalen
1 0.75a 0.75a 0.75a 17 0b 0.9a 0.1a 21 0b 2.8a 2.3a 28 0b 3a 0.6a 31 0b 4.4a 2.4a 38 0.1b 1.4a 1.1a 42 0b 2a 3a
Huruf superscript yang berbeda (a,b) pada baris yang sama menunjukkan hasil yang berbeda nyata (p<0.05)
Serum yang berasal dari kelompok bebek yang divaksinasi menggunakan vaksin monovalen diuji dengan antigen homolognya (clade 2.3.2) menunjukkan hasil yang lebih tinggi dari serum vaksin bivalen (clade 2.1.3 dan 2.3.2) (Tabel 2, Gambar 2). Hal ini terjadi karena adanya kecocokan terhadap protein permukaan antigen pada vaksin yang dimasukkan dengan protein permukaan antigen pada pengujian yang dilakukan (homolog) (Safeian et al. 2013, Lee et al. 2006). Respon titer antibodi vaksin bivalen lebih rendah daripada vaksin monovalen karena adanya reaksi silang antara protein pada antibodi terhadap protein permukaan yang terdapat pada antigen uji yang digunakan (Lee et al. 2006). Uji
11 statistik memperlihatkan bahwa vaksin monovalen dan vaksin bivalen tidak berbeda nyata (p>0.05) pada pengujian HI dengan antigen AI H5N1 clade 2.3.2.
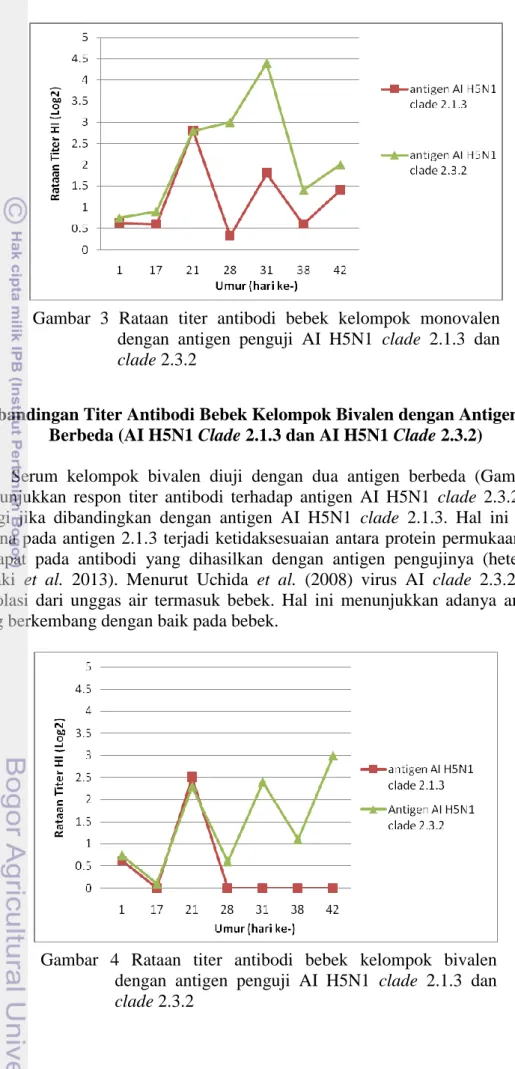
Perbandingan Titer Antibodi Bebek Kelompok Monovalen dengan Antigen yang Berbeda (AI H5N1 Clade 2.1.3 dan AI H5N1 Clade 2.3.2)
Serum yang berasal dari kelompok bebek yang divaksinasi menggunakan vaksin monovalen diuji dengan menggunakan dua antigen yang berbeda yaitu antigen AI H5N1 clade 2.1.3 dan AI H5N1 clade 2.3.2. Hasil pengujian (Gambar 3) dengan menggunakan antigen AI H5N1 clade 2.3.2, serum dari kelompok monovalen memiliki nilai titer antibodi yang tinggi dibandingkan dengan menggunakan antigen AI H5N1 clade 2.1.3. Hal ini terjadi karena adanya kecocokan (homolog) antara antibodi dengan antigen penguji yang digunakan ketika uji HI (Uraki et al.2013). Hal ini sesuai dengan penelitian yang dilakukan oleh Indriani et al. (2014) yang menyatakan bahwa titer antibodi yang diuji dengan menggunakan antigen homolog mempunyai hasil yang lebih tinggi jika dibandingkan dengan pengujian HI menggunakan antigen heterolog.
Gambar 2 Rataan titer antibodi bebek kelompok monovalen dan kelompok bivalen dengan antigen AI H5N1 clade 2.3.2
12
Perbandingan Titer Antibodi Bebek terhadap Vaksin Bivalen dengan Antigen yang Berbeda (AI H5N1 Clade 2.1.3 dan AI H5N1 Clade 2.3.2
Perbandingan Titer Antibodi Bebek Kelompok Bivalen dengan Antigen yang Berbeda (AI H5N1 Clade 2.1.3 dan AI H5N1 Clade 2.3.2)
Serum kelompok bivalen diuji dengan dua antigen berbeda (Gambar 4) menunjukkan respon titer antibodi terhadap antigen AI H5N1 clade 2.3.2 lebih tinggi jika dibandingkan dengan antigen AI H5N1 clade 2.1.3. Hal ini terjadi karena pada antigen 2.1.3 terjadi ketidaksesuaian antara protein permukaan yang terdapat pada antibodi yang dihasilkan dengan antigen pengujinya (heterolog) (Uraki et al. 2013). Menurut Uchida et al. (2008) virus AI clade 2.3.2 dapat diisolasi dari unggas air termasuk bebek. Hal ini menunjukkan adanya antibodi yang berkembang dengan baik pada bebek.
Gambar 4 Rataan titer antibodi bebek kelompok bivalen dengan antigen penguji AI H5N1 clade 2.1.3 dan clade 2.3.2
Gambar 3 Rataan titer antibodi bebek kelompok monovalen dengan antigen penguji AI H5N1 clade 2.1.3 dan clade 2.3.2
13 Vaksin monovalen memiliki kecenderungan lebih baik dalam menggertak respon tanggap kebal dari bebek jika dibandingkan dengan vaksin bivalen. Hal ini terjadi karena respon tubuh bebek yang bersifat spesifik yang disertai dengan tidak adanya reaksi kompetisi antar antigen vaksin dalam merespon sistem kekebalan bebek.
Apabila virus paparan lapang identik dengan virus vaksin monovalen, maka vaksin monovalen akan lebih efektif dalam menggertak respon tanggap kebal bebek, namun bila terjadi sebaliknya maka vaksin bivalen akan lebih baik dalam menggertak respon tanggap kebal bebek.
SIMPULAN DAN SARAN Simpulan
Berdasarkan data yang diperoleh dari penelitian ini dapat disimpulkan bahwa vaksin AI H5N1 monovalen (clade 2.3.2) menghasilkan respon tanggap kebal lebih baik dibandingkan dengan vaksin AI H5N1 bivalen (clade 2.1.3 dan 2.3.2) apabila virus paparan lapang identik dengan virus vaksin, namun apabila terjadi sebaliknya maka vaksin bivalen akan lebih baik dalam menggertak respon tanggap kebal bebek.
Saran
Perlu dilakukan penelitian lebih lanjut terkait potensi vaksin monovalen dan bivalen terhadap paparan virus lapang serta shedding virus dari masing-masing vaksin setelah vaksinasi.
DAFTAR PUSTAKA
Akoso BT. 2006. Waspada Flu Burung Penyakit Menular pada Hewan dan Manusia. Yogyakarta (ID): Kanisius.
Asmara W. 2007. Peran Biologi Molekuler dalam Pengendalian Avian Influenza dan Flu Burung. Di dalam: Pidato Pengukuhan Guru Besar FKH UGM[Internet].[12 Maret 2007 Yogyakarta].Yogyakarta (ID):UGM Press[diunduh pada 2014 Juli 8]Tersedia pada: http://www.lib.ugm.ac.id/digitasi/upload/1093_pp0911265.pdf
Bateman AC, Kieke BA, Irving SA, Meece JK, Shay DK, Belongia EA. 2013. Effectiveness of monovalent 2009 pandemic influenza A virus subtype H1N1 and 2010-2011 trivalent inactivated influenza vaccines in Wisconsin during the 2010-2011 influenza season. J Infect Dis.207(8):1262-9
Black JG. 2011. Microbiology: Principles and Explorations, 7th Edition. San Francisco (US): Willey
Cardona CJ. 2005. Low-Pathogenicity Avian Influenza A Outbreaks in Commercial Poultry in California. Washington (US): The National Academies Press.
14
Charlton. 1996. Avian Disease Manual. Ed IV. Pennysylvania(US): American Association of Avian Pathologists.
Chen HG, Deng Z, Li G. Tian G, Li Y , Jiao P , Zhang L , Liu Z, Webster RG, Yu K. 2004. The evolution of H5N1 influenza viruses in ducks in southern China. J Virol. 101(28):10452-10457.
Coleman JR. 2007. The PB1-F2 protein of Influenza A virus: Increasing pathogenecity by disrupting alveolar macrophages. J Virol. 4:1-5
Dharmayanti NLPI, Indriani R, Damayanti R, Wiyono A. 2005. Karakter virus avian influenza isolat Indonesia pada wabah gelombang ke dua. JITV. 10:217-225.
Dharmayanti NLPI, Indriani R dan Adjid RMA. 2006. Identifikasi virus avian influenza pada beberapa jenis unggas di taman margasatwa ragunan dan upaya eradikasinya. Med Kedr Hew. 2(2):79-83.
[ECDGH] European Commission Directorate-General for Health and Consumers (SC). Animal Disease Notification System. Annual report 2010 [Internet][diunduh pada 2014 Juli 6]. Tersedia di: http://ec.europa.eu/food/animal/diseases/adns/adns_report2010_en.pdf. Fenner FJ, Gibbs EPJ, Murphy FA, Root R, Studdert MJ, White DO. 1995.
Virologi Veteriner Edisi 2. Putra DKH, penerjemah. Semarang (ID): IKIP Pr. Terjemahan dari Veterinary Virology.
Guyton AC, Hall JE. 2007. Fisiologi Kedokteran Edisi ke-11. Irawati, penerjemah; Rachman LY, editor. Jakarta (ID): EGC. Terjemahan dari:
Textbook of Medical Physiology. Ed ke-11
Hanon EJ, Stephenne J. 2009. Influenza vaccine. Phildelphia (US): King of Prussia
Hartati Y. 2005. Respon kekebalan vaksin avian influenza inaktif pada ayam indukan pedaging strain Hubbard (studi kasus pada peternakan ayam indukan pedaging) [skripsi]. Bogor (ID): Fakultas Kedokteran Hewan, Institut Pertanian Bogor.
Indriani R, Dharmayanti NLPI, Adjid RMA. 2014. Efikasi penerapan vaksin AI H5N1 clade 2.1.3 pada itik Mojosari terhadap tantangan virus AI H5N1 clade 2.3.2 pada kondisi laboratorium. JITV. 19(1):59-66.
[Kementan] Kementerian Pertanian (ID). 2005. Buku pedoman dan Pencegahan
Flu Burung (Avian Influenza) pada Peternakan Unggas skala kecil. Buku Petunjuk Mengenai Avian Influenza. Jakarta (ID): Direktorat Jendral
Peternakan Kementerian Pertanian.
Kumar M, Duran JP. 2009. Multivalent Avian Influenza Vaccines and Methods. Wyeth (US): Madison.
Laudert E, Halvorson D, Sivanandan V, Shaw D. 1993. Comparative evaluation of tissue tropism caracterization in turkey and mallard ducks after intravenous inoculation of type a influenza viruses. J Av Dis. 37(3):773-780.
Lee CW, Senne DA, Suarez DL. 2006. Development and application of reference antisera against 15 haemaglutinin subtypes of avian influenza virus by dna vaccination of chicken. J Clin and Vac Immun.13:395-402.
15 Munch M, Nielsen LP, Handberg, Jorgensen PH. 2001. Detection and subtyping (H5 amd H7) of avian type A influenza virus by reverse transcriptionPCR and PCR ELISA. Arch Virol 145: 87-97Murphy FA, Gibbs EPJ, Horzinek MC, Studdert MJ. 2006. Veterinary Virology Third Edition. London (UK): Academic Pr.
Murphy FA, Gibbs EPJ, Horzinek MC, Studdert MJ. 2006. Veterinary Virology Third Edition. London (UK): Academic Pr.
[OIE] Office International des Epizooties World (FR). 2008. Manual OIE , Avian Influenza Chapter 2. 7.12. 2008
Plotkin JB, Dushoff J. 2003. Codon bias and frequency-dependent selection on the hemagglutinin epitopes of influenza A virus. Proc Natl Acad Sci USA 100:7152-7157
Radji M. 2010. Immunologi & Virologi veteriner. Jakarta (ID): ISFI
Safaeian M, Kemp TJ, Pan DY, Porras C, Rodriguez AC, Schiffman M, Cortes B, Katki H, Wacholder S, Schiller JT. 2013. Cross-protective vaccine efficacy of the bivalent HPV vaccine against HPV31 is associated with humoral immune responses: Results from the Costa Rica Vaccine Trial. J.vac: 9:1399 – 1406
Soejoedono RD, Handharyani E. 2005. Flu Burung. Jakarta (ID): Penebar Swadaya.
Stephenson I, Zambon M. 2002. The epidemoilogy of influenza. Occup. Med. 5:241-247
Sturm-Ramirez KM, Ellis T, Bousfield B, Bisset L, Dryting K, Rehg JE, Poon Y, Guan Y, Peiris M, Webster RG. 2004. Reemerging H5N1 influenza viruses in Hongkong in 2002 are highly pathogenic to ducks. J Virol. 78:4892-4901. Suarez DL, Perdue ML, Cox N, Rowe, Bender C, Huang J and Swayne DE. 2004. Comparisont of higly virulent H5N1 influenza a viruses isolated from humans and chickens from Hongkong. J Virol 72 (8):6678-6688
Swartzentrover R. 2008. Pekin Duck[Internet]. [diunduh pada 2014 Februari 9] tersediapada:http//www.swartzentrover.com/cotor/Photos/Hiking/Birds/Bird Pages/PekinDuck.htm
Tizard IR. 2004. Veterinary Immunology an Introduct Sixth Edition. Philadelphia (US): W.B Saunders Company.
Tong S, Zhu X, Yan L, Shi S, Zhang J, Bourgeois M, Yang H, Chen X, Sergio Recuenco, et al. 2013. New world bats harbor diverse influenza a viruses. J Ppat. 9(10):1003657
Tumpey TM, Suarez DL, Perkins LE, Senne DA, Lee YJ, Mo I, Swayne DE. 2003. Evolution of a high-pathogenicity H5N1 avian influenza a virus isolated from duck meat. J Av dis. 47:951-955.
Uchida Y, Mase M, Yoneda K, Kimura A, Obara T, Kumagai S, et al. 2008. Highly pathogenic avian influenza virus (H5N1) isolated from whooper swans, Japan. Emerg Infect Dis.14(9):1427.
Uraki R, Kiso M, Horimoto KI, Fukuyama S, Takashita S, Ozawa M, Kawaokaa Y. 2013. A novel bivalent vaccine based on a PB2-knockout influenza virus protects mice from pandemic H1N1 and highly pathogenic H5N1 virus challenges. J. Virol. 87(14):7874
16
[WHO]World Health Organization (IT). 2005. Measures to stop the spread of highly pathogenic bird flu at its source.[Internet].[diunduh pada 2013
Februari 12]. Tersedia pada: http://whg/ibdoc.who.int/wpro
/2005/stopthespread_eng.pdf
[WHO]World Health Organization (IT). 2013. Cumulative number of confirmed human cases of avian influenza (H5N1) reported to WHO. [Internet].[diunduh pada 2013 Agustus 9]. Tersedia pada: http//www.who.int/csr/disease/avia_influenza
17 LAMPIRAN I Jadwal Penelitian Hari ke Keterangan perlakuan
1 B1 90 DOD tiba di kandang, kemudian diambil darah intrakardial untuk dicek antibodi maternal sejumlah 20 DOD
7 Pemisahan dan penandaan untuk masing-masing vaksin (monovalen dan bivalen) 10 Vaksinasi sejumlah 60 DOD:
1. Vaksimune AIplus A (30 DOD) 0.2 mL SC 2. Vaksimune AIplus B (30 DOD) 0.2 mL SC
11-16 Pengamatan harian Pengamatan harian
17 B2 Pengambilan darah 10 ekor setiap grup vaksin Pengambilan darah 10 ekor setiap grup vaksin 21 B3 Pengambilan darah 10 ekor setiap grup vaksin Pengambilan darah 10 ekor setiap grup vaksin 28 B4 Pengambilan darah 10 ekor setiap grup vaksin Pengambilan darah 10 ekor setiap grup vaksin 31 B5 Pengambilan darah 10 ekor setiap grup vaksin
Vaksinasi kedua:
1. Vaksimune AIplus A (30 DOD) 0.5 mL IM. 2. Vaksimune AIplus B (30 DOD) 0.5 mL IM
Pengambilan darah 10 ekor setiap grup vaksin
32-38 Pengamatan harian Pengamatan harian
38 B6 Pengambilan darah 10 ekor setiap grup vaksin Pengambilan darah 10 ekor setiap grup vaksin
39-41 Pengamatan harian Pengamatan harian
42 B7 Pengambilan darah 10 ekor setiap grup vaksin Pengambilan darah 10 ekor setiap grup vaksin
Penelitian ini dilakukan dengan pemberian vaksin monovalen dan vaksin bivalen inaktif. Vaksinasi dilakukan dua kali selama proses penelitian. Vaksinasi pertama pada saat ayam berumur 10 hari dengan dosis 0.2 mL/ekor dengan rute pemberian subkutan dan vaksinasi kedua pada umur 31 hari dengan dosis 0.5 mL/ekor secara intramuskular. Sampel yang diambil sebanyak sepuluh ekor secara acak pada masing-masing kelompok bebek yang divaksin monovalen, vaksin bivalen maupun bebek kontrol. Serum diambil dan diukur titer antibodinya terhadap virus AI dengan uji HI dengan menggunakan antigen standar AI H5N1 clade 2.3.2 dan 2.1.3.
18
RIWAYAT HIDUP
Penulis dilahirkan di Bantul 17 Oktober 1991 dari ayah Sartono dan ibu Kasmi. Penulis merupakan anak pertama dari dua bersaudara. Penulis menamatkan pendidikan di SD Negeri Sorobayan pada tahun 2007 dan SMP Negeri 1 Sanden pada tahun 2007. Pada tahun 2010 penulis lulus dari SMA Negeri 1 Bantul dan di tahun yang sama penulis diterima di Fakultas Kedokteran Hewan Institut Pertanian Bogor melalui jalur Undangan Seleksi Masuk IPB (USMI) serta berkesempatan memperoleh Beasiswa Bidik Misi.
Selama masa perkuliahan, penulis pernah aktif di organisasi BEM TPB Kabinet Harmoni pada tahun 2011, LDK AlHurriyah 2011, DKM An-Nahl 2013, Himpro Satli serta Senior Resident di Asrama Putra TPB IPB hingga sekarang.