BAB 2
TINJAUAN PUSTAKA
2.1. Air Gambut
Lahan gambut merupakan salah satu lahan tropis yang lembab, yang memiliki lapisan senyawa organik yang berasal dari daun, batang dan semua bagian pohon maupun tumbuhan yang telah lapuk maupun belum. Seluruh isi dari lahan gambut ini merupakan akumulasi dari senyawa organik. (Salimin et al., 2010)
Air gambut adalah air permukaan yang banyak terdapat di daerah berawa maupun dataran rendah yang terhambat membusuk secara sempurna oleh kondisi asam dan anaerob terutama terdapat di Sumatera dan Kalimantan, yang mempunyai ciri-ciri sebagai berikut (Kusnaedi, 2006) :
1. Intensitas warna yang tinggi (berwarna merah kecoklatan) 2. pH yang rendah
3. Kandungan zat organik yang tinggi
4. Kekeruhan dan kandungan partikel tersuspensi yang rendah 5. Kandungan kation yang rendah
Kelima ciri yang telah disebutkan diatas ternyata mempunyai hubungan satu dengan lainnya. Derajat keasaman (pH) yang rendah juga disebabkan oleh kandungan kation yang rendah, adanya zat organik dalam bentuk asam, dan sedikitnya kation dan partikel tersuspensi. Hal ini menyebabkan berkurangnya proses koagulasi secara alami.
Air rawa umumnya memiliki warna coklat kehitaman. Hal ini disebabkan oleh adanya kandungan senyawa organik yang berasal dari proses dekomposisi rawa. Air rawa yang berwarna kehitaman ini terjadi karena adanya kontak antara air dengan beragam sampah organik, berupa dedaunan maupun kayu, yang mana tahap dekomposisinya juga berbeda – beda.
warna coklat kehitaman pada air rawa. Lahan gambut umumnya mempunyai tingkat kemasaman yang relatif tinggi dengan kisaran pH 3 - 5. (Gasim et al.,2007).
Asam humus merupakan senyawa organik heterogen yang memiliki berat molekul tinggi dan sulit untuk mengalami degradasi serta secara umum berwarna kuning hingga hitam. Warna ini akan semakin meningkat intensitasnya apabila terdapat logam besi yang terikat pada asam organik tersebut. (Stevenson, 1994).
Asam humus diklasifikasikan menjadi tiga fraksi utama berdasarkan kelarutan dan warnanya, yaitu :
1. Asam humat
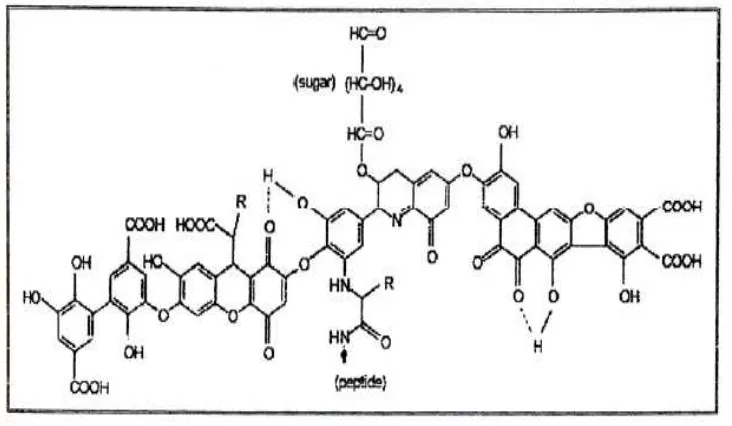
Asam humat memiliki berat molekul 10.000 hingga 100.000 g/mol. Senyawa ini dapat larut dalam basa dan tidak dapat larut dalam asam. Umumnya asam humat memiliki warna mulai dari coklat hingga abu – abu. Asam humat dapat dikarakterisasi karena adanya gugus fungsional yang kaya akan oksigen seperti –COOH, fenolik/enolik – OH, alcohol –OH dan quionon -C=O. (Stevenson, 1994).
Gambar 2.1 Model struktur asam humat ; R dapat berupa alkil atau aril (Stevenson, 1994)
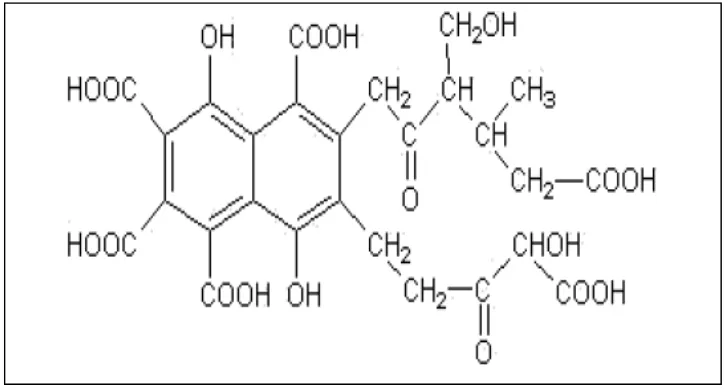
2. Asam fulvat
Gambar 2.2 Struktur model asam fulvik (Buffle, 1977)
3. Humin
Humin dianggap sebagai molekul paling besar dari senyawa humus karena rentang berat molekulnya mencapai 100.000 hingga 10.000.000 g/mol. Sedangkan sifat kimia dan fisika humin belum banyak diketahui. Tan juga menyatakan bahwa karakteristik humin adalah berwarna coklat gelap (Tan, 1982). Humin tidak dapat larut dalam air, alkohol asam maupun basa. (Stevenson, 1994).
Ketiga jenis fraksi asam humus ini memiliki struktur yang hampir sama satu sama lain, hanya berbeda berat molekul dan kandungan gugus fungsionalnya. (Novita, E., 2008). Asam fulvik dengan berat molekul yang rendah memiliki kandungan oksigen yang lebih tinggi dan kandungan karbon yang rendah jika dibandingkan dengan asam humat dengan berat molekul yang tinggi. Warna juga akan semakin tinggi dengan semakin tingginya berat molekul.
Bahan organik tanah dan tanamam berada dalam bentuk koloid. Dan berdasarkan kemudahan berikatan dengan air maka, bahan organik dapat dibedakan atas hidrofobik (tidak suka air) dan hidrofilik (suka air). Koloid hidrofobik dapat diflokulasi, sedangan koloid hidrofilik biasanya tidak. Koloid tanaman kebanyakan bersifat hidrofilik sehingga sulit untuk dikoagulasi secara konvensional (Tan, 1982).
2.2 Prospek Pengolahan
bisa menjadi alternatif sumber air minum masyarakat. Kondisi yang kurang menguntungkan dari segi kesehatan adalah sebagai berikut :
a. Kadar keasaman pH yang rendah dapat menyebabkan kerusakan gigi dan sakit perut. b. Kandungan Organik yang tinggi dapat menjadi sumber makanan bagi mikroorganisne
dalam air, sehingga dapat menimbulkan bau apabila bahan organik tersebut terurai secara biologis.
c. Apabila dalam pengolahan air gambut tersebut digunakan klor sebagai desinfektan, akan terbentuk Trihalometan (THM) seperti senyawa organoklor yang dapat bersifat karsinogenik.
d. Ikatan yang kuat dengan logam (besi dan mangan) menyebabkan kandungan logam dalam air tinggi dan dapat menimbulkan kematian jika dikonsumsi secara terus-menerus.
(Wagner, 2001).
Sebenarnya secara kuantitas air gambut berpotensial menjadi sumber air untuk dimanfaatkan manusia dalam kebutuhannya sehari-hari. Akan tetapi dari segi kualitas, estetika dan kesehatan air gambut tidak layak digunakan untuk aktivitas manusia karena tidak memenuhi standar air bersih sesuai PP 82 Tahun 2001. Hal ini mendorong timbulnya penelitian-penelitian yang baru dalam pengolahan air gambut, sehingga dapat dimanfaatkan sesuai standar yang berlaku.
Air gambut dapat diolah dengan berbagai cara, baik fisik maupun kimia. Pengolahan yang paling umum dilakukan adalah koagulasi, flokulasi, sedimentasi dan filtrasi. Namun hasil yang diberikan dari proses pengolahan tersebut belumlah maksimal untuk permasalahan zat organik yang terlarut dalam air gambut.
Metode koagulasi konvensional menggunakan koagulan kulit kerang dan batu karang yang telah dilakukan dalam mengolah air rawa daerah Geuredong Pase hanya mampu menyisihkan konsentrasi besi 5-58% dan tidak memberikan perubahan warna air yang signifikan sehingga air rawa gambut hasil olahan masih tampak berwarna kuning kecoklatan. (N.I.Said., 2010). Metode UV-Peroksidasi hanya dapat menurunkan 77,64% konsentrasi senyawa organik didalam air gambut dalam waktu 240 menit. (Elfiana dan Zulfikar, 2013)
280-300 mg/L tetapi tidak signifikan baik terhadap penurunan konsentrasi besinya. Proses koagulasi yang telah dilakukan membutuhkan jumlah bahan kimia koagulan yang besar. (Fitria, D., 2008).
Proses elektrokoagulasi yang digunakan untuk mengurangi zat-zat organik dari limbah rumah potong hewan dengan menggunakan 4 buah elektroda yang dioperasikan pada arus 0,3 A selama 70 menit menunjukkan penurunan TSS sebesar 99,6391%, TDS sebesar 99,7277% dan warna larutan yang semakin jernih ( nilai turbiditas rendah ).( Ardhani, 2007 ). 2.3 Warna Air
Dalam proses pengolahan air, warna merupakan salah satu parameter fisika yang digunakan sebagai persyaratan kualitas air baik untuk air bersih maupun untuk air minum. Warna air dikelompokkan menjadi warna sesungguhnya (true colour) dan warna tampak (apparent colour). Warna sesungguhnya dari perairan adalah warna yang hanya disebabkan oleh bahan –bahan terlarut, sedangkan warna tampak adalah warna yang tidak hanya disebabkan oleh bahan terlarut, tetapi juga oleh bahan tersuspensi. Prinsip yang berlaku dalam penentuan warna adalah memisahkan terlebih dahulu zat atau bahan-bahan yang terlarut yang menyebabkan kekeruhan. (Effendi, 2003)
Warna pada air gambut disebabkan karena adanya partikel koloid organik seperti tannin, lignin dan asam humus yang merupakan dekomposisi dari tanaman. Warna air dapat diamati secara visual (langsung) ataupun diukur berdasarkan suatu skala warna dengan spektrofotometer.
Skala warna air yang paling banyak digunakan saat ini adalah skala APHA (The American Public Health Association) dan skala Platina-Cobalt sering disingkat menjadi Pt-Co unit. Pemeriksaan warna ditentukan dengan membandingkan secara visual warna dari sampel dengan larutan standar warna yang diketahui konsentrasinya. (Pararaja, 2008).
2.4 Kekeruhan
liat, lumpur, bahan organic, plankton dan organism mikroskopik yang menhambat cahaya melalui air. (Moreno-Casillas, et al., 2007).
Kekeruhan dengan kadar semua jenis zat suspense tidak dapat dihubungkan secara langsung. Semakin tinggi nilai padatan tersuspensi maka semakin tinggi juga nilai kekeruhannya. Akan tetapi semakin tingginya nilai podatan terlarut tidak selalu diikuti dengan tingginya kekeruhan.
Pengukuran yang bersifat visual, yiatu dengan membandingkan air sampel dengan air standar. Metode lain yang dapat digunakan untuk merngukur kekeruhan yaitu Nephelometric dengan satuan NTU. Kekeruhan dinyatakan dalam satuan unit turbiditas, yang setara dengan 1 mg/L SiO2. Peralatan yang digunakan untuk mengukur kekeruhan yaitu Jackson Candler Turbidimeter yang dikalibrasi menggunakan silica. Satu unit turbiditas Jackson Candler Turbidimeter dinyatakan dengan 1 JTU. Konversi antara NTU dengan JTU yaitu bahwa 40 NTU setara dengan 40 JTU. (Gandjar, G.I., 2007).
2.5 Besi
Logam besi memiliki warna putih keperakan, yang kukuh dan liat. Ia melebur pada 15350C. Jarang terdapat besi komersial yang murni, biasanya besi mengandung sejumlah kecil karbida, silisida, fosfida, dan sulfida dari besi, serta sedikit grafit. Asam klorida encer atau pekat dan asam sulfat encer dapat melarutkan besi.
Fe + HCl Fe2+ + 2Cl- + H2
2Fe + H2SO4 + 6H+ 2Fe3+ + 3SO2 + 6H2O
Dengan asam nitrat encer dingin, terbentuk ion besi (II) dan ammonia : 4Fe + 10H+ + NO−3 4Fe
2+
+ NH+
4 + 3H2O
Asam nitrat pekat yang panas dapat melarutkan besi dengan membentuk gas nitrogen oksida dan ion besi (III) :
Fe + HNO3 + 3H+ Fe3+ + NO + 2H2O (Shevla, G.,1979)
ion logam yang akan menyebabkan peningkatan kadar ion logam dalam air. Di sisi lain, senyawa humus dalam air gambut menghalangi proses oksidasi ion Fe2+ yang lebih bersifat toksik menjadi ion Fe3+. (Suzuki et al., 1992).
Kandungan besi dalam air yang diperbolehkan < 0,3 ppm apabila melebihi 0,3 ppm, mengakibatkan warna air menjadi kemerah merahan, memberi rasa tidak enak pada minuman dan pembentukan endapan pada pipa logam. Kelebihan zat besi (Fe) pada tubuh manusia bisa menyebabkan keracunan, dimana terjadi muntah, diare dan kerusakan usus serta gangguan pada ginjal. Selain itu, kelebihan zat besi ini, bisa meningkatkan risiko penyakit jantung. Zat ini dapat mendorong pembentukan plaque (semacam kerak) di dinding pembuluh arteri, sehingga terjadi aterosklerosis, yaitu dinding pembuluh arteri jadi tebal dan mengeras. (Agmalini, S., 2013).
Penentuan kandungan Fe menggunakan metode pengujian yang mengacu pada SNI 06-6989.4-2004. Prinsip utama dari metode pemeriksaan ini adalah dengan penambahan asam nitrat yang bertujuan untuk melarutkan analit logam dan ,menghilangkan zat zat pengganggu yang terdapat dalam sampel dengan bantuan pemanas listrik, kemudian diukur dengan SSA menggunakan gas asetilen, C2H2 pada λspesifik = 248,3 nm. (BSN, SNI 06-6989.4-2004).
2.6 Mangan
Logam mangan adalah unsur kimia dalam tabek periodik yang memiliki lambang Mn dan nomor atom 25, berwarna silver metalik, keras dan sangat rapuh. Mangan terdapat dalam jumlah yang melimpah dengan urutan keduabelas pada batuan dan tanah, namun karena logam mangan reaktif terhadap oksigen maka unsur ini tidak ditemui dalam keadaan bebas di alam, yakni dalam bentuk mangan oksida dan hidroksida.( Cotton, F. Albert. 2007).
Mangan melebur pada suhu kira – kira 12500 C. ia bereaksi dengan air hangat membentuk mangan (II) hidroksida dan hydrogen .
Mn + 2H2O Mn(OH)2 + H2
Asam mineral encer dan juga asam asetat melarutkannya dengan menghasilkan garam mangan(II) dan hydrogen.
Mn + 2H+ Mn2+ + H2
Mn + 2H2SO4 Mn2+ SO 2−
4 + SO2 + 2H2O (Shevla, G.,1979).
Mangan terdapat dalam semua jaringan tubuh, dan level tertinggi ditemukan pada hati, ginjal dan pankreas. Konsentrasi mangan dalam tubuh dikontrol oleh regulasi eksresinya dari hati menuju empedu. Batas aksimum kadar mangan di perairan untuk peruntukan air minum adalah 0,1 mg/L. Mangan dalam dosis tinggi bersifat toksik. Gejala toksisitas Mn berupa gangguan kejiwaan, hiperiritabilitas, perlakuan kasar, kerusakan syaraf, halusinasi, kelupaan, gejala kelainan otak serta tingkah laku abnormal. (Montgomery, J.M., 1985).
Pengujian kandungan Mn menggunakan metode pengujian yang mengacu pada SNI 06-6989.4-2004 dengan penambahan asam nitrat yang bertujuan untuk melarutkan analit logam Mn dan menghilangkan zat – zat pengganggu yang terdapat dalam contoh uji air dan air limbah dengan bantuan pemanas listrik, kemudian diukur serapannya dengan SSA menggunakan gas asetilen, C2H2 pada λspesifik = 279,5 nm. (BSN, SNI 06-6989.4-2004).
2.7 Zeolit
Zeolit pertama kali ditemukan oleh seorang ahli mineral berkebangsaan Swedia, Baron Axel Frederick Cronsted pada tafun 1756 pada rongga-rongga batuan basalt di pertambangan Lappmark. Nama zeolit berasal dari bahasa Yunani, “zein” yang berarti membuih dan “litos” berarti batu. Nama ini sesuai dengan sifat zeolit yang akan membuih bila dipanaskan pada suhu 1000C hingga 3500C. (Harjanto, S., 1983).
Zeolit dapat didefenisikan sebagai mineral hidrat alumino silikat, dimana mineral ini terhidrasi dari logam-logam alkali dan alkali tanah dengan struktur tiga dimensi yang mempunyai rongga dan saluran yang dibentuk atas
penggabungan dan pengulangan unit-unit tetrahedral AlO4 dan SiO4 yang dihubungkan oleh atom oksigen. Rumus umum zeolit ditulis :
Mx/n (AlO2)x)(SiO2)ym.H2O dimana : M : Logam alkali atau alkali tanah n : Valensi dari kation logam
m : Banyaknya molekul air per unit sel zeolit
x,y : Bilangan total tetrahedral per unit sel dan perbandingan y/x berkisar 1-5
Berdasarkan hasil penelitian laboratorium Departemen Pertambangan dan Energi Sumatera Utara, zeolit alam ada terdapat di Sarulla (Tapanuli Utara) yang merupakan salah satu lokasi yang memiliki potensi zeolit alam yang besar. Jenis zeolit yang terdapat di Sarulla tersebut pada umumnya adalah zeolit klinoptilolit, Na6(Al6Si30O72).24H2O.
Tabel 2.1 Komposisi Kimia yang Terkandung dalam Zeolit Alam Sarulla
No. Senyawa Kandungan (%)
1. SiO2 65,2
2. Al2O3 14,91
3. Fe2O3 1,80
4. CaO 4,46
5. MgO 1,84
6. K2O 1,49
7. Na2O 1,29
8. TiO2 0,75
Sumber : Pusat Penelitian dan Pengembangan Teknologi dan Mineral dan Batubara
Sifat-sifat yang dimiliki zeolit alam Sarulla adalah sebagai berikut : Warna : Putih kekuningan
Kekerasan : 1-2 Sifat dalam : Rapuh
Sifat lain : Ringan dan padat
2.8 Ferri Sulfat
Ferri sulfat tersedia dalam bentuk granula atau bubuk yang berwarna merah kecoklatan. Rumus kimianya adalah Fe2(SO4)3.9H2O. Koagulan ini sedikit bersifat higroskopik tetapi sulit untuk larut. Ferri sulfat adalah koagulan dengan ion besi trivalent (Fe3+) yang efektif dan sangat baik untuk pengolahan air minum, air limbah dan penghilangan posfor. Koagulan ini juga efisien untuk menangani korosi dengan cara mengontrol pembentukan hidrogen sulfida. (Risdianto, 2007).
korosif yang lebih rendah terhadap berbagai logam jika dibadingkan dengan ferri klorida. Ferri sulfat dapat bekerja dengan baik pada air limbah yang memiliki pH rendah seperti air limbah yang memiliki kandungan lemak dan minyak yang tinggi serta warna yang pekat. (Duan Jinming, G.J.,2003).
2.9 Proses Elektrokoagulasi
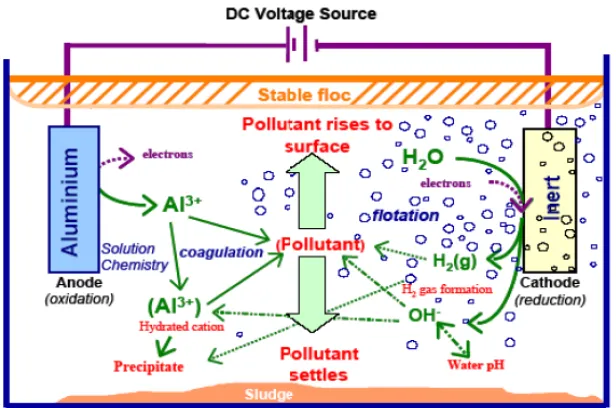
Sekarang ini, elektrokoagulasi sangat digemari dalam proses pengolahan air/air limbah. Elektrokoagulasi adalah proses pengolahan secara elektrokimia yang mana menggunakan koagulan logam yang bersifat larut seperti besi dan aluminium. Proses elektrokoagulasi merupakan proses yang menggunakan elektroda (Fe/Al) untuk menyumbangkan ion ke dalam aliran air. Elektroda Fe/Al kemudian akan larut dari anoda untuk menghasilkan ion logam yang sesuai, yang kemudian akan segera terhidrolisis membentuk polimer besi atau aluminium hidroksida.( H. Liu, et al., 2010)
Menurut Holt et al., 2006 ada berbagai kemungkinan mekanisme yang terjadi dalam elektrokoagulasi yaitu:
1. Migrasi ke elektroda dengan muatan berlawanan (elektroforesis) dan agregasi disebabkan netralisasi muatan.
2. Kation atau ion hidrosil (OH-) membentuk endapatan dengan polutan.
3. Kation logam berinteraksi dengan OH- untuk membentuk hidroksida, yang memiliki sifat-sifat penyerapan tinggi yang dengan demikian mengalami pengikatan pada polutan (koagulasi jembatan).
4. Hidroksida membentuk struktur mirip-kisi yang lebih besar dan menyapu air (koagulasi sapuan).
5. Oksidasi polutan menjadi spesies yang tidak begitu toksik.
Gambar 2.3 Mekanisme dalam elektrokoagulasi (Holt, 2006)
Reaksi yang terjadi pada proses elektrokoagulasi adalah : a. Reaksi pada katoda
Reaksi pada katoda adalah reaksi reduksi terhadap kation, jadi yang diperhatikan kationnya saja.
1. Jika larutan mengandung ion-ion logam alkali, ion-ion logam alkali tanah, ion Al+3, dan ion Mg2+, mengandung ion-ion logam ini tidak dapat direduksi dari larutannya.
Yang akan mengalami reduksi adalah pelarut (air) dan terbentuk gas Hidrogen (H2) pada katoda.
2H2O + 2e 2OH- + H2
2. Jika larutan mengandung asam maka ion H+ dari asam akan direduksi menjadi gas hidrogen pada katoda.
2H+ + 2e H2
3. Jika larutan mengandung ion-ion lain maka ion-ion logam ini diendapkan pada permukaan batang katoda.
Fe2+ + 2e Fe Mn2+ + 2e Mn
b. Reaksi Pada Anoda
Elektroda pada Anoda, elektrodanya dioksidasi (bereaksi) diubah menjadi ionnya. Contoh :
Zn Zn2+ + 2e
Dalam sistem elektrokimia dengan anoda terbuat dari alumunium, beberapa kemungkinan reaksi elektroda dapat terjadi sebagai berikut.
Anoda : Al Al3+ + 3e
Katoda : 2H2O + 2e H2 + 2OH -2H+ + 2e H2
O2 + 4H+ + 4e 2H2O
(Holt, P.K. 2006)
2.10 Spetrofotometer Serapan Atom (SSA)
Peristiwa serapan atom pertama sekali diamati Fraunhofer, ketika menelaah garis-garis hitam pada spektrum matahari. Sedangkan yang memanfaatkan prinsip serapan atom pada bidang analisis adalah seorang australia bernama Alan Walsh di tahun 1955. Sebelumnnya ahli kimia banmyak tergantung pada cara-cara spektrografik. Beberapa cara ini sulit dan memakan waktu. Kemudian digantikan dengan Spekroskopi Serapan Atom (SSA). Metode ini sangat tepat untuk analisis zat pada konsentrasi rendah. (Dedina, J. 1995).
Teknik ini mempunyai beberapa kelebihan dibandingkan dengan metode Spektroskopi emisi konvensional, pada metode konvensional emisi tergantung pada sumber eksitasi, bila eksitasi dilakukan secara termal maka ia akan tergantung pada temperatur sumber. Selain itu eksitasi termal tidak selalu spesifik dan eksitasi secara serentak terjadi pada berbagai spesies dalam suatu campuran. Sedangkan dengan nyala, eksitasi unsur-unsur dengan tingkat energi eksitasi yang rendah dapat dimungkinkan, tentu saja perbandingan banyaknya atom yang tereksitasi terhadap atom yang berada pada tingkat dasar harus cukup besar, karena metode serapan atom hanya tergantung pada perbandingan ini dan tidak bergantung pada temperatur. (Khopkar, S.M., 2002).
2.10.1. Instrumentasi Spektrofotometer Serapan Atom
Gambar 2.3. Sistematis ringkas dari alat SSA
A. Sumber sinar
Lampu katoda berongga merupakan sinar yang memancarkan spektrum dari unsure logam yang akan dianalisa (setiap logam memiliki lampu khusus untuk logam tersebut).
B. Chopper
Mengatur sinar yang dipancarkan.
C. Tungku
Tempat pembakaran bertujuan untuk mengubah larutan uji menjadi atom – atom dalam bentuk gas. Fungsi pengabut adalah menghasilkan kabut atau aerosol larutan uji.
D. Monokromator
Fungsi monokromator adalah untuk memisahkan garis resonansi daris emua garis yang tak diserap yanhg dipancarkan oleh sumber radiasi.
E. Detektor
Detektor pada spektrofotometer serapan atom berfungsi mengubah intensitas radiasi yang datang menjadi arus listrik. Pada spektrofotometer serapan atom yang umum digunakan adalah tabung penggandaan foton.
F . Rekorder
Hasil pembacaan dapat berupa angka atau berupa kurva dari suatu rekorder yang menggambarkan absorbansi atau intensitas emisi.
(Basset, J. Denney.1994)