BAB II
TINJAUAN PUSTAKA
2.1. Botani Kopi
Kopi merupakan salah satu tumbuhan yang termasuk dalam family Rubiaceae yang bernilai ekonomi tinggi. Kopi pertama kali ditemukan pada abad IX di Ethiopia, dimana biji-bijian asli ditanam oleh orang Ethiopia dataran tinggi. Pada saat itu, banyak orang di Benua Afrika, terutama bangsa Ethiopia, yang mengkonsumsi biji kopi yang dicampurkan dengan lemak hewan dan anggur untuk memenuhi kebutuhan protein dan energi tubuh. Akan tetapi, ketika bangsa Arab mulai meluaskan perdagangannya, biji kopi pun telah meluas sampai ke Afrika Utara dan biji kopi disana ditanam secara massal. Dari Afrika Utara itulah biji kopi mulai meluas dari Asia sampai pasaran Eropa dan ketenarannya sebagai minuman mulai menyebar. Kopi kemudian terus berkembang hingga saat ini menjadi salah satu minuman paling populer di dunia yang dikonsumsi oleh berbagai kalangan masyarakat (National Geographic, 2013).
2.1.1. Morfologi Kopi
Kopi adalah tanaman perdu yang memiliki tinggi antara 2 - 4 meter. Kopi memiliki sistem perakaran yang dangkal, lebih dari 90 % akar berada pada lapisan tanah dengan kedalaman kurang dari 30 cm (Gambar 2.1.A). Oleh karena itu tanaman kopi peka terhadap kandungan bahan organik maupun perubahan musim (Najiyati & Danarti, 1990).
Batang tanaman kopi memiliki dua tipe percabangan, yaitu cabang yang tumbuh tegak (orthotrop) dan cabang yang tumbuh mendatar (plagiotrop;
Gambar 2.1.B.). Cabang plagiotrop berfungsi sebagai penghasil bunga, sedangkan cabang ortotrop tumbuhnya pesat dengan ruas yang relatif panjang sehingga banyak digunakan sebagai sumber stek (van Steenis et al., 2008).
Kopi mempunyai daun berbentuk bulat telur dengan ujung yang agak meruncing sampai bulat (Gambar 2.1.C). Pada ortotrop, daun tersusun berselang-seling pada ruas-ruas berikutnya, sedangkan pada plagiotrop daun tersusun mendatar dan tidak berselang-seling (Najiyati & Danarti, 1990). Daun kopi rata-rata berukuran panjang 20 - 30 cm dan lebar sekitar 10 - 16 cm dengan urat daun tenggelam sehingga permukaan daun nampak berlekuk-lekuk (van Steenis et al., 2008).
akan mekar pada permulaan musim kemarau, berwarna putih dan harum dengan panjang tabung dapat mencapai 1,8 cm. Petala berjumlah 5 – 7 dengan ukuran panjang mencapai 1,3 cm dan lebar mencapai 0,4 cm (Gambar 2.1.D). Benang sari tertancap pada tabung mahkota berjumlah lima sampai tujuh tangkai yang berukuran pendek. Tangkai putik memanjang jauh di luar tabung mahkota dan bercabang dua. Bakal buah mengandung dua bakal biji (vanSteenis et al, 2008).
Setelah terjadi penyerbukan dan pembuahan, bakal buah kemudian berkembang menjadi buah. Buah tersebut akan terus tumbuh dan siap panen setelah sembilan bulan sampai satu tahun (Muljana, 1986). Tanaman kopi hanya menghasilkan buah satu kali dalam satu tahun dan dipanen pada bulan Maret sampai September (Gambar 2.1.E;Siahaan, 2008). Buah kopi bertipe drupa dan berbentuk bulat telur, terdiri atas 4 lapisan yaitu lapisan kulit luar (exocarp), daging buah (mesocarp), kulit tanduk (parchment), dan biji (endosperm; Gambar 2.1.F). Kulit buah kopi sangat tipis dan mengandung klorofil serta zat – zat warna lainnya sehingga sewaktu muda biji kopi berwarna hijau dan berubah menjadi merah jika telah tua (van Steenis et al., 2008).
Gambar 2.1. akar tanaman kopi (A; Kuit et al., 2004), batang kopi (B), daun kopi (C), bunga kopi (D), buah kopi (E), dan biji kopi (F; Cafedecolombia.com, 2013)
2.1.2. Varietas Kopi
Ada sekitar 100 jenis kopi yang ditemukan di dunia, tetapi hanya dua jenis kopi yang dikenal memiliki nilai ekonomis dan diperdagangkan secara komersial, yaitu kopi arabika (Coffea arabica L.) dan kopi robusta (Coffea canephora Pierre ex Froehner; Etienne, 2006). Dua jenis kopi yang lain yang dibudidayakan dalam skala lebih kecil adalah kopi liberika (Coffea liberica) dan kopi excelsa (Coffea dewevrei).
A B
C
F D
Kopi arabika (Gambar 2.2.A) merupakan kopi yang paling banyak diproduksi (60 % produksi kopi dunia) karena memiliki harga yang lebih baik. Kopi arabika umumnya tumbuh ideal di tempat pada ketinggian di atas 1.000 meter di atas permukaan (Sofyana, 2011). Kopi arabika tidak tahan terhadap penyakit karat daun dan perubahan musim, namun biji kopi arabika memiliki rasa yang lebih manis dan aroma yang kurang kuat sehingga banyak digemari masyarakat di dunia (Anggara et al., 2011).
Kopi robusta lebih tahan terhadap cuaca dan hama penyakit, serta mudah pemeliharaannya dibandingkan kopi arabika. Kopi robusta juga bisa hidup di bawah ketinggian 1.000 meter di atas permukaan laut dan mampu menghasilkan biji lebih banyak dibandingkan dengan kopi arabika sehingga banyak dibudidayakan di Indonesia (Sofyana, 2011). Biji kopi robusta memiliki kadar kafein lebih tinggi dibandingkan dengan kopi arabika dengan aroma kopi yang lebih kuat. Saat ini sekitar sepertiga produksi kopi dunia adalah kopi robusta (Gambar 2.2.B).
Gambar 2.2. Perbandingan antara kopi arabika (A) dan kopi robusta (B; Rogers, 2013)
2.1.3. Manfaat Kopi
Kopi merupakan tanaman yang memiliki berbagai khasiat untuk kesehatan dan kecantikan. Kafein yang terdapat dalam biji kopi merupakan stimulan bagi sistem saraf pusat sehingga dapat meningkatkan kinerja otak. Kafein mampu melindungi kerusakan sel kulit akibat radiasi (Panggabean, 2011). Kopi juga mengandung chlorogenic acid yang merupakan senyawa polyphenol yang berfungsi sebagai antioksidan kuat. Adanya antioksidan dapat membantu tubuh dalam menangkal efek perusakan oleh senyawa radikal bebas dalam tubuh dan memperbaiki sel-sel yang rusak. Kopi juga dapat memberi efek relaksasi karena aromanya yang wangi dan menyegarkan (Johnston et al., 2003). Putri (2012) menambahkan bahwa serbuk biji kopi dapat digunakan sebagai sunblock untuk mencegah sengatan matahari dan mencegah kulit keriput (Gambar 2.3.A).
Gambar 2.3. masker dengan bubuk kopi (A; Kobylanski, 2010), minuman dari kopi (B; Brown, 2012), arang dari tanaman kopi (C), dan limbah kulit buah kopi (D; Arnawa et al., 2010)
2.2. Budidaya Kopi dan Permasalahannya
2.2.1. Produksi Kopi Dunia dan Indonesia
Kopi merupakan salah satu komoditas pertanian yang paling banyak diperdagangkan di pasar dunia. Total produksi kopi di dunia mencapai 8 juta ton dengan nilai penjualan melebihi dari US$ 22,7 milyar selama tahun 2011 (ICO, 2010). Luas areal perkebunan kopi di dunia mencapai 10,2 juta hektar lahan yang mencakup lebih dari 80 negara dan diproduksi oleh petani kecil hingga mencapai 70% (Santos-Briones et al., 2006).
A B
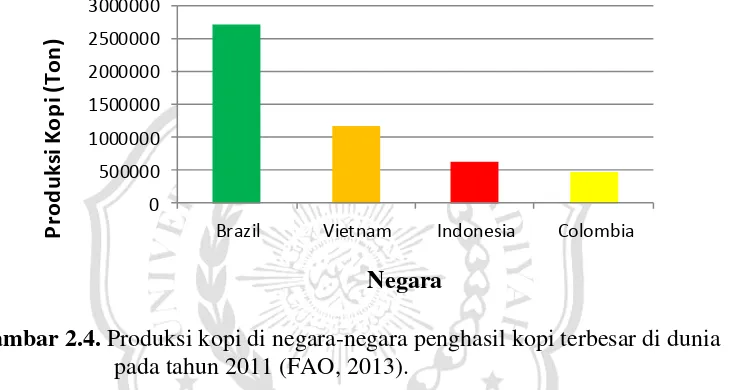
Indonesia merupakan negara produsen kopi utama ketiga di dunia setelah Brazil dan Vietnam, sementara pada posisi keempat adalah negara Kolombia (Gambar 2.4). Keempat negara tersebut menghasilkan 63,48% produksi kopi dunia (ICO, 2013). Produksi kopi Indonesia dan Vietnam lebih didominasi kopi robusta, sementara kopi utama yang dihasilkan oleh Brazil dan Kolombia adalah kopi arabika.
Gambar 2.4. Produksi kopi di negara-negara penghasil kopi terbesar di dunia pada tahun 2011 (FAO, 2013).
Perkebunan kopi di Indonesia dikelola dalam tiga bentuk pengusahaan yaitu perkebunan rakyat, perkebunan besar negara dan perkebunan besar swasta. Dari seluruh luas areal perkebunan kopi Indonesia, 93,07 % luas areal perkebunan kopi dimiliki oleh perkebunan rakyat, sedangkan sisanya oleh perkebunan besar negara dan perkebunan besar swasta masing-masing sebesar 3,93 % dan 3,62 % (AEKI, 2013).
Menurut data AEKI (2013), produksi kopi Indonesia saat ini telah mencapai lebih kurang 650.000 ton per tahun, dimana sektor perkebunan rakyat merupakan penghasil utama kopi Indonesia (96,2%), sisanya dari sektor perkebunan swasta lebih kurang sebesar 10.000 ton (1,5%) dan dari sektor perkebunan negara
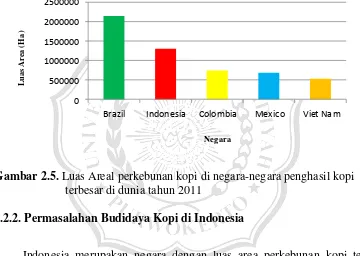
menyumbang rata-rata 15.000 ton (2,3%) per tahun. Dari total produksi kopi Indonesia, 550.000 ton (81,2%) berupa kopi robusta dan 125.000 ton (18,8%) berupa kopi arabika. Luas areal perkebunan kopi di Indonesia pada tahun 2011 hampir mencapai 1,3 juta hektar dan merupakan yang terluas kedua di dunia setelah Brazil dengan luas areal 2,1 juta hektar (Gambar 2.5).
Gambar 2.5. Luas Areal perkebunan kopi di negara-negara penghasil kopi terbesar di dunia tahun 2011
2.2.2. Permasalahan Budidaya Kopi di Indonesia
Indonesia merupakan negara dengan luas area perkebunan kopi terbesar kedua di dunia setelah Brazil. Namun, bila ditinjau dari produksi, Indonesia menempati urutan ketiga setelah Brazil dan Vietnam. Keadaan ini terjadi karena produktivitas kopi Indonesia per hektarnya hanya mencapai sekitar 500 kg. Angka tersebut jauh lebih rendah bila dibandingkan dengan negara penghasil kopi di dunia lainnya, seperti Sierra Leone dan Vietnam yang mampu menghasilkan kopi per hektarnya mencapai lebih dari 2 Ton/Ha (Gambar 1.1).
Rendahnya produktivitas kopi disebabkan oleh beberapa faktor diantaranya adalah gangguan penyakit karat daun (Hemileia vastatrix), yang merupakan penyakit paling merugikan usaha tani kopi di Indonesia (Mahfud, 2012). Faktor lain yang menyebabkan rendahnya produktivitas kopi di Indonesia adalah perkebunan kopi Indonesia sebagian besar adalah perkebunan rakyat yang penanamannya masih secara tradisional dengan pengelolaan budidaya dan penanganan pasca panen masih kurang memadai (Gisca, 2012).
Kendala lain dari permasalahan kopi di Indonesia adalah kurangnya ketersediaan bibit kopi yang bermutu. Priyono (2010) mengungkapkan bahwa rendahnya produktivitas kopi di Indonesia salah satunya disebabkan oleh terbatasnya penggunaan bahan tanam hasil perbanyakan vegetatif dari material genetik unggul.
2.3. Pembibitan Kopi di Indonesia
tanaman yang dihasilkan. Hal tersebut karena tanaman kopi khususnya jenis robusta memiliki sifat menyerbuk silang (Santoso & Rahardjo, 2011).
Gambar 2.6. Pembibitan kopi secara generatif (Muljana, 1986)
Salah satu cara yang dapat digunakan untuk mengatasi permasalahan di atas adalah dengan menggunakan perbanyakan bibit secara vegetatif. Secara konvensional, perkembangbiakkan kopi melalui cara vegetatif dengan menggunakan teknik stek, okulasi dan sambung pucuk.
besar karena keterbatasan jumlah batang atau ranting dari tanaman induk. Selain itu, teknik tersebut juga akan merusak tanaman induk serta bibit yang dihasilkan juga akan memiliki akar serabut sehingga tidak tahan terhadap perubahan musim (Prastowo et al., 2010).
Teknik perkembangbiakkan vegetatif yang lain adalah teknik okulasi. Teknik tersebut dilakukan dengan cara menyiapkan batang bawah berupa bibit yang berasal dari perbanyakan biji serta menyiapkan mata tunas yang berasal dari pohon induk unggul (Gambar 2.7.B). Mata tunas ditempelkan pada batang bawah, setelah ditutup atau diselubungi plastik dilanjutkan dengan pemeliharaan selama sekitar 20 hari. Bibit siap ditanam di lahan setelah 15 bulan (Prastowo et al., 2010).
Gambar 2.7 perkembangbiakkan kopi secara vegetatif, stek (A; smallhousebiggarden.html, 2012), okulasi (B; Arteaga, 2011), dan sambung pucuk (Prastowo et al., 2010; C)
Teknik ini memiliki keunggulan berupa bibit yang dihasilkan memiliki akar tunggang dan memiliki sifat sama dengan tanaman induknya. Namun, jumlah mata tunas yang terbatas, waktu pembuatan bibit yang lama serta memiliki tingkat keberhasilan yang rendah maka teknik ini tidak mampu menghasilkan bibit dalam
jumlah masal. Selain itu teknik ini juga merusak tanaman induknya (Santoso & Raharjo, 2011).
Teknik vegetatif lain yang sering digunakan oleh petani untuk menghasilkan bibit adalah teknik sambung pucuk. Teknik ini mirip seperti okulasi namun tidak digunakan mata tunas melainkan digunakan cabang yang masih muda. Cabang muda dengan 1 - 3 pasang daun disambungkan ke bibit kopi yang digunakan sebagai bawang bawah (Gambar 2.7.C). Keberhasilan sambungan dapat diketahui setelah dua minggu dan bibit dapat ditanam ke lahan setelah 6 - 8 bulan. (Prastowo et al., 2010). Teknik perbanyakan tersebut mampu menghasilkan bibit dengan kualitas yang seragam dan sama dengan induknya (Prastowo et al., 2010). Namun, teknik tersebut tidak mampu menghasilkan bibit dalam jumlah yang masal serta merusak tanaman induk yang digunakan sebagai sumber batang atas (Oktavia et al., 2003).
Secara umum, ada lima teknik dasar kultur jaringan, yaitu kultur meristem, proliferasi tunas aksilar, induksi pucuk adventif, organogenesis dan embryogenesis somatik (Zulkarnain, 2009). Kultur meristem adalah teknik kultur jaringan yang menggunakan potongan tunas yang sangat kecil, terdiri atas satu kubah meristem dan beberapa primordial daun. Teknik tersebut digunakan untuk mendapatkan tanaman bebas virus dari bahan induk yang terinfeksi (Zulkarnain, 2009).
Teknik lainnya adalah proliferasi tunas aksilar merupakan teknik kultur jaringan yang menggunakan tunas – tunas terminal dan lateral yang proliferasi tunas aksilarnya dipacu dan pertumbuhan tunas terminalnya ditekan. Teknik tersebut diterapkan secara luas pada spesies tanaman angiospermae (Zulkarnain, 2009).
Induksi pucuk adventif termasuk inisiasi perkembangan pucuk adventif dari eksplan maupun dari kalus yang dihasilkan eksplan sebagai akibat adanya perlukaan dan perlakuan zat pengatur tumbuh. Perbanyakan melalui induksi pucuk adventif menghasilkan regenerasi yang jauh lebih besar daripada metode perbanyakan vegetatif secara konvensional (Zulkarnain, 2009).
yang mulai dikembangkan untuk memperbanyak kopi secara in vitro adalah melalui teknik embryogenesis somatik (Oktavia et al., 2003).
2.4. Perkembangan Penelitian Embryogenesis Somatik Kopi
Embryogenesis somatik adalah menumbuhkan embryo (calon tanaman) dari sel somatik secara aseptis (Nugrahani et al., 2011). Pada umumnya tahapan kegiatan dalam melaksanakan perbanyakan tanaman melalui teknik embryogenesis somatik adalah tahap induksi sel dan kalus embryogenik, tahap induksi embryo somatik, tahap perkecambahan, dan tahap aklimatisasi (Gambar 2.8; Purnamaningsih, 2002).
Pada tahap induksi kalus embryogenik dilakukan isolasi eksplan dan penanaman pada media tumbuh. Pada umumnya eksplan ditumbuhkan pada media yang mengandung auksin dan sitokinin yang mempunyai daya aktivitas kuat atau dengan konsentrasi tinggi (Purnamaningsih, 2002). Kalus yang tumbuh dengan ciri-ciri tertentu seperti mudah dilepas-lepas (friabel) dan berwarna putih kekuningan merupakan kalus yang kemungkingan besar mampu membentuk embryo atau biasa disebut kalus embryogenik (Lizawati, 2012).
Tahap induksi embryo adalah tahap perkembangan dari kalus mulai membentuk embryo somatik. Pembentukan embryo somatik dapat digambarkan melalui beberapa tahap, yaitu embryo globular (Gambar 2.8.C), embryo tahap hati (Gambar 2.8.D), embryo tahap torpedo (Gambar 2.8.E), tahap embryo pra kotiledon (Gambar 2.8.F), serta tahap kotiledon (Gambar 2.8.G). Beberapa hasil penelitian menunjukkan bahwa tahap induksi embryo somatik ini merupakan tahapan yang paling sulit pada kultur jaringan. Pada tahap ini sering digunakan medium dengan konsentrasi sitokinin tinggi dengan auksin yang rendah atau tanpa penambahan auksin (Purnamaningsih, 2002).
Tahap terakhir adalah tahap aklimatisasi dimana embryo yang telah dikecambahkan membentuk bibit dengan 2 - 3 daun kemudian dipindahkan dari kondisi in vitro ke lingkungan ex vitro di rumah kaca (Gambar 2.8.K). Tahapan ini merupakan tahapan penentu keberhasilan teknik embryogenesis somatik agar bisa diaplikasikan dalam skala masal untuk produksi bibit suatu tanaman. Pada tahap ini bibit disesuaikan secara perlahan dengan perubahan lingkungan dari lingkungan dengan suhu yang konstant dan kelembapan yang tinggi ke lingkungan dengan suhu yang tidak stabil dan kelembapan yang rendah (Purnamaningsih, 2002).
Teknik embryogenesis somatik sudah banyak digunakan untuk perbanyakan pada berbagai jenis tanaman seperti kelapa sawit (Sumaryono et al., 2007), kakao (Winarsih et al., 2003), sagu (Kasi & Sumaryono, 2006), kacang tanah (Lestari, 2005), cendana (Sukmadjaja, 2005), dan pule pandak (Sugito, 2006).
yang dikulturkan masih relatif rendah (Oktavia et al., 2003) dan persentase keberhasilan berkisar antara 0 - 70% (Quiroz-Figueroa et al., 2002).
Berbagai upaya telah dilakukan untuk meningkatkan keberhasilan teknik embryogenesis somatik pada tanaman kopi, di antaranya adalah dengan menggunakan berbagai jenis ekplan (Oktavia et al., 2003) modifikasi medium dasar (Gatica et al., 2008), maupun penambahan air kelapa ke dalam medium tanam (Priyono & Danimihardja, 1991).
Eksplan alternatif yang berasal dari sel vegetatif adalah eksplan batang. Eksplan tersebut telah diujikan untuk digunakan dalam induksi embryo somatik kopi, namun hasil penelitian menunjukkan bahwa tingkat keberhasilan induksi embryo dari eksplan batang masih relatif rendah yaitu berkisar antara 0 – 64 % (Priyono & Danimiharja, 1991).
Salah satu eksplan yang paling banyak digunakan dan memiliki prospek yang cerah untuk diinduksi embryo somatik karena merupakan organ vegetatif adalah daun. Eksplan tersebut telah diujikan dengan hasil yang lebih baik dari jenis eksplan yang lain. Namun demikian, tingkat keberhasilan induksi embryo dari eksplan tersebut sangat tergantung kepada genotip tanaman kopi yang digunakan. Beberapa genotip berhasil diperbanyak melalui teknik embryogenesis somatik dengan tingkat keberhasilan tinggi (70 %), namun genotip-genoptip lain tidak berhasil diinduksi pembentukan embryo somatik (Arimarsetyowati, 2011; Murni, 2010; Riyadi, 2004; Priyono, 2004; Hatanaka et al., 1991; Oktavia et al.,2003; Neuenschwander & Baumann, 1992; Quiroz-Figueroa, 2002).
seperempat konsentrasi garam makro dan setengah konsentrasi garam mikro dari media MS yang dilengkapi medium B5 (Hatanaka et al., 1991), media MS dilengkapi dengan vitamin Morel (Gatica et al., 2007), setengah konsentrasi medium MS yang dilengkapi dengan triakontanol (TRIA, Gatica et al., 2008). Dari semua hasil penelitian tersebut, embryo somatik berhasil diinduksi dengan tingkat keberhasilan yang bervariasi, tergantung dari genotip yang ditanam.
Upaya lain untuk meningkatkan keberhasilan induksi embryo somatik kopi adalah dengan menggunakan medium cair (Gatica et al., 2008), dan medium semi padat (Gatica et al., 2008). Hasil dari semua penelitian tersebut menunjukkan tingkat keberhasilan induksi embryo somatik yang cukup tinggi, namun waktu yang dibutuhkan relatif lama yaitu lebih dari 3 bulan.
Upaya lainnya juga telah dilakukan untuk meningkatkan keberhasilan induksi embryogenesis somatik, yaitu dengan penambahan air kelapa ke dalam medium tanam (Priyono & Danimihardja, 1991). Hasil penelitian menunjukan persentase yang cukup tinggi dalam menginduksi embryo yaitu sekitar 80 %, dan juga embryo berhasil dikecambahkan, namun tingkat keberhasilan pada tahap aklimatisasi masih cukup rendah, yaitu hanya 18 %.
Beberapa faktor diduga menjadi penyebab rendahnya tingkat keberhasilan embryogenesis somatik kopi, diantaranya adalah pemilihan jenis eksplan yang tepat sebagai sumber eksplan, genotif dan zat pengatur tumbuh (Oktavia et al., 2003). Salah satu cara yang diduga mampu meningkatkan keberhasilan induksi embryo somatik kopi adalah dengan menambahkan zat pengatur tumbuh (ZPT) yang tepat ke dalam medium tanam (Oktavia et al., 2003; Zulkarnain & Lizawati, 2011).
2.5. Zat Pengatur Tumbuh
Zat pengatur tumbuh (ZPT) didefinisikan sebagai senyawa organik bukan nutrisi yang aktif dalam jumlah kecil (sekitar 10-6 M) baik disintesis pada bagian tertentu suatu tanaman (hormon) maupun senyawa sintetik yang dapat diangkut ke bagian lain tanaman dimana zat tersebut menimbulkan tanggapan secara biokimia, fisiologis dan morfologis (Wattimena, 1988).
diantaranya, indole-3-acetic acid (IAA), 2,4 - dichlorophenoxyacetic acid (2,4 - D), dan α-naftalenacetic acid (NAA; Zulkarnain, 2009).
Sitokinin merupakan salah satu ZPT yang memiliki peran dalam memacu pembelahan sel (sitokinesis), mempercepat pematangan buah, merangsang pembungaan dan merangsang pembentukan buah, Sitokinin juga dilaporkan mampu menambah daya perkecambahan tunas, menunda penuaan pada tanaman, dan memacu pertumbuhan tunas aksiler (Salisbury & Ross, 1995). Pada kultur jaringan, sitokinin sering digunakan untuk merangsang pembentukan tunas ataupun merangsang pembentukan embryo somatik. Sitokinin yang biasa digunakan dalam kultur jaringan adalah kinetin, zeatin, 2iP (N6-2-isopentanyl adenin) , BAP (6-benzylamino purine), dan TDZ (thidiazuron; Gunawan, 1995).
Gibberellin berperan meningkatkan perkecambahan biji dan pemanjangan pucuk. Semua giberelin bersifat asam oleh karena itu dinamakan GA (asam giberelat). Pada kultur kutlur jaringan gibberellin sering digunakan untuk memacu pertumbuhan tunas,meningkatkan perkecambahan biji dan pemanjangan pucuk (Zulkarnain, 2009). Golongan gibberellin yang paling umum digunakan dalam kultur jaringan adalah GA3, GA4 dan GA7 (Salisbury & Ross, 1995).
untuk membantu proses pembentukan embryo secara normal dan pembentukan simpanan protein pada biji serta menghambat perkecambahan pada banyak jenis biji (Salisbury & Ross, 1995).
Diantara kelima golongan ZPT tersebut, auksin dan sitokinin merupakan ZPT yang paling sering digunakan pada teknik embryogenesis somatik. Sitokinin dan auksin memiliki peran yang sangat penting dalam hal menginduksi tunas adventif. Nisbah keduanya akan menentukan apakah suatu kalus akan membentuk tunas adventif, akar, atau tunas adventif dan akar (Armini et al., 1991). Salah satu golongan auksin yang sering digunakan adalah asam naftalena asetat (NAA) sedangkan salah satu golongan sitokinin yang sering digunakan adalah 6-benzylamino Purine (BAP).
2.5.1. Asam Naftalena Asetat (NAA)
NAA merupakan salah satu auksin yang berperan dalam pemanjangan sel. NAA memiliki berat molekul 186.21 dengan rumus molekul C12H10O2 (Gambar 2.9; Salisbury dan Ross, 1995). NAA merupakan auksin sintetik yang sering digunakan dalam kultur jaringan karena memiliki sifat yang lebih tahan terhadap suhu tinggi dan tidak terdegradasi ketika diotoklaf serta lebih murah.
Mekanisme kerja NAA dalam pemanjangan sel adalah NAA menyebabkan sel penerima mengeluarkan ion H ke dinding sel primer yang mengelilinginya. Ion tersebut akan menurunkan pH dinding sel sehingga mengaktifkan beberapa enzim hidrolisis polisakarida. Akibatnya dinding sel akan mengendur sehingga proses pemanjangan sel menjadi lebih mudah terjadi dan pertumbuhan yang cepat (Salisbury dan Ross, 1995).
Penelitian tentang penambahan NAA ke dalam medium tanam telah banyak dilaporkan dengan tingkat keberhasilan yang bervariasi seperti yang dilaporkan pada tanaman anggrek (Utami et al., 2007), lamtoro (Sapsuha, 2009), alfalfa (Hayati et al., 2010), gandarusa (Ikhwan, 2007), kemiri (Haloho, 2004), opium (Ovecka et al., 1996), dan jagung (Joshi et al., 2010).
Pada tanaman kopi, penambahan NAA ke dalam medium tanam juga telah dilaporkan dengan tingkat keberhasilan yang bervariasi. Quiroz-Figueroa et al. (2002) melaporkan bahwa penambahan NAA ke dalam medium tanam dengan konsentrasi 0.54 μM mampu menginduksi pembentuk embryo somatik tanaman
2.5.2. 6-benzylamino purine (BAP)
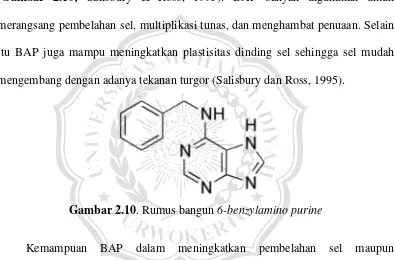
Salah satu sitokinin yang banyak digunakan dalam perbanyakan tanaman melalui kultur jaringan adalah 6-benzylamino purine (BAP). BAP merupakan generasi pertama sitokinin sintetik yang memiliki kandungan karbon, hidrogen dan oksigen dengan rumus kimia C12H11N5 dengan berat molekul 225,31 gr/mol
(Gambar 2.10; Salisbury & Ross, 1995). BAP banyak digunakan untuk merangsang pembelahan sel, multiplikasi tunas, dan menghambat penuaan. Selain itu BAP juga mampu meningkatkan plastisitas dinding sel sehingga sel mudah mengembang dengan adanya tekanan turgor (Salisbury dan Ross, 1995).
Gambar 2.10. Rumus bangun 6-benzylamino purine
Kemampuan BAP dalam meningkatkan pembelahan sel maupun multiplikasi tunas diduga karena BAP merupakan salah satu basa purin. Basa tersebut merupakan komponen struktural dari asam deoksiribonukleat (DNA) maupun asam ribinukleat (RNA). Dengan adanya BAP maka sintesis RNA dan DNA akan meningkat sehingga dapat merangsang sintesis protein dan pembelahan sel (George & Sherrington, 1984).
Pada tanaman kopi, Priyono dan Danimihardja (1991) melaporkan keberhasilan induksi embryo somatik dengan tingkat keberhasilan tinggi (58,5-78,4 %) dengan menambahkan BAP dengan konsentrasi 1-5 mg/l ke dalam medium tanam. Priyono (2010) juga melaporkan keberhasilan induksi embryo somatik dengan tingkat keberhasilan tinggi (85 %) dengan menggunakan medium tanam yang ditambahkan BAP pada konsentrasi 30 mg/l. Gatica et al., (2008) juga melaporkan keberhasilan induksi embryogenesis somatik dengan menggunakan BAP yang ditambahkan ke dalam medium tanam.