BAB III
METODE PENELITIAN
3.1
BAHAN DAN ALAT
3.1.1
Bahan
Bahan baku yang digunakan yaitu kacang kedelai (Glycine max) dari koperasi produsen tahu PT. Diazara Tresna, Bogor (Koperasi Produsen Tahu Tempe Indonesia [KOPTI]), air, dan koagulan CaSO4.2H2O. Dan bahan-bahan yang diperlukan untuk analisis terdiri dari NaCl, etanol 70%, NaOH, n-heksana, coomassie brilliant blue G-250, etanol 95%, asam fosforat 85%, bovine serum albumin (BSA), K2SO4, HgO, H2SO4 pekat, Na2S2O3.5H2O, H3BO3, HCl, akuades, indikator metilen, akrilamid, N,N’-metilen bisakrilamid, ammonium persulfat (APS), sodium dodecyl sulfate (SDS), tetrametil-etilendiamin (TEMED), tris base, glisin, gliserol, bromphenol blue, 2-merkaptoetanol, coomassie brilliant blue R-250, methanol, asam asetat glasial, akua-biodestilat, standar low molecular
weight protein (LMW).
3.1.2
Alat
Alat-alat yang digunakan selama penelitian meliputi alat pemasakan tahu, alat analisis tekstur, dan alat analisis komposisi protein tahu. Pemasakan tahu memerlukan peralatan dapur seperti blender, panci, kompor, pisau, cetakan tahu, kain blacu dan kain saringan tahu, termometer -10-100°C, sendok kayu pengaduk, perlengkapan penyaji, serta neraca kasar. Analisis tekstur secara objektif menggunakan perangkat texture profile analyzer TA-XT2i dan perangkat lunak terkait. Analisis komposisi protein tahu memerlukan sentrifuge, sentrifuge kondisi 4°C, hot plate, perlengkapan elektroforesis SDS-PAGE, spektrofotometer UV-visible, perangkat analisis Kjeldahl, pH meter, termometer -10-100°C, neraca analitik, tabung Eppendorf, tabung sentrifuge, tabung reaksi, kuvet, sudip, magnetic stirrer, mikropipet, sarung tangan, gelas kimia, labu takar 10 mL, labu takar 100 mL, dan labu takar 1000 mL.
3.2
METODE PENELITIAN
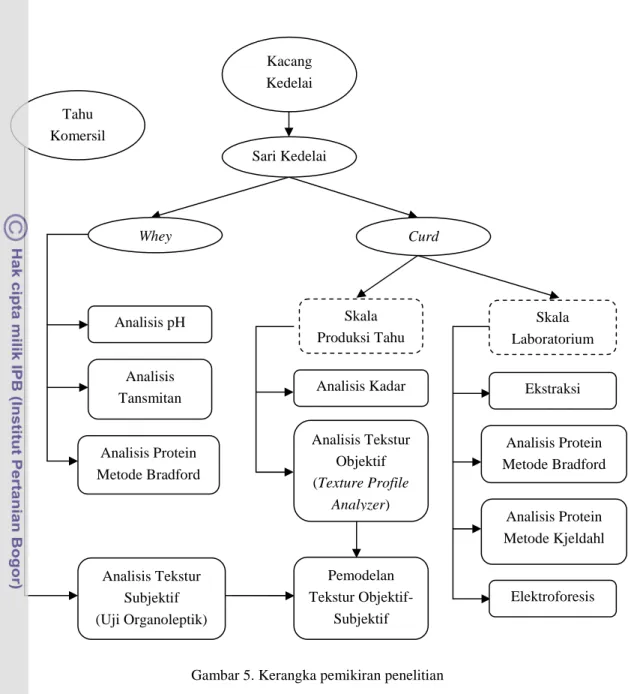
Penelitian ini terdiri dari tiga tahap. Tahap pertama adalah analisis kadar protein curd/tahu dan transmitan whey serta kadar air dan tekstur curd secara objektif. Lalu, dilanjutkan ke tahap kedua yaitu analisis komponen protein spesifik curd yang terdiri atas ekstraksi protein curd dan elektroforesis protein terekstraksi. Tahap ini menghasilkan komposisi protein curd berdasarkan bobot molekulnya. Dan tahap ketiga adalah analisis subjektif tahu oleh panelis yang meliputi seleksi panelis terlatih dan pengujian atribut kekerasan tahu. Data ini digunakan untuk mendukung data analisis tekstur objektif sebelumnya. Kemudian dilanjutkan dengan analisis keterkaitan/korelasi antar parameter analisis yang terukur. Secara garis besar, rancangan penelitian yang akan dilakukan dapat dilihat pada Gambar 5.
Gambar 5. Kerangka pemikiran penelitian
3.2.1
Tahap I
3.2.1.1
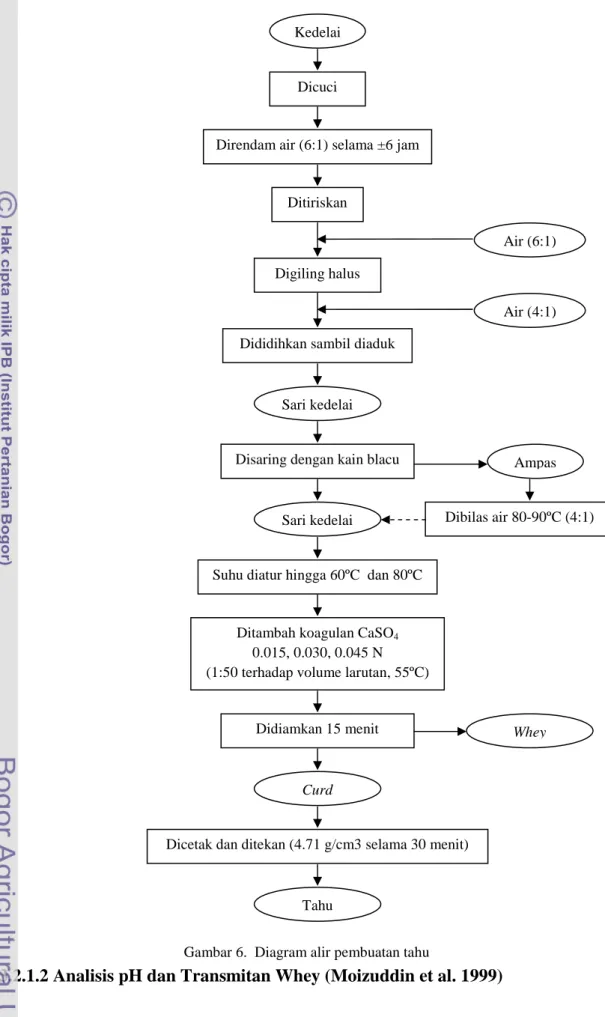
Pembuatan Tahu (Fahmi 2010)
Kacang kedelai yang telah dicuci dan direndam air (1:6) selama 6 jam, digiling dengan penambahan air (1:6) hingga diperoleh bubur kedelai. Bubur kedelai ditambah air (1:4) lalu didihkan selama 3 menit sambil terus diaduk. Selanjutnya sari kedelai disaring dan ampas dicuci dengan air mendidih (1:5). Kemudian sari kedelai yang diperoleh tersebut, diatur suhunya seperti desain perlakuan penelitian dan dikoagulasi dengan koagulan yang telah dilarutkan dalam air hangat 55°C (volume pelarut 2% dari volume sari kedelai). Suspensi didiamkan selama 15 menit, lalu dicetak dan dipress dengan tekanan 4.71 g/cm3 selama 30 menit, sehingga diperoleh curd tahu. Whey yang terbentuk dipisahkan untuk analisis selanjutnya. Alir pembuatan tahu tersebut dapat dilihat pada Gambar 6. Tahu Komersil Pemodelan Tekstur Objektif-Subjektif Elektroforesis Ekstraksi Protein Analisis Tekstur Subjektif (Uji Organoleptik) Analisis Tekstur Objektif (Texture Profile Analyzer) Analisis Kadar Analisis Protein Metode Kjeldahl Analisis Protein Metode Bradford Analisis Tansmitan Analisis pH Skala Laboratorium Skala Produksi Tahu Curd Whey Sari Kedelai Kacang Kedelai Analisis Protein Metode Bradford
Gambar 6. Diagram alir pembuatan tahu
3.2.1.2
Analisis pH dan Transmitan Whey (Moizuddin et al. 1999)
TahuDicetak dan ditekan (4.71 g/cm3 selama 30 menit)
Curd
Whey
Didiamkan 15 menit Ditambah koagulan CaSO4
0.015, 0.030, 0.045 N (1:50 terhadap volume larutan, 55ºC)
Suhu diatur hingga 60ºC dan 80ºC
Dibilas air 80-90ºC (4:1) Sari kedelai
Ampas Disaring dengan kain blacu
Sari kedelai Dididihkan sambil diaduk
Air (4:1) Digiling halus
Air (6:1) Ditiriskan
Direndam air (6:1) selama ±6 jam Dicuci
Tingkat keasaman whey hasil pengepresan curd diukur dengan menggunakan pH meter pada suhu ruang, sedangkan persen transmittan (%T) whey diukur secara spektrofotometri pada panjang gelombang 400 nm.
3.2.1.3
Analisis Kadar Protein Whey Metode Bradford (Zor-Selinger 1996)
3.2.1.3.1
Preparasi Pereaksi Bradford
Sebanyak 100 mg pewarna CBB G-250 dilarutkan ke dalam 50 mL etanol 95%. Selanjutnya ditambahkan 100 mL asam fosforat 85% dan ditepatkan hingga 1 L dengan menggunakan akuades. Larutan kemudian disaring menggunakan kertas Whatman No.1 dan disimpan dalam botol gelap.
3.2.1.3.2
Pembentukan Kurva Standar
Sebanyak 100 µL larutan BSA (100-1000 µg/mL) dipipet ke dalam tabung reaksi berukuran 1.2 x 10 cm. Kemudian ditambahkan 5 mL pereaksi Bradford. Larutan kemudian divorteks dan diukur secara spektrofotometri pada λ = 595 nm setelah 5 menit. Untuk blanko, sebanyak 100 µL akuades ditambahkan 5 mL perekasi Bradford dan diukur dengan cara yang sama. Kurva standar yang diperoleh digunakan untuk mengukur konsentrasi sampel.
3.2.1.3.3
Pengukuran Sampel
Sebanyak 100 µL sampel dipipet ke dalam tabung reaksi berukuran 1.2 x 10 cm. Kemudian ditambahkan 5 mL pereaksi Bradford. Larutan kemudian divorteks dan diukur secara spektrofotometri pada λ = 595 nm setelah 5 menit.
3.2.1.4
Analisis Kadar Air Tahu Metode Oven (SNI 1992)
Sejumlah sampel (1-2 g) dimasukkan ke dalam cawan yang telah diketahui beratnya. Kemudian cawan dimasukkan ke dalam oven bersuhu 105°C hingga diperoleh berat yang konstan. Perhitungan kadar air berdasarkan berat basah sesuai dengan Persamaan 3.1.
%
100
%
(3.1)
Keterangan :
a = berat cawan dan sampel awal (g) b = berat cawan dan sampel akhir (g) c = berat sampel awal (g)
Analisis tekstur curd secara objektif dilakukan dengan menggunakan alat Texture Analyzer dengan metode Texture Profile Analysis (TPA). Analisis ini dilakukan dengan alat Texture Analyzer TA-XT2i. Alat ini telah dilengkapi dengan sistem komputerisasi. Pengukuran dengan metode texture
profile analysis dilakukan dengan terlebih dahulu memilih setting Texture Profile Analysis pada
program Texture Analyzer. Pengaturan alat TA-XT2i untuk pengukuran TPA curd dapat dilihat pada Tabel 6.
Tabel 6. Pengaturan TA-XT2i untuk pengukuran TPA curd
Pre-test speed 1.5 mm/sec
Test speed 1.5 mm/sec
Post-test speed 10 mm/sec
Target mode 0 = distance
Unit distance % strain
Distance 30%
Time 5 sec
Trigger type 0 = Auto (force)
Unit force grams
Trigger force 20 g
Tare mode 0 = Auto
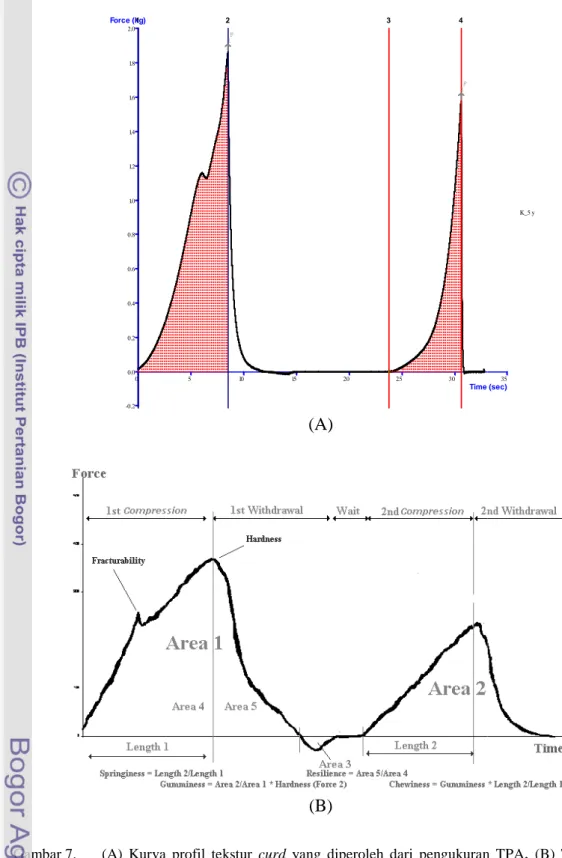
Sampel curd yang akan dicetak silinder berdiameter ±3 cm dan tinggi 2 cm. Sampel kemudian ditempatkan pada wadah uji dan dilakukan pengukuran tekstur melalui pemberian gaya tekan (compression) sebanyak dua kali yang merupakan simulasi dari proses pengunyahan di dalam mulut. Pengukuran sampel curd dilakukan sebanyak empat kali dari empat titik yang berbeda. Sampel dianalisis menggunakan probe P/100 dengan diameter 50mm. Parameter yang diukur menggunakan metode TPA adalah hardness, cohesiveness, chewiness, dan gumminess. Output hasil pengukuran berupa grafik kemudian dianalisis untuk menghitung parameter rheologi yang diinginkan. Parameter rheologi dan cara menentukannya dapat dilihat dengan panduan pada Gambar 7 dan Tabel 7.
Hardness atau kekerasan adalah puncak kurva (gaya tekan) pertama pada produk. Fracturability atau kerapuhan adalah titik puncak signifikan pertama saat probe menekan produk
pertama kali. Cohesiveness atau daya kohesif adalah kemampuan produk menahan deformasi kedua relatif setelah mendapatkan deformasi pertama. Nilai ini diukur sebagai hasil bagi luas area positif di bawah kurva kedua dengan luas area positif di bawah kurva pertama. Resilience atau daya kenyal adalah kemampuan produk untuk tegak kembali ke posisi semula. Daya kenyal ini didapat dengan membagi luas area negatif saat penakanan probe pertama ditarik dengan luas area positif kurva pertama. Springiness atau elastisitas adalah kemampuan fisik produk melenting kembali setelah terdeformasi akibat penekan pertama. Nilai ini diukur dengan membagi jarak penekanan kedua (Length 2 pada Gambar 7) dengan jarak penekan pertama (Length 1). Gumminess atau kelengketan diukur pada produk semi-solid. Nilai kelengketan adalah hasil kali kekerasan dengan daya kohesif.
Gambar 7. (A) Kurva profil tekstur
TPA untuk produk pangan dengan parameter (www.texturetechnologies.com
Tabel 7. Parameter rheologi dan cara penentuannya dalam analisis profil
0 2.0 1.8 1.6 1.4 1.2 1.0 0.8 0.6 0.4 0.2 0.0 -0.2 Force (kg)1
(A)
(B)
Kurva profil tekstur curd yang diperoleh dari pengukuran TPA
TPA untuk produk pangan dengan parameter tekstur dan perhitungannya www.texturetechnologies.com
)
Parameter rheologi dan cara penentuannya dalam analisis profil
5 10 15 20 25 30 Time (sec) 2 3 4 1 F 2 F
yang diperoleh dari pengukuran TPA
,
(B) Tipe kurva tekstur dan perhitungannyaParameter rheologi dan cara penentuannya dalam analisis profil
35
Time (sec)
No. Parameter Rheologi Cara Menentukan
1. Kekerasan (hardness) Ditentukan dari maksimum gaya (nilai puncak) pada tekanan/kompresi pertama.
2. Kerapuhan (brittlenesss)
Ditentukan dari puncak yang pertama kali terbaca pada tekanan pertama.
3. Elastisitas (springiness)
Ditentukan dari jarak yang ditempuh oleh sampel pada tekanan kedua sehingga tercapai nilai gaya maksimumnya (L2) dibandingkan dengan jarak yang ditempuh oleh produk pada tekanan pertama sehingga tercapai nilai gaya maksimumnya (L1) dan dirumuskan sebagai L2/L1. Elastisitas menentukan seberapa besar produk dapat kembali ke kondisi semula setelah diberikan tekanan pertama.
4. Daya kohesif (cohesiveness)
Dihitung dari luasan di bawah kurva pada tekanan kedua (A2) dibagi dengan luasan di bawah kurva pada tekanan pertama (A1) atau A2/A1
5. Kelengketan (gumminess)
Dihitung dari nilai kekerasan dikalikan dengan daya kohesif atau A2/A1*kekerasan
6. Daya kunyah (chewiness)
Dihitung dari hasil perkalian nilai kelengketan dengan elastisitas, atau L2/L1*kelengketan
3.2.2
Tahap II
3.2.2.1
Ekstraksi Protein Curd
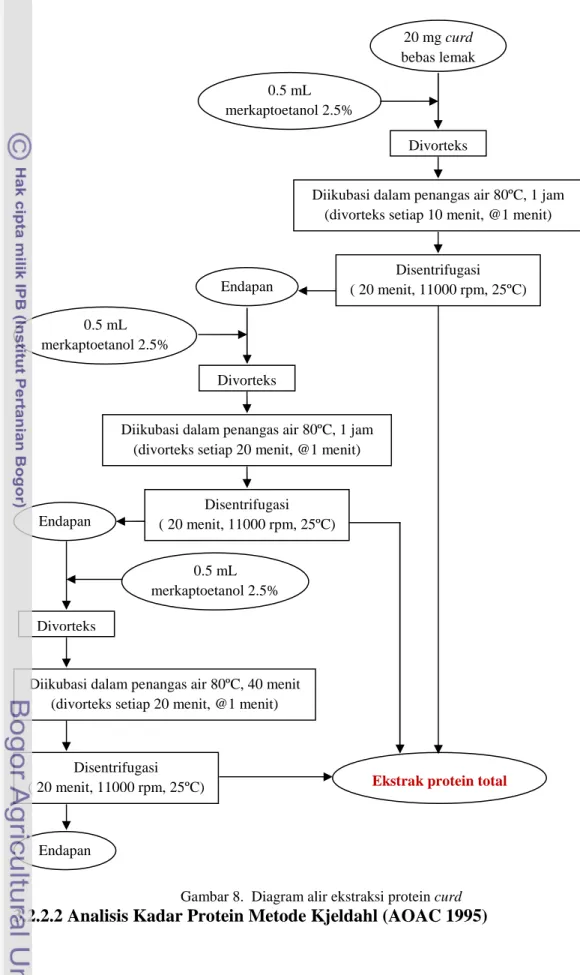
Sebanyak 20 mg curd direndam dengan 1 mL methanol selama semalam. Kemudian curd disentrifusi selama 15 menit pada kecepatan 4500 rpm dan suhu 25°C. Lalu methanol berlemak dibuang dan heksana dalam curd diuapkan di suhu ruang dalam lemari asam sampai aroma heksana tidak tercium. Sampel curd yang telah bebas bebas lemak ditambah pelarut merkaptoetanol 2,5% ke dalam tabung Eppendorf 1.5 mL lalu divorteks. Sampel divorteks dan diinkubasi pada penangas air 80°C selama 1 jam sambil divorteks setiap 10 menit, masing-masing selama 1 menit. Kemudian sampel disertifuse selama 20 menit pada kecepatan 11000 rpm suhu 25°C. Filtrat dimasukkan ke dalam tabung Eppendorf stock dan endapan ditambah 0.5 ml pelarut merkaptoetanol 2.5%. Lalu sampel divorteks dan diinkubasi pada penangas air 80°C selama 1 jam sambil divorteks setiap 20 menit, masing-masing selama 1 menit. Kemudian sampel disertifuse (20 menit, 11000 rpm, 25°C). Filtrat kembali dimasukkan ke dalam tabung Eppendorf stock dan endapan ditambah 0.5 ml pelarut merkaptoetanol 2,5%. Endapannya ditambah 0,5 ml pelarut merkaptoetanol 2.5% lalu divorteks dan diinkubasi pada penangas air 80°C selama 40 menit sambil divorteks setiap 20 menit, masing-masing selama 1 menit. Kemudian sampel disertifuse kembali (20 menit, 11000 rpm, 25°C). Filtrat kembali
dimasukkan ke dalam tabung Eppendorf stock untuk selanjutnya dianalisis kadar proteinnya dengan metode Bradford. Alur tahap ekstraksi protein curd dapat dilihat pada Gambar 8.
Gambar 8. Diagram alir ekstraksi protein curd
3.2.2.2
Analisis Kadar Protein Metode Kjeldahl (AOAC 1995)
Endapan
Ekstrak protein total
Disentrifugasi ( 20 menit, 11000 rpm, 25ºC)
Diikubasi dalam penangas air 80ºC, 40 menit (divorteks setiap 20 menit, @1 menit) Divorteks 0.5 mL merkaptoetanol 2.5% Disentrifugasi ( 20 menit, 11000 rpm, 25ºC) Endapan
Diikubasi dalam penangas air 80ºC, 1 jam (divorteks setiap 20 menit, @1 menit)
Divorteks 0.5 mL merkaptoetanol 2.5% Disentrifugasi ( 20 menit, 11000 rpm, 25ºC) Endapan
Diikubasi dalam penangas air 80ºC, 1 jam (divorteks setiap 10 menit, @1 menit)
Divorteks 0.5 mL
merkaptoetanol 2.5%
20 mg curd bebas lemak
Sejumlah sampel (100-250 mg) ditimbang ke dalam labu Kjeldahl. Kemudian ditambahkan 1.9±0.1 g K2SO4 , 40±10 mg HgO dan 2±0.1 mL H2SO4. Sampel dididihkan selama 1-1.5 jam dengan kenaikan suhu secara bertahap sampai cairan menjadi jernih, lalu didinginkan. Sejumlah kecil akuades diteteskan perlahan lewat dinding labu kemudian labu digoyang pelan agar kristal yang terbentuk larut kembali. Isi labu kemudian dipindahkan ke dalam alat destilasi dan labu dibilas 5-6 kali dengan 1-2 mL akuades. Lalu ditambahkan 8-10 mL larutan 60% NaOH-5% Na2S2O3 ke dalam alat destilasi. Erlenmeyer berisi 5 mL H3BO3 dan 2 tetes indikator metilen red-metilen blue diletakkan di bawah kondensor dengan kondisi ujung kondensor terendam di bawah larutan H3BO3. Destilasi dilakukan hingga diperoleh destilat sebanyak ± 15 mL. Destilat yang diperoleh selanjutnya diencerkan hingga ± 50 mL dan dititrasi dengan HCl terstandar sampai terjadi perubahan warna menjadi abu-abu keunguan. Perhitungan kadar protein sesuai dengan Persamaan 3.2 dan 3.3.
%
!" # $%&
14.007 100%
(3.2)* +,- . /
899 0 : 7 ; :0 1234567< %
= >,+ >+.?- @
(3.3)3.2.2.3
Elektroforesis Protein Terekstraksi (Bolag -Edelstein 1991)
Elektroforesis SDS-Polyacrylamide Gel Electrophoresis (SDS-PAGE) dilakukan dengan metode Bolag dan Edelstein (1991), untuk menentukan berat molekul protein yang mempengaruhi tekstur curd yang terbentuk. Analisis SDS-PAGE dilakukan menggunakan gel akrilamid dengan konsentrasi separating gel 12% dan stacking gel 5%. Sampel yang dielektroforesis adalah supernatan protein hasil ekstraksi dari sampel curd kedelai. Beberapa tahapan utama yang harus dilakukan dalam melakukan elektroforesis SDS-PAGE adalah 1) pembuatan separating gel, 2) pembuatan stacking gel, 3) persiapan sampel, 4) running gel, 5) pewarnaan gel, 6) destaining gel, dan 7) penentuan berat molekul protein-protein yang terpisahkan.
3.2.2.3.1
Pembuatan Larutan Stok
Larutan stok yang dibuat terdiri atas larutan A, larutan B, larutan C, larutan APS, buffer elektroforesis, buffer sampel, larutan pewarna, dan larutan penghilang warna.
3.2.2.3.1.1
Larutan A (Akrilamid 30%; 0.8 bisakrilamid), 100 mL
Sebanyak 30.0 g akrilamid dan 0.8 g N,N’-metilen-biasakrilamid dilarutkan dalam 100 mL akuades. Larutan disaring melalui filter 0.45 µm. Pada waktu penimbangan dan selama proses pelarutan, analis selalu harus menggunakan sarung tangan dan tutup wadah dengan parafilm. Larutan akrilamid dapat disimpan selama 1 bulan dalam lemari pendingin bersuhu 4oC.
Sebanyak 18.17 g Tris base dan 4 mL 10% SDS dilarutkan dalam 40 mL akuades. Larutan dibuat pada pH 8.8 dengan 1 N HCl dan ditepatkan dengan akuades hingga volume total 100 mL. Kemudian larutan disaring dengan filter 0.45 µm.
3.2.2.3.1.3
Larutan C (4x Tris-Cl/SDS, pH 6.8), 100 mL
Sebanyak 6.05 g Tris base dan 4 mL 10% SDS dilarutkan dalam 40 mL akuades. Larutan dibuat pada pH 6.8 dengan 1 N HCl. Dan ditepatkan dengan akuades hingga volume total 100 mL. Kemudian larutan disaring dengan filter 0.45 µm.
3.2.2.3.1.4
10% ammonium persulfat (APS), 0.5 mL
APS 10% dibuat segar setiap kali akan melakukan elektroforesis yaitu dengan melarutkan 0.05 g amonium persulfat dalam 0.5 mL akuades.
3.2.2.3.1.5
5x SDS/ buffer elektroforesis, 1 L
Sebanyak 15.1 g tris base, 72.0 g glisin, dan 5.0 g SDS dilarutkan dalam 800 mL akuades. Setelah larut, volume ditepatkan hingga 1.0 L. Untuk membuat 1x SDS/buffer elektroforesis, 1 bagian volume larutan di atas diencerkan dalam 4 bagian volume akuades.
3.2.2.3.1.6
2x SDS/buffer sampel, 100 mL
Sebanyak 30 mL 10%SDS, 10 mL gliserol, 5.0 mL 2-merkaptoetanol, 12.5 mL 4x Tris-Cl/SDS, pH 6.8 dan 5-10 mg bromphenol blue dilarutkan dalam akuades dan ditepatkan volume hingga 100 mL. Buffer disimpan pada suhu rendah.
3.2.2.3.1.7
Larutan pewarna (staining)
Sebanyak 1 gram coomasie brilliant blue R-250, 450 mL metanol, dan 100 mL asam asetat glasial dilarutkan dalam 450 mL akuades.
3.2.2.3.1.8
Larutan penghilang warna (destaining)
Sebanyak 100 mL metanol, 100 mL asam asetat glasial dilarutkan dalam 800 mL akuades.
3.2.2.3.2
Pembuatan Separating Gel
Dua lempengan kaca (mini slab) yang akan digunakan sebagai cetakan gel dirangkai sesuai dengan petunjuk pemakaian. Sebanyak 4 mL larutan A dipipet ke dalam gelas piala, kemudian ditambahkan 2.5 mL larutan B dan 3.5 mL akua-biodestilat. Campuran kemudian diaduk perlahan dengan menggoyangkan gelas piala. Selanjutnya, sebanyak 50 µL APS 10% dan 5 µL TEMED
ditambahkan ke dalam campuran dan diaduk kembali dengan perlahan. Campuran dimasukkan ke dalam lempengan kaca (mini slab) tanpa menimbulkan gelembung udara dengan menggunakan mikropipet sampai sekitar 1 cm dari atas lempengan. Bagian yang tidak diisi gel diberi akuades untuk meratakan gel yang terbentuk. Gel kemudian dibiarkan mengalami polimerisasi selama 30-60 menit. Komposisi separating gel dapat dilihat pada Tabel 8.
Tabel 8. Komposisi separating gel untuk dua plat
Bahan
Konsentrasi Akhir Poliakrilamid
5% 10% 15% 20% Larutan A 2500 µL 5000 µL 7500 µL 10000 µL Larutan B 3750 µL 3750 µL 3750 µL 3750 µL Akuades 8750 µL 6250 µL 3750 µL 1250 µL APS 10% 50 µL 50 µL 50 µL 50 µL TEMED 10 µL 10 µL 10 µL 10 µL
3.2.2.3.3
Pembuatan Stacking Gel
Air dibuang dari atas separating gel dan dikeringkan dengan menggunakan tissue. Larutan A, C, dan akuades dicampur dalam gelas piala. TEMED dan APS 10% ditambahkan sambil terus diaduk dengan magnetic stirrer. Larutan gel dipipet ke dalam mini slab di atas separating gel sampai mencapai puncak plat. Kemudian sisir dimasukkan dengan cepat untuk menghindari pembentukan gel sebelum sisir dimasukkan. Pemasukan sisir harus dilakukan dengan hati-hati agar udara tidak terperangkap. Stacking gel dibiarkan berpolimerisasi selama 30 menit. Komposisi stacking gel dapat dilihat pada Tabel 9.
Tabel 9. Komposisi stacking gel untuk dua plat
Bahan Gel 5% Larutan A 650 µL Larutan C 1250 µL Akuades 3050 µL TEMED 5 µL APS 10% 25 µL
Sampel berupa curd (endapan protein) dilarutkan dalam 50 sampai 100 µL 2 x SDS/ buffer sampel di dalam tabung Eppendorf, kemudian dipanaskan selama 1 menit dalam air mendidih 100oC. Setelah pemanasan, dinginkan pada suhu ruang dan sentrifusa dengan kecepatan rendah selama 5 menit. Sampel siap dimasukkan ke dalam pelat gel.
3.2.2.3.5
Running Elektroforesis (Pemisahan Protein)
Reservoir buffer bawah diisi dengan buffer elektroforesis. Sisir dari slab dilepaskan, kemudian
slab direkatkan pada chamber elektroforesis. Reservoir atas kemudian diisi dengan buffer
elektroforesis. Sumur-sumur pada gel diatur agar tidak ada gelembung air yang terdapat di dalamnya, kemudian sampel dimasukkan pada masing-masing sumur. Katup elektroda dipasang dengan arus mengalir ke anoda. Sumber listrik dinyalakan dan dijaga konstan pada 125 V. Running dilakukan selama 30-40 menit sampai migrasi dye sekitar 1 cm dari dasar. Setelah selesai, aliran listrik dimatikan dan katup elektroda dilepaskan, lalu plat gel dipindahkan dari elektroda.
3.2.2.3.6
Pewarnaan Gel
Gel diangkat dari slab dan dipindahkan ke dalam wadah yang telah berisi pewarna coomassie
brilliant blue. Kemudian diagitasi dalam rotary shaker selama 5-10 menit. Larutan stain dibuang dan
diganti dengan larutan penghilang warna (destain).
3.2.2.3.7
Destaining Gel (Penghilangan Warna)
Setelah larutan stain dibuang, ditambahkan larutan penghilang warna (larutan destaining). Penghilangan warna dilakukan dengan merendam gel dalam larutam destaining selama 30 menit, lalu membilasnya dan mengulang perendaman yang serupa sebanyak 3 kali2 (dengan larutan destaining yang baru). Setelah itu pita-pita protein sudah mulai nampak, namun latar gel belum bersih dari larutan pewarna. Maka gel kembali direndam larutan destaining semalaman. Kemudian gel ditiriskan dan gel siap dianalisis. Semua larutan destaining bekas penghilangan warna dibuang dan tidak bisa dipakai ulang.
3.2.2.3.8
Penentuan Berat Molekul Protein yang Terpisahkan
Berat molekul protein sampel dapat dihitung dari persamaan regresi antara mobilitas relatif protein marker (penanda protein) dengan log dari berat molekul marker yang telah diketahui. Mobilitas relatif protein dihitung dengan membandingkan jarak migrasi protein diukur dari garis awal separating gel sampai ujung pita protein yang dibandingkan dengan jarak migrasi tracking dye. Pengukuran mobilitas relatif sesuai dengan Persamaan 3.4.
2
Metode Bolag-Eldestein (1991) menyarankan pencucican/penghilangan warna dilakukan dalam rotary shaker selama 1 malam. Hal tersebut dilakukan karena keterbatasan alat analisis dalam lab
A=
BCDCE FGHDCIG 42 O670 PQ5BCDCE FGHDCIG JDKLMGN(3.4)
3.2.2.3.9
Pengukuran Tebal Pita Protein Terelektroforesis
Pengukuran ini dilakukan dengan menggunakan perangkat lunak Image J. Program membaca tebal pita per kolom yang dipilih sebagai kurva yang berfluktuasi. Semakin banyak pita yang terbaca, semakin banyak puncak kurva. Tinggi dan lebar kurva dipengaruhi oleh ketebalan dan intensitas pita. Semakin tebal pita, semakin lebar kurva, dan semakin tinggi intensitas warna pita, semikin tinggi puncak pita. Pengukuran dilakukan dengan membandingkan posisi puncak protein sampel dengan posisi puncak protein standar untuk memperoleh jenis protein yang sama. Konsentrasi protein sampel diperolah dengan pengukuran luas kurva di bawah puncak samapi batas dasar. Batas dasar merupakan satu buah garis lurus yang ditaik dan memotong satu gambar keseluruhan, sehingga diperoleh beberapa kurva utama sesuai dengan jumlah protein standar yang dibandingkan.
3.2.3
Tahap III
3.2.3.1
Seleksi Panelis Terlatih
Seleksi dilakukan untuk mendapatkan 12 orang panelis terlatih, yaitu panelis yang mengerti prinsip uji organoleptik dan telah dilatih oleh analis untuk melakukan uji organoleptik tekstur tahu. Penggunaan panelis terlatih dapat memperkecil standar deviasi data subjektif tekstur tahu. Seleksi dilakukan dengan uji penekanan sampel tahu untuk mengukur parameter kekerasan tahu. Seleksi terdiri dari uji segitiga dan uji ranking. Setiap panelis umum mendapat 3 set pengujian. Setiap set terdiri dari 1 uji segitiga dan 1 uji ranking. Panelis yang lolos seleksi adalah panelis yang minimal menjawab dengan benar 2 dari 3 pengujian.
Di setiap pengujian, panelis disajikan sampel tahu segar yang dipotong ukuran 1 x 1 x 1 cm3. Sampel disajikan pada suhu ruang segera setelah tahu dipotong. Panelis melakukan pengujian di
booth yang terpisah. Penilaian dilakukan dengan menekan tahu, mengapitnya dengan ujung ibu jari
dan telunjuk di sisi vertikal tahu, tanpa mengangkat potongan tahu. Panelis hanya menilai atribut kekerasan, tanpa dipengaruhi oleh atribut sensori lain.
3.2.3.1.1
Uji Segitiga
Panelis disajikan 3 potong tahu yang terdiri atas 2 sampel sama dan 1 sampel beda dari segi atribut tekstur. Panelis melakukan pengujian tekstur. Kemudian, di antara ketiga tahu tersebut, panelis harus menentukan 1 tahu yang berbeda, dan mengisinya di lembar jawaban, seperti yang terdapat pada Lampiran 1.
3.2.3.1.2
Uji Ranking
Panelis disajikan 3 potong tahu yang terdiri atas 3 sampel berbeda dari segi atribut tekstur. Panelis melakukan pengujian tekstur. Kemudian, mengurutkan ketiga tahu tersebut dari yang terkeras
(diberi nilai 1) samapi terlunak (diberi nilai 3), dan mengisinya di lembar jawaban, seperti yang terdapat pada Lampiran 2.
3.2.3.2
Uji Organoleptik
Tahu yang digunakan adalah tahu komersil dari jenis tofu (tahu gel tanpa penambahan telur
ataupun rasa) dan tahu press dari berbagai merk. Semua sampel yang akan dijui selama tahap III telah diukur kekerasannya secara objektif dengan metode Texture Profile Analyser (TPA). Sampel tahu segar dipotong ukuran 1 x 1 x 1 cm3. Sampel disajikan pada suhu ruang segera setelah tahu dipotong. Kemudian, sampel dinilai kekerasannya secara subjektif dengan menggunakan skala garis. Garis sepanjang 15 cm mewakili parameter tekstur paling lunak (nilai 0 di titik 0 cm) sampai paling keras (nilai 15 di titik 15 cm). Penilaian dilakukan dengan menekan tahu, mengapitnya dengan ujung ibu jari dan telunjuk di sisi vertikal tahu, tanpa mengangkat potongan tahu. Panelis hanya menilai atribut kekerasan, tanpa dipengaruhi oleh atribut sensori lain.
Tahap uji organoleptik terdiri dari 2 langkah, yaitu Focus Group Discussion (FGD) dan pengujian sampel. Langkah pertama, panelis terlebih dahulu diberi standar tahu terlunak yang diberi nilai 1 dan tahu terkeras yang diberi nilai 14. Setelah itu panelis diberi 3 buah sampel tahu yang berbeda dan dinilai kekerasannya. Nilai berada di antara rentang 1 sampai 14. Pemberian nilai dilakukan meletakkan garis vertikal di titik yang sesuai. Setelah itu, penguji berdiskusi bersama panelis untuk membahas hasil pengujian sebelumnya. FGD dilakukan sampai panelis memiliki persepsi yang sama terhadap nilai kekerasan tahu, yang ditandai dengan semakin menurunnya standar deviasi data setiap tahu. Langkah berikutnya adalah pengujian 2 sampel baru. Semua hasil penilaian yang mencakup 2 sampel standar, 3 sampel FGD, dan 2 sampel baru kemudian diplotkan bersama data objektif dan diregresikan sehingga diperoleh sebuah persamaan garis linear.