STUDI AWAL REAKSI SIMULTAN SAKARIFIKASI DAN FERMENTASI TEPUNG
SORGHUM (Sorghum Bicolor L. Moench) DENGAN KATALIS ENZIM
GLUCOAMYLASE DAN YEAST (Saccharomyces cereviseae)
Endah Retno D1, Enny K A1, dan Fadilah1 1
Jurusan Teknik Kimia, Fakultas Teknik UNS,
Jl. Ir. Sutami No.36 A, Surakarta 57126, Telp./Fax : 0271-632112. E-mail: [email protected]
Abstract: Sorghum is a crop which have potency to be developed because lenient to dryness
and pond irrigate, and also hold up to pest trouble. Sorghum also has a relatively high carbohydrate content that can be processed into ethanol. Sorghum flour is converted into ethanol via simultaneous saccharification reaction and fermentation (SSF). This research aims to study the effect of concentration of yeast (Saccharomyces cereviseae), the influence of catalyst concentration shakerbath glucoamylase and the influence of rotation on the amount of glucose / sugar reduction. The variable on this research is concentration yeast ( 2, 4 and 8 gr), concentration of katalis enzyme glucoamylase ( 1, 2, 4 and 8 ml) and rotation shaker ( 6 and 9 scale shaker). SSF reactions performed using sorghum flour, erlenmeyer in the shaker bath with a temperature gauge. Liquefaction reaction with the addition of the enzyme alpha amylase (Baccilus Lichenformis), at 80 oC, pH 6.9, for 120 minutes. Furthermore, SSF reaction by the addition of the enzyme glucoamylase (Aspergillus Niger) and yeast (Saccharomyces cereviseae) at 30 oC, pH 4.8, 72 hours. Sampling for reducing sugar analysis performed every 24 hours. Glucose samples were analyzed by using the method of Shafer-Somogiyi.
Keywords : Flour Sorgum, a simultaneous saccharification and fermentation process
PENDAHULUAN
Etanol adalah salah satu bahan bakar yang terbarukan yang mempunyai nilai ekonomi yang tinggi. Etanol bisa digunakan dalam bentuk murni ataupun sebagai campuran untuk bahan bakar gasolin (bensin) maupun hidrogen. Interaksi etanol dengan hidrogen bisa dimanfaatkan sebagai sumber energi fuel cell ataupun dalam mesin pembakaran dalam (internal combustion engine) konvensional. Diversifikasi bahan baku etanol di Indonesia perlu dikembangkan karena negara Indonesia adalah negara agraris yang memiliki kekayaan tanaman yang berbagai jenis.
Sorgum (Sorgum bicolor L.) dapat digunakan sebagai pengganti dalam industri pati jagung. Keunggulan sorgum terletak pada daya adaptasi agroekologi yang luas, tahan terhadap kekeringan, produksi tinggi, perlu input lebih sedikit serta lebih tahan terhadap hama dan penyakit dibanding tanaman lain. Dengan kandungan karbohidrat yang cukup tinggi sekitar 73 g/100 g bahan, maka sorghum dapat digunakan sebagai bahan baku pembuatan etanol. Industri etanol dari bahan baku sorgum banyak dibangun di negara maju seperti Amerika Serikat.
Penelitian ini bertujuan mempelajari pengaruh konsentrasi yeast (saccharomyces cereviseae), pengaruh konsentrasi katalis glucoamylasedan pengaruh putaran shakerbath terhadap jumlah glukosa/gula reduksi pada reaksi simultan sakarifikasi dan fermentasi tepung sorghum). Variabel yang diteliti adalah konsentrasi yeast (2, 4 dan 8 gr), konsentrasi katali enzim glucoamylase (1,2,4 dan 8 ml) serta putaran shaker (6 dan 9 skala shaker).
LANDASAN TEORI
Tabel 1. Kandungan Gizi Sorgum
Unsur Nutrisi Kandungan/100 g
Berat Jagung Singkong Sorgum Kedelai
Kalori (cal) 360 361 146 332 286
Sumber: Direktorat Gizi, Departemen Kesehatan RI (Induksi Mutasi pada Sorgum dengan SinarGamma)
Pati adalah salah satu jenis polisakarida yang amat luas tersebar di alam. Bahan disimpan sebagai cadangan makanan bagi tumbuh-tumbuhan di dalam biji, buah, umbi dan batang. Tumbuh-tumbuhan yang mempunyai kadar pati yang tinggi antara lain padi, sagu, ketela pohon, ketela rambat dan jagung. Secara histologis, pati disimpan dalam bentuk plastida yang dinamakan amiloplast di dalam sel. Dilihat dari rumus kimianya, pati adalah karbohidrat yang berbentuk polisakarida berupa polimer anhidro monosakarida dengan rumus umum (C6H10O5)n . Komponen utama penyusun pati adalah amilosa dan amilopektin. Amilosa tersusun atas satuan glukosa yang saling berkaitan melalui ikatan 1-4 glukosida, sedang amilopektin merupakan polisakarida yang tersusun atas 1-4α glikosida dan mempunyai rantai cabang 1-6α glukosida (Winarno, 1980)
Hidrolisis adalah suatu proses antara reaktan dengan air agar suatu senyawa pecah atau terurai.Pada reaksi hidrolisis pati dengan air, air akan menyerang pati pada ikatan 1-4 α glukosida menghasilkan dextrin, sirup atau glukosa tergantung pada derajat pemecahan rantai polisakarida dalam pati. Tetapi reaksi antara air dan pati ini berlangsung sangat lambat sehingga diperlukan bantuan katalisator untuk memperbesar keaktifan air. Katalisator ini bisa berupa asam maupun enzim. Pati dikonversi menjadi gula melalui proses hidrolisis dengan enzim meliputi pemecahan menjadi gula kompleks (liquefaction) dan sakarifikasi (Saccharification) . Enzim yang digunakan dalam hidrolisis pati pada tahap liquifikasi adalah enzim alpha amylase dan pada tahap sakarifikasi adalah enzim gluco amylase. Enzim alpha amylase berperan dalam memecahkan ikatan a-1,4 glukosid dari amillose dan amilopektin secara acak. Proses pemecahan ini dilakukan pada gelatin pati, sehingga dihasilkan maltosa dan maltotriosa
yang terikat pada a-1,6 glukosid, yang menyebabkan penurunan viskositas pada gel pati. Sedangkan enzim glucoamylase berperan dalam memecah kedua ikatan glukosid (a-1,4 glukosid dan a-1,6 glukosid) dari pati, poligosakarida dan dekstrin sehingga dihasilkan glukosa. Enzim gluco amylase hanya aktif memecah pati yang sudah menjadi gelatin (Reed,1975). Enzim alpha amylase terdapat dalam jaringan tanaman, mamalia dan mikroba. Hidrolisis amilosa oleh alpha amylase terjadi dalam dua tahap. Tahap pertama adalah degradasi amilosa menjadi maltosa dan maltotriosa yang terjadi secara acak. Degradasi tersebut terjadi sangat cepat dan diikuti dengan penurunan viskositas yang sangat cepat. Sedangkan tahap kedua bersifat lebih lambat dengan membentuk glukosa dan maltosa sebagai hasil akhirnya Menurut Fogarty (1983), enzim alphaamylase pada umumnya stabil pada kisaran pH 5,5 -8. Enzim dari bakteri dapat digunakan untukmengkatalisasi proses hidrolisis pati pada suhu tinngi. Sifat tersebut sangat berguna pada proses likuifikasi yang mempunyai suhu gelatinasi tinggi (Tjokro-adikoesoemo,1985). Reaksi Hidrolisis tepung berlangsung dua tahap sebagai berikut :
2 (C6H10O5)n + H2O C12H22O11 (1)
C12H22O11 + H2O (C6H12O6) (2)
Aktivitas enzim secara umum dipengaruhi oleh suhu, pH larutan, konsentrasi enzim, konsentrasi substrat, inhibitor dan waktu. Temperatur optimum untuk enzim alpha amylase berkisar 70 - 90 oC dan untuk gluco amylase 50 -60 OC. Sedangkan derajat keasaman untuk enzim gluco amylase adalah 4.5 - 5 (Reed, 1975). Aktivitas alpha amylase ditentukan dengan mengukur hasil degradasi pati. Penurunan substrat dapat diukur dengan berkurangnya derajat pewarnaan yodium
-amylase
terhadap substrat. Selain itu, keaktifan alpha amylase dapat juga dinyatakan dengan mengukur viskositas dan jumlah gula pereduksi yang terbentuk (Tjokroadikoesoemo,1985).
Produksi Bioetanol
Secara umum, produksi bioetanol ini mencakup 3 (tiga) rangkaian proses, yaitu: Persiapan Bahan baku, Fermentasi, dan Pemurnian.
Persiapan Bahan Baku
Bahan baku untuk produksi bietanol bisa didapatkan dari berbagai tanaman, baik yang secara langsung menghasilkan gula sederhana atau yang menghasilkan pati. Persiapan bahan baku secara umum terbagi menjadi beberapa proses, yaitu:
Tebu dan Gandum manis harus digiling untuk mengektrak gula
Pati dan material selulosa harus dihancurkan untuk memecahkan susunan patinya agar bisa berinteraksi dengan air secara baik Pemasakan, Pati dikonversi menjadi gula melalui proses pemecahan menjadi gula kompleks (liquefaction) dan sakarifikasi (Saccharification)
Tahap Liquefaction
Pencampuran dengan air secara merata hingga menjadi bubur. Pengaturan pH agar sesuai dengan kondisi kerja enzim. Penambahan katalisator dengan perbandingan yang tepat. Pemanasan bubur hingga kisaran 80 sd 90 oC, dimana pati bebas akan mengalami gelatinasi, sampai suhu optimum katalis asam bekerja memecahkan struktur pati secara kimiawi menjadi gula komplek (dextrin). Proses Liquefaction selesai ditandai bubur yang diproses menjadi lebih cair seperti sup.
Tahap sakarifikasi
pemecahan gula kompleks menjadi gula sederhana, melibatkan proses sebagai berikut: Pendinginan bubur sampai suhu optimum enzim sakarifikasi bekerja. Penambahan enzim (glukoamilase) secara tepat. Mempertahankan pH dan temperature pada rentang 50 sd 60 oC sampai proses sakarifikasi selesai
Fermentasi
Pada tahap ini, pati telah berubah menjadi gula sederhana (glukosa dan sebagian fruktosa) dimana proses selanjutnya melibatkan penambahan enzim yang diletakkan pada ragi (yeast) agar dapat bekerja pada suhu optimum. Proses fermentasi ini akan menghasilkan etanol dan CO2. Bubur kemudian dialirkan kedalam
tangki fermentasi dan didinginkan pada suhu kisaran 27 sd 32 oC, dan membutuhkan ketelitian agar tidak terkontaminasi oleh mikroba lainnya. Ragi akan menghasilkan etanol sampai kandungan etanol dalam tangki mencapai 8 sd 12 %), dan selanjutnya ragi tersebut akan menjadi tidak aktif, karena kelebihan etanol akan berakibat racun bagi ragi.
METODE PENELITIAN Bahan dan alat
Bahan yang digunakan adalah Tepung sorgum, Enzim α-Amylase dari Bacillus Licheniformis (Sigma-Aldrich, pf, D-89555 Steinheim, 07323/970) dengan konsentrasi 31 U/mgr, Enzim Amyloglucosidase dari Aspergillus Niger (Sigma-Aldrich, pf, D-89555 Steinheim, 07329/970) dengan konsentrasi 138 U/mgr,
Yeast: Dry baker’s yeast, S.
Reaksi simultan sakarifikasi dan fermentasi (SSF) tepung sorghum dengan katalis enzim glucoamylase dilakukan shaker bath
Cara penelitian
200 U/gr tepung. Hasil penelitian dapat dilihat pada gambar 1 dan gambar 2.
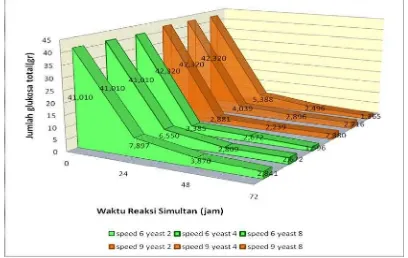
Gambar 1. Grafik Pengaruh Konsentrasi Enzim Glucoamylase terhadap Jumlah Glukosa pada Konsentrasi Tepung 10 % untuk Kadar Yeast 4 gr
Dari gambar 1 pada konsentrasi substrat tepung sorghum 10 % dengan konsentrasi enzim alpha amylase yang sama 200 U/gr pada kondisi operasi reaksi likuifikasi suhu 80OC pH 6.9. Pada reaksi SSF suhu 30 oC, pH 4.8 variasi konsentrasi enzim glucoamylase (1,2,3 dan 4 ml) Pada putaran shaker yang lebih besar (skala skala shaker 9) terlihat reaksi yang terjadi lebih singkat. Pada gambar 1 terlihat semakin besar konsentrasi enzim yang digunakan maka semakin besar pengurangan konsentrasi gula reduksi atau glukosa. Hal tersebut dikarenakan pada reaksi SSF, laju reaksi fermentasi lebih cepat dibandingkan laju reaksi sakarifikasi sehingga jumlah glukosa yang terbentuk lebih kecil dibandingkan glukosa yang dikonsumsi menjadi etanol.
Dari gambar 2 pada konsentrasi substrat tepung sorghum 10 % dengan konsentrasi enzim alphaamylase yang sama 200 U/gr pada kondisi operasi reaksi likuifikasi suhu 80 oC pH 6.9 serta reaksi sakarifikasi suhu 30 oC, pH 4,8 variasi dry baker’s yeast (2,4,8 gram) terlihat semakin besar konsentrasi yeast yang digunakan maka semakin besar pengurangan konsentrasi gula reduksi atau glukosa.
KESIMPULAN DAN SARAN
Dari hasil penelitian ini dapat disimpulkan bahwa pada tahap reaksi simultan sakarifikasi dan fermentasi, untuk kosentrasi substrat 10 %, konsentrasi dry yeast 4 gr menghasilkan gula reduksi semakin rendah pada konsentrasi katalis glucoamylase yang semakin tinggi (range 1, 2 3 dan $ ml) dan pada putaran shaker yang semakin besar (6 dan 9 skala shaker). Pada konsentrasi enzim glukoamylase
4 ml dengan untuk konsentrasi substrat yang sama maka dapat disimpulkan bahwa konsentrasi gula reduksi yang dihasilkan juga lebih sedikit. Hal ini terlihat dari gula reduksi yang dihasilkan terus menurun sampai pada waktu terakhir.
Gambar 2. Grafik Pengaruh Konsentrasi Enzim Glucoamylase terhadap Kadar Glukosa Reduksi
gr/L pada Konsentrasi Tepung 20%
Penelitian ini masih merupakan data awal untuk mencari kondisi yang sesuai untuk pembuatan etanol melalui metode reaksi simulan sehingga perlu dilakukan untuk range variabel yang lebih lebar dan dilakukan optimasi sehingga dicapai kondisi proses yang ekonomis.
UCAPAN TERIMA KASIH
Penulis mengucapkan terima kasih kepada Departemen Pendidikan Nasional yang telah membantu membiayai penelitian ini melalui dana Hibah Bersaing tahun 2009. Ucapan terimakasih juga disampaikan kepada seluruh Tim Bioetanol Teknik Kimia UNS, atas dukungan dan kerjasama yang telah diberikan.
DAFTAR PUSTAKA
Earl, W.B.; Brown, W.A. "Alcohol Fuels from Biomass in New Zealand: The Energetics and Economics of Production and Processing." Third International Symposium on Alcohol Fuels Technology. Vol. 1, pp. 1-11. Asilomar, CA; May 28-31, 1979.
Groggins, P H, 1958, Unit process in Organic Syntetic, 5th ed., McGrawHill Kogakusha, Ltd., Tokyo
Kirk, R.E dan Othmer, D. F., 1978, Encyclopedika of Chemical Tehnology, The Interscience Encyclopedia Inc., New York.
Saccharification and Fermentation of Low-grade Wheat Flour, Brazilian Archives Of Biology And Technology An International Journal vol.49, n. 3 : pp. 481-490, May 2006
Matz, S.A., 1970, Sereal Technology, The Avi Publishing. Co., Inc., West Port, Connecticut
Montesinos T. and Navarro, J. M. (2000), Production of alcohol from raw wheat flour by Amyloglucosidase and Saccharomyces cerevisiae. Enzyme Microb.Technol., 27, 362-370.
Mudjisihono, R. dan D.S. Damardjati. (1987), ”Prospek kegunaan sorgum sebagai sumber pangan dan pakan”. Jurnal Penelitian dan Pengembangan Pertanian VI(I): 1−5.
Perry, R.H., and Green, D., 1984, Perry’s Chemical Engeneering Hand’s Book, 6 th Edition, Mc Graw Hill Book Co., New York
Suarni dan M. Zakir. (2000), “Studi sifat fisikokimia tepung sorgum sebagai bahan
substitusi terigu”, Jurnal Penelitian
Pertanian 20(2): 58−62.
Sudarmaji dkk, 1997, Prosedur Analisa untuk Bahan Makanan dan Pertanian, edisi ke empat, Liberty, Yogyakarta