KIMIA ANORGANIK LANJUT
“
RESONANSI MOLEKUL PADA BEBERAPA STRUKTUR IKATANVALENSI DAN JARAK ANTAR ATOM SERTA HUBUNGANNYA DENGAN STRUKTUR MOLEKUL DAN KRISTAL
”
DISUSUN OLEH:
DEWI FARIANTI (162051601009)
A. HARDIYANTI DJALIL (162051601018)
REZKY WAHYUNI CEMANG (162051601010)
NURHUSNUL KHATIMAH
(162051601006)
PROGRAM PASCASARJANA
UNIVERSITAS NEGERI MAKASSAR
TAHUN 2017
Puji syukur kehadirat Tuhan Yang Maha Esa atas segala limpahan Rahmat, Inayah, Taufik dan Hidayah-Nya sehingga kelompok kami dapat menyelesaikan penyusunan makalah ini dalam bentuk maupun isinya yang sangat sederhana dengan judul “Resonansi Molekul pada Beberapa Struktur Ikatan Valensi dan Jarak Antar Atom serta Hubungannya dengan Struktur Molekul dan Kristal”.
Harapan penulis semoga makalah ini membantu menambah pengetahuan dan pengalaman bagi para pembaca, sehingga penulis dapat memperbaiki bentuk maupun isi makalah ini sehingga kedepannya dapat lebih baik. Dalam penyusunan makalah ini, tidak sedikit hambatan yang penulis hadapi. Namun penulis menyadari bahwa kelancaran dalam penyusunan makalah ini tidak lain berkat kerjasama yang baik oleh anggota kelompok, sehingga kendala-kendala yang dihadapi penulis dapat teratasi.
Semoga makalah ini dapat memberikan wawasan yang lebih luas khususnya pada ilmu kimia anorganik lanjut. Kami sadar bahwa makalah ini masih banyak kekurangan dan masih jauh dari sempurna. Oleh kerena itu penulis harapkan kepada para pembaca untuk memberikan masukan-masukan yang bersifat membangun untuk kesempurnaan makalah ini.
Makassar, 2 November2017 Penyusun
Kelompok VI
KATA PENGANTAR... i
DAFTAR ISI... ii
BAB I PENDAHULUAN A. LatarBelakang 1 B. RumusanMasalah ... ... 2 C. Tujuan Penulisan... 2
BAB II PEMBAHASAN A. Pengertian Resonansi ... ... 3 B. Resonansi pada Benzena dan Dinitrogen Monoksida... 4
C. Energi Resonansi... 7
D. Struktur Molekul Aromatik... 9
E. Jari-Jari Atom... 12
F. Jarak antara Atom pada Molekul Kovalen... 13
BAB III PENUTUP A. Kesimpulan... 15
B. Saran... 15
BAB I
PENDAHULUAN
A. Latar Belakang
Molekul terdiri dari sejumlah atom yang bergabung melalui ikatan kovalen, dan atom tersebut berkisar dari jumlah yang sangat sedikit(dari atom tunggal, seperti gas mulia) sampai jumlah yang sangat banyak (seperti pada polimer, protein atau bahkan DNA). Bentukmolekul, yang berarti cara atom tersusun di dalam ruang, mempengaruhi banyak sifat-sifat fisika dan kimia molekul tersebut. Kebanyakan molekul mempunyai bentuk yang didasarkan kepada lima bentuk geometri yang berbeda.
Molekul-molekul di dalam berikatan, mengacu pada beberapa aturan dan bentuk-bentuk ikatan kimia. Apabila molekul ingin berikatan harus sesuai dengan aturan-aturan atau syarat-syarat unsur-unsur tersebut dalam membentuk sebuah molekul. Karena tidak sembarang suatu unsure membentuk molekul.Ikatan kimia adalah ikatan yang terjadi antar atom atau antar molekul. Ikatan kimia itu sendiri bertujuan agar mencapai kestabilan dalam suatu unsur. Ketika atom berinteraksi untuk membentuk ikatan kimia, hanya bagian terluarnya saja yang bersinggungan dengan atom lain. Oleh karena itu, untuk mempelajari ikatan kimia, maka kita hanya perlu membahas tentang elektron valensi dari atom-atom yang terlibat dalam ikatan kimia tersebut.
B. Rumusan Masalah
Berdasarkan latar belakang di atas maka rumusan masalah dalam makalah ini, yaitu: Bagaimana Resonansi Molekul pada Beberapa Struktur Ikatan Valensi dan Jarak Antar Atom serta Hubungannya dengan Struktur Molekul dan Kristal?
C. Tujuan Penulisan
BAB II
PEMBAHASAN
A. PENGERTIAN RESONANSI
Resonansi merupakan peristiwa ikut bergetarnya sebuah benda disebabkan getaran dari benda lain yang mempunyai frekuensi yang sama atau mempunyai frekuensi dengan nilai yang merupakan kelipatan bilangan bulat dari frekuensi benda tersebut. Contoh yang paling mudah untuk dilihat adalah apabila kita memukul beduk pada satu sisi, maka pasti sisi yang lainnya pun akan turut bergetar sehingga menciptakan bunyi yang lebih keras. Resonansi ialah sebuah struktur yang menunjukkan dua buah struktur atau lebih yang mengalami perpindahan elektron berulang untuk menstabilkan molekulnya.
Dalam kimia, resonansi atau mesomerisme merupakan penggunaan dua atau lebih struktur Lewis untuk menggambarkan molekul tertentu. Struktur resonansi adalah salah satu dari dua atau lebih struktur Lewis untuk satu molekul yang tidak dapat dinyatakan secara tepat dengan hanya menggunakan satu struktur Lewis. Tanda panah dua arah menyatakan bahwa struktur-struktur yang diberikan merupakan struktur resonansi.
Molekul atau ion yang dapat beresonansi mempunyai sifat-sifat berikut:
1. Dapat dituliskan dalam beberapa struktur Lewis yang disebut dengan struktur resonan. Tetapi tidak satupun struktur tersebut melambangkan bentuk asli molekul yang bersangkutan.
2. Di antara struktur yang saling beresonansi bukanlah isomer.
3. Masing-masing struktur struktur Lewis harus mempunyai jumlah elektron valensi dan elektron tak berpasangan yang sama.
4. Ikatan yang mempunyai orde ikatan yang berbeda pada masing-masing struktur tidak mempunyai panjang ikatan yang khas.
5. Struktur yang sebenarnya mempunyai energi yang lebih rendah dibandingkan energi masing-masing struktur resonan.
(struktur yang berkontribusi dalam ion iminium)
B. RESONANSI PADA BENZENA DAN DINITROGEN MONOKSIDA 1. Resonansi pada Benzena
Resonansi 1.Resonansi terjadi karena adanya delokalisasi elektron dari ikatan rangkap ke ikatan tunggal. Delokalisasi elektron yang terjadi pada benzena pada struktur resonansi adalah sebagai berikut:
Resonansi 2. Hal yang harus diperhatikan adalah, bahwa lambang resonasi bukan struktur nyata dari suatu senyawa, tetapi merupakan struktur khayalan. Sedangkan struktur nyatanya merupakan gabungan dari semua struktur resonansinya. Hal ini pun berlaku dalam struktur resonansi benzena, sehingga benzena lebih sering digambarkan sebagai berikut:
Resonansi 3. Teori resonansi dapat menerangkan mengapa benzena sukar diadisi. Sebab, ikatan rangkap dua karbon-karbon dalam benzena terdelokalisasi dan membentuk semacam cincin yang kokoh terhadap serangan kimia, sehingga tidak mudah diganggu. Oleh karena itulah reaksi yang umum pada benzena adalah reaksi substitusi terhadap atom H tanpa mengganggu cincin karbonnya.
Dalam suatu molekul, Atom atom memiliki kestabilan tersediri. Salah satu yang mempengaruhinya ialah muatan formal. Muatan formal suatu atom adalah
jumlah elektron valensi dalam atom bebas dikurangi jumlah elektron yang dimiliki oleh atom tersebut di dalam struktur lewis. Untuk lebih jelasnya bisa dilihat pada gambar dibawah :
Pada struktur 1 , muatan atom Oksigen memiliki muatan formal -1. jika dihitung sesuai definisi maka elektron valensi O dikurang jumlah elektron pada struktur lewis maka : 6 – 7 = 1 . begitu pula dengan yang lainnya. Muatan Molekul merupakan penjumlahan dari muatan formal atom atom di dalamnya. sehingga molekul N2O tersebut tetap netral walaupun di dalamnya banyak muatan
formal yang tidak 0.
Resonansi Dinitrogen monoksida
Molekul oksida nitrat linier, dengan atom oksigen di salah satu ujungnya. Ini berisi 16 elektron valensi; dan terlihat bahwa ini dapat ditugaskan ke orbit L yang stabil dari atom dengan cara berikut yang masuk akal berikut ini:
Karena oksigen lebih elektronegatif daripada nitrogen, muatan negatif akan stabil lebih baik oleh atom oksigen.
Struktur di bagian bawah akan menjadi penyumbang kecil karena memiliki pemisahan muatan yang lebih besar dibandingkan dengan dua lainnya. Selain itu, ini menunjukkan muatan positif yang ditempatkan pada atom oksigen yang lebih elektronegatif dan muatan formal yang sangat tidak stabil (-2) pada atom nitrogen.Sebagai aturan praktis, muatan formal yang lebih besar dari pada (-1) atau (+1) secara otomatis akan menyiratkan bahwa struktur resonansi adalah penyumbang kecil.Oleh karena itu, tiga struktur resonansi dapat ditarik untuk dinitrogen monoksida, dengan 1 kontributor utama dan 1 minor.
C. ENERGI RESONANSI
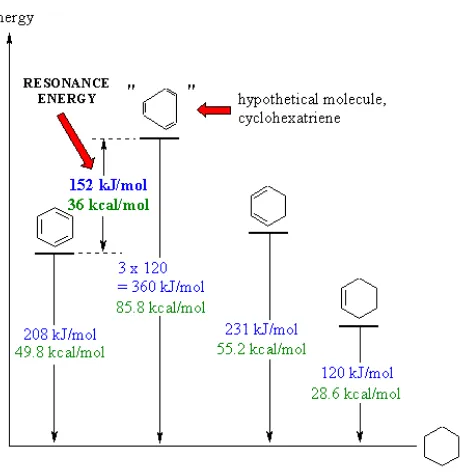
Penentuan struktur resonansi pada molekul terkadang dapat dibuat berdasarkan argumen teoritis, seperti pada dua kasus di atas. Secara umum, penentuan semacam itu harus didukung oleh bukti eksperimental, seperti yang diberikan oleh ikatan kimia, energi resonansi, jarak interatomis, konstanta gaya ikatan ikatan, momen listrik, dan sebagainya. Jika struktur valensi-ikatan yang masuk akal tidak setara, perkiraan kandungan kontribusi dari struktur yang berbeda pada keadaan normal molekul dibuat dari informasi ini. Dari metode ini mempelajari resonansi pada molekul yang paling bermanfaat saat ini adalah penentuan dan interpretasi nilai - nilai.
Diagram tersebut menunjukkan pemanasan eksperimental hidrogenasi, ΔH, untuk tiga molekul, benzena, 1,3-sikloheksadiena dan sikloheksena. Ini terkait dalam kondisi yang sesuai yang semuanya dapat dikurangi ke produk yang sama, sikloheksana.
Nilai ΔH untuk "sikloheksatriena", sebuah molekul hipotetis dimana ikatan rangkap diasumsikan diisolasi satu sama lain, dihitung menjadi 3 kali nilai sikloheksen. Nilai ini mencerminkan energi yang dapat kita harapkan untuk dilepaskan dari 3 C = C yang terisolasi. Dengan membandingkan nilai ini dengan nilai eksperimen untuk benzena, kita dapat menyimpulkan bahwa benzena adalah 152 kJ atau 36 kkal / mol lebih stabil daripada sistem hipotetis. Inilah energi resonansi untuk benzen.
D. STRUKTUR MOLEKUL AROMATIK
Untuk naftalen, struktur ikatan valensi konvensionalnya adalah struktur Erlenmeyer:
Ada dua struktur lain yang berbeda dari ini hanya dalam redistribusi ikatan:
dan
Dan untuk fenantrena ada lima :
Nilai yang diamati dari energi resonansi adalah 105 kkal / mol untuk antrasena dan 110 kkal / mol untuk fenantrena. Ini masuk akal jika dibandingkan dengan benzena dan naftalena, dan juga satu sama lain, sistem cincin sudut memiliki sejumlah besar struktur resonansi stabil dan energi resonansi lebih besar daripada sistem cincin linier. Sistem cincin kental yang lebih tinggi dapat juga digambarkan sebagai beresonansi di antara banyak struktur ikatan valensi. Energi resonansi meningkat dalam proporsi yang kasar dengan jumlah cincin heksagonal dalam sistem. Selain itu, ini agak lebih besar untuk sistem cincin bercabang dan angular daripada yang liniernya sesuai yang sebelumnya bergema di antara struktur ikatan valensi yang lebih stabil daripada yang terakhir (seperti dalam kasus fenantrena dan antrasena).
sebagai ikatan tunggal dalam satu struktur Kekulé dan sebagai ikatan rangkap di sisi lainnya. Ini tidak berarti bahwa obligasi berperilaku setengah waktu sebagai ikatan rangkap, melainkan bahwa itu adalah ikatan jenis baru, sangat berbeda dari ikatan rangkap, dan dengan sifat antara ikatan rangkap dan ikatan tunggal. (Sifat-sifatnya bukan rata-rata untuk dua jenis ikatan; pertimbangan juga harus diberi efek menstabilkan energi resonansi). Pada naftalena, antrasena, dan fenantrena, jumlah karakter ikatan ganda, ditemukan dengan rata-rata resonansi stabil.
E. JARI-JARI ATOM
Terdapat beberapa jenis jari-jari atom yang digunakan untuk menyatakan jarak dari inti atom ke lintasan stabil terluar dari elektronnya, di antaranya adalah
jari-jari kovalen, jari-jari logam dan jari-jari van der Waals. Ketiganya dipilih disebabkan oleh perbedaan dari sifat-sifat elemen yang akan diukur.
Jari-jari kovalen
Jari-jari atom diukur menggunakan jari-jari kovalen untuk elemen-elemen yang memiliki jenis ikatan kovalen. Umumnya elemen-elemen ini merupakan
elemen-elemen non-logam. Secara teknis jarak yang diukur adalah setengah dari jarak
internuklir antara dua atom bertetangga terdekat dalam kisi-kisi kristal.Jari-jari kovalen untuk elemen-elemen yang tidak dapat berikatan dapat diperkirakan dengan melakukan kombinasi jari-jari dari elemen-elemen yang dapat berikatan dalam molekul untuk atom-atom yang berbeda.
Jari-jari logam
Jari-jari atom diukur menggunakan jari-jari logam untuk elemen-elemen yang termasuk dalam elemen-elemen logam. Jari-jari logam adalah setengah jarak dari jarak internuklir terdekat dari atom-atom dalam kristal logam.
Jari-jari van der Waals
mulia, di mana dikatakan bahwa atom-atom dari elemen ini tak termampatkan atau terpadatkan (unsquashed).
F. JARAK ANTAR ATOM PADA MOLEKUL KOVALEN
Jari-jari kovalen (bahasa Inggris: covalent radius, rcov) adalah suatu ukuran
besarnya sebuah atom yang terlibat dalam pembentukan suatu ikatan kovalen.Biasanya diukur dalam pikometer (pm) atau angstrom (Å), di mana 1 Å = 100 pm.
Jari-jari kovalen digunakan untuk senyawa-senyawa yang memiliki ikatan kovalen. Ikatan kovalen umumnya terbentuk dari unsur-unsur nonlogam. Jari-jari kovalen ditentukan dengan membandingkan jarak antara dua inti atom yang berikatan. Misalnya molekul Cl2 diketahui panjang ikatannya 0,198 nm. Di dalam
1 molekul Cl2 terdapat 2 atom Cl, maka jari-jari atom Cl adalah 0,099 nm. Dengan
demikian apabila diketahui panjang ikatan C-Cl pada CCl4 adalah 0,176 nm, maka
jari-jari atom C adalah 0,088 nm. Jari-jari atom yang ditentukan dengan cara ini hanya bersifat teoritik, karena berdasarkan eksperimen jari-jari atom C dapat lebih besar atau lebih kecil.
Jari-jari kovalen digunakan pada molekul-molekul yang bentuk atomnya berikatan kovalen berdasarkan nomor atom dan posisinya dalam sistem periodik. Tabel berikut menunjukkan nilai jari-jari kovalen pada beberapa atom :
Jari-jari ikatan tunggal Jari-jari ikatan rangkap dua
Jari-jari ikatan rangkap tiga Jari-jari ikatan rangkap dua
PENUTUP
A. Kesimpulan
Resonansi atau mesomerisme merupakan penggunaan dua atau lebih
struktur Lewis untuk menggambarkan molekul tertentu. Struktur resonansi adalah salah satu dari dua atau lebih struktur Lewis untuk satu molekul yang tidak dapat dinyatakan secara tepat dengan hanya menggunakan satu struktur Lewis. Tanda panah dua arah menyatakan bahwa struktur-struktur yang diberikan merupakan struktur resonansi. Masing-masing struktur resonan dapat melambangkan struktur Lewis, dengan hanya satu ikatan kovalen antara masing-masing pasangan atom. Beberapa struktur Lewis digunakan bersama-sama untuk menjelaskan struktur
molekul. Namun struktur tersebut tidak tetap, melainkan ada sebuah osilasi antara
ikatan rangkap dengan elektron, saling berbolak-balik. Maka dari itu disebut dengan resonansi. Struktur yang sebenarnya mungkin saja adalah peralihan dari dua struktur resonan.
Terdapat beberapa jenis jari-jari atom yang digunakan untuk menyatakan jarak dari inti atom ke lintasan stabil terluar dari elektronnya, di antaranya adalah
jari-jari kovalen, jari-jari logam dan jari-jari van der Waals. Ketiganya dipilih disebabkan oleh perbedaan dari sifat-sifat elemen yang akan diukur.
B. Saran
Semoga makalah ini dapat memberikan wawasan yang lebih luas khususnya pada materi ilmu kimia anorganik lanjut. Kami sadar bahwa makalah ini masih banyak kekurangan dan masih jauh dari sempurna. Oleh kerena itu penulis harapkan kepada para pembaca untuk memberikan masukan-masukan dan saran- saran yang bersifat membangun untuk kesempurnaan makalah ini.
Chang, Raymond. 2004. Kimia Dasar. Jakarta: Erlangga.
http://www.anorganc-chemistry.org
http://wikipedia-resonansi molekul.com
Pauling, Linus. 1967. The Chemical Bond. New York: Cornell University Press.