BAB II
TINJAUAN PUSTAKA
2.1 Cedera Kepala
Cedera kepala adalah jejas atau perlukaan jaringan otak bukan karena proses degeneratif atau bawaan lahir, melainkan akibat dorongan dari luar yang dapat mengakibatkan penurunan ataupun perubahan status kesadaran (National Head Injury Foundation, 1985). Berdasarkan patofisiologi ini, cedera kepala dapat diklasifikasikan menjadi
1. Komosio serebri
Komosio serebri adalah kehilangan fungsi otak sesaat tanpa adanya kerusakan jaringan otak, seperti pingsan kurang dari 10 menit atau amnesia pascacedera kepala.
2. Kontusio serebri
Kontusio serebri adalah kerusakan jaringan otak dengan defisit neurologik yang timbul setara dengan kerusakan otak tersebut, seperti pingsan lebih atau sama dengan 10 menit atau ada lesi neurologis yang jelas.
3. Laserasi otak
Laserasi otak adalah kerusakan jaringan otak yang luas disertai dengan robekan jaringan otak dan umumnya disertai fraktur terbuka kranium.
tidak langsung melalui mekanisme sekunder (Maas et al., 2000). Mekanisme ini secara konseptual terbagi menjadi dua, yaitu secondary brain insult dan secondary brain damage. Secondary brain insult timbul akibat dari perburukan sistemik dan intrakranial yang memperberat kerusakan neuron setelah cedera kepala primer. Gejala yang timbul pada keadaan ini adalah systemic secondary insult dan intrakranial secondary insult (Teasdale, 1998; Maas et al., 2000). Secondary brain damage adalah cedera kepala sekunder yang terjadi setelah aktivasi langsung proses imunologi dan biokimia yang merusak dan menyebar secara ritmik. Mediator biokima dan inflamasi pada cedera ini terdiri atas asidosis laktat, kalsium, asam amino eksitatorik, asam arakhidonat, nitric oxide (NO), radikal bebas, peroksidasi lipid, aktivasi kaskade komplemen, sitokin, bradikinin, makrofag, dan pembentukan edema serebri (Hsu et al., 1995; Kossman, 2002; Lezlinger et al., 2001; McIntosh et al., 1999; Maas et al., 2000; Teasdale, 1998).
2.1.1 Edema serebri
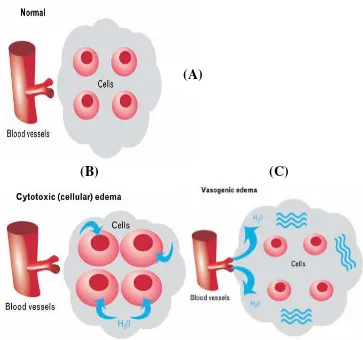
Cedera kepala dapat memicu terjadinya berbagai mekanisme sehingga menyebabkan perlukaan sekunder yaitu edema serebri (Cooper, 1985). Edema serebri adalah peningkatan akumulasi cairan otak intraselular dan atau ekstraselular (Klatzo, 1967). Keadaan ini ditandai dengan pembengkakan jaringan otak sesuai dengan peningkatan progresif kadar cairan otak yang dapat terjadi karena iskemia (Ribeiro et al., 2006), trauma (Zador et al., 2007), tumor (Saadoun et al., 2002), dan inflamasi (Papadopoulos dan Verkman, 2005). Terbatasnya rongga kranium dan pembengkakan progresif jaringan otak mengakibatkan peningkatan tekanan intrakranial (TIK), penurunan aliran darah ke otak, herniasi serebri, dan bahkan kematian. Berdasarkan mekanismenya, Klatzo membagi edema serebri menjadi dua kategori, yaitu edema sitotoksik atau intraselular dan edema vasogenik atau ekstraselular. Keduanya dapat diketahui dengan rinci melalui studi mikroskopik dan ultrastruktural. Pengukuran kadar cairan jaringan melalui pencitraan Magnetic Resonance Imaging (MRI) dapat membedakan edema sitotoksik
dan edema vasogenik (Klatzo, 1967).
Gambar 2.1 Ilustrasi keadaan Sel Normal (A); Edema Sitotoksik (B), Edema Vasogenik (C) (Donkin dan Vink, 2010)
Edema vasogenik adalah peningkatan cairan esktrasel yang terjadi karena kebocoran SDO. Akibatnya terjadi peningkatan tekanan osmotik dan cairan ke luar dari pembuluh darah dan kemudian masuk ke dalam kompartemen ekstraselular. Cairan intravaskular ini keluar melalui endotel dengan mekanisme pinositosis dan atau tight junction yang bocor. Edema vasogenik sering disebut juga edema osmotik. Kebocoran SDO dapat terjadi karena beberapa keadaan seperti cedera kepala, tumor, infeksi, perdarahan intraserebri, dan inflamasi. Oleh karena itu, edema vasogenik
(C)
(B)
sangat berhubungan dengan peningkatan kadar cairan otak, pembengkakan jaringan otak, dan peningkatan TIK.
Pada keadaan tertentu dapat terjadi edema serebri yang didasari oleh kedua mekanisme di atas, misalnya edema transependimal. Edema transependimal adalah peningkatan cairan interstitial periventrikular karena kerusakan lapisan ependimal dinding ventrikular. Hal ini biasanya terjadi pada hidrosefalus. Edema hidrostatik adalah bagian dari edema vasogenik yang terjadi ketika tekanan perfusi serebral meningkat. Keadaan ini biasanya terjadi pada ensefalopati hipertensi. Pada dasarnya, baik edema sitotoksik maupun edema vasogenik terjadi ketika osmolalitas plasma menurun sehingga terjadi pengeluaran cairan. Meskipun demikian, keduanya dipisahkan menjadi dua klasifikasi yang berbeda. Beberapa keadaan klinik berkembang menjadi edema serebri berdasarkan kombinasi mekanisme edema yang berbeda. Ini bergantung pada gangguan yang timbul akibat penyakit dan waktu perjalanan penyakit (Nag et al., 2009).
meningkatkan TIK, menurunkan TPS, serta memicu berlanjutnya iskemia (Rosner dan Rosner, 1995). Beberapa studi eksperimental menyatakan bahwa beberapa neurotransmitter, seperti glutamat, asetilkolin, dan senyawa vasoaktif, seperti serotonin, histamin, prostaglandin, asam amino, asam laktat, dan lain-lain berperan dalam mediasi, inisiasi, dan propagasi edema otak. Platelet adalah sumber utama senyawa-senyawa di atas yang akan memproduksi neurotransmitter ketika melekat di pembuluh darah kapiler (Baethmann et al., 1980; Baethmann et al., 1991; Hayes et al., 1991). Prostaglandin berperan pada terjadinya edema serebri melalui mekanisme (1) peningkatan permeabilitas kapiler serebral, (2) vasokonstriksi yang menyebabkan iskemia (Yamamoto et al., 1972), dan (3) potensiasi dari senyawa lain seperti serotonin dan katekolamin.
yang berperan pada sintesis protein (Taya et al., 2009). Peningkatan kadar cairan jaringan otak ditunjukkan oleh komponen vaskular sebagai tempat pergeseran kompartemen sitotoksik. Hambatan AQP channel berperan pada keadaan edema sitotoksik, tetapi tidak pada edema vasogenik, karena AQP channel melekat pada dinding sel.
Selain AQP, terdapat matriks metalloproteinase (MMP) yang berperan saat terjadinya edema serebri. Matriks metalloproteinase adalah enzim endopeptidase zinc-dependent yang berperan dalam perbaikan jaringan pada berbagai keadaan patologis. Regulasi MMP sangat kompleks dan terkontrol. Hilangnya kontrol regulasi sangat berperan dalam patofisiologi kerusakan sinaps dan SDO pada cedera kepala, stroke, dan neurodegenerasi (Rosenberg dan Yang, 2007; Candelario-Jalil et al., 2009; Ding et al., 2009; Rosenberg, 2009). Peran MMP dalam
efek protektif pada cedera kepala dengan iskemia fokal dan global (Wang et al., 2000; Asahi et al., 2001; Gidday et al., 2005). Defisiensi gen MMP9 ini menurunkan kebocoran SDO dan pembentukan edema, menurunkan respons inflamasi, serta meningkatkan integritas membran sel dan status fungsional (Fujimoto et al., 2008; Vajtr et al., 2009, Homsi et al., 2009; Tejima et al., 2009).
Plesnila, 2009; Su et al., 2009). Anggota lain dari keluarga kinin adalah takikinin, yaitu sebuah mediator peptida yang berperan pada inflamasi neurogenik.
Inflamasi neurogenik adalah proses yang terdiri atas vasodilasi, ekstravasasi plasma, dan hipersensitivitas neuronal yang disebabkan oleh penglepasan neuropeptida dari neuron sensorik (Geppetti et al., 1995). Neuropeptida yang telah teridentifikasi berperan pada inflamasi neurogenik adalah calcitonin gene-related peptide (CGRP), CGRP ini berperan pada vasodilasi yang senyawa P-nya meningkatkan ekstravasasi protein plasma (Nimmo et al., 2004).
Ada keterkaitan langsung antara aliran darah otak (ADO) dan metabolisme tubuh. Penurunan ADO berhubungan dengan hipoksia dan glikolisis anaerob. Hipoksia dapat menimbulkan gangguan SDO melalui berbagai mekanisme yang diperantarai oleh VEGF, NO, dan respon inflamasi. Hipoksia memicu peningkatan produksi Vascular endothelial growth factor (VEGF) yang berakibat pada peningkatan permeabilitas
iskemia-hipoksia meningkatkan produksi prostaglandin dan kinin. Kedua mediator ini selanjutnya menginisiasi respon inflamasi yang dapat berakibat pada gangguan SDO (Zach et al., 1997; Yang et al., 1999; Saleh et al., 2004). Kemokin dan sitokin yang diproduksi oleh sel glia dan endotel pada saat iskemia-hipoksia meningkatkan migrasi limfosit melalui SDO dan juga permeabilitas pembuluh darah (Zach et al., 1997; Gong et al., 1998; Weiss et al., 1998; Prat et al., 2001). Selain itu, respon inflamasi dapat mengaktivasi caspase, translokase, dan endonuklease yang dapat menginisiasi perubahan membran dan nukleosom DNA secara progresif. Hipoksia juga menyebabkan penglepasan beberapa neurotransmitter, seperti glutamat dan aspartat. Neurotransmiter ini akan mengaktivasi reseptor ionotropik dan metabotropik. Akibat dari ini akan terjadi influks ion kalsium (Ca) dan ion natrium (Na), serta efluks ion kalium (K). Influks ion Ca menimbulkan proses katabolisme intraselular, aktivasi enzim lipid peroksidase, akumulasi asam lemak bebas, dan radikal bebas. Untuk glikolisis anaerob, keadaan ini menyebabkan deplesi adenosin trifosfat (ATP) dan terganggunya pompa ion energy dependent di otak. Glikolisis anaerob ini juga berhubungan dengan akumulasi asam laktat dan peningkatan permeabilitas membran yang berakibat pada edema serebri.
2.1.2 Sel Mikroglia
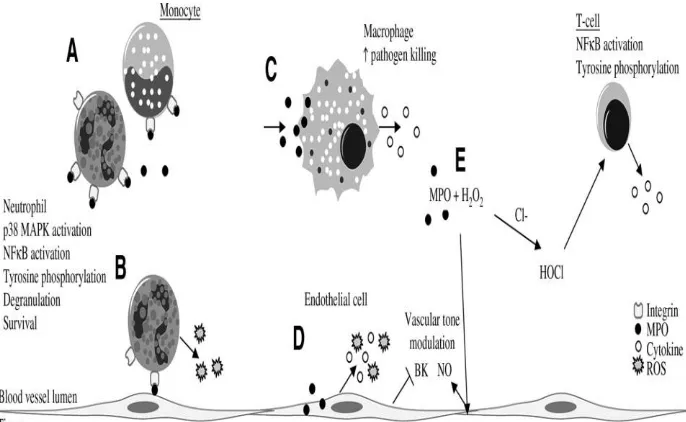
Mikroglia dapat dianggap sebagai sel imun dari sistem saraf pusat, yang berperan setara dengan sel fagosit mononuklear yang ada pada jaringan soma (Gonzales-Scarano dan Baltuch, 1999), yakni immun surveillance dan pertahanan tubuh terhadap invasi berbagai proses infeksi. Namun demikian, jika mikroglia teraktivasi sebagai respon terjadinya proses inflamasi, mikroglia aktif akan mengalami berbagai proses diferensiasi, proliferasi, dan menghasilkan berbagai faktor proinflamasi.
Mikroglia yang aktif akan mensekresi berbagai faktor proinflamasi dan neuroinflamasi yang bersifat neurotoksik. Faktor-faktor ini bila tidak dikendalikan maka akan menimbulkan kerusakan yang luas (Liu dan Hong, 2002). Proses aktivasi mikroglia diawali oleh inflamasi sel dan jaringan akibat adanya lesi dan/atau iskemia. Mikroglia aktif akan melepaskan glial derived neurotrophic factor, TNFα, IL-1β, IL-6, NO, superoxide, eikosanoid, asam kuinolat, plasminogen, dan nuclear factor (NF)κB (Shigemoto-Mogami et al., 2001; Suzuki et al., 2004). Nuclear
factor (NF)κB adalah suatu faktor transkripsi yang bila teraktivasi akan
Ada berbagai metode dalam mengendalikan aktivasi mikroglia seperti mekanisme cell adhesion molecules (CAM) oleh neuron (McMillian et al., 1994), penggunaan reseptor antagonis opioid dan golongan steroid (Kong et al.,1997), mekanisme vasoactive intestinal peptide (VIP), dan aktivasi sitokin antiinflamasi, seperti TGF β dan IL-10 melalui mekanisme mikroglia-deactivating factor (Delgado dan Ganea, 2003).
2.1.3 Malondialdehyde
Malondialdehyde (MDA) adalah senyawa organik dengan rumus CH2(CHO)2. Struktur senyawa ini lebih kompleks dan sangat reaktif, terjadi secara alami, dan merupakan penanda stres oksidatif (Romieu et al., 2008).
Malondialdehyde utama terdapat dalam bentuk enol dengan rumus
kimianya :
CH2(CHO)2 Hoch = CH-CHO
Malondialdehyde merupakan senyawa golongan sebagai hasil produksi proses lipid peroksida, yang bersifat toksik pada sel. Malondialdehyde dapat diukur degan metode Thibarbituric Acid Reactive
Substance (TBARS). Nilai stres oksidatif berdasarkan reaksi asam thibarbiturat pada suhu 1000C akan menghasilkan krofor berwarna merah muda yang dapat dibaca pada panjang gelombang 532 m (Halliwell and Gutterge, 1999).
Malondialdehyde merupakan senyawa yang sangat reaktif yang tidak
hidrolis dari 1,1,3,3-tetramethoxypropane, yang tersedia secara komersial. Hal ini memudahkan hilangnya proton dalam memberikan garam sodium dari enolat (mp 2450C). Spesies oksigen reaktif menurunkan lipid polyunsaturated, dan membentuk Malondialdehyde. Senyawa ini merupakan aldehida reaktif dan merupakan salah satu spesies yang memiliki banyak elektrofil reaktif. Akibatnya dapat menimbulkan stres toksid dalam sel, dan membentuk protein kovalen adduct yang disebut akhir lipoxidation sebagai lanjutan produk Advance Lipoxidation End-product (ALE), dan mengakhiri glikasi maju-produk Advance Glicostatin
End-product (AGE). Produksi aldehida ini digunakan sebagai biomarker untuk mengukur tingkat stres oksidatif dalam organisme. Malondialdehyde bereaksi dengan deoxyadenosine dan deoxyguanosine dalam DNA, serta membentuk DNA M1G yang mutagenik (Hall, 1995).
Malondialdehyde (MDA) adalah suatu senyawa yang berasal dari
peroksidasi lipid dan biosintesis eicosanoid. Keduanya terdapat dalam matriks biologis dalam bentuk bebas dan terikat kepada SH atau kelompok NH2 dari berbagai biomolekul. Meskipun senyawa lain (isoprostance) telah diusulkan sebagai indikator yang lebih dapat
besar dalam pengukuran, bahkan pada konsentrasi fisiologis MDA plasma manusia (Cighetti et al., 2002).
2.1.3.1 Malondialdehyde (MDA) sebagai produk hasil Stres Oksidatif
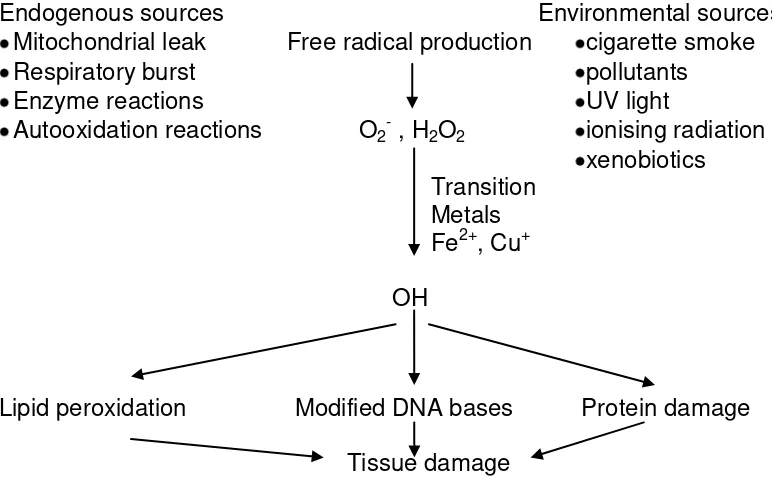
Radikal bebas dihasilkan selama proses fisiologis normal. Namun pelepasannya meningkat pada keadaan iskemia, reperfusi, reaksi inflamasi, dan penyakit neuro-degeneratif. Sumber-sumber endogen pembentukan radikal bebas meliputi sistem NADPH oksidase, reaksi fosforilasi oksidatif, enzim oksidasi dan metabolisme arakhidonat, sedangkan sumber oksigennya adalah radiasiionisasi, merokok, alkohol, paparan polutan, sinar ultraviolet, dan radiasiterionisasi (Droge, 2002).
teraktivasinya NADPH oksidase dan superoksid diproduksi akibat aktivasi oleh 12-LO (lipooksigenase) dalam vasculer smooth muscle cell (VSMCs). Pada hiperkolesterolemia produksi ROS dan LDL teroksidasi (Ox-LDL) berhubungan dengan NaDPH oksidase pada subunit p22 phox. ROS yang diproduksi akibat aktivasi NaDPH oksiadse meningkat secara bermakna dan secara progresif mencapai kadar puncak saat terjadi dekompensasi kordis (Ardhibatla et al., 2003).
Penelitian yang dilakukan oleh Walter et al., didapatkan adanya peningkatan kadar MDA dengan metode TBARS pada perokok, hipertensi, hiperlipidemia dan diabetes melilitus. (Walter et al., 2004). Kadar MDA juga meningkat pada penyakit asma, rheumatoid arthritis dan preeklamsia. (Ladecola and Zhang, 1995).
Endogenous sources Environmental sources Mitochondrial leak Free radical production cigarette smoke
Stres oksidatif merupakan keadaan yang tidak seimbang antara prooksidan dan antioksidan. Produksi radikal bebas dapat melebihi kemampuan penghambat radikal alamiah atau mekanisme scavenging (pembersih). Mekanisme penghambat radikal bebas terdiri atas oksidan endogen dan eksogen. Antioksidan endogen terdiri dari superoksid dismutase (SOD), Glutathion peroksidase (GPx) dan katalase. Anti oksidan eksogen terdiri atas vitamin E, betakaroten dan vitamin C. (Cherubini et al., 1995).
Stres oksidatif pada susunan saraf pusat sangat mematikan sebab otak manusia utamanya memakai metabolisme oksidatif. Meskipun berat otak hanya 2 % dari berat tubuh, otak menggunakan sekitar 50% dari seluruh oksigen tubuh. Faktor lain yang sangat berbahaya adalah stres oksidatif pada otak dengan kandungan polyunsaturated fatty acid (PUFA) yang tinggi, yaitu hampir 50 % dari struktur jaringan otak. Jaringan otak mengandung asam askorabat 100 kali lipat dibandingkan dengan pembuluh darah perifer, yang juga dapat meningkatkan risiko terjadinya stres oksidatif. Radikal bebas merusak sel dan bereaksi dengan makro molekuler sel melalui proses peroksidasi lipid, oksidasi DNA, dan protein (Gusev and Skvortsova, 2003).
bertambah. Produk-produk peroksidasi lipid MDA, HNE, dan acrolein juga dapat bereaksi dengan protein dan mengakibatkan perubahan fungsi protein (Weigan et al., 1999).
Kerusakan pada DNA baik disebabkan radikal maupun perosinitrit mengakibatkan terbentuknya single stand break DNA dan struktur ini akan mengaktivasi poli-ADP ribose polymerase (PARP). Aktivasi PARP mengakibatkan berkurangnya adenin nukleotida yang akan menghambat fungsi mitokondria sehingga terjadi penurunan ATP sel dan kematian sel. PARP juga dapat menaktivasi apoptoticinducing factor (AIF) di mitokondria. Mekanisme ini juga didukung dengan berkurangnya infark otak tikus didapat dengan PARP inhibitor (Lipton, 1999).
Oksidasi protein oleh radikal bebas membentuk kelompok karbonil atau disfid, dan juga sebagai reduktan, yang menyebabkan formasi S-H dari ikatan S-s. Kerusakan pada protein, terutama bentuk enzim, akan mengganggu fungsinya (Cherubini et al., 1999).
2.1.4 Reactive Oxygen Species dan Respon Inflamasi
mitokondria, dan retikulum endoplasma; hidrogen peroksida (H2O2) yang diproduksi peroksisom; radikal hidroksil reaktif (OH); oksigen singlet (1O2). Ketidakseimbangan oksidatif seperti gangguan keseimbangan produksi ROS atau radikal bebas atau prooksidan dengan antioksidan dikenal sebagai stres oksidatif. Keadaan ini dapat menyebabkan berbagai kerusakan sel yang pada akhirnya berakibat pada hilangnya fungsi dan integritas sel (Halliwell dan Gutteridge, 1999). Molekul ROS secara fisiologis berperan sebagai second messenger dalam regulasi proses apoptosis (Curtin et al., 2002) dalam mengaktivasi faktor transkripsi, seperti NFκB dan p38-MAPkinase yang berperan pada aktivasi gen
respon imun (Owuor dan Kong, 2002) dan gen yang mengkoding enzim-enzim antioksidan (Holgrem, 2003). Peran stres oksidatif sangat krusial pada modulasi fungsi selular, terutama pada apoptosis dan excitotoxicity astrosit dan mikroglia. Apoptosis dan produksi ROS berlebih pada akhirnya akan menimbulkan disfungsi mitokondria (Yun et al., 1996). Stres oksidatif erat kaitannya dengan respon inflamasi. Sehingga secara teori respon inflamasi akan meningkatkan produksi ROS.
pituitari atau hipofisis. Stimulasi kelenjar pituitari meningkatkan sekresi adrenocoticotropin hormone (ACTH) dan stimulasi kelenjar adrenal. Kelenjar adrenal yang terstimulasi akan mengeluarkan katekolamin dan menstimulasi sel makrofag dan limfosit. Stimulasi makrofag dan limfosit selanjutnya menyebabkan pengeluaran sitokin, yaitu mediator biokimia yang berperan besar pada respon inflamasi seperti edema serebri (Visser dan Labadarios, 2002).
adalah serangkaian proses fisiologis sistemik yang terjadi segera setelah terjadinya infeksi, trauma, dan beberapa jenis keganasan sehingga terjadi berbagai perubahan patologis dan metabolik seperti demam, peningkatan permeabilitas vaskular, dan yang paling mencolok adalah peningkatan protein fase akut (PFA).
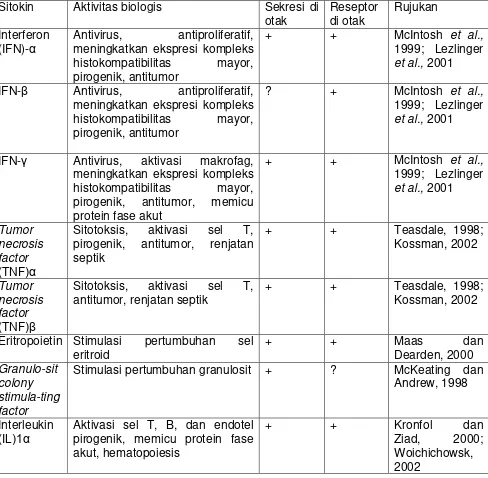
Tabel 2.1. Jenis Sitokin berdasarkan aktivitas Biologis Sitokin Aktivitas biologis Sekresi di
otak
IFN-γ Antivirus, aktivasi makrofag, meningkatkan ekspresi kompleks
Eritropoietin Stimulasi pertumbuhan sel eritroid
IL-1β Aktivasi sel T, B, dan endotel pirogenik, memicu protein fase akut, hematopoiesis IL-3 Pertumbuhan dan diferensiasiasi
sel hematopoietik, hematopoiesis IL-5 Proliferasi dan diferensiasi
eosinofil, produksi IgA, eosinofilia IL-10 Inhibisi sintesis sitokin, proliferasi
sel T, inhibisi renjatan septik Sumber: Cytokines and The Brain, Am J Psychiatry, 2000
pascaiskemia-hipoksia (Lazovic et al., 2005). Pemberian IL-1β diketahui dapat meningkatkan ekspresi AQP4 melalui aktivasi faktor transkripsi proinflamasi, yaitu NFκB. Data ini menunjukkan peran IL-1β dalam terjadinya edema serebri melalui regulasi AQP4 (Ito et al., 2006).
2.1.5 Sawar Darah Otak
Sawar darah otak (SDO) atau blood brain barrier adalah struktur penting untuk menjaga homeostatik lingkungan internal otak. Struktur SDO memisahkan jaringan otak dengan aliran darah secara selektif. Struktur terpenting dari SDO adalah sel endotel kapiler yang satu dan lainnya dihubungkan satu sama lain oleh tight junction. Berbeda dengan kapiler ekstraserebral, sel endotel serebral bersifat nonfenestrated, minim celah intraselular, mengandung sedikit vesikel pinositik, memiliki banyak mitokondria, dan tertutup oleh astrosit. Terbukanya tight junction merupakan kunci utama terjadinya edema vasogenik. Akumulasi cairan pada keadaan edema mencapai 14–78 mL/hari (Reulen et al., 1990). Kebocoran protein plasma SDO adalah penentu utama terjadinya akumulasi cairan dalam ruang ekstraselular (Abbott et al., 2010). Berbagai mekanisme dapat berperan dalam terjadinya disintegrasi SDO, yang salah satu di antaranya adalah inflamasi jaringan otak (Sandoval dan Witt, 2008).
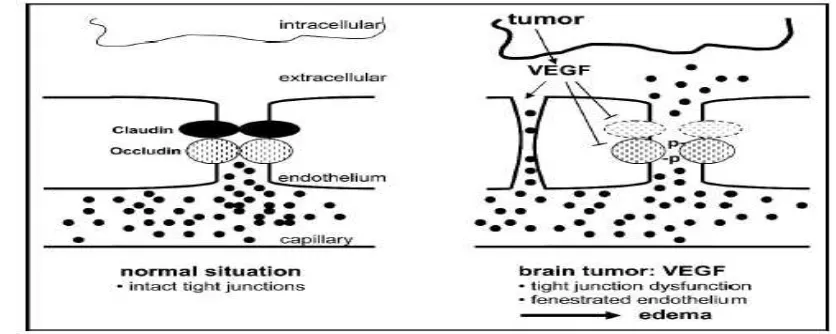
melalui aliran transependimal. Protein ekstraselular seperti okludin, klaudin, dan molekul adesi junctional adalah komposisi molekular tight junction. Bila protein ekstraselular ini berlebih, akan dikeluarkan melalui mekanisme fagositosis oleh astrosit dan mikroglia (Furuse et al., 1993; Hirase et al., 1997; Furuse et al., 1998; Martin Padura et al., 1998; Papadopoulos et al., 2001; Davies, 2002). Protein ekstraselular ini disebut juga protein transmembran yang pada kenyataannya berikatan dengan protein intraselular, seperti ZO-1 dan ZO-2. Ikatan ini bertautan membentuk perlekatan antara tight junction dan sitoskeleton sel endotel. Penurunan ekspresi dan/atau fungsi dari protein tight junction ini akan menyebabkan terbukanya tight junction dan terbentuknya edema. Ternyata mediator utama dari mekanisme ini adalah VEGF (Liebner et al., 2000; Papadopoulos 2001).
2.1.6 Vascular Endothelial Growth Factor.
darah oleh sekresi protease sel endothel. 2. Migrasi sel endothelial ketempat pembentukan pembuluh darah dimana sel akan berproliferasi membentuk cikal bakal pembuluh darah baru. 3. Selanjutnya terjadi proliferasi dan diferensiasi membentuk lumen pada pembuluh darah baru. 4. Sekresi faktor pertumbuhan (growth factor) oleh sel endotel yang menarik sel pendukung seperti perisit dan sel otot polos serta membentuk membran besemen. Sel pendukung dan membran besemen penting sebagai fungsi dan stabilitas pembuluh darah baru. Pada tahap akhir ini, pembuluh juga berkembang secara khusus sesuai dengan jaringan atau organ yang disuplai (Jain, 2003).
34-46kDa yang dihasilkan oleh berbagai jenis sel dalam merespon berbagai rangsangan. VEGF bekerja pada sel endothel vaskuler dengan mengikat rangsangan transmembran yang spesifik. Pengikatan pada signaling pathway menghasilkan proliferasi dan migrasi sel endotel
vaskuler, mempertahankan sel endotel immatur dan meningkatkan permebilitas vaskular (Ferrara, Gerber, LeCouter, 20004).
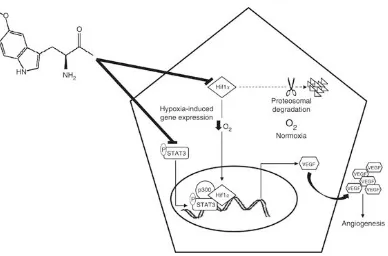
Gambar 2.4 Hif1 adalah regulator utama homeostasis oksigen. Sedangkan normoxia menginduksi Hif1α degradasi proteosomal, di bawah hipoksia stabil dan translokasi ke inti di mana ia membentuk kompleks dengan phospho-STAT3 dan CBP / p300 untuk meningkatkan ekspresi VEGF, dan dengan demikian hipoksia menginduksi angiogenesis (Tocharus, et al., 2014).
Gambar 2.5 Mekanisme VEGF dalam memediasi Edema Vasogenik (Kaal dan Vecht, 2004)
Selain seluruh faktor di atas, SDO atau tepatnya endothelial astrocytic foot process juga memproduksi AQP yang berperan pada pembentukan edema serebri. Belum diketahui pasti, apakah peningkatan regulasi AQP dapat meningkatkan kejadian edema atau justru sebaliknya (Kaal dan Vecht, 2004).
2.1.7 Aquaporin-4
Aquaporin (AQP) adalah protein membran integral kecil dengan
subarachnoid. Kedua AQP ini terutama berperan dalam homeostasis cairan di susunan saraf pusat (SSP) (Rash et al., 1998). Namun, pada tulisan ini akan lebih ditekankan pada pembahasan AQP4.
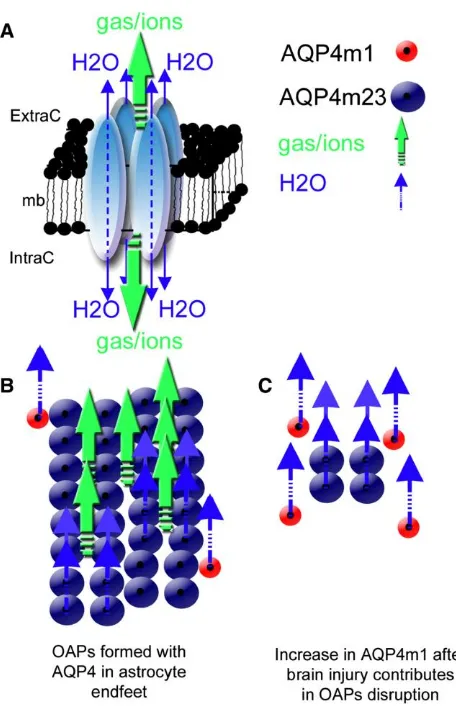
Gambar 2.6 Struktur organisasi dari AQP4 dalam membran astrosit. (A) Skema gambar dari AQP4 homo-tetramer (B) Dalam otak normal, hubungan antara isoform AQP4-m1 (lingkaran merah) dan AQP4-m23 (lingkaran biru) berkontribusi untuk membentuk susunan orthogonal partikel (OAPs). (C) Dalam cedera kepala, peningkatan AQP4-m1 memberikan kontribusi pada gangguan OAPs dengan terjadinya perubahan dalam ukuran OAP dapat menurunkan jumlah pori sentral dan mungkin tidak hanya mempengaruhi pergerakan air, tetapi juga gerakan ion dan gas (Pallab, et al., 2014).
sel glia dan peningkatan regulasi AQP4. Sejatinya AQP4 meningkat pada kedua fase edema, namun tingkat transkripsi dan translasi ekspresi AQP4 jauh lebih tinggi pada fase resolusi (Tourdias et al., 2011). Regulasi ekspresi AQP4 adalah penentu utama jumlah cairan otak secara keseluruhan dan resolusi edema. Beratnya cedera berhubungan dengan peningkatan regulasi AQP4 dan edema interstitial (Tourdias et al., 2009).
mengurangi edema sitotoksik jika diberikan awal untuk memperlambat masuknya cairan edema ke parenkim otak. Pemberian AQP4 inhibitor yang terlambat pada edema sitotoksik diduga dapat meningkatkan edema serebri. (Papadopoulos et al., 2004). Sejalan dengan ini dan mengacu pada peran AQP4 dalam memodulasi cairan serebri, beberapa penelitian juga mendapatkan bahwa penurunan ekspresi AQP4 dapat digunakan sebagai pilihan baru terapi edema serebri (Manley et al., 2000; Papadopoulos dan Verkman, 2007; Kleffner et al., 2008).
2.2 Melatonin
Melatonin (5-metoksi-N-asetiltriptamin) adalah hormon derivat asam amino triptofan yang diproduksi oleh kelenjar pineal dan bersifat sebagai antioksidan (Brzezinski, 1997). Berdasarkan strukturnya Melatonin bersifat ampifilik, dan berbeda dengan antioksidan lain yang bersifat hidrofilik atau lipofilik. Dengan kata lain, Melatonin dapat larut dalam air dan lemak sehingga ia dapat melewati sawar atau barrier fisiologis berupa lemak dan cairan tubuh (Reiter, 2004).
2.2.1 Metabolisme dan Biosintesis Melatonin
serotonin
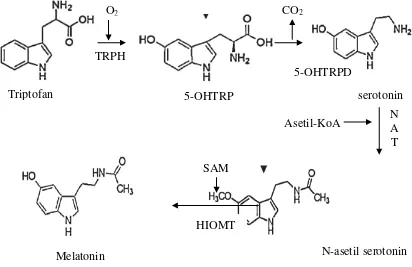
Gambar 2.8 Metabolisme dan biosintesis Melatonin (Morera et al., 2009)
2.2.2 Regulasi Melatonin
Kadar Melatonin dipengaruhi oleh ritme sirkadian serta disekresikan secara ritmik di bawah kendali siklus malam-siang dan poros hipotalamo-hipofisis (Arendt, 1988). Produksi Melatonin meningkat pada malam hari dan menurun pada siang hari. Kadar Melatonin serum mulai meningkat pukul 21.00–23.00, mencapai puncaknya pada pukul 01.00–03.00, dan mulai menurun pada pukul 07.00–09.00 (Brzezinski, 1997). Mandera et al., mendapatkan bahwa kompresi kelenjar pineal dapat menurunkan
sekresi Melatonin secara bermakna pada pagi hari (Mandera et al., 2003). Pencahayaan minimal dan tidur lelap akan meningkatkan produksi
Meskipun Melatonin terutama disekresikan oleh kelenjar pineal, ada beberapa sel dan organ tubuh lainnya yang juga memproduksi Melatonin, seperti medulla spinalis (Conti et al., 2000), kantung empedu (Tan et al.,1999a; Koppisetti et al., 2008), cairan serebrospinal dari ventrikel tiga
2.2.3 Fungsi Melatonin
Melatonin dapat berperan sebagai antioksidan (Reiter et al., 1997; Reiter, 1998; Reiter et al., 2003), modulator biologis untuk mood, tidur, perilaku seksual, sistem reproduksi, ritme sirkadian (Beyer et al., 1998; Nowak et al., 1998), serta immunoregulator (Haldar et al., 2001; Maestroni, 2001). Selain itu, Melatonin juga dapat berperan sebagai antikonvulsan (Turgut et al., 2003; Yahyavi- Firouz- Abadi, 2006; Yildirim dan Marangouz, 2006), freparat antipenuaan (Reiter, 1994), bersifat onkostatik terhadap berbagai jenis tumor (Anisimov et al., 1997; Gilad et al., 1999; Petranka et al.,1999; Kanishi et al., 2000; Siu et al., 2002; Kiefer et al., 2002; Lissoni et al., 2003); memengaruhi berbagai gangguan yang
terkait ritme sirkadian, seperti jet lag dan bekerja dengan sistem shift (Croughs dan de Bruin, 1996; Arendt et al., 1997; Arendt, 1998 Manfredini et al., 2000; Parry, 2002). Beberapa studi mendapatkan bahwa Melatonin
bersifat neuroprotektif di SSP, seperti pada cedera kepala (Beni, et al., 2004), cedera kepala iskemik (Gupta et al., 2003; Pei dan Cheung, 2004), alzheimer (Feng et al., 2004), amyotrophic lateral sclerosis (Weishaupt et al., 2006), parkinson (Mayo et al., 2005; Sharma et al., 2006), dan
Sifat antioksidan Melatonin adalah kemampuannya dalam membersihkan radikal bebas dan menginduksi ekspresi enzim antioksidan (Burkhardt et al., 2001). Aktivitas dan ekspresi enzim antioksidan seperti superoksid dismutase, katalase, glutation peroksidase, dan glutation reduktase meningkat karena Melatonin (Pablo et al., 1995; Ozturk et al., 2000; Meki dan Hussein, 2001; Reiter et al., 2004; Subramanian et al., 2007). Meskipun berat jaringan otak hanya 2 % dari berat badan, penggunaan energi jaringan otak mencapai 20 % dari utilisasi energi tubuh (Clarke et al., 1994). Keadaan ini menyebabkan produksi ROS otak lebih banyak daripada jaringan tubuh lain (Reiter et al., 2005). Terlebih lagi jaringan otak mengandung tinggi asam lemak tidak jenuh ganda atau polyunsaturated fatty acid (PUFA) dan besi non-heme yang rentan teroksidasi oleh radikal bebas. Kondisi patologis berhubungan dengan penurunan kadar antioksidan nonenzimatik plasma dan penurunan aktivitas enzim antioksidan (Cherubini, 2005). Melatonin diketahui mencegah produksi inducible nitric oxide synthase (iNOS) (Alonso et al, 2006; Escames et al., 2006). Peningkatan ekspresi iNOS ini terjadi di berbagai jaringan sebagai respon terhadap hipoksia dan berperan dalam memicu peningkatan produksi NO dan ROS (Jung et al., 2000). Efek neuroprotektif Melatonin pada cedera kepala dilaporkan melalui potensiasi antioksidan jaringan otak, seperti asam askorbat dan menurunkan aktivasi NFκB (Beni et al., 2004). Aktivasi NFκB inilah yang selanjutnya berperan
Wagner, 2007). NFκB aktif akan memicu produksi berbagai sitokin proinflamasi dan mikroglia merupakan salah satu sel utama pembentuk berbagai sitokin (Ye et al., 1999; Yu et al., 2002).
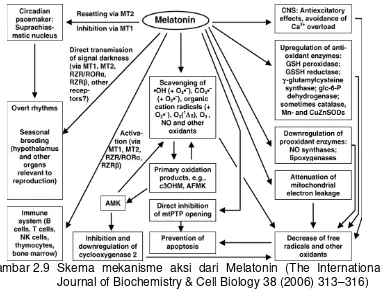
Gambar 2.9 Skema mekanisme aksi dari Melatonin (The International Journal of Biochemistry & Cell Biology 38 (2006) 313–316)
2.2.4 Kebutuhan Melatonin
memberikan efek samping negatif (Nordlund dan Lerner, 1997). Srinivasan et al., mendapatkan suplementasi Melatonin 20 mg/kgBB/ hari dapat menghambat apoptosis dan kerusakan sel hepar karena stres oksidatif pada malaria (Srinivasan et al., 2010). Beberapa studi pada hewan coba menggunakan dosis bervariasi untuk edema serebri. Rerata dosis yang diberikan adalah 5 – 6 mg/kgBB.
2.2.5 Bioavailabilitas Melatonin
besar 6HMT diekskresikan melalui urin dan feces dalam bentuk konjugat sulfat 6-sulfatoksiMelatonin (6SMT) dan sisanya dalam bentuk glukuronid (Arendt, 1995). Gangguan fungsi hepar dan ginjal dapat memengaruhi bersihan atau klirens Melatonin (Viljoen et al., 1992). Metabolit utama Melatonin adalah 6SMT, dan konsentrasi dalam urin mencapai 90% setelah suplementasi Melatonin (Arendt, 1995).
2.2.6 Peran Melatonin pada Penurunan Edema Serebri
Lotufo et al., menjelaskan modulasi interaksi antara endotel dan leukosit (Lotufo et al., 2001), efek langsung pada sel endotel (Lotufo et al., 2006), penekanan produksi NO pada jaringan otak hipoksia, dan menjelaskan antioksidan (Cuzzocrea et al., 1997; Cuzzocrea et al., 1999; Bilici et al., 2002; El-shenawy et al., 2002). Sifat antioksidan Melatonin ini adalah karena antioksidan dapat menangkap radikal bebas dan memicu ekspresi enzim antioksidan. Melatonin dapat menyingkirkan radikal hidroksil (OH), hidrogen peroksida (H2O2), singlet oxygen, asam hipoklorat, anion peroksinitrit (ONOO-) dan atau asam peroksinitrat (Reiter et al., 2003; Haldar et al., 2001). Melatonin meningkatkan dan ekspresi
4-hidroksi-2-nonenal terbentuk selama peroksidasi lipid karena kerusakan jaringan dapat meningkatkan kadar radikal bebas (Esterbauer et al.,1991). Melatonin diketahui dapat berinteraksi langsung dengan MDA dan menghindari kerusakan selular karena stres oksidatif (Li et al., 2005). Stres oksidatif ini terjadi bila ada inflamasi dan kerusakan selular terjadi karena produksi sitokin proinflamasi yang berlebih.
Melatonin dapat berperan sebagai antiinflamasi karena dapat menyupresi produksi sitokin proinflamasi dan reactive oxygen species (ROS). Produksi sitokin proinflamasi, seperti IL-1, IL-6, dan TNFα diinduksi oleh NFκB yang teraktivasi, transkripsi (Li et al., 2005) ini
Gambar 2.10 Signaling Melatonin pada Sel Melalui Aktivasi Gpcr dan Reseptor Inti (Tae-Young., et al., 2014).
dengan pemberian Melatonin 5 mg/kgBB (Mesenge et al., 1998). Penelitian berikutnya adalah dengan memberikan injeksi Melatonin 10 mg/kgBB pada hewan coba dengan cedera kepala lebih berat. Kemudian sampai dengan dua jam pascatrauma diberikan tiga kali injeksi ulang dengan dosis yang sama. Pada hasil akhir didapatkan bahwa volume kontusio menurun secara bermakna. Jumlah dari kerusakan jaringan saraf yang dinyatakan sebagai volume kontusio penting diketahui untuk estimasi defisit neurologis yang timbul akibat cedera (Sarrafzadeh et al., 2002; Kerman et al., 2005). Beni et al., menguji efikasi Melatonin dalam perbaikan gangguan neufisiologi dan perubahan molekular yang sebagai akibat cedera. Pada uji ini digunakan hewan coba yang diberikan Melatonin dengan dosis 1-10 mg/ kgBB setelah induksi trauma. Hasil yang didapat adalah 5 mg/kgBB merupakan dosis efektif untuk menekan kerusakan jaringan saraf. Perbaikan terjadi pada hari pertama, keempat, dan ketujuh pascatrauma. Hewan coba yang mendapat Melatonin mengalami pemulihan lebih cepat dan lebih baik dibandingkan dengan kelompok kontrol. Kemudian, diketahui bahwa Melatonin meningkatkan kadar antioksidan, menghambat dengan sempurna aktivasi fase lanjut NFκB, dan menurunkan jumlah apoptocyc (AP)-1. Makna dari penemuan
Studi oleh Genovese et al., menguji pemberian kombinasi Melatonin dengan steroid dalam menghadapi stres oksidatif atau nitrosatif. Kelompok perlakuan mendapatkan deksametason 10 mg/kgBB dan Melatonin 0,025 mg/kgBB diberikan secara intraperitoneal pada satu dan empat jam pascatrauma. Sejumlah penanda kerusakan selular diamati termasuk sitokin proinflamasi TNFα yang terkait dalam respon inflamasi. Pengamatan dilakukan setiap hari selama sepuluh hari pascatrauma. Setelah diuji, diketahui bahwa terapi kombinasi deksametason dan Melatonin secara bermakna menurunkan kerusakan morfologis sel saraf melalui supresi TNFα (Genovese et al., 2007). Hasil ini konsisten dengan
studi Samanta et al., yang memberikan perlakuan Melatonin 45 mg/kgBB pada 15 menit pascatrauma dan diamati selama 48 jam kemudian. Samanta et al., menyatakan bahwa Melatonin menurunkan secara bermakna ekspresi kalpain, respon inflamasi, kerusakan akson, dan kematian sel saraf (Samanta et al., 2008). Secara teoretis, sebagai respon dari terjadinya inflamasi akan terjadi stres oksidatif. Stres oksidatif ini kemudian meningkatkan ekspresi NFκB dan TNFα. Nuclear factor κ-B aktif akan mengaktivasi TNFα. Kemudian, TNFα inilah yang akan
menghasilkan dan mengaktifkan berbagai sitokin proinflamasi lain, sehingga penekanan pada NFκB dan TNFα diduga berperan pada
Torii et al., meneliti peran Melatonin dalam supresi edema serebri dengan uji klinis pada hewan coba. Kelompok perlakuan mendapatkan Melatonin 6 mg/kgBB per oral sebanyak dua kali, yaitu pada satu jam pascaoklusi middle cerebral artery (MCA) dan satu hari setelah pembedahan. Pada analisis diketahui bahwa volume edema kelompok perlakuan menurun 51,6 % (p< 0,01) dibandingkan dengan kelompok kontrol. Efek protektif Melatonin terhadap edema ini tampak lebih besar pada korteks serebri. Edema korteks serebri menurun 59,8 % (p< 0,01) dibandingkan dengan striatum yang 34,2% (p< 0,05) (Torii et al., 2004). Sebelumnya, Kondoh et al., juga menyatakan bahwa Melatonin berperan dalam menurunkan pembentukan edema serebri pada hewan coba dengan iskemia (Kondoh et al., 2002). Melatonin diketahui dapat menurunkan permeabilitas vaskular karena dapat menurunkan kadar jaringan VEGF (Kaur et al., 2006; Kaur et al., 2007; Sivakumar et al., 2008), sehingga produksi AQP4 dan formasi edema serebri menurun (Kaur et al., 2006).
menyatakan bahwa survival rate kelompok perlakuan lebih tinggi secara bermakna dibandingkan dengan kedua kelompok kontrol. Begitu juga dengan jumlah cairan otak kelompok perlakuan. Hasil ini mengindikasikan adanya hubungan antara jumlah cairan otak dengan edema serebri dan tingkat mortalitas. Melatonin dosis tinggi dapat mencegah peningkatan kadar cairan otak secara bermakna (Ayer et al., 2008).
Sejalan dengan Ayer et al., Lee et al., juga melakukan penelitian pada hewan coba untuk mengetahui efek antioksidan Melatonin pada hewan coba pascabedah otak. Lee et al., membagi subjek menjadi tiga kelompok, Kelompok pertama mendapat Melatonin 5 mg/kgBB, kelompok kedua mendapat Melatonin 15 mg/kgBB, dan kelompok ketiga mendapat Melatonin 150 mg/kgBB. Seluruh kelompok mendapat injeksi Melatonin satu jam pasca pembedahan dan kemudian efek Melatonin diamati pada 24 jam pasca pembedahan. Setelah dianalisis, diketahui bahwa Melatonin dosis rendah memiliki kecenderungan menurunkan kadar cairan otak dan Melatonin dosis tinggi (150 mg/kgBB) menurunkan kadar cairan otak dan edema serebri secara bermakna (Lee et al., 2008).
cairan oleh sel dan pembentukan edema dapat ditekan (Kaur et al., 2006). Kemampuan ekspresi Melatonin dalam menurunkan ekspresi AQP4 diduga berhubungan dengan kemampuannya sebagai antioksidan. Sebagai antioksidan, Melatonin berperan dalam menghambat NFκB sehingga aktivasi dan ekspresi NFκB menurun. Penghambatan NFκB ini
menurunkan (80%) regulasi AQP4 pascatrauma secara signifikan (p<0,01) (Kakulavarapu et al., 2011).
2.3 Kerangka Teori
CEDERA KEPALA
SEL DEBRIS
MAKROFAG
SITOKIN
MPO ROS (MDA)
ISKEMIA
EDEMA OTAK
VCAM VEGF
AQP-4 MELA
TONIN
IL-8 IL-6 TNFα IL-1
Pada cedera kepala akan terjadi kerusakan sel (sel debris). Adanya kerusakan sel tersebut akan difagositosis oleh makrofag. Makrofag yang memfagositosis sel debris tersebut akan menjadi aktif dan melepaskan beberapa sitokin antara lain: IL-6, TNF-α, IL-8, IL-1. IL-6 dan TNF-α, dan akan menginduksi sumsum tulang untuk pembentukan leukosit (leukositosis), sedangkan IL-8 berperan sebagai neutrophil chemotactic factor (NCF), sehingga neutrofil migrasi ke perifer. Selain itu, TNF-α menginduksi endotel untuk mengeskpresikan E-selektin, yaitu dalam molekul adesi terhadap eosinofil. Sedangkan IL-1 berperan untuk menginduksi endotel dan mengekspresikan VCAM yang merupakan molekul adesi terhadap monosit. Adanya kedua molekul tersebut mengakibatkan neutrofil dan monosit menempel pada permukaan endotel. Selanjutnya, sel tersebut melepaskan suatu enzim yaitu myeloperoksidase, yang menginduksi pelepasan ROS/MDA. Adanya trombosis dan ROS/MDA tersebut mengakibatkan terjadi gangguan vaskuler pada otak dan akhirnya mengakibatkan terjadinya iskemia. Iskemia tersebut akan mengakibatkan gangguan pompa sodium pada astrosit, sehingga astrosit mengalami swelling (pembengkakan).
area interstitial. Adanya swelling (pembengkakan) sel-sel pada otak akibat iskemia dan peningkatan kadar air pada area interstitial maka terjadilah perluasan volume otak yang kemudian dikenal sebagai edema otak. Adanya edema otak akan mengakibatkan terjadi peningkatan tekanan intrakranial yang sangat berbahaya bagi penderita. Untuk mengatasi hal tersebut dilakukan dengan pemberian Melatonin. Melatonin ini bekerja menghambat myeloperoksidase. Bila enzim ini dihambat, maka tidak akan terjadi pembentukan ROS/MDA sehingga kerusakan jaringan pun tidak terjadi. Oleh karena itu, iskemik dapat dikurangi. Bila iskemik tidak terjadi, pompa sodium dapat berjalan dengan baik sehingga astrosit tidak mengalami pembengkakan. Selain menghambat myeloperoksidase, Melatonin juga bekerja menghambat VEGF. Adanya hambatan VEGF tersebut maka astrosit tidak terinduksi untuk melepaskan AQP-4 sehingga H2O tidak masuk ke cairan interstitial dan akhirnya edema otak dapat diatasi.
2.4 Hipotesis Penelitian
1. Melatonin berperan pada ekspresi MDA pada sel mikroglia hewan coba yang mengalami cedera kepala.
2. Melatonin berperan pada ekspresi MPO pada sel mikroglia hewan coba yang mengalami cedera kepala.
3. Melatonin berperan pada produksi VEGF pada SDO hewan coba yang mengalami cedera kepala.
5. Terdapat korelasi positif antara produksi VEGF dan AQP-4 pada SDO hewan coba yang diberi Melatonin.
2.5 Kerangka Konseptual
Hewan coba secara random dikelompokkan ke dalam 3 kelompok, kelompok tanpa dilakukan cedera kepala, kelompok dilakukan cedera kepala tanpa diberi Melatonin Kontrol (-), kelompok dilakukan cedera kepala dengan diberi Melatonin. Pemberian Melatonin dilakukan 1 jam pascatrauma kepala dan diulang tiap 12 jam selama 7 hari, kemudian semua hewan coba dikorbankan untuk diambil jaringan otaknya dan dilakukan pemeriksaan imunohistokimia untuk melihat MDA, MPO, VEGF dan AQP-4.
Hewan coba :
- Kelompok tanpa cedera kepala
- Kelompok kontrol dengan cedera kepala - Kelompok perlakuan dengan cedera kepala
Cedera kepala:
- MDA - MPO - VEGF - AQP4
MELATONIN