1
PEMODELAN DENSITAS PLASMA HIDROGEN PADA KESETIMBANGAN TERMODINAMIK TEKANAN ATMOSFER
HENDRA YOHANES1, SAKTIOTO2, DEFRIANTO2 E-mail : hendrayohanes80@yahoo.com
1
Mahasiswa Program S1 Fisika FMIPA-UR
2
Dosen Jurusan Fisika FMIPA-UR
Fakultas Matematika dan Ilmu Pengetahuan Alam Universitas Riau Kampus Binawidya Pekanbaru, 28293, Indonesia
ABSTRACT
The equilibrium densities of hydrogen species have been determined by a computational modeling. The thermodynamic equilibrium process is required to expose plasma on a sample at a stable and controlled condition. Hydrogen species densities have been modeled based on the time-dependent continuity equation and a modified Arrhenius equation. These equations are used to integrate the density change over the time. This simulation is designed to find the equilibrium hydrogen species densities and reaction rates, both among the thermal hydrogen species and among the non-thermal hydrogen species, at a constant atmospheric pressure and low temperature. For the thermal hydrogen plasma, the equilibrium density of electron, H2, H, H2+, H+, and H- are obtained from the numerical calculation is 2.6×1010; 5.12×1024; 9.23×1022; 4.07×1021; 3.58×1022; and 5.12×1020 m-3, respectively. And, for the non-thermal hydrogen plasma, the equilibrium density of electron, H2, H, H2+, and H+ are acquired from the numerical simulation is 4.03×1023; 1.01 × 1025; 6.05 × 1024; 3.02 × 1024; and 3.36 × 1023 m-3, respectively. From the reaction rate gained, it can be inferred that the dominant process of electron in thermal hydrogen is the recombination, where its density decreases in order to reach the equilibrium. Meanwhile, the dominant process for electron in non-thermal hydrogen is the ionization, where its density increases in order to reach the equilibrium. From this modeling, the relationship between equilibrium electron densities in hydrogen plasmas and the required time to reach equilibrium was found.
Keywords : Hydrogen Plasma, Atmospheric Pressure Plasma, Equilibrium Electron Density, Reaction Rate, Chemical Kinetic Model
PENDAHULUAN
Plasma merupakan kumpulan gas yang terionisasi dan dikenal juga sebagai wujud materi yang ke empat, selain padat, cair, dan gas. Berdasarkan tekanan operasinya, teknologi berbasis plasma umumnya dikelompokkan menjadi dua jenis, yakni plasma
2
tekanan rendah dan plasma tekanan atmosfer. Aplikasi plasma tekanan atmosfer yang tengah dikembangkan pada tahun-tahun terakhir ini adalah aplikasi plasma temperatur rendah di bidang kesehatan. Aplikasi biomedis plasma tekanan atmosfer umumnya dikelompokkan menjadi modifikasi permukaan biomaterial, dekontaminasi biologis, dan terapi dengan plasma (Weltmann et al., 2008). Salah satu contoh plasma termal tekanan atmosfer yang telah berhasil diaplikasikan adalah Koagulator Plasma Argon (APC), yakni untuk menghentikan pendarahan atau hemostasis, teknik pengangkatan tumor (Heinlin et al., 2010), dan sebagai teknik pembedahan (Canady et al., 2006).
Selain plasma termal, plasma nontermal mulai diteliti dan dikembangkan dalam aplikasi biomedis. Sifat plasma nontermal memungkinkan plasma untuk berinteraksi dengan jaringan organik, biomaterial polimer sintetik, dan material anorganik dengan tubuh manusia secara aman (Lee et al., 2011). Contoh-contoh aplikasi biomedis plasma tekanan atmosfer lainnya adalah dekontaminasi (Ehlbeck et al., 2011), koagulasi darah (Kalghatgi et al., 2007), dan penyembuhan luka (Lloyd et al., 2010).
Di bidang biomedis, para peneliti sedang mengembangkan terapi penyembuhan luka dengan plasma, yang membutuhkan unsur-unsur yang reaktif dan tetap aman dalam interaksi dengan jaringan organik tubuh yang terluka (Morfill et al., 2009; Laroussi, 2009). Hidrogen merupakan unsur yang memiliki reaktivitas yang tinggi. Pada tahun 2007, dilaporkan bahwa telah berhasil dikembangkan peralatan pembangkit plasma tekanan atmosfer yang dapat menghasilkan ion H+, untuk menetralkan radikal bebas OH di udara dalam ruangan dan aman bagi manusia (Nojima et al., 2007). Reaktivitas hidrogen menjadi alasan utama untuk melibatkan hidrogen dalam pengembangan teknologi plasma medis.
Densitas hidrogen setimbang yang hendak dipaparkan pada sampel merupakan permasalahan yang belum terselesaikan. Maka untuk mencoba menyelesaikan masalah ini, penulis ingin menentukan densitas plasma hidrogen yang dibutuhkan dengan pemodelan menggunakan perangkat lunak komputasi. Dengan memperoleh densitas hidrogen, para peneliti dapat menghitung jumlah energi panas yang diperlukan untuk berinteraksi dengan sampel perlakuan plasma secara aman. Selain itu, jumlah energi sumber yang dibutuhkan dalam pengoperasian alat pembangkit plasma dapat diperkirakan. Lebih jauh lagi, dengan memperoleh densitas hidrogen pada kesetimbangan termodinamik, pengoperasian alat pembangkit plasma dapat lebih dioptimalkan. Karena, dapat mencegah terjadinya pengotoran atau percampuran plasma hidrogen dengan gas-gas lain di udara, sehingga pengoperasian plasma terkendali dengan baik sesuai dengan kebutuhan.
Sistem plasma hidrogen terdiri dari beberapa spesies dengan densitas awal pada temperatur tertentu, seperti elektron, H2, H, ion H+, H2+, dan H-. Sesuai dengan Teori Kinetik Gas Ideal, spesies-spesies plasma hidrogen ini saling bertumbukan satu sama lain terus menerus, hingga mencapai keadaan kesetimbangan dimana densitas spesies sebelum dan sesudah tumbukan tetap sama.
METODE PENELITIAN
Untuk menggambarkan model kinetik kimia, diterapkan persamaan kontinuitas untuk tiap spesies, yakni :
3 ∂ n
∂ t + ∇∙ n v = S (1)
dimana n merupakan densitas, v adalah kecepatan bergantung posisi, dan S adalah sumber partikel per satuan volume, per satuan waktu.
Suku difusif ∇∙ n v pada persamaan (1) dapat diabaikan (Yu et al., 2001). Oleh karena itu, persamaan (1) menjadi nol dimensi dan hanya bergantung pada waktu, seperti yang ditunjukkan oleh persamaan berikut ini :
∂ n
∂ t = S (2)
Persamaan (2) menunjukkan bahwa perubahan densitas sepenuhnya bergantung kepada suku sumber S.
Tinjau suatu proses reaksi setimbang yang diwakili oleh persamaan berikut ini (Ismail et al., 2011).
aA + bB → cC + dD + … (3)
Sedangkan, laju reaksi maju diberikan oleh :
Rf = kf A a B b (4)
dan laju reaksi balik diberikan oleh :
Rr = kr C c D d… (5)
dimana A, B, C dan D adalah spesies yang terlibat dalam reaksi dan simbol [ ] menunjukkan densitas spesies. Sedangkan, a, b, c, dan d adalah jumlah molekul dari tiap pereaksi dan hasil reaksi yang terlibat. Konstanta laju reaksi maju disimbolkan oleh kf (forward reaction rate) dan konstanta laju reaksi balik disimbolkan oleh kr (reverse reaction rate).
Formulasi Arrhenius digunakan untuk menggambarkan konstanta laju reaksi (k) sebagai fungsi terhadap temperatur (T). Persamaan Arrhenius modifikasi didefinisikan untuk memperjelas kebergantungan faktor pra-eksponensial pada suhu. Persamaan Arrhenius modifikasi dapat ditulis dalam bentuk sebagai berikut (Saktioto, 2000).
k = α Tβ exp - γ
T (6)
dimana : k = konstanta laju reaksi dalam satuan m3 s-1. α = konstanta yang tidak bergantung kepada suhu. T = temperatur mutlak ketika reaksi terjadi (Kelvin). β = bilangan pangkat tak bersatuan.
γ = konstanta yang setara dengan EA/R.
Ketiga konstanta α, β, dan γ dalam persamaan (6) disebut sebagai parameter Arrhenius, yang nilainya bergantung kepada hasil eksperimen.
Sumber total spesies untuk setiap reaksi dapat dihitung menurut persamaan berikut ini :
S = Mr - Nf Rf - Rr (7) dimana Mr dan Nf berturut-turut adalah jumlah molekul spesies hasil reaksi dan pereaksi.
Tinjau kembali persamaan gas ideal (Krall dan Trivelpiece, 1973), seperti yang dinyatakan oleh persamaan berikut.
p = n . kB . T (8)
Dengan asumsi temperatur spesies dan tekanan dalam sistem plasma konstan, maka persamaan gas ideal dapat didiferensialkan secara parsial terhadap waktu menjadi :
4 d p
d t = kB T d n
d t = 0 (9)
Dengan mengabaikan kB sebagai konstanta Boltzmann dan menggabungkan persamaan (9) dan (7), maka dapat diperoleh solusi sebagai berikut.
d n
d t = Mr - Nf Rf - Rr = 0 (10) Pada saat nilai persamaan (10) mencapai nilai mendekati atau sama dengan nol, maka kesetimbangan densitas telah tercapai.
Penelitian ini dikerjakan dengan metode pemodelan komputasi menggunakan perangkat lunak Matrix Laboratory (MATLAB). Di dalam penelitian ini, dikumpulkan nilai parameter Arrhenius untuk reaksi-reaksi spesies hidrogen dari berbagai referensi. Daftar nilai parameter Arrhenius yang digunakan dalam pemodelan komputasi ini dimuat dalam Tabel 1 untuk plasma hidrogen termal dan Tabel 2 untuk plasma hidrogen nontermal.
Tabel 1. Reaksi Spesies Hidrogen Termal
No Reaksi (m3 s-1) (K) Referensi 1 H + e- → H+ + e-+ e- 1,14×10-15 0,21 169000 Al-Mamun et al -1 H+ + e-+ e- → H + e- 7,08×1027 -4,5 0 Rhodes-Keefer 2 H + H2 → H2 + H 6,3×10 5 0,5 4000 Westley -2 H2 + H → H + H2 6,3×105 0,5 4000 Westley 3 H2 + H → H + H + H 4,49×10-14 -0,1 52530 Cohen-Westberg -3 H + H +H → H2 +H 8,8×10 -45 0 0 Cohen-Westberg 4 H2 + H2 → H + H + H2 1,43×10 -12 -0.7 52530 Cohen-Westberg -4 H + H + H2 → H2 +H2 2,8×10-43 -0,6 0 Baulch et al 5 H 2 + e- → H + H + e- 1,91×10 -1 1,0 116045 Kimura-Kasugai
-5 Data reaksi balik tidak tersedia
6 H2+ + H2 + e- → H2 + H2 6,07×10 -34
-2,5 0 Al-Mamun et al
-6 Data reaksi balik tidak tersedia
7 H+ + H2 + e- → H2 + H 6,07×10-34 -2,5 0 Al-Mamun et al
-7 Data reaksi balik tidak tersedia
8 H + H2+ + e- → H + H2 1,66×10-35 -2,5 0 Tanaka
-8 Data reaksi balik tidak tersedia
9 H+ + H + e- → H + H 1,66×10-35 -2,5 0 Al-Mamun et al -9 H + H → H+ + H + e- 6,5×103 -3,78 159000 Tanaka
10 H2 + e- → H2+ + e- + e- 9,53×10-19 0,9 145000 Al-Mamun et al -10 Data reaksi balik tidak tersedia
11 H- + H → H2 + e- 7,83×102 0 0 McCay-Dexter -11 Data reaksi balik tidak tersedia
12 H+ + H- → H + H 1,3×106 -0,5 0 McCay-Dexter -12 Data reaksi balik tidak tersedia
Tabel 2. Reaksi Spesies Hidrogen Nontermal
No Reaksi (m3 s-1) (K) Referensi
5
-1 Data reaksi balik tidak tersedia
2 H + H2 → H2 + H 6,3×105 0,5 4000 Westley -2 H2 + H → H + H2 6,3×105 0,5 4000 Westley 3 H2 + H → H + H + H 2,23×1012 0,5 46600 Watanabe et al -3 H + H +H → H2 +H 8,8×10-45 0 0 Cohen-Westberg 4 H2 + H2 → H + H + H2 2,23×10 12 0,5 46600 Watanabe et al -4 H + H + H2 → H2 +H2 2,8×10 -43 -0,6 0 Baulch et al 5 H 2 + e- → H + H + e- 2,23×10 12 0,5 46600 Watanabe et al -5 Data reaksi balik tidak tersedia
6 H2+ + H2 + e- → H2 + H2 6,07×10 -34
-2,5 0 Tanaka -6 Data reaksi balik tidak tersedia
7 H2+ + H + e- → H2 + H 6,07×10-34 -2,5 0 Tanaka -7 Data reaksi balik tidak tersedia
8 H2+ + H + e- → H + H2 1,66×10-35 -2,5 0 Tanaka -8 Data reaksi balik tidak tersedia
9 H+ + H + e- → H + H 1,66×10-35 -2,5 0 Tanaka -9 Data reaksi balik tidak tersedia
10 e- + H2 → H2+ + e- + e- 3,11×10 -14
0 219324 Kimura-Kasugai -10 Data reaksi balik tidak tersedia
11 e- + H2 → H + H+ 3,07×10 -16
0 203078 Kimura-Kasugai -11 Data reaksi balik tidak tersedia
12 e- + H2+ → H++ H + e- 1,45×10 -13
0 22861 Kimura-Kasugai -12 Data reaksi balik tidak tersedia
HASIL DAN PEMBAHASAN
Pemodelan plasma hidrogen termal ini melibatkan 6 spesies. Nilai masukan yang digunakan untuk spesies termal, disajikan dalam Tabel 3.
Tabel 3. Daftar Nilai Input Pemodelan Plasma Hidrogen Termal
Parameter
Spesies
elektron H2 H H+ H2+ H
-Densitas (m-3) 2×1018 1×1023 1,8×1021 8×1019 7×1020 1×1019 Temperatur awal (eV) 0,12 0,12 0,12 0,12 0,12 0,12
Waktu integrasi (s) 1,0 × 10-9
Sedangkan, Pemodelan plasma hidrogen nontermal yang dikerjakan melibatkan 5 spesies. Nilai input yang digunakan untuk spesies nontermal, disajikan dalam Tabel 4.
6
Tabel 4. Daftar Nilai Input Pemodelan Plasma Hidrogen Nontermal
Parameter
Spesies
elektron H2 H H+ H2+
Densitas (m-3) 2×1017 3×1020 1,8×1020 9×1019 1×1019 Temperatur awal (eV) 1 0,032 0,032 0,032 0,032
Waktu integrasi (s) 1,0 × 10-9
Dengan mengolah data masukan seperti yang tercantum dalam Tabel 1, 2, 3, dan 4, pemodelan ini berhasil memperoleh densitas spesies hidrogen pada kesetimbangan termodinamik tekanan atmosfer. Nilai densitas spesies yang diperoleh ditampilkan dalam Tabel 5 berikut ini.
Tabel 5. Densitas Hidrogen Pada Kesetimbangan Termodinamik (m-3) Spesies Densitas Spesies Termal Densitas Spesies Nontermal
elektron 9,7×1012 4,03×1023 H2 5,12×1024 1,01 × 1025 H 9,23×1022 6,05 × 1024 H+ 4,07×1021 3,02 × 1024 H2+ 3,58×1022 3,36 × 1023 H- 5,12×1020 Tidak ditinjau
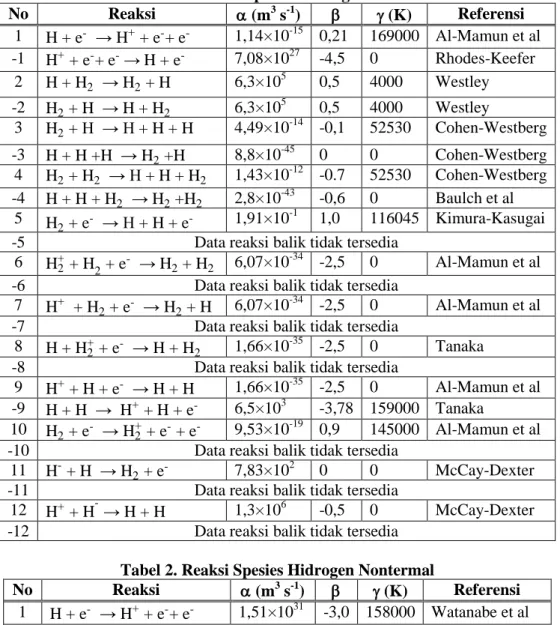
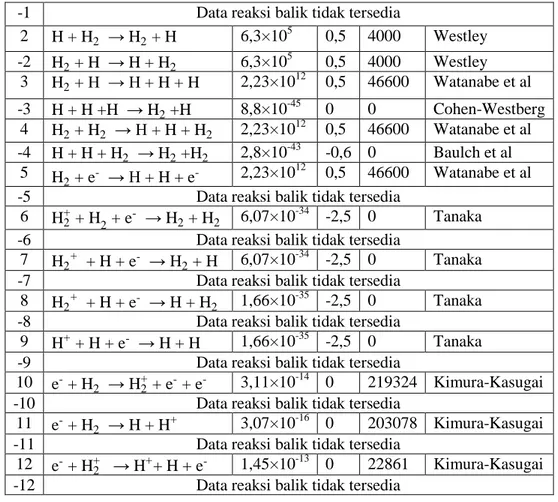
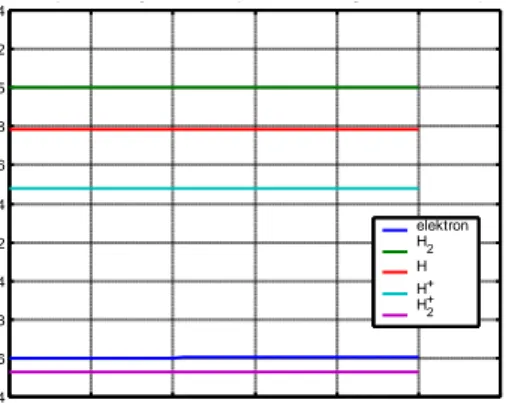
Pemodelan ini juga mem-plot grafik perubahan densitas tiap spesies hidrogen termal untuk mencapai kesetimbangan termodinamik, seperti yang disajikan dalam Gambar 1(a). Sedangkan, untuk spesies hidrogen nontermal disajikan pada Gambar 1(b). Dari Gambar 1 yang diperoleh dengan pemodelan ini, terlihat bahwa spesies yang mengalami perubahan densitas yang paling signifikan adalah elektron. Pada plasma hidrogen termal, kesetimbangan densitas elektron dicapai pada nilai yang cukup rendah, yakni dalam orde 1012 m-3. Sedangkan, pada plasma hidrogen nontermal, kesetimbangan densitas elektron dicapai pada nilai yang cukup tinggi, yakni dalam orde 1023 m-3.
(a) (b)
Gambar 1. Perubahan Densitas Spesies Plasma Hidrogen 0 50 100 150 200 250 300 12 14 16 18 20 22 24 26
Perubahan Densitas Spesies Hidrogen Termal
Waktu (nanosekon) D e n s it a s l o g n ( m -3) elektron H2 H H+ H2+ H- 0 5 10 15 20 25 30 35 40 22.5 23 23.5 24 24.5 25 25.5
Perubahan Densitas Spesies Hidrogen Nontermal
Waktu (nanosekon) D e n s it a s l o g n ( m -3) elektron H2 H H+ H 2 +
7
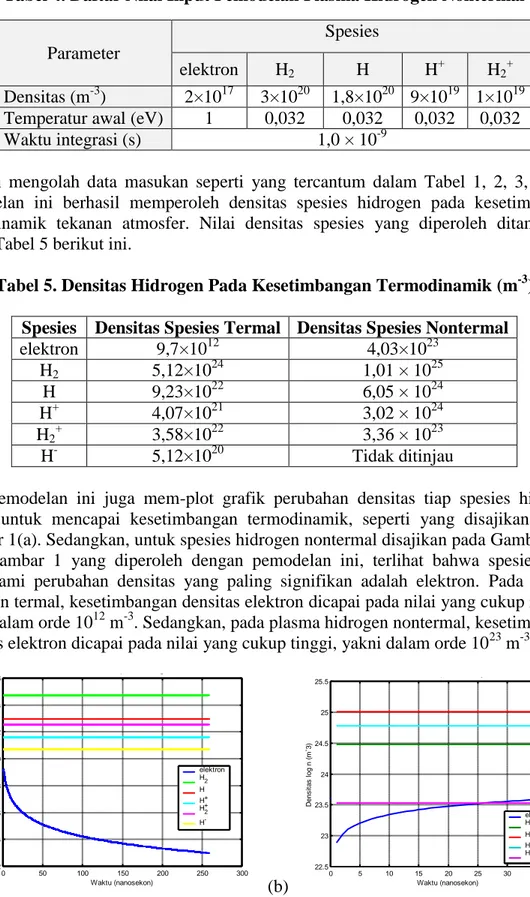
Pada Gambar 2(a), disajikan densitas tiap spesies plasma hidrogen termal pada kesetimbangan termodinamik tekanan atmosfer dan untuk spesies hidrogen nontermal pada Gambar 2(b). Dari pemodelan ini, dapat disimpulkan bahwa plasma hidrogen termal akan mengalami kesetimbangan termodinamik tekanan atmosfer pada rentang waktu 259 - 260 nanosekon. Sebagai bahan perbandingan, Keller et al melaporkan durasi plasma argon termal sekitar 450 - 470 ns. Hal ini tidak menentang kenyataan fisis bahwa nomor massa atom hidrogen lebih kecil dibandingkan dengan argon, sehingga lebih cepat mencapai kesetimbangan termodinamik. Sedangkan, pemodelan plasma hidrogen nontermal mendapati bahwa kesetimbangan termodinamik tekanan atmosfer akan berlangsung pada rentang waktu 38 – 39 nanosekon.
(a) (b)
Gambar 2. Kesetimbangan Densitas Spesies Hidrogen
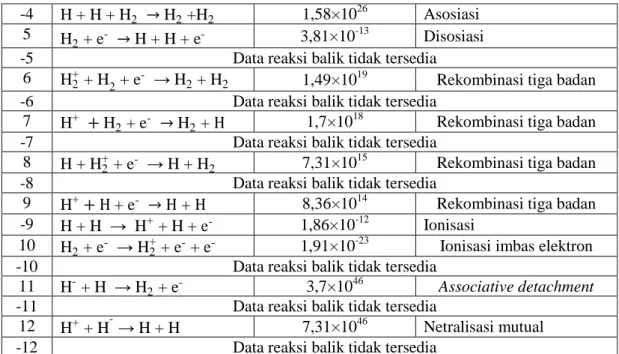
Pemodelan yang dirancang juga berhasil menghitung nilai laju reaksi antar spesies plasma hidrogen. Daftar tumbukan beserta nilai laju tumbukan yang diperoleh untuk spesies hidrogen termal, dicantumkan dalam Tabel 6. Setiap reaksi bernomor positif merupakan reaksi maju, sedangkan reaksi bernomor negatif merupakan reaksi balik. Laju tumbukan terbesar ditunjukkan oleh reaksi 2 dan -2, yakni 6,28×1053 m-3 s-1. Sementara itu, laju tumbukan terkecil dicapai oleh ionisasi (reaksi 1), yakni 9,09×10-32 m-3 s-1. Umumnya, laju ionisasi plasma hidrogen termal lebih rendah dibandingkan dengan laju rekombinasi (reaksi 1 dan 9). Sedangkan, laju asosiasi lebih tinggi dibandingkan dengan laju disosiasi (reaksi 3 dan 4).
Tabel 6. Daftar Reaksi dan Laju Reaksi Plasma Hidrogen Termal 2.588 2.59 2.592 2.594 2.596 2.598 2.6 x 10-7 12 14 16 18 20 22 24 26 Waktu (sekon) D e n s it a s l o g n ( m -3) elektron H2 H H+ H2+ H- 3.8 3.82 3.84 3.86 3.88 3.9 3.92 x 10-8 23.4 23.6 23.8 24 24.2 24.4 24.6 24.8 25 25.2 25.4
Densitas Spesies Hidrogen Nontermal pada Kesetimbangan Termodinamik (1 atm)
Waktu (sekon) D e n s it a s l o g n ( m -3) elektron H2 H H+ H 2 +
No. Reaksi Laju Reaksi (m-3 s-1) Jenis Reaksi 1 H + e- → H+ + e-+ e- 9,09×10-32 Ionisasi imbas elektron -1 H+ + e-+ e- → H + e- 1,93×1061 Rekombinasi tiga badan
2 H + H2 → H2 + H 6,28×1053 hamburan elastik -2 H2 + H → H + H2 6,28×1053 hamburan elastik
3 H2 + H → H + H + H 4,25×1017 Disosiasi -3 H + H +H → H2 +H 6,89×1024 Asosiasi
8
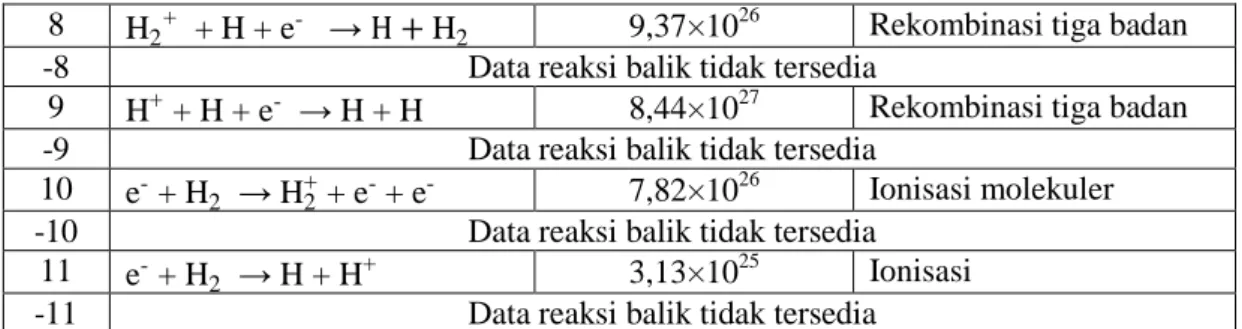
Sedangkan, daftar reaksi dan nilai laju reaksi spesies hidrogen nontermal dicantumkan dalam Tabel 7. Nilai laju reaksi yang terbesar ditunjukkan oleh reaksi 1, yakni 2,88×1061 m-3 s-1. Sementara itu, laju tumbukan terkecil dicapai oleh reaksi 3, yakni 8,27×108 m-3 s-1. Pada reaksi 3 dan 4, laju asosiasi lebih tinggi daripada laju disosiasi. Karena keterbatasan yang data referensi yang ada, pemodelan ini tidak menggunakan nilai parameter Arrhenius untuk satu reaksi ionisasi dan rekombinasi yang lengkap. Berdasarkan data input yang ada, diperoleh nilai laju reaksi untuk ionisasi dan rekombinasi yang berbeda-beda dan tidak dianggap sebagai satu reaksi dapat balik (reversible reaction).
Tabel 7. Daftar Reaksi dan Laju Reaksi Plasma Hidrogen Nontermal No Reaksi Laju Reaksi (m-3 s-1) Jenis Reaksi
1 H + e- → H+ + e-+ e- 2,88×1061 Ionisasi imbas elektron
-1 Data reaksi balik tidak tersedia
2 H + H2 → H2 + H 1,55×1052 Hamburan elastik -2 H2 + H → H + H2 1,55×10 52 Hamburan elastik 3 H2 + H → H + H + H 8,27×108 Disosiasi -3 H + H +H → H2 +H 1,95×1030 Asosiasi 4 H2 + H2 → H + H + H2 1,38×109 Disosiasi -4 H + H + H2 → H2 +H2 2,97×10 30 Asosiasi 5 H 2 + e- → H + H + e- 1,76×10 61 Disosiasi
-5 Data reaksi balik tidak tersedia
6 H2+ + H2 + e- → H2 + H2 5,71×10
28 Rekombinasi tiga badan
-6 Data reaksi balik tidak tersedia
7 H2+ + H + e- → H2 + H 3,43×10
28 Rekombinasi tiga badan
-7 Data reaksi balik tidak tersedia
-4 H + H + H2 → H2 +H2 1,58×10 26 Asosiasi 5 H 2 + e- → H + H + e- 3,81×10 -13 Disosiasi
-5 Data reaksi balik tidak tersedia
6 H2+ + H2 + e- → H2 + H2 1,49×1019 Rekombinasi tiga badan
-6 Data reaksi balik tidak tersedia
7 H+ + H2 + e- → H2 + H 1,7×1018 Rekombinasi tiga badan
-7 Data reaksi balik tidak tersedia
8 H + H2+ + e- → H + H2 7,31×1015 Rekombinasi tiga badan
-8 Data reaksi balik tidak tersedia
9 H+ + H + e- → H + H 8,36×1014 Rekombinasi tiga badan -9 H + H → H+ + H + e- 1,86×10-12 Ionisasi
10 H2 + e- → H2+ + e- + e- 1,91×10-23 Ionisasi imbas elektron
-10 Data reaksi balik tidak tersedia
11 H- + H → H2 + e- 3,7×1046 Associative detachment
-11 Data reaksi balik tidak tersedia
12 H+ + H- → H + H 7,31×1046 Netralisasi mutual
9
8 H2+ + H + e- → H + H2 9,37×1026 Rekombinasi tiga badan
-8 Data reaksi balik tidak tersedia
9 H+ + H + e- → H + H 8,44×1027 Rekombinasi tiga badan
-9 Data reaksi balik tidak tersedia
10 e- + H2 → H2+ + e- + e- 7,82×10 26
Ionisasi molekuler
-10 Data reaksi balik tidak tersedia
11 e- + H2 → H + H+ 3,13×10 25
Ionisasi
-11 Data reaksi balik tidak tersedia
Dengan memvariasikan waktu integrasi, pemodelan ini dapat memperoleh berbagai nilai densitas elektron pada kesetimbangan tekanan atmosfer. Hasil yang diperoleh ditampilkan pada Gambar 3(a) untuk elektron pada hidrogen termal dan pada Gambar 3(b) untuk elektron pada hidrogen nontermal. Pada plasma hidrogen termal, densitas elektron pada kesetimbangan cenderung menurun secara signifikan terhadap pertambahan waktu, yakni dalam orde ~ 108 pada rentang waktu dari 1×10-10 sampai 5×10-8 s. Sedangkan, elektron pada plasma hidrogen nontermal mengalami peningkatan densitas pada kesetimbangan, namun tidak terlalu signifikan, yakni ~ 101 pada rentang waktu yang sama.
Gambar 3. Densitas Elektron Plasma Hidrogen pada Berbagai Waktu Integrasi
KESIMPULAN
Melalui pemodelan ini, penulis dapat menentukan nilai densitas masing-masing spesies hidrogen termal dan nontermal pada kesetimbangan termodinamik tekanan atmosfer. Dari hasil pemodelan, dapat disimpulkan bahwa nilai densitas elektron dalam plasma hidrogen termal jauh lebih rendah daripada spesies lainnya pada kesetimbangan. Sedangkan, untuk plasma hidrogen nontermal, nilai densitas elektron tidak berbeda
15.98 13.89 12.99 10.89 9.99 7.88 0 2 4 6 8 10 12 14 16 18 De n sitas E lektr on log n ( m -3) Waktu Integrasi (s) (a) 23.17 23.48 23.61 23.88 23.9924.26 22.6 22.8 23 23.2 23.4 23.6 23.8 24 24.2 24.4 De n sitas E lektr on log n ( m -3) Waktu Integrasi (s) (b)
10
terlalu jauh dengan densitas spesies lainnya pada kesetimbangan termodinamik, yakni maksimum dalam rasio orde 102.
Pada plasma hidrogen termal, tiga nilai laju reaksi yang terbesar berturut-turut adalah hamburan elastik (reaksi 2), rekombinasi (reaksi -1), dan netralisasi mutual (reaksi 12). Hal ini mengimplikasikan elektron plasma hidrogen termal lebih banyak berekombinasi, sehingga densitasnya menurun dalam proses untuk mencapai kesetimbangan, seperti yang ditunjukkan spesies elektron pada Gambar 1(a). Sedangkan, pada plasma hidrogen nontermal, tiga nilai laju reaksi yang terbesar berturut-turut adalah ionisasi (reaksi 1), disosiasi (reaksi 5), dan hamburan elastik (reaksi 2). Hal ini mengimplikasikan elektron plasma hidrogen termal lebih banyak berionisasi, sehingga densitasnya meningkat dalam proses untuk mencapai kesetimbangan, seperti yang ditunjukkan spesies elektron pada Gambar 1(b).
Pemodelan plasma hidrogen termal yang dikerjakan berhasil memperoleh waktu yang diperlukan untuk mencapai kesetimbangan densitas adalah 259 nanosekon. Sedangkan, untuk plasma hidrogen nontermal dibutuhkan waktu 38 nanosekon. Dari pemodelan ini, juga dapat disimpulkan bahwa densitas elektron pada kesetimbangan termodinamik untuk plasma hidrogen termal menurun seiring meningkatnya waktu untuk mencapai kesetimbangan, sesuai dengan Gambar 3(a). Sedangkan, pada plasma hidrogen nontermal berlaku hal sebaliknya, yakni densitas elektron pada kesetimbangan meningkat seiring meningkatnya waktu untuk mencapai kesetimbangan, sesuai dengan Gambar 3(b).
DAFTAR PUSTAKA
Al-Mamun, S.A., Tanaka, Y., Uesugi, Y. (2010). Two-Temperature Two-Dimensional Non Chemical Equilibrium Modeling of Ar–CO2–H2 Induction Thermal Plasmas at Atmospheric Pressure. Plasma Chemistry and Plasma Processing 30, 141–172.
Baulch, D.L., Bowman, C.T., Cobos, C.J., Cox, R.A., Just, Th., Kerr, J.A., … Warnatz, J. (2005). Evaluated Kinetic Data for Combustion Modeling: Supplement II. Journal of
Physical and Chemical Reference Data 34 (3), 905-912 .
Canady, J., Wiley, K., Ravo, B. (2006). Argon Plasma Coagulation and the Future Applications for Dual-Mode Endoscopic Probes. Reviews In Gastroenterological Disorders 6 (1), 1-12.
Cohen, N. and Westberg, K. (1983). Chemical Kinetic Data Sheets for High Temperature Chemical Reactions. Journal of Physical and Chemical Reference Data 12 (3), 559-562. Ehlbeck, J., Schnabel, U., Polak, M., Winter, J., Woedtke, T.V., Brandenburg, R., …, Weltmann, K.D. (2011). Low Temperature Atmospheric Pressure Plasma Sources for Microbial Decontamination. Journal of Physics D : Applied Physics 44 (1), 3002.
Heinlin, J., Morfill, G., Landthaler, M., Stolz, W., Isbary, G., Zimmermann, J.L., … Karrer, S. (2010). Plasma Medicine: Possible Applications In Dermatology. Journal der
Deutschen Dermatologischen Gesellschaft 8 (12), 968–976.
Ismail, F.D., Saktioto, T., Fadhali, M., Yupapin, P.P., Qindeel, R, Ali, J. (2011). Thermodynamic Equilibrium of Nitrogen Species Discharge: Comparison with Global Model. Optik - International Journal for Light and Electron Optics 122 (5), 455–458.
11
Kalghatgi, S.U., Fridman, G., Cooper, M., Nagaraj, G., Peddinghaus, M., Balasubramanian, M., … Friedman, G. (2007). Mechanism of Blood Coagulation by Nonthermal
Atmospheric Pressure Dielectric Barrier Discharge Plasma. IEEE Transactions on
Plasma Science 35 (5), 1559-1566.
Kimurai, T. and Kasugai H. (2010). Properties of inductively coupled rf Ar/H2 plasmas: Experiment and global model. Journal of Applied Physics 107 (8), 083308.
Krall, A.N. and Trivelpiece, A.W. (1973). Principles of Plasma Physics. New York: McGraw-Hill, Inc.
Laroussi, Mounir. (2009). Low-Temperature Plasmas for Medicine? IEEE Transactions On
Plasma Science 37 (6), 714-725.
Lee, J.K., Kim, M.S., Byun, J.H., Kim, K.T., Kim, G.C., Park, G.Y. (2011). Biomedical Applications of Low Temperature Atmospheric Pressure Plasmas to Cancerous Cell Treatment and Tooth Bleaching. Japanese Journal of Applied Physics 50, 08JF01. Lloyd, G., Friedman, G., Jafri, S., Schultz, G., Fridman, A., Harding, K. (2010). Gas Plasma:
Medical Uses and Developments in Wound Care. Plasma Processes and Polymers 7, 194-211.
McCay, T.D. and Dexter, C.E. (1987). Chemical Kinetic Performance Losses for a Hydrogen Laser Thermal Thruster. J. Spacecraft 24 (4).
Morfill, G.E., Shimizu, T., Steffes, B., Schmidt, H.U. (2009). Nosocomial infections—a new approach towards preventive medicine using plasmas. New Journal of Physics 11,115019.
Nojima, H., Park, R.E., Kwon, J.H., Suh, I., Jeon, J., Ha, E., … Takiyama, K. (2007). Novel Atmospheric Pressure Plasma Device Releasing Atomic Hydrogen: Reduction Of Microbial-Contaminants And OH Radicals in The Air. Journal of Physics D : Applied
Physics 40, 501–509.
Rhodes, R. and Keefer, D. (1993). Non-Equilibrium Modeling Of Hydrogen Arcjet Thrusters.
International Electric Propulsion Conference (IEPC) 1993-217, 3, 2020.
Saktioto. (2000). Studies of Atmospheric Pressure Plasma Sources (Thesis). University of Manchester, Manchester.
Tanaka, Y. (2009). Thermally and chemically non-equilibrium modelling of Ar-N2-H2 inductively coupled plasmas at reduced pressure. Thin Solid Films 518 (3), 936–942. Watanabe, T., Atsuchi, N., Shigeta, M. (2006). Two-Temperature Chemically Non-Equilibrium
Modeling of Argon Induction Plasmas with Diatomic Gas. International Journal of
Heat and Mass Transfer 49, 4867-4876.
Weltmann, K.D., Woedtke, T.V., Brandenburg, R., Ehlbeck, J. (2008). Biomedical Applications of Atmospheric Pressure Plasma. Chemicke Listy 102, s1450−s1451.
Westley, Francis. (1980). Table of Recommended Rate Constants for Chemical Reactions
occurring in Combustion. Washington D.C. : United States National Standard
Reference Data Series-National Bureau of Standards.
Yu, L., Pierrot, L., Laux, C.O., Kruger, C.H. (2001). Effects of Vibrational Nonequilibrium on The Chemistry of Two-Temperature Nitrogen Plasmas. Plasma Chemistry and Plasma