commit to user
i
INDUKSI TUNAS JERUK PAMELO (
Citrus maxima
Merr.) KULTIVAR BAGENG SECARA
INVITRO
DENGAN PEMBERIAN JENIS DAN KONSENTRASI
SITOKININ
Tesis
Untuk Memenuhi Sebagian Persyaratan Mencapai Derajat Magister
OLEH
SUHARIJANTO
S.610908008
PROGRAM STUDI AGRONOMI FAKULTAS PASCA SARJANA UNIVERSITAS SEBELAS MARET
commit to user
ii
INDUKSI TUNAS JERUK PAMELO (
Citrus maxima
Merr.) KULTIVAR BAGENG SECARA
INVITRO
DENGAN PEMBERIAN JENIS DAN KONSENTRASI
SITOKININ
Disusun oleh:
SUHARIJANTO S.610908008
Telah disetujui oleh Tim Pembimbing
Susunan Tim Pembimbig
Jabatan Nama Tandatangan Tanggal
Pembimbing Utama
Dr. Ir. Endang Yuniastuti, Msi. NIP. 197006091994022001
Pembimbing Pendamping
Prof. Dr. Ir. Nandariyah, MS NIP. 19540805 198103 2 002
Mengetahui
Ketua Program Studi Agronomi
commit to user
iii
INDUKSI TUNAS JERUK PAMELO (
Citrus maxima
Merr.) KULTIVAR BAGENG SECARA
INVITRO
DENGAN PEMBERIAN JENIS DAN KONSENTRASI
SITOKININ
Disusun oleh :
SUHARIJANTO S.610908008
Telah disetujui oleh Tim Penguji :
Jabatan Nama Tanda
Tangan Tanggal
Ketua Prof. Dr. Ir. Supriyono, MS NIP. 19590711 1984031002
Sekretaris Dr. Ir. Supriyadi, MS NIP. 196203231988031001
Anggota Penguji
Dr. Ir. Endang Yuniastuti, M.Si NIP: 197006091994022001
Prof. Dr. Ir. Nandariyah, MS NIP. 19540805 198103 2 002
Mengetahui,
Direktur Program Pasca Sarjana, Ketua Program Studi Agronomi
commit to user
iv
PERNYATAAN
Yang bertanda tangan dibawah ini, saya:
Nama : SUHARIJANTO
NIM : S.610908009
Menyatakan dengan sesungguhnya bahwa tesis yang berjudul “Induksi Tunas Jeruk Pamelo (Citrus Maxima Merr.) Kultivar Bageng Secara Invitro Dengan Pemberian Jenis Dan Konsentrasi Sitokinin”.adalah betul-betul karya saya sendiri. Hal-hal yang bukan karya saya dalam tesis ini diberi tanda sitasi dan ditunjukkan dalam daftar pustaka.
Apabila dikemudian hari terbukti saya tidak benar, maka saya bersedia menerima sanksi akademik berupa pencabutan tesis dan gelar yang saya peroleh dari tesis tersebut.
Surakarta, 3 Januari 2011 Yang membuat pernyataan,
commit to user
v
MOTTO DAN PERSEMBAHAN
Motto :
“Hidup adalah perjuangan”
Persembahan :
Kupersembahkan untuk:
- Isteriku tercinta Farikha Budiastuti, anak-anakku terkasih Hamida Parimita, Rakryanto Priyahita.
commit to user
vi
KATA PENGANTAR
Puji syukur penulis panjatkan kehadirat Allah SWT. Atas tersusunnya tesis
berjudul Induksi Tunas Jeruk Pamelo (Citrus Maxima Merr.) Kultivar Bageng Secara
Invitro Dengan Pemberian Jenis Dan Konsentrasi Sitokinin.
Pada kesempatan ini penulis menyampaikan terimakasih kepada:
1. Ir. Hadi Supriyo, MS, selaku Dekan Fakultas Pertanian UMK.
2. Prof. Dr. dr. Sarjadi, SpPA, selaku Rektor UMK
3. Prof. Drs. Suranto, M.Sc, Ph.D, selaku Direktur Program Pasca Sarjana UNS.
4. Prof. Dr. Ir. Supriyono, MS, selaku Ketua Pengelola Pascasarjana Jurusan
Agronomi.
5. Ibu Dr. Ir. Endang Yuniastuti, MS. selaku pembimbing utama
6. Ibu Prof. Dr. Ir. Nandariyah, selaku pembimbing pendamping
Penulis menyadari bahwa tesis ini masih jauh dari sempurna dan oleh karena itu
kritik dan saran yang bersifat membangun sangat penulis harapkan guna perbaikan dan
penyempurnaan tesis ini.
Surakarta, 3 Januari 2011
commit to user
vii DAFTAR ISI
KATA PENGANTAR ... vi
DAFTAR ISI ... vii
DAFTAR TABEL ... ix
DAFTAR GAMBAR... x
DAFTAR LAMPIRAN ... xi
ABSTRAK ... xii
ABSTRACT ... xiii
I. PENDAHULUAN... 1
A. Latar Belakang... 1
B. Perumusan Masalah ... 2
C. Tujuan Penelitian ... 3
D. Manfaat Penelitian ... 3
II. KAJIAN PUSTAKA ... 4
A. Tinjauan Pustaka ... 4
1) Tanaman Jeruk Pamelo (Citrus maxima Merr.)... 4
2) Kultur jaringan ... 6
3) Zat Pengatur Tumbuh Sitokinin ... 8
4) Pengaruh Sitokinin ... 10
B. Kerangka Berfikir ... 12
C. Hipotesis ... 13
III. BAHAN DAN METODE... 14
A. Tempat Dan Waktu Penelitian... 14
B. Bahan dan Alat Penelitian ... 14
commit to user
viii
D. Pelaksanaan Penelitian ... 15
E. Variabel Penelitian ... 15
F. Analisis Statistik ... 15
IV. HASIL DAN PEMBAHASAN ... 17
A. Kalus ... 21
B. Tunas ... 24
V. KESIMPULAN DAN SARAN ... 28
A. Kesimpulan ... 28
B. Saran ... 28
commit to user
ix
DAFTAR TABEL
Tabel Halaman
Tabel 1. Jumlah Eksplan Bertunas, Berkalus, Tidak Berkembang (Stagnasi)
commit to user
x
DAFTAR GAMBAR
Gambar Halaman
Gambar 1. Diagram Bagan Alir Kerangka Berpikir 13
Gambar 2 . Tunas yang Sedang Aktif Tumbuh Digunakan Sebagai Eksplan 14
Gambar 3. Eksplan Terkontaminasi (A) Cendawan (B) Bakteri 17
Gambar 4. Eksplan (A) Mati, warna mencoklat (B) Stagnasi (Bertahan Hidup Tetapi
Tidak Ada Gejala Tumbuh) 19
Gambar 5. Pola Perubahan Jumlah Eksplan Bertunas, Berkalus, Tidak Berkembang (Stagnasi) dan Coklat (Mati), Selama Masa Percobaan Berlangsung 20
Gambar 6. Letak Terbentuknya Kalus Ditunjukkan oleh Anak Panah 21
Gambar 7. Pengaruh Konsentrasi BA dan Kn Terhadap Persentase Eksplan yang
Membentuk Kalus 22
Gambar 8. Kemunculan Kalus Karena Pengaruh (A) Kinetin 1mg/l, (B) Kinetin 2mg/l, (C) Kinetin 3mg/l, (D) BA 1mg/l ,(E) BA 2mg/l ,(F) BA 3mg/l 23
Gambar 9. Perubahan Warna Kalus (A) Bagian Kalus Hidup Berwarna Putih, (B) Kalus
Mati Berwarna Coklat 24
Gambar 10. Induksi tunas akibat (A) BA 1mg/l, (B) 2mg/l dan (C) 3mg/l pada Media
commit to user
xi
DAFTAR LAMPIRAN
Lampiran Halaman
commit to user
xii
INDUKSI TUNAS JERUK PAMELO (
Citrus maxima
Merr.)
KULTIVAR BAGENG SECARA
INVITRO
DENGAN
PEMBERIAN JENIS DAN KONSENTRASI SITOKININ
SUHARIJANTO
S.610908008
ABSTRAK
Pamelo (Citrus maxima Merr.) kultivar Bageng merupakan salah satu jeruk besar yang berpotensi ekonomi tinggi. Pamelo Bageng tidak menghasilkan biji sehingga perbanyakan tanaman dilakukan secara vegetatif (cangkok dan sambung), sehingga perlu dilakukan penelitian terhadap tanaman ini guna mendapatkan metode perbanyakan tanaman yang efektif untuk mendukung perbanyakan tanaman tersebut. Penelitian bertujuan untuk mengetahui respon induksi tunas jeruk pamelo (Citrus maxima) bageng akibat pemberian jenis dan konsentrasi sitokinin, secara in vitro.
Penelitian dilaksanakan di Laboratorium Kultur Jaringan Fakultas Pertanian Universitas Muria Kudus, pada bulan Januari sampai Juni 2010.
Eksplan berupa nodia yang diambil dari lapangan. Eksplan dipelihara pada medium padat MS dengan penambahan sitokinin berupa Benzyladenin (BA)(1 mg/l, 2 mg/l, 3 mg/l) dan Kinetin (1 mg/l, 2 mg/l, 3 mg/l). Parameter yang diamati meliputi saat muncul kalus, warna dan tekstur kalus, persentase eksplan yang membentuk kalus, saat terbentuk tunas, persentase eksplan yang membentuk tunas dan jumlah tunas per eksplan.
Hasil penelitian menunjukkan bahwa sebagian besar eksplan menghasilkan kalus . Kalus muncul mulai hari keempat setelah tanam. Secara visual ukuran, warna dan tekstur kalus pada setiap eksplan tidak terdapat perbedaan. Media MS dengan BA menghasilkan persentase eksplan berkalus lebih banyak dibanding MS + kinetin. Dari 137 botol eksplan yang tidak terkontaminasi, hanya 7 botol yang membentuk tunas yaitu pada media MS + BA 1 mg/l (2botol), MS + BA 2 mg/l (4 botol), dan MS + BA 3mg/l (1 botol). Setiap eksplan hanya menghasilkan satu tunas (tidak terjadi multiplikasi). Media MS + Kinetin tidak membentuk tunas.
commit to user
xiii
IN VITRO SHOOTS INDUCTION OF BAGENG PUMMELO
CULTIVAR (
Citrus maxima
Merr.) BY TYPE AND
CONCENTRATION OF CYTOKININ
SUHARIJANTO
S.610908008
ABSTRACT
Bageng Pummelo (Citrus maxima Merr..) is one of the big orange with high economic potential. Bageng Pummelo not produce seeds that carried through vegetative propagation (grafting), so need to do research on this plant in order to obtain an effective plant propagation methods to support the propagation of these plants. This research aims to study the response of shoots induction Bageng Pummelo as result of the type and concentration of cytokines, by in vitro method. The experiment was conducted at Tissue Culture Laboratory of Agricultural Faculty of Muria Kudus University, in January to June 2010.
Methods of research used was single factor experiment, arranged in Complete Random Design (CRD). Explants taken from the field. Explants maintained on MS agar medium with cytokines such Benzyladenin (BA)(1 mg / l, 2 mg / l, 3 mg / l) and Kinetin (1 mg / l, 2 mg / l, 3 mg / l). The parameters observed included time appeared callus, color and texture of callus, the percentage of explants that formed callus, formed shoots time, the percentage of explants that formed shoots and number of shoots per explant.
Result of research showed that most of the explants produced callus. Callus appeared in fourth day after planting. There is no difference in size, color and texture in each explant callus, visually. MS medium with BA produced a percentage of explants that produced callus more than MS + kinetin. Of 137 bottles uncontaminated explants, only 7 bottles that produced shoots on MS medium ie MS+ BA 1 mg / l (2 bottle ), MS + BA 2 mg / l (4 bottles), and MS + BA 3mg / l (1 bottle .) Each explant produced only one shoot (no multiplication). Media MS + Kinetin did not produced shoots.
commit to user
1
I. PENDAHULUAN
A. Latar Belakang
Jeruk pamelo merupakan salah satu jenis buah-buahan yang sudah dikenal sejak
lama di Indonesia. Beberapa ahli menduga bahwa tanaman jeruk pamelo merupakan salah
satu jenis tanaman asli Indonesia. Kebutuhan akan buah jeruk pamelo meningkat dari
tahun ke tahun bersamaan meningkatnya permintaan pasar baik dalam maupun luar negeri.
Meningkatnya pendapatan perkapita dan kesadaran orang akan kebutuhan sebagai sumber
gizi menyebabkan meningkatnya permintaan pasar akan kebutuhan buah-buahan.
Populasi tanaman jeruk pamelo di Indonesia tersebar secara luas di seluruh pelosok
nusantara. Di Indonesia varietas jeruk pamelo ada beberapa macam diantaranya Adas
Duku, Bali Merah, Bali Putih, Nambangan, Srinyonya, dan beberapa jenis lokal lainnya.
Di Kabupaten Pati terdapat satu jenis jeruk pamelo dan sedang dikembangkan oleh
pemerintah daerah Pati, yaitu jeruk pamelo Bageng. Jenis jeruk ini telah didaftarkan di
Perlindungan Varietas Tanaman (PVT) dan sudah dikaji oleh Tim Penilai Pelepas Varietas
Tanaman pada tanggal 2 Juli 2009 untuk direkomendasikan sebagai varietas unggul
nasional. Tanggal 10 Februari 2010 pamelo Bageng ditetapkan sebagai varietas unggul
nasional.
Menurut Kompas (2009) permintaan jeruk pamelo Bageng terus meningkat meski
harganya lebih mahal (karena unggulnya), sehingga produksi belum mencukupi kebutuhan
konsumsi. Dengan meningkatnya permintaan pasar pada komoditas buah-buahan, buah
jeruk Bageng yang memiliki rasa khas banyak diminati masyarakat. Rasa daging buah
manis tanpa getir sedikitpun meski buah belum matang, dengan kandungan air tinggi
membuat jeruk Bageng terasa segar saat dikonsumsi.
Jeruk Bageng tidak berbiji dan oleh karenanya, berdasarkan hasil pengamatan di
lapangan, selama ini petani memperoleh bibit jeruk pamelo dalam bentuk okulasi antara
jeruk Karag sebagai batang bawah dan jeruk pamelo Bageng sebagai batang atas, atau
pencangkokan. Jumlah pohon induk yang terbatas menyebabkan hasil perbanyakan tidak
banyak. Teknik cangkok menyebabkan tajuk pohon induk rusak dan memerlukan waktu
lama.
Sementara untuk pengembangannya, diperlukan jumlah bibit banyak dalam waktu
commit to user
2
dalam jumlah yang besar dan waktu yang singkat. Menurut Suryowinoto (1996) salah satu
alternatif pemecahan masalah yaitu melalui teknik kultur jaringan atau teknik invitro. Dalam budidaya tanaman dengan menggunakan teknik invitro, pemberian zat pengatur tumbuh dalam media tanam dan pemilihan eksplan sebagai bahan inokulum
awal yang ditanam dalam media perlu diperhatikan karena mempengaruhi pertumbuhan
dan perkembangan eksplan tersebut menjadi bibit yang baru. Zat pengatur tumbuh yang
sering diberikan adalah auksin dan sitokinin.
Sitokinin adalah zat pengatur tumbuh yang berperan dalam mengatur pembelahan
sel serta mempengaruhi diferensiasi tunas pada jaringan kalus. Menurut Mariska et al., (1987) Benzyl Adenine (BA) merupakan zat pengatur tumbuh sintetik yang daya
rangsangnya lebih lama dan tidak mudah dirombak oleh sistem enzim dalam tanaman. BA
dapat merangsang pembentukan akar dan pembentukan tunas.
Pemakaian sitokinin dalam perbanyakan jeruk secara in vitro telah dilakukan oleh Tao et al. (2004) pada jeruk pamelo dengan eksplan daun yang mendapatkan bahwa BA konsentrasi 0.89 µM menghasilkan jumlah tunas terbanyak (5-7 tunas); Mukhtar et al.
(2005) pada Citrus reticulata mendapatkan 1 mg/l BAP dan 1.5 mg/l kinetin menghasilkan persentase tunas tertinggi.
Belum ada informasi tentang perbanyakan secara in vitro pada jeruk Bageng. Oleh karena itu penelitian in vitro terhadap jeruk pamelo Bageng perlu dilakukan mengingat kebutuhan bibit berkualitas terus meningkat dan harus dipenuhi, tanpa harus merusak
tanaman induk oleh karena metoda perbanyakan okulasi dan cangkok.
B. Perumusan Masalah
Jeruk Bageng banyak diminati konsumen sehingga pasokan tidak mencukupi
kebutuhan. Teknik perbanyakan jeruk Bageng masih menggunakan cara okulasi dan
cangkok. Cara ini menghasilkan jumlah bibit sedikit dan merusak tanaman induk yang
jumlahnya terbatas. Untuk mendapatkan jumlah bibit banyak dengan kualitas baik dalam
waktu singkat dapat ditempuh dengan teknik kultur jaringan. Sementara belum ada
informasi mengenai aplikasi teknik kultur jaringan pada jeruk Bageng.
Permasalahan yang dipelajari dalam penelitian ini adalah pengaruh konsentrasi zat
pengatur tumbuh sitokinin (BA dan Kinetin) dalam perbanyakan tunas jeruk Bageng
commit to user
3
C. Tujuan Penelitian
Tujuan penelitian untuk mengetahui respon induksi tunas jeruk pamelo (Citrus maxima Merr.) varietas Bageng akibat pemberian jenis dan konsentrasi sitokinin, secara
invitro.
D. Manfaat Penelitian
Penelitian ini diharapkan dapat menyumbangkan pengetahuan tentang teknik
perbanyakan tanaman jeruk Bageng secara in vitro yang kemudian dapat dimanfaatkan oleh pemerintah Kabupaten Pati untuk mempercepat penyediaan bibit dalam rangka
commit to user
terbesar. Nama pamelo disarankan oleh Kementerian Pertanian karena jeruk ini
tidak ada kaitannya dengan Bali.
Jeruk ini termasuk jenis yang mampu beradaptasi dengan baik pada daerah
kering dan relatif tahan penyakit, terutama Citrus Virus Phloem Degeneration
(CVPD) yang pernah menghancurkan pertanaman jeruk di Indonesia.
Beberapa kultivar unggulan Indonesia: Nambangan, Srinyonya, Magetan,
Bageng (tanpa biji). Tiga kultivar yang pertama ditanam di sentra produksi jeruk
pamelo di daerah Kabupaten Magetan dan Kabupaten Madiun, sedangkan yang
terakhir ditanam di daerah Bageng, Kabupaten Pati.
Klasifikasi jeruk pamelo sebagai berikut:
Kingdom : Plantae (Tumbuhan)
Subkingdom : Tracheobionta (Tumbuhan berpembuluh)
Super Divisi : Spermatophyta (Menghasilkan biji)
Divisi : Magnoliophyta (Tumbuhan berbunga)
Kelas : Magnoliopsida (berkeping dua / dikotil)
Sub Kelas : Rosidae
Ordo : Sapindales
Famili : Rutaceae (suku jeruk-jerukan)
Genus : Citrus
Spesies : Citrus maxima Merr.
Buahnya berbentuk bulat dengan bagian atas agak meruncing dan bagian
bawah mendatar. Ukuran buahnya tidak begitu besar dibanding jeruk pamelo
lainnya. Kulit buah bagian luar berwarna hijau saat muda dan setelah tua berubah
menjadi kekuning-kuningan. Keadaan kulitnya lebih tipis dibanding jeruk lainnya.
Daging buah berwarna merah muda dengan rasa manis, teksturnya halus, dan
berair banyak. Daging buah sangat rapat satu dengan lainnya. Jumlah biji sedikit,
commit to user
5
pohon agak rendah dan melebar dengan percabangan tidak teratur. Ujung
percabangan biasanya merunduk. Garis tengah batang antara 10-30 cm (Christman,
2008). Kulit batang agak tebal dan berwarna cokelat kekuningan. Seperti spesies
jeruk lainnya, cabang dan ranting jeruk pamelo pun bersudut saat masih muda dan
membulat saat tua. Keadaan batangnya ada yang berduri dan ada yang tidak
berduri. Namun, biasanya duri tersebut ada pada tanaman yang berasal biji dan
masih muda. Setelah dewasa duri-duri tersebut biasanya hilang. Daun tanaman ini
berwarna hijau kuning agak suram dan berbulu. Akan tetapi, daun yang masih
muda kebanyakan tidak berbulu. Bentuk daun bulat telur dengan ujung tumpul dan
letaknya terpencar-pencar. Tepi daun agak rata, tetapi dekat ujung agak berombak.
Tangkai daun bersayap lebar berwarna hijau kekuningan. Bunga jeruk pamelo
berupa bunga majemuk atau bunga tunggal yang bertandan. Bentuknya agak besar
dan berbau harum. Kelopak bunga membentuk lonceng dengan tajuk berjumlah
4-5. Benangsari tegak, jumlahnya 25-34-5. Bakal buah berbentuk bulat kerucut dengan
jumlah biasanya dua buah (Manner et al., 2006).
Daging buah jeruk pamelo yang segar banyak mengandung air dapat
dikonsumsi langsung setelah dikupas dengan tangan atau dicampur dalam rujak.
Bagian dalam kulit buah yang berwarna putih dapat dijadikan manisan setelah
dibuang bagian kulit luarnya yang banyak mengandung kelenjar minyak. Di
Vietnam, bunga digunakan untuk membuat parfum. Kayu dimanfaatkan untuk
gagang perkakas. Pohon jeruk pamelo yang kualitas buahnya rendah pun masih
tetap dipelihara untuk dimanfaatkan daun, bunga, buah, dan bijinya untuk obat
batuk, demam, dan gangguan pencernaan (Manner, 2006).
Jeruk dapat tumbuh di sembarang tempat. Namun, tanaman ini akan
memberikan hasil optimum bila ditanam di lokasi yang sesuai. Ketinggian tempat
yang sesuai untuk tanaman ini yaitu dataran rendah sampai 700 m di atas
permukaan laut. Sedangkan yang ditanam di atas ketinggian tersebut rasa buahnya
lebih asam. Suhu optimum yang dibutuhkan untuk pertumbuhannya berkisar antara
25-30° C. Sedangkan sinar matahari harus penuh agar produksi optimum. Tanah
yang disukai tanaman jeruk ialah tanah gembur, porous, dan subur. Kedalaman
permukaan air tanah tidak lebih dari 1,5 m pada musim kemarau dan tidak boleh
kurang dari 0,5 m pada musim hujan. Tanah tidak boleh tergenang air karena akar
commit to user
6
Curah hujan berkisar antara 1.000-1.200 mm per tahun dengan kelembapan udara
50-85% (Christman, 2008).
Secara tradisonal, perbanyakan jeruk dilakukan dengan biji, sambung
(okulasi) atau dengan pencangkokan. Teknik ini mempunyai kelemahan jika
dibandingkan dengan teknik kultur jaringan.
2) Kultur jaringan
Kultur jaringan atau budidaya in vitro adalah suatu metode untuk mengisolasi bagian dari tanaman seperti protoplasma, sel, jaringan atau organ yang
serba steril, ditumbuhkan pada media buatan yang steril, dalam botol kultur yang
steril dan dalam kondisi yang aseptik, sehingga bagian-bagian tersebut dapat
memperbayak diri dan beregenerasi menjadi tanaman yang lengkap.
Landasan kultur jaringan didasarkan atas tiga kemampuan dasar dari
tanaman (George, 1993), yaitu:
1. Totipotensi, yaitu potensi atau kemampuan dari sebuah sel untuk tumbuh dan
berkembang menjadi tanaman secara utuh jika distimulasi dengar benar dan
sesuai. Implikasi dari totipotensi adalah bahwa semua informasi tentang
pertumbuhan dan perkembangan suatu organisme terdapat di dalam sel.
Walaupun secara teoritis seluruh sel bersifat totipotensi, tetapi yang
mengekspresikan keberhasilan terbaik adalah sel yang meristematik.
2. Dediferensiasi, yaitu kemampuan sel-sel dewasa (mature) kembali menjadi ke kondisi meristematik dan berkembang dari satu titik pertumbuhan baru yang
diikuti oleh rediferensiasi yang mampu melakukan reorganisasi manjadi organ
baru.
3. Kompetensi menggambarkan potensi endogen dari sel atau jaringan untuk
tumbuh dan berkembang dalam satu jalur tertentu. Contohnya embrioagenicali competen cel adalah kemampuan untuk berkembang menjadi embrio funsional penuh. Sebaliknya adalah non-kompeten atau morfogeneticali tidak mempunyai kemampuan.
Dalam pelaksanaannya dijumpai beberapa tipe-tipe kultur (Gunawan,
1995), yakni:
commit to user
7
2. Kultur organ (organ culture), merupakan budidaya yang bahan tanamnya menggunakan organ, seperti: ujung akar, pucuk aksilar, tangkai daun,
helaian daun, bunga, buah muda, inflorescentia, buku batang, akar dll.
3. Kultur kalus (callus culture), merupakan kultur yang menggunakan jaringan (sekumpulan sel) biasanya berupa jaringan parenkim sebagai bahan
eksplannya.
4. Kultur suspensi sel (suspension culture) adalah kultur yang menggunakan media cair dengan pengocokan yang terus menerus menggunakan shaker dan
menggunakan sel atau agregat sel sebagai bahan eksplannya, biasanya
eksplan yang digunakan berupa kalus atau jaringan meristem.
5. Kultur protoplasma. Eksplan yang digunakan adalah sel yang telah dilepas
bagian dinding selnya menggunakan bantuan enzim. Protoplas diletakkan
pada media padat dibiarkan agar membelah diri dan membentuk dinding
selnya kembali. Kultur protoplas biasanya untuk keperluan hibridisasi
somatik atau fusi sel soma (fusi dua protoplas baik intraspesifik maupun
interspesifik).
6. Kultur haploid adalah kultur yang berasal dari bagian reproduktif tanaman,
yakni: kepalasari/ anther (kultur anther/kultur mikrospora), tepungsari/
pollen (kutur pollen), ovule (kultur ovule), sehingga dapat dihasilkan tanaman haploid.
Media sebagai tempat tumbuh eksplan memegang peranan penting karena
fungsinya menyediakan hara makro dan mikro. Kedalam media juga ditambahkan
sumber energi, zat pengatur tumbuh dan lainnya yang dapat mendukung
pertumbuhan eksplan (George, 1993). Banyak ragam komposisi media, tetapi yang
sering digunakan adalah Murashige and Skoog (MS). Media ini kini telah banyak
dimodifikasi oleh para pengguna, misalnya yang disebut sebagai media setengah
MS yang mengandung setengah bagian unsur makro (dari yang seharusnya/dasar)
dan satu bagian unsur mikro.
Pada penelitian kultur jaringan jeruk, media MS digunakan oleh Paudyal
dan Haq (2000), Mukhtar et al. (2005), dan media setengah MS digunakan oleh Bhalla et al. (2009).
Dalam perbanyakan tanaman secara kultur jaringan eksplan merupakan
commit to user
8
pemilihan sebagai bahan kultur adalah jenis tanaman, bagian tanaman yang
digunakan, morfologi permukaan, lingkungan tumbuhnya, kondisi tanaman, dan
musim waktu mengambilnya. Umumnya bagian tanaman yang digunakan sebagai
eksplan adalah jaringan muda yang sedang aktif karena mempunyai regenerasi
yang tinggi.
Penggunaan eksplan dari jaringan muda lebih sering berhasil karena
sel-selnya aktif membelah, dinding sel tipis karena belum terjadi penebalan lignin dan
selulose yang menyebabkan kekakuan pada sel. Gunawan (1995) menyatakan
bagian tanaman yang dapat digunakan sebagai eksplan adalah : pucuk muda,
batang muda, daun muda, kotiledon, hipokotil. Menurut Wattimena (1992)
perbedaan dari bagian tanaman yang digunakan akan menghasilkan pola
pertumbuhan yang berbeda. Eksplan tanaman yang masih muda menghasilkan
tunas maupun akar adventif lebih cepat bila dibandingkan dengan eksplan tanaman
yang sudah tua.
Ali dan Mirza (2006) meneliti berbagai tipe eksplan Citrus jambhiri Lush., yaitu batang, akar, daun dan kotiledon. Eksplan batang menghasilkan persentase
tertinggi dalam menghasilkan kalus jika dibanding lainnya. Dari kalus tersebut
ditumbuhkan tunas dan kemudian akar, dan eksplan batang menghasilkan tunas
dan akar terbanyak.
3) Zat Pengatur Tumbuh Sitokinin
Zat pengatur tumbuh pada tanaman adalah senyawa organik yang bukan
hara yang dalam jumlah sedikit dapat mendukung (promote), menghambat dan merubah proses fisiologi tumbuhan. Dalam kultur jaringan, ada dua golongan zat
pengatur tumbuh yang sangat penting adalah auksin dan sitokinin. Auksin dan
sitokinin mempengaruhi pertumbuhan dan morfogenesis dalam kultur sel,
jaringan dan organ. Interaksi dan perimbangan antara zat pengatur tumbuh yang
diberikan dalam media dan yang diproduksi oleh sel secara endogen, menentukan
arah perkembangan suatu kultur. Penambahan auksin atau sitokinin eksogen,
mengubah level zat pengatur tumbuh endogen sel. Level zat pengatur tumbuh
endogen ini kemudian merupakan trigerring factor untuk proses-proses yang tumbuh dan morfogenesis (Abidin, 1995).
Golongan sitokinin adalah turunan dari adenine (Wikipedia, 2009).
commit to user
9
Sitokinin ada yang alamiah dan sintetis. Sitokinin yang pertama ditemukan, adalah
kinetin yang diisolasi oleh Skoog dalam laboratorium Botany di University of
Wisconsin. Kinetin diperoleh dari DNA ikan Herring yang diautoklaf dalam
larutan yang asam. Persenyawaan dari DNA tersebut sewaktu ditambahkan ke
dalam media untuk tembakau, ternyata merangsang pembelahan sel dan
differensiasi sel. Persenyawaan tersebut kemudian dinamakan kinetin. Fungsi
sitokinin terhadap tanaman antara lain adalah:
1. Memacu terbentuknya organogenesis.
2. Memacu terjadinya pembelahan sel.
3. Kombinasi antara auxin dan sitokinin akan memacu pertumbuhan kalus.
Sitokinin adalah kelompok zat pengatur tumbuh yang merangsang
pembelahan sel. Mereka utamanya terlibat dalam pertumbuhan sel, diferensiasi
dan proses-proses fisiologis lainnya. Ada dua tipe sitokiin, yaitu tipe adenin yang
direpresentasikan oleh kinetin, zeatin, dan 6-benzylaminopurin (BAP), dan tipe
diphenylurea atau thidiazuron (TDZ). Biosintesa Sitokinin tipe adenin terdapat di batang, daun dan akar dimana terdapat kambium atau jaringan yang aktif
membelah. Belum ada bukti TDZ dibentuk secara alami. Sitokinin terlibat dalam
signalling lokal ataupun jauh pada mekanisme transpor purin dan nukleotida
(Wikipedia, 2009).
Sitokinin terlibat dalam banyak proses, meliputi pembelahan sel,
pembentukan tunas dan akar, pematangan khloroplas, pembesaran sel,
pemunculan dan penuaan tunas ketiak daun. Rasio auksin terhadap sitokinin
penting selama pembelahan sel dan diferensiasi jaringan-jaringan tanaman.
Kelompok hormon ini secara khusus menginduksi transisi dari pertumbuhan
apikal ke pertumbuhan melalui sebuah sel apikal dalam moss protonema. Induksi
tunas ini dapat mengarah ke diferensiasi sel tunggal khusus, dan ini merupakan
efek khusus dari sitokinin (Wikipedia, 2009).
Kinetin (Kn) adalah salah satu macam sitokinin. Diberi nama kinetin
karena kemampuannya menginduksi pembelahan sel. Kinetin sering digunakan
pada kultur jaringan tanaman untuk menginduksi pembentukan kalus
(bekerjasama dengan auksin) dan untuk meregenerasi jaringan pucuk dari kalus
(dengan konsentrasi auksin rendah). Kinetin dapat dibuat secara artifisial. Kinetin
commit to user
10
berbagai tanaman. Sejak 1994 kinetin secara luas diuji pengaruhnya untuk anti
penuaan kulit manusia. Dan sekarang kinetin digunakan secara luas sebagai
komponen berbagai kosmetik pemeliharaa kulit (Wikipedia, 2009).
6-Benzylaminopurine (C12H11N5 ) atau BAP atau Benzyladenin (BA) merupakan generasi pertama sitokinin sintetis yang mempengaruhi respon
pertumbuhan dan perkembangan tanaman, pembentukan bunga dan merangsang
jumlah buah dengan cara merangsang pembelahan sel. Hormon ini merupakan
penghambat respiratory kinase dalam tanaman, dan meningkatkan hasil panen sayuran hijau (Wikipedia, 2009).
4) Pengaruh Sitokinin
Tao et al. (2004) meneliti pengaruh zat pengatur tumbuh dan macam eksplan terhadap regenerasi tanaman Citrus maxima. Eksplan daun dengan 2,4-D memunculkan kalus. Dari kalus yang muncul, kalus yang berwarna hijau yang
dapat membentuk tunas (lebih dari 13 tunas per kalus), setelah diberi BA dengan
konsentrasi 6.66 µM. Eksplan pucuk langsung menghasilkan tunas sebanyak 5-7
tunas pada media dengan BA 0.89 M, dan akar muncul setelah tunas tunas ditanam
pada media mengandung 9.84 µM IBA. Akar juga muncul dari tunas
padaperlakuan NAA 5.37 µM.
Penelitian untuk mengeksplor tipe eksplan dari lapang, ZPT dan
penambahan organik pada proses regenerasi jeruk Kinow (Citrus reticulata) oleh Mukhtar et al. (2005) menggunakan Media MS ditambah (0.25, 0.5, 1.0, dan 2 mg/l) BAP; kinetin (0.5, 1.0, 1.5, 2.0 mg/l) untuk menghasilkan tunas-tunas baru.
Setelah muncul tunas kecil, tunas dipisah satu persatu dan dikultur pada media
MS yang mengandung (1.0, 1.5, 2.0 mg/l) NAA untuk inisiasi akar. Persentase
keberhasilan: Eksplan pucuk pada media MS dengan 1 mg/l BAP dan 1.5 mg/l
kinetin menghasilkan persentase tunas tertinggi. Persentase pembentukan tunas
ditemukan lebih tinggi pada eksplan pucuk daripada nodia. Pucuk yang ditanam
pada media MS dengan 1.0 mg/l BAP menghasilkan lebih dari 84% ; semakin
tinggi BAP semakin meningkat tetapi menurun pada 2 mg/l. Kinetin juga berhasil
menghasilkan pucuk tetapi lebih rendah (80%) dari BAP. Rata-2 tunas per eksplan
tertinggi pada 1.5 kinetin dan 0.5 mg/l dan BAP. Eksplan nodia pada media MS
dengan 2 mg/l NAA menghasilkan lebih banyak akar. Pada eksplan pucuk, ada
commit to user
11
membentuk akar berkurang. Jumlah tunas terbentuk: BAP terbaik 0.5 mg/l yaitu
7.33. jumlah dari eksplan pucuk lebih tinggi daripada eksplan nodia. Untuk kinetin
terbaik 1.5 mg/l yaitu 7.99.
Penelitian Rahman et al. (2004) pada zaitun, eksplan internodia diambil dari lapangan ditanam pada media 1/2MS (hara makro setengah hara mikro
penuh). Untuk menginduksi kalus digunakan 2,4-D secara sendiri atau
dikombinasi dengan BA dan Kn. Kalus dipindah ke media yang mengandung BA,
Kn, NAA untuk ditumbuhkan tunas. Sedang untuk menumbuhkan akar ditanam
pada media MMS2 (setengah unsur makro dan setengah unsur mikro) dengan
hormon auksin (NAA, IBA atau IAA) secara tunggal. Mereka mendapatkan kalus
muncul dari bagian bawah potongan setelah 4 mgg. Pada minggu ke 6 hampir
semua eksplan terpenuh kalus terutama pada hormon 2,4-D 0.1-1.0 mg/l secara
tunggal atau kombinasi dengan BA/Kn 0.5-2.0 mg/l. Persentase tertinggi pada 0.5
BA + 0.5 mg 2,4-D mg/l yaitu 75%. Kalus kompak dengan warna kehijauan.
Tidak muncul tunas selama eksplan ditanam pada media penumbuh kalus. Tunas
muncul setelah 4 minggu dipindah ke media penumbuh tunas. Kalus yang
menghasilkan tunas, Persentase tetinggi (80%) dengan jumlah tunas terbanyak
(15) per kultur ada pada BA 1.0 mg/l dengan NAA 0.1 mg/l.
Pada Citrus jambhiri (Ali dan Mirza, 2006) BA 3 mg/l menyebabkan 83% eksplan menghasilkan tunas dan ini merupakan persentase tertinggi dibanding
konsentrasi lainnya diikuti BA 1 mg/l sebesar 76%. Kombinasi BA dengan NAA
pada berbagai konsentrasi menghasilkan tunas lebih rendah. Pengakaran terbaik
pada NAA 0.5 mg/l, 70% tunas menghasilkan akar, sama baiknya dengan 2,4-D 1
mg/l.
Altaf et al. (2009) telah memakai media MS yang diperkaya dengan BA, Kn, 2,4-D dan NAA untuk mendapatkan kalus berbagai jenis tanaman jeruk Citrus reticulata, Citrus aurantium, Citrus sinensis, Citrus paradisi, Citrus aurantifolia. Semua jenis tanaman jeruk tersebut berhasil menghasilkan kalus dan ini
menunjukkan media MS sesuai. Sedangkan Nhan dan Chau (2009) mendapatkan
bahwa pengakaran tunas jeruk “Volkamer lemon” (Citrus volkameriana)lebih mudah dilakukan pada media setengah MS.
Wulandari, Syafii dan Yossilia (2004) menggunakan eksplan daun jeruk
commit to user
12
BA jumlah akar terbanyak pada pemberian kombinasi 1 ppm NA dan 10 ppm BA
yaitu 29,66 buah.
Paudyal dan Haq (2000) mengembangkan protokol perbanyakan in vitro
jeruk pamelo (Citrus grandis) dengan menggunakan eksplan pucuk pada media MS sebagai penumbuh perbanyakan tunas.setelah 6 minggu didapat tunas rata-rata
5.2 dari BA konsentrasi 1.8 M. NAA dengan sitokinin tidak meningkatkan
pembentukan tunas. Pada media penginduksi akar (1/2MS), NAA menghasilkan
akar lebih banyak (superior) dibanding IBA. Peningkatan konsentrasi dari 1.3 ke
10.7 µM pada NAA terus meningkatkan jumlah akar dari 1.5 ke 4 akar per eksplan
sedang IBA tetap saja hanya menghasilkan 1 akar.
B. Kerangka Berfikir
Peningkatan kesejahteraan dan kesadaran akan gizi menyebabkan kebutuhan
konsumsi jeruk Bageng terus meningkat sementara produksi masih terbatas.
Peningkatan kebutuhan juga disebabkan keunggulan jeruk Bageng sehingga makin
banyak penggemarnya. Untuk memenuhi kebutuhan tersebut perlu dilakukan
peningkatan produksi yang biasanya ditempuh dengan ekstensifikasi (perluasan
pertanaman) dan intensifikasi. Perluasan pertanaman jeruk telah dilakukan
Pemerintah Kabupaten Pati namun dalam pengadaan bibitnya masih menggunakan
teknik perbanyakan vegetatif konvensional (cangkok) sehingga proses perluasan
lambat karena bibit yang didapat tidak banyak dan merusak tanaman induk.
Sementara terdapat teknik perbanyakan yang dapat menghasilkan lebih banyak
bibit dalam waktu lebih cepat, yaitu teknik kultur jaringan. Teknik ini telah
diaplikasikan pada berbagai jenis tanaman dan berbagai jeruk, namun belum pada
jeruk Bageng. Berdasar prinsip kultur jaringan, jeruk Bageng dimungkinkan untuk
diperbanyak secara kultur jaringan.
Aplikasi kultur jaringan pada jeruk Bageng dapat memenuhi kebutuhan bibit
dalam jumlah banyak dalam waktu singkat, dengan kualitas seragam dan sama dengan
sifat-sifat induknya.
commit to user
13
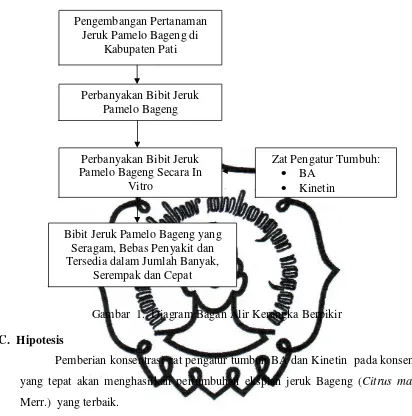
Gambar 1. Diagram Bagan Alir Kerangka Berpikir
C. Hipotesis
Pemberian konsentrasi zat pengatur tumbuh BA dan Kinetin pada konsentrasi
yang tepat akan menghasilkan pertumbuhan eksplan jeruk Bageng (Citrus maxima
Merr.) yang terbaik.
Bibit Jeruk Pamelo Bageng yang Seragam, Bebas Penyakit dan Tersedia dalam Jumlah Banyak,
Serempak dan Cepat Perbanyakan Bibit Jeruk Pamelo Bageng Secara In
Vitro
Perbanyakan Bibit Jeruk Pamelo Bageng Pengembangan Pertanaman
Jeruk Pamelo Bageng di Kabupaten Pati
Zat Pengatur Tumbuh: · BA
commit to user
14
III. BAHAN DAN METODE
A. Tempat Dan Waktu Penelitian
Penelitian dilakukan di Laboratorium Kultur Jaringan Fakultas Pertanian
Universitas Muria Kudus, Kudus , Jawa Tengah, pada bulan Desember 2009 sampai
dengan April 2010.
B. Bahan dan Alat Penelitian
Eksplan berupa nodia yang diambil dari tanaman induk jeruk Bageng di desa
Bageng, Kabupaten Pati. Tunas yang sedang aktif tumbuh berumur satu bulan
(Gambar 2) digunakan sebagai eksplan, dipotong, setiap potong mengandung satu
nodia. Pucuk tunas tidak digunakan sebagai eksplan.
Gambar 2 . Tunas yang Sedang Aktif Tumbuh Digunakan Sebagai Eksplan
Media MS (1962) digunakan sebagai media tanam. Komposisi hara dan
vitamin yang digunakan sebagaimnana pada Lampiran 1.
Zat pengatur tumbuh yang digunakan adalah golongan sitokinin yaitu
Benzyladenin (BA) dan Kinetin (Kn).
C. Metoda Penelitian
Metoda yang digunakan adalah eksperimen, menggunakan Rancangan Acak
Lengkap (RAL) dengan perlakuan berupa Media MS dengan berbagai variasi
commit to user
tekanan 15 psi selama 20 menit.
Eksplan disterilkan dengan cara dicuci dengan detergen, dibilas dengan air
mengalir sampai bersih, direndam dengan 3 mg Dithane 80WP dan 2 mg Agrept
20WP dalam 1 liter aquades selama 12 jam, dicuci air steril tiga kali. Bagian tanaman
yang digunakan sebagai eksplan adalah lima tunas dari pucuk. Eksplan
dipotong-potong dan setiap dipotong-potongan terdapat satu buku, kemudian ditanam dalam kultur
aseptik.
Keasaman media diatur sehingga pH 5.8 + 0.1 sebelum disterilkan dengan
autoklaf pada tekanan 15 psi dan suhu 121oC selama 20 menit. Media padat
menggunakan 8 g/l agar ditambah 30 g/l sukrosa. Media disterilkan kemudian dituang
kedalam botol kultur sebanyak 20 ml ditutup dengan aluminium foil dan selanjutnya
disterilkan dalam autoklaf, media dibiarkan selama 3 hari di rak kultur untuk melihat
terkontaminasi atau tidak.
Penanaman eksplan dilakukan dalam Laminar Air Flow yang sudah
disterilkan. Kultur menggunakan tabung gelas kapasitas 100 ml dengan diameter 4
cm. Botol yang telah berisi satu eksplan diletakkan pada rak kultur pada lingkungan
suhu 25oC + 1oC, lama penyinaran 16 jam menggunakan lampu intensitas 2000 –
3000 lux.
E. Variabel Penelitian
Pengamatan dilakukan terhadap kalus (saat muncul, warna dan tekstur),
persentase eksplan yang membentuk kalus, saat terbentuk tunas, persentase eksplan
yang membentuk tunas dan jumlah tunas per eksplan.
Pengamatan dilakukan setelah tujuh hari setelah tanam dengan interval tujuh
hari.
F. Analisis Statistik
Data tentang saat muncul kalus, warna dan tekstur kalus, saat terbentuk
tunas, persentase eksplan yang membentuk tunas dan jumlah tunas per eksplan yang
commit to user
16
dianalisis Analysis of Variance (Anova) , dan untuk mengetahui perbedaan rerata pengaruh antar perlakuan dilakukan uji lanjut dengan Duncan Multiple Range Test
commit to user
17
IV.HASIL DAN PEMBAHASAN
Bahan tanaman yang digunakan dalam penelitian ini diambil dari pohon induk
di kebun petani, sehingga kemungkinan bahan tanaman mengandung debu,
kotoran-kotoran, dan berbagai kontaminan hidup pada permukaannya, sangat besar meski
kondisi tanamannya dalam keadaan sehat. Kontaminan hidup dapat berupa cendawan,
bakteri, serangga dan telurnya, tungau serta spora-spora. Pada media yang
mengandung gula, vitamin dan mineral, kontaminan terutama cendawan dan bakteri
dapat tumbuh secara cepat. Dalam beberapa hari, kontaminan memenuhi seluruh botol
kultur. Eksplan yang tertutup kontaminan akhirnya mati, dapat sebagai akibat
langsung dari serangan cendawan/bakteri.
commit to user
18
Kontaminasi terjadi sejak umur 3 hari setelah tanam (HST) sampai dengan 7
HST. Penyebabnya berupa cendawan putih dengan spora hitam, dan bakteri yang
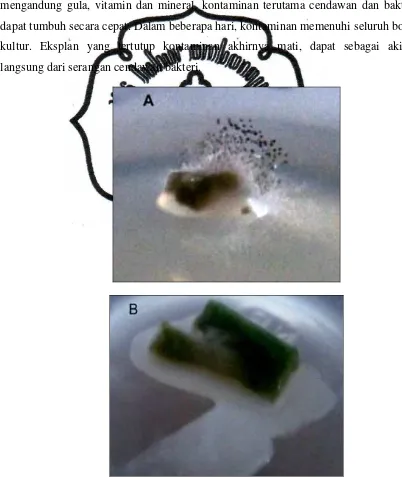
mengeluarkan eksudat berupa lendir putih. Contoh eksplan terkontaminasi seperti
Gambar 3.
Kontaminasi juga terjadi karena adanya kontaminan internal, terutama bakteri.
Kontaminan internal ini sangat sulit dihilangkan, karena sterilisasi permukaan tidak
dapat mencapainya. Upaya menghilangkan kontaminan internal ditempuh dengan
perlakuan antibiotik atau fungisida yang sistemik.
Bagian tanaman yang dipergunakan sebagai ekplan berupa tunas lateral yang
sedang tumbuh dengan ukuran panjang antara 5 cm sampai 10 cm sehingga sel-sel
sekulen, yaitu bersifat meristematik dan mudah diisolasi karena kandungan air yang
cukup. Pemakaian eksplan yang berasal dari tunas meristem diharapkan dapat
memperkecil tingkat kontaminasi. Sel-sel aktif membelah diharapkan kecepatan
pembelahan sel lebih dari kecepatan pertumbuhan / perkembangbiakan kontaminan.
Pemakaian eksplan yang berbulu atau tidak berbulu dapat secara langsung
mempengaruhi tingkat kontaminasi. Morfologi permukaan eksplan tidak berbulu
sehingga lebih memudahkan kontaminan bersentuhan langsung dengan sel jaringan
eksplan, meningkatkan peluang terjadinya serangan kontaminan. Sedangkan untuk
eksplan yang berbulu, metode sterilisasi membutuhkan cara tersendiri misalnya
dengan menggunakan larutan Tween 20 agar proses sterilisasi dapat langsung
bersentuhan dengan permukaan eksplan.
Dalam penelitian ini dari jumlah satuan percobaan 180 botol, yang mengalami
kontaminasi 43 botol (24%); 24 botol (13%) disebabkan cendawan dan 19 botol
(11%) disebabkan bakteri, sehingga terdapat 137 botol tidak terkontaminasi .
Kontaminasi dapat terjadi karena beberapa hal, misalnya kesalahan teknis
setelah proses otoklaf, tutup botol kultur tidak dikencangkan kembali sehingga pada
waktu penanaman kontaminan masuk dalam botol kultur. Disamping itu juga karena
upaya sterilisasi yang dilakukan tampaknya belum sempurna, terlihat dari adanya
eksplan yang ditanam masih mengalami kontaminasi dan adanya eksplan mati
mencoklat akibat terlalu kerasnya proses sterilisasi. Eksplan yang mati berwarna
kecoklatan, pada umumnya media berubah warna dari jernih menjadi kecoklatan
commit to user
19
Eksplan dalam 137 botol yang tidak terkontaminasi selanjutnya ada yang
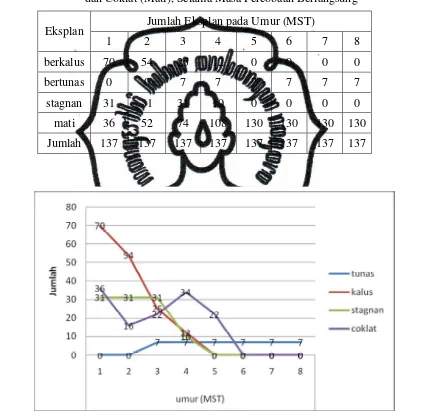
menghasilkan kalus, bertunas, stagnasi, dan mati. Tabel 1 memuat jumlah
masing-masing eksplan tersebut, dan secara grafis pada Gambar 5.
Gambar 4. Eksplan (A) Mati, warna mencoklat (B) Stagnasi (Bertahan Hidup Tetapi Tidak Ada Gejala Tumbuh)
Jumlah eksplan berkalus terus berkurang sejak minggu kedua dan semua mati
pada minggu kelima. Sedang eksplan yang stagnasi baru berkurang (mati) mulai
minggu ketiga. Kematian eksplan ditandai dengan perubahan warna secara pelan;
kalus berubah dari putih ke coklat, sedangkan eksplan yang stagnasi dari hijau ke
coklat. Kematian eksplan berkalus lebih cepat diduga karena tingkat kepekaan sel
A
commit to user
20
kalus lebih tinggi daripada sel jaringan eksplan yang stagnan, terhadap kondisi lingkungan dalam botol yang mengalami vitrifikasi. Hasil pengukuran pH media
pada media berisi eksplan mati (secara acak) menunjukkan terjadinya peningkatan
keasaman sampai satu aras (data tidak disajikan). Peningkatan keasaman media bisa
disebabkan akibat proses sterilisasi media dengan autoklaf, keluarnya eksudat eksplan
yang mencemari media, berkurangnya unsur hara pada media dll.
Tabel 1. Jumlah Eksplan Bertunas, Berkalus, Tidak Berkembang (Stagnasi) dan Coklat (Mati), Selama Masa Percobaan Berlangsung
Eksplan Jumlah Eksplan pada Umur (MST)
1 2 3 4 5 6 7 8
berkalus 70 54 25 12 0 0 0 0
bertunas 0 0 7 7 7 7 7 7
stagnan 31 31 31 10 0 0 0 0
mati 36 52 74 108 130 130 130 130
Jumlah 137 137 137 137 137 137 137 137
Altaf (2006) mengemukakan bahwa potensi pembelahan sel dan regenerasi
tunas di dalam kondisi invitro tanaman jeruk rendah karena pencoklatan dan Gambar 5. Pola Perubahan Jumlah Eksplan Bertunas, Berkalus, Tidak Berkembang
commit to user
21
lambatnya pertumbuhan. Tunas dengan meristemnya sendiri terganggu dengan
sterilisasi bahan kimia, yang memiliki efek mematikan pada kuncup.
A. Kalus
Kalus merupakan sekumpulan sel yang masih aktif tumbuh dan membelah dan
belum terdeferensisai untuk membentuk tunas maupun akar.
Ada dua kategori kalus yaitu kompak dan remah. Pada kalus kompak sel-sel
teragregasi secara padat, sedangkan kalus remah sel-selnya longgar satu sama lainnya
sehingga mudah terurai.
Pada penelitian ini, kalus terbentuk pada tangkai daun bagian sel yang berfungsi
sebagai ‘jembatan’ antara daun dengan batang (Gambar 6). Gejala muncul kalus
mulai tampak pada hari keempat setelah tanam eksplan terutama pada perlakuan BA.
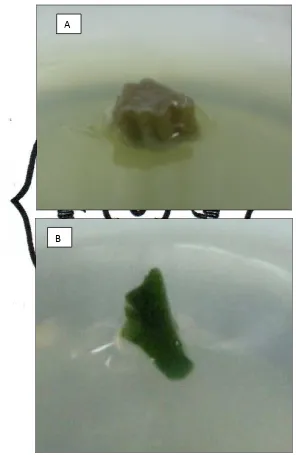
Kalus yang didapat dalam penelitian ini berwarna putih (Gambar 7), dengan
tekstur kalus remah. Taira et al. (1977 dalam (George, 1993)) mengemukakan bahwa genotipe dapat berpengaruh terhadap perbedaan warna dan tekstur kalus. Mungkin
warna dan tesktur kalus pamelo Bageng yang putih dan remah juga akibat sifat
genetik. Hasil penelitian Altaf, et al. (2009) juga menjukkan adanya kalus berwarna putih krem.
Gambar 6. Letak Terbentuknya Kalus Ditunjukkan oleh Anak Panah
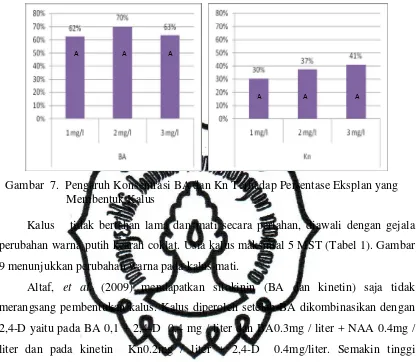
Secara visual, tidak ada perbedaan jumlah dan ukuran kalus yang dibentuk
eksplan akibat perlakuan. Peningkatan dosis ZPT juga tidak memperlihatkan suatu
pola respon pada jumlah dan ukuran kalus yang terbentuk (Gambar 8). Namun
commit to user
22
2 mg/l dan terendah (30%) pada perlakuan Kn 1 mg/l meski tidak berbeda nyata
(Gambar 7).
Gambar 7. Pengaruh Konsentrasi BA dan Kn Terhadap Persentase Eksplan yang Membentuk Kalus
Kalus tidak bertahan lama dan mati secara perlahan, diawali dengan gejala
perubahan warna putih kearah coklat. Usia kalus maksimal 5 MST (Tabel 1). Gambar
9 menunjukkan perubahan warna pada kalus mati.
Altaf, et al. (2009) mendapatkan sitokinin (BA dan kinetin) saja tidak merangsang pembentukan kalus. Kalus diperoleh setelah BA dikombinasikan dengan
2,4-D yaitu pada BA 0,1 + 2,4-D 0,4 mg / liter dan BA0.3mg / liter + NAA 0.4mg /
liter dan pada kinetin Kn0.2mg / liter + 2,4-D 0.4mg/liter. Semakin tinggi
konsentrasi menyebabkan eksplan mencoklat. Kalus berwarna putih krem. Setelah
sub kultur kalus berubah menjadi hijau dan berkembang lebih lanjut menghasilkan
embrio.
Pada penelitian ini kalus tetap terbentuk meski media tidak ditambahkan auksin.
Diduga kandungan auksin endogen eksplan cukup tinggi sehigga sitokinin yang
ditambahkan dari luar masih belum mampu merubah rasio yang dipersyaratkan untuk
tidak munculnya kalus.
A A A
A
commit to user
23
Gambar 8. Kemunculan Kalus Karena Pengaruh (A) Kinetin 1mg/l, (B) Kinetin 2mg/l, (C) Kinetin 3mg/l, (D) BA 1mg/l ,(E) BA 2mg/l ,(F) BA 3mg/l
A B
C
D
commit to user
24
Gambar 9. Perubahan Warna Kalus (A) Bagian Kalus Hidup Berwarna Putih, (B) Kalus Mati Berwarna Coklat
B. Tunas
Terdapat tujuh botol yang eksplannya menghasilkan tunas. Setiap eksplan hanya
membentuk satu tunas. Tunas mulai terbentuk pada minggu ketiga setelah tanam pada
eksplan berkalus (Tabel 1). Tunas muncul dari eksplan yang berkalus. Eksplan yang
stagnasi tidak menghasilkan tunas. Warna tunas hijau (Gambar 10). Perkembangan
tunas amat lambat. Daun tidak dapat membuka penuh, seperti hanya terdiri dari tulang
daun. Pada akhir masa percobaan tunas-tunas mati dengan gejala pencoklatan dimulai
A
commit to user
25
dari pangkal tunas bergerak pelan keujung. Diduga ini disebabkan terjadinya
vitrifikasi.
Vitrifikasi adalah pertumbuhan yang tidak diinginkan, tampak dari bentuk daun
berupa penebalan dan ukurannya lebih panjang, yang terjadi pada semua daun.
Perubahan warna daun menjadi putih kecoklatan (transparan).
Rendahnya jumlah eksplan yang menghasilkan tunas diduga disebabkan oleh
adanya kandungan auksin endogen eksplan yang jumlahnya seimbang dengan
sitokinin yang diberikan sehingga sebagian besar eksplan hanya membentuk kalus.
Skoog and Miller (1957 dalam George, 1993) berpendapat bahwa pembentukan tunas dan akar dikendalikan oleh keseimbangan antara auksin dan sitokinin; jika auksin
tinggi dan sitokinin rendah maka terbentuk akar , jika auksin dan sitokinin seimbang
maka akan terbentuk kalus, dan jika auksin rendah dan sitokinin tinggi terbentuk tunas.
Usman et al (2005) mendapatkan hasil bahwa eksplan terbaik dalam hal pembentukan tunas adalah eksplan nodia, disebabkan oleh meristem yang sudah ada
pada nodia tersebut. Namun penelitian Altaf ( 2006) mendapatkan potongan nodia
memerlukan waktu lebih lama untuk pembentukan tunas. Sub kultur memegang
peranan penting. Pertumbuhan di sub kultur lebih cepat dibanding kultur pertama.
Tunas segera muncul dengan gejala pertumbuhan lebih normal. Oleh karena itu
dalam penelitian ini hasil akan lebih baik jika seandainya tunas yang didapat segera
disubkultur seperti yang dilakukan Altaf et al. (2006).
Dalam penelitian ini Tunas hanya dihasilkan dari tujuh eksplan yang mendapat
perlakuan BA yaitu BA 1 mg/l terdapat dua eksplan bertunas (9%),, BA 2 mg/l
terdapat 4 eksplan bertunas (18%) dan BA 3 mg/l terdapat 1 eksplan bertunas (6%)
Gambar 10 memperlihatkan kondisi tunas tersebut. Semua eksplan yang diberi kinetin
tidak menghasilkan tunas. Sehingga terkesan BA lebih baik daripada kinetin. Ini
sejalan dengan penelitian Miah et al. (2008) yang mendapatkan bahwa BA lebih baik daripada Kn dalam hal pembentukan tunas. Hanya saja kinetin yang diberikan Miah et al (2008) masih bisa menghasilkan tunas. Eksplan nodia dan pucuk dikultur dalam MS dengan BA dan Kn baik sendiri-sendiri atau dalam kombinasi mampu beregenerasi
dan menghasilkan beberapa tunas. Jumlah maksimum tunas diperoleh dari eksplan
commit to user
26
Gambar 10. Induksi tunas akibat (A) BA 1mg/l, (B) 2mg/l dan (C) 3mg/l pada Media MS, 8 MST
A
AB B
B
B
commit to user
27
Hasil penelitian seperti penelitian yang dilakukan Mukhtar et al. (2005) pada Jeruk Aurantifolia dan Citrus sinensis, persentase pembentukan tunas tertinggi diperoleh pada media MS dengan 2,0 mg /l Benzylaminopurin (BA). Pemberian BA mempercepat hari yang diperlukan untuk induksi tunas dibanding tanpa BA (Usman
et al., 2005).
Dari berbagai penelitian penumbuhan tunas eksplan nodia dengan media MS
dasar, ZPT terbaik didapat Begum et al. (2004) pada BAP 1,8 µM; Ali dan Mirza (2006) pada BAP 3 mg/l atau 0,5 mg Kinetin; Rachman et al. (2004) dengan tanaman zaitun pada BAP 1 mg/l; Mukhtar et al. (2005) dengan Citrus reticulata pada BAP 1 mg/l; dan Miah et al. (2008) dengan Citrus macroptera pada BAP 1 mg/l.
Salah satu faktor (selain lingkungan) yang mempengaruhi petumbuhan dan
morfogenesis kultur jaringan yaitu genotipe bahan tanaman yang dikultur. Pengertian
genotipe disini meliputi varietas (George, 1993). Interaksi genotipe tanaman dengan
lingkungan tumbuh dapat menyebabkan perbedaan-perbedaan respon meski hanya
dalam aras varietas. Vareitas A dapat melangsungkan morfogenesis pada suatu macam
ZPT, sementara varietas B tidak responsif hingga konsentrasi ZPT diubah, diganti
atau dilengkapi dengan yang lain. Disebabkan oleh spesifisitas genotipe, kebutuhan
media dan lingkungan tumbuh sering berbeda dari satu genus atau spesies tanaman
(George, 1993).
Secara umum tanaman yang ex vitro mudah menghasilkan tunas adventif maka demikian juga halnya jika tanaman tersebut dalam kondisi in vitro. Pada pamelo telah dilaporkan tentang keberhasilan multiplikasi tunas dari nodia (Paudyal dan Haq, 200).
Tetapi Pamelo Bageng tergolong sedikit menghasilkan tunas adventif meski dilakukan
pangkas pucuk untuk menghilangkan dominasi apikal. Mungkin ini yang
menyebabkan mengapa pada penelitian ini tidak terjadi multiplikasi tunas. Pada jenis
commit to user
28
V. KESIMPULAN DAN SARAN
A. Kesimpulan
1. Pamelo Bageng dapat dikultur secara in vitro, terlihat dari keberhasilan eksplan membentuk kalus dan tunas.
2. Sebagian besar eksplan menghasilkan kalus . Kalus mulai terbentuk pada hari keempat setelah tanam. Secara visual ukuran, warna dan tekstur kalus pada setiap eksplan tidak terdapat perbedaan. Media MS + BA menghasilkan persentase eksplan berkalus lebih tinggi dibanding MS + Kn.
3. Tunas berhasil dibentuk pada media MS + BA 1 mg/l (2 botol), MS + BA 2 mg/l (4 botol), dan MS + BA 3mg/l (1 botol). Setiap eksplan hanya menghasilkan satu tunas (tidak terjadi multiplikasi). Media MS + Kinetin tidak membentuk tunas.
4. Pemberian sitokinin BA dan Kn dapat menimbulkan pengaruh yang berbeda terhadap pertumbuhan kalus dan tunas pamelo.
B. Saran
1. Mengingat pertumbuhan tunas sangat lambat diduga akibat vitrifikasi, perlu dilakukan penelitian lanjutan guna mengidentifikasi penyebab utama vitrifikasi.