i
PREPARASI TiO2-TERSENSITIFKAN AgCl PADA KONDISI pH ASAM DAN APLIKASINYA
SEBAGAI MATERIAL ANTIBURAM
SKRIPSI
Diajukan Kepada Fakultas Matematika dan Ilmu Pengetahuan Alam Universitas Negeri Yogyakarta untuk Memenuhi Sebagian
Persyaratan guna Memperoleh Gelar Sarjana Sains Kimia
Oleh Ratna Novita Sari
12307141008
PROGRAM STUDI KIMIA
FAKULTAS MATEMATIKA DAN ILMU PENGETAHUAN ALAM UNIVERSITAS NEGERI YOGYAKARTA
v
MOTTO
Sesungguhnya bersama kesulitan ada kemudahan,
Maka apabila engkau telah selesai (dari satu urusan), maka kerjakanlah
(urusan yang lain) dengan sungguh-sungguh
(Q.S. Al-Insyirah : 6-7).
Mengapa Lelah?
Sementara Allah SWT selalu menyemangatimu dengan
Hayya’alal falah
Bahwa jarak kemenangan hanya berkisar antara kening dan sajadah
-Ratria Devy-
“Banyak kegagalan dalam hidup ini dikarenakan orang-orang Tidak menyadari betapa dekatnya mereka dengan keberhasilan saat mereka
menyerah”
vi
PERSEMBAHAN
Alhamdulillaahirobil’alamin...
Puji syukur kepada Allah SWT atas segala rahmat dan hidayah-Nya
sehingga skripsi ini dapat terselesaikan..
Ku persembahkan skripsi ini untuk kedua orang tua saya dan
sahabat saya (Wiwit Mei Anggraeni, Tiara Rahmadini,
Muthia Khadijah) serta untuk orang-orang yang telah
menyayangiku, mendo’akan, mendukung dan
menyemangatiku dengan kesabaran
vii
PREPARASI TiO2-TERSENSITIFKAN AgCl PADA KONDISI pH ASAM DAN APLIKASINYA SEBAGAI MATERIAL ANTIBURAM
Oleh
Ratna Novita Sari 12307141008
ABSTRAK
Penelitian ini bertujuan untuk mengetahui pengaruh penambahan perak pada sintesis TiO2@AgCl dalam suasana pH asam terhadap karakter produk yang
dihasilkan dan mengetahui aktivitas fotokatalik TiO2@AgCl sebagai antiburam.
Subjek penelitian ini adalah TiO2-tersensitifkan AgCl dengan 0%; 1,5%;
3%; 6%; dan 9% perak. Objek penelitian ini adalah karakter fisik dan aktivitas antiburam dari material TiO2-tersensitifkan AgCl. TiO2-tersensitifkan Ag
disintesis dengan metode pengendapan teknik refluks dari campuran prekursor TiO2, HNO3 8M, dan AgNO3. Emulsi kemudian direfluks pada 150oC selama 6
jam. Adanya AgCl sebagai sensitiser berasal dari ion Cl- yang terabsorbsi pada permukaan TiO2 dan bereaksi dengan ion Ag+ dari penambahan larutan AgNO3.
Hasil padatan TiO2@AgCl dikarakterisasi dengan X-Ray Diffraction (XRD) dan
Spektrofotometer UV-Vis Diffuse Reflectance. Uji aktivitas antiburam dilakukan dengan membuat lapisan tipis dari TiO2@AgCl pada kaca preparat dengan teknik
deep coating. Pengurangan sudut kontak air diukur di bawah sinar matahari dan sinar ultraviolet.
Hasil penelitian menunjukkan bahwa sampel TiO2@AgCl dengan 0%;
1,5%; 3%; 6%; dan 9% perak menghasilkan fasa anatas, AgCl (minor) dan fasa rutil (mayor). Penambahan Ag yang semakin banyak meningkatkan komposisi AgCl yang dihasilkan. Sampel 1,3%; 3,4%; 8,3%; dan 15,2 % menunjukkan energi celah pita masing-masing sebesar 3,24; 3,00; 3,09; dan 2,95 eV, sedangkan pada kontrol adalah 3,05 eV. Ukuran kristal semua sampel TiO2@AgCl adalah
5-9 nm (anatas), 5-9-11 nm (rutil), dan 37-60 nm (AgCl). Aktivitas antiburam paling baik pada sinar matahari adalah sampel TiO2@AgCl 6% perak dan pada sinar UV
adalah 3% perak.
viii
PREPARATION OF AgCl-SENSITIZED TiO2 IN ACID CONDITION AND THE APLICATION FOR ANTI-HAZY MATERIAL
By:
Ratna Novita Sari 12307141008
ABSTRACT
This study aimed to determine the effect of silver addition on the synthesis of AgCl-sensitized TiO2 (TiO2@AgCl) in acid pH to the character of products and
determine the photocatalytic activity of TiO2@AgCl as anti-hazy material.
The subject of this study was AgCl-sensitized TiO2 with 0%; 1,5%; 3%;
6%, and 9% silver. The object of this study is physical character and anti-hazy activity of AgCl-sensitized TiO2 material. AgCl-sensitized TiO2 synthesized by of
precepitation techniques from a mixture TiO2, HNO3 8 M, and AgNO3. The
emulsion then refluxed at of 150oC for 6 hours. The presence of AgCl as sensitizer drived from Cl- ions adsorbed on the surface of TiO2 and react with Ag+
ions the addition of a AgNO3 solution. The result of TiO2@AgCl solids were
characterized by X-Ray Diffraction (XRD) and spectrophotometer UV-Vis Diffuse Reflectance. The activity is studied by thin layer of TiO2@AgCl on glass by
deepcoating. The decreasing of the contact angel of water under the sun and ultraviolet rays were measured.
The results showed that all samples of TiO2@AgCl with 0%; 1.5%; 3%;
6%; and 9% silver produced anatas, rutile, and AgCl phases. The increasing of Ag added increase the composition of AgCl in the products. The samples of 1.3%; 3.4%; 8; 3; and 15.2% Ag showed the band gap energy of 3.24; 3.00; 3.09; and 2.95 eV, while the control was 3.05 eV, respectively. The crystal size in all sample of TiO2@AgCl were 5-9 nm (anatase), 9-11 nm (rutile), and 37-60 nm
(AgCl).The best result on sunlight were TiO2@AgCl with 6% Ag and on the UV
light is 3% Ag.
ix
KATA PENGANTAR
Puji dan syukur penulis panjatkan kehadirat Allah SWT, yang telah
memberikan rahmat dan hidayah-Nya sehingga penulis mampu menyelesaikan
Tugas Akhir Skripsi yang berjudul “Preparasi TiO2-Tersensitifkan AgCl Pada
Kondisi pH Asam dan Aplikasinya Sebagai Material Antiburam”.
Tugas akhir Skripsi ini disusun berdasarkan hasil penelitian yang
dilaksanakan di Laboratorium Kimia FMIPA UNY. Dengan segala kerendahan
hati penulis menyadari bahwa dalam menyelesaikan Tugas Akhir Skripsi ini tidak
lepas dari bimbingan, bantuan serta dukungan dari berbagai pihak. Oleh karena
itu, pada kesempatan ini penulis mengucapakan terima kasih yang
sebesar-besarnya kepada :
1. Bapak Dr. Hartono selaku Dekan FMIPA UNY yang telah memberikan izin
untuk mengadakan penelitian.
2. Bapak Dr. Jaslin Ikhsan, Ph.D selaku Ketua Jurusan Pendidikan Kimia dan
Koordinator Tugas Akhir Skripsi Program Studi Kimia FMIPA Universitas
Negeri Yogyakarta yang telah banyak memberikan bantuan kepada kami.
3. Bapak Dr. Hari Sutrisno selaku Dosen Pembimbing yang selalu sabar
memberikan bimbingan, masukan, nasehat, motivasi dan saran dalam
penyusunan Tugas Akhir Skripsi.
4. Bapak Prof. A.K. Prodjosantoso, Ph.D selaku Dosen Penguji Utama yang
telah memberikan saran dan masukannya demi sempurnanya Tugas Akhir
x
5. Ibu Dr. Cahyorini Kusumawardani, M.Si selaku Dosen Penguji Pendamping
yang telah memberikan saran dan masukannya demi sempurnanya Tugas
Akhir Skripsi.
6. Ibu Dr. Kun Sri Budiasih, M.Si selaku Dosen Sekretaris Penguji yang telah
memberikan saran dan masukannya demi sempurnanya Tugas Akhir
Skripsi.
7. Bapak dan ibu atas do’a, dukungan, motivasi, dan kasih sayangnya.
8. Segenap dosen dan staf Jurusan Pendidikan Kimia FMIPA Universitas
Negeri Yogyakarta yang telah banyak membantu selama kuliah.
9. Teman-teman Kimsub 2012 yang selama penelitian dan penyusunan Tugas
Akhir Skripsi selalu membantu, memberikan support dan
nasehat-nasehatnya.
10. Semua pihak yang telah membantu dan memberikan informasi baik secara
langsung maupun tidak langsung dalam pembuatan Tugas Akhir Skripsi ini
yang tidak dapat disebutkan satu persatu.
Dalam penyelesaian skripsi ini, penulis menyadari akan keterbatasan
kemampuan, pengetahuan dan pengalaman, sehingga masih banyak kekurangan.
Saran dan kritik yang bersifat membangun sangat penulis harapkan. Akhir kata,
semoga skripsi ini dapat bermanfaat bagikita semua.
Yogyakarta, September 2016
Ratna Novita Sari
xi
DAFTAR ISI
Halaman
HALAMAN JUDUL... i
PERSETUJUAN... ii
PENGESAHAN... iii
PERNYATAAN... iv
MOTTO... v
PERSEMBAHAN... vi
ABSTRAK... vii
ABSTRACT... viii
KATA PENGANTAR... ix
DAFTAR ISI... xi
DAFTAR TABEL... xiv
DAFTAR GAMBAR... xv
DAFTAR LAMPIRAN... xvi
BAB I PENDAHULUAN A. Latar Belakang………... 1
B. Identifikasi Masalah... 5
C. Pembatasan Masalah... 5
D. Perumusan Masalah... 6
E. Tujuan Penelitian... 6
xii
BAB II KAJIAN PUSTAKA
A. Deskripsi Teori... 8
1. Titanium Dioksida (TiO2)... 8
2. Perak Klorida... 11
3. Fotoaktivitas Titanium Dioksiada... 13
a. Fotokatalis... b. Fotohidrofil... . 13 16 4. Difraksi Sinar X... 5. Spektroskopi UV-Vis... 18 20 B.Penelitian Yang Relevan... C. Kerangka Berpkir... 22 23 BAB III METODE PENELITIAN A. Subjek dan Objek Penelitian... 24
B. Variabel Penelitian... 24
C. Alat dan Bahan... 25
D. Prosedur Penelitian... 26
E. Diagram Alir... 28
F. Teknik Analisis Data... 30
BAB IV HASIL PENELITIAN DAN PEMBAHASAN A. Preparasi Prekursor TiO2... 32
xiii
C. Karakterisasi Hasil Sintesis TiO2... 34
D.Uji Aktivitas Antiburam...
BAB V KESIMPULAN DAN SARAN
49
A. Kesimpulan... 53
B. Saran... 54
DAFTAR PUSTAKA... 55
LAMPIRAN………... .
xiv
DAFTAR TABEL
Halaman Tabel 1. Perbandingan struktur dan sifat Fisik TiO2 rutil & anatas
………... 11
Tabel 2. Data bidang-bidang hkl , puncak difraksi, dan intensitas I/Io
dari berbagai sampel penambahan perak... 39 Tabel 3.
Tabel 4
Nilai parameter kisi dan volume sel TiO2@AgCl berbagai
variasi penambahan perak... Data komposisi sampel TiO2@AgCl berbagai variasi
penambahan perak.………... 37
40 Tabel 5. Ukuran Kristal TiO2@AgCl berbagai variasi penambahan
Perak...………. 42 Tabel 6. Data absorbansi sampel TiO2@AgCl berbagai variasi
penambahan perak... 45 Tabel 7.
Tabel 8.
Data nilai energi celah pita TiO2@AgCl berbagai variasi
penambahan perak... Sudut kemiringan (slope) garis singgung penurunan sudut kontak air sampel TiO2@AgCl dengan berbagai variasi
penambahan perak pada sinar matahari dan sinar UV...
48
xv
DAFTAR GAMBAR
Halaman
Gambar 1. Struktur kristal rutil dan anatas... 9
Gambar 2. Mekanisme degradasi polutan organik pada AgCl@Ag@TiO2... 12
Gambar 3. Skema fotoeksitasi yang diikuti oleh deeksitasi pada permukaan semikonduktor... 14
Gambar 4. Difraksi sinar-X pada suatu Kristal... 19
Gambar 5. Diagram alir preparasi prekursor TiO2... 28
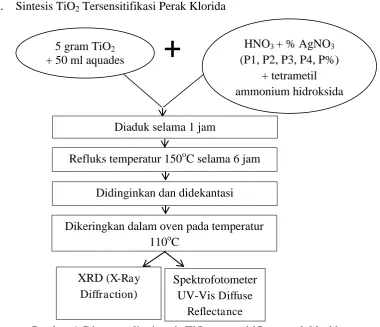
Gambar 6. Diagram alir sintesis TiO2-tersensitifkan perak klorida.... 29
Gambar 7. Diagram alir uji aktivitas antiburam TiO2 tersensitifkan perak klorida... 29
Gambar 8. Proses refluks TiO2@AgCl... 33
Gambar 9. Pola difraksi XRD sampel TiO2-tersensitifkan AgCl... 35
Gambar 10. Grafik volume sel TiO2@AgCl fasa anatas... 38
Gambar 11. Grafik volume sel TiO2@AgCl fasa rutil... 38
Gambar 12. Grafik volume sel TiO2@AgCl pada AgCl... 38
Gambar 13. Grafik hubungan persentase Ag dan AgCl setelah sintesis... 41
Gambar 14. Grafik ukuran kristal TiO2@AgCl fasa anatas berbagai variasi penambahan perak... 43
Gambar 15. Grafik ukuran kristal TiO2@AgCl fasa rutil berbagai variasi penambahan perak... 43
Gambar 16. Grafik ukuran kristal TiO2@AgCl oada AgCl berbagai variasi penambahan perak... 43
Gambar 17. Grafik absorbansi TiO2@AgCl berbagai variasi penambahan perak... 45
Gambar 18. Grafik energi celah pita TiO2@AgCl berbagai variasi penambahan perak... 47
Gambar 19. Grafik uji aktivitas antiburam sinar matahari... 50
xvi
DAFTAR LAMPIRAN
Halaman Lampiran 1. Perhitungan jumlah Prekursor TiO2 dan AgNO3 yang
digunakan pada sintesis TiO2@AgCl... 61
Lampiran 2. Data Kualitatif dan Kuantitatif TiO2@AgCl Pada
Berbagai Variasi Penambahan Ag... 65 Lampiran 3. Data Standar PDF Fasa Anatas, Rutil, dan AgCl... 91 Lampiran 4. Data Perhitungan Parameter Kisi dengan U-FIT... 95 Lampiran 5. Perhitungan Ukuran Kristal Senyawa TiO2
-Tersensitifkan AgCl Pada Berbagai Variasi Penambahan
Perak... 111 Lampiran 6. Data Absorbansi dan Reflektansi Spektrofotometer
UV-Vis Diffuse Reflectance... 118 Lampiran 7. Uji Aktivitas Antiburam Sinar Matahari dan Sinar UV.... 128 Lampiran 8. Data Tabel Penurunan Sudut Kontak TiO2@AgCl
Berbagai Variasi Penambahan Perak... 140 Lampiran 9. Gradien Kemiringan (Slope) TiO2@AgCl Berbagai
1
BAB I PENDAHULUAN
A.Latar Belakang
Saat ini industri-industri kaca berusaha mengembangkan sifat termal, sifat
optik, sifat mekanik, dan sifat elektrik dari material kaca. Mengingat penggunaan
kaca yang semakin meningkat tiap harinya pada berbagai bidang aplikasi, maka
dibutuhkan bahan pelindung atau pembersih kaca dari air yang dapat
meninggalkan efek lengket dan buram pada permukaan kaca tersebut, sehingga
dibutuhkan material pelapis kaca yang memiliki sifat anti air (hidrofobik), salah
satunya dengan pelapisan permukaan menggunakan titanium dioksida (TiO2)
Titanium dioksida merupakan semikonduktor yang memiliki berbagai
keunggulan antara lain, memiliki kestabilan yang tinggi, ketahanan terhadap
korosi, ketersediaan yang melimpah di alam, dan harga yang relatif murah
(Radecka, 2008). Selain itu, bersifat non toksik dan memiliki sifat redoks yaitu
mampu mengoksidasi polutan organik, mereduksi sejumlah ion logam dalam
larutan (Rajh et al.,1996) dan tersedia secara komersial serta preparasinya yang
mudah dilakukan di laboratorium. Adanya berbagai keunggulan tersebut, TiO2
banyak diaplikasikan sebagai pewarna dalam industri cat, kertas, dan plastik
(Chen et al., 2009), degradasi senyawa organik (Chen et al., 2009; Chen et al.,
2012; Dastan & Chaure, 2014), penjernih air (Smith et al., 2010), antibakteri,
fotokatalis (Venckatesh et al., 2012), sel surya (Chekina et al., 2013), biological
2
atau superfotohidrofil oleh sinar matahari atau ultra violet (Wang et al., 1997;
Wang et al., 1998).
Titanium dioksida (TiO2) umumnya ditemukan dalam tiga jenis struktur
kristal yaitu: rutil (tetragonal), anatas (tetragonal), dan brookit (ortorombik) (Kim
et al., 2005; Chekina et al., 2013). Struktur kristal rutil dan anatas cukup stabil
dan biasa digunakan sebagai bahan fotokatalis. Secara fotokatalitik, struktur
anatas menunjukkan aktivitas yang lebih baik dari segi kereaktifan dibandingkan
dengan struktur rutil (Melemeni et al., 2009). Struktur anatas memiliki luas
permukaan serbuk yang lebih besar serta ukuran partikel yang lebih kecil
dibandingkan dengan struktur rutil (Su et al., 2004). Selain itu, energi celah pita
TiO2 anatas lebih tinggi yaitu 3,2 eV sedangkan rutil sebesar 3,0 eV sehingga
anatas memiliki aktivitas fotokatalitik yang lebih tinggi (Hoffmann et al., 1995).
Harga energi celah pita tersebut berhubungan dengan maksimal serapan panjang
gelombang yang berkisar mulai dari 365 hingga 413 nm (daerah UV). Hal
tersebut menjadi problem yang besar dalam aplikasi spektrum matahari berbasis
TiO2 karena hanya 4 – 5% dari sinar matahari yang teremisi pada daerah UV
sehingga berbagai usaha dilakukan untuk memperbaiki respon TiO2 terhadap sinar
tampak (Anpo & Takeuchi, 2003).
Kinerja TiO2 dapat ditingkatkan dengan cara meningkatkan aktivitas sifat
optik agar terjadi pergeseran respon dari absorpsi sinar UV ke cahaya tampak.
Ada 2 cara untuk merekayasa TiO2 yaitu rekayasa kimia melalui penambahan
pendadah (chemical modification: doping) dan rekayasa kimia permukaan melalui
3
Mao, 2007). Pada penelitian ini berkaitan dengan rekayasa kimia permukaan
melalui penambahan sensitiser. Sensitiser yang digunakan dalam penelitian ini
adalah perak klorida, karena memiliki konduktivitas yang baik dan stabil secara
kimia (Yeo et al., 2003). Golongan perak halida terkenal sebagai material yang
peka terhadap cahaya dan secara luas digunakan sebagai sumber bahan dalam
fotografis film. Dalam proses fotografis, perak halida menyerap foton
menghasilkan pasangan elektron dan hole. Salah satu senyawa perak halida yang
digunakan yaitu perak klorida. Sangchaya et al. (2012) melaporkan bahwa serbuk
TiO2-AgCl yang disintesis dengan metode sol gel menunjukkan efek fotokatalitik
yang lebih efisien dibawah UV dan sinar tampak untuk degradasi metil biru (MB)
dengan laju reaksi fotokatalitik yang dihasilkan sebesar 0,47 lebih tinggi
dibandingkan dengan TiO2 komersial P25 sebesar 0,12.Hal tersebut menunjukkan
bahwa dengan penambahan perak klorida yang bertindak sebagai sensitiser dapat
meningkatkan aplikasi TiO2 sebagai fotokatalis.
Berbagai metode untuk sintesis TiO2 telah banyak dilakukan antara lain
sol gel, hidrotermal, solvotermal, elektrodeposisi, metal organik, MOCVD (Metal
Organic Chemical Vapor Deposition), sonokimia dan metode pengendapan (Chen
et al., 2005). Penelitian ini menggunakan metode pengendapan dengan teknik
refluks, karena tingkat kemudahan dalam mengontrol temperatur dan tekanan
sehingga struktur dan morfologi pun dapat direkayasa (Ropp, 2003). Teknik
refluks dengan temperatur 83oC selama 15 jam menghasilkan titanium dioksida
fasa brookit dengan kemurnian tinggi dan campuran fasa rutil dan anatas
4
itu preparasi partikel anatas dan rutil berukuran nano teratur telah dipelajari
dengan metode hidrotermal menggunakan titanium tetraklorida sebagai prekursor
(Cheng et al.,1995). Penelitian tersebut melaporkan bahwa keasaman tinggi yang
berasal dari konsentrasi TiCl4 yang tinggi mempengaruhi pembentukan fasa rutil,
sedangkan larutan dengan kisaran pH 3,4-8,2 menghasilkan fasa anatas.
Pembentukan struktur kristal dalam sintesis TiO2 dipengaruhi oleh beberapa
faktor diantaranya temperatur kalsinasi, pH larutan, konsentrasi dopan, waktu
reaksi (lama pengadukan) dan banyaknya air yang digunakan (Wang et al., 2007).
Faktor-faktor ini juga dapat mempengaruhi ukuran butir, komposisi atau
transformasi fasa, dan kristalinitas dari TiO2. Salah satu faktor yang secara
signifikan berpengaruh adalah pengaturan pH larutan. Berdasarkan penelitian
Wang et al. (2007) menunjukkan bahwa variasi pH larutan menghasilkan
pembentukan fasa yang berbeda dari TiO2. Hal ini dikarenakan semakin rendah
keasaman larutan atau bersifat basa maka struktur fasa yang terbentuk adalah
anatas, sedangkan semakin tinggi keasaman larutan maka fasa yang terbentuk
terarah ke fase rutil. Selain itu, Youji et al. (2008) melaporkan bahwa dalam
keadaan pH rendah (kondisi asam) permukaan TiO2 akan bermuatan positif
sehingga daya tolak antar partikel TiO2 akan semakin besar. Semakin besarnya
daya tolak antar partikel akan mempengaruhi distribusi partikel, dimana partikel
TiO2 dapat terdistribusi secara merata diseluruh permukaan cairan.
Nanopartikel TiO2 biasanya disintesis menggunakan berbagai macam
prekursor titania seperti titanium tetra-iso-propoxide (TTIP) (Nagamine et al.,
5
(TiCl4) (Lee et al., 2005) disamping senyawa titanium lainnya. Prekursor titanium
dioksida yang digunakan akan mempengaruhi morfologi dari nanopartikel TiO2
yang dihasilkan seperti luas spesifik permukaan, tingkat kristalinitas, dan ukuran
kristalit produk yang akan sangat berpengaruh terhadap sifat dan kinerja TiO2
dalam aplikasi.
B.Identifikasi Masalah
Berdasarkan uraian latar belakang diatas maka dapat diidentifikasi beberapa
permasalahan sebagai berikut:
1. Berbagai macam aplikasi senyawa TiO2 dalam kehidupan sehari-hari
seperti: degradasi senyawa organik, fotokatalis, antiburam dan
antibakteri.
2. Zat pensensitif (sensitiser) yang digunakan dalam sintesis TiO2
3. Berbagai macam metode yang digunakan dalam sintesis TiO2.
4. Temperatur sintesis TiO2
5. Waktu sintesis TiO2
6. pH sintesis TiO2.
7. Prekursor yang digunakan.
C.Pembatasan Masalah
Berdasarkan identifikasi masalah diatas, maka dapat dikemukaan batasan
6
1. Aplikasi yang digunakan dalam senyawa TiO2 adalah aktivitas
antiburam.
2. Zat pensensitif (sensitiser) yang digunakan adalah perak klorida
3. Metode yang digunakan dalam sintesis TiO2 ini adalah metode
pengendapan dengan teknik refluks.
4. Temperatur yang digunakan adalah 150oC.
5. Waktu sintesis TiO2 adalah 6 jam.
6. pH sintesis TiO2 dalam kondisi pH asam.
7. Prekursor yang digunakan adalah TiO2.
D.Perumusan Masalah
Berdasarkan batasan masalah, maka dapat dirumuskan beberapa
permasalahan sebagai berikut:
1.Bagaimana pengaruh penambahan variasi perak pada sintesis TiO2@AgCl
dalam suasana pH asam terhadap karakter produk yang dihasilkan?
2.Bagaimana aktivitas fotokatalis TiO2@AgCl yang dihasilkan dengan
berbagai variasi penambahan perak sebagai material antiburam?
E.Tujuan Penelitian
Tujuan yang diharapkan dari penelitian ini adalah:
1.Mengetahui pengaruh penambahan variasi perak pada sintesis
TiO2@AgCl dalam suasana pH asam terhadap karakter produk yang
7
2.Mengetahui aktivitas fotokatalis TiO2@AgCl yang dihasilkan dengan
berbagai variasi penambahan perak sebagai material antiburam.
F. Manfaat Penelitian
Manfaat yang diperoleh dalam penelitian ini adalah:
1. Memberikan informasi tentang sintesis TiO2@AgCl dalam suasana pH
asam pada berbagai variasi penambahan perak terhadap karakter produk
yang dihasilkan.
3.Memberikan informasi tentang aktivitas fotokatalis TiO2@AgCl yang
dihasilkan dengan berbagai variasi penambahan perak sebagai material
8
BAB II
TINJAUAN PUSTAKA
A.Deskripsi Teori
1. Titanium dioksida (TiO2)
Titanium dioksida (TiO2) merupakan padatan berwarna putih mempunyai
berat molekul 79,90 gram/mol, densitas 4.26 g/cm3, tidak larut dalam HCl, HNO3
dan akuaregia tetapi larut dalam asam sulfat pekat membentuk titanium sulfat
(TiSO4). Titanium (Ti) adalah unsur logam transisi yang dapat membentuk ion
titanium (III) atau (Ti3+) dan titanium (IV) atau (Ti4+). Ion titanium (III) dicirikan
dengan warna lembayung, sedangkan ion titanium (IV) tidak berwarna. Ion Ti(III)
dalam air bersifat kurang stabil dan mudah mengalami oksidasi menjadi titanium
(IV). Ion Ti(IV) berada hanya dalam larutan yang bersifat sangat asam (pH < 2,5)
dan dapat terhidrolisis mula–mula membentuk ion titanil (TiO2+) selanjutnya
membentuk kesetimbangan dengan Ti(OH)22+ dan Ti4+ atau TiO2.nH2O (Cotton et
al., 1999).
Titanium dioksida merupakan material kristalin yang dilaporkan memiliki
tujuh bentuk polimorf, empat bentuk ditemukan di alam dan sisanya sintetik
(Ahonen, 2001). Dari empat bentuk alami tersebut hanya tiga yang terlibat dalam
sintesis anorganik yaitu, anatas, rutil dan brookit. Anatas dan rutil telah secara
luas dipelajari untuk berbagai aplikasi fotokatalis. Brookit tidak begitu dikenal
secara umum dan belum banyak digunakan dalam aplikasi fotokatalis. Anatas dan
rutil mempunyai struktur kristal tetragonal, sedangkan brookit mempunyai
9
struktur tersusun atas oktahedral TiO62- yang saling berhimpitan antara bagian tepi
dan sudutnya untuk rutilsedangkan anatashanya pada bagian tepinya seperti yang
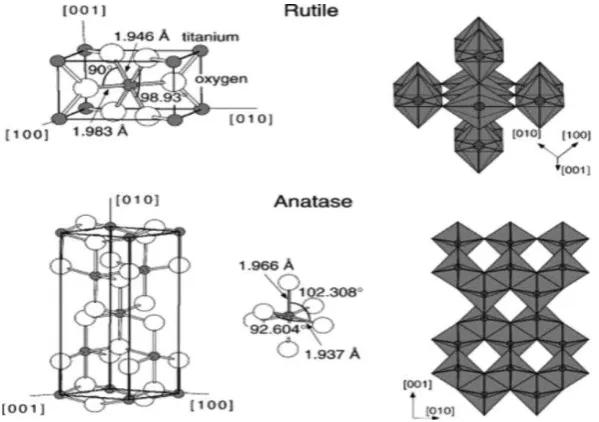
terlihat pada Gambar 1 (Diebold, 2003).
Gambar 1. Struktur kristal rutil dan anatas
Struktur rutil dan anatas dapat digambarkan dalam rantai TiO62- okahedral.
Kedua struktur berbeda karena distorsi dari masing-masing rantai oktahedron.
Setiap ion Ti4+ dikelilingi oleh oktahedral 6 dan ion O2-. Rantai oktahedral pada
rutil tidak teratur, menunjukkan sedikit distorsi ortorombik sedangkan pada anatas
distorsi orthorombiknya cukup besar sehingga relatif tidak simetri. Distorsi
orthorombik menyebabkan terjadinya perbedaan luasan aktif, karena luasan aktif
anatas lebih besar daripada rutil sehingga memiliki simetri geometris yang lebih
mendukung untuk mengadsorbsi cahaya (Linsebigler et al., 1995). Jarak antara
Ti-Ti anatas lebih besar dibandingkan dengan rutil (3,79 dan 3,04 Å dengan 3,57
10
dan 1,980 Å dengan 1,949 dan 1,980 Å). Cherepy et al. (1997) menyatakan
bahwa setiap oktahedral pada struktur rutil dikelilingi oleh 10 oktahedron
tetangga, sedangkan pada struktur anatas setiap oktahedronnya dikelilingi 8
oktahedron lainnya.
Perbedaan struktur anatas dan rutil menyebabkan perbedaan massa jenis dan
struktur pita elektroniknya antara dua bentuk titanium (IV) oksida, yaitu anatas
mempunyai daerah aktivasi yang lebih luas dari pada rutil. Hal ini menyebabkan
titanium (IV) oksida jenis anatas lebih reaktif dibandingkan dengan jenis rutil.
Selain itu, menurut Linsebigler et al. (1995) anatas merupakan tipe yang paling
aktif dikarenakan memiliki band gap energi (celah pita energi yang
menggambarkan energi cahaya minimum yang dibutuhkan untuk mengeksitasi
elektron) sebesar 3,2 eV (lebih dekat ke sinar UV, panjang gelombang maksimum
388 nm), sedangkan rutil 3,0 eV (lebih dekat ke sinar tampak, panjang gelombang
maksimum 413 nm). Perbedaan ini membuat letak conduction band (CB : tingkat
energi hasil hibridisasi yang berasal dari kulit 3d titanium) dari anatas lebih tinggi
daripada rutil, sedangkan valence band (VB : tingkat energi hasil hibridisasi dari
kulit 2p oksigen) dari anatas dan rutil sama yang membuat anatas mampu
mereduksi oksigen molekular menjadi superoksida serta mereduksi air menjadi
hidrogen.
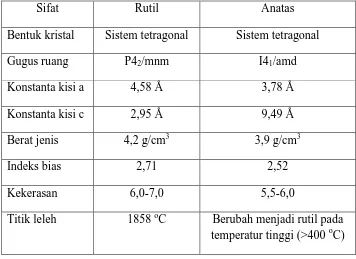
Perbandingan struktur dan sifat fisik dari titanium dioksida jenis rutil dan
11
Tabel 1. Perbandingan struktur dan sifat fisik TiO2 rutil & anatas
Sifat Rutil Anatas
Bentuk kristal Sistem tetragonal Sistem tetragonal
Gugus ruang P42/mnm I41/amd
Konstanta kisi a 4,58 Å 3,78 Å
Konstanta kisi c 2,95 Å 9,49 Å
Berat jenis 4,2 g/cm3 3,9 g/cm3
Indeks bias 2,71 2,52
Kekerasan 6,0-7,0 5,5-6,0
Titik leleh 1858 oC Berubah menjadi rutil pada
temperatur tinggi (>400 oC)
2. Perak Klorida
Perak halida (AgX) terkenal sebagai material yang peka terhadap cahaya
dan secara luas digunakan sebagai fotosensitizer, prekursor logam perak, dan
sumber bahan pada fotografis film. Dalam proses fotografis, perak halida
menyerap foton dan melepaskan elektron serta hole. Salah satu contoh golongan
perak halida yang digunakan adalah perak klorida.
Perak klorida (AgCl) diendapkan dari larutan perak nitrat dengan ion
klorida. Perak klorida memiliki direct band gap sebesar 5,6 eV dan inderect band
gap sebesar 3,25 eV (Tejeda et al., 1975), sehingga diakui secara luas sebagai
material fotosensitif dan sumber bahan pada fotografis film. Selain itu, beberapa
12
menunjukkan peningkatan aktivitas fotokatalisnya di bawah cahaya tampak untuk
degradasi polutan organik (Gao et al., 2011).
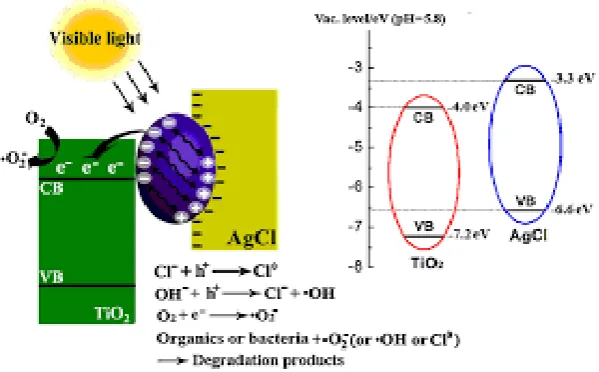
Mekanisme reaksi yang diusulkan dalam fotokatalis AgCl@Ag@TiO2
untuk degradasi polutan organik (atau bakteri) digambarkan secara skematis pada
Gambar 2 (Marimoto et al., 2007).
Gambar 2. Mekanisme degradasi polutan organik pada AgCl@Ag@TiO2
Berdasarkan Gambar 2 terjadi iradiasi dibawah cahaya tampak, sehingga
Ag NPs menghasilkan elektron dan hole yang dapat dipisahkan oleh medan
electromagnetik. Menurut penelitian Marimoto et al. (2007), tepi pita konduksi
dan pita valensi dari AgCl (-3,3eV dan -6,6 eV) lebih tinggi dibandingkan TiO2
(-4,0 eV dan -7,2 eV). Hal ini karena kesesuaian tingkat energi CB dan VB dari
AgCl dan TiO2. Terbentuknya elektron akibat iradiasi cahaya tampak ditransfer ke
TiO2 sementara hole ditransfer ke AgCl, dengan demikian, elektron dan hole
dapat dipisahkan. Selanjutnya, elektron terperangkap dan diserap oleh O2
13
*
OH / atau radikal Clo. Semua spesises *O2-, *OH, dan Clo reaktif untuk degrdasi
polutan organik (atau bakteri).
3. Fotoaktivitas Titanium Dioksida a. Fotokatalis
Fotokatalis merupakan suatu proses kombinasi antara proses fotokimia dan
katalisis, yaitu suatu proses secara kimiawi dengan melibatkan cahaya sebagai
pemicu dan katalis sebagai pemercepat proses transformasi tersebut (Slamet dkk.,
2007). Berdasarkan jenis katalis yang digunakan, proses fotokatalik terdiri dari
fotokatalitik homogen dan fotokatalitik heterogen. Fotokatalik homogen adalah
fotokatalis yang berlangsung pada suatu sistem dalam satu fasa dan biasanya
dengan bantuan zat pengoksidasi seperti ozon dan hidrogen peroksida, sedangkan
pada proses fotokatalitik heterogen, katalis tidak berada pada satu fasa dengan
medium dan reaktan. Konsep degradasi fotokatalis ini cukup sederhana, yaitu
iradiasi padatan semikonduktor yang stabil menstimulasi reaktan antara fasa
permukaan padat atau larutan (Vora et al., 2009).
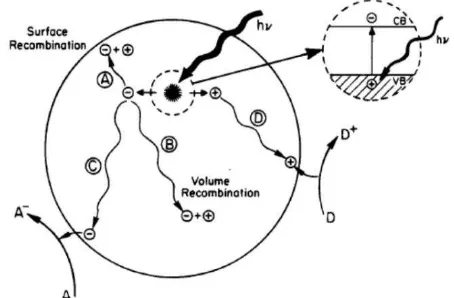
Secara umum, fenomena fotokatalitik pada permukaan semikonduktor dapat
dilihat pada Gambar 3 ((Linsebigler et al., 1995). Jika suatu semikonduktor tipe n
dikenai cahaya (hν) dengan energi yang sesuai, maka electron (e-) pada pita valensi akan pindah ke pita konduksi dan meninggalkan lubang positif (hole
disingkat sebagai h+) pada pita valensi. Sebagian besar pasangan e- dan h+ ini
akan berekombinasi kembali, baik di permukaan (jalur A) atau di dalam bulk
partikel (jalur B). Sementara itu sebagian pasangan e- dan h+ dapat bertahan
sampai pada permukaan semikonduktor (jalur C dan D). Pada jalur C elektron
14
organik/anorganik, sehingga spesies tersebut mengalami reduksi. Pada jalur D
lubang positif pergi ke permukaan semikonduktor dan berikatan dengan spesies
donor elektron, sehingga spesies tersebut mengalami oksidasi. Sehingga h+
menginisiasi reaksi oksidasi dan e- akan menginisiasi reaksi reduksi zat kimia
[image:30.595.220.447.228.377.2]yang ada di sekitar permukaan semikonduktor (Gunlazuardi, 2001).
Gambar 3. Skema fotoeksitasi yang diikuti oleh deeksitasi pada permukaan semikonduktor
Mekanisme migrasi elektron dari pita valensi ke pita konduksi dan setelah
mengalami eksitasi, elektron bermigrasi menuju logam dan terperangkap dalam
logam, sehingga rekombinasi electron-hole dapat ditekan dan h+ akan leluasa
berdifusi ke permukaan semikonduktor. Pada permukaan tersebut akan terjadi
oksidasi senyawa-senyawa yang digedrasi. Pada prinsipnya, reaksi oksidasi pada
permukaan semikonduktor dapat berlansung melalui donasi elektron dari substrat
ke h+ (menghasilkan radikal pada substrat yang akan menginisiasi reaksi
berantai). Apabila potensial oksidasi yang dimiliki oleh h+ pada pita valensi ini
cukup besar untuk mengoksidasi air dan gugus hidroksil pada permukaan partikel
15
Secara umum, reaksi fotokatalik terbagi atas empat tahapan (Hoffmann et
al., 1995) yaitu:
1) Reaksi pembentukan pembawa muatan (e-cb, h
+
vb) oleh foton
TiO2 + hν h+vb + e-cb
2) Reaksi penjebakan pembawa muatan. Hole pada pita valensi terjebak
dalam gugus titanol
h+vb + >TiIVOH {>TiIVOH•}+
Elektron pada pita konduksi terjebak pada permukaan metastabil
e-cb + >TiIVOH {>TiIIIOH}
e-cb + >TiIV >TiIII
3) Rekombinasi pembawa muatan dengan membebaskan energi dalam
bentuk panas
e-cb + {>TiIVOH•}+ >TiIVOH
h+vb + {>TiIIIOH•} >TiIVOH
4) Transfer muatan antar muka
Reaksi oksidasi oleh hole pada pita valensi
{TiIVOH•}+ + >TiIVOH+Red•+
Reaksi reduksi oleh elektron pada pita konduksi
e-tr + Oks >TiIVOH + Oks•-
Keterangan :
>TiOH : permukaan TiO2 dalam keadaan terhidrat
e-cb : elektron pada pita konduksi
h+vb : lubang (hole) positif pada pita valensi
e-tr : elektron pada pita konduksi yang terjebak
16
{TiIIIOH} : elektron pita konduksi yang terjebak di permukaan
Red : donor elektron
Oks : akseptor elektron
b. Fotohidrofil
Film tipis TiO2 dapat mengurai air menjadi butiran-butiran kecil yang
ditandai dengan berkurangnya sudut kontak air-permukaan film tipis TiO2 dengan
kehadiran sinar ultra violet. Fenomena ini ditemukan pertama kali oleh Grup
Fujishima (Wang et al., 1998) yang dikenal sebagai fotohidrofilisitas yaitu
perubahan sifat hidrofob-hidrofil dari partikel TiO2 akibat sinar UV. Proses
fotohidrofil pada permukaan film TiO2 berlangsung cepat sehingga sering
dikatakan sebagai superfotohidrofil.
Berdasarkan karakter superfotohidrofil tersebut, lapisan tipis TiO2
dimanfaatkan untuk proses degradasi zat organik, salah satunya pada permukaan
kaca (Guan, 2005). Hal ini sesuai dengan penelitian yang dilakukan oleh Feng
(2004) bahwa fotokatalis TiO2 memiliki sifat swa-bersih dan anti-kabut yang
dibuktikan dengan kemampuan TiO2 untuk membersihkan polutan dengan
sendirinya. Selain itu, TiO2 secara luas juga digunakan sebagai fotokatalis untuk
konversi energi matahari dan material antiburam. Secara teoritik material
antiburam terjadi sebagai akibat proses fotokatalis yang menyebabkan permukaan
lapis tipis TiO2 bersifat polar atau hidrofilik (suka air). Sifat hidrofilik dan
hidrofobik salah satunya ditandai dengan ukuran sudut kontak butiran air pada
permukaan lapisan tipis TiO2 (Wang et al., 1997).
Sudut kontak air pada lapis tipis TiO2 di permukaan benda sekitar puluhan
17
menyebar rata pada permukaan bahan daripada membentuk partikel-partikel
berupa butiran. Akhirnya sudut kontak air akan mendekati 0o dan pada keadaan
ini permukaan bahan menjadi sama sekali tidak menolak air dan berada dalam
keadaan superhidrofilik ( sangat suka dengan air). Bahan tersebut akan bertahan
beberapa jam dengan sifat tersebut meskipun sinar UV dipadamkan. Perlahan
dalam keadaan gelap permukaan tersebut akan bersifat hidrofobik lagi, namun
sifat superhidrofilik dapat diperoleh kembali dengan bantan sinar UV (Fujishima
et al., 1999).
Turunnya sudut kontak air di permukaan TiO2 disebabkan oleh terbentuknya
pasangan elektron-lubang positif (hole), dimana elektron mereduksi Ti(IV)
menjadi Ti(III), sedangkan kekosongan (h+) mengoksidasi O2- menjadi O2
menghasilkan kekosongan oksigen dipermukaan (Carp et al., 2004). Adanya
kekosongan oksigen (oxygen vacancies) tersebut, permukaan menjadi lebih
hidrofilik karena dapat dengan mudah mengisi tempat kosong dan menghasilkan
grup OH teradsorpsi. Dengan adanya gaya Van der Waals dan ikatan hidrogen
maka gugus OH teradsorpsi dapat berikatan dengan air yang datang ke permukaan
(Guan, 2005). Kondisi ini akan menyebabkan air tidak berbentuk butiran
melainkan terdispersi sehingga mencegah terjadinya pembentukan kabut (anti
fogging). Air yang terdispersi sewaktu turun akan dengan mudah membawa serta
partikel-partikel debu yang menempel di permukaan fotokatalis serta spesi-spesi
18
4. Difraksi Sinar-X
Sinar-X merupakan gelombang elektromagnetik dengan panjang gelombang
pendek sebesar 0,7 sampai 2,0 Å yang dihasilkan dari penembakan logam dengan
e- berenergi tinggi kemudian e- ini mengalami pengurangan kecepatan dengan
cepat dan energinya diubah menjadi energi foton sehingga energinya besar (lebih
besar daripada energi sinar UV-Vis) dan tidak mengalami pembelokkan pada
medan magnet (Jenkins, 1988).
Teknik difraksi sinar-X merupakan salah satu metoda karakterisasi material
yang digunakan untuk menganalisis struktur kristal dalam material dengan cara
menentukan parameter kisi serta untuk mendapatkan ukuran partikel dengan
mempelajari keteraturan atom atau molekul dalam suatu struktur tertentu. Apabila
dalam analisis pola difraksi unsur diketahui maka unsur tersebut dapat ditentukan
(Smallman & Bishop, 2000).
Prinsip dasar dari XRD adalah hamburan elektron yang mengenai permukaa
kristal. Bila sinar-X dilewatkan ke permukaan kristal, sebagian sinar tersebut akn
dihamburkan dan sebagian lagi akan berinteraksi secara konstruktif (menguatkan)
dan destruktif (melemahkan) ((Vlack, 2004). Hamburan sinar yang berinteraksi
konstruktif inilah yang digunakan untuk analisis. Interferensi konstruktif terjadi
apabila berkas sinar-X yang dihamburkan berada dalam keadaan satu fasa seperti
terlihat pada Gambar 4. Interferensi konstruktif terjadi sesuai dengan Hukum
Bragg berikut ini :
19
dimana, n= urutan difraksi, λ= panjang gelombang sinar-X, d= jarak antar bidang
[image:35.595.206.388.143.258.2]kristal, dan θ= sudut difraksi.
Gambar 4. Difraksi sinar-X pada suatu kristal
Ukuran kisi kristal juga dapat ditentukan dari difraksi sinar-X yaitu dengan
menggunakan persamaan Scherrer (Manorama et al., 2002) :
D=
... (2)
Keterangan :
D = Rata-rata ukuran kristal (nm)
K = konstanta (0,94)
λ = Panjang gelombang sinar-X (nm)
β= Lebar puncak pada setengah intensitas
θ = sudut Bragg.
Difraksi sinar-X sangat penting pada identifikasi senyawa kristalin.
Kekuatan dari cahaya yang terdifraksi tergantung pada kuantitas material kristalin
yang sesuai di dalam sampel sehingga sangat mungkin mendapatkan analisa
20
5. Spektrofotometer UV-Vis
Spektrofotometer UV-Vis merupakan alat yang digunakan untuk mengukur
panjang gelombang dan intensitas penyerapan sinar-UV serta cahaya tampak.
Eksitasi elektron dalam orbital molekul dari tingkat energi dasar ke tingkat energi
yang lebih tinggi dapat terjadi akibat penyerapan sinar tampak atau ultraviolet
oleh molekul tersebut. Hasil pengukuran UV-Vis berupa hubungan antara panjang
gelombang terhadap transmisi spektrum absorbansi yang dapat digunakan sebagai
pengukuran awal untuk menentukan besarnya energi celah pita.
Suatu spektrofotometer tersusun dari sumber spektrum tampak yang
kontinu, monokromator sel pengadsorpsi untuk sampel atau blanko dan suatu alat
untuk mengukur perbedaan absorbsi antara sampel dan blanko atau pembanding
(Khopkar, 1990). Prinsip dasar spektrofotometer UV-Vis yaitu jika suatu material
disinari dengan gelombang elektromagnetik maka cahaya akan diserap oleh
elektron dalam material sehingga menyebabkan elektron akan meloncat ke tingkat
energi yang lebih tinggi. Elektron tidak sanggup meloncat dari pita valensi jika
energi cahaya yang diberikan kurang dari lebar celah pita energi. Jika energi
cahaya yang diberikan lebih besar maka elektron akan meloncat ke pita konduksi.
Besarnya energi gap dapat ditentukan dengan metode spektrofotometer
UV-Vis Difusi Reflektensi. Metode ini didasarkan pada pengukuran intensitas UV-UV-Vis
yang direfleksikan oleh sampel. Reflektansi yang terukur merupakan reflektansi
standar dan di nyatakan dalam persamaan (3):
... (3)
21
... (4)
Dimana, F(R) adalah faktor Kubelka-Munk, k adalah koefisien absorbansi, s
adalah koefisien scattering, dan R adalah nilai reflektansi (Ilyas, 2011).
Persamaan ini memiliki hubungan dengan parameter k dan s, F(R’ ) = k/s,
sehingga persamaan (5) dapat ditulis:
... (5)
Spektrum UV-Vis Difusi Reflektansi berupa kurva hubungan antara k/s
melawan panjang gelombang (λ) atau absorbansi (A) melawan panjang
gelombang (λ) (Morales, 2007). Hubungan absorbansi (A) dengan reflektansi
dinyatakan dalam persamaan (6) di bawah ini:
log
= A ... (6)
Perhitungan dilakukan pada setiap sampel dengan menggunakan metode
Kubelka Munk dimana energi gap diperoleh dari grafik hubungan antara hv (eV)
vs (F(R’ )hv)1/2. Nilai hv (eV) ditentukan dengan persamaan berikut:
Eg= hν = ... (7)
Dimana, Eg adalah energi celah pita (eV), h adalah ketetapan Planck (6,624
x 10-34 Js atau 4,14 x10-15 eV.s), c adalah kecepatan cahaya di udara (3 x 108 m/s),
dan λ adalah panjang gelombang (nm). Energi celah pita semikonduktor adalah
besarnya hν pada saat (F(R’ )hν)1/2
= 0, yang diperoleh dari persamaan regresi
22
B.Penelitian Yang Relevan
Titanium dioksida berbasisi medium air berhasil disintesis dengan metode
sol-gel dan etilen glikol sebagai surfaktan pada berbagai pH 1,5; 2,7; dan 5,0
selama 2 jam pada temperatur 170oC, dan dilanjutkan dengan variasi waktu
refluks pH 1,5 yaitu 8, 16, dan 24 jam menghasilkan TiO2 berbentuk anatas
dengan ukuran kristal sebesar 2-5 nm serta kristalinitas paling tinggi dari pola
XRD ditunjukkan pada pH 1,5 dengan waktu refluks 16 jam (Hendra Adi
Pratama, 2010).
Sangchaya et al. (2012) berhasil mensintesis serbuk TiO2-AgCl dengan
metode sol gel untuk degradasi fotokatalis metil biru (MB) dengan
membandingkan pada TiO2 komersial P25. Hasil menunjukkan bahwa aktifitas
fotokatalik serbuk TiO2-AgCl lebih efisien untuk degradasi fotokatalis metil biru
dibawah UV dan sinar tampak dengan laju reaksi fotokatalitik yang dihasilkan
sebesar 0,47 lebih tinggi dibandingkan dengan TiO2 komersial P25 sebesar 0,12.
Beberapa peneliti yang lainnya seperti Cao et al. (2011) mensintesis
AgI/AgCl/TiO2 dengan metode pertukaran ion menunjukkan bahwa TiO2
memiliki energi celah pita (Eg=3,12 eV), disisi lain EVB dari AgCl@TiO2 yaitu
2,87 eV terjadi ketika h+ berpindah dari VB AgCl ke TiO2.
Titanium dioksida yang dikontrol dengan poli-etilen glikol (PEG)
mempunyai sifat superhidrofil. Pada percobaan tetes air pada kaca preparat yang
dilapisi dengan suspensi TiO2 menunjukkan terjadinya penurunan sudut kontak air
23
satu bulan sudut kontak air kembali menurun dengan cepat ke sudut 0o, disis lain
sudut kontak pada kaca yang tidak dilapisi masih 30o (Gan et al., 2007).
C.Kerangka Berfikir
Titanium tetraklorida yang direaksikan dengan H2O2 akan menghasilkan
prekursor TiO2. Prekursor TiO2 yang terbentuk masih mengandung ion Cl- yang
terabsorbsi pada permukaan TiO2. Ion Cl- yang terabsorbsi pada permukaan TiO2
ini berasal dari hasil samping reaksi TiCl4 dengan H2O2 pada saat pembuatan
prekursor. Preparasi AgCl di permukaan TiO2 dilakukan dengan penambahan
AgNO3 sebagai sumber perak dengan pengontrolan pH asam menggunakan
larutan HNO3. Adanya ion Ag+ dari AgNO3 akan berikatan dengan ion Cl- yang
terabsorbsi pada permukaan TiO2 membentuk AgCl yang dapat bertindak sebagai
sensitiser. Sensitiser AgCl diharapkan dapat menggeser respon absorbsi TiO2 dari
sinar UV ke sinar tampak. Adanya Penambahan variasi persen mol perak 1,5%,
3%, 6%, 9% dan TiO2 tanpa perak sebagai kontrol sangat diperlukan untuk
mengetahui kemampuan optimum dari ion Cl- yang dapat bereaksi dengan ion
24
BAB III
METODE PENELITIAN
A.Subjek dan Objek Penelitian 1. Subjek Penelitian
Subjek penelitian pada penelitian ini adalah padatan TiO2-tersensitifkan
perak klorida (TiO2@AgCl).
2. Objek Penelitian
Objek penelitian pada penilitian ini adalah karakteristik fisik dan aktivitas
antiburam TiO2-tersensitifkan perak klorida (TiO2@AgCl).
B.Variabel Penelitian 1. Variabel Bebas
a. Variabel bebas dalam penelitian ini adalah TiO2-tersensitifkan perak
klorida dengan variasi penambahan persen mol perak yaitu: 0% (P1); 1,5% (P2); 3% (P3); 6% (P4); dan 9% (P5).
b. Uji aktivitas antiburam dengan perlakuan sinar matahari dan sinar ultraviolet.
2. Variabel Terkontrol
Variasi terkontrol dalam penelitian ini adalah :
a. Temperatur sintesis 150°C
b. Waktu refluks selama 6 jam
25
3. Variabel Terikat
Variabel terikat pada penilitian ini adalah:
a. Variabel terikat pada penelitian ini adalah karakter fisik (struktur kristal,
ukuran kristal dan daerah serapan) padatan TiO2-tersensitifkan perak
klorida pada berbagai variasi penambahan persen mol perak.
b. Uji aktivitas antiburam pada kaca preparat dengan gradien penurunan
sudut kontak dalam waktu tertentu (t=0-40 menit).
C.Alat dan Bahan 1. Alat yang digunakan
a. Peralatan Gelas
b. Seperangkat Alat Refluks
c. Neraca Analitik
d. Magnetic Stirrer
e. Pemanas
f. pH meter
g. Termometer
h. Kaca Preparat
i. Kamera
j. XRD Rigaku Multiflek merk S-6000
26
2. Bahan yang digunakan
a. TiCl4 (Merck)
b. AgNO3 (Merck)
c. H2O2 (Merck)
d. Akuades
e. HNO3
f. Minyak Parafin
g. Tetrametilammonium Hidroksida
h. Aseton
i. Etanol
D.Prosedur Penelitian 1. Preparasi prekursor TiO2
a. Titanium tetraklorida (TiCl4) sebanyak 100 ml dimasukkan ke dalam gelas
ukur 250 ml.
b. Di dalam lemari asam, larutan H2O2 dipersiapkan dalam buret.
c. Kemudian larutan H2O2 ditambahkan tetes demi tetes ke dalam gelas ukur
yang berisi larutan TiCl4 hingga terbentuk endapan berwarna kuning.
d. Proses penyaringan dilakukan setelah endapan terbentuk dan mengeringkan
27
2. Sintesis TiO2 tersensitifkan perak klorida
a. Sebanyak5gram TiO2 dimasukkan ke dalam gelas ukur berukuran 250 ml.
Ke dalam gelas ukur, dimasukkan akuades sebanyak 50 ml dan diaduk
selama 1 jam dengan pengaduk magnet sebagai larutan (a).
b. Larutan (a) dimasukkan ke dalam labu leher tiga dan ditambahkan akuades
serta larutan HNO3 tetes demi tetes hingga diperoleh pH 1,2 sebagai larutan
(b)
c. Sejumlah gram AgNO3 (variasi penambahan persen mol perak yaitu: P1, P2,
P3, P4, dan P5) dilarutkan dengan akuades pada gelas ukur yang kemudian
ditambahkan tetrametil ammonium hodroksida, sebagai larutan (c)
d. Larutan (c) dicampurkan ke dalam larutan (b) hingga volume total larutan
sebanyak 100 ml.
e. Larutan campuran (larutan c dan b) diaduk dengan pengaduk magnet dan
direfluks pada temperatur 150oC selama 6 jam.
f. Larutan hasil refluks selanjutnya didinginkan dan didekantasi, kemudian
dikeringkan dengan menggunakan oven pada temperatur 110oC.
g. Kristal yang terbentuk dikarakterisasi dengan menggunakan XRD dan
spektrofotometer UV-Vis Diffuse Reflectance.
3. Uji aktivitas antiburam larutan pada TiO2 tersensitifkan perak klorida
a. TiO2@AgCl dengan variasi penambahan persen mol perak P1, P2, P3, P4,
dan P5 ditimbang sebanyak 0,03 gram kemudian dimasukkan ke dalam
28
b. Akuades sebanyak 50 ml dimasukkan ke dalam gelas ukur sambil diaduk
hingga terbentuk suspensi TiO2-tersensitifkan perak klorida.
c. Lima buah kaca preparat dicelupkan ke dalam masing-masing suspensi TiO2
dengan varisasi penambahan persen mol perak P1, P2, P3, P4, dan P5
sedangakan satu kaca preparat tanpa dilakukan pencelupan dengan suspensi
TiO2 sebagai kontrol.
d. Enam kaca preparat selanjutnya dikeringkan pada temperatur kamar.
e. Ditetesi satu tetes air pada masing-masing kaca preparat.
f. Enam kaca preparat disinari dengan sinar UV.
g. Diamati pengurangan sudut kontak air dengan permukaan kaca preparat
menggunakan kamera berdasarkan berjalannya waktu hingga sudut kontak
air berkurang , untuk pertama penetesan air dihitung t=0 menit sampai t=40
menit.
h. Langkah diatas diulangi untuk perlakuan dengan sinar matahari.
E. Diagram Alir
1. Preparasi Prekursor TiO2
+
Gambar 5. Diagram alir preparasi prekursor TiO2
100 ml TiCl4
H2O2
pekat
Saring dan keringkan dalam oven pada suhu 80oC sampai kering
29 2. Sintesis TiO2 Tersensitifikasi Perak Klorida
[image:45.595.119.500.108.435.2]+
Gambar 6. Diagram alir sintesis TiO2-tersensitifkan perak klorida
3. Uji Aktifitas Antiburam TiO2 Tersensitifkan Perak Klorida
[image:45.595.113.549.467.687.2]
+
Gambar 7. Diagram alir uji aktivitas antiburam TiO2
tersensitifkan perak klorida 5 gram TiO2
+ 50 ml aquades
HNO3 + % AgNO3
(P1, P2, P3, P4, P%) + tetrametil ammonium hidroksida
Diaduk selama 1 jam
Refluks temperatur 150oC selama 6 jam
Didinginkan dan didekantasi
Dikeringkan dalam oven pada temperatur 110oC
XRD (X-Ray Diffraction)
Spektrofotometer UV-Vis Diffuse
Reflectance
0,03 gram TiO2
(variasi perak P1, P2, P3, P4, P5)
50 ml akuades
Aduk sampai terbentuk suspensi
Keringkan dalam suhu kamar
Tetesi air di atas permukaan kaca
preparat Sinari dengan sinar
UV dan matahari. Foto sudut kontak air pada
permukaan setiap 4 menit sekali selama 40 menit
Celupkan kaca preparat dalam suspensi TiO2
30
F. Teknik Analisis Data
1. Penentuan Struktur, Ukuran dan Parameter Kisi dengan X-Ray
Diffraction (XRD)
Penentuan difraktogram TiO2 direkam dengan difraktometer sinar-x Merk
Rigaku Multiflek S-6000 dengan radiasi Cu Kα (1,5405981 Å) dari daerah 2θ=
20o-80o dengan interval 0,02o. Metode ini dapat digunakan untuk menentukan
ukuran kristal dengan menggunakan persamaan Scherrer :
D=
... (8)
dimana K adalah konstanta Scherrer = 0,94; λ merupakan panjang gelombang
sinar-X yang digunakan (λ Cu = 0,15406 nm); β adalah puncak pada setengah
tinggi intensitas (FWHM = Full Width at a Half Maximum); dan θ adalah sudut
difraksi.
2. Penetapan Energi Celah Pita Berbagai Fasa TiO2 Terhadap Sinar Tampak.
Besarnya energi celah pita dapat ditentukan dengan metode
spektrofotometer UV-Vis Difusi Reflektansi. Metode ini didasarkan pada
pengukuran intensitas UV-Vis yang direfleksikan pada sampel. Perhitungan
dilakukan pada setiap sampel dengan menggunakan metode Kubelka Munk
dimana energi celah pita diperoleh dari grafik hubungan antara hν (eV) vs
(F(R’ hν)1/2
. Persamaan Kubelka-Munk dapat dituliskan sebagai berikut:
31
3. Uji Antiburam TiO2@AgCl Hasil Sintesis
Teknik analisa data uji aktivitas antiburam dilakukan dengan cara mengukur
sudut kontak air pada permukaan kaca preparat menggunakan program corel draw
dengan Angular Dimension Tool. Hasil pengukuran sudut kontak air selanjutnya
dibuat grafik hubungan antara sudut kontak dengan waktu (menit) untuk
mengetahui perbedaan kecepatan penurunan sudut kontak dari masing-masing
32
BAB IV
HASIL DAN PEMBAHASAN
A.Preparasi Prekursor TiO2
Pembuatan prekursor menjadi langkah awal dalam sintesis titanium dioksida
(TiO2). Prekursor dapat diperoleh dengan cara meneteskan sedikit demi sedikit
larutan hidogen peroksida (H2O2) yang berlebih ke dalam larutan titanium
tetraklorida (TiCl4). Menurut Gao et al. (2007) titanium tetraklorida dapat
tereduksi oleh H2O2 membentuk Ti(O2)-O.2H2O. Akan tetapi, dalam penelitian ini
prekursor yang terbentuk adalah TiO2 fasa rutil dengan difraktogram XRD yang
diperoleh dapat dilihat pada penelitian Vina Ayu Mu’izayanti (2016). Berdasarkan
penelitian Cheng et al. (1995) bahwa keasaman tinggi yang berasal dari
konsentrasi TiCl4 yang tinggi mempengaruhi pembentukan fasa rutil, sedangkan
larutan dengan kisaran pH 3,4-8,2 menghasilkan fasa anatas. Hasil pengamatan
menunjukkan bahwa setelah ditambahkan H2O2 tetes demi tetes terbentuk
endapan berwarna kuning serta mengeluarkan gas berwarna putih. Endapan yang
terbentuk kemudian disaring dan dikeringkan dalam oven pada temperatur 80oC
untuk mengurangi kadar air yang terikat di dalam endapan. Endapan yang semula
berwarna kuning berubah menjadi putih.
B.Sintesis TiO2-Tersensitifkan Perak Klorida
Titanium dioksida tersensitifkan perak klorida dapat disintesis dengan
metode pengedapan teknik refluks. Teknik ini dilakukan dengan beberapa
33
TiO2 yang mengabsorbsi ion Cl- yang berasal dari hasil samping reaksi antara
TiCl4 dengan H2O2 pada saat pembuatan prekursor dalam 50 ml akuades dan
dilakukan pengadukan selama 1 jam. Kemudian larutan dimasukkan ke dalam
labu destilasi untuk dilakukan pengecekan pH awal prekursor, selanjutnya
menambahkan perak nitrat (AgNO3) sebagai sumber Ag dengan berbagai variasi
penambahan persen mol yaitu: P2, P3, P4, P5 dan TiO2 sebagai kontrol ke dalam
larutan. Adanya penambahan perak nantinya dapat mempengaruhi sintesis TiO2,
dikarenakan perak akanbereaksi dengan ion Cl- yang terabsorbsi pada permukaan
TiO2 membentuk AgCl. Pada penelitian ini dilakukan penambahan larutan HNO3
pekat tetes demi tetes untuk mengontrol pH dalam kondisi asam, seperti penelitian
Sangchaya et al. (2012) yang melakukan sintesis TiO2-AgCl dengan
menambahkan HNO3 2M sebagai pengontrol pH pada rentang pH 1-2. Kemudian
merefluks emulsi tersebut pada temperatur 150oC selama 6 jam pada pH 1,2
[image:49.595.218.395.471.676.2]seperti yang ditunjukkan pada Gambar 8.
Gambar 8. Proses refluks TiO2@AgCl
R (110)
34
Langkah kedua yaitu mendinginkan emulsi hasil refluks dan menuangkan
dalam cawan porselin. Emulsi tersebut didiamkan selama ± 24 jam untuk
memperoleh endapan. Selanjutnya dilakukan pengukuran pH setelah refluks untuk
memastikan pH dalam kondisi asam dan diperoleh pH sebesar 1,2 baik sesudah
maupun sebelum proses refluks. Endapan yang terbentuk kemudian didekantasi
dan dikeringkan di dalam oven pada temperatur 110oC sampai kering untuk
menghilangkan kadar air yang ada dalam endapan. Setelah kering endapan digerus
untuk mendapat serbuk TiO2.
Serbuk titanium dioksida hasil sintesis dikarakterisasi dengan
menggunakan XRD untuk mengetahui struktur kristal, ukuran kristalinitas dari
TiO2 hasil sintesis dan UV-Vis Diffuse Reflectance untuk mengetahui daerah
serapan dan energi celah pita.
C.Karakterisasin Hasil Sintesis TiO2 1. Analisis XRD
a. Data Kualitatif XRD
Analisa difraksi sinar-X dari TiO2 hasil sintesis dilakukan menggunakan
X-Ray Diffraction (XRD) pada kisaran daerah 20o-80o dengan sumber radiasi Cu-Kα
yang memiliki panjang gelombang karakterisasi radiasi Kα=1,54060Å. Pola
difraksi yang dihasilkan dari XRD kemudian dianlisis lebih lanjut dengan
membandingkan pola difraksi dengan pola standar pada data Powder Diffraction
File (PDF). Pola difraksi sinar-X dari semua sampel dengan variasi penambahan
35
penghalusan (smoothing) pada program Winplotr yang dapat dilihat pada Gambar
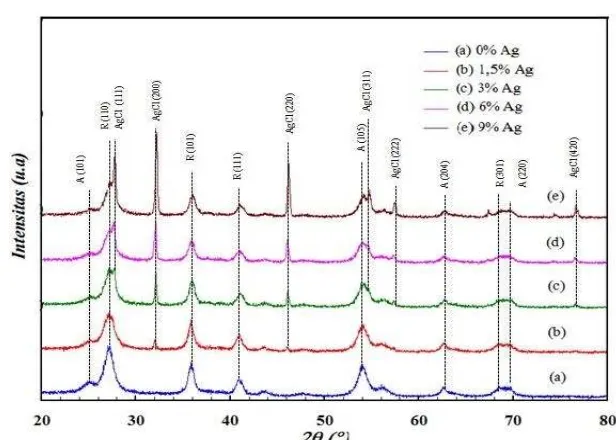
[image:51.595.147.455.132.352.2]9.
Gambar 9. Pola difraksi XRD sampel TiO2-tersensitifkan AgCl
Berdasarkan Gambar 9 menunjukkan adanya 3 fasa campuran yaitu anatas
rutil, dan AgCl pada sampel TiO2 dengan variasi penambahan perak P1, P2, P3,
P4, dan P5. Fasa rutil ditandai dengan puncak difraksi 2θ= 27,20o; 35,74o; 40,90o;
dan 68,24o dengan bidang hkl masing-masing (110), (101), (111), dan (301) yang
sesuai dengan data standar Sugiyama et al. (1991) PDF card no: 01-076-0322,
sedangkan pada fasa anatas didukung dengan munculnya puncak-puncak difraksi
pada daerah 2θ= 25,23o
; 53,90o; 62,63o; dan 70,30o dengan bidang hkl
masing-masing (101), (105), (204), dan (220) sesuai dengan data standar Khitrova et al.
(1977) PDF card no: 01-083-2243. Selain itu, pada sampel TiO2@AgCl dengan
variasi penambahan persen mol perak P2, P3, P4, dan P5 menunjukkan adanya
puncak difraksi tambahan pada daerah 2θ=27,85o
; 32,23o; 46,23o; 54,81o; 57,41o;
36
dan (420) yang sesuai dengan data standar Swanson PDF card no: 01-085-1355.
Adanya puncak-puncak difraksi tersebut mengindikasikan spesies AgCl dalam
struktur TiO2 hasil sintesis. Puncak difraksi ini adalah tajam dan intens yang
menunjukkan tingkat kristalinitas tinggi dari spesies AgCl. Berdasarkan penelitian
yang telah dilakukan oleh Tian & Zhang (2012) bahwa pada sampel AgCl,
Ag@AgCl, AgCl@TiO2, dan AgCl@Ag@TiO2 yang dikarakterisasi dengan XRD
menunjukkan adanya puncak difraksi yang identik dengan penilitian ini yaitu
2θ=27,80o
; 32,20o; 46,20o; 54,80o; 57,50o, dan 76,70o yang mengindikasikan
puncak dari AgCl.
Selain itu, adanya pengontrolan pH asam sebelum dan setelah refluks juga
mempengaruhi hasil dari masing-masing sampel TiO2 tersensitifkan AgCl dengan
variasi penambahan perak P1, P2, P3, P4, dan P5. Terlihat pada Lampiran 2
menunjukkan bahwa dengan adanya penambahan HNO3 sebagai pengontrol pH
asam menghasilkan fasa rutil yang lebih dominan dibandingkan dengan fasa
anatas dan AgCl. Sesuai dengan laporan penelitian dari (Wang et al., 2007; dan
Bae et al., 2003) yang menunjukkan bahwa adanya variasi pH larutan
menghasilkan pembentukan fasa yang berbeda dari TiO2. Hal ini dikarenakan
semakin rendah keasaman larutan atau bersifat basa maka struktur fasa yang
terbentuk adalah anatas, sedangkan semakin tinggi keasaman larutan maka fasa
yang terbentuk terarah ke fasa rutil. Hal ini ditandai dengan intensitas relatif fasa
rutil yang lebih tinggi. Variasi tinggi intensitas relatif tersebut juga menandai
37
Identifikasi bidang-bidang (hkl) dilakukan dengan mencocokan data
puncak difraksi dan intenistas I/Io dari percobaan dengan data standar PDF card
no: 01-076-0322 (rutil), 01-083-2243 (anatas), dan 01-085-1355 (AgCl) pada
setiap sampel TiO@AgCl dengan variasi penambahan perak P1, P2, P3, P4, dan
P5 yang dapat dilihat pada Tabel 2.
Analisis lebih lanjut dari data Tabel 2 dengan menggunakan bantuan
program U-FIT dapat ditentukan nilai parameter kisi dari masing-masing sampel
yang disajikan pada Tabel 3. Perhitungan nilai parameter kisi dan volume sel pada
program U-FIT dilakukan dengan mencocokkan data puncak difraksi dan
intensitas I/Io dari percobaan dengan data puncak difraksi teori yang telah ada
dalam program U-FIT dari masing-masing fasa kristal rutil, anatas, dan AgCl.
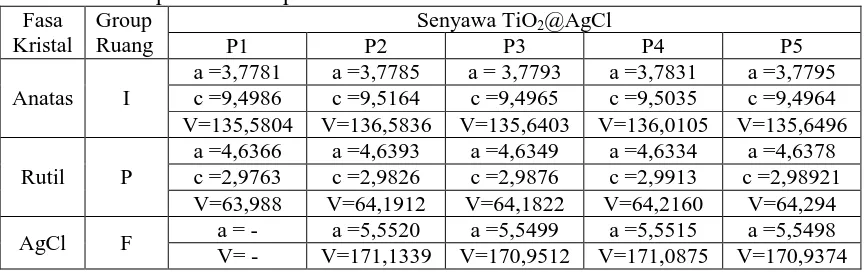
Tabel 3. Nilai parameter kisi (Å) dan volume sel TiO2@AgCl berbagai variasi
penambahan perak
Fasa Kristal
Group Ruang
Senyawa TiO2@AgCl
P1 P2 P3 P4 P5
Anatas I
a =3,7781 a =3,7785 a = 3,7793 a =3,7831 a =3,7795
c =9,4986 c =9,5164 c =9,4965 c =9,5035 c =9,4964
V=135,5804 V=136,5836 V=135,6403 V=136,0105 V=135,6496
Rutil P
a =4,6366 a =4,6393 a =4,6349 a =4,6334 a =4,6378
c =2,9763 c =2,9826 c =2,9876 c =2,9913 c =2,98921
V=63,988 V=64,1912 V=64,1822 V=64,2160 V=64,294
AgCl F a = - a =5,5520 a =5,5499 a =5,5515 a =5,5498
V= - V=171,1339 V=170,9512 V=171,0875 V=170,9374
Hasil parameter kisi dan volume sel pada Tabel 3 identik dengan data
penelitian yang telah dipaparkan oleh Khitrova et al. (1977) yaitu a=b= 3,7800 Å
dan c= 9,5100 Å dengan volume sel sebesar 135,883 untuk fasa anatas yang
memiliki grup ruang I41/amd. Menurut Sugiyama et al. (1991), pada fasa rutil
[image:53.595.85.517.427.565.2]38
volume sel sebesar 64,258 , sedangkan pada penelitian Swanson fasa AgCl yang
menunjukkan bahwa a= 5,5490 Å dengan volume sel sebesar 170,861 memiliki
grup ruang Fm3m. Nilai volume sel pada masing- masing sampel disajikan dalam
bentuk grafik hubungan antara variasi Ag dengan volume sel yang dapat dilihat
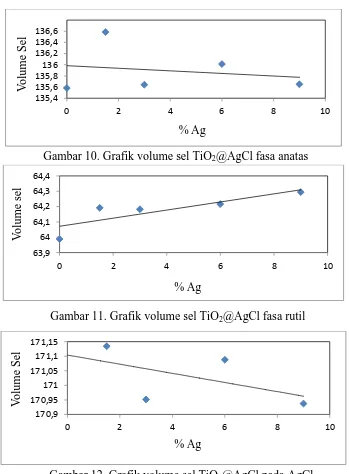
pada Gambar 10, 11, dan 12.
Gambar 10. Grafik volume sel TiO2@AgCl fasa anatas
[image:54.595.141.490.214.688.2]Gambar 11. Grafik volume sel TiO2@AgCl fasa rutil
Gambar 12. Grafik volume sel TiO2@AgCl pada AgCl 135,4 135,6 135,8 136 136,2 136,4 136,6
0 2 4 6 8 10
V olum e S el % Ag 63,9 64 64,1 64,2 64,3 64,4
0 2 4 6 8 10
V olum e sel % Ag 170,9 170,95 171 171,05 171,1 171,15
0 2 4 6 8 10
V
olum
e S
el
39
Tabel 2. Data bidang-bidang hkl , puncak difraksi, dan intensitas I/Io dari berbagai sampel penambahan Ag
Percobaan Teori
Hasil TiO2@AgCl (0%) TiO2@AgCl (1,5%) TiO2@AgCl (3%) TiO2@AgCl (6%) TiO2@AgCl
(9%) Anatas Rutil AgCl
2θ I/Io 2θ I/Io 2θ I/Io 2θ I/Io 2θ I/Io 2θ I/Io 2θ I/Io 2θ I/Io hkl
25,25 24,5 25,23 14,5 25,23 12,1 25,28 3,9 25,21 3,7 25,23 100,0 - - - - A (101)
27,15 100,0 27,19 100,0 27,19 100,0 27,20 63,0 27,21 30,4 - - 27,19 100,0 - - R (110)
- - - - 27,85 96,4 27,85 44,0 27,85 45,6 - - - - 27,83 49,6 AgCl (111)
- - 32,23 27,4 32,23 68,5 32,23 100,0 32,24 100,0 32,24 100,0 AgCl (200)
35,80 58,4 35,81 74,6 35,74 30,9 35,74 46,4 35,75 21,1 - - 35,69 44,9 - - R (101)
- - - 37,81 7,9 37,81 0,9 37,81 6,3 - - - A (004)
- - 38,64 2,5 - - 38,81 5,2 - - 38,61 11,8 38,83 6,3 - - A (112) /
R (200)
40,90 27,2 40,90 35,0 40,83 6,7 40,90 23,4 40,92 10,3 - - 40,81 17,2 - - R (111)
43,63 8,1 43,61 5,7 43,63 56,7 43,65 4,0 43,69 2,3 - - 43,61 6,2 - - R (210)
- - 46,17 16,1 46,23 5,1 46,17 60,3 46,18 68,4 - - - - 46,24 61,4 AgCl (220)
48,05 4,2 48,03 2,9 48,08 66,2 48,08 3,0 48,09 2,1 48,10 21,1 - - - - A (200)
53,93 2,6 53,90 74,2 53,90 18,7 53,90 47,1 53,85 22,1 53,92 11,3 - - - - A (105)
- - - 54,81 20,2 - - - - 54,83 19,0 AgCl (311)
56,05 61,3 56,13 4,1 56,13 15,1 56,13 13,5 56,13 5,5 - - 56,08 11,7 - - R (220)
- - 57,44 20,4 57,31 12,2 57,41 20,1 - - - - 57,49 18,2 AgCl (222)
62,63 17,1 62,60 23,7 62,68 11,2 62,65 12,6 62,66 7,0 62,75 4,4 - - - - A (204)
63,38 19,3 - - - 63,42 5,2 - - R (310)
- - - - 67,44 7,1 67,44 4,6 67,45 8,8 - - - - 67,46 7,4 AgCl (400)
68,27 2,2 68,24 13,5 68,24 14,1 - - 68,27 5,7 68,28 12,4 R (301)
70,31 16,9 70,23 19,3 70,30 3,0 - - 70,30 6,0 70,39 4,5 - - - - A (220)
- - - 68,94 15,1 - - - - 68,95 6,8 - - R (112)
- - 74,13 13,0 74,14 3,5 74,14 5,3 74,10 1,6 - - - - A (107)
76,15 16,5 - - - 76,15 2,1 - - - - A (301)
40
b. Data Kuantitatif XRD
Dari hasil analisis XRD dengan metode Reference Intensity Ratio (RIR)
diperoleh data kuantitatif berupa komposisi berat fasa anatas, rutil, dan AgCl
dengan penambahan variasi Ag (P1, P2, P3, P4, dan P5) yang dapat dilihat pada
Tabel 4 dan Lampiran 2. Metode Reference Intensity Ratio ( RIR) merupakan
metode yang digunakan untuk analisis kuantitatif dengan menggunakan
perbandingan nilai intesitas difraksi sampel dengan intensitas difraksi material
referensi. Metode Reference Intensity Ratio (RIR) menggunakan pengukuran
rasio area puncak untuk menetukan komposisi berat tiap fasa yang terkandung
[image:56.595.139.500.399.501.2]dalam sampel yang diuji.
Tabel 4. Data komposisi berat sampel TiO2@AgCl berbagai
variasi penambahan Ag
Senyawa Ag
(%)
Rutil (%)
Anatas (%)
AgCl (%)
TiO2@AgCl
P1 81,0 19,0 0,0
P2 89,0 10,0 1,3
P3 92,0 4,2 3,4
P4 87,0 4,4 8,3
P5 82,0 3,2 15,2
Berdasarkan data Tabel 4 menunjukkan bahwa sampel TiO2 dengan variasi
penambahan perak (P1, P2, P3, P4, dan P5) menghasilkan komposisi berat fasa
rutil yang lebih dominan dibandingkan dengan anatas dan AgCl. Hal ini
dipengaruhi oleh kondisi pH asam pada saat sintesis TiO2 tersensitifkan perak
klorida bahwa dengan adanya keasaman larutan yang tinggi maka fasa yang
terbentuk akan terarah ke fasa rutil. Akan tetapi, adanya penambahan Ag yang
masing-41
masing sampel TiO2 dengan variasi penambahan persen mol perak (P1, P2, P3,
P4, dan P5) dan fasa rutil pada sampel TiO2 dengan varisai penambahan perak (P4
dan P5) yang disebabkan semakin meningkatnya intensitas dari AgCl pada
masing-masing sampel.
Intensitas AgCl yang tinggi dengan variasi penambahan Ag yang semakin
banyak menandakan adanya perbedaan komposisi berat pada masing-masing
sampel. Semakin tinggi intensitas AgCl maka semakin besar pula komposisi AgCl
[image:57.595.148.477.304.483.2]yang diperoleh, yang dapat dilihat pada Gambar 13.
Gambar 13. Grafik hubungan persentase Ag dan AgCl setelah sintesis
c. Ukuran Kristal TiO2@AgCl
Ukuran kristal (Apparent Crystal Size) dari kelima sampel TiO2@AgCl
variasi penambahan Ag (P1, P2, P3, P4, dan P5) diperoleh dari data XRD yang
dapat dihitung dengan persamaan Debye Scheerer. Melalui perhitungan kuantitatif
menggunakan persamaan (2) dan (8), dengan nilai β yang digunakan adalah nilai
puncak-puncak maksimum yang dimiliki oleh fasa anatas pada orientasi bidang
0 2 4 6 8 10 12 14 16
0 2 4 6 8 10
%
Ag
C
l
42
(101,