xv
INTISARI
Penelitian ini bertujuan untuk mengevaluasi penentuan beyond use date
dari sediaan racikan pulveres campuran ketotifen fumarat dan siproheptadin HCl yang diproduksi oleh rumah sakit X. Penentuan beyond use date yang di rumah sakit X selama ini didasarkan dari expired date tablet ketotifen fumarat (Profilas) atau siproheptadin HCl (Pronicy) yang lebih singkat.
Metode pendekatan untuk mengetahui beyond use date pada penelitian ini adalah menggunakan uji stabilitas dipercepat dengan menggunakan 3 peringkat suhu, uji stabilitas dipercepat dengan 1 peringkat suhu, dan dengan menggunakan 25% dari sisa expired date (waktu kadaluwarsa) tablet ketotifen fumarat atau siproheptadin HCl yang memiliki expired date yang lebih singkat atau 6 bulan (dipilih yang lebih singkat).
Hasil dari uji stabilitas dipercepat dengan menggunakan 3 peringkat suhu dan uji stabilitas dipercepat dengan 1 peringkat suhu tidak dapat digunakan dalam penentuan beyond use date sedangkan hasil penentuan beyond use date
menggunakan 25% dari sisa expired date tablet ketotifen fumarat, adalah 9 bulan sejak tanggal peracikannya (28 Mei 2008). Maka penentuan beyond use date
sediaan racikan pulveres campuran ketotifen fumarat dan siproheptadin HCl yang dilakukan oleh rumah sakit X sebaiknya adalah 6 bulan (28 Februari 2008).
xvi
ABSTRACT
The aim of this research is to evaluate the beyond use date of ketotifen fumarate and cyproheptadine HCl powder combination produced by X’ hospital. The determination of beyond use date in X’ hospital is based on expired date of ketotifen fumarate or cyproheptadine HCl tablet whichever is earlier.
The approximation methods to predict beyond use date are accelerated stability testing with three temperature degrees, accelerated stability testing with single temperature degree, and using 25% of expired date ketotifen fumarate or cyproheptadine HCl tablet remained or 6 months, whichever is earlier.
5
EVALUASI CARA PENENTUAN BEYOND USE DATE (MASA EDAR)
SEDIAAN RACIKAN PULVERES
CAMPURAN KETOTIFEN FUMARAT DAN SIPROHEPTADIN HCl
DARI RUMAH SAKIT X
SKRIPSI
Diajukan Untuk Memenuhi Salah Satu Syarat Memperoleh Gelar Sarjana Farmasi (S.Farm.)
Program Studi Ilmu Farmasi
Oleh : Lidia Kristalia NIM : 048114148
FAKULTAS FARMASI
UNIVERSITAS SANATA DHARMA
YOGYAKARTA
i
EVALUASI CARA PENENTUAN BEYOND USE DATE (MASA EDAR)
SEDIAAN RACIKAN PULVERES
CAMPURAN KETOTIFEN FUMARAT DAN SIPROHEPTADIN HCl
DARI RUMAH SAKIT X
SKRIPSI
Diajukan Untuk Memenuhi Salah Satu Syarat Memperoleh Gelar Sarjana Farmasi (S.Farm.)
Program Studi Ilmu Farmasi
Oleh : Lidia Kristalia NIM : 048114148
FAKULTAS FARMASI
UNIVERSITAS SANATA DHARMA
YOGYAKARTA
iv
With all my love, for
Papa, M ama, Ko’ Andreas, Yoyo
Almamaterku,
dan semua yang mengenal L idia K ristalia
Apapun yang dapat anda lakukan atau ingin anda lakukan, mulailah!
Keberanian memiliki kecerdasan, kekuatan,
dan keajaiban di dalamnya (Goeti).
Tak ada orang yang begitu banyak tahu
sampai bisa mengatakan dengan pasti
apa yang mungkin dan tak mungkin (Henry Ford).
So I won’t give up
No I won’t breakdown
Sooner that it seems life turns around
And I will be strong even if all goes wrong
When I’m standing in the dark, I’ll still believe
Some one’s watching over me
It doesn’t matter how long it takes
Believe in your self and you’ll fly high
And it only matters how true you are
Be true to your self and follow your heart
LEMBAR PERNYATAAN PERSETUJUAN
PUBLIKASI KARYA ILMIAH UNTUK KEPENTINGAN AKADEMIS
Yang bertanda tangan di bawah ini, saya mahasiswa Universitas Sanata Dharma : Nama : Lidia Kristalia
Nomor Mahasiswa : 048114148
Demi pengembangan ilmu pengetahuan, saya memberikan kepada Perpustakaan Universitas Sanata Dharma karya ilmiah saya yang berjudul :
EVALUASI CARA PENENTUAN BEYOND USE DATE (MASA EDAR)
SEDIAAN RACIKAN PULVERES CAMPURAN KETOTIFEN FUMARAT DAN SIPROHEPTADIN HCl DARI RUMAH SAKIT X
beserta perangkat yang diperlukan (bila ada). Dengan demikian saya memberikan kepada Perpustakaan Universitas Sanata Dharma hak untuk menyimpan, mengalihkan dalam bentuk media lain, mengelolanya di Internet atau media lain untuk kepentingan akademis tanpa perlu meminta ijin dari saya maupaun memberikan roya lty kepada saya selamA tetap mencantumkan nama saya sebagai penulis.
Demikian pernyatan ini yang saya buat dengan sebenarnya. Dibuat di Yogyakarta
Pada tanggal : 28 Maret 2008 Yang menyatakan
v
KATA PENGANTAR
Puji dan syukur penulis panjatkan kepada Tuhan Yesus Kristus atas berkat, hikmat, kekuatan, serta penyertaan yang diberikan sehingga penulis dapat menyelesaikan skripsi yang berjudul ”Evaluasi Cara Penentuan Beyond Use Date
(Masa Edar) Sediaan Racikan Pulveres Campuran Ketotifen Fumarat dan Siproheptadin HCl dari Rumah Sakit X” dengan baik.
Skripsi ini disusun sebagai tugas akhir untuk memenuhi salah satu syarat guna memperoleh gelar Sarjana Strata satu Farmasi (S. Farm.), program Studi Ilmu Farmasi Fakultas Farmasi, Universitas Sanata Dharma, Yogyakarta.
Terselesaikannya skripsi ini tidak lepas dari bantuan dan dukungan dari berbagai pihak. Untuk itu penulis mengucapkan terima kasih kepada :
1. Rita Suhadi, M.Si., Apt. selaku Dekan Fakultas Farmasi Universitas Sanata Dharma Yogyakarta.
2. Christine Patramurti, M.Si., Apt. selaku dosen pembimbing yang telah mengarahkan, mendampingi, dan menyediakan waktu untuk berdiskusi bersama penulis selama proses penelitian, penyusunan, hingga selesainya skripsi ini.
3. Agatha Budi Susiana, M.Si., Apt. selaku dosen penguji yang telah memberikan banyak dukungan, saran, dan kritikan yang membangun.
vi
5. Drs. Ag. Yuswanto, S.U., Ph.D., Apt. yang telah bersedia menjadi dosen pembimbing selama penulis melakukan penelitian di laboratorium Kimia Farmasi, Fakultas Farmasi Universitas Gadjah Mada, Yogyakarta.
6. Pak Wardoyo dan Pak Sudiyana selaku laboran di laboratorium Kimia Farmasi, Fakultas Farmasi Universitas Gadjah Mada, Yogyakarta yang bersedia membantu dan menemani penulis selama melakuk an penelitian bahkan sampai lembur dan tetap masuk di hari Minggu.
7. Laboran- laboran dan staf sekretariat yang turut membantu penulis selama melakukan penelitian di laboratorium Fakultas Farmasi Universitas Sanata Dharma Yogyakarta : Pak Mukminin, Pak Prapto, Mas Parlan, Mas Sarwanto, Mas Heru, Mas Otok. Serta Pak Tatmo dan Mas Narto yang membantu menyelesaikan administrasi.
8. Teman-teman senasib seperjuangan di laboratorium : Rian ’Bunting’, yang selalu setia menemani ke UGM, Tika ’Bule’, Novi, Reni, Frengky, buat semua dukungan, kebersamaan, serta canda tawanya selama di lantai 4 dan di UGM. 9. Andrew, Arie Gozonk, Blian, Frengky, Fandy, Tice, Tintus, buat semua bantuan, tawa, air mata, kegilaan, kebersamaan, semangat, dukungan, serta kesediaan untuk jadi tempat curhat dan teman makan bersama sejak pertama kuliah.
vii
11. Anggota kos ”Luv”, Anik, Minul, Nopen, Nuvo, Resty, Tina, untuk kebersamaan, semua bantuan, dukungan, semangat, teriakan, dan tawanya.
12. My Brother, ”Charles” Yudo. L, buat semua doa, dukungan, semangat, waktu untuk jalan-jalan, kesediaan menjadi pendengar yang baik, perhatian, dan printer beserta tintanya. Thank you so much bro!
13. Mas Ardhyan, Kukuh, Ko’ Tanto, atas doa, semangat, dukungan, bantuan dan masukan dalam penyusunan skripsi ini.
14. Kasis, Dee-dee, Gita, Ayu, teman-teman KKN USD kelompok 20, angkatan XXXV, terima kasih buat semua dukungan, semangat, dan kebersamaannya. 15. Semua pihak yang telah membantu penulis dalam menyelesaikan skripsi ini yang tidak dapat penulis sebutkan satu-persatu.
Tak ada gading yang tak retak, demikian pula dalam penyusunan skripsi ini. Penulis menyadari masih banyak kekurangan dan ketidaksempurnaan yang ada dalam penyusunan skripsi ini. Untuk itulah penulis mengaharapkan kritik dan saran yang dapat membuat karya ini menjadi lebih baik. Akhir kata, semoga penelitian skripsi yang telah dilakukan penulis dapat bermanfaat bagi perkembangan ilmu kefarmasian.
Penulis
viii
PERNYATAAN KEASLIAN KARYA
Saya menyatakan bahwa sesungguhnya skripsi yang saya tulis ini tidak memuat karya orang lain, kecuali yang telah disebutkan dalam kutipan dan daftar pustaka sebagaimana layaknya karya ilmiah.
Yogyakarta, Februari 2008 Penulis,
ix
DAFTAR ISI
HALAMAN SAMPUL ... . i
HALAMAN JUDUL ... ii
HALAMAN PERSETUJUAN PEMBIMBING ... iii
HALAMAN PENGESAHAN ... iv
HALAMAN PERSEMBAHAN ... v
KATA PENGANTAR … ... vi
PERNYATAAN KEASLIAN KARYA ... ix
DAFTAR ISI ... x
DAFTAR TABEL ... xiii
DAFTAR GAMBAR ... xiv
DAFTAR LAMPIRAN ... xv
INTISARI ... xvi
ABSTRACT ... xvii
BAB I. PENGANTAR ... 1
A. Latar Belakang ... 1
B. Perumusan masalah ... 2
C. Keaslian karya ... 3
D. Manfaat penelitian ... 3
E. Tujuan Penelitian ... 3
BAB II. PENELAAHAN PUSTAKA ... 4
A. Pulveres ... 4
x
C. Siproheptadin HCl...8
D. Stabilitas dan Masa Edar Sediaan... 9
E. Beyond Use Date... 10
F. Pengaruh Temperatur dan Faktor Lain Terhadap Laju Reaksi... 12
G. Penentuan Orde Reaksi... 13
H. Uji Stabilitas Dipercepat ... 15
I. Analisis Kestabilan yang Dipercepat ... 16
J. Spektrofotometri Ultraviolet... 17
K. Keterangan Empiris ... 18
BAB III. METODOLOGI PENELITIAN ... 19
A. Jenis Rancangan Penelitian... 19
B. Variabel Penelitian ... 19
C. Definisi Operasional ... 19
D. Bahan dan Alat... 20
E. Tata Cara Penelitian... 20
1. Pemilihan sampel... 20
2. Pembuatan larutan stok ... 21
3. Uji stabilitas ... 21
F. Analisis Hasil ... 22
BAB IV. HASIL DAN PEMBAHASAN ... 24
xi
B. Optimasi Kadar Ketotifen Fumarat dan Siproheptadin HCl Menggunakan Metode Spektrofotometri Ultraviolet Dengan Aplikasi Panjang Gelombang
Berganda ...26
C. Penentuan Beyond Use Date (Masa Edar) Sediaan Racikan Pulveres Campuran Ketotifen Fumarat dan Siproheptadin HCl dari Rumah Sakit X...29
D. Evaluasi Penentuan Beyond Use Date di Rumah Sakit X ...41
BAB V. KESIMPULAN DAN SARAN...43
A. Kesimpulan ...43
B. Saran ...43
C. Keterbatasan Penelitian...43
DAFTAR PUSTAKA ...44
LAMPIRAN ...46
xii
DAFTAR TABEL
xiii
DAFTAR GAMBAR
Gambar 1 Struktur kimia ketotifen fumarat... 7 Gambar 2 Struktur kimia siproheptadin HCl... 8 Gambar 3 Plot garis lurus log C terhadap waktu untuk reaksi orde-pertama ... 14 Gambar 4 Penguraian obat dalam larutan air yang dipercepat pada temperatur yang dinaikkan...16 Gambar 5 Plot Arrhenius untuk memperkirakan kestabilan obat pada temperatur ruangan ... 17 Gambar 6 Spektra tumpang tindih antara siproheptadin HCl dan ketotifen fumarat (2:1). (a) spektra siproheptadin HCl (λmax 286 nm); (b) spektra ketotifen fumarat (λmax 298 nm) ... 27 Gambar 7 Grafik kadar ketotifen fumarat setelah pemanasan selama 7 hari pada
xiv
DAFTAR LAMPIRAN
Lampiran 1. Sertifikat analisis ketotifen fumarat...46 Lampiran 2. Sertifikat analisis siproheptadin HCl... 47 Lampiran 3. Hasil penimbangan baku siproheptadin HCl dan contoh perhitungan seri larutan baku siproheptadin HCl... 48 Lampiran 4. Hasil penimbangan baku ketotifen fumarat dan contoh perhitungan seri larutan baku ketotifen fumarat... 50 Lampiran 5. Pemilihan sampel... 52 Lampiran 6. Hasil absorbansi ketotifen fumarat dan siproheptadin HCl pada 3
peringkat suhu selama 7 hari ... 54 Lampiran 7. Contoh perhitungan kadar ketotifen fumarat dan siproheptadin HCl ..
58
xv
INTISARI
Penelitian ini bertujuan untuk mengevaluasi penentuan beyond use date
dari sediaan racikan pulveres campuran ketotifen fumarat dan siproheptadin HCl yang diproduksi oleh rumah sakit X. Penentuan beyond use date yang di rumah sakit X selama ini didasarkan dari expired date tablet ketotifen fumarat (Profilas) atau siproheptadin HCl (Pronicy) yang lebih singkat.
Metode pendekatan untuk mengetahui beyond use date pada penelitian ini adalah menggunakan uji stabilitas dipercepat dengan menggunakan 3 peringkat suhu, uji stabilitas dipercepat dengan 1 peringkat suhu, dan dengan menggunakan 25% dari sisa expired date (waktu kadaluwarsa) tablet ketotifen fumarat atau siproheptadin HCl yang memiliki expired date yang lebih singkat atau 6 bulan (dipilih yang lebih singkat).
Hasil dari uji stabilitas dipercepat dengan menggunakan 3 peringkat suhu dan uji stabilitas dipercepat dengan 1 peringkat suhu tidak dapat digunakan dalam penentuan beyond use date sedangkan hasil penentuan beyond use date
menggunakan 25% dari sisa expired date tablet ketotifen fumarat, adalah 9 bulan sejak tanggal peracikannya (28 Mei 2008). Maka penentuan beyond use date
sediaan racikan pulveres campuran ketotifen fumarat dan siproheptadin HCl yang dilakukan oleh rumah sakit X sebaiknya adalah 6 bulan (28 Februari 2008).
xvi
ABSTRACT
The aim of this research is to evaluate the beyond use date of ketotifen fumarate and cyproheptadine HCl powder combination produced by X’ hospital. The determination of beyond use date in X’ hospital is based on expired date of ketotifen fumarate or cyproheptadine HCl tablet whichever is earlier.
The approximation methods to predict beyond use date are accelerated stability testing with three temperature degrees, accelerated stability testing with single temperature degree, and using 25% of expired date ketotifen fumarate or cyproheptadine HCl tablet remained or 6 months, whichever is earlier.
1
BAB I
PENDAHULUAN
A. Latar Belakang
Pasien anak pada umumnya sulit menerima obat dalam bentuk sediaan padat (tablet, pil, maupun kaplet), sehingga sediaan padat tersebut baik dalam sediaan tunggal maupun campuran diracik menjadi puyer (serbuk) agar lebih mudah diterima. Selain itu proses peracikan diperlukan untuk penyesuaian dosis pada anak.
Proses peracikan yang terjadi di rumah sakit umumnya dilakukan sesekali dalam jumlah besar sehingga dapat digunakan untuk stok persediaan di rumah sakit. Sediaan racikan yang umumnya diracik dalam jumlah besar adalah sediaan racikan yang memiliki jumlah permintaan yang tinggi dan bersifat fast moving, seperti racikan pulveres yang berisi Ketotifen fumarat dan Siproheptadin HCl dengan dosis ½ tablet Profilas (Ketotifen Hidrogen Fumarat, Dankos (1mg)) dan ¼ tablet Pronicy (Siproheptadin HCl, Kalbe Farma (4mg)). Racikan pulveres ini digunakan untuk pengobatan asthma pada pasien anak-anak. Peracikan dilakukan tidak hanya jika ada permintaan dari pasien saja. Hal ini dilakukan untuk efisiensi waktu, sehingga pasien tidak perlu menunggu terlalu lama jika mendapat resep yang berupa racikan.
stabilitas dari racikan sehingga perlu dilakukan adanya kontrol kualitas terhadap sediaan racikan. Salah satu caranya adalah dengan pemberian waktu kadaluwarsa pada sediaan racikan.
Berdasarkan Anonim (2001), expiration date hanya boleh dicantumkan pada produk hasil pembuatan dari pabrik. Untuk bentuk sediaan yang sudah diubah dari bentuk aslinya seperti pada peracikan pulveres, pendekatan expiration date yang dilakukan menggunakan beyond use date. Cara penentuan beyond use date sendiri masih belum ditetapkan secara pasti.
Untuk itulah perlu dilakukan uji stabilitas dari racikan yang dapat digunakan sebagai pendekatan untuk mengetahui beyond use date (lama masa edar) agar dapat digunakan sebagai kontrol kualitas dari racikan. Uji stabilitas juga digunakan untuk memastikan stabilitas sediaan racikan pulveres selama 1 bulan karena sediaan racikan pulveres campuran ketotifen fumarat dan siproheptadin HCl dari rumah sakit X digunakan untuk pengobatan asthma pada anak dan satu kali peresepan digunakan untuk pengobatan selama 1 bulan.
B. Perumusan Masalah
Masalah yang timbul dalam penelitian ini adalah apakah cara penentuan
beyond use date (lama masa edar) dari sediaan racikan pulveres campuran ketotifen fumarat dan siproheptadin HCl dari rumah sakit X sudah tepat?
C. Keaslian Penelitian
Sejauh pengetahuan penulis, penelitian tentang evaluasi cara penentuan
beyond use date (masa edar) sediaan racikan pulveres campuran ketotifen fumarat dan siproheptadin HCl dari rumah sakit X belum pernah dilakukan sebelumnya.
D. Manfaat Penelitian
1. Manfaat teoritis
Penelitian ini dapat digunakan sebagai referensi untuk mengevaluasi cara penentuan lama masa edar dari sediaan racikan pulveres yang berisi ketotifen fumarat dan siproheptadin HCl hasil racikan dari rumah sakit X.
2. Manfaat metodologis
3. Manfaat praktis
Penelitian ini dapat digunakan untuk mengetahui stabilitas dari sediaan racikan pulveres yang berisi ketotifen fumarat dan siproheptadin HCl hasil racikan dari rumah sakit X selama 1 bulan.
E. Tujuan Penelitian
5
BAB II
PENELAAHAN PUSTAKA
A. Pulveres
Serbuk adalah campuran kering bahan obat atau zat kimia yang dihaluskan untuk pemakaian oral atau pemakaian luar. Serbuk oral dapat diserahkan dalam bentuk terbagi (pulveres) atau tidak terbagi (pulvis). Pada umumnya serbuk terbagi dibungkus dengan kertas perkamen. Walaupun begitu apoteker dapat lebih melindungi serbuk dari pengaruh lingkungan dengan melapisi tiap bungkus dengan kertas selofan atau sampul polietilena (Anonim, 1995).
Pulveres (serbuk bagi) adalah serbuk yang dibagi dalam bobot yang lebih kurang sama, dibungkus dengan kertas perkamen atau bahan pengemas yang lain yang cocok. Supaya dapat terbagi tepat, maka campuran serbuk kering ditambah zat tambahan yang bersifat netral atau indiferen, seperti saccharum lactis, saccharum album, sampai berat serbuk tiap bungkusnya 500mg. Penggunaan saccharum album ada keuntungannya sebagai korigen rasa, tetapi serbuk akan mudah basah karena higroskopis (Anief, 2003).
Penyimpangan berat masing- masing serbuk terhadap yang lain adalah paling besar 10%. Serbuk bagi dikemas dalam kertas perkamen. Bagi serbuk yang mengandung zat yang higroskopis serbuk dibungkus dalam kertas berlilin dan diserahkan dalam pot dengan tutup sekrup. Penyimpangan antara penimbangan, satu persatu terhadap bobot isi rata-rata tidak lebih dari 15% dari tiap 2 bungkus dan tidak lebih dari 10% untuk tiap 18 bungkus yang lain (Anief, 2003).
Serbuk diracik dengan cara mencampur satu persatu, sedikit demi sedikit dan dimulai dari bahan yang jumlahnya sedikit kemudian diayak, biasanya menggunakan pengayak nomor 60 dan dicampur lagi. Cara mencampur obat-obatan dan bahan-bahan tambahan harus cermat, dan di bawah ini disusun petunjuk yang perlu diperhatikan :
1. Jangan mencampur obat berkhasiat keras dalam mortir dalam keadaan tidak diencerkan, untuk mencegah sebagian obat tertinggal dalam pori-pori dinding mortir.
2. Bila bagian-bagian serbuk mempunyai BJ yang berlainan, masukkan dulu serbuk yang nya besar baru kemudian masukkan bagian serbuk yang BJ-nya lebih rendah dan diaduk.
3. Jangan menggerus bahan-bahan serbuk dalam jumlah banyak sekaligus. Hal ini untuk menghindari agar jangan sampai ada bagian serbuk yang belum halus.
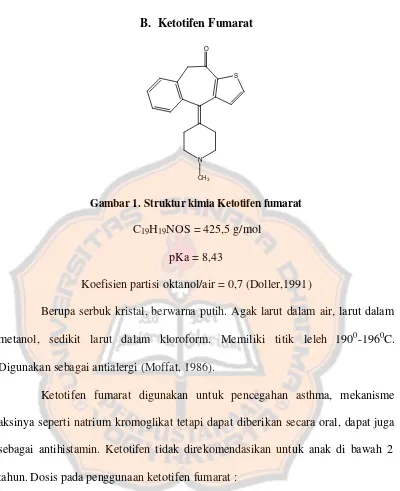
B. Ketotifen Fumarat
S O
N
CH3
Gambar 1.Struktur kimia Ketotifen fumarat C19H19NOS = 425,5 g/mol
pKa = 8,43
Koefisien partisi oktanol/air = 0,7 (Doller,1991)
Berupa serbuk kristal, berwarna putih. Agak larut dalam air, larut dalam metanol, sedikit larut dalam kloroform. Memiliki titik leleh 1900-1960C. Digunakan sebagai antialergi (Moffat, 1986).
Ketotifen fumarat digunakan untuk pencegahan asthma, mekanisme aksinya seperti natrium kromoglikat tetapi dapat diberikan secara oral, dapat juga sebagai antihistamin. Ketotifen tidak direkomendasikan untuk anak di bawah 2 tahun. Dosis pada penggunaan ketotifen fumarat :
Dewasa : 1-2 mg, 2 kali sehari bersama makan.
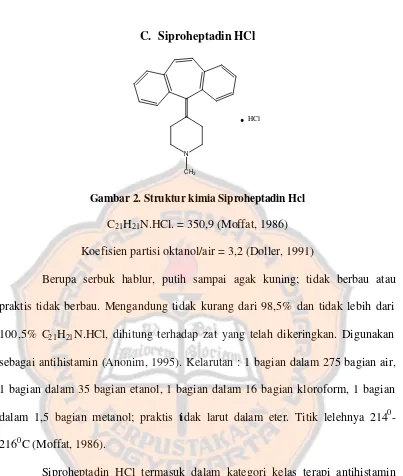
C. Siproheptadin HCl
N
CH3
HCl
Gambar 2. Struktur kimia Siproheptadin Hcl C21H21N.HCl. = 350,9 (Moffat, 1986) Koefisien partisi oktanol/air = 3,2 (Doller, 1991)
Berupa serbuk hablur, putih sampai agak kuning; tidak berbau atau praktis tidak berbau. Mengandung tidak kurang dari 98,5% dan tidak lebih dari 100,5% C21H21N.HCl, dihitung terhadap zat yang telah dikeringkan. Digunakan sebagai antihistamin (Anonim, 1995). Kelarutan : 1 bagian dalam 275 bagian air, 1 bagian dalam 35 bagian etanol, 1 bagian dalam 16 bagian kloroform, 1 bagian dalam 1,5 bagian metanol; praktis tidak larut dalam eter. Titik lelehnya 2140 -2160C (Moffat, 1986).
Siproheptadin HCl termasuk dalam kategori kelas terapi antihistamin yang digunakan untuk mengobati gejala alergi seperti hay fever, urtikaria, migren. Mekanisme aksinya, merupakan antihistamin yang poten dan antagonis serotonin. Penggunaan dosis siproheptadin HCl untuk alergi :
Anak-anak : 0,25 mg/kg/hari atau 8 mg/m2/hari, terbagi dalam 2-3 dosis atau untuk anak 2-6 tahun : 2 mg tiap 8-12 jam (tidak boleh lebih dari 12 mg/hari), untuk anak 7-14 tahun : 4 mg tiap 8-12 jam (tidak boleh lebih dari 16 mg/hari). Dewasa : 4-20 mg/hari terbagi tiap 8 jam (Lacy, 2003).
D. Stabilitas dan Masa Edar Sediaan
Stabilitas dapat diartikan bahwa obat (bahan obat, sediaan obat), jika disimpan di bawah persyaratan lingkungan tertentu dalam kemasan tertentu untuk penyimpanan dan distribusinya, tidak atau hanya berubah dalam suatu skala yang diizinkan dalam sifat khas kualitasnya yang penting. Sifat khas kualitas yang penting adalah kandungan bahan aktif, keadaan galeniknya, termasuk sifat yang dapat terlihat secara sensorik, sifat mikrobiologis dan toksikologisnya dan aktivitasnya secara terpeutik. Obat yang dibuat secara reseptur, yang umumnya segera sampai ke pasien, sebaiknya memiliki stabilitas sekurang-kurangnya untuk beberapa bulan (Voigt, 1994).
Pengujian stabilitas pada sediaan merupakan faktor penting untuk mengetahui sifat stabilitas dari sediaan dan untuk menentukan kondisi penyimpanan yang cocok serta tanggal kadaluwarsa (Anonim, 2001(a)). Pengujian terhadap stabilitas sediaan meliputi : uji organoleptis, kimia- fisika, kimiawi dan mikrobiologi (Carstensen, 2000).
Hal-hal yang harus diperhatikan dalam uji stabilitas, antara lain :
1. Jumlah contoh dan jadwal pengujian berdasarkan kriteria statistik tiap sifat yang diuji untuk menjamin kebenaran perkiraan stabilitas
2. Kondisi penyimpanan
3. Metoda pengujian yang spesifik, bermakna, dan dapat diandalkan
5. Pada obat jadi untuk rekonstitusi, pengujian stabilitas dilakukan sebelum dan sesudah rekonstitusi (Anonim, 2001(b)).
Masa edar didefinisikan sebagai perioda waktu yang ditetapkan pada tingkat konfidensi 95% bahwa dalam perioda waktu tersebut produk tetap mengandung zat aktif tidak kurang dari batas spesifikasi (Anonim, 2001 (b)).
E. Beyond Use Date
Expired date hanya diberikan pada obat-obat hasil produksi dari pabrik dan dapat digunakan saat produk obat tersebut masih dalam kemasan asli dari pabriknya atau dalam kontainer tertutup dengan kondisi yang sudah ditentukan. Apabila terjadi pemindahan obat dari pengema s aslinya untuk dikemas ulang menjadi unit-dose packing maka expired date tidak boleh digunakan melainkan menggunakan beyond use date (Anonim, 2001 (c)).
Menurut cara peracikan obat yang baik, sediaan obat hasil racikan harus mencantumkan beyond use date. Definisi beyond use date sesuai dengan USP (795) adalah tanggal dimana setelah tanggal tersebut, sediaan racikan tidak dapat digunakan lagi, ditetapkan dari tanggal pembuatan racikan (Kupiec, 2003).
Menurut USP (797) ada tiga metode yang tepat yang dapat digunakan untuk menentukan beyond use date yaitu dari sumber literatur yang tepat, tes secara langsung, dan menurut USP (795) (Kupiec, 2003).
1. Sumber literatur yang tepat
suatu obat. Prediksi beyond use date berdasarkan hasil publikasi, diagram, tabel, dan sebagainya dapat digunakan untuk mengetahui beyond use date teoritis. Prediksi beyond use date secara teori dapat menyebabkan asumsi yang berbeda, kesalahan, atau ketidakakuratan. Besarnya kesalahan atau ketidakakuratan tergantung pada perbedaan antara karakteristik produk hasil racikan; seperti, komposisi, konsentrasi, volume, tipe kemasan, bahan dari kemasan, dan karakteristik dari data stabilitas produk yang akan digunakan. Semakin besarnya ketidakpastian dari penentuan beyond use date secara teori menyebabkan perlunya penentuan beyond use date secara eksperimental dari suatu racikan (Kupiec, 2003).
2. Tes secara langsung
Perlu diketahui bahwa beyond use date yang valid hanya dapat diperoleh melalui studi stabilitas produk spesifik. Stabilitas kuantitatif dapat menggunakan HPLC (High Performance Liquid Chromatography) dan GC (Gas Chromatography) untuk preparasi campuran tertentu (Kupiec, 2003).
3. USP (795)
Menurut USP (795) untuk sediaan racikan berbentuk nonaqueuos liquid
Data stabilitas primer adalah data pada produk obat yang disimpan pada kemasan untuk dipasarkan dibawah kondisi penyimpanan untuk merencanakan
shelf life. Data ini merupakan akumulasi dari tes pada waktu ke nol (sesaat setelah produksi) dan pada titik waktu penetapan sebelumnya dari beyond use date yang diinginkan. Frekuensi dari tes yang dilakukan harus cukup untuk dapat menentukan stabilitas dari obat. Frekuensi dari tes secara normal untuk kondisi jangka panjang adalah setiap 3 bulan selama 1 tahun pertama, setiap 6 bulan pada tahun kedua dan kemudian dilakukan setiap tahunnya. Untuk mengetahui beyond use date selama 6 bulan, perlu dilakukan tes pertama pada saat awal (waktu-0) kemudian dilakukan tes lagi pada bulan ketiga dan keenam dengan kondisi penyimpanan 250C ± 20C/60% RH ± 5%, dengan menggunakan kondisi yang dipercepat, stabilitas selama 6 bulan dapat diprediksi setelah melakukan tes selama 1 bulan untuk mendapatkan data beyond use date yang lebih cepat (Kupiec, 2003).
Tabel I. Kondisi dan jangka waktu yang diperbolehkan untuk uji stabilitas jangka panjang dan dipercepat
Kondisi Jangka waktu minimum yang diperbolehkan
Uji jangka panjang 25
0
C ± 20C
60% RH ± 5% 12 bulan
Uji dipercepat 40
0
C ± 20C
75% RH ± 5% 6 bulan
F. Pengaruh Temperatur dan Faktor Lain Terhadap Laju Reaksi
kenaikan 100C. Pengaruh temperatur terhadap laju ini diberikan dengan persamaan yang pertama kali dikemukakan oleh Arhenius (Martin, 1993).
T R
E
e A
k = − .
T R
E A k
. ln
ln = −
T R E A
k 1
. 303 , 2 log
log = − ×
A T
R E
k 1 log
. 303 , 2
log = − × +
Keterangan : E = energi aktivasi (J.mol-1), A = faktor frekuensi, R = tetapan gas universal (1,987 kalori/derajat mol), T = suhu mutlak (K), e = basis dari logaritme natural (2,718), k = tetapan kecepatan reaksi (Voigt, 1994).
G. Penentuan Orde Reaksi
Orde reaksi kimia kimia dapat menunjukkan bentuk dari profil konsentrasi- waktu dari obat atau produk obat, dimana tetapan kecepatan reaksi dapat ditentukan dari slopenya (Connors, K.A., Arnedon, G.L., and Stella, V.J., 1986).
Orde reaksi dapat ditentukan dengan beberapa metode, yaitu :
1. Metode substitusi
2. Metode grafik
Plot data dalam bentuk grafik sepert terlihat dalam Gambar 3. dapat digunakan untuk mengetahui orde reaksi tersebut. Jika konsentrasi diplot terhadap
t dan didapatkan garis lurus, reaksi adalah nol. Reaksi dikatakan orde-pertama bila log (a – x) terhadap t menghasilkan garis lurus. Suatu reaksi orde-kedua akan memberikan garis lurus bila 1/(a – x) diplot terhadap t (jika konsentrasi mula-mula sama). Jika plot 1/(a – x)2 terhadap t menghasilkan garis lurus dengan seluruh reaktan sama konsentrasi mula-mulanya, reaksi adalah orde-ketiga (Martin, 1993).
Gambar 3. Plot garis lurus log C terhadap waktu untuk reaksi orde -pertama
3. Metode waktu-paruh
Dalam reaksi orde- nol, waktu-paruh sebanding dengan konsentrasi awal,
a, seperti diperlihatkan pada tabel 1. Waktu-paruh reaksi orde-pertama tidak bergantung pada a; waktu-paruh untuk reaksi orde-kedua, di mana a = b
sebanding dengan 1/a dari dalam reaksi orde-ketiga, di mana a = b = c, sebanding dengan 1/a2 (Martin, 1993).
Waktu
log k
onsentrasi
Kemiringan = 303 , 2
Tabel II. Persamaan laju dan Waktu-paruh Orde Persamaan Laju yang
Diintegrasikan
Persamaan Waktu-Paruh
0 x = kt
k a t 2 2 / 1 =
1 k t
x a a 303 , 2 ) ( log =
− t k
693 , 0 2 / 1 =
2 kt
x a a x = − )
( t 2k
1
2 /
1 =
3 kt
x a a x ax 2 ) ( 2 2 2 2 = − − k a t1/2 12
2 3 =
H. Uji Stabilitas yang Dipercepat
Semua obat akan mengalami dekomposisi dengan jalannya waktu. Instabilitas dari formulasi biasanya diketahui setelah penyimpanan di bawah kondisi normal. Untuk menentukan stabilitas dari formulasi produk ini biasa digunakan high stress seperti temperatur penyimpanan, kelembapan dan intensitas cahaya. Kondisi high stress menyebabkan peningkatan deterionisasi dari produk dan dengan demikian dapat mengurangi waktu yang diperlukan untuk uji ini. Kemungkinan akan lebih banyak data yang bisa dikumpulkan dalam jangka waktu yang pendek dan ketidakpuasan dari formulasi dapat dihilangkan sejak awal dari tes dan mengurangi waktu yang diperlukan untuk mendapatkan produk yang baik dan dipasarkan (Aulton,2002).
Sasaran dari uji stabilitas dipercepat ini adalah :
2. Untuk memprediksi dari shelf life, merupakan waktu dimana produk tetap stabil ketika disimpan dibawah kondisi normal atau kondisi yang seharusnya. 3. Merupakan syarat dari kontrol kualitas untuk memastikan tidak ada perubahan
yang tidak diharapkan ketika penyimpanan (Aulton, 2002).
I. Analisis Kestabilan yang Dipercepat
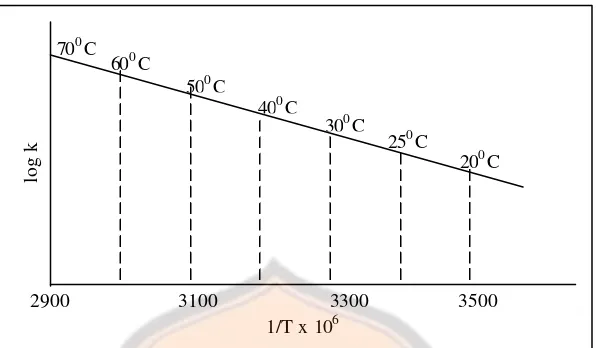
Menurut teknik ini nilai k untuk penguraian obat dalam larutan pada berbagai temperatur yang dinaikkan diperoleh dengan memplot beberapa fungsi konsentrasi terhadap waktu, seperti yang terlihat pada Gambar 4. Logaritma laju penguraian spesifik kemudian diplot terhadap kebalikan dari temperatur mutlak seperti yang terlihat pada Gambar 5, dan hasil berupa garis lurus diekstrapolasi sampai temperatur ruang. k250 digunakan untuk memperoleh pengukuran kestabilan obat pada kondisi penyimpanan biasa (Martin, 1993).
Gambar 4. Penguraian obat dalam larutan air yang dipercepat pada temperatur yang dinaikkan
Time in hours
Konsentrasi
400C
500C
Gambar 5. Plot Arrhenius untuk memperkirakan kestabilan obat pada temperatur ruangan
Penentuan waktu kadaluwarsa lebih diminati dengan menggunakan waktu pada saat suatu zat memiliki kadar sisa tertentu dari pada dengan menggunakan kecepatan reaksi. Untuk suatu reaksi pengurangan orde 1, waktunya dapat dihitung sebagai berikut, di dalamnya terdapat sisa bahan aktif 90% (t90%):
t90% =
k k
105 , 0 11 , 1 ln
= (Voigt,1994).
J. Spektrofotometri Ultra Violet
Spektrofotometri adalah salah satu teknik analisis fisiko-kimia yang mengamati tentang interaksi atom atau molekul dengan radiasi elektromagnetik (REM) (Mulja dan Suharman, 1995). Interaksi antara senyawa yang mempunyai gugus kromofor dengan radiasi elektromagnetik pada daerah UV-Vis (200-800 nm) akan menghasilkan transisi elektromagnetik dan spektra absorbansi elektromagnetik. Jumlah radiasi elektromagnetik yang diserap akan sebanding dengan jumlah molekul penyerapnya, sehingga spektra absorbansi dapat
log k
700C 600C
500C
400C
300C
200C 250C
digunakan untuk analisis kuantitatif. Spektrum visible mempunyai absorbansi antara 400-800 nm, sedangkan spektrum UV mempunyai aborbansi antara 100-400 nm. Kuantitas energi yang diserap oleh suatu senyawa berbanding terbalik dengan panjang gelombang radiasi (Fessenden, 1995).
K. Keterangan Empiris
Perubahan bentuk sediaan dari suatu obat, misalnya melalui proses peracikan tablet menjadi pulveres dapat mempengaruhi stabilitasnya, untuk itu pengujian stabilitas pada sediaan merupakan faktor penting untuk mengetahui sifat stabilitas dari sediaan dan untuk menentukan kondisi penyimpanan yang cocok serta tanggal kadaluawarsanya.
Menurut AMA (American Medical Assosiation), penentuan beyond use date untuk sediaan racikan berbentuk nonaqueuos liquid dan padat, tidak boleh lebih dari 25% dari tanggal kadaluwarsa obat aslinya atau 6 bulan, bisa juga lebih singkat. Penentuan batas beyond use date dapat diperpanjang apabila didukung dengan informasi stabilitas darisediaan racikan tersebut .
19
BAB III
METODE PENELITIAN
A. Jenis dan Rancangan Penelitian
Jenis penelitian yang dilakukan dalam evaluasi cara penentuan beyond use date (masa edar) sediaan racikan pulveres campuran ketotifen fumarat dan siproheptadin HCl dari rumah sakit X adalah penelitian non-eksperimental
B. Variabel dalam Penelitian
Variabel-variabel yang terdapat dalam evaluasi cara penentuan beyond use date (masa edar) sediaan racikan pulveres campuran ketotifen fumarat dan siproheptadin HCl dari rumah sakit X adalah :
1. Variabel terkendali : suhu oven yang digunakan.
2. Variabel tak terkendali : cara pembuatan sediaan racikan pulveres yang berisi ketotifen fumarat dan siproheptadin HCl di rumah sakit X dan kelembaban ruangan saat pelaksanaan uji stabilitas.
C. Definisi Operasional
2. Beyond use date adalah lama masa edar dari sediaan racikan pulveres campuran ketotifen fumarat dan siproheptadin HCl dari rumah sakit X
D. Bahan Penelitian
Bahan yang digunakan dalam penelitian ini adalah ketotifen fumarat fumarat (Dankos), siproheptadin HCl (Pharos), tablet Profilas (Ketotifen fumarat Hidrogen Fumarat, Dankos (1mg)) dan tablet Pronicy (Siproheptadin HCl, Kalbe Farma (4mg)), sediaan racikan pulveres yang berisi Ketotifen fumarat dan Siproheptadin dengan dosis ½ tablet Profilas (Ketotifen fumarat Hidrogen Fumarat, Dankos (1mg)) dan ¼ tablet Pronicy (Siproheptadin HCl, Kalbe Farma (4mg)) dari rumah sakit X, methanol p.a (E.Merck), dan aquadest.
E. Alat Penelitian
Alat yang digunakan dalam penelitian ini adalah Spectrophotometer Genesis 10 UV, neraca analitik merk Scaltec, mikropipet Socorex, sentrifuge dan tabung sentrifuge, labu ukur, termometer dan alat-alat gelas lain yang lazim digunakan dalam laboratoriun analisis.
F. Tata Cara Penelitian
1. Pemilihan sampel
Kalbe Farma (4mg)) dari rumah sakit X. Pemilihan sampel berdasarkan pada nomor batch yang sama saat pembuatan.
2. Pembuatan larutan stok
a. Pembuatan larutan ketotifen fumarat fumarat 1000 ppm. Ditimbang lebih kurang seksama 10,0 mg baku ketotifen fumarat fumarat dilarutkan dengan methanol p.a sampai volume 10,0 ml.
b. Pembuatan larutan siproheptadin HCl 1000 ppm. Ditimbang lebih kurang seksama 10,0 mg baku siproheptadin HCl dilarutkan dengan methanol p.a sampai volume 10,0 ml.
c. Pembuatan seri larutan baku ketotifen fumarat fumarat. Larutan stok ketotifen fumarat fumarat dipipet 0,100; 0,125; 0,150; 0,175; 0,200; 0,225; dan 0,250 ml dimasukkan kedalam labu takar 10,0 ml kemudian diencerkan hingga tanda dengan methanol p.a sehingga didapat larutan ketotifen fumarat fumarat dengan konsentrasi 10,00; 12,50; 15,00; 17,50; 20,00; 22,50; dan 25,00 ppm.
d. Pembuatan seri larutan baku siproheptadin HCl. Larutan stok siproheptadin HCl dipipet 0,100; 0,125; 0,150; 0,175; 0,200; 0,225; dan 0,250 ml dimasukkan kedalam labu takar 10,0 ml kemudian diencerkan hingga tanda dengan methanol p.a sehingga didapat larutan siproheptadin HCl dengan konsentrasi 10,00; 12,50; 15,00; 17,50; 20,00; 22,50; dan 25,00 ppm.
3. Uji stabilitas
b. Setiap bungkus pulveres ditimbang, digerus, dan dilarutkan dengan metanol dalam labu ukur 10,0 ml kemudian dipindahkan ke dalam tabung sentrifuge. Lalu disentrifuse dengan kecepatan 2500 rpm selama 10 menit.
c. Diambil 240 µL cairan yang bening, dimasukkan ke dalam labu ukur 10,0 ml diencerkan dengan methanol hingga tanda lalu disaring dengan milipore.
d. Diukur absorbansinya menggunakan spektrofotometer UV pada panjang gelombang 260nm, 275nm, 286nm, 290nm, 298nm, 310nm, dan 315nm.
G. Analisis Hasil
1. Uji stabilitas dipercepat dengan 3 peringkat suhu
a.Penentuan orde reaksi ketotifen fumarat dan siproheptadin HCl. Penentuan orde reaksi diperoleh dengan membandingkan nilai r yang diperoleh dari regresi linier antara waktu dengan beberapa fungsi kadar tiap senyawa. Jika konsentrasi diplot terhadap t dan didapatkan garis lurus (r mendekati ± 1), reaksi adalah orde-nol. Reaksi dikatakan orde-pertama bila ln konsentrasi terhadap t
menghasilkan garis lurus (r mendekati ± 1), dan dikatakan reaksi orde-kedua bila 1/konsentrasi diplot terhadap t (jika konsentrasi mula- mula sama) akan memberikan garis lurus (r mendekati ± 1).
regresi linier antara 1/T (T dalam 0Kelvin) dengan nilai ln k dari tiap senyawa dari tiap peringkat suhu.
c.Penentuan beyond use date berdasarkan pada nilai t90 yang lebih singkat. Perhitungan t90 disesuaikan dengan orde reaksi dari masing- masing senyawa :
Orde 0,
k a t90 = 0,1
Orde 1,
k t90 = 0,105
Dimana a adalah konsentrasi awal.
2. Uji stabilitas dipercepat dengan 1 peringkat suhu
Stabilitas tiap senyawa dapat diketahui dari persentase perubahan kadar dari waktu ke waktu dengan membandingkan kadar pada waktu tertentu dengan kadar awal.
3. Menggunakan 25% dari sisa waktu kadaluwarsa tablet yang lebih
singkat
24
BAB IV
HASIL DAN PEMBAHASAN
A. Pemilihan Sampe l
Sampel yang digunakan dalam penelitian ini adalah sediaan racikan pulveres campuran ketotifen fumarat dan siproheptadin HC l yang diperoleh dari rumah sakit X. Proses peracikan sediaan pulveres campuran ketotifen fumarat dan siproheptadin HCl dilakukan karena di rumah sakit X tidak mempunyai tablet ketotifen fumarat dan siproheptadin HCl yang memiliki dosis khusus untuk anak-anak sehingga perlu dilakukan penyesuaian dosis pada anak-anak dengan cara membuat racikan sediaan pulveres campuran ketotifen fumarat dan siproheptadin HCl. Sediaan racikan pulveres campuran ketotifen fumarat dan siproheptadin HCl digunakan pada pengobatan asthma untuk anak di rumah sakit X. Adapun dosis yang digunakan dalam peresepan ini adalah ½ tablet Profilas dan ¼ tablet Pronicy.
24
pulveres campuran ketotifen fumarat dan siproheptadin HCl di rumah sakit X dilakukan setiap hari Selasa pada setiap minggunya.
Berat sampel sediaan racikan pulveres campuran ketotifen fumarat dan siproheptadin HCl yang diperoleh dari rumah sakit X memiliki perbedaan yang cukup besar antar tiap bungkusnya. Untuk itu perlu dilakukan pemilihan sampel agar mendapat data yang homogen.
Sampel sediaan racikan pulveres campuran ketotifen fumarat dan siproheptadin HCl yang dipilih adalah pulveres yang memiliki berat antara 0,1835-0,2753 gram. Range berat sediaan racikan pulveres ini diperoleh dari perhitungan berat yang sesuai dengan resep sediaan racikan pulveres ini yaitu ½ tablet Profilas (Ketotifen Hidrogen Fumarat, Dankos (1mg)) dan ¼ tablet Pronicy (Siproheptadin HCl, Kalbe Farma (4mg)), hal ini berdasarkan berat rata-rata tablet ketotifen fumarat dan siproheptadin HCl. Berat rata-rata dari tablet Profilas adalah 0,1500 gram dan berat rata-rata tablet Pronicy adalah 0,6174 gram sehingga berat untuk tiap pulveres seharusnya (½ (0,1500 gram)) + (¼ (0,6174 gram) = 0,2294 gram dengan simpangannya sebesar 20%.
24
karena jika nilai simpangan diperkecil maka banyak sampel tidak masuk dalam range beratnya sehingga jumlah sampel yang ada tidak mencukupi untuk digunakan dalam uji stabilitas dengan 3 peringkat suhu.
B. Optimasi Penetapan Kadar Ketotifen Fumarat dan Siproheptadin HCl
Menggunakan Metode Spektrofotometri Ultraviolet Dengan Aplikasi
Panjang Gelombang Berganda
Metode yang digunakan untuk menetapkan kadar siproheptadin HCl dan ketotifen fumarat dalam sampel pulveres yaitu metode panjang gelombang berganda secara spektrofotometri ultraviolet. Menurut Adrianto (2008), metode ini memiliki akurasi dan presisi yang baik untuk menetapkan kadar siproheptadin HCl dan ketotifen fumarat dalam campuran 2:1. Optimasi metode yang dilakukan meliputi penetapan panjang gelombang pengamatan, penentuan serapan jenis dan penetapan kadar siproheptadin HCl dan ketotifen fumarat dalam sampel pulveres.
1. Penetapan panjang gelombang pengamatan
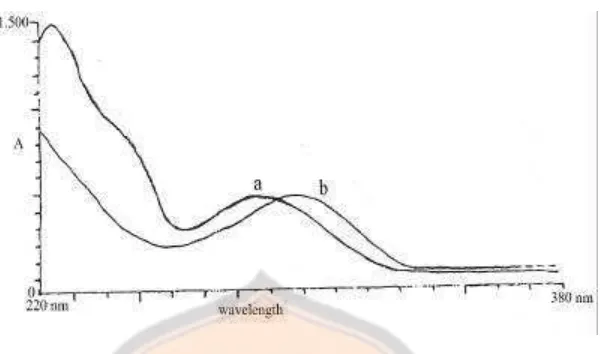
24
Gambar 6. Spektra tumpang tindih antara siproheptadin HCl dan ketotifen fumarat (2:1). (a) spektra siproheptadin HCl (λmax 286 nm); (b) spektra
ketotifen fumarat (λmax 298 nm)
Daerah tumpang tindih dari spektra siproheptadin HCl dan ketotifen fumarat dapat dilihat pada gambar 1 yaitu antara 220–380 nm. Berdasarkan daerah tumpang tindih dari siproheptadin HCl dan ketotifen fumarat dapat dipilih beberapa panjang gelombang untuk pengamatan. Pada penelitian ini dipilih 7 panjang gelombang pengamatan yaitu 260, 275, 286, 290, 298, 310, dan 315 nm. Ketujuh panjang gelombang ini yang akan digunakan untuk penentuan serapan jenis dari seri larutan baku dan pengukuran serapan dari sampel.
2. Penentuan serapan jenis siproheptadin HCl dan ketotifen fumarat
24
konsentrasi dengan serapan semakin berbanding lurus. Hasil dari perhitungan serapan jenis dari masing – masing senyawa dapat dilihat pada tabel II.
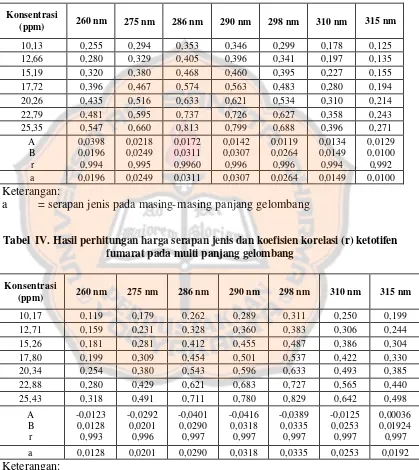
Tabel III. Hasil perhitungan harga serapan jenis dan koefisien korelasi (r) siproheptadin HCl pada multi-panjang gelombang
Konsentrasi
(ppm) 260 nm 275 nm 286 nm 290 nm 298 nm 310 nm 315 nm
10,13 0,255 0,294 0,353 0,346 0,299 0,178 0,125 12,66 0,280 0,329 0,405 0,396 0,341 0,197 0,135 15,19 0,320 0,380 0,468 0,460 0,395 0,227 0,155 17,72 0,396 0,467 0,574 0,563 0,483 0,280 0,194 20,26 0,435 0,516 0,633 0,621 0,534 0,310 0,214 22,79 0,481 0,595 0,737 0,726 0,627 0,358 0,243 25,35 0,547 0,660 0,813 0,799 0,688 0,396 0,271
A B r 0,0398 0,0196 0,994 0,0218 0,0249 0,995 0,0172 0,0311 0,9960 0,0142 0,0307 0,996 0,0119 0,0264 0,996 0,0134 0,0149 0,994 0,0129 0,0100 0,992 a 0,0196 0,0249 0,0311 0,0307 0,0264 0,0149 0,0100 Keterangan:
a = serapan jenis pada masing- masing panjang gelombang
Tabel IV. Hasil perhitungan harga serapan jenis dan koefisien korelasi (r) ketotifen fumarat pada multi panjang gelombang
Konsentrasi
(ppm) 260 nm 275 nm 286 nm 290 nm 298 nm 310 nm 315 nm
10,17 0,119 0,179 0,262 0,289 0,311 0,250 0,199 12,71 0,159 0,231 0,328 0,360 0,383 0,306 0,244 15,26 0,181 0,281 0,412 0,455 0,487 0,386 0,304 17,80 0,199 0,309 0,454 0,501 0,537 0,422 0,330 20,34 0,254 0,380 0,543 0,596 0,633 0,493 0,385 22,88 0,280 0,429 0,621 0,683 0,727 0,565 0,440 25,43 0,318 0,491 0,711 0,780 0,829 0,642 0,498
A B r -0,0123 0,0128 0,993 -0,0292 0,0201 0,996 -0,0401 0,0290 0,997 -0,0416 0,0318 0,997 -0,0389 0,0335 0,997 -0,0125 0,0253 0,997 0,00036 0,01924 0,997
a 0,0128 0,0201 0,0290 0,0318 0,0335 0,0253 0,0192 Keterangan:
24
Dari tabel III dan IV, dapat dilihat bahwa nilai koefisien korelasi dari masing – masing panjang gelombang telah melebihi dari r tabel. Oleh karena itu, nilai serapan jenis yang diperoleh dapat digunakan untuk perhitungan kadar dalam sampel pulveres dari rumah sakit X.
C. Penentuan Beyond Use Date (Masa Edar) Sediaan Racikan Pulveres
CampuranKetotifen Fumarat dan Siproheptadin HCl dari Rumah Sakit X
Penetuan masa edar (beyond use date) yang dilakukan dalam penelitian ini terdiri dari 3 macam metode, yaitu dengan metode uji stabilitas menggunakan 3 peringkat suhu, uji stabilitas dipercepat dengan 1 peringkat suhu, dan dengan menggunakan 25% dari sisa waktu expired date sediaan aslinya.
Suhu yang digunakan dalam penelitian ini adalah 400C, 500C, dan 600C serta lamanya penyimpanan adalah 7 hari. Pemilihan peringkat suhu tersebut karena menurut Reynolds (2002), pada uji stabilitas dipercepat suhu yang digunakan harus sedikit lebih tinggi dari suhu kamar dan perbedaan suhunya tidak boleh terlalu ekstrim.
24
dapat digunakan untuk memprediksi stabilitas suatu sediaan selama 6 bulan ke depan maka untuk memprediksi stabilitas dari sediaan racikan pulveres selama 1 bulan, dapat dilakukan uji stabilitas dipercepat dengan suhu 400C selama 7 hari.
1. Uji stabilitas dipercepat dengan 3 peringkat suhu
Uji stabilitas dipercepat dengan menggunakan 3 peringkat suhu dapat digunakan sebagai pendekatan untuk mencari beyond use date sediaan racikan pulveres campuran ketotifen fumarat dan siproheptadin HCl karena pada uji stabilitas dipercepat dengan menggunakan 3 peringkat suhu dapat digunakan untuk mengetahui hubungan linieritas antara konsentrasi dengan suhu yang digunakan untuk mencari besarnya tetapan kecepatan reaksi. Nilai log k dari masing- masing peringkat suhu diplotkan dengan 1/T (T = suhu dalam 0Kelvin) kemudian diekstrapolasi untuk mengetahui nilai k pada suhu ruangan (250C). Nilai k250 digunakan untuk mencari t50 dan t90 dari senyawa tersebut dengan menggunakan persamaan Arhenius.
24
Pemanasan dengan suhu 400C, 500C, dan 600C selama 7 hari dapat menyebabkan perubahan kadar pada ketotifen fumarat dan siproheptadin HCl dalam sediaan racikan pulveres. Hal ini tampak dari adanya perbedaan kadar ketotifen fumarat dan siproheptadin dari hari ke hari baik dalam satu peringkat suhu yang sama maupun antar peringkat suhu sesuai pada tabel V.
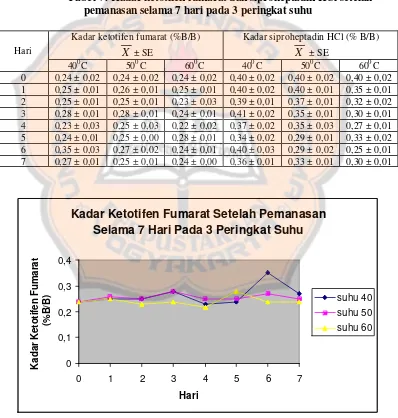
Tabel V. Kadar ketotifen fumarat dan siproheptadin HCl setelah pemanasan selama 7 hari pada 3 peringkat suhu
Kadar ketotifen fumarat (%B/B)
X ± SE
Kadar siproheptadin HCl (% B/B)
X ± SE Hari
400C 500C 600C 400C 500C 600C 0 0,24 ± 0,02 0,24 ± 0,02 0,24 ± 0,02 0,40 ± 0,02 0,40 ± 0,02 0,40 ± 0,02 1 0,25 ± 0,01 0,26 ± 0,01 0,25 ± 0,01 0,40 ± 0,02 0,40 ± 0,01 0,35 ± 0,01 2 0,25 ± 0,01 0,25 ± 0,01 0,23 ± 0,03 0,39 ± 0,01 0,37 ± 0,01 0,32 ± 0,02 3 0,28 ± 0,01 0,28 ± 0,01 0,24 ± 0,01 0,41 ± 0,02 0,35 ± 0,01 0,30 ± 0,01 4 0,23 ± 0,03 0,25 ± 0,03 0,22 ± 0,02 0,37 ± 0,02 0,35 ± 0,03 0,27 ± 0,01 5 0,24 ± 0,01 0,25 ± 0,00 0,28 ± 0,01 0,34 ± 0,02 0,29 ± 0,01 0,33 ± 0,02 6 0,35 ± 0,03 0,27 ± 0,02 0,24 ± 0,01 0,40 ± 0,03 0,29 ± 0,02 0,25 ± 0,01 7 0,27 ± 0,01 0,25 ± 0,01 0,24 ± 0,00 0,36 ± 0,01 0,33 ± 0,01 0,30 ± 0,01
Kadar Ketotifen Fumarat Setelah Pemanasan Selama 7 Hari Pada 3 Peringkat Suhu
0 0,1 0,2 0,3 0,4
0 1 2 3 4 5 6 7
Hari
Kadar Ketotifen Fumarat
(%B/B)
suhu 40
suhu 50 suhu 60
24
Kadar Siproheptadin HCl Setelah Pemanasan Selama 7 Hari Pada 3 Peringkat Suhu
0 0,1 0,2 0,3 0,4 0,5
0 1 2 3 4 5 6 7
Hari
Kadar Siproheptadin HCl
(%B/B)
suhu 40
suhu 50 suhu 60
Gambar 8. Grafik kadar siproheptadin HCl setelah pemanasan selama 7 hari pada 3 peringkat suhu
Perbedaan kadar ketotifen fumarat dan siproheptadin HCl selama 7 hari perlu diuji secara statistik untuk memastikan apakah perbedaan kadar yang terjadi benar-benar signifikan atau tidak. Uji statistik yang digunakan adalah One Way ANOVA dengan tingkat signifikansi 95%. Pemilihan penggunaan tingkat signifikansi 95% dalam penelitian ini karena pembuatan sediaan racikan pulveres dilakukan secara manual oleh pegawai bagian produksi di rumah sakit X sehingga ada faktor yang tidak dapat dikendalikan yaitu ketrampilan tiap pegawai yang meracik sediaan pulveres karena proses peracikan dilakukan oleh beberapa pegawai di rumah sakit X yang bekerja secara bergantian.
24
bermakna, sedangkan pada pemanasan dengan suhu 500C adalah berbeda tidak bermakna. Perbedaan kadar siproheptadin HCl, selama 7 hari setelah pemanasan dengan suhu 400C, 500C, dan 600C adalah berbeda bermakna.
Dari hasil diatas, tidak dapat dikatakan telah terjadi penurunan kadar setelah pemanasan dengan suhu 400C, 500C, dan 600C selama 7 hari karena perubahan kadar yang terjadi ternyata dapat menjadi lebih besar atau lebih kecil dari kadar pada hari ke-0.
Penghitungan tetapan kecepatan degradasi dari suatu senyawa dapat dilakukan dengan mencari nilai slope dari kadar tiap peringkat suhu dengan lama penyimpanan. Berikut ini adalah nilai slope tiap peringkat suhu dan orde reaksi dari ketotifen fumarat dan sip roheptadin HCl yang tercantum pada tabel VI.
Tabel VI. Nilai slope dari tiap peringkat suhu dan orde reaksi dari ketotifen fumarat dan siproheptadin HCl
Ketotifen fumarat Siproheptadin HCl Suhu
400C 500C 600C 400C 500C 600C
t Vs Ct
A = 0,2375 B = 0,0075 r = 0,4769
A = 0,2525 B = 0,0011 r = 0,2015
A = 0,2392 B = 0,0010 r = 0,1331
A= 0,4033 B= -0,0056 r = -0,5604
A= 0,4008 B= -0,0152 r = -0,8678
A= 0,3650 B= -0,0143 r = -0,7460
t Vs ln Ct
A= -1,4322 B = 0,0260 r = 0,4757
A= -1,3778 B = 0,0043 r = 0,2105
A= -1,4314 B = 0,0036 r = 0,1246
A= -0,9074 B= -0,0149 r =-0,5591
A= -0,9013 B= -0,0439 r = -0,8520
A= -1,102 B= -0,0442
r = -0,7345
t Vs 1/Ct
A= 4,1716 B= -0,0091 r = -0,4716
A = 3,9714 B= -0,0173 r = -0,2196
A = 4,1880 B= -0,0132 r = -0,1159
A= 2,4764 B= 0,0398 r = 0,5572
A= 2,4726 B= 0,1273 r = 0,8339
A= 2,7506 B= 0,1385 r = 0,7183 Orde
kesimpulan 0 2 0 1 0 0
24
t Vs ln Ct dan t Vs 1/Ct serta lebih besar dari r tabel untuk 6 derajad bebas bebas dengan tingkat signifikansi 95% (0,707). Orde reaksi ketotifen fumarat termasuk dalam orde reaksi 0. Nilai r yang diperoleh dari regresi antara t Vs Ct di bawah nilai r tabel untuk 6 derajad bebas bebas dengan tingkat signifikansi 95% (0,707), ini berarti perbandingan pengaruh antara lama waktu pemanasan dan kadar ketotifen fumarat tidak konstan.
Persamaan laju reaksi ketotifen fumarat mengikuti persamaan laju reaksi orde 0 sehingga persamaannya :
Ct = Co – k t Ct = – k t + Co Y = B X + A B = – k ? k = - B
Nilai B adalah nilai slope (B) dari persamaan t Vs Ct ketotifen fumarat pada tiga peringkat suhu, sesuai pada tabel VI.
Tabel VII. Nilai 1/T dan ln k dari ketotifen fumarat
T (Kelvin) k 1/T ln k
313 -0,0075 0,0032 - 323 -0,0011 0,0031 - 333 -0,0010 0,0030 -
24
Persamaan laju reaksi siproheptadin HCl juga mengikuti persamaan laju reaksi orde 0 sehingga persamaannya :
Ct = Co – k t Ct = – k t + Co Y = B X + A B = – k ? k = - B
Nilai B adalah nilai slope (B) dari persamaan t Vs Ct siproheptadin HCl pada tiga peringkat suhu sesuai pada tabel VI.
Tabel VIII. Nilai 1/T dan ln k dari siproheptadin HCl
T (Kelvin) k 1/T ln k
313 0,0056 0,0032 -5,1850 323 0,0152 0,0031 -4,1864 333 0,0143 0,0030 -4,2475
Dari tabel VIII dapat diketahui nilai k dan nilai dari 1/T serta ln k siproheptadin HCl. Hasil regresi antara 1/T dengan ln k siproheptadin HCl adalah A = 9,9916; B = -4687,5000; dan r = -0,8374; sehingga diperoleh persamaan regresi tetapan laju reaksi untuk siproheptadin HCl adalah Y = -4687,5000 X + 9,9916.
Sesuai dengan persamaan Arhenius,
A T R
E
k ln
ln +
× − =
A T R
E
k 1 ln
ln = − × +
24
Maka, A
T B
k = ×1 +
ln sehingga persamaan tetapan laju reaksi siproheptadin HCl
menjadi ln =-4687,5000 ×1 +9,9916 T
k dan nilai k250C dapat dihitung dengan
mengganti nilai T menjadi 298. Tetapi karena nilai r dari hasil regresi antara 1/T dan ln k siproheptadin HCl kurang dari nilai r tabel untuk 1 derajad bebas dengan tingkat signifikansi 95% (0,997) maka persamaan tersebut tidak dapat digunakan untuk menghitung nilai k250C.
Nilai r menunjukkan korelasi antara 1/T dengan ln k, apabila nilainya masih di bawah nilai dari r tabel maka korelasi antara 1/T dan ln k belum dapat dipastikan sehingga apabila tetap digunakan untuk menghitung nilai k250C akan didapatkan nilai k250C yang tidak akurat. Padahal nilai k250C selanjutnya akan digunakan untuk menghitung nilai t90 yang digunakan sebagai pendekatan untuk penentuan beyond use date.
Hasil nilai r dari regresi antara 1/T dan ln k siproheptadin HCl kurang dari nilai r tabel karena dimungkinkan degradasi siproheptadin HCl dalam sediaan racikan pulveres masih dalam tahap lag fase. Menurut Connors, dkk (1986),
24
Gambar 9. Kinetika dari dekomposisi sediaan padat
Oleh karena kecepatan degradasi dari ketotifen fumarat dan siproheptadin HCl tidak dapat dihitung maka t90 dari ketotifen fumarat maupun siproheptadin HCl tidak dapat ditentukan, hal ini menyebabkan stabilitas dari ketotifen fumarat maupun siproheptadin HCl dalam sediaan racikan pulveres juga belum dapat dipastikan.
2. Uji stabilitas dipercepat dengan 1 peringkat suhu
24
Tabel IX. Kadar ketotifen fumarat dan siproheptadin HCl setelah
pemanasan selama 7 hari dengan menggunakan suhu 400 C
Hari
Kadar siproheptadin HCl (%B/B)
X ± SE
Kadar ketotifen fumarat (%B/B)
X ± SE
0 0,40 ± 0,02 0,24 ± 0,02
1 0,40 ± 0,02 0,25 ± 0,01
2 0,39 ± 0,01 0,25 ± 0,01
3 0,41 ± 0,02 0,28 ± 0,01
4 0,37 ± 0,02 0,23 ± 0,03
5 0,34 ± 0,02 0,24 ± 0,01
6 0,40 ± 0,03 0,35 ± 0,03
7 0,36 ± 0,01 0,27 ± 0,01
Hasil uji stabilitas ketotifen fumarat dan siproheptadin dalam sediaan racikan pulveres selama 7 hari dengan pemanasan pada suhu 400Ctelah tercantum pada tabel IX. Berdasarkan uji statistik menggunakan One Way ANNOVA dengan tingkat signifikansi 95% perbedaan kadar ketotifen fumarat dan kadar siproheptadin HCl setelah pemanasan selama 7 hari adalah berbeda bermakna. Adanya perbedaan kadar yang bermakna setelah pemanasan selama 7 hari, tidak dapat membuktikan bahwa sediaan racikan pulveres campuran ketotifen fumarat dan siproheptadin HCl ini tidak stabil selama 1 bulan kedepan.
24
dan siproheptadin HCl dikatakan stabil apabila kadar siproheptadin dalam racikan sediaan tersebut tidak kurang dari 90% dan tidak lebih dari 110%.
Hasil persentase perubahan kadar ketotifen fumarat dan siproheptadin HCl selama 7 hari tertera pada tabel X. Persentase perubahan kadar tersebut didapat dengan membandingkan kadar pada hari tertentu dengan kadar pada hari ke-0.
Tabel X. Persentase perubahan kadar ketotifen fumarat dan siproheptadin
HCl setelah pemanasan selama 7 hari dengan menggunakan suhu 400C
Hari Persentase perubahan kadar ketotifen fumarat
Persentas e perubahan kadar siproheptadin HCl
0 100,00 100,00
1 104,17 100,00
2 104,17 97,50
3 116,67 102,50
4 95,83 92,50
5 100,00 85,00
6 145,83 100,00
7 112,5 90,00
24
sehingga adanya sedikit saja perbedaan antar tiap bungkus pulveres saat pembagian serbuk campuran obat dalam proses peracikan dapat memberikan perbedaan kadar yang menjadi sangat bermakna. Jadi adanya perbedaan kadar bukan berarti terjadi degradasi atau perubahan zat aktif karena pemanasan yang dilakukan selama 7 hari sehingga mempengaruhi kadarnya dalam tiap sediaan racikan pulveres.
Terjadinya perbedaan kadar selain disebabkan karena zat aktif yang terlalu kecil, dapat pula disebabkan karena perubahan bentuk sediaan. Sediaan siproheptadin HCl yang digunakan (Pronicy, Kalbe Farma) merupakan kaplet salut film seharusnya bentuk sediaan bersalut tidak boleh dipecah lagi karena adanya salut berfungsi untuk melindungi sediaan agar tidak rusak oleh asam lambung. Proses peracikan yang dilakukan telah merusak lapisan film yang ada pada kaplet menyebabkan ada sebagian siproheptadin HCl yang masih menempel pada salutnya sehingga tidak dapat larut sempurna dengan pelarut yang digunakan sehingga mempengaruhi kadarnya saat dilakukan penetapan kadar.
3. Menggunakan 25% dari waktu expired date sediaan aslinya
24
Sediaan racikan pulveres campuran ketotifen fumarat dan siproheptadin HCl merupakan sediaan padat sehingga beyond use datenya adalah 6 bulan atau tidak lebih dari 25% dari expired date dari tablet ketotifen fumarat atau siproheptadin HCl yang memiliki expired date yang lebih singkat. Expired date
untuk tablet ketotifen fumarat (Profilas, Dankos) adalah April 2010 dan untuk tablet siproheptadin HCl (Pronicy, Kalbe Farma) adalah Mei 2010. Maka beyond use date dari sediaan racikan pulveres campuran ketotifen fumarat dan siproheptadin HCl adalah 25% dari sisa expired date tablet ketotifen fumarat. Sisa
expired date untuk tablet ketotifen fumarat adalah 3 tahun (2007-2010) sehingga
beyond use date dari sediaan racikan pulveres campuran ketotifen fumarat dan siproheptadin HCl adalah 9 bulan, dihitung sejak tanggal peracikan (28 Agustus 2007) yaitu 28 Mei 2008.
D. Evaluasi Penentuan Beyond Use Date di Rumah Sakit X
Rumah sakit X hingga saat ini masih menggunakan expired date dari sediaan tablet ketotifen fumarat atau siproheptadin HCl yang lebih singkat untuk menentukan lama masa edar dari sediaan racikan pulveres, belum mengenal adanya beyond use date. Menurut Kupiec (2003), untuk sediaan racikan berbentuk nonaqueous liquids dan sediaan padat tidak lebih dari 25% dari sisa waktu expired date obatnya atau 6 bulan, dipilih mana yang lebih singkat. Sesuai dengan hasil perhitungan beyond use date dengan menggunakan 25% dari waktu
24
sakit X adalah 9 bulan. Jadi beyond use date yang dipilih untuk sediaan racikan pulveres campuran ketotifen fumarat dan siproheptadin HCl dari rumah sakit X adalah 6 bulan.
BAB V
KESIMPULAN DAN SARAN
A. Kesimpulan
1. Hasil uji stabilitas dari 3 peringkat suhu dan 1 peringkat suhu tidak dapat digunakan untuk menentukan beyond use date sediaan racikan pulveres campuran ketotifen fumarat dan siproheptadin HCl dari rumah sakit X.
2. Penentuan beyond use date sediaan racikan pulveres campuran ketotifen fumarat dan siproheptadin HCl dari rumah sakit X hanya boleh 6 bulan dari tanggal peracikannya.
B. Saran
1. Sebaiknya kelembaban ruang saat uji stabilitas dikendalikan.
2. Perlu dilakukan uji stabilitas dengan waktu pemanasan yang lebih lama. 3. Sampel sebaiknya dibuat sendiri.
C. Keterbatasan Penelitian
44
DAFTAR PUSTAKA
Adrianto, T. A., 2008, Analisis Bikomponen Campuran Siproheptadin HCl dan Ketotifen Fumarat Secara Spektrofotometri Ultraviolet dengan Aplikasi Panjang Gelombang Berganda, Skripsi, Universitas Sanata Dharma, Yogyakarta
Anief, M., 2003, Ilmu Meracik Obat : Teori dan Praktik, Gadjah Mada University Press, Yogyakarta, 34-44
Anonim, 1995, Farmakope Indonesia, Edisi ke-4, Departemen Kesehatan Republik Indonesia, Jakarta, 14-15
Anonim, 2001 (a), Pedoman Cara Pembuatan Obat yang Baik, Badan Pengawasan Obat dan Makanan, Jakarta,
Anonim, 2001 (b), Petunjuk Operasional Penerapan Cara Pembuatan Obat yang Baik, Badan Pengawasan Obat dan Makanan, Jakarta,
Anonim, 2001 (c), Report 1 of the Council on Scientific Affairs (A-01) Full Text,
America Medical Association,
http://www.ama-assn.org/ama/pub/category, diakses pada 16 Mei 2007
Anonim, 2004, Guidelines For The Validation Of Analytical Methods For Active Constituent, Agricultural And Veterinary Chemical Products, Australian Pestisides & Veterinary Medicines Authority, http://www.apvma.gov.au, diakses pada 25 Juni 2007
Aulton, M.E., 2002, Pharmaceutics : The Science Of Dosage Form Design, Churchill Livingstone, United State of America, 109-111
Connors, K.A., Arnedon, G.L., and Stella, V.J., 1986, Chemical Stability of Pharmaceuticals : A Handbook for Pharmacists, Edisi2, John Willey & Sons Inc, Canada, 3-662
Doller,Colin, 1991, Therapeutic Drugs, Second Editition, Churchill Livingstone, United Kingdom, K25-K28
Fessenden, R.J. dan Fessenden, J.S., 1995, Kimia Organik, jilid II, diterjemahkan oleh Pudjaatmaka, A.H., edisi ke 3, Penerbit Erlangga, Jakarta, 436
Kupiec, Thomas, 2003, Beyond Use Dating-101, 201& 301, Analytical Research Laboratories, http://www.arlok.com, diakses pada 3 Oktober 2007
Lacy, Charles F., 2003, Drug Information Handbook, 11th edition, Lexi-Comp Inc, United State of America, 361-362
Martin, A., James Swarbrick, Arthur Cammarata, 1993, Farmasi Fisik : Dasar-dasar Farmasi Fisik dalam Ilmu Farmasetik, Edisi ke-3, Penerbit Universitas Indonesia, Jakarta, 745-746, 766, 812-813
Moffat, A.C., 1986, Clarke’s Isolation and Identification of Drugs in Pharmaceuticals, Body Fluids, and Post-mortem Material, Second Edition, The Pharmaceutical Press, London, 505-506, 698
Mulja, H.M., Suharman, 1995, Analisis Instrumental, Airlangga University Press, Surabaya, 236-252
Reynolds, Dan. W., 2002, Guidance and Best Practice for Conducting Forced
Degradation Studies, Pharmaceutical Technology,
http://www.pharmtech.com, diakses pada 16 Mei 2007
Lampiran 1. Sertifikat analisis ketotifen fumarat
Lampiran 3. Tabel hasil penimbangan baku siproheptain HCl dan contoh perhitungan seri larutan baku siproheptadin HCl
Contoh perhitungan konsentrasi larutan stok siproheptadin HCl: Replikasi I
konsentrasi larutan stok = berat zat yang ditimabng 10 ml
= 10,13 mg
10 ml = 1,013 mg/ml = 1013 ppm Pembuatan seri larutan baku:
Larutan stok siproheptadin HCl
↓
diambl sebanyak: 0,100 ml add 10,00 ml (seri 1) 0,125 ml add 10,00 ml (seri 2) 0,150 ml add 10,00 ml (seri 3) 0,175 ml add 10,00 ml (seri 4) 0,200 ml add 10,00 ml (seri 5) 0,225 ml add 10,00 ml (seri 6) 0,250 ml add 10,00 ml (seri 7)
Contoh perhitungan seri larutan baku: Seri 1: Vstok . Cstock = V1 . C1
0,100 ml . 1013 ppm = 10,00 ml . C1 C1 = 10,13 ppm
Seri 2: Vstok . Cstok = V2 . C2 0,125 ml . 1013 ppm = 10,00 ml . C2
C2 = 12,66 ppm
Seri 3: Vstok . Cstok = V3 . C3 0,150 ml . 1013 ppm = 10,00 ml . C2
C3 = 15,20 ppm Seri 4: Vstok . Cstok = V4 . C4
0,175 ml . 1013 ppm = 10,00 ml . C2 C4 = 17,73 ppm
Replikasi I Replikasi II Replikasi III Berat kertas
Berat kertas + zat
Berat kertas + zat (analitik) Berat kertas + sisa
0,2156 gram 0,2260 gram 0,22606 gram 0,21593 gram
0,2163 gram 0,2267 gram 0,22652 gram 0,21661 gram
0,2164 gram 0,2265 gram 0,22658 gram 0,21658 gram
Seri 5: Vstok . Cstok = V5 . C5 0,200 ml . 1013 ppm = 10,00 ml . C2
C5 = 20,26 ppm
Seri 6: Vstok . Cstok = V6 . C6 0,225 ml . 1013 ppm = 10,00 ml . C6
C6 = 22,79 ppm
Seri 7: Vstok . Cstok = V7 . C7 0,250 ml . 1013 ppm = 10,00 ml . C7
C7 = 25,35 ppm
Lampiran 4. Tabel hasil penimbangan baku ketotifen fumarat dan contoh perhitungan seri larutan baku ketotifen fumarat
Contoh perhitungan konsentrasi larutan stok siproheptadin HCl: Replikasi III
konsentrasi larutan stok = berat zat yang ditimabng 10 ml
= 10,17 mg
10 ml = 1,017 mg/ml = 1017 ppm Pembuatan seri larutan baku ketotifen fumarat:
Larutan stok ketotifen fumarat
↓
diambl sebanyak: 0,100 ml add 10,00 ml (seri 1) 0,125 ml add 10,00 ml (seri 2) 0,150 ml add 10,00 ml (seri 3) 0,175 ml add 10,00 ml (seri 4) 0,200 ml add 10,00 ml (seri 5) 0,225 ml add 10,00 ml (seri 6) 0,250 ml add 10,00 ml (seri 7)
Contoh perhitungan seri larutan baku: Seri 1: Vstok . Cstock = V1 . C1
0,100 ml . 1017 ppm = 10,00 ml . C1 C1 = 10,17 ppm
Seri 2: Vstok . Cstok = V2 . C2 0,125 ml . 1017 ppm = 10,00 ml . C2
C2 = 12,71 ppm
Seri 3: Vstok . Cstok = V3 . C3 0,150 ml . 1017 ppm = 10,00 ml . C2
C3 = 15,26 ppm
Replikasi I Replikasi II Replikasi III Berat kertas
Berat kertas + zat
Berat kertas + zat (analitik) Berat kertas + sisa
0,2404 gram 0,2413 gram 0,24149 gram 0,23202 gram
0,2327 gram 0,2428 gram 0,24290 gram 0,23282 gram
0,2348 gram 0,2451 gram 0,24518 gram 0,23501 gram
Seri 4: Vstok . Cstok = V4 . C4 0,175 ml . 1017 ppm = 10,00 ml . C2
C4 = 17,80 ppm
Seri 5: Vstok . Cstok = V5 . C5 0,200 ml . 1017 ppm = 10,00 ml . C2
C5 = 20,34 ppm
Seri 6: Vstok . Cstok = V6 . C6 0,225 ml . 1017 ppm = 10,00 ml . C6
C6 = 22,88 ppm
Seri 7: Vstok . Cstok = V7 . C7 0,250 ml . 1017 ppm = 10,00 ml . C7
Lampiran 5. Pemilihan Sampel
Berat 20 tablet Profilas (ketotifen fumarat)
No. Berat tablet
(gram) No.
Berat tablet (gram)
1 0,6258 11 0,6220
2 0,6111 12 0,6026
3 0,6166 13 0,6093
4 0,6309 14 0,6156
5 0,6226 15 0,6157
6 0,6213 16 0,6199
7 0,6200 17 0,6323
8 0,6221 18 0,6110
9 0,6114 19 0,6096
10 0,6098 20 0,6179
Berat rata-rata tablet Profilas : 0,6174 gram SD : 0,0076
Berat 20 tablet Pronicy (siproheptadin HCl)
No. Berat tablet
(gram) No.
Berat tablet (gram)
1 0,1483 11 0,1534
2 0,1476 12 0,1520
3 0,1483 13 0,1474
4 0,1514 14 0,1531
5 0,1478 15 0,1485
6 0,1538 16 0,1488
7 0,1524 17 0,1456
8 0,1501 18 0,1520
9 0,1470 19 0,1530
10 0,1503 20 0,1486
Berat rata-rata tablet Pronicy : 0,14999 gram SD : 0,0025
Berat pulveres yang digunakan dalam penelitian ini
Berat Pulveres (gram) Hari Suhu
400C
Suhu 500C
Suhu 600C 0,18527 0,18527 0,18527 0,18493 0,18493 0,18493 0
0,23246 0,23246 0,23246 0,22411 0,22585 0,20246 0,26156 0,23018 0,22642 1
0,23760 0,21579 0,19379 0,22587 0,21147 0,24315 0,23658 0,19655 0,23743 2
0,20558 0,18445 0,27517 0,21161 0,23836 0,19858 0,23391 0,24360 0,19756 3
0,21716 0,21030 0,18921 0,22729 0,21573 0,21788 0,21175 0,20365 0,22124 4
0,22054 0,20126 0,21