BAB II
TINJAUAN PUSTAKA
2.1. Thalassemia
Thalassemia adalah suatu penyakit anemia hemolitik herediter yang diturunkan dari kedua orangtua kepada anak-anaknya secara resesif yang disebabkan karena kelainan gen globin. Penyakit ini banyak ditemukan di daerah Mediterania dan daerah sekitar khatulistiwa (Abdoerrachman et al., 2007). Berdasarkan laporan World Health Organization (WHO) tahun 2006 sekitar 7% penduduk dunia diduga carrier Thalassemia, dan sekitar 300.000-500.000 bayi lahir dengan kelainan ini setiap tahunnya. Thalassemia merupakan salah satu kelainan genetik dengan proporsi 1,67% penduduk dunia sebagai penderita. Prevalensi gen Thalassemia tertinggi di negara-negara tropis, namun dengan tingginya angka migrasi, penyakit ini telah ditemukan di seluruh dunia.
Di Indonesia, Thalassemia merupakan penyakit terbanyak di antara golongan anemia hemolitik dengan penyebab intrakorpuskuler. Sampai saat ini, ditemukan kira-kira 200 jenis mutasi (cacat molekul) pada gen globin. Mutasi
pada gen globin α atau β mengakibatkan tidak terjadinya atau berkurangnya
Keadaan klinis penyakit Thalassemia bervariasi, yaitu gejala anemia yang berat sehingga membutuhkan transfusi secara teratur pada Thalassemia mayor (bentuk homozigot) dan gejala anemia ringan atau tanpa anemia, tetapi morfologi sel eritrositnya terlihat abnormal pada Thalassemia minor (bentuk heterozigot). Selain itu, dikenal pula Thalassemia intermedia dan Thalassemia minima. Pada Thalassemia intermedia gejala klinisnya tidak seberat Thalassemia mayor dan sifat genetiknya diduga berbentuk heterozigot ganda. Sementara pada Thalassemia minima, pasien tidak mengalami anemia dan morfologi sel eritrositnya normal tetapi pasien menyandang gen Thalassemia.
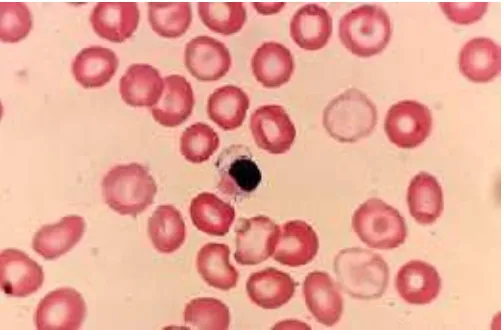
Gambar 2.1. Morfologi eritrosit penderita Thalassemia (Lichtman’s Atlas of Hematology)
Penderita Thalassemia ini tampak seperti orang normal, sehingga diagnosis perlu ditegakkan melalui analisis DNA (diagnosis molekuler), diagnosis yang langsung menunjukkan kelainan urutan DNA pada pasien (Suryohudoyo et al., 2000).
sering ditemukan karena rantai globin α dan β adalah komponen utama
hemoglobin dewasa.
Pada Thalassemia α terjadi gangguan sintesis rantai globin α, yang
mengakibatkan produksi rantai globin α berkurang atau tidak ada. Sedangkan
gangguan sintesis rantai globin β, yang mengakibatkan produksi rantai globin β
berkurang atau tidak ada , disebut Thalassemiaβ(Suryohudoyo et al., 2000). Pada Thalassemia α, rantai globin α yang sedikit disintesis, bergabung
dengan rantai globin β dan δ sehingga HbA (α2β2) dan HbA2(α2δ2) yang terbentuk
juga sedikit. Sintesis rantai globin α yang terlalu sedikit ini mengakibatkan rantai
globin β dan γ berlebih sehingga terbentuk HbH (β4) dan Hb Bart (γ4)
(Suryohudoyo et al., 2000; Weatherall, 1997).
Pada Thalassemia β, sintesis rantai globin β berkurang, sehingga
pembentukan HbA (α2β2) juga berkurang. Namun pembentukan HbA2(α2δ2) tidak
berkurang bahkan dapat meninggi kira-kira dua kali lipat dari biasa. Selain itu,
kadar HbF (α2γ2) juga meninggi.
2.1.1. Membran sel eritrosit pada penderita Thalassemia
Telah diketahui bahwa cacat molekul (mutasi) pada gen globin α atau β mengakibatkan tidak terjadinya atau berkurangnya sintesis rantai globin tersebut.
Hal ini mengakibatkan terjadi ketidakseimbangan jumlah antara rantai globin α
dan rantai globin β. Jumlah rantai globin α dan β yang tidak seimbang pada
penderita Thalassemia mengakibatkan adanya rantai globin yang tidak berpasangan.
Pada Thalassemia β terdapat rantai globin α yang berlebih, yang akan mengalami disintegrasi menjadi bentuk monomer yang tidak stabil. Rantai globin yang tidak stabil ini akan mengalami otooksidasi dan mengendap pada membran. Pengendapan rantai globin ini tampak sebagai bahan inklusi atau badan Heinz, dan dapat menghasilkan radikal oksigen dalam jumlah besar. Hemoglobin merupakan salah satu sasaran untuk radikal oksigen selain komponen-komponen membran sehingga kadar hemoglobin yang rendah pada penderita Thalassemia mengakibatkan radikal oksigen semakin mudah mengoksidasi komponen-komponen membran (Shinar et al, 1987).
Otooksidasi pada membran sel eritrosit dapat mengakibatkan perubahan struktur protein membran, antara lain terjadinya ikatan lintas silang antara protein membran disertai berkurangnya gugus sulfhidril. Hasil elektroforesis protein membran sel eritrosit Thalassemia menunjukkan adanya band (pita) protein tambahan dengan BM sekitar 30.000 yang mungkin dihasilkan dari ikatan lintas silang beberapa protein membran (Olivieri et al., 1994).
protein spektrin berinteraksi dengan rantai globin αyang mengalami peroksidasi,
dengan protein 4.1 berinteraksi dengan protein spektrin dan aktin. Kelainan struktural spektrin tidak mengakibatkan gangguan fungsi karena ikatan spektrin dengan komponen lainnya tidak terpengaruh. Sedangkan interaksi protein 4.1 dengan protein lain mengakibatkan penurunan kemampuan protein 4.1 untuk mengikat spektrin (Olivieri et al., 1994).
Telah dilaporkan ada pula ptotein lain yang mengalami perubahan, yaitu protein Band 3. Protein Band 3 merupakan protein transmembran sel eritrosit yang berfungsi sebagai penukar ion. Perubahan yang terjadi pada protein Band 3 akibat adanya otooksidasi membran, adalah berupa tidak bisa diamatinya protein tersebut (tampak tipis) pada hasil elektroforesis protein dengan menggunakan SDS PAGE 10% dan disertai dengan munculnya pita tambahan (penebalan pita) yang berat molekulnya lebih kecil (± 80 kD). Disimpulkan protein tersebut telah mengalami degradasi menjadi molekul yang lebih kecil (Voet, 1995; Hamasaki, 1999; Wang, 1994).
Perubahan struktur membran sel eritrosit Thalassemia akibat otooksidasi juga terjadi pada lipid membran. Pada sel eritrosit Thalassemia terjadi peroksidasi lipid. Sel eritrosit penderita Thalassemia lebih peka terhadap oksidasi daripada sel eritrosit normal, ditemukan bahwa malondialdehid (MDA), suatu produk pemecahan sekunder pada peroksidasi lipid, sangat meningkat pada pemberian H2O2, sebagai beban oksidatif eksogen pada sel eritrosit Thalassemia (Rachmilewitz, 1982).
membran dwilapis lipid, sedangkan fosfatidiletanolamin (FE) dan fosfatidilserin (FS) terdapat pada lapis luar membran dwilapis. Perubahan asimetri fosfolipid membran ini dapat berperan penting pada proses fagositosis sel eritrosit pada sistem retikuloendotelial. Selain itu, persentase FE dan asam lemak tak jenuh jamak berkurang. FE dan asam lemak tak jenuh jamak rentan terhadap peroksidasi sehingga penurunan jumlah kedua jenis molekul tersebut menunjukkan tingginya tingkat oksidasi (Shinar et al., 1990).
Perubahan struktur membran sel eritrosit yang terjadi akibat otooksidasi membran menyebabkan membran sel eritrosit menjadi lebih rigid, sehingga menurunkan kemampuan deformabilitas membran sel eritrosit. Selain rigid, sel eritrosit Thalassemia menjadi lebih kecil. Perubahan-perubahan ini akan ditanggapi sebagai suatu sinyal oleh sistem makrofag berupa isyarat untuk merusak sel tersebut. Selain itu, penurunan deformabilitas membran sel eritrosit juga dapat mengakibatkan pendeknya usia sel terutama pada saat melalui pembuluh darah yang sangat kecil. Berkurangnya kemampuan deformabilitas membran sel yang mengandung badan Heinz dapat mengakibatkan sel tersebut tidak dapat melalui sinusoid limpa sehingga terperangkap di dalamnya dan kemudian dihancurkan (Olivieri et al., 1994).
Selanjutnya sel eritrosit tersebut difagositosis oleh makrofag limpa atau hati. Pembentukan antigen pada permukaan sel eritrosit ini dipicu oleh denaturasi hemoglobin, pembentukan hemikrom dan agregasi protein (Shinar et al., 1990).
2.1.2. Hemoglobin
Diketahui bahwa Thalassemia adalah suatu kelainan genetik pada gen globin sehingga terjadi gangguan sintesis protein globin yang menyusun hemoglobin. Hemoglobin merupakan molekul yang terdiri dari heme dan protein globin, yang saling berikatan satu sama lain. Heme merupakan gugus prostetik yang mengandung besi (Fe), dan memiliki kemampuan untuk mengikat oksigen secara reversible. Globin adalah suatu protein yang berada di sekitar heme dan berikatan dengannya untuk melindungi molekul heme (Olivieri et al., 1999).
Hemoglobin adalah molekul yang mengandung 4 rantai polipeptida, 2 rantai
globin α dan 2 rantai globin β. Perbedaan keempat rantai globin tersebut terletak
pada jumlah dan susunan asam aminonya. Rantai globin α terdiri dari 141 asam
amino sedangkan rantai globin β terdiri dari 146 asam amino. Keempat rantai globin tersebut mengikat gugus heme yang mengandung atom Fe. Gugus heme yang terikat keempat rantai globin akan membentuk molekul hemoglobin (Higgs et al., 2001).
Rantai globin dapat dibagi menjadi 2 (dua) kelompok yaitu : kelompok α
dan kelompok β. Kelompok α terdiri dari rantai globin α dan ζ; dan kelompok β
terdiri dari rantai globin β, γ, δ dan ε. Selama perkembangan dari masa embrio
sampai dengan dewasa dikenal dua fase perubahan produksi rantai globin
Semua rantai polipeptida tersebut disintesis di ribosom. Jenis rantai globin
kelompok α yang diproduksi pada masa embrio adalah rantai globin ζ dan α,
sedangkan selama masa fetus sampai dewasa hanya rantai globin α yang tetap
diproduksi. Jenis rantai globin kelompok β yang diproduksi pada masa embrio
adalah rantai globin ε dan γ, masa fetus : rantai globin γ, sedangkan pada masa
dewasa rantai globin β dan δ. Kombinasi dari 2 rantai globin kelompok α dan 2
rantai globin kelompok β menghasilkan molekul hemoglobin sempurna (Higgs et
al., 2001).
Berdasarkan komposisi pasangan 2 rantai globin kelompok α dan 2 rantai
globin kelompok β terdapat enam varian hemoglobin yang secara normal dibentuk
selama perkembangan manusia : 1. Hemoglobin embrio :
- Hb Gower I : 2 rantai globin ζ dan 2 rantai globin ε (ζ2ε2) - Hb Gower II : 2 rantai globin α dan 2 rantai globin ε (α2ε2) - Hb Portland : 2 rantai globin ζ dan 2 rantai globin γ (ζ2γ2) 2. Hemoglobin fetus (HbF) :
Dihasilkan pada awal minggu ke-8 kehamilan sampai sekitar 48 minggu setelah kelahiran. HbF mempunyai afinitas yang tinggi terhadap oksigen dengan tujuan memperoleh/ menangkap oksigen dari darah ibu dan diberikan ke fetus.
HbF : 2 rantai globin α dan 2 rantai globin γ (α2γ2) 3. Hemoglobin dewasa :
- HbA (95%) : 2 rantai globin α dan 2 rantai globin β (α2β2) - HbA2 (23,5%) : 2 rantai globin α dan 2 rantai globin δ (α2δ2) - Sisa HbF (>2%) : 2 rantai globin α dan 2 rantai globin γ (α2γ2)
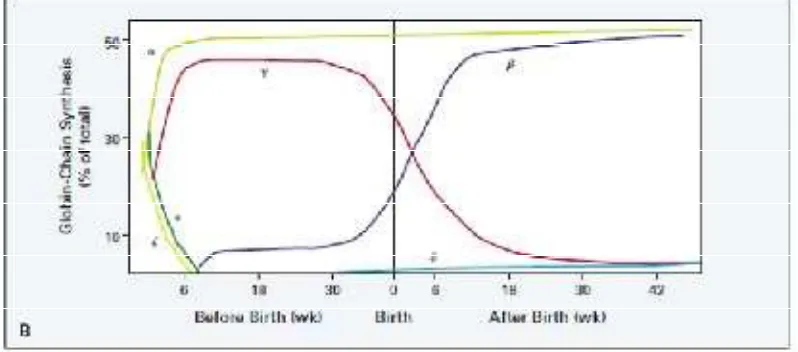
Konsentrasi molekul globin α agak stabil pada kehidupan fetus dan dewasa.
Globin β tampak pada awal kehidupan fetus sangat rendah konsentrasinya dan
mulai meningkat dengan cepat setelah 30 minggu umur kehamilan dan mencapai
maksimum sekitar 30 minggu setelah lahir. Molekul globin γ mencapai
konsentrasi yang tinggi awal kehidupan fetus sekitar 6 minggu dan mulai menurun sekitar 30 minggu umur kehamilan, mencapai konsentrasi yang rendah sekitar 48
minggu umur kehamilan. Globin δ tampak dengan konsentrasi rendah pada sekitar
30 minggu umur kehamilan dan selama kehidupan tetap terjaga dalam keadaan konsentrasi rendah (Gambar 2.2) (Olivieri, 1999; Higgs et al., 2001).
Gambar 2.2. Perkembangan hemoglobin manusia (Olivieri, 1999)
oksigen secara efisien. Dua hemoglobin dimer bergabung membentuk hemoglobin tetramer, merupakan hemoglobin yang fungsional (Higgs et al., 2001).
Gen-gen yang mengkode rantai globin kelompok α (globin αlocus) berada
pada kromosom 16, dan yang mengkode kelompok β (globin β locus) berada pada
kromosom 11. Ekspresi dari gen-gen kelompok α dan β hampir seimbang oleh mekanisme yang sampai saat ini belum diketahui. Keseimbangan ekspresi gen ini dibutuhkan untuk fungsi sel eritrosit yang normal. Gangguan pada keseimbangan ini menyebabkan suatu kelainan yang disebut Thalassemia (Olivieri, 1999; Higgs et al., 2001).
Gen-gen globin di atas berekspresi secara spesifik sesuai dengan tingkat perkembangan; gen-gen globin tersebut ‘dihidupkan’ dan ‘dimatikan’ untuk menghasilkan bentuk hemoglobin yang sesuai pada tingkat perkembangan yang berbeda (haemoglobin switching). Sehingga dengan terjadinya switching, pada masa dewasa ditemukan HbA (Olivieri, 1999).
Gen globin ζ dari kelompok gen globin α diekspresikan hanya selama
beberapa minggu pertama dari perkembangan embrio (embriogenesis). Sesudah
itu, gen globin α mengambil alih/ menggantikan. Untuk kelompok gen globin β,
gen globin ε diekspresikan pada permulaannya selama masa embriogenesis, gen
globin γ diekspresikan selama perkembangan fetus. Sekitar waktu kelahiran,
produksi globin γ menurun dan sebaliknya sintesis globin β meningkat (Olivieri,
2.1.3. Thalassemiaβ
Thalassemiaβ diturunkan secara autosom resesif dan timbul karena adanya
cacat molekul (mutasi) pada gen globin β yang terletak pada kromosom 11. Gen
globin β terdiri dari tiga ekson yang dipisahkan oleh dua intron (Olivieri, 1999;
Gibbons et al., 2001) .
Gen Thalassemia β umum disebut βT. Karena tiap kromosom hanya
mengandung satu gen β, maka haplotipe yang mungkin adalah β/ dan βT
/ dengan genotip : β/β normal, β/βT thalassemia β heterozigot, βT/βT thalassemia β homozigot. Oleh karena itu Thalassemiaβ dikategorikan ke dalam tiga golongan : Thalassemia β minor (carrier), Thalassemia β intermedia, dan Thalassemia β mayor (Higgs et al., 2001).
Penderita Thalassemia minor adalah individu yang secara klinis tidak sakit (tampak seperti orang normal) disertai anemia ringan dengan kelainan gen heterozigot dan disebut dengan trait atau carrier. Telah diyakini adanya seleksi positif terhadap infeksi Plasmodium, karena individu dengan Thalassemia trait memperoleh keuntungan protektif terhadap malaria. Hal ini ditunjukkan dengan distribusi penderita Thalassemia yang sama dengan daerah yang umum terdapat nyamuk malaria, tetapi penderita tidak terkena penyakit malaria (Olivieri, 1999).
Thalassemia intermedia menggambarkan kondisi anemia yang lebih berat daripada Thalassemia minor tetapi tidak separah mayor. Penderita Thalassemia intermedia diduga memiliki kelainan gen heterozigot ganda yang menyebabkan
penurunan produksi rantai β, tetapi tidak sampai tingkat yang membutuhkan terapi
Thalassemia mayor merupakan bentuk klinis yang berat dimana penderita mengalami anemia berat sejak awal masa kanak-kanak dan sangat tergantung pada transfusi darah. Kelainan gen pada jenis ini biasanya homozigot atau heterozigot ganda (Higgs et al., 2001).
Individu dengan 2 alel thalassemiaβ baik homozigot atau heterozigot ganda, pada umumnya secara klinis sesuai dengan Thalassemia β mayor yang ditandai dengan anemia berat dan ketergantungan pada transfusidarah. Jika rantai globin β sama sekali tidak diproduksi sehingga HbA tidak ada, kondisinya disebut Thalassemiaβ0, tetapi bila produksi rantai globin β masih ada (menurun) dan HbA masih dapat terdeteksi, disebut Thalassemia β+. Sedangkan individu yang hanya membawa 1 alel Thalassemia β (carrier atau trait) umumnya secara klinis tidak dapat dibedakan dari individu normal. Individu tersebut umumnya mempunyai eritrosit yang hipokrom mikrositik dan kadang-kadang mengalami anemia ringan (Olivieri, 1999; Higgs et al., 2001).
2.1.4. Terapi
sebagian besar besi dalam serum penderita Thalassemia berasal dari pemberian darah transfusi (Abdoerrachman et al., 2007).
2.2. Mentzer Index
Mentzer Index ditemukan pertama kali pada tahun 1973 oleh Mentzer. Mentzer Index dinyatakan dapat digunakan untuk membedakan Anemia Defisiensi Besi dengan Thalassemia. Apabila hasil pemeriksaan darah tepi memperlihatkan adanya anemia mikrositik, Mentzer Index dapat digunakan untuk membedakan antara kedua kelainan di atas. Pada pelaksanaannya, meskipun Mentzer Index bukanlah indikator utama, namun sering digunakan untuk skrining penderita Thalassemia. Mentzer Index diperoleh dari hasil pemeriksaan darah lengkap, yaitu, nilai Mean Corpuscular Volume (MCV) dibagi dengan nilai Red Blood Cell Count (RBC). Nilai Mentzer Index di bawah 13 dinyatakan sebagai tersangka penderita Thalassemia dan nilai Mentzer Index di atas 13 dinyatakan sebagai tersangka penderita Anemia Defisiensi Besi.
2.3. Protein Membran Sel Eritrosit
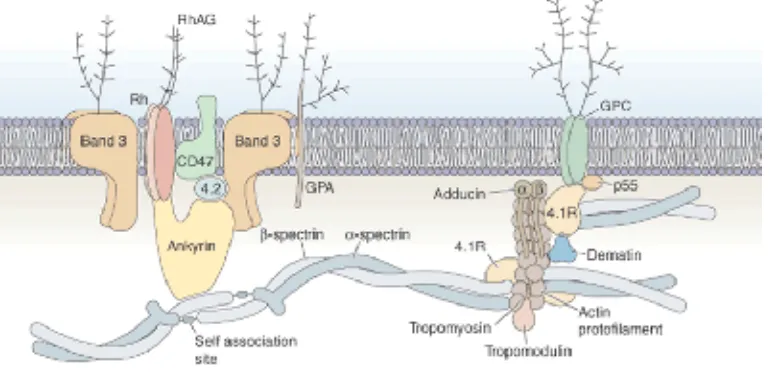
Membran biologis tersusun dari suatu dwilapis lipid, protein dan sejumlah kecil karbohidrat (Gambar 2.3). Pada umumnya membran sel berfungsi untuk : mengangkut molekul masuk dan keluar sel, transduksi sinyal, mempertahankan bentuk sel, dan interaksi sel dengan sel.
Gambar 2.3. Skema membran eritrosit (Young et al., 2006)
Secara umum, protein membran dapat dibagi dalam dua bagian, yaitu protein ekstrinsik dan protein intrinsik.
2.3.1. Protein ekstrinsik
Protein ekstrinsik berkaitan dengan membran melalui ikatan hidrogen dan ikatan ionik (Voet, 1995).
Protein ekstrinsik terdiri atas spektrin, ankirin, aktin, protein band 4.1 dan protein kecil lainnya. Protein-protein ini memainkan peran penting untuk mempertahankan bentuk bikonkaf sel eritrosit serta fleksibilitas membran (Voet, 1995).
Protein membran sel eritrosit diberi nomor sesuai dengan nomor urutan pita-pita polipeptida, hasil pemisahan protein membran dengan elektroforesis gel poliakrilamid-SDS. Protein band 1dan band 2merupakan suatu protein ekstrinsik membran sel eritrosit yang terletak pada sitosol, yang disebut spektrin. Spektrin merupakan protein mayor dari komponen membran skeleton sel eritrosit. Spektrin terdiri atas dua heterodimer yaitu spektrin α (band 1), dengan berat molekul
240.000, dan spektrin β (band 2), dengan berat molekul 220.000. Spektrin α
memiliki tempat pengikatan untuk spektrin β, sedangkan spektrin β memiliki
tempat pengikatan untuk ankirin. Spektrin berjumlah kira-kira 25-30% dari seluruh protein membran (Voet, 1995).
Ankirin (band 2.1) merupakan protein ekstrinsik dengan BM 215.000 yang
menghubungkan ikatan spektrin β dengan Band 3. Pada elektroforesis, ankirin
tampak sebagai band 2.1, 2.2, 2.3(Voet, 1995).
Protein 4.1 merupakan suatu protein ekstrinsik dengan BM 80.000. Protein ini berjumlah sekitar 6% dari seluruh protein membran.
Protein 4.9 merupakan protein ekstrinsik, dengan BM 48.000. Protein ini merupakan suatu fosfoprotein dan mungkin berfungsi sebagai protein pengikat aktin (Voet, 1995).
Aktin tampak sebagai band 5 dan merupakan protein sitoskeleton yang sebagai suatu monomer memiliki BM 42.000. Aktin membentuk suatu protofilamen aktin F yang terdiri atas 10-13 monomer (Voet, 1995).
2.3.2. Protein intrinsik
Protein intrinsik atau protein integral merupakan protein yang letaknya tertanam di dalam lapisan lipid membran. Umumnya protein intrinsik memiliki 3 domain yang spesifik, yaitu domain ekstraseluler, domain intramembran dan domain sitoplasma.
Domain ekstraseluler umumnya merupakan domain tempat terikatnya reseptor dan terglikosilasi. Domain intramembran bersifat sangat hidrofobik sehingga dapat terikat erat pada membran dan hanya dapat dipisahkan dari membran dengan menggunakan suatu bahan yang dapat merusak membran seperti larutan organik dan detergen. Domain sitoplasma bersifat hidrofilik yang dapat berhubungan dengan protein-protein perifer. Dengan demikian protein intrinsik merupakan protein amfipatik.
terhadap beberapa virus dan racun. Bagian ujung karboksil membentang ke dalam sitosol dan terikat pada protein 4.1 dan spektrin (Voet, 1995).
2.4. Protein Band 3
Protein Band 3 merupakan protein intrinsik atau protein integral utama membran sel eritrosit. Protein ini mempunyai berat ± 95.000 D dan merupakan suatu glikoprotein (mengikat karbohidrat ± 7%). Persentase Band 3dari berat total protein yang ada di membran adalah 25 – 30 %. Protein ini dinamakan Band 3, karena dengan menggunakan elektroforesis SDS gel poliakrilamid terhadap membran sel eritrosit manusia, protein ini tampak sebagai pita yang ketiga (Voet, 1995).
Dengan menggunakan teknik imunokimia atau teknik biologi molekuler, dapat ditemukan adanya protein Band 3 di dalam sel epitel ginjal, paru-paru dan usus, juga di hati, otak dan jantung, serta di sel-sel precursor eritrosit dan di sel B dan T. Protein Band 3eritrosit dan non eritrosit ini merupakan produk dari 3 gen yang berbeda, yaitu gen AE1 (anion exchanger1), AE2, dan AE3, masing-masing gen mentranskripsi bentuk-bentuk mRNA yang berbeda pula dan berlokasi pada kromosom yang terpisah (kromosom 17, 7 dan 2). Domain hidrofobik dari produk ketiga gen AE ini mempunyai kemampuan menjalankan pertukaran anion melalui membran plasma (Voet, 1995).
mengekspresikan protein AE3 yang ditemukan di otak, retina dan hati (Voet, 1995).
Protein Band 3 membran sel eritrosit merupakan produk dari gen AE1, yang berlokasi pada kromosom 17q21 dengan panjang 17 ribu pasang basa (pb) yang terdiri dari 20 ekson dan 19 intron. Belum ada laporan tentang transkripsi gen AE1 manusia dalam sel eritrosit, tetapi telah diketahui pada bagian promotor transkripsi ini tidak ada kotak TATA atau kotak CCAAT dan mengandung sekuens-sekuens konsensus untuk tempat pengikatan beberapa faktor transkripsi (Hamasaki, 1999; Wang, 1994).
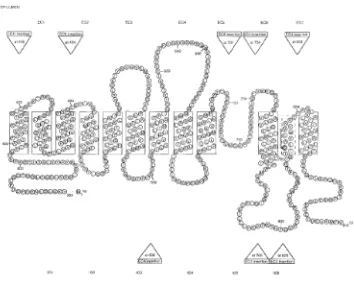
Protein Band 3 membran sel eritrosit mengandung ± 911 asam amino dan menembus membran lipid dua lapis pada 14 tempat serta memiliki beberapa bagian yang menonjol ke luar sel membentuk struktur simpai (loop) (Gambar 2.4). Protein Band 3 terbagi dalam dua domain dengan fungsi yang berbeda, yaitu domain N-terminal (sekitar 40 kD) dan domain C-terminal (sekitar 55kD).
Gambar 2.
2.4. Model protein Band 3eritrosit (Human AE1)
tidak mengalami kerusakan ketika melalui kapiler diameternya karena sel eritrosit memiliki kemampuan untuk
deformabilitas. Bentuk normal dan kemampuan deformabilitas dipertahankan oleh struktur protein rangka membran
protein 4.1, protein 4.2 dan ankirin. Protein Band 3 fungsi protein rangka membran ini dengan adanya
dengan ankirin. Protein 4.1 yang menstabilkan hubungan s mengikat protein Band 3 dengan afinitas yang rendah (agak
nkirin juga mengikat domain sitoplasma dari protein pada tempat yang terpisah (Milka et al., 1999).
Domain C-terminal protein Band 3 disebut juga domain membran, merupakan domain yang tertanam atau berada di dalam lipid bilayer membran, bersifat hidrofobik, dan mempunyai fungsi memperantarai/ sebagai media pertukaran anion inorganik melalui membran, terutama bikarbonat dan klorida (Hamasaki, 1999; Wang, 1994).
Diketahui protein Band 3 merupakan protein integral membran sel eritrosit yang berfungsi sebagai protein penukar anion, yaitu pada transport ion HCO3-dan Cl- melalui membran sel eritrosit sesuai dengan gradient konsentrasi. Sel eritrosit melakukan fungsi transport CO2 melalui peran protein Band 3 sebagai penukar anion tersebut (Hamasaki, 1999; Wang, 1994).
Dalam darah, CO2 mengalami hidrasi menjadi asam karbonat (H2CO3) dengan bantuan enzim anhidrase karbonat. Pada pH netral, H2CO3 mudah berdisosiasi menjadi HCO3-dan H+. Dengan demikian, CO2diangkut dalam darah dalam bentuk HCO3-(Voet, 1995; Hamasaki, 1999; Wang, 1994).
Di jaringan, CO2 masuk ke dalam sel eritrosit dan membentuk H2CO3. Sebagian H2CO3 keluar sel eritrosit dan masuk ke plasma, sedangkan sebagian lagi membentuk HCO3-. Ion HCO3- yang terbentuk masuk ke dalam plasma sementara ion Cl- masuk ke dalam sel eritrosit. Pertukaran antara HCO3-, yang keluar dari sel eritrosit, dengan Cl-, yang masuk ke dalam sel eritrosit terjadi melalui protein Band 3. Pada paru-paru, pertukaran anion melalui protein Band 3 tersebut terjadi dengan arah yang berkebalikan dengan pertukaran anion dalam jaringan (Murray, 1997).
bikarbonat pada tubulus colectivus ginjal. Protein Band 3 juga dapat berfungsi sebagai penanda sel eritrosit yang sudah tua. Agregat protein Band 3 yang terbentuk pada sel eritrosit yang sudah tua akan dikenal oleh sistem imunitas untuk segera menghancurkan sel tersebut (Murray, 1997).
2.5. Ovalositosis
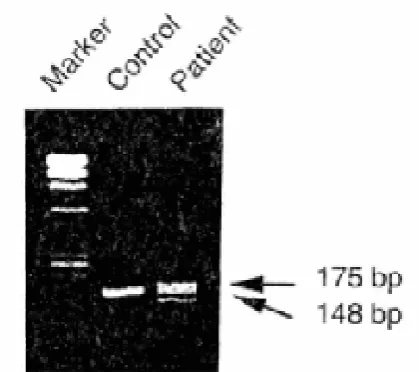
Gambar 2.5. PCR gen protein Band 3pada pasien ovalocytosis
Ciri morfologi ovalositosis selain bentuk oval adalah daerah pucat tak beraturan (irregular pale region) dan adanya stomatosis.
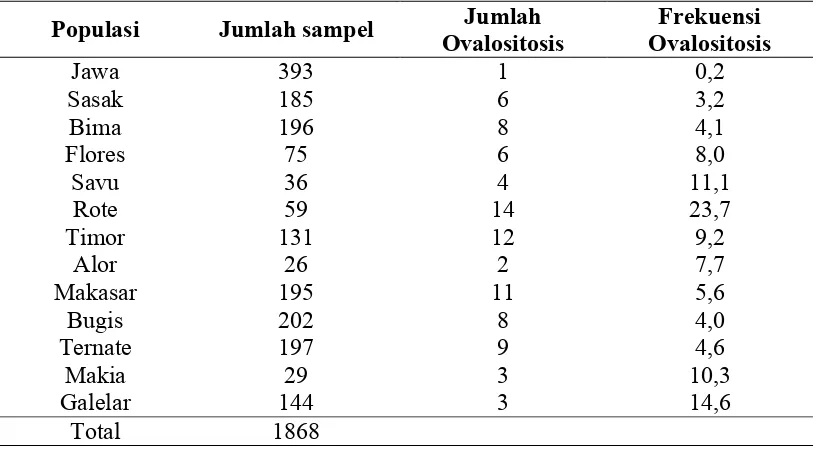
Perubahan pada membran dan bentuk sel eritrosit ini diduga merupakan salah satu mekanisme perlindungan terhadap malaria. Mekanisme resistensi SAO terhadap malaria serta berbagai faktor yang berhubungan dengan resistensi tersebut masih diperdebatkan. Penelitian mengenai frekuensi terjadinya ovalositosis sering dilakukan pada daerah endemis malaria. Pada penelitian yang dilakukan pada tahun 1999 oleh Tumpal Yansen Sihombing di Desa Tanjung Tirta, Kecamatan Punggelan, Kabupaten Banjarnegara, Jawa Tengah, dengan metode PCR, diperoleh bahwa dari 280 orang penduduk terdapat 24 orang yang merupakan individu dengan ovalositosis (8,6%) dan individu dengan ovalositosis tersebut menunjukkan insiden malaria yang lebih rendah dibandingkan dengan individu yang non ovalositosis.
metode PCR dalam mendeteksi ovalositosis tampak lebih handal dibandingkan pemeriksaan mikroskopis. Sensitifitas dan spesifisitas pemeriksaan molekuler dengan metode PCR terhadap sampel ovalositosis dapat mencapai 100%, sementara sensitifitas dan spesifisitas berdasarkan gambaran morfologi sel eritrosit berbentuk oval, berdasarkan morfologi irregular pale region dan berdasarkan morfologi stomatosis untuk sampel ovalositosis tidak mencapai 100%. Diagnosis ovalositosis berdasarkan gambaran morfologi sangat dipengaruhi oleh kriteria yang digunakan. Hingga saat ini belum ada kesepakatan bahwa yang disebut ovalositosis adalah jika pada gambaran morfologis ditemukan eritrosit oval antara 1-25%, 50-90%, atau di atas 90%. Sementara ini yang terbanyak dianut adalah kriteria 50% atau lebih.
Identifikasi ovalositosis secara mikroskopis yang pernah dilakukan pada beberapa populasi di Indonesia, dapat dilihat pada tabel berikut :
2.6.Polymerase Chain Reaction(PCR)
PCR adalah suatu teknik untuk memperbanyak/ menggandakan DNA hasil isolasi secara in vitro. Proses tersebut mirip dengan proses replikasi DNA in vivo. Teknik ini melibatkan beberapa tahapan berulang dan pada setiap tahap terjadi duplikasi fragmen DNA secara eksponensial dengan waktu yang relatif singkat dalam suatu thermocycler.
PCR pertama kali dikembangkan oleh Kary Mullis pada tahun 1985, dan karena penemuan tersebut ia mendapat nobel pada tahun 1993.
Komponen utama pada PCR adalah :
1. DNA template
DNA template yang digunakan dapat berupa genomic DNA, genomic libraries. Untuk optimasi PCR biasanya digunakan DNA template dalam jumlah subanogram.
2. PCR Buffer
Merupakan komponen yang sangat bervariasi dalam PCR. Beberapa komponen dasar dari PCR buffer ini adalah Tris-HCl, dan KCl dalam pH basa. Saat ini PCR buffer telah banyak diproduksi secara komersial oleh beberapa produsen bahan biologi molekuler.
3. dNTPs (Deoxy-oligonucleoside Tri Phospates)
Merupakan campuran dari 4 macam nucleoside (dATP, dCTP, dGTP, dTTP) yang merupakan bahan dasar reaksi polimerisasi. Konsentrasi zat ini sangat
inkorporasinya tetap terjamin. Untuk memperoleh konsentrasi dNTP yang optimal tergantung pada : konsentrasi MgCl2, konsentrasi primer, panjang produk amplifikasi dan jumlah PCR cycle.
4. MgCl2
Konsentrasi ion Mg di dalam reaksi sangat tergantung pada konsentrasi dNTP. Konsentrasi ion Mg yang terlalu kecil akan mengakibatkan gagalnya reaksi polimerisasi, tetapi bila berlebihan dapat mengakibatkan berbagai hasil yang non-spesifik. Konsentrasi MgCl2 yang optimum adalah 0,5 – 5,0 mM.
5. Primer
Primer yang digunakan dalam PCR merupakan suatu oligonukleotida yang disintesis dan dipurifikasi secara khusus. Primer yang ideal mempunyai panjang 15-30 urutan basa dari bagian tertentu dari kedua rantai DNA yang diamplifikasi.
Dalam PCR digunakan 2 macam primer, yaitu :
Forward primer, disusun berdasarkan urutan basa dari urutan DNA rantai
pertama
Reverse primer, disusun berdasarkan urutan basa rantai kedua
Konsentrasi primer yang umum digunakan antara 0,1 – 1 μM. Konsentrasi dari kedua primer yang digunakan harus dalam jumlah yang seimbang dan jauh lebih besar dari konsentrasi DNA yang diamplifikasi.
6. Enzim DNA Polymerase
yang tahan panas dari Thermus aquaticus (Taq), maka memungkinkan proses annealing dan extension dilakukan pada berbagai kondisi suhu sehingga hasil amplifikasi non-spesifik dapat dikurangi. Kelebihan lain enzim ini dari Klenow fragment adalah tahan terhadap panas sehingga memungkinkannya tetap aktif dalam berbagai fluktuasi suhu.
Pada teknik PCR berlangsung 3 proses reaksi yang berulang pada suhu yang berbeda, yaitu :
a. Denaturasi : berlangsung pada suhu di atas 92 oC dan ditandai oleh memisahnya rantai ganda DNA menjadi dua rantai tunggal b. Annealing : umumnya berlangsung pada suhu antara 37-65 oC, dan ditandai
dengan menyatunya kembali kedua rantai tunggal DNA tersebut. Karena terdapat primer dalam jumlah yang jauh lebih besar dari DNA yang akan diamplifikasi, maka primer tersebut akan mempunyai kesempatan yang lebih besar untuk melekat pada DNA rantai tunggal pasangannya dibanding dengan pasangan rantai tunggal DNA semula.
c. Extension : berlangsung pada suhu antara 68 – 75 oC dan ditandai oleh sintesis DNA melalui perpanjangan dari primer tersebut mengikuti urutan nukleotida DNA rantai tunggal pasangannya.
dilakukan dengan pewarnaan menggunakan Ethidium bromide (EtBr) yang merupakan zat warna fluorescent yang dapat berikatan dengan DNA. Setelah pewarnaan, visualisai dilakukan di bawah sinar UV. Marker (penanda) yang digunakan sebagai control dapat di-elektroforesis pada well yang berdekatan sehingga ukuran amplicans dapat diketahui.
2.7. Fragilitas Eritrosit
Hemolisa adalah peristiwa keluarnya hemoglobin dari dalam sel eritrosit menuju ke cairan di sekelilingnya. Keluarnya hemoglobin ini disebabkan karena pecahnya membran sel eritrosit. Membran sel eritrosit mudah dilalui atau ditembus oleh ion-ion H+, OH-, NH4+, HCO3-, Cl-, dan juga oleh substansi-substansi yang lain seperti glukosa, asam amino, urea, dan asam urat.
Sebaliknya membran sel eritrosit tidak dapat ditembus oleh Na+, K+, Ca2+, Mg2+, fosfat organik, dan juga substansi lain seperti hemoglobin dan protein plasma (Asscalbiass, 2010).
Membran sel eritrosit termasuk membran permeabel selektif, yaitu membran yang dapat ditembus oleh molekul air dan substansi-substansi tertentu, tetapi tidak dapat ditembus oleh substansi yang lain (Asscalbiass, 2010).