Spektroskopi UV-VIS Page 1 A. Judul : Spektroskopi UV-VIS
B. Hari/tanggal Percobaan : Selasa, 15 Desember 2014 C. Tujuan Percobaan :
Menentukan konsentrasi suatu larutan
Menentukan konsentrasi permanganate dan dikromat dalam campurannya Mengetahui pengaruh pelarut dan pH pada panjang gelombang optimum D. Dasar Teori :
1. Spektofotometer UV-Vis
Spektrofotometer adalah alat untuk mengukur transmitan atau absorban suatu sampel sebagai fungsi panjang gelombang. Spektrofotometer merupakan gabungan dari alat optic dan elektronika serta sifat-sifat kimia fisiknya. Dimana detektor dapat mengukur intensitas cahaya yang dipancarkan secara tidak langsung cahaya yang diabsorbsi. Tiap media akan menyerap cahaya pada panjang gelombang tertentu tergantung pada senyawa atau warna yang terbentuk (Pangestu, A., 2011).
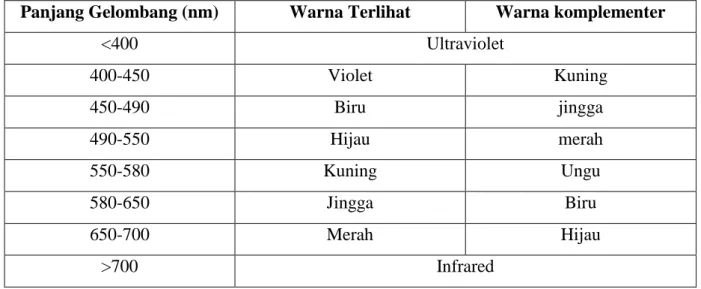
Warna yang diserap oleh suatu senyawa merupakan warna komplementer dari warna yang teramati. Beberapa warna yang diamati dan warna komplementernya terdapat pada tabel berikut ini :
Tabel Spektrum Warna
Panjang Gelombang (nm) Warna Terlihat Warna komplementer
<400 Ultraviolet 400-450 Violet Kuning 450-490 Biru jingga 490-550 Hijau merah 550-580 Kuning Ungu 580-650 Jingga Biru 650-700 Merah Hijau >700 Infrared
Spektroskopi UV-VIS Page 2 Sinar dari sumber cahaya akan dibagi menjadi dua berkas oleh cermin yang berputar pada bagian dalam spektrofotometer. Berkas pertama akan melewati kuvet berisi blanko, sementara berkas kedua akan melewati kuvet berisi sampel. Blanko dan sampel akan diperiksa secara bersamaan. Adanya blanko, berguna untuk menstabilkan absorbsi akibat perubahan voltase dari sumber cahaya.
2. Prinsip kerja
Ketika cahaya dengan panjang berbagai panjang gelombang (cahaya polikromatis) mengenai suatu zat, maka cahaya dengan panjang gelombang tertentu saja yang akan diserap. Di dalam suatu molekul yang memegang peranan penting adalah elektron valensi dari setiap atom yang ada hingga terbentuk suatu materi. Elektron-elektron yang dimiliki oleh suatu molekul dapat berpindah (eksitasi), berputar (rotasi) dan bergetar (vibrasi) jika dikenai suatu energi. Jika zat menyerap cahaya tampak dan UV maka akan terjadi perpindahan elektron dari keadaan dasar menuju ke keadaan tereksitasi. Perpindahan elektron ini disebut transisi elektronik. Apabila cahaya yang diserap adalah cahaya inframerah maka electron yang ada dalam atom atau elektron ikatan pada suatu molekul dapat hanya akan bergetar (vibrasi). Sedangkan gerakan berputar elektron terjadi pada energi yang lebih rendah lagi misalnya pada gelombang radio.
Atas dasar inilah spektrofotometri dirancang untuk mengukur konsentrasi suatu suatu yang ada dalam suatu sampel. Dimana zat yang ada dalam sel sampel disinari dengan cahaya yang memiliki panjang gelombang tertentu. Ketika cahaya
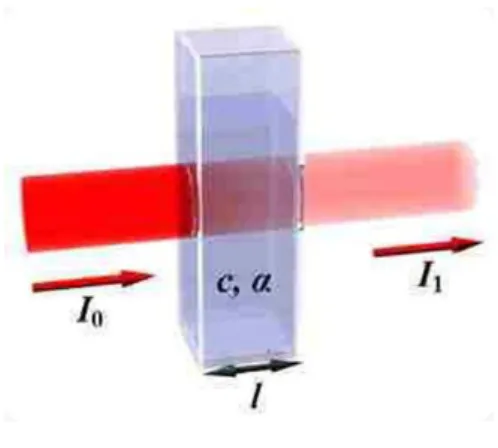
Spektroskopi UV-VIS Page 3 mengenai sampel sebagian akan diserap, sebagian akan dihamburkan dan sebagian lagi akan diteruskan. Pada spektrofotometri, cahaya datang atau cahaya masuk atau cahaya yang mengenai permukaan zat dan cahaya setelah melewati zat tidak dapat diukur, yang dapat diukur adalah I /I atau I /I (perbandingan cahaya datang dengan cahaya setelah melewati materi (sampel)). Proses penyerapan cahaya oleh suatu zat dapat digambarkan sebagai berikut.
Gambar Proses penyerapan cahaya oleh zat dalam sel sampel.
Dari gambar terlihat bahwa zat sebelum melewati sel sampel lebih terang atau lebih banyak di banding cahaya setelah melewati sel sampel Cahaya yang diserap diukur sebagai absorbansi (A) sedangkan cahaya yang hamburkan diukur sebagai transmitansi (T), dinyatakan dengan hukum lambert- beer atau Hukum Beer, berbunyi:
“Jumlah radiasi cahaya tampak (ultraviolet, inframerah dan sebagainya) yang diserap atau ditransmisikan oleh suatu larutan merupakan suatu fungsi eksponen dari konsentrasi zat dan tebal larutan”.
Dalam hal ini, hukum Lamber-Beer dapat menyatakan hubungan antara serapan cahaya dengan konsentrasi zat dalam larutan. Di bawah ini adalah persamaan Lamber-Beer ; A = - log T = εb c Dengan A = absorban, T = transmitan, Ε = absortivitas molar (Lcm-1. mol-1),
Spektroskopi UV-VIS Page 4 b = panjang sel (cm), dan c = konsentrasi zat (mol/L).
Sinar dari sumber cahaya akan dibagi menjadi dua berkas oleh cermin yang berputar pada bagian dalam spektrofotometer. Berkas pertama akan melewati kuvet berisi blanko, sementara berkas kedua akan melewati kuvet berisi sampel. Blanko dan sampel akan diperiksa secara bersamaan. Adanya blanko, berguna untuk menstabilkan absorbsi akibat perubahan voltase dari sumber cahaya (Pangestu, A., 2011).
Radiasi elektromagnetik, yang mana sinar ultraviolet dan sinar tampak merupakan salah satunya, dapat dianggap sebagai energi yang merambat dalam bentuk gelombang. Beberapa istilah yang digunakan untuk menggambarkan gelombang ini. Panjang gelombang merupakan jarak linier dari suatu titik pada satu gelombang ke titik yang bersebelahan pada gelombang yang bersebelahan. Dimensi panjang gelombang adalah panjang (L) yang dapat dinyatakan dalam centimeter (cm) (Ibnu dan Rohman, 2009).
Menurut Sastrohamidjodjo H., 2001, instrumen yang digunakan untuk mempelajari serapan atau emisi radiasi elektromagnetik sebagai fungsi dari panjang gelombang disebut “spektrometer” atau spektrofotometer. Komponen–komponen pokok dari spektrofotometer meliputi :
1. Sumber tenaga radiasi yang stabil
Sumber radiasi UV yang kebanykan digunakan adalah lampu hidrogen dan lampu deuterium. Yang terdiri dari sepasang elektroda yang terselubung dalam tabung gas dan diisi dengan gas hidrogen dan deuterium yang bertekanan rendah. Sumber radiasi ultraviolet lain adalah lampu xenon, tetapi tidak se stabil lampu hidrogen. Sumber radiasi terlihat dan radiasi inframerah dekat yang biasa digunakan adalah lampu filamen tungsten. Filament dipanaskan oleh sumber arus searah (DC), atau oleh baterai. Filamen tungsten menghasilkan radiasi kontinu dalam daerah antara 350 dan 2500 nm.
2. Monokromator
Dalam spektrometer, radiasi yang polikromatik yang harus diubah menjadi radiasi monokromatik. Ada dua jenis alat yang digunakan untuk mengurai radiasi polikromatik menjadi monokromatik yaitu penyaring dan monokromator. Penyaring dibuat dari benda khusus yang hanya meneruskan radiasi pada daerah panjang gelombang tertentu dan penyerap radiasi dari panjang
Spektroskopi UV-VIS Page 5 gelombang yang lain. Monokromator merupakan serangkaian alat optik yang mengurai radiasi polikromatik menjadi jalur-jalur yang efektif/panjang gelombang tunggalnya dan memisahkan panjang gelombang-gelombang tersebut menjadi jalur-jalur yang sangat sempit.
3. Tempat Cuplikan
Cuplikan pada daerah ultraviolet atau terlihat yang biasnya berupa gas atau larutan ditempatkan dalam sel atau kuvet. Untuk daerah violet biasanya digunakan Quartz atau sel dari silica yang dilebur, sedangkan untuk daerah terlihat digunkan gelas biasa atau quartz. Sel yang digunakan untuk cuplikan yang berupa gas mempunyai panjang lintasan dari 0,1 – 100 nm, sedangkan sel untuk larutan mempunyai panjang lintasan tertentu dari 1 hingga 10 cm. Sebelum sel dipakai harus dibersihkan dengan air, atau jika dikehendaki dapat dicuci dengan larutan detergen atau asam nitrat panas.
4. Detektor
Setiap detektor penyerap tenaga foton yang mengenainya dan mengubah tenaga tersebut untuk dapat di ukur secara kuantitatif seperti sebagai arus listrik atau perubahan-perubahan panas. Kebanyakan detektor menghasilkan sinyal listrik yang dapat mengaktifkan meter atau pencatat. Setiap pencatat harus menghasilkan sinyal yang secara kuantitatif berkaitan dengan tenaga cahaya yang mengenainya.
Cara kerja spektrofotometer secara singkat adalah sebagai berikut. Tempatkan larutan pembanding, misalnya blanko dalam sel pertama sedangkan larutan yang akan dianalisis pada sel kedua. Kemudian pilih fotosel yang cocok 200 nm - 650 nm (650 nm – 1100 nm) agar daerah λ yang diperlukan dapat terliputi. Dengan ruang fotosel dalam keadaan tertutup “nol” galvanometer dengan menggunakan tombol dark-current. Pilih yang diinginkan, buka fotosel dan lewatkan berkas cahaya pada blanko dan “nol” galvanometer didapat dengan memutar tombol sensitivitas. Dengan menggunakan tombol transmitansi, kemudian atur besarnya pada 100%. Lewatkan berkas cahaya pada larutan sampel yang akan dianalisis. Skala absorbansi menunjukkan absorbansi larutan sampel (Khopkar, 2002).
Istilah penting dalam Spektrofotometri UV tampak adalah :
1. Kromofor, gugus tak jenuh kovalen yang bertanggungjawab terhadap terjadinya peristiwa absobsi radiasi molekul.
Spektroskopi UV-VIS Page 6 2. Auksokrom, gugus jenuh yang bila terikat pada kromofor dapat menyebabkan perubahan panjang gelombang dan intensitas absobansi maksimum molekul ( -OH, -NH2 dan –Cl).
3. Pergeseran Batokromik, absorbansi molekul ke panjang gelombang yang lebih tinggi akibat substitusi auksokrom atau pengaruh soluen.
4. Pergeseran Hipsokromik, Pergeseran absobansi molekul ke panjang gelombang yang lebih rendah akibat substitusi auksokrom atau pengaruh soluen.
5. Hiperkromik, kenaikkan intensitas absorbs molekul terhadap molekul radisai. 6. Hipokromik, Penurunan intensitas molekul terhadap molekul radiasi.
Spektrofotometer UV-VIS dapat digunakan untuk analisis kualitatif maupun analisis kuantitatif, :
Analisis Kualitatif
Penggunaan alat ini dalam analisis kuantitatif sedikit terbatas sebab spektrum sinar tampak atau sinar UV menghasilkan puncak-puncak serapan yang lebar sehingga dapat disimpulkan bahwa spektrum yang dihasilkan kurang menunjukan puncak-punca serapan. Namun, walaupun puncak yang dihasilkan bebentuk lebar, puncak tersebut masih dapat digunakan untuk memperoleh keterangan ada atau tidaknya gugus fungsional tertentu dalam suatu molekul organik.
Spektrum yang dikeluarkan oleh UV-VIS berupa pita yang lebar sedangkan pada pita yang dikeluarkan oleh IR berupa garis atau puncak tajam.
Spektroskopi UV-VIS Page 7 Analisis Kuantitatif
Penggunaan sinar UV dalam analisis kuantitatif memberikan beberapa keuntungan, diantaranya ;
Dapat digunakan secara luas Memiliki kepekaan tinggi
Keselektifannya cukup baik dan terkadang tinggi Ketelitian tinggi
Tidak rumit dan sepat
Adapun langkah-langkah utama dalam analisis kuantitatif adalah ;
•Pembentukan warna ( untuk zat yang yang tak berwarna atau warnanya kurang kuat ),
•Penentuan panjang gelombang maksimum, •Pembuatan kurva kalibrasi,
•Peangukuran konsentrasi sampel.
Dikromat, Cr2O72-. Kromat merupakan logam yang berbentuk zat padat berwarna, yang menghasilkan larutan kuning bila larut dalam air asam mineral encer, ion-ion hydrogen, kromat berubah menjadi dikromat
Spektroskopi UV-VIS Page 8 Cr2O72- + 2 OH- ↔ 2 CrO42- + H2O
Kelarutan kromat dari logam alkali dan dari kalsium serta magnesium larut dalam air, stronsium kromat larut sangat sedikit. Kebanyakan tidak larut dalam air. Natrium, kalsium, dan ammonium dikromat larut dalam air. Permanganate, MnO4-. Kelarutan semua permanganate larut dalam air membentuk larutan ungu (lembayung keperakan).
Metil Merah
Metil Merah (Methyl Red ) adalah senyawa organic yang memiliki rumus kimia C15H15N3O2, senyawa ini banyak dipakai untuk indikator titrasi asam basa. Indikator ini berwarna merah pada pH dibawah 4,4 dan berwarna kuning diatas 6,2. Warna transisinya menghasilkan warna orange. Berikut ini merupakan struktur dari metil merah.
Spektroskopi UV-VIS Page 10 F. Hasil Pengamatan :
No.Perc. Prosedur Percobaan Hasil Pengamatan Dugaan/Reaksi Kesimpulan
1.
Spektroskopi UV-VIS Page 11 3.
Spektroskopi UV-VIS Page 12 G. Analisis/Pembahasan :
Penentuan Konsentrasi Suatu Larutan
a. Penyiapan Larutan Baku
Larutan baku metil merah yang berwarna merah (+++) dibuat sebagai larutan baku dilakukan pengenceran dengan aquades menghasilkan warna dari metil merah dari warna kuning sampai menuju warna jingga sesuai dengan bertambahnya konsentrasi pengenceran. Hal ini dikarenakan semakin besar pengenceran (penambahan aquades) maka akan mengubah warna asli dari metil merah tersebut menjadi warna pada spektrum cahaya tampak.
b. Penentuan Panjang Gelombang Maksimum
Penentuan panjang gelombang maksimum larutan metil merah dapat diketahui dengan mengukur absorbansi larutan metil merah dengan konsentrasi terendah pada panjang gelombang tertentu, apabila panjang gelombang tersebut menghasilkan absorbansi terbesar maka merupakan panjang gelombang maksimum. Pada larutan metil merah dengan konsentrasi 1 ppm (kuning) pada rentang panjang gelombang 300nm – 600nm didapatkan panjang gelombang maksimum 240 nm dan nilai absorbansi 0,213, dan pada larutan metil merah dengan konsentrasi 3 ppm (kuning+) pada rentang panjang gelombang 300nm – 600nm didapatkan panjang gelombang maksimum 333 nm dan nilai absorbansi 0,087. Panjang gelombang ini kurang tepat karena panjang gelombang ini menunjukkan nilai absorbansi yang kurang baik. Absorbansi yang baik adalah nilai absorbansi yang mendekati nilai 1,00 karena pada rentang 0,1 – 0,9 adalah rentang tempat kesalahan
minimum, sehingga dilakukan pengukuran kembali pada larutan metil dengan konsentrasi 5 ppm (kuning ++) pada rentang panjang gelombang 300 – 600 nm didapatkan panjang gelombang maksimum yang sesuai teori (panjang gelombang untuk warna komplementer kuning) yaitu 429 nm dengan nilai absorbansi 0,501. Pada penentuan panjang gelombang maksimum, konsentrasi larutan standar yang digunakan adalah 5 ppm sehingga perlu dicari konsentrasi larutan standar yang memberikan kesalahan minimum yaitu 0,501 lebih mendekati nilai 1,00. Kurva serapan dapat dilihat pada Lampiran ”Spektrum : Metil merah 5 ppm”.
c. Pembuatan Kurva Kalibrasi
Kurva kalibrasi dibuat dengan mengukur absorbansi setiap larutan standar metil merah ( 1, 3, 5, 10, 15, dan 20 ppm ), kenmudian membuat kurva kalibrasi antara absorbansi dengan konsentrasi larutan standar. Penentuan konsentrasi sampel dapat diketahui dengan cara memasukkan nilai absorbansi sampel ke dalam persamaan garis linier yang diperoleh dari kurva kalibrasi.
Tabel Absorbansi Larutan Standart Metil Merah No Konsentrasi (C) Absorbansi (A)
1. 1 ppm 0,134 2. 3 ppm 0,332 3. 5 ppm 0,504 4. 10 ppm 1,085 5. 15 ppm 1,561 6. 20 ppm 1,974
Spektroskopi UV-VIS Page 13
d. Penentuan konsentrasi suatu larutan
Pada pembuatan kurva kalibrasi dari larutan metil merah pada percobaan 1c, didapatkan persamaan regresinya adalah :
y = 0,0989x + 0,042 dengan R2 = 0,9972
Dari persamaan regresi diatas maka dapat ditentukan konsentrasi sampel pada larutan metil merah pada panjang gelombang maksimum dengan absorbansi 0,937, yaitu : y = 0,0989x + 0,042 (dimana y adalah nilai absorbansi sampel)
0,937 = 0,0989x + 0,042 0,0989x = 0,937 – 0,042 0,0989x = 0,895
x = 9,049 (dimana x adalah konsentrasi sampel)
Sehingga, diperoleh nilai konsentrasi sampel yang diuji dengan absorbansi sebesar 0,937 yaitu 9,049 mol/L dan % akurasi alat sebesar 99,97%.
Hal ini sesuai dengan perhitungan menggunakan analisis spektrafotometri Uv-Vis yaitu 9,051 mol/L.
Spektroskopi UV-VIS Page 14
H. Kesimpulan :
X. KESIMPULAN :
1. Konsentrasi larutan sampel metil merah dapat ditentukan dengan alat spektrofotometer UV-Vis. Dalam percobaan ini diperoleh konsentrasi sampel metil merah sebesar 9,049 mol/L dengan keakurasian alat 99,97 %.
2. Konsentrasi permanganat dan dikromat dalam percobaan ini dilihat dari persamaan pada kurva kalibrasi konsentrasi larutan standar permanganat vs absorbansinya, dan konsentrasi larutan standar dikromat vs absorbansiya kemudian dihitung sesuai hukum Lambert-Beer dan diperoleh konsentrasi permanganat = 1,74 mol/L dan konsentrasi dikromat = 0,1685 mol/L. 3. Panjang gelombang maksimum dipengaruhi oleh pH. Pada suasana basa panjang gelombang maksimum sedikit mengalami pergeseran. Sementara pada suasana asam, panjang gelombang maksimum mengalami pergeseran yang
sangat tinggi.
I. Jawaban Pertanyaan ; J. Daftar Pustaka :
Aeni, N. 2012. Spektrofotometer UV-Visible. Universitas Tadulako: Palu.
Day, R.A & A.L Underwood. 2002. Analisis Kimia Kuantitatif Edisi Keenam.Jakarta:Erlangga
Gholib, I., dan Abdul R. 2007. Kimia Farmasi Analisis. Cetakan Pertama, Pustaka Pelajar, Yogyakarta.
Jamaluddin. 2012. Analisis Instrumen. Universitas Tadulako:Palu.
Khopkar, S.M, 2002. Konsep Dasar Kimia Analitik. UI-Press:Jakarta. Pangestu, A.. 2011. Spektrofotometer UV-Vis dan Refraktometer.
[Online : spektrofotometer-uv-vis-dan.html], Diakses pada tanggal 15 Desember 2014.
Sastrohamidjojo, H. 1985. Kromatografi, Edisi Pertama, Penerbit Liberty:Yogyakarta. Skoog, D.A,. 1996. Penyidikan Spektrometrik Senyawa Organik Edisi ke-4, Penerbit
Spektroskopi UV-VIS Page 15 Taufikurrohmah, Titik dkk. 2014. Panduan Praktikum Kimia Analitik III Spektroskopi dan Kromatografi.Surabaya:Laboratorium Instrumen Jurusan Kimia FMIPA UNESA
Lampiran Gambar
HCl, metil merah, dan NaOH NaoH, H2O, dan HCl