I
ISSSSNN::22080877--55004455
S
Scciieennttiiaa,,VVooll..11,,NNoo..11,,22001111;;hhaallaammaann11––5588IISSSSNN::22008877--55004455
Volume 3, Nomor 1, Februari 2013
S
S
C
C
I
I
E
E
N
N
T
T
I
I
A
A
J
J
U
U
R
R
N
N
A
A
L
L
F
F
A
A
R
R
M
M
A
A
S
S
I
I
D
D
A
A
N
N
K
K
E
E
S
S
E
E
H
H
A
A
T
T
A
A
N
N
T TEERRBBIITTDDUUAAKKAALLIISSEETTAAHHUUNN S SEETTIIAAPPBBUULLAANNFFEEBBRRUUAARRIIDDAANNAAGGUUSSTTUUSSD
D
E
E
W
W
A
A
N
N
R
R
E
E
D
D
A
A
K
K
S
S
I
I
Penanggung Jawab :Prof. H. Syahriar Harun, Apt Pemimpin Umum :
DR.H.M. Husni Mukhtar,MS, DEA, Apt Redaktur Pelaksana :
Verawati, M.Farm, Apt Eka Fitrianda, M.Farm, Apt Sekretariat :
Afdhil Arel, S.Farm, Apt Khairul
Dewan Penyunting : Prof.H. Syahriar Harun,Apt
Prof.DR.H. Amri Bakhtiar,MS,DESS,Apt Prof.DR.H. Almahdy, MS, Apt
DR.H.M. Husni Mukhtar, MS, DEA, Apt DR. H. Yufri Aldi, MSi, Apt
Drs. B.A. Martinus , MSi Hj. Fifi Harmely, M.Farm ,Apt Farida Rahim, M.Farm, Apt Revi Yenti, M.Si, Apt Verawati, M.Farm, Apt Ria Afrianti, M.Farm ,Apt Eka Fitrianda, M.Farm, Apt
Penerbit :
Sekolah Tinggi Farmasi Indonesia (STIFI) Perintis Padang
ISSN : 2087-5045
Gambar Cover : blogmahkotadewa.blogspot.com Alamat Redaksi/Tata Usaha :
STIFI Perintis
Jl. Adinegoro Km. 17 Simp. Kalumpang Lubuk Buaya Padang Telp. (0751)482171, Fax. (0751)484522
e-mail : stifpadang@gmail.com website : www.stifi-padang.ac.id
ISSN : 2087-5045 SALAM REDAKSI
Jurnal Scientia kembali terbi t dengan tetap memua t artikel-artikel penelitian yang mengeksplorasi kekayaan aktivitas tumbuhan oba t di Indonesia. Salah satu aktivitas yang banyak digali dalam edisi ini adalah aktivitas antioksidan.
Pengaruh radikal bebas dalam tu buh sejatinya telah lama diketahui. Keadaan stress oksidatif yang berlangsung lama dalam tubuh dapat mencetuskan sejumlah penyakit degeneratif. Karena itu, penelitian mengenai antioksidan, bahan yang dapat menghamba t reaksi radikal bebas, tampaknya terus dilakukan. Dalam Scientia edisi ini misalnya, dimuat beberapa artikel yang memaparkan hasil penelitian aktivitas antioksidan baik secara in vitro maupun in vivo dari berbagai tumbuhan seperti ja mbu biji, ubi jalar, gambir dan toma t.
Masih dalam semangat eksplorasi tumbuhan obat Indonesia, dimuat pula artikel penelitian mengenai aktivitas an tiinflamasi daun kembang bulan, antipiretika ta mpa badak, dan aktivitas penyembuhan luka daun kirinyuh. Di samping itu, terdapat pula artikel mengenai pemanfaatan pigmen pada buah kesumba dalam formulasi perona bibir.
Semoga kehadiran jurnal Scientia ini dapat memperkaya khazanah keilmuan para pembaca sekalian di bidang farmasi dan kesehatan.
Padang, Februari 2013 Salam Sehat
D
D
A
A
F
F
T
T
A
A
R
R
I
I
S
S
I
I
AKTIFITAS ANTI INFLAMASI FRAKSI-FRA KSI DAUN KEMBANG BULAN 1--55 (Tithonia diversifolia. A. Gray) TERHADAP MENC IT PUTIH BETINA
Verawati, Mimi Aria, Mira Yunimel
IN VIVO AN TIO XIDAN T AC TIV ITY O F ETHANO LIC EXTRAC T O F GUAVA 6--1100 (Psidium guajava L.) LEAV ES BASED ON DEC REASING LEV EL
O F SERUM MALO NEDIA LD EHYD E (MDA) IN MIC E Eka Fitrianda, Ria Afrianti, Fifi Nofita
UJI EFEKTIVITAS KRIM EKS TRAK ETANO L Eupatorium odoratum L. TERHADAP 11--1166 KERAPA TAN SERABUT KO LAGEN PADA PROSES PEYEMBUHAN LUKA
Revi Yenti, Ria Afrianti, Meri Sandi
PENGARUH W AKTU SIMPAN KULIT UBI JALAR (Ipomea batatas L.) TERHADAP 1177--2233 KADAR FENO LAT DAN AKTIVITAS ANTIO KSIDANNYA SEC ARA
SPEKTRO FO TO METRI UV-VIS Dedi Nofiandi, Farida Rahim, Rika Puspita
EFEK AN TIPIR ETIK EKS TRAK ETANO L DAUN TUMBUHAN TAMPA BADAK 24--2288 (Voacanga foetida (Bl.) K. Schum) TERHADAP TIKUS PUTIH (Rattus norvegicus) JANTAN Adriani Susanty, Emma Susanti, Yenni Ratna Sari
FO RMULASI SEDIAAN PEW ARNA BIBIR DARI EKSTRAK ETANO L BIJI 29--3344 BUAH KESUMBA (Bixa orellana L)
Enda Mora, Deni Anggraini, Pipin Suknayani
AKTIVITAS ANTIO KSIDAN EKSTRA K ETIL ASETA T GAMBIR 3355--3399 (Uncaria gambir (Hunte r). Roxb) ASAL MUARA TAKUS RIAU
Noveri Rahmawati, Musyirna Rahmah Nst, Winna Rahmaini
PENGARUH PEMB ERIAN JUS TO MAT TERHADAP UKURAN LESI KIS TA 40--4455 DAN STA TUS ANTIO KSIDAN LIKO PEN PLASMA PENDER ITA KISTA
PAYUDARA DI RUMAH SAKIT KAN KER DHARMAIS JAKARTA Putri Aulia Arza, Evy Damayanthi
AKTIFITAS ANTI INFLAMAS I FRAKS I-FRAKS I DAUN KEMBANG BULAN
(Tithonia diversifolia. A. Gray) TERHADAP MENCIT PUTIH BETINA
Verawati, Mimi Aria, Mira Yunimel STIFI Pe rintis Padang
ABSTRAC T
The topical anti-inflammatory effect of Tithonia diversifolia A. Gray leaves fractions on female albino mice had been done using edema induction and granuloma pouch method. Edema induction was done by injection of 2% b/v carragenin in NaCl physiologic subcutaneously. T he fractions, each of 5% concentration, was given topically in ointment base for 4 days. The parameters of inflammation were observed, include edema volume, and total number of leucocyte cells on edema and blood. Reduction in the volume of edema exudate resulted by fractions of Tithonia diversifolia A. Gray leaves were not significantly different (p> 0.05) compared to hydrocortisone acetate 2,5%b/v but significantly different (p <0.05) compared to positive control. Fractions of T. diversifolia leaves affected the number leucocytes of cells in the inflammatory exudates but not in the blood (p<0.05).
Keywords : Tithonia diversifolia, anti-inflammatory, edema
PENDAHULUAN
Tithonia diversifolia A. Gray merupakan tumbuhan asli dari Meksiko dan Amerika T engah. T umbuhan ini telah dimanfaatkan di berbagai negara-negara tropis dan dapat tumbuh alami di Indonesia dan negara lain di Asia T enggara. Tithonia diversifolia A. Gray (Famili : Asteraceae) memiliki beberapa nama seperti kembang bulan (Indonesia), Rondosemoyo (Jawa), Harsaga (Jawa), Mary Gold (Inggris) (Sulistijowati, 1999). Secara tradisional tumbuhan ini digunakan sebagai obat sakit perut, kembung, diare, obat luka dan bisul (Dalimartha, 2000). Beberapa penelitian menyebutkan ekstrak daun T. diversifolia memiliki aktivitas sebagai antimalaria, antidiare, antiinflamasi, antibakteri dan antiproliferasi (Oyewole et al., 2008). Daun T. diversifolia kaya akan kandungan metabolit sekunder seperti alkaloid, terpenoid, polifenol, flavonoid dan tannin. Beberapa terpenoid telah diisolasi dari daun yaitu T agitinin C, T agitinin A, tirotundin dan lain sebagainya (Gu JQ et al., 2002). Pada penelitian sebelumnya telah dilakukan uji aktivitas antiinflamasi dari ekstrak etanol daun T. diversifolia pada konsentrasi 1; 2,5 dan 5%. Ekstrak etanol daun pada konsentrasi 5% memberikan penurunan volume eksudat yang
lebih baik dibandingkan hidrokortison asetat 2,5% (Verawati, 2011). Berdasarkan hal tersebut di atas maka dilakukan penelitian lanjutan untuk mengetahui kemampuan antiinflamasi dari fraksi-fraksi daun T. diversifolia. Fraksi-fraksi dimaksud masing-masing adalah fraksi heksan, etil asetat dan met anol. Aktivitas antiinflamasi diuji secara topikal menggunakan metode edema buatan dengan “ granuloma pouch” (Gryglewsky, 1997; Domer, 1971). Parameternya adalah pengukuran volume udem buatan pada bagian punggung mencit putih dan penentuan jumlah sel leukosit pada eksudat inflamasi dan dalam darah (Winter, 1962).
METO DE P EN ELITIAN
Alat
Alat- alat yang digunakan yaitu rotary evaporator, botol maserasi, jarum suntik 5 ml, jarum suntik 1 ml, gunting bedah, timbangan hewan, lumpang dan stamfer, gelas ukur, alat cukur, spidol, kandang hewan, dan lain- lain.
Bahan
Bahan yang digunakan yaitu daun T. diversifolia, etanol 70%, air suling, vaselin flava, NaCl fisiologis, karagen, krim perontok bulu dan hidrokortison asetat (serbuk). Hewan yang digunakan adalah mencit putih betina dengan berat 20-30 g sebanyak 25 ekor, dimana masing–masingnya dibagi menjadi 5 kelompok
Fraksinasi Daun T. diversifolia
Se banyak 2 kg daun segar T. diversifolia dikeringanginkan selama lebih kurang 1 minggu. Daun kering tersebut diserbukkan dengan grinder dan diayak dengan ayakan 100. Serbuk daun kering ini ditimbang 200 gram kemudian dimaserasi dengan pelarut heksan selama 3x3 hari. Hasil maserasi disaring dan uapkan pelarutnya dengan rotary evaporator pada suhu 40oC hingga diperoleh fraksi kental heksan. Ampas daun dimaserasi kembali dengan etil asetat selama 3x3 hari. Hasil maserasi disaring dan filtrat diuapkan pelarutnya secara vakum sehingga diperoleh fraksi kental etil asetat. Ampas daun sisa maserasi etil asetat ini kembali dimaserasi dengan metanol, dan dengan cara yang sama seperti sebelumnya diperoleh pula fraksi kental metanol.
Pembuatan Sediaan Uji
Fraksi daun T. diversifolia ditimbang sebanyak 250 mg lalu digerus halus dalam lumpang, kemudian tambahkan vaselin flava sebanyak 4,75 g sedikit demi sedikit sambil digerus sehingga didapatkan massa yang homogen, dengan konsentrasi 5% b/b. Pembanding yang digunakan adalah hidrokortison asetat dengan konsentrasi 2,5% b/b.
Pembuatan Larutan Penginduksi
Karagen ditimbang sebanyak 1 gram, lalu digerus halus dalam lumpang kemudian sedikit demi sedikit ditambah NaCl fisiologis 50 ml sambil digerus homogen, hingga diperoleh konsentrasi karagen 2% .
Penginduksian Udem
Mencit dicukur bulu bagian punggungnya dengan diameter ± 3 cm. Mulanya
dipotong dengan gunting, selanjutnya untuk menghilangkan bulu yang masih tersisa dioleskan krim perontok bulu, sehingga bulunya betul-betul hilang dan dibiarkan selama 24 jam. Pada bagian punggung yang dicukur disuntikkan udara sebanyak 5 ml secara subkutan sehingga terbentuk kantong udara. Setelah 24 jam kantong udara terbentuk, udara yang ada di dalamnya dihisap dengan jarum suntik 5 ml sehingga kantong udara tersebut jadi kempes. Selanjutnya ditambahkan larutan karagen 2% dalam NaCl fisiologis sebanyak 0,2 ml ke dalam kantong udara tersebut.
Pemberian Sediaan Uji
Se diaan uji diberikan dengan cara dioleskan secara merata pada daerah terbentuknya kantong udara (daerah yang dicukur) sebanyak 200 mg (dalam bentuk salep) dengan diameter ± 3 cm segera setelah penyuntikan karagen 2%. Selanjutnya obat diberikan lagi setiap hari selama 3 hari setelah pemberian pertama (obat diberikan selama 4 hari). Pada kelompok kontrol hanya diberikan vaselin flava saja.
Pengukuran Paramete r Pengukuran volume radang
Pada hari ke lima eksudat diambil dengan jarum suntik lalu diukur volumenya.
Penghitungan jumlah sel leukosit dalam hapusan darah dan cairan eksudat
Darah atau cairan eksudat segar diteteskan satu tetes pada gelas objek dan diratakan dengan gelas objek yang lain sehingga diperoleh lapisan darah yang homogen (hapusan darah), lalu dikeringkan. Setelah kering ditetesi dengan metanol, sehingga melapisi seluruh lapisan darah, dan dibiarkan 5 menit. Larutan Giemsa yang telah diencerkan dengan air suling (1:20) ditambahkan satu tetes dan dibiarkan selama 20 menit, dicuci dengan air suling, dikeringkan dan dilihat dibawah mikroskop. Selanjutnya dihitung jumlah sel neutrofil, eusinofil, limfosit, dan sel monosit.
Analisa Data
Data hasil penelitian yang diperoleh dari semua parameter dianalisa menggunakan analisa variansi (ANOVA) satu arah.
HASIL DAN PEMBAHASAN
Fraksinasi daun T. diversifolia dilakukan dengan fraksinasi (ekstraksi)
bertingkat langsung terhadap serbuk daun keringnya bukan secara fraksinasi cair-cair (FCC). Fraksi etil asetat memberikan persentase rendemen paling tinggi dibanding fraksi lain. Fraksi heksan memiliki persentase susut pengeringan paling tinggi, hal ini menunjukkan adanya kandungan senyawa menguap seperti monoterpen, seskuiterpen, dan komponen minyak atsiri lainnya.
Tabe l I. Rendemen fraksi-fraksi daun T. diversifolia
No Sampel B obot f raksi (g) % rendemen terhadap berat daun kering % susut pengeringan 1 Fx. Heksan 4,34 2,17 13,68 2 Fx. Etil asetat 9,72 4,86 5,20 3 Fx. metanol 8,9 4,45 1,26
Aktivitas antiinflamasi ekstrak daun T. diversifolia sebelumnya telah diuji pada beberapa konsentrasi dan memberikan hasil yang maksimal pada konsentrasi 5% dimana aktivitasnya lebih baik dibanding hidrokortison asetat 2,5% (Verawati, 2011). Pada penelitian lanjutan ini digunakan fraksi-fraksi pada konsentrasi yang sama yaitu 5%b/v. Fraksi etil asetat memberikan hasil inhibisi volume udem paling tinggi dibandingkan fraksi lain yaitu
sebesar 89,44 % dimana volume udem paling rendah yaitu 0,0567 ml. Hasil analisa statistik ANOVA satu arah memperlihatkan bahwa terdapat perbedaan yang bermakna (p < 0,05) dari volume udem pada tiap kelompok perlakuan. Analisis lanjut dengan uji Duncan menunjukkan bahwa penurunan volume udem dari fraksi-fraksi daun T. diversifolia berbeda nyata dengan kontrol negatif, dan tidak berbeda nyata (dengan hidrokortison asetat.
Tabe l II. Hasil pengukuran volume eksudat dari radang punggung mencit putih betina setelah pemberian fraksi-fraksi daun T. diversifolia A.Gray secara topikal
No Sampel Konsentrasi (%) Volume udem (ml) ± SD, n=5 % inhibisi volume udem 1 Kontrol positif 0 0,5367 ± 0,08145 - 2 Fraksi heksan 5 0,06± 0,01732 88,82
3 Fraksi etil asetat 5 0,0567 ± 0,01528 89,44
4 Fraksi metanol 5 0,0833 ± 0,02082 84,48
Hasil perhitungan jumlah sel leukosit dan uji statistik dengan analisa varian dari mencit menunjukkkan bahwa pemberian fraksi daun T. diversifolia mempengaruhi persentase jumlah sel leukosit dalam cairan eksudat. Sel neutrofil segmen pada kelompok fraksi daun T. diversifolia meningkat dibandingkan kontrol positif yang hanya diberi vaselin flava saja. Peningkatan jumlah sel neutrofil segmen
dibandingkan dengan kontrol positif bisa saja diseba bkan karena pada saat pengambilan sampel eksudat, sel ini sedang aktif melakukan fungsinya sebagai sel fagosit sehingga kadarnya tinggi pada daerah radang. Sedangkan pada jumlah monosit mengalami penurunan diseba bkan karena adanya perubahan monosit menjadi makrofag sehingga jumlahnya menjadi berkurang.
Tabe l III. Hasil perhitungan sel leukosit dari eksudat punggung mencit betina setelah pemberian ekstrak daun Tithonia diversifolia A.Gray. secara topikal
Sampel
Jumlah Sel Leukosit (x±SD, n = 5 )
Neutrofil segmen
Neutrofil
batang Monosit Limposit Eosinof il
Kontrol positif 41 ± 6,083 0,67 ± 1,155 13 ± 3,000 48 ± 9,644 0,67 ± 0,577 Fx. Heksan 57,67 ± 0,577 1 ± 1,000 7,67 ± 0,577 33,33 ± 1,528 0,33 ± 0,577 Fx. Etil asetat 50,67 ± 6,110 1,67 ± 0,577 5,67 ± 1,528 41,67 ± 8,622 0,33 ± 0,577 Fx. metanol 45,33 ± 7,371 0,67 ± 0,577 8 ± 2,646 45,33 ± 10,066 0,67 ± 0,577 Hidrokortison asetat 2,5% 56,67 ± 1,155 0,67 ± 0,577 7 ± 2,646 35,33 ± 3,055 0,33 ± 0,577
Persentase jumlah sel leukosit dalam darah tidak dipengaruhi oleh pemberian fraksi daun T. diversifolia karena pemberian fraksi
dilakukan secara topikal dan tidak melewati pembuluh darah sehingga jumlah sel leukosit dalam darah tidak berbeda jauh.
Tabe l IV. Hasil perhitungan sel leukosit dari darah mencit betina setelah pemberian ekstrak daun Tithonia diversifolia A.Gray. secara topikal
Sampel
Jumlah Sel Leukosit (x±SD, n = 5 )
Neutrofil segmen
Neutrofil
batang Monosit Limposit Eosinof il
Kontrol positif 75 ± 4,359 1 ± 1,000 3,67 ± 2,082 20 ± 2,646 0,33 ± 0,577 Fx. Heksan 77 ± 1,735 0,67 ± 0,577 2 ± 1,000 20,33 ± 1,528 0± 0,000 Fx. Etil asetat 77,67 ± 1,528 0,67 ± 0,577 2,33 ± 0,577 19,33 ± 2,082 0 ± 0,000 Fx. metanol 76,67 ± 1,528 0,33 ± 0,577 3,33 ± 1,528 19,33 ± 0,577 0,33 ± 0,577 Hidrokortison asetat 2,5% 76,33 ± 1, 55 1,33 ± 0,577 3,33 ± 2,082 16,67 ± 1,528 0,33 ± 0,577
KESIMPULAN
Berdasarkan hasil penelitian dapat disimpulkan bahwa fraksi-fraksi daun T. diversifolia memiliki aktivitas antiinflamasi yamg ditunjukkan dengan kemampuan menurunkan volume eksudat radang pada punggung mencit betina secara bermakna (p<0,05) dibandingkan dengan kontrol positif. Penghambatan volume radang paling besar diperlihatkan oleh fraksi etil asetat dengan persentase inhibisi volumne eksudat sebesar
89,44%.
DAFTAR PUSTAKA
Dalimartha, S., 2000, Atlas Tum buhan Obat Indonesia, Trubus Agriwidya, Jakarta. Domer, F.R., 1971, Anim al Experim ent in
Pharmacological Basis of Therapeutic, Charles C. Thomas Publiser, Springfield, IIIonis, USA.
Gryglewsky, J.R., 1997, Som e Experim ental Models for the Study of Inflam ation and Anti Inflam atory Drugs, Departemen of Pharmacology, Copernicus Academy of Medicine, Cracow, Poland
Gu JQ, Gills JJ, Park EJ, Mata-Greenwood E, Hawthorne ME, Axelrod F, Chavez PI,
Fong HH, Mehta RG, Pezzuto JM, Kinghorn AD, 2002, Sesquiterpenoids from T ithonia diversifolia With Potential Cancer Chemopreventive Activity, J. Nat. Prod., Vol 65(4) : 532-6
OyewoleI.O., Ibidapo, C.A., Moronkola, D.O., Adeoye G.O., Anyasor G. N. and Obansa J. A., 2008, Anti-malarial and Repellent Activities of Tithonia diversifolia (Hemsl.) Leaf Extracts, Academ ic Journals, Vol. 2(8), pp 171-175
Sulistijowati, A. dan Didik Guna wan, 1999, Efek Ekstrak Daun Kembang Bulan (Tithonia diversifolia A. Gray) T erhadap Candida albicans Serta Profil Kromatografinya, Media Litbangkes Edisi Khusus “Obat Asli Indonesia”, Vol 8(4).
Verawati, Mimi Aria, N. Maulida, 2011, Aktivitas Antiinflamasi T opikal Ekstrak Etanol Daun T ithonia diversifolia A. Gray, Jurnal Scientia, Vol 1(1)
Winter, C.A., Risley, E.A and G.W Nuss, 1962, Carragenin-Induced Edema in Hind Paw of Rat Asam Assay For anti Inflamantory Days, Proceding A Society For Experim ental Biology and Medicine III, p.544-547.
IN VIVO ANTIOXID ANT ACTIVITY OF ETHANOLIC EXTRACT OF GUAVA
(Psidium guajava L.) LEAVES BAS ED ON DECREAS ING LEVEL OF S ERUM
MALONEDIALD EHYDE (MDA) IN MIC E
Eka Fitrianda, Ria Afrianti, Fifi Nofita STIFI Pe rintis Padang
ABSTRAC T
A research had been done to observe in vivo antioxidant activity of the ethanolic extract of guava leaves (Psidium guajava L.) on male albino mice. The parameter measured was level of serum malondialdehyde (MDA) in mice which were given maximum physical activity. Mice were divided into 4 groups: group I wa s the positive control which did not receive ethanolic extract, meanwhile group II, III and IV received suspension of ethanolic extract in doses: 50 mg/kgBW, 100 mg/kgBW and 200 mg/kgBW respectively. T he entire group of mice were allowed to swim until almost drowned and then given dose of ethanolic extract once a day for 7 days. On the 8th day, the level of serum malondialdehyde was measured by using Northwest Life Science Specialties (NWLSST M) method. As result, the level of serum malondialdehyde in group I-IV was 17,42 μM, 16,05 μM, 15,45 μM and 14,51 μM respectively. These results showed that the ethanolic extract of guava leaves (Psidium guajava L.) could reduce levels of serum malondialdehyde in mice given maximum physical activity significantly (p <0.05). Increasing of ethanolic extract dose in range 50-200 mg/kgBW could significantly reduce levels of malondialdehyde.
Keywords : Psidium guajava L., malondialdehyde (MDA), in vivo antioxidant activity
IN TRO DUC TIO N
Every day, the human body faces exposure to oxidants or free radicals either from inside or outside the body. Free radicals are atoms or molecules that have unpaired electron. Unpaired electron in this compound has a tendency to find its part ner from other compounds that may lead to the destruction of the latter compound and formation of new compounds (Winarsi, 2007). The reaction of these free radicals inside the body can cause cancer, atherosclerosis, diabetes mellitus, coronary heart disease, kidney disease, cataracts and the aging process (Kumalaningsih, 2008; Setati, 2003). Under normal circumstances, a number of radicals can be intercepted by the body's natural antioxidants such as superoxide dismutase (SOD), catalase (CAT ), glutation peroksidase (GPx), glutation reduktase (GR) dan seruloplasmin. However, in certain circumstances, the amount of free radicals can be so large that they can not be overcame by the natural antioxidants in the body. Such a situation is known as oxidative stress.
Oxidative stress can occurs due to increased production of free radicals in the body, one of which can be caused by maximum physical activity experienced by the body. When the body is undergoing maximum activity, the body consumes oxygen 100-200 fold because of increased metabolism in the body. Increased oxygen consumption will lead to increased production of free radicals. Free radicals (hydroxyl radicals) formed will react with the poly unsaturated fatty acids (PUFA) which is a component of cell membranes. T his reaction is a chain reaction, resulting in the formation of hydrogen peroxide compounds and damage of the cell membrane. Hydrogen peroxide can cause decomposition of cell membrane’s structure and decomposition of some aldehyde products which are different in long chain and toxic to cells, such as malone dialdehyde (MDA) (Winarsi, 2007). Malondialdehyde (MDA) is the end result of lipid peroxides as well as can be used a s an indicator of the presence of free radicals (Aruna,1996).
Effects of free radicals in the body can be reduced by consuming a variety of
ingredients that contain antioxidants. Antioxidants are compounds that can counteract or reduce the negative impact of oxidants in the body. Antioxidants work by donating an electron to the oxidant such as free radicals, so free radicals will become stable and non-toxic (Setati, 2003; Winarsi, 2007). Antioxidants can be obtained from variety of plants or animals. One of the plants that contain antioxidants is the guava (Psidium guajava L.). Research on the antioxidant activity of guava leaves in vitro was performed by Dwijanarko (2005) using DPPH radical method. T he result of his research showed that IC50 of guava leaves extract extracted with various ethanol concentrations (0%, 70%, and 96%) were 8.628 ppm, 8.372 ppm and 11.280 ppm respectively. This result indicate that guava leaf which is extracted with 70% ethanol has a very strong antioxidant activity due to the smallest IC50 value (50 ppm). Based on the result of in vitro antioxidant activity mentioned above, this research was conducted to investigate the in vivo antioxidant activity of guava leaves extracted using 70% ethanol by using Northwest Life Science Specialties (NWLSST M) method measuring the levels of serum MDA. Decreased levels of MDA shows the decreasing of poly unsaturated fatty acids oxidation by free radicals triggered by physical maximum activity, which further shows the antioxidant activity of the tested materials (ethanolic extract of guava leaves).
RES EARC H METHO D Equipment and Mate rials
Laboratory standard glass equipment, funnels, rotary evaporator, analytical scales, centrifuge equipment, vortex mixer, waterbath, spectrophotometer MICROLAB 300, guava leaves, 70% ethanol, distilled water, chloroform, concentrated sulfuric acid, magnesium powders, concentrated hydrochloric acid, norit, anhydride acetic, chloroform, 0.05 N ammonia, 2N H2SO4, mayer reagent, Na CMC, Standard MDA and NWLSST M Assay Kit.
Pre paration of animal expe riments
Animals used in this study were healthy male albino mice aged 2-3 months which
weighing 20-30 grams from Swiss strain. Before treating, mice were acclimatized with laboratory environment for 7 days, with enough fed and watered. Mice used were healthy mice and visually showed normal behavior. Mice were randomly divided into 4 groups, each group consisting of 5 individuals.
Sampling and identification of sample
Guava (Psidium guajava L.) samples were taken in T anjung Baru, T anah Datar, West Sumatera. Identification of sample was done in Herbarium of Biology Department, Andalas University Padang.
Pre paration of ethanolic extract of guava leaves
Guava leaves were weighed 1 kg and cleaned to eliminate foreign organic materials and other impurities by washing it with water. Drying proccess was performed at room temperature without direct sunlight. Dried guava leave was pounded and then macerated in 70% ethanol for five days with occasional stirring, and then filtered. This maceration was repeated for three times. The extract was evaporated by using a rotary evaporator to obtain viscous extract (Voight, 1995).
Examination of ethanolic e xtract of guava leaves
Organoleptic exam ination
Observation was done visually by observing the form, color, smell and taste of ethanolic extract.
Phytochem ical exam ination
Extract (0.5 g) was added with 5 mL of distilled water and 5 mL of chloroform, this mixture was shaken strongly and allowed for a few moments until it formed two layers: water and chloroform layer.
Identification of flavonoids (Sianidin test method) was done by putting 1-2 drops of water layer into the plate and adding single drop of Magnesium powder and a few drops of concenrated HCl, formation of the red color indicates the presence of flavonoids.
Identification of terpenoids and steroids (Simes Methods) was done by adding
norit
to the chloroform layer, this mixture was then filtered. The filtrate was added with 1 drop of concentrated H2SO4 and 2 drops of anhydride acetic acid, the formation of a blue violet color indicates indicates the presence steroids, wheares the formation of red color indicates indicates the presence terpenoid.
Identification of saponin was done by taking water layer, then shaken vigorously in a test tube, a permanent foam formation (± 10 min) showed a saponin.
Identification of alkaloids (Method Culvenore-Fritzgerald) was done by taking chloroform layer. T his layer was added with 10 ml of 0.05 N ammonia chloroform, stirred gently, added with a few drops of 2 N H2SO4 and then shaken gently. This mixture was allowed to separate. Acid layer is then added with few drops of mayer reagent, alkaloid is characterized by formation of white haze or sediment.
Pre paring of e thanolic extract suspension Extracts suspension was made using NaCMC 0.5%. as the suspending agent. Na CMC (50 mg) was added with 1 ml hot water, and allowed for 15 minutes. Ethanolic extract was then added with an appropriate weight for each of the desired concentration which are 50 mg/kg, 100 mg/kg and 200 mg/kg.
Animals tre atments protocol
Mice were divided into 4 groups, each consisting of 5 individual mice, namely:
Group I: which was given maximum physical activity but not given ethanolic extract (positive control)
Group II: which was given maximum physical activity and 50 mg/kg ethanolic extract.
Group III: which was given maximum physical activity and 100 mg/kg ethanolic extract.
Group IV: group which was given maximum physical activity and 200 mg/kg ethanolic extract.
Maximum load of physical activity in mice was achieved by allowing mice to swim until almost getting drown. This state was achieved when the mice head was under the water for 7 seconds and there was no significant movement of mice legs. This was due to reducing of muscle strength, decreasing of motion frequency and decreasing of reflexes (Binekada, 2002). Mice were then dried with a towel and sunlight for 10 minutes. Suspension of ethanolic extract was given orally once a day. This treatment was done for 7 days. On 8th day, blood from all animals of all groups was taken by cutting the blood vessels in the neck and placed in a test tube as much as 3 ml.
Measurement of se rum malondialdehyde (MDA) le vel by using NW LSSTM method Ingredients of NWLSST M reagent kit:
BHT (Butylated hydroxytoluene) Acid Phosphate
T BA (thiobarbituric acid)
Blood was allo wed for 15-20 minutes to forming a clot and then centrifuged at 3000 rpm for 20 minutes until two layers were formed. The upper layer was a clear fluid called serum. This serum was then separated from the sediment in order to be reacted with NWLSST kit and be measured its MDA level.
T ubes were prepared according this following procedure:
Table I. Composition of the tubes
Substance Blank tube Standard tube Samples tube (I,II,III,IV) BHT Reagent 10 μL 10 μL 10 μL Aquades 250 μL - - MDA Standard - 250 μL - Serum sample - - 250 μL
Into each tube was then added: 250 μL phosphoric acid and 250 μL T BA, mixed by using a vortex mixer and incubated in a waterbath for 60 min at 60°C, and then allowed cooling. After getting cool, this mixture was
centrifugated at 10,000 rpm for 3 minutes. The filtrate obtained was separated, and the absorbtion of this filtrate was measured using spectrophotometer Microlab 300 at λmax 532 nm. T he absorbtion of each sample was then converted automatically into serum MDA level by software of the spectrophotometer.
ANALYSIS O F DATA
The data were processed statistically by one way ANOVA, and then proceed using the Duncan New Multiple Range T est by statistical software SPSS17.0 for Windows.
RESULTS AND DISC USSIO N
From 1 kg fresh guava leaves, we obtained 53.53 g viscous ethanolic extract (5.35%). The extract seems blackish brown, and has specific odor and taste. Phytochemical identification showed that extract contains flavonoids, terpenoids and saponins. Levels of malondialdehyde (MDA) in group I-IV were: 17.42 μM, 16.05 μM, 15.45 μM and 14.56 μM respectively.
In this research, ethanolic extract of guava leaves was tested for its in vivo antioxidant activity based on its in vitro antioxidant activity reported earlier by Dwijanarko (2005). Guava leaves are expected to have a strong antioxidant efficacy in preventing various diseases such as cancer, atherosclerosis, diabetes mellitus, coronary heart disease, kidney disease, cataracts and the aging process (Kumalaningsih, 2008; Setati, 2003).
Guava leaves were taken in the morning during the maximum process of photosynthesis (Kartasapoetra, 2011). Guava leaves was extracted by maceration using 70% ethanol because the sample tested was dried samples. The presence of water in the solvent can activate cells in the leaves so the solvent more quickly penetrate into the cells and the extraction process goes more efficiently. Maceration method was chosen because its implementation is simple and it avoids the possibility of decomposition of the active substances contained in the sample due to the influence of temperature.
Experimental animals used in this study were male albino mice aged 2-3 months with an average weight 20-30 grams. To avoid distortion
of research results, mice were selected from same strain (Swiss strain), same sex, relatively same age and weight (Thompson, 1990). Before the treatment, mice were acclimatized for 1 week so that mice could adapt to the experimental environment, and avoid the stress that can affect the research results. Animal that meets the requirements for use in the research was healthy animal that visually show no symptoms of illness.
To induce a state of oxidative stress in experimental animals, animals were loaded with maximum activity. This maximum activity is achieved by allowing mice to swim almost drowned, which is characterized by the sinking of mice head under water for 7 seconds and no movement of mice feet. Maximum activity can trigger a state of oxidative stress because when the body face a maximal activity, it will consumes oxygen 100-200 fold higher than normal for the purpose of respiration and metabolism. This results in an increased byproduct of respiration and metabolism in the form of free radicals. Excessive free radicals that amount is greater than the natural antioxidants in the body is calle d the state of oxidative stress. Free radicals which can not be intercepted by the natural antioxidants in the body will result in a chain reaction of lipid peroxidation of cell membranes components which include producing a compound called malonedialdehyde (MDA), thus increasing of MDA levels in serum can be a marker that a stress oxidative has occurred within the body (Youngson, 2005). Conversely, the decreasing of serum MDA levels after the administration of a substance in individuals who experience oxidative stress may also be a marker of antioxidant property of that substance.
Table II. MDA levels in each groupa
Group MDA (μM)
Control 17.4280±.84248
50 mg/kg dose 16.0500±.32156*
100 mg/kg dose 15.4460±.61443*
200 mg/kg dose 14.5640±.47684*
aValues are mean±SD, *p<0.05
From the research that had been done, it can be seen that the extract of guava leaves
could reduce levels of serum malondialdehyde (MDA) in mice which were loaded with maximum physical activity for 7 days. On 8th day, the average levels of serum MDA in the control group were 17.42 μM, 16.05 μM, 15.45 μM dan 14.56 μM respectively. Statistical analysis of the data using one way ANOVA showed a probability < 0.05. T his result showed that administration of guava leaves extract for 7 days could significantly affected serum MDA levels in mice which given maximum activity.
Post Hoc analysis using
Duncan test showed that the average levels of MDA in all groups receiving ethanolic extract of guava leaves were significantly lower than the control group which was not given the extract (positive control). Furthermore, levels of MDA in 50 mg/kg dose group was not significantly different from 100 mg/kg dose group, but MDA level in 200 mg/kg dose group wa s significantly lower than another group.
Based on the result obtained and statistical analysis, it can be seen that the ethanolic extract of guava leaves can reduce levels of serum MDA in mice induced by maximum physical activity, so it also can be concluded that this extract has an in vivo antioxidant activity in mice. This result supports previous research result that had been reported by Dwijanarko (2005) that the ethanolic extract of guava leaves have an in vitro anti-oxidant activity against DPPH radical.
CONC LUSIO N
Ethanolic extract of guava (Psidium guajava L.) leaves has an in vivo antioxidant activity based on its ability to reduce levels of
serum MDA in mice induced by maximum physical activity
BIBLIO GRAPHY
Aruna, P., 1996, Antioxidant determinations by the use of a stable free radical, Nature, 181 : 1199-1200.
Binekada, M. C., 2002, Pelatihan Fisik Berlebih Menurunkan Konsentrasi dan Motilitas Sperm atozoa Mencit, T esis Universitas Udayana, Denpasar.
Dwijanarko, F., 2005, Uji Aktivitas Antioksidan ekstrak etanol daun jambu biji (Psidium guajava L.) secara Spektrofotom etri dan KLT-Bioautografi terhadap DPPH, Skripsi Universitas Airlangga, Surabaya.
Kartasapoetra, G., 2011, Budidaya Tanaman Berkhasiat Obat, Penerbit Rineka Cipta, Bandung.
Kumalaningsih, S., 2008, Antioksidan Alam i, Penangkal Radikal Bebas, Penerbit Trubus Agri Sarana, Surabaya.
Setati, S., 2003, Radikal Bebas, Antioksidan dan Proses Menua, Majalah Medika, no 6 : 366-369.
Thompson, E. P., 1990, Bioscreening of drug, evaluation technique & pharmacology, Weinheim Basel Cambrige, New York. Winarsi, H., 2007, Antioksidan Alam i dan
Radikal Bebas Potensi dan Aplikasinya dalam Kesehatan, Cet 2, Penerbit Kanisius, Yogyakarta.
Youngson, R., 2005, Antioksidan, Manfaat Vitam in C dan E bagi Kesehatan, Arcan, Jakarta.
UJI EFEKTIVITAS KRIM EKS TRAK ETANOL Eupatorium odoratum L. TERHAD AP
KERAPATAN S ERABUT KOLAGEN PADA PROS ES PEYEMBUHAN LUKA
Revi Yenti, Ria Afrianti, Meri Sandi STIFI Pe rintis Padang
ABSTRAC T
The test of activity cream formula of ethanolic extract of the leaf of Eupatorium odoratum L. to formation of collagen fibers in the wound healing process has been studied. T he type of cream formula is water in the oil (w/o) with 10% concentration of ethanolic extract of the leaf of kirinyuh. T he test of wound healing process have been done to the mice were divided into three groups. The first group was the negative control group was treatment by cream bases. The second group was the treatment group was treatment by cream formula of ethanolic extract of the leaf of kirinyuh (Eupatorium odoratum L). The third group was compared group was treatment by cream“ Lanakeloid-E”. Each of the groups divided again into four sub groups based on the period of the termination 5th, 7th. 14th, and 21th day after wounded. Histological evaluation was done to investigate proliferation phase by valuing the density of collagen fibers. T he result of histological evaluation showed that the compact of formation of collagen happened between 7th day and 14th day. T he data were analyzed by two way Anova SPSS17 program. T he result showed that there was significant difference of density of collagen fibers between treatment groups with control negative and compared group (p<0,05).
Keywords : Eupatorium odoratum L., cream , wound healing
PENDAHULUAN
Indonesia merupakan negara tropis yang mempunyai sumber daya alam melimpah yang dapat digali seba gi sumber obat -obatan alami. Salah satunya adalah Eupatorium odoratum L. dari family Asteraceae sebagai obat penyembuhan luka (wound healing). Eupatorium odoratum L mengandung beberapa senyawa utama seperti tannin, flavonoid, saponin, dan steroid. Essential oil dari daun kirinyuh memiliki kandungan α pinene, cadinene, camphora, limonene, β-caryophyllene dan candinol isomer (Benjamin, 1987).
Pada penelitian sebelumnya telah dilakukan pengujian terhadap ekstrak etanol Eupatorium odoratum L. konsentrasi 2,5 %, 5 % dan 10 % untuk penyembuhan luka pada mencit putih jantan. Hasil penelitian menunjukkan bahwa ekstrak etanol Eupatorium odoratum L.
konsentrasi 10% memberikan efek
penyembuhan luka lebih cepat dibandingkan dengan konsentrasi lain (Afrianti, dkk, 2010). Selanjutnya ekstrak tersebut diformulasi dalam bentuk sediaan krim tipe m/a dan a/m. Hasil penelitian menunjukkan bahwa krim tipe a/m dengan konsentrasi 10 % menunjukkan aktivitas
penyembuhan luka yang maksimal dengan parameter yang diamati adalah persentase penyembuhan luka dengan mengukur rata-rata diameter luka (Yenti, dkk, 2012).
Proses penyembuhan luka meliputi beberapa fase yang masing-masing saling berkaitan, yaitu fase inflamasi, proliferasi, dan maturasi. Segera setelah injuri, paparan kolagen fibriler ke darah akan menyebabkan agregasi dan aktivasi trombosit dan melepaskan faktor-faktor kemotaksis yang memulai proses penyembuhan luka. Fragmen-fragmen kolagen melepaskan kolagenase leukositik untuk menarik fibroblas ke daerah injuri. Selanjutnya kolagen menjadi pondasi untuk matrik ekstraseluler yang baru. Semakin rapat penampilan serabut kolagen pada daerah luka berarti akan mempercepat proses penyembuhan luka. Se baliknya semakin jarang serabut kolagen, maka akan memperlambat proses penyembuhan luka (Mercandetti, 2002). Sehingga pembentukan serabut kolagen penting untuk diteliti karena kolagen merupakan komponen kunci pada fase penyembuhan luka yang dihasilkan pada fase proliferasi.
Pada penelitian ini akan dilakukan uji efektivitas pemberian krim tipe a/m konsentrasi
10 % terhadap pembentukan serabut kolagen pada kulit punggung mencit putih jantan, karena kolagen merupakan komponen kunci pada fase dari penyembuhan luka. Proses ekstraksi daun kirinyuh dilakukan secara maserasi menggunakan pelarut etanol 70%. Ekstrak dibuat dalam bentuk krim konsentrasi 10% dengan tipe a/m. Kerapatan serabut kolagen hewan percobaan ditentukan dengan menggunakan pewarnaan hematosiklin eosin pada preparat histologisnya.
METO DE Bahan
Daun Eupatorium odoratum L., etanol 96%, reagen identifikasi ekstrak, paraffin liquidum, cetaceum, cera alba, natrium tetraborat, aquadest, krim perontok bulu, krim pembanding, eter, formalin, toluene, paraffin murni, dan pewarnaan hematoksilin-eosin (HE). Alat
Alat – alat gelas standar Laboratorium, timbangan digital, mortir, stamper, waterbath, lemari pendingin, botol maserasi, rotary evaporator, gunting bedah, pH meter inolab, desikator, furnace, krus porselin, m icrotome, dan mikroskop cahaya dengan pembesaran 400x.
He wan Pe rcobaan
Hewan percobaan yang digunakan mencit putih jantan sebanyak 36 ekor yang berumur kira-kira 3 bulan dengan berat rata-rata 20-30 gram. Mencit diaklimatisasi dengan cara dibiarkan dalam kandang selama satu minggu. Pengolahan Sampel
Sampel yang digunakan dalam penelitian ini adalah daun Euphatorium odoratom L. yang diambil di daerah Bypass KM.17 Padang. Sampel dibersihkan, ditimbang sebanyak 1 Kg lalu dirajang kemudian dimaserasi dengan etanol 96% selama lima hari. Maserat disaring, lakukan sebanyak 3 kali, kemudian dipekatkan dengan rotary evaporator hingga diperoleh ekstrak kental (Voight, 1995).
Peme riksaan Pendahuluan Bahan Baku Ekstrak Etanol Eupatorium odoratum L.
Ekstrak etanol Eupatorium odoratum L. dilakukan pemeriksaan organoleptis, kadar abu, pH, susut pengeringan, kelarutan dan kandungan kimia yang meliputi : fenolik, flavonoid, saponin, terpenoid/steroid, alkaloid dan tannin.
Formulasi Basis Krim dan Krim Ekstrak Etanol Daun Kirinyuh Tipe a/m
Tabe l I. Formula basis krim dan krim
ekstrak etanol daun kirinyuh tipe a/m
Nama Bahan F0 F1
Ekstrak Eupatorium odoratum L. - 10%
Cetaceum 12,5 g 12,5 g Cera alba 12 g 12 g Boraks 0,5 g 0,5 g P arafin Liquidum 50 g 50 g Nipagin 0,1 g 0,1 g Nipasol 0,05 g 0,05 g Aqua dest ad 100 g 100 g Keterangan: F0 = Basis Krim
F1 = Krim ekstrak etanol Eupatorium odoratum L. 10%
Pembuatan basis krim dan krim ekstrak e tanol Eupatorium odoratum L. tipe a/m
Pembuatan basis krim tipe a/m dilakukan sesuai dengan komposisi formula yang tertera pada tabel I. Masing-masing bahan basis krim ditimbang terlebih dahulu yang penimbangannya dilebihkan 10%. Selanjutnya dilakukan pembuatan basis krim dengan cara : fase minyak (cetaceum, cera alba, paraffin liquidum) dipindahkan ke dalam cawan penguap, tutup dengan kaca arloji, panaskan pada suhu 150°C selama 1 jam dalam oven. Fase air (nipagin, nipasol, boraks, dan aqua dest) dimasukkan ke dalam botol penutup, dan disterilkan dengan otoklaf selama 30 menit. Fase minyak dipindahkan ke dalam lumpang panas steril dan tambahkan fase air, lalu gerus sampai dingin sampai terbentuk masa basis krim yang homogen. Masukkan ekstrak etanol Eupatorium
odoratum L. ke dalam lumpang, tambahkan basis krim yang telah terbentuk sedikit demi sedikit kemudian digerus hingga homogen. Lalu sediaan disimpan dalam wadah krim.
Peme riksaan Basis dan Krim Ekstrak Etanol
Eupatorium odoratum L.
Pemeriksaan basis krim dan krim ekstrak etanol Eupatorium odoratum L. meliputi : pemeriksaan organoleptis, homogenitas, tipe krim, pH krim, daya tercuci krim, stabilitas terhadap suhu, distribusi ukuran partikel dan uji iritasi.
Pembuatan luka iris.
Mencit dianastesi dengan eter kemudian rambut pada daerah punggung dicukur bersih seluas 4x4 cm. Luka di eksisi pada kulit punggung mencit putih jantan dengan diameter 1 cm. Masing-masing mencit diberi perlakuan sesuai dengan kelompoknya. Pembagian kelompok dibagi menjadi tiga kelompok yaitu : Kelompok I (kontrol negatif) merupakan kelompok mencit yang akan diberi basis krim setelah dilukai. Kelompok II (perlakuan) merupakan kelompok mencit yang dioleskan krim ekstrak etanol Eupatorium odoratum L. pada bagian yang luka 2 kali sehari. Kelompok III (pembanding) yang diberikan sediaan krim yang beredar, yaitu ”Lanakeloid-E” yang mengandung ekstrak Centella asiatica dan vitamin E. Masing-masingnya dioleskan sebanyak 20 miligram.
Masing-masing kelompok dibagi lagi menjadi empat sub kelompok yang terdiri dari 3 (tiga) ekor mencit sesuai periode pengamatan kerapatan serabut kolagen, yaitu hari ke-5, 7, 14 dan 21. Pengambilan jaringan pada masing-masing kelompok dilakukan dengan cara mengambil jaringan luka 0,3 cm dari tepi luka awal dan dibuat sediaan histologis.
Pembuatan se diaan histologist
Pembuatan sediaan histologis dilakukan dengan beberapa tahap yaitu tahap fiksasi, tahap dehidrasi, tahap clearing, tahap em bedding, dan tahap pemotongan
Pe warnaan dengan He matoksilin-Eosin (HE) Deparafinisasi menggunakan xylol 2 kali masing-masing selama 5 menit dan rehidrasi dengan alkohol 95%, 90%, 80% dan 70%. Kemudian irisan dicuci dengan air mengalir lalu dibilas dengan aqua dest dan dikeringkan dengan lap. Perendaman dalam pewarnaan Hematoksilin (dalam aquadest) selama 5 menit di dalam inkubator dengan suhu 250C (ruangan), kemudian dicuci dengan tap aquadest. Setelah dicuci dengan aquadest sebanyak 2 kali, apabila terlalu hitam, dekolorisasi dengan HCl 1% lalu cuci dengan aquadest. Kemudian celupkan dalam Eosin selama 1 menit lalu cuci dengan aquadest. Keringkan dengan kertas saring. Lakukan dehidrasi dengan alkohol 70%, 80%, 90% dan 95% masing-masing 5 menit. Masukkan ke dalam xylol lagi, kemudian ditetesi dengan balsem Canada dan ditutup dengan gelas penutup. Sediaan diamati dibawah mikroskop cahaya dengan perbesaran 400x dan menggunakan kriteria berdasarkan penelitian:
(-) atau 0 : tidak tampak serabut kolagen (+) atau 1 : serabut kolagen terlihat sangat tipis atau sedikit
(++) atau 2 : serabut kolagen menyebar sedang
(+++) atau 3 : serabut kolagen menyebar padat atau tebal
ANALSIS DATA
Data kelompok perlakuan yang diperoleh diolah secara statistik dengan analisa variasi dua arah (ANOVA) dengan program SPSS 17. Hasil akan berarti bila perbandingan dengan kelompok kontrol dan kelompok pembanding memberikan perbedaan yang nyata dan bermakna secara statistik (P<0,05)
HASIL DAN PEMBAHASAN
Ekstraksi 1 Kg daun Eupatorium odoratum L. dengan pelarut etanol 96% menghasilkan rendemen 8,43%. Pemeriksaan organoleptis, kadar abu, pH, susut pengeringan, dan kelarutan berturut-turut adalah sebagai berikut : ekstrak berwarna hijau tua, berbau aromatis, berbentuk kental dan berasa pahit, kadar abu 5,79%, pH 6,35, susut pengeringan 4,59%, ekstrak sangat sukar larut dalam air dan
mudah larut dalam etanol. Hasil pemeriksaan kandungan kimia Eupatorium odoratum L. positif terhadap flavonoid, saponin, steroid , fenolik dan tannin. Hasil pemeriksaan evaluasi basis krim dan krim esktrak etanol Eupatorium odoratum L. menunjukkan hasil yang stabil secara fisik selama 8 minggu penyimpanan.
Hasil pemeriksaan uji efek krim ekstrak etanol Eupatorium odoratum L. terhadap kerapatan serabut kolagen pada proses
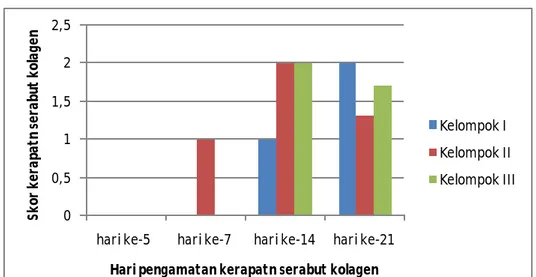
penyembuhan luka mencit putih jantan diperoleh hasil bahwa serabut kolegen baru terlihat pada hari ke-14 pada kelompok I, sedangkan pada kelompok II sudah terlihat pada hari ke-7. Kelompok III serabut kolagen mulai terlihat pada hari ke-14. Hasil pengamatan kerapatan kolagen pada hari ke-5, 7, 14 dan 21 terhadap kelompok Kontrol, perlakuan dan pembanding dapat dilihat pada gambar 1.
Gambar 1. Hasil pemeriksaan kerapatan serabut kolagen pada hewan percobaan Keterangan :
Kelompok I = kelompok mencit yang diberi basis krim (F0)
Kelompok II = kelompok mencit yang diberi krim ekstrak etanol daun Eupatorium odoratum L. 10% (F1)
Kelompok III = kelompok mencit yang diberi krim pembanding
Hasil analisa statistik menunjukkan bahwa a da perbedaan kerapatan serabut kolagen yang berbeda nyata antara kelompok II dengan kelompok I tetapi tidak berbeda nyata dengan kelompok III (p<0,05). Sedangkan hasil analisis statistic dari pengaruh hari terhadap kerapatan serabut kolagen menunjukkan bahwa setiap kelompok perlakuan berbeda nyata pada hari ke-5 dan ke-7, tetapi tidak berbeda nyata kerapatan serabut kolagennya setiap kelompok perlakuan pada hari ke-14 dan ke-21.
Semua kelompok perlakuan
menunjukkan bahwa pada hari ke-5 jaringan luka dipenuhi dengan sel radang. Pada kelompok II jumlah sel radang lebih banyak jika
dibandingkan dengan kelompok I. Pada hari ke-7 jumlah sel radang pada kelompok I semakin banyak tetapi epitel dan kolagen masih belum terbentuk, sedangkan kelompok II sel radang sudah mulai berkurang, bahkan sudah mulai menghilang. Sementara epitel sudah mulai terbentuk dan kolagen sudah mulai terlihat menyebar tipis (skor +). Hal ini disebabkan karena pada kelompok I fase inflamasi telah diperpanjang. Menurut Ambarwati, 2009 fase inflamasi berlangsung sejak terjadinya luka sampai kira-kira hari ke-5.
Pada hari ke-14 kelompok I, kolagen dan epitel mulai terlihat, walaupun skornya +, sementara sel radang sudah menghilang. Pada hari ke-21 kulit sudah mulai normal, hal ini ditandai dengan mulai tumbuhnya folikel rambut dan jaringan epidermis sudah terbentuk kembali, dapat dilihat pada gambar 2. Pengamatan pada kelompok I ini tidak terlihat gambaran serabut kolagen yang padat, disebabkan oleh interval pengambilan jaringan yang terlalu jauh. T api dari gambar jaringan yang diperoleh dapat disimpulkan bahwa kerapatan serabut kolagen
0 0,5 1 1,5 2 2,5
hari ke-5 hari ke-7 hari ke-14 hari ke-21
S ko r ke ra pa tn s e ra bu t k o la ge n
Hari pengamatan kerapatn serabut kolagen
Kelompok I Kelompok II Kelompok III
yang padat terjadi di antara hari 14 dan ke-21.
Fol ikel R ambut
Gambar 2. Gambar jaringan kelompok kontrol hari ke-21
Pada hari ke-14 kelompok II, epitel telah terbentuk sempurna. Kulit sudah kembali normal, hal ini ditandai dengan telah terbentuknya folikel rambut dan epidermis. Se dangkan kolagen terlihat menyebar sedang bahkan terlihat semakin tipis, dapat dilihat pada gambar 3. Hal ini menandakan bahwa luka sudah mulai sembuh dan jaringan sudah normal, sehingga akan terjadi pengurangan pembentukan serabut kolagen. Pada kelompok II juga tidak terlihat adanya penyebaran serabut kolagen yang padat. Dari hasil penelitian yang diperoleh dapat disimpulkan bahwa penyebaran serabut kolagen yang padat terjadi di antara hari ke 7 dan 14. Hal ini sesuai dengan pengamatan dari penelitian sebelumnya secara visual persentase penyembuhan luka yang maksimal terjadi pada hari ke 10 (Yenti, 2012).
Fol ikel Ra mbut
Gambar 3. Gambar jaringan kelompok perlakuan pada hari ke-14
Hasil pengamatan pada kelompok III terlihat bahwa pada hari ke-5 dan ke-7 serabut kolagen dan epitel belum terlihat. Pada hari ke-14 sel epitel mulai terbentuk dan serabut
kolagen terlihat menyebar sedang. Pada hari ke-21 kulit sudah kembali normal, hal ini ditandai dengan terbentuknya folikel rambut dan pembentukan serabut kolagen yang sudah mulai berkurang. Penyebaran serabut kolagen yang padat pada kelompok III ini diperkirakan terjadi di antara hari ke 14 dan 21. Namun pada kelompok III lebih cepat pembentukan serabut kolagen dibandingkan dengan kelompok I karena pada hari ke-14 skor kerapatan serabut kolagennya kelompok III ++ dibandingkan dengan kelompok kontrol yang masih + , dapat dilihat pada gambar 4.
Foli ke l rambut
Kol agen
Gambar 4. Gambar jaringan kelompok pembanding hari ke-14
Proses penyembuhan luka yang lambat pada kelompok I dapat diakibatkan oleh faktor lokal seperti infeksi bakteri sehingga dapat memperpanjang fase inflamasi dan fase proliferasi (Ama, 2011). Fase proliferasi berlangsung dari akhir fase inflamasi sampai kira-kira akhir minggu ke-3. Fase proliferasi disebutkan juga fase fibroplasia karena yang menonjol adalah proses proliferasi fibroblast. Fibroblast berasal dari sel mesenkim yang belum berdiferensiasi, menghasilkan mukopolisakarida, asam aminoglikosida, prolin yang merupakan bahan dasar serat kolagen yang akan mempertautkan tepi luka (Ambarwati, 2009).
Kolagen adalah protein utama yang menyusun komponen matrik ekstraseluler dan merupakan protein yang paling banyak ditemukan di dalam tubuh manusia. Kolagen tersusun atas triple helix dari tiga rantai α polipeptida. Kolagen memegang peranan yang sangat penting pada setiap tahap proses penyembuhan luka. Kolagen mempunyai kemampuan antara lain homeostasis, interaksi dengan trombosit, interaksi dengan fibronektin, meningkatkan eksudasi cairan, meningkatkan komponen seluler, meningkatkan faktor
pertumbuhan dan mendorong proses fibroplasia dan terkadang pada proliferasi epidermis (Robins dan Kumar, 1995).
Adanya perbedaan skor kerapatan serabut kolagen kelompok I dengan kelompok II diseba bkan kandungan kimia dari ekstrak daun Eupatorium odoratum L. yang mengandung senyawa fenolik, flavanoid, saponin, terpenoid, steroid dan tannin. Flavonoid dalam menghambat pertumbuhan bakteri antara lain
menyebabkan terjadinya kerusakan
permeabilitas dinding sel bakteri, mikrosom dan lisosom sebagai hasil dari interaksi antara flavonoid dengan DNA bakteri. Flavonoid juga mampu melepaskan energi tranduksi terhadap membran sitoplasma bakteri selain itu juga menghambat motilitas bakteri (Robinson, 1995).
T annin adalah golongan senyawa polifenol tumbuhan yang mampu mengubah kulit hewan menjadi kulit samak karena kemampuannya menyambung silang protein. T annin bereaksi dengan protein membentuk kopolimer mantap, yang tidak larut dalam air. Dalam tumbuhan letak tannin terpisah dari protein dan enzim sitoplasma, tetapi bila jaringan rusak akan terjadi reaksi penyamakan (Simes, 1959). Tannin juga berfungsi sebagai adstringen yang dapat menyebabkan penciutan pori-pori kulit, memperkeras kulit, menghentikan eksudat dan pendarahan yang ringan, sehingga mampu menutupi luka dan mencegah pendarahan yang biasa timbul pada luka (Robinson, 1995).
Saponin adalah senyawa aktif permukaan yang menimbulkan busa jika dikocok dalam air dan pada konsentrasi yang rendah sering menyebabkan hemolisis sel darah merah. Beberapa saponin bekerja sebagai antimikroba, saponin memiliki kemampuan sebagai pembersih dan antiseptik yang berfungsi membunuh atau mencegah pertumbuhan mikroorganisme yang biasa timbul pada luka sehingga luka tidak mengalami infeksi yang berat (Harbone, 1987).
KESIMPULAN DAN SARAN
Formula krim yang mengandung ekstrak etanol Eupatorium odoratum L. dapat mempercepat pembentukan serabut kolagen pada proses penyembuhan luka dan kerapatan serabut kolagen terjadi di antara hari ke-7 dan hari ke-14. Disarankan pada peneliti selanjutnya untuk mengamati struktur histologi lainnya
secara mikroskopis di daerah epidermis, dermis dan hipodermis dengan mengidentifikasi keberadaan sel-sel radang, fibroblast, epitel squomus komplek, folikel rambut, jaringan ikat dengan pembuluh darah arteri dan vena, jaringan lemak dan otot skelet yang berperan dalam penyembuhan luka.
DAFTAR PUSTAKA
Afrianti, R., R. Yenti, L. Afriani, 2010, Studi Pendahuluan Ekstrak Etanol Daun Kirinyuh Terhadap Penyem buhan Luka, Laporan Penelitian ST IFI, Padang Ama, F., 2011, Potensi Stimulasi Elektrik dalam
Penyembuhan Luka Kulit marmot (Cavia cobaya) melalui pemeriksaan Histopatologi dan Analisa Image [T esis], Fakultas T eknologi Industri, IT S, Surabaya
Ambarwati, R, 2009, KDPK Kebidanan, Nuha Medika, Yogyakarta
Benjamin, V.T ., A, Sofowora., et al, 1987, Phytochem ical and Antibacterial Studies on The Essential Oil of Eupatorium Odoratum , Available online at http://www.Pharmaceutical
Biology.htm, [24 Februari 2010]
Harbone, J.B., 1987, Metode Fitokim ia Penentuan Cara Modern Manganalisa Tumbuhan, Diterjemahkan oleh Kosasi Padmawinata, Terbitan IT B, Bandung Mercandetti M., Cohen A, 2002, Wound
Healing, Healing and Repair. http://www.eMedicine .com.Inc [08 Agustus 2010]
Robins dan Kumar, 1995, Buku Ajar Patologi, Edisi 4, Alih Bahasa : Staf Pengajar Laboratorium Patologi Anatomik Fakultas Kedokteran Universitas Airlangga, Penerbit Buku Kedokteran, Jakarta
Simes, J.J.H., J. G. T racy, L.J. Dunston, 1995, An Australian Phychem Common Wealth Scientific and Industrial Research Organization, Australia, Melbourne, Bulletin No. 281, 5-9 Yenti, R., Ria A., dan Linda A, 2012, Formula
Krim Ekstrak Etanol Daun Kirinyuh (Eupatorium odoratum L.) Tipe A/M untuk Penyembuhan Luka, J. Ipteks Terapan, Vol 6 (2)
PENGARUH WAKTU S IMPAN KULIT UBI JALAR (Ipomea batatas L.) TERHAD AP
KADAR FENOLAT DAN AKTIVITAS ANTIOKS IDANNYA S ECARA
S PEKTROFOTOMETRI UV-VIS
Dedi Nofiandi, Farida Rahim, Rika Puspita STIFI Pe rintis Padang
ABSTRAC T
Research to investigate the effect of storing time on the level of phenolic and antioxidant activity of sweet potato skin had been conducted. T he sweet potatoes tested in this research are yellow and purple sweet potatoes which were stored for 0, 2, 4, and 6 days in a container without any special treatment at room temperature. At all storing times, the skin of yellow and purple sweet potatoes was macerated and concentrated by using rotary evaporator. As a result, concentrated extract of sweet potato skin was produced. T hen the level of phenolic and antioxidant activity of concentrated extract were measured by using UV- Vis spectrophotometry method. The result shows that phenolic content of the purple sweet potato skin stored for 0 day is 0,6497%, 2 days is 0,6371 %, 4 days is 0,5594 %, 6 days is 0,4779 %, with IC50 for each storing day respectively were 31,83 µg/ml, 55,87 µg/ml, 465,40, and 118,47 µg/ml. Fenolat
content of the yellow sweet potato skin stored for 0 day is 0,6128 %, 2 days is 0,5443 %, 4 days is 0,5304 %, 6 days is 0,335 with IC50 for each storing day respectively were 44,28µg/ml, 50,18 µg/ml,
57,27 µg/ml, and 97,13 µg/ml. T he data were processed by using two ways ANOVA with SPSS 17 application. The result of the research shows that there is a significant difference of phenolic level between concentrated extract of sweet potato toward the storing time (p>0,05), the level of phenolic and antioxidant activity decrease during the storing time. Overall, the purple sweet potato skin showed higher phenolic content and antioxidant activity than yellow sweet potato skin in all storing day.
Keywords : Storing time, Skin of yellow and purple sweet potato, Antioxidant
PENDAHULUAN
Ubi jalar (Ipom oea batatas L.) sebagai salah satu komoditas pertanian penghasil karbohidrat sudah tidak diragukan manfaatnya bagi masyarakat Indonesia. Bahkan, ubi jalar memiliki peran yang penting sebagai cadangan pangan yang bila produksi padi dan jagung tidak mencukupi lagi. Di daerah pedesaan yang sangat miskin, ubi jalar dapat dijadikan bahan pangan alternatif untuk menggantikan beras dan jagung (Juanda, 2000).
Setiap 100 g ubi jalar mengandung sekitar 8,4 g gula, 2 g protein, 20,7 g karbohidrat, 3,3 g serat, dan 90 g kalori (Subroto, 2008). Selain itu ubi jalar mengandung karotenoid vitamin A terutama yang berdaging umbi jingga, akan tetapi kandungan karoten bervariasi dari 0-8000 IU/100g atau 0-22 mg/100 g berat umbi segar. Ubi jalar juga mengandung vitamin C (20-30 mg/100 g),
Kalium (200-300 mg/ g), Besi (0.8 mgl/100 g), Kalsium (11 mg/ 100 g) (Novita, 1996).
Varietas ubi jalar ada yang berwarna putih, kuning dan ungu. Kulit umbinya juga bervariasi, yaitu putih, kuning, merah dan ungu. Semakin gelap warnanya akan semakin baik, karena menunjukkan bahwa kandungan senyawa karotennya juga lebih tinggi (Subroto, 2008).
Karotenoid merupakan sekelompok pigmen merah, oranye, dan kuning yang dapat ditemukan baik pada buah, umbi, maupun daun tanaman, juga dalam daging hewan yang mengkonsumsi tanaman yang mengandung karoten.
Senyawa karoten memiliki aktivitas antioksidan, dan berfungsi sebagai prekursor vitamin A (Munifah, 2011.) Ubi jalar merupakan salah satu makanan yang kaya akan serat alami, vitamin, mineral, dan antioksidan seperti: asam fenolat, antosianin, tokoferol (vitamin E) , dan β- karoten.
Antioksidan adalah senyawa yang menetralkan radikal bebas. T erdapat tiga macam antioksidan, yaitu: antioksidan yang dibuat oleh tubuh kita sendiri yang berupa enzim antara lain superoksida dismutase, glutathione peroxidase, dan katalas, antioksidan alami yang dapat diperoleh dari tanaman, yaitu tokoferol, vitamin C, betakaroten, flavonoid, dan senyawa fenolik, serta antioksidan sintetik yang dibuat dari bahan-bahan kimia yaitu Butil Hidroksi Anisol (BHA), Butil Hidroksi T oluen (BHT), Tersier Butil Hidrokuinon (T BHQ) (Kumalaningsih, 2006).
Seiring meningkatnya kesadaran masyarakat akan pentingnya pangan sehat maka tuntutan konsumen terhadap bahan pangan juga mulai naik diakibatkan oleh pengetahuan akan fungsi fisiologis senyawa metabolit sekunder yang terdapat pada ubi jalar. Hal ini tentunya membuat pemanfaatan ubi jalar semakin meningkat. Dalam pengolahannya, bagian ubi jalar yang sangat sering digunakan adalah bagian da ging ubi jalar. Namun, kulit ubi jalar masih hanya terbuang begitu saja yang mungkin menjadi sampah organik secara alami yang biasanya baru dibuang setelah beberapa hari. Dari studi pendahuluan, kulit umbi ubi jalar mengandung senyawa flavonoid dan fenolik, yang apabila dimakan bersama umbinya tentu akan meningkatkan asupan gizi. Selain itu, kulit ubi jalar juga bisa diolah tersendiri dari umbinya menjadi berbagai formulasi produk makanan, minuman, sediaan farmasi dan kosmetika.
Berdasarkan latar belakang diatas peneliti ingin mengetahui kadar fenolat dan aktivitas antioksidan kulit ubi jalar, serta mengamati bagaimana pengaruh waktu simpan terhadap kadar fenolat dan aktivitas antioksidan kulit ubi jalar tersebut.
METO DE P EN ELITIAN Bahan-Bahan
Ubi jalar warna kuning, dan ungu, etanol 96%, FeCl3, serbuk Mg, HCl(p), asam
asetat anhidrat, kloroform, H2SO4(P), Na2CO3,
asam galat, reagen DPPH, reagen Folin Ciocalteu, metanol p.a, aquadest.
Alat-Alat
Potato peeler, rotary evaporator, tabung reaksi, labu ukur, gelas ukur, pipet tetes, pipet volume, beaker glas, plat tetes, spektrofotometer UV-Vis.
PROSEDUR PEN ELITIAN Pengambilan Sampel
Sampel ubi jalar ungu dan kuning diambil dari daerah Padang Panjang, Sumatera Barat
Penyimpanan Sampel
Ubi jalar dicuci dengan air yang mengalir sampai bersih, kemudian dikupas kulitnya tipis-tipis. Kulit tersebut kemudian dikelompokkan sesuai dengan waktu simpannya (0, 2, 4, dan 6 hari) masing-masing sebanyak 200 gram. Kulit ubi jalar disimpan pada suhu kamar tanpa perlakuan khusus
Ekstraksi Sampel
Kulit ubi jalar ungu dan kuning yang sudah disimpan selama waktu yang telah ditentukan dirajang dan dimaserasi dengan etanol 96% selama 30 menit. Ekstrak yang diperoleh kemudian dipekatkan dengan rotary evaporator pada suhu 60 ̊C, hingga diperoleh ekstrak kental.
Penetapan Susut Pengeringan
Ekstrak kulit ubi jalar ditimbang 1 gram, dimasukkan kedalam krus yang telah ditara, lalu dipanaskan dalam oven dengan temperatur 105 ̊C selama 1 jam, kemudian didinginkan dan ditimbang, diulangi sampai diperoleh berat konstan. Susut pengeringan ditentukan dalam persen terhadap bobot sampel yang digunakan.
Peme riksaan Me tabolit Sekunde r
Ekstrak kental kulit ubi jalar (Ipom ea batatas. L) dimasukkan kedalam tabung reaksi, ditambahkan 5 ml aquadest dan 5 ml kloroform, dikocok, dan dibiarkan sampai terbentuk 2 lapisan yaitu lapisan air dan lapisan kloroform. Lapisan air digunakan untuk pemeriksaan