III METODOLOGI 3.1 Waktu dan Tempat Penelitian
Penelitian dilaksanakan pada Bulan Desember 2009 sampai Juni 2010 di Laboratorium Pilot Plant dan Evaluasi Sensori Seafast Center IPB, serta Laboratorium Pengolahan Pangan, Kimia Pangan, serta Biokimia Pangan dan Gizi Departemen Ilmu dan Teknologi Pangan.
3.2 Bahan dan Alat 3.2.1 Bahan
Bahan baku yang digunakan meliputi bahan baku utama dan bahan baku tambahan serta bahan kimia. Bahan baku utama antara lain jagung varietas Pioneer 21 dan tepung terigu cakra kembar, sedangkan bahan tambahan dalam pembuatan mi yaitu guar gum, CMC, K2CO3, Na2CO3, garam, baking soda dan air.
Bahan kimia yang digunakan untuk analisis diantaranya adalah HCl, NaOH, asam asetat, aseton, kertas saring, heksan, amilosa standar, buffer fosfat 0.1 M pH 6 dan pH 7, buffer asetat pH 5 dan pH 6, alumunium foil, asam dinitrosalsilat (DNS), iod, etanol, eter, asam tanat, Folin-Denis, maltosa standar, glukosa standar, amiloglukosidase (SIGMA A7095), α-amilase from Aspergillus oryzae (SIGMA 86250), pepsin (SIGMA P7000), peptidase (SIGMA P7500), pankreatin (SIGMA P1750), α-amilase solution Type XII A-bacterial from Bacillus licheniformis (SIGMA A3403), kimotripsin (SIGMA C4129), dan tripsin (SIGMA T4799). 3.2.2 Alat
Peralatan yang digunakan terdiri peralatan penepungan, produksi mi jagung dan peralatan untuk analisis kimia dan evaluasi biologis serta indeks glikemik. Peralatan penepungan adalah hammer mill, disc mill, automatic siever, dan pengering kabinet. Peralatan untuk produksi mi jagung diantaranya adalah mixer, noodle sheeter, steamer, slitter, dan oven (Thelco Model 15), alat-alat penggoreng dan pengering kabinet. Alat untuk analisa kimia dan evaluasi nilai biologis mi serta pengujian indeks glikemik adalah tanur (Barnstead Thermolyne 48000), pompa vakum (Oakton WP-15-1), waterbath (Geselifchaft fur Labortechnik Type 1083 LGL), sentrifus (Hettich Sentrifugen D-7200), spektofotometer (Spectronic 20D+), pH meter (Orion Model 210A), timbangan
23 analitik (Precisa XT 220A), penangas (Therolyne Cimarec 3), dan glukometer Merk One Touch Ultra.
3.3 Tahapan Penelitian
Penelitian dibagi menjadi tiga tahap yaitu tahap produksi dan karakterisasi kimia tepung jagung, tahap proses dan karakterisasi sifat kimia dan evaluasi nilai biologis mi jagung substitusi kering dan instan, dan pengukuran indeks glikemik mi jagung substitusi kering dan instan serta mi komersial. Secara garis besar tahap penelitian ditampilkan pada Tabel 5.
Tabel 5. Tahap penelitian dan analisis
Tahap Tujuan analisis Tahapan Analisis Hasil analisis
1 Menentukan karakteristik kimia tepung jagung Analisis tepung jagung Kimia: proksimat,
analisis kadar pati metode hidrolisa asam dan kadar amilosa.
Kadar kimia (proksimat, pati dan amilosa) tepung jagung 2 Menentukan karakteristik kimia dan evaluasi nilai biologis mi jagung substitusi kering dan instan
Analisis mi jagung substitusi kering dan instan Kimia: proksimat,
analisis kadar pati metode hidrolisa asam dan kadar amilosa Evaluasi nilai biologis:
Analisis kadar pati resisten secara in vitro, analisis kadar serat pangan metode enzimatis, analisis daya cerna pati secara enzimatis, analisis daya cerna protein secara in vitro teknik multienzim. Kadar kimia (proksimat, pati dan amilosa) dan evaluasi nilai biologis mi jagung substitusi kering dan instan 3 Menentukan indeks glikemik mi jagung substitusi kering dan instan serta mi komersial Pengukuran indeks glikemik Pengukuran indeks glikemik Data indeks glikemik
24 3.3.1 Pembuatan Tepung Jagung
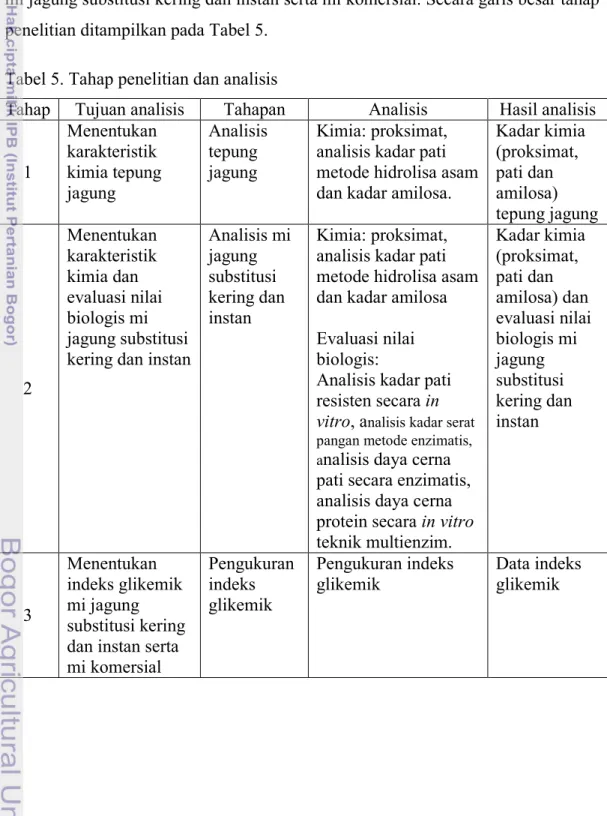
Pembuatan tepung jagung bertujuan mengevaluasi karakteristik kimia tepung jagung dengan melakukan analisis proksimat, analisis kadar pati metode hidrolisa asam dan kadar amilosa. Proses penepungan diawali dengan penggilingan jagung pipil dengan hammer mill, dari tahap penggilingan tersebut terpisah grits (pecahan biji jagung), kulit ari dan lembaga. Hasil penggilingan jagung pipil dicuci dan di endapkan untuk memisahkan bagian yang terapung (lembaga dan kulit ari) dengan bagian grits yang mengendap. Grits dikering-anginkan hingga kadar air ±17%. Grits kering digiling dengan menggunakan disc mill, kemudian dimasukkan ke dalam ayakan bertingkat ukuran 100 mesh, sehingga dihasilkan tepung jagung dengan ukuran lolos ayakan 100 mesh. Alur proses penepungan jagung ditunjukkan pada Gambar 4.
Gambar 4. Pembuatan tepung jagung dengan penggilingan kering Lembaga, kulit dan tip cap Penggilingan I (hammer mill)
Jagung pipil kering
Pengayakan 100 mesh Pemisahan endosperm dari
lembaga, kulit dan tip cap
Penirisan dan pengeringan Grits, lembaga, tip
cap dan kulit
Grits jagung
Penggilingan II (disc mill)
Tepung kasar
Tepung jagung 100 mesh
25 3.3.2 Pembuatan Mi Jagung Substitusi Kering dan Instan
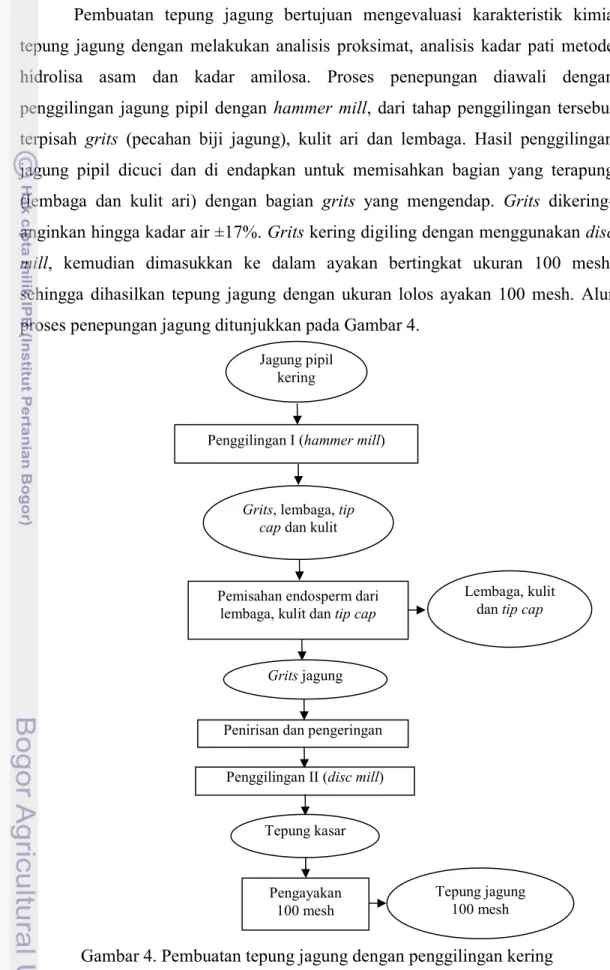
Pembuatan mi jagung substitusi kering dan instan digunakan untuk mengevaluasi karakteristik kimia dan evaluasi nilai biologis. Analisis kimia mi jagung substitusi meliputi proksimat, kadar pati metode hidrolisa asam dan kadar amilosa. Analisis evaluasi nilai biologis yaitu kadar pati resisten secara in vitro, kadar serat pangan metode enzimatis, daya cerna pati secara enzimatis dan daya cerna protein secara in vitro dengan teknik multienzim. Proses pembuatan mi jagung substitusi diawali dengan mencampur sejumlah bahan kering yang terdiri dari tepung terigu (70%), tepung jagung (30%). Pada pembuatan mi jagung instan bahan kering yang dicampurkan adalah CMC (carboxy methyl cellulose) (1%) serta baking powder (0.3%), sedangkan untuk mi jagung kering, bahan kering yang dicampurkan adalah guar gum (0.5%), K2CO3 (0.1%), dan Na2CO3 (0.1%).
Bahan yang telah tercampur merata ditambahkan larutan garam (garam 1% dan air 40%) dan dicampur kembali dalam mixer sehingga terbentuk adonan. Adonan yang telah tercampur sempurna (kalis) dibentuk bulatan-bulatan agar memudahkan proses pembentukan lembaran mi. Adonan ditekan dengan cara dimasukkan ke dalam grinder dengan ukuran diameter 0.3 cm sebanyak 2 kali, kemudian campuran dibentuk lembaran secara bertahap dengan alat sheeting.
Lembaran mi dibagi menjadi dua bagian untuk mengurangi panjang lembaran mi yang terbentuk. Pembentukan lembaran mi dilakukan pengaturan skala dari skala 1.8 hingga 0.2 (penurunan per 0.2 skala), dimana pada skala 1.8 adonan dilewatkan maksimal 3 kali (hingga terbentuk lembaran) dan sebelum memasuki skala 1.4 dilakukan dasting (pelumuran) dengan tepung jagung. Untaian mi yang telah dipotong kemudian dilakukan pengukusan pada suhu 95oC selama 15 menit. Untuk membuat mi jagung instan, mi yang telah dikukus dilakukan proses penggorengan pada suhu 160oC selama 4 menit, didinginkan dan diperoleh mi jagung instan. Sedangkan untuk mi jagung kering, mi jagung yang dikeringkan dengan oven pada suhu 60oC selama 70 menit, dimana dilakukan pembalikan setelah 45 menit pengeringan. Alur proses pembuatan mi jagung substitusi ditunjukkan pada Gambar 5.
26 Gambar 5. Pembuatan mi jagung substitusi kering dan instan tepung jagung 30 %
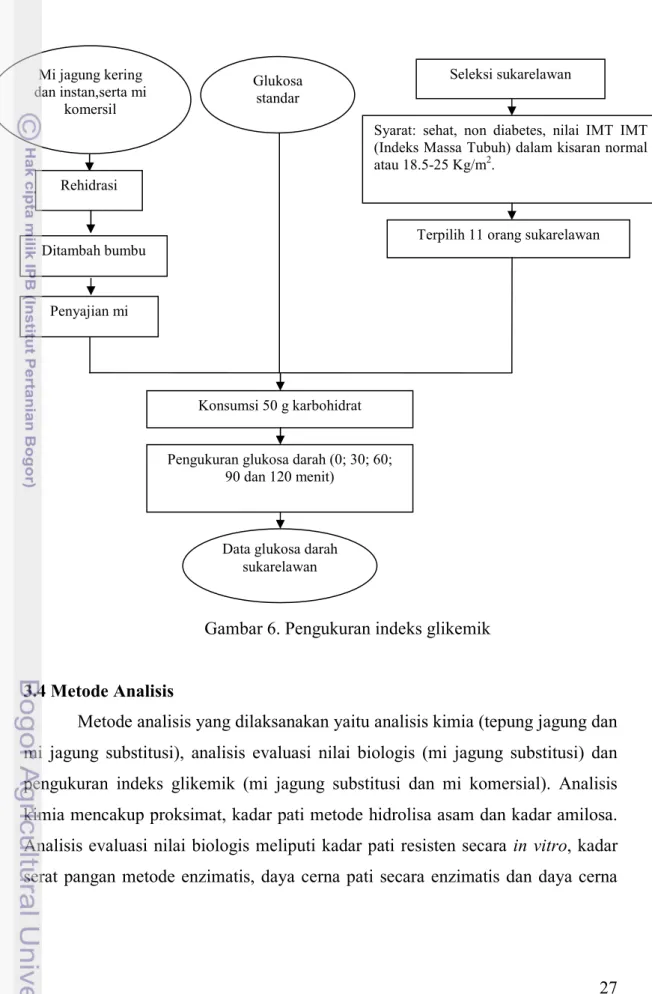
3.3.3 Pengukuran Indeks Glikemik
Penelitian tahap tiga ini bertujuan untuk (1) menganalisis nilai indeks glikemik masing-masing produk mi, (2) membandingkan indeks glikemik mi jagung substitusi kering dan instan terhadap indeks glikemik mi komersial. Waktu rehidrasi mi jagung kering 5 menit, mi jagung instan selama 3.30 menit dan mi komersial selama 3 menit seperti yang ditunjukkan pada Gambar 6. Penjelasan
Air garam (garam 1% dan air 40%) Tepung terigu (70%) Pencampuran I (kering) Pencampuran II Untaian mi
Sheeting, slitting, dan cutting
Pengeringan oven (T = 60oC, t = 70 menit) Penggorengan (T = 160oC t = 4 menit) Pendinginan Mi jagung substitusi instan Tepung jagung (30%) Adonan Pengukusan mi mentah (T = 95oC; t = 15 menit) Bahan tambahan kering Pendinginan Mi jagung substitusi kering
27 lebih lengkap tentang pengukuran indeks glikemik diterangkan pada prosedur penelitian tentang pengukuran indeks glikemik.
Gambar 6. Pengukuran indeks glikemik
3.4 Metode Analisis
Metode analisis yang dilaksanakan yaitu analisis kimia (tepung jagung dan mi jagung substitusi), analisis evaluasi nilai biologis (mi jagung substitusi) dan pengukuran indeks glikemik (mi jagung substitusi dan mi komersial). Analisis kimia mencakup proksimat, kadar pati metode hidrolisa asam dan kadar amilosa. Analisis evaluasi nilai biologis meliputi kadar pati resisten secara in vitro, kadar serat pangan metode enzimatis, daya cerna pati secara enzimatis dan daya cerna
Data glukosa darah sukarelawan Mi jagung kering
dan instan,serta mi komersil
Seleksi sukarelawan
Syarat: sehat, non diabetes, nilai IMT IMT (Indeks Massa Tubuh) dalam kisaran normal atau 18.5-25 Kg/m2.
Terpilih 11 orang sukarelawan
Konsumsi 50 g karbohidrat
Pengukuran glukosa darah (0; 30; 60; 90 dan 120 menit) Rehidrasi Ditambah bumbu Penyajian mi Glukosa standar
28 protein secara in vitro dengan teknik multienzim. Pengukuran indeks glikemik dilakukan dengan pengukuran kadar glukosa darah 8 orang sukarelawan.
3.4.1 Analisis Kimia
Analisis kimia yang dilakukan meliputi proksimat, kadar pati metode hidrolisa asam dan kadar amilosa.
3.4.1.1 Analisis Proksimat (AOAC 1995)
Pengujian analisis proksimat terdiri dari analisis kadar air, abu, protein, lemak, sedangkan karbohidrat diperoleh dengan cara “by difference”. Analisis kadar air dilakukan dengan menggunakan metode oven, kadar abu dengan pengabuan kering, kadar lemak dengan metode soxhlet dan kadar protein dengan metode Mikro-Kjeldahl.
3.4.1.2 Analisis Kadar Pati Metode Hidrolisa Asam (Modifikasi Sudarmadji 1997)
Prinsip pengukuran kadar pati adalah dengan melakukan hidrolisis pati dalam sampel menjadi gula dengan menggunakan asam, kemudian larutan sampel diukur kadar gulanya. Kadar pati adalah glukosa dikalikan 0.9.
Persiapan sampel pati hidrolisa asam
Sampel ditimbang sebanyak 0.1 g dan dimasukkan ke dalam erlenmeyer 250 ml, kemudian ditambahkan 50 ml akuades dan diaduk selama 1 jam. Suspensi disaring dengan kertas saring dan dicuci dengan akuades hingga volume filtrat 250 ml. Filtrat tersebut mengandung karbohidrat yang larut sehingga dibuang. Residu dicuci dengan 10 ml eter sebanyak 5 kali untuk menghilangkan lemak, setelah eter menguap cuci kembali dengan 150 ml alkohol 10% untuk membebaskan lebih lanjut karbohidrat yang larut. Residu dipindahkan secara kuantitatif ke dalam erlenmeyer dengan pencucian 200 ml akuades dan ditambahkan 20 ml HCl 25%, dan ditutup dengan pendingin balik dan dipanaskan diatas penangas air mendidih selama 2.5 jam. Setelah dingin dinetralkan dengan larutan NaOH 45% dan encerkan hingga volume 500 ml, kemudian disaring dan diperoleh filtrat. Filtrat yang diperoleh kemudian dilakukan analisis kadar gula dengan menggunakan metode Luff-Schoorl.
29 Penentuan total gula pereduksi dengan Metode Luff-Schoorl
Larutan sampel yang telah diencerkan diambil 25 ml dan dimasukkan ke dalam erlenmeyer, kemudian ditambah 25 ml larutan Luff-Schoorl. Dibuat pula percobaan blanko yaitu 25 ml larutan Luff-Schoorl ditambah 25 ml akuades. Campuran kemudian dimasukkan kedalam waterbath bersuhu 100 oC selama 10 menit dan didinginkan dengan air mengalir. Setelah campuran dingin, ditambahkan 15 ml KI 20% dan tambahkan 25 ml H2SO4 26,5%. Penambahan
larutan H2SO4 dilakukan secara perlahan-lahan. Iodium yang dibebaskan dititrasi
dengan larutan Na-thiosulfat 0.1 N memakai indikator pati sebanyak 2-3 ml, untuk memperjelas perubahan warna pada akhir titrasi sebaiknya pati ditambahkan pada saat titrasi hampir berakhir. Di catat ml Na-thiosulfat yang terpakai untuk proses perhitungan.
Perhitungan kadar pati sampel:
Dengan mengetahui selisih antara titrasi blanko dan titrasi contoh, kadar gula reduksi setelah inverse (setelah hidrolisa dengan HCl 30%) dalam bahan dapat dicari dengan menggunakan tabel selisih (Lampiran 2). Selisih kadar gula reduksi sesudah dengan sebelum inverse (penentuan gula reduksi) dikalikan 0.9 dan faktor pengenceran merupakan kadar pati dalam bahan.
3.4.1.3 Analisis Kadar Amilosa (Apriyantono et al. 1989)
Prinsip pengukuran amilosa adalah berdasarkan pembentukan warna biru akibat reaksi amilosa dengan iod yang diukur dengan spektrofotometer pada panjang gelombang 625 nm.
Pembuatan kurva standar
Amilosa murni ditimbang sebanyak 40 mg, dimasukkan kedalam labu takar 100 ml, lalu ditambahkan etanol 1 ml dan NaOH 1 N sebanyak 9 ml. Campuran kemudian dipanaskan dalam air mendidih selama kurang lebih 10 menit sampai semua bahan membentuk gel dan didinginkan. Pindahkan seluruh campuran ke dalam labu takar 100 ml dan ditepatkan sampai tanda tera dengan akuades. Pipet standar masing-masing sebanyak 1, 2, 3, 4, dan 5 ml dan dimasukkan kedalam labu takar 100 ml. Masing-masing larutan ditambahkan asam asetat 1 N sebanyak 0.2, 0.4, 0.6, 0.8, dan 1.0 ml, lalu ditambahkan larutan iod sebanyak 2 ml. Larutan ditambahkan akuades hingga tanda tera, dikocok,
30 didiamkan selama 20 menit, lalu diukur intensitas warnanya dengan spektrofotometer pada panjang gelombang 625 nm.
Penetapan sampel
Sampel sebanyak 100 mg dimasukkan kedalam labu takar 100 ml, dan ditambahkan 1 ml etanol dan 9 ml NaOH 1 N. Campuran kemudian dipanaskan dalam air mendidih selama kurang lebih 10 menit sampai semua bahan membentuk gel dan didinginkan. Pindahkan seluruh campuran ke dalam labu takar 100 ml dan ditepatkan sampai tanda tera dengan akuades. Sampel dipipet 5 ml, lalu dimasukkan kedalam labu takar 100 ml, ditambahkan 1 ml asetat 1 N dan 2 ml larutan iod. Setelah itu larutan ditambahkan akuades hingga tanda tera, dikocok, didiamkan selama 20 menit, dan diukur intensitas warnyanya dengan spektrofotometer pada panjang gelombang 625 nm. Kadar amilosa dihitung berdasarkan persamaan garis yang diperoleh dari kurva standar. Absorbansi yang diperoleh diplotkan pada kurva standar. Kadar amilosa dihitung berdasarkan rumus sebagai berikut:
Kadar amilosa (%) =
Keterangan: A = absorbansi sampel pada panjang gelombang 620 nm S = slope kemiringan pada kurva standar
Fp = faktor pengencaran W = berat sampel
3.4.2 Analisis Evaluasi Nilai Biologis
Analisis evaluasi nilai biologis meliputi beberapa analisis yaitu kadar pati resisten secara in vitro, kadar serat pangan metode enzimatis, daya cerna pati secara enzimatis, dan daya cerna protein secara in vitro dengan teknik multienzim. 3.4.2.1 Analisis Kadar Pati Pesisten secara in vitro (Modifikasi Goni et al.
1996)
Analisis kadar pati resisten terhadap sampel terlebih dahulu dilakukan proses pengecilan ukuran, pengurangan kadar air dengan pengeringan oven dan lemak (≥ 5%) dengan menggunakan petroleum eter. Sampel yang telah siap kemudian ditimbang sebanyak 100 mg dan dimasukkan kedalam tabung sentrifus. Tambahkan 10 ml buffer KCl-HCl pH 1.5 (sesuaikan pH dengan HCl 2 M atau NaOH 0.5 M) dan vortex. Tambahkan 0.2 ml larutan enzim pepsin (1 g pepsin/10
31 ml buffer KCl-HCl), divortex dan diinkubasikan dalam waterbath bergoyang pada suhu 40 oC selama 60 menit.
Setelah proses inkubasi selesai, sampel dipindahkan dan ditempatkan pada suhu ruang. Kemudian ditambahkan 9 ml buffer fosfat 0.1 M pH 6.9 (sesuaikan pH dengan HCl 2 M atau NaOH 0.5 M). Larutan enzim amilase (40 mg α-amilase per ml buffer fosfat) ditambahkan sebanyak 1 ml, divortex dan diinkubasi selama 16 jam pada waterbath bergoyang bersuhu 37 oC. Setelah inkubasi, sampel disentrifus dengan kecepatan 3000 rpm selama 15 menit dan supernatan dibuang. Sampel dicuci dengan 10 ml akudes dan disentrifus serta supernatan kembali dibuang.
Kedalam residu ditambahkan 3 ml akuades dan 3 ml KOH 4 M, kemudian divortex dan kembali diinkubasi pada waterbah bergoyang selama 30 menit pada suhu ruang. Campuran kemudian ditambahkan 5.5 ml HCl 2 M dan 3 ml buffer natrium asetat 0.4 M pH 4.75 9 (sesuaikan pH dengan HCl 2 M atau NaOH 0.5 M) dan divortex. Setelah itu, campuran ditambahkan 80 µl enzim amiloglucosidase (AMG), divortex dan kembali dilakukan inkubasi pada waterbath bergoyang pada suhu 60 oC selama 45 menit. Campuran kemudian disentrifus dengan kecepatan 3000 rpm selama 15 menit dan supernatan diambil. Sampel dicuci dengan menambahkan 10 ml akuades dan kembali disentrifus serta supernatan digabungkan dengan yang sebelumnya. Supernatan kemudian diencerkan 25-1000 ml tergantung kandungan pati resisten dari sampel. Supernatan yang diperoleh dianalisis gula dengan menggunakan metode Luff-Schoorl. Kadar pati resisten sampel adalah kadar glukosa dikalikan 0.9 dan faktor pengenceran.
3.4.2.2 Analisis Kadar Serat Pangan Metode Enzimatis (AOAC 1995)
Analisis kadar serat pangan dilakukan dengan mereaksikan sampel dengan enzim termamil, pepsin dan pankreatin. Residu yang merupakan serat pangan yang tidak larut dicuci dengan etanol dan aseton, kemudian dikeringkan. Filtrat yang merupakan serat larut diendapkan dengan etanol, kemudian disaring dan dikeringkan. Pengukuran serat pangan dibagi menjadi tiga tahap yaitu persiapan sampel, pengukuran pangan tidak larut, dan pengukuran serat pangan larut.
32 Persiapan sampel
Sampel yang telah diekstrak lemaknya dengan pelarut petroleum eter pada suhu kamar selama 15 menit ditimbang sebanyak 1 gram dan dimasukkan kedalam erlenmeyer, kemudian ditambahkan 25 ml buffer natrium fosfat 0.1 M pH 6. Penambahan buffer dimaksudkan untuk menstabilkan ezim termamil. Sampel ditambahkan 100 µl termamil lalu dipanaskan sambil ditutup dan diinkubasi (suhu = 100 oC selama waktu = 15 menit) sambil sesekali diaduk. Sampel didinginkan kemudian ditambahkan 20 ml akuades dan ditambahkan HCl 4 M hingga pH 1.5.
Sampel ditambahkan 100 mg pepsin, lalu erlenmeyer ditutup dan diinkubasikan pada suhu 40 oC sambil diaduk selama 60 menit. Pengaturan pH hingga 1.5 dimaksudkan untuk mengkondisikan agar aktivitas enzim pepsin maksimum. Sampel ditambahkan 20 ml akuades dan diatur pH-nya hingga 6.8 dengan cara ditambahkan NaOH. Sampel ditambahkan 100 ml enzim pankreatin, lalu erlenmeyer ditutup dan diinkubasi pada suhu 40 oC selama 60 menit sambil diaduk, kemudian sampel ditambahkan HCl kembali hingga pH 4.5. Kemudian sampel disaring sehingga diperoleh endapan yang dicuci dengan menggunakan 10 ml akuades sebanyak 2 kali. Pengukuran yang sama juga dilakukan untuk blanko. Dengan cara yang sama tetapi tanpa adanya sampel (hanya akuades). Nilai blanko harus diperiksa ulang terutama jika menggunakan enzim dari kemasan yang baru. Pengukuran residu (serat makanan tidak larut)
Residu dari hasil persiapan sampel dicuci dengan 10 ml etanol 95% dan 10 ml aseton masing-masing sebanyak 2 kali, lalu dikeringkan pada suhu 105 oC sampei berat tetap (sekitar 12 jam) dan dimasukkan dalam desikator dan ditimbang (D1). Suspensi yang telah kering diabukan dalam tanur 500 oC selama 5 jam, didinginkan dalam desikator dan ditimbang (I1).
Filtrat (serat makanan larut)
Volume dari filtrat yang diperoleh dari persiapan sampel ditambahkan akuades sampai dengan 100 ml, ditambah 400 ml hangat (60 oC) etanol 95%, dan diendapkan selama 1 jam. Filtrat disaring, kemudian dicuci dengan 10 ml etanol 95% dan 10 ml aseton sebanyak 2 kali. Sampel dikeringkan pada suhu 105 oC
33 selama 24 jam, kemudian dimasukkan kedalam desikator dan ditimbang (D2). Sampel yang telah kering diabukan dengan suhu 500 oC selama 5 jam, didinginkan dalam desikator, dan ditimbang (I2).
Perhitungan serat pangan:
D1 - I1 - B1
Serat makanan tidak larut (%bk) = 100%
W x
D2 - I2 - B2
Serat makanan larut (%bk) = 100%
W x
Nilai TDF (% bk) = Nilai IDF + SDF
Keterangan: Angka 1 menunjukkan berat sampel pada analisis serat makanan tidak larut dan 2 menunjukkan berat sampel pada analisis serat makanan larut.
W = berat sampel (g)
D = berat setelah analisis dan dikeringkan (g) I = berat setelah diabukan (g)
B = berat blanko bebas serat (g)
3.4.2.3 Analisis Daya Cerna Pati secara Enzimatis (Muchtadi et al. 1989) Analisis daya cerna pati dilakukan dengan mereaksikan sampel yang mengandung 1 g pati dengan enzim α-amilase sehingga akan terjadi pemecahan pati menjadi maltosa, kemudian daya cerna pati diukur sebagai jumlah maltosa pada sampel dibagi dengan jumlah maltosa dari pati standar.
Sebanyak 1 g tepung atau pati murni dimasukkan dalam erlenmeyer 250 ml, lalu ditambahkan dengan 100 ml air destilata. Wadah ditutup dengan alumunium foil dan dipanaskan dalam wadah waterbath hingga mencapai suhu 90
o
C sambil diaduk. Setelah mencapai suhu 90 oC, sampel segera diangkat dan didinginkan. Dari larutan tersebut dipipet sebanyak 2 ml ke dalam tabung reaksi tertutup, lalu ditambahkan 3 ml akuades dan 5 ml buffer fosfat 0.1 M pH 7. Masing-masing sampel dibuat dua kali, salah satunya adalah blanko. Tabung ditutup dan diinkubasi pada suhu 37 oC selama 15 menit. Larutan diangkat dan ditambahkan 5 ml larutan α-amilase (1 mg/ml dalam buffer fosfat 0.05 M pH 7) untuk sampel dan 5 ml buffer fosfat 0.1 M pH 7 untuk blanko sampel. Inkubasi dilanjutkan selama 30 menit.
Sebanyak 1 ml campuran hasil inkubasi dipindahkan ke dalam tabung reaksi bertutup berisi 2 ml DNS (asam dinitrosalsilat). Larutan dipanaskan dalam air mendidih selama 10 menit, lalu didinginkan dengan air mengalir. Ke dalam
34 larutan ditambahkan 10 ml akuades dan dibuat homogen dengan vortex, lalu diukur absorbansinya pada panjang gelombang 520 nm yang ditunjukkan dari warna oranye-merah yang terbentuk dari reaksi campuran tersebut. Kurva standar diperoleh dari perlakuan DNS terhadap 0.0, 0.2, 0.4, 0.6, 0.8, dan 1.0 larutan maltosa murni 0.5 mg/ml yang ditepatkan menjadi 1 ml dengan akuades.
A - a
Daya cerna pati (%) = 100%
B - b x
Keterangan: A = kadar maltosa sampel a = kadar maltosa blanko sampel B = kadar maltosa pati murni b = kadar maltosa blanko pati murni
3.4.2.4 Analisis Daya Cerna Protein secara in vitro dengan Teknik Multienzim (Muchtadi et al. 1989)
Pengukuran daya cerna protein dengan teknik multienzim dilakukan dengan mempersiapkan pereaksi, kemudian melakukan pengukuran daya cerna protein. Nilai pH pada menit ke-10 dicatat untuk menghitung daya cerna protein sampel menggunakan persamaan regresi Y = 210.464 – 18.103x. Pengukuran pH dilakukan pada menit ke-10, karena pH suspensi protein pada menit tersebut setelah dihidrolisis dengan larutan multienzim berkorelasi baik dengan daya cerna protein yang ditetapkan secara biologis menggunakan tikus.
Persiapan pereaksi
Pereaksi yang dipersiapkan antara lain larutan HCl 0.1 N, larutan NaOH 0.1 N dan larutan enzim. Pembuatan larutan enzim adalah dengan mencampuran 1.6 mg tripsin, 3.1 mg kimotripsin, dan 1.3 mg peptidase per ml akuades. Larutan enzim diatur pH-nya menjadi 8 dengan larutan NaOH atau HCl 0.1 N dan ditempatkan pada ice bath.
Prosedur
Sebanyak 1 g sampel disuspensikan dalam akuades sampai diperoleh konsentrasi 6.25 mg protein/ml. Sebanyak 50 ml suspensi sampel ditempatkan dalam gelas piala dan diatur pH-nya menjadi 8.0 dengan menambahkan HCl 0.1 N atau NaOH 0.1 N. Sampel diletakkan dalam penangas air bersuhu 37 oC selama 5 menit sambil diaduk. Kemudian ditambahkan 5 ml larutan multienzim (saat ditambahkan dicatat sebagai waktu nol) kedalam suspensi protein sambil tetap
35 diaduk dalam penangas air 37 oC dan pH dicatat setelah menit ke-10. Daya cerna protein dihitung menggunakan rumus sebagai berikut:
Y = 210.464 – 18.103x Keterangan: Y = daya cerna protein (%)
x = pH suspensi sampel pada menit ke- 10.
3.4.3 Pengukuran Indeks Glikemik dan Beban Glikemik (Miller et al. 1996) 3.4.3.1 Pengukuran Indeks Glikemik
Pengukuran nilai indeks glikemik dilakukan pada mi jagung substitusi kering dan instan dan mi komersil. Waktu rehidrasi yang dibutuhkan untuk masing-masing mi adalah 3.30 menit dan 5 menit untuk mi jagung substitusi kering dan instan, serta 3 menit untuk mi instan komersial. Mi yang disajikan pada sukarelawan adalah setara dengan 50 g karbohidrat dan ditambahkan bumbu.
Uji indeks glikemik dilakukan dengan menggunakan darah manusia sebagai objek penelitian (in vivo). Sukarelawan yang berpartisipasi berjumlah 11 orang. Sukarelawan yang ikut serta dalam analisis ini adalah sukarelawan yang telah lolos seleksi persyaratan pengujian indeks glikemik dan lolos screening gula darah. Syarat-syarat sukarelawan yang digunakan dalam analisis ini adalah sehat, non-diabetes, dan memiliki nilai IMT (Indeks Massa Tubuh) dalam kisaran normal atau 18.5-25 Kg/m2. Sukarelawan yang telah memenuhi persyaratan tersebut, selanjutnya akan di-screening gula darahnya yang bertujuan untuk mengetahui respon gula terhadap konsumsi glukosa dari masing-masing sukarelawan. Sukarelawan yang dinyatakan lolos screening adalah yang mempunyai respon gula darah yang baik setelah 2 jam pengujian. Pada tahap screening, masing-masing sukarelawan diminta untuk meminum glukosa yang dilarutkan dalam 200 ml air. Sukarelawan yang telah memenuhi kriteria tersebut akan menjadi subjek dan bersedia menandatangi informed consent. Dalam pengambilan subjek manusia, penelitian ini telah dimintakan izin ethical clereance dari Panitia Etik Penelitian Kesehatan di Badan Penelitian dan Pengembangan Kesehatan Departemen Kesehatan Republik Indonesia (Lampiran 27).
36 Pengukuran kadar gula darah dilakukan setelah periode puasa selama 12 jam. Selama dua jam pasca konsumsi pangan uji (mi jagung substitusi kering dan instan serta mi komersil), diambil sampel darah sukarelawan setiap selang 30 menit sekali yaitu 0 menit (kadar gula darah puasa), 30 menit, 60 menit, 90 menit, dan 120 menit. Selang sehari, hal yang sama dilakukan dengan memberikan 50 g glukosa murni (sebagai pangan acuan) kepada sukarelawan. Pengukuran kadar gula darah dilakukan dengan menggunakan glukometer merk One Touch Ultra.
Pengambilan darah dilakukan melalui pembuluh kapiler yang terdapat di jari tangan. Pembuluh darah kapiler dipilih karena berdasarkan penelitian yang dilakukan oleh Ragnhild et al. (2004), menunjukkan bahwa darah yang diambil dari pembuluh darah kapiler memiliki variasi kadar glukosa darah pada panelis yang lebih kecil dibandingkan darah yang diambil dari pembuluh vena. Glukosa darah akan bereaksi dengan enzim glucose oxydase (GOD) dan potassium ferricyanide yang terdapat pada test strip, dan dihasilkan potassium ferrocyanide. Jumlah potassium ferrocyanide yang dihasilkan setara dengan jumlah glukosa yang terkandung pada sampel (Arkray 2001).
Nilai kadar gula darah ini kemudian diplotkan menjadi sebuah grafik dengan sumbu x sebagai waktu pengukuran dan sumbu y sebagai kadar gula darah. Indeks glikemik ditentukan dengan membandingkan luas daerah dibawah kurva antara pangan yang diukur IG-nya dengan pangan acuan (glukosa murni) dikalikan 100.
Luas kurva sampel
Indeks glikemik = 100
Luas kurva glukosa x
3.4.3.2 Pengukuran Beban Glikemik
Beban glikemik dihitung berdasarkan takaran saji karbohidrat dikalikan dengan indeks glikemik suatu bahan pangan dikalikan dengan 100%.
Beban glikemik = Indeks glikemik x karbohidrat per saji
100
3.5 Analisis Data (Steel dan Torrie 1993)
Rancangan percobaan yang digunakan adalah rancangan acak lengkap (RAL) dua kali ulangan. Faktor perlakuannya adalah perlakuan pemanasan
37 (pengovenan atau penggorengan) terhadap dua jenis mi yaitu mi jagung substitusi kering dan instan. Pengolahan data selain indeks glikemik dilakukan menggunakan uji t dengan perangkat lunak Statistical Package for Social Science (SPSS) tipe 17.
Model rancangannya adalah:
Keterangan :
ij
Y = nilai pengamatan faktor pengovenan atau penggorengan ke-i dan ulangan ke-j (j=1,2)
µ = nilai tengan atau rataan umum populasi
i
τ = pengaruh faktor pengaruh pemanasan pada taraf ke-i (i = 1,2,3,4)
ij
ε = galat atau sisa percobaan dari faktor perlakuan pada taraf ke-i dengan ulangan ke-j
Analisis data indeks glikemik mi dilakukan dengan analisis Ragam (Anova). Jika analisisnya berbeda nyata, dilanjutkan dengan uji lanjut Duncan.
ij i ij