PEMANFAATAN PATI GARUT KULTIVAR CREOLE SEBAGAI SUBSTRAT DALAM PROSES PRODUKSI SIKLODEKSTRIN
Oleh:
WAHYU BUDI SATYO F03498017
2005
FAKULTAS TEKNOLOGI PERTANIAN INSTITUT PERTANIAN BOGOR
Sesungguhnya sesudah kesulitan
itu ada kemudahan. Maka apabila
kamu telah selesai (dari
sesuatu urusan),
kerjakanlah
Kupersembahkan karya kecil ini untuk Ibu, Bapak, Mbak imung,
Mas Nuri, Mas Arif, Dik Atik serta Sahabat-sahabatku yang selalu memberikan kasih sayang dan motivasi untuk terus berjuang.
PEMANFAATAN PATI GARUT KULTIVAR CREOLE SEBAGAI SUBSTRAT DALAM PROSES PRODUKSI SIKLODEKSTRIN
SKRIPSI
Sebagai salah satu syarat untuk memperoleh gelar
SARJANA TEKNOLOGI PERTANIAN
Pada Departemen Teknologi Industri Pertanian Fakultas Teknologi Pertanian
Institut Pertanian Bogor
Oleh
WAHYU BUDI SATYO F03498017
2005
FAKULTAS TEKNOLOGI PERTANIAN INSTITUT PERTANIAN BOGOR
INSTITUT PERTANIAN BOGOR FAKULTAS TEKNOLOGI PERTANIAN
PEMANFAATAN PATI GARUT KULTIVAR CREOLE SEBAGAI SUBSTRAT DALAM PROSES PRODUKSI SIKLODEKSTRIN
SKRIPSI
Sebagai salah satu syarat untuk memperoleh gelar
SARJANA TEKNOLOGI PERTANIAN
Pada Departemen Teknologi Industri Pertanian Fakultas Teknologi Pertanian
Institut Pertanian Bogor
Oleh
WAHYU BUDI SATYO F03498017
Dilahirkan pada tanggal 12 September 1980 Di Kudus, Jawa Tengah
Tanggal Lulus : 20 Oktober 2005
Menyetujui, Bogor, 5 Desember 2005
Dr. Ir. Erliza Noor Ir. Nur Richana, MSi
Wahyu Budi Satyo F03498017. The Usage of Arrowroot Cultivar Creole as a
Substrate in Production Process of Cyclodextrin. Under Guidance of Dr. Ir. Erliza Noor and Ir. Nur Richana, MSi.
SUMMARY
Generally, starch is used as a food product and an industrial material. Because of its properties limitation, starch have to modified for larger usage. Cyclodextrin is a kind of modified starch produced in biochemical reaction by Cyclodextrin Glicosyl Transferase (CGTase).
This research was used arrowroot cultivar creole as a substrate in production of cyclodextrin. Cyclodextrin is a non reducing oligosaccharide consisting of six, seven or eight glucose monomers arranged in a cyclic -shaped ring linked by á-1,4 D-glucopyranose rings. Production process of cyclodextrin consist of two steps. Hydrolize á-1,4 D-glucopyranose rings of amylose by á-amylase and catalysis of cyclodextrin by CGTase.
The aim of the research was to determine the best concentration of á-amylase, CGTase, substrate usage and reaction time. The method of analysis was used iod method to analyze polysaccarides, DNS method to analyze reducing sugar and fenol method to analyze total sugar.
The yield of arrowroot starch extraction is 9.81 percent. Starch was produced have a whiteness degree 75.06 percent BaSO4. The proximate analysis
result of starch are starch 90.22 percent, amylose 20.64 percent, amylopectin 79.32 percent, moisture 8.89 percent, ash 0.30 percent, fat 1.47 percent, fibre 0.96 percent, protein 0.30 percent. Gelatinization temperature of starch was at 69.5 – 82.5 0C.
Temperature of liquification set on 82.5 – 85 0C. The best condition of liquification process was the use of á-amylase 0.5 percent mixed for 30 minutes and starch decreased until 5.26 g/L from the base substrate concentration 50 g/L. The best condition of cyclodextrin catalysis process was by using of CGTase 30 unit during 40 minutes and the cyclodextrin increased until 42 g/L by using the base substrate concentration 50 g/L.
Wahyu Budi Satyo. F03498017. Pemanfaatan Pati Garut Kultivar Creole
Sebagai Substrat Dalam Proses Produksi Siklodekstrin. Di bawah Bimbingan Dr. Ir. Erliza Noor dan Ir. Nur Richana, MSi.
RINGKASAN
Pada umumnya pati digunakan untuk produk pangan. Penggunaan pati dalam dunia industri termasuk industri pangan dibatasi oleh sifat yang dimilikinya. Oleh karena itu perlu dilakukan upaya menghasilkan pati termodifikasi untuk pemanfaatan pati yang lebih luas. Siklodekstrin merupakan salah satu jenis pati termodifikasi yang dihasilkan secara biokimiawi oleh enzim Cyclodextrin Glicosyl Transferase (CGTase).
Pada penelitian ini digunakan pati garut kultivar creole sebagai substrat untuk proses produksi siklodekstrin. Siklodekstrin didefinisikan sebagai oligosakarida non-reduksi berbentuk siklik yang terdiri dari 6 – 8 monomer glukosa yang dihubungkan oleh ikatan á-1,4-D-glikosidik. Proses produksinya dilakukan melalui 2 tahap yaitu reaksi hidrolisis ikatan á-1,4-D-glikosidik yang terdapat di dalam rantai amilosa dan amilopektin pada pati dengan menggunakan enzim á-amilase. Tahap kedua adalah reaksi transglikolisasi intramolekular (siklisasi) untuk menghasilkan siklodekstrin yang struktur molekulnya berbentuk siklik.
Tujuan penelitian ini untuk menentukan konsentrasi enzim á-amilase dan lama reaksi terbaik pada proses likuifikasi pati, menentukan konsentrasi CGTase dan lama reaksi te rbaik untuk produksi siklodekstrin dan menentukan konsentrasi substrat pati terbaik terhadap perolehan siklodekstrin. Analisis yang digunakan adalah kadar pati sisa (metode iod), kadar gula pereduksi (metode DNS) dan kadar total gula (metode fenol).
Umbi garut kultivar creole menghasilkan rendemen pati sebesar 9,81 %. Pati yang dihasilkan memiliki derajat putih sebesar 75,06 % BaSO4, kadar pati
sebesar 90,22 %, kadar amilosa 20,64 %, kadar amilopektin 79,32 %, kadar air 8,89 %, kadar abu 0,30 %, kadar lemak 1,47 %, kadar serat 0,96 % dan kadar protein 0,30 %. Suhu gelatinisasi dicapai pada suhu 69,5 – 82,5oC.
Proses likuifikasi dilakukan pada suhu 82,5 - 85oC. Berdasarkan jumlah pati sisa selama proses lik uifikasi, parameter terbaik adalah pada penggunaan á-amilase sebesar 0,5 % dengan lama reaksi 30 menit dan dihasilkan penurunan kadar pati sisa sebesar 5,26 g/L dari pati awal sebesar 50 g/L. Kenaikan jumlah siklodekstrin terbaik sebesar 42 g/L diperoleh pada penggunaan CGTase sebesar 30 IU selama 40 menit dari pati awal yang digunakan sebesar 50 g/L.
SURAT PERNYATAAN
Saya menyatakan dengan sebenar-benarnya bahwa skripsi dengan judul :
PEMANFAATAN PATI GARUT KULTIVAR CREOLE SEBAGAI SUBSTRAT DALAM PROSES PRODUKSI SIKLODEKSTRIN
Adalah karya asli sa ya sendiri, dengan arahan dosen pembimbing akademik dan pembimbing II, kecuali yang jelas ditunjukkan rujukannya.
Bogor, 2005
Yang membuat pernyataan
WAHYU BUDI SATYO F03498017
RIWAYAT HIDUP
Penulis dilahirkan di Kudus pada tanggal 12 September 1980. Penulis adalah anak ketiga dari tiga bersaudara dari pasangan Achmad Chusen dan Hidayati (Alm). Penulis menyelesaikan pendidikan dasar di SDN Piji IV pada tahun 1992 dan melanjutkan ke SMPN I Gebog Kudus hingga tamat pada tahun 1995. Pada tahun yang sama penulis masuk SMUN I Bae Kudus dan lulus pada tahun 1998. Melalui jalur USMI, penulis diterima sebagai mahasiswa Departemen Teknologi Industri Pertanian, Fakultas Teknologi Pertanian, Institut Pertanian Bogor pada tahun 1998.
Selama menjalankan masa studi, penulis aktif dalam Organisasi Mahasiswa Daerah ‘Keluarga Kudus Bogor’ tahun 1999-2000 dan Himpunan Mahasiswa Islam tahun 2000-2001. Sebagai salah satu syarat memperoleh gelar Sarjana Teknologi Pertanian, penulis melakukan kegiatan praktek lapang pada bulan Juli-Agustus 2001 di PT. Pindo Deli Pulp and Paper Mills, Karawang Jawa Barat dengan judul praktek lapang “ Mempelajari Aspek Teknologi Pengolahan dan Pengendalian Mutu Kertas di PT. Pindo Deli Pulp and Paper Mills, Karawang-Jawa Barat”. Tugas akhir dilakukan oleh penulis yaitu penelitian dengan judul “ Pemanfaatan Pati Garut Kultivar Creole sebagai Substrat dalam Proses Produksi Siklodekstrin di bawah bimbingan Dr. Ir. Erliza Noor dan Ir. Nur Richana, MSi.
KATA PENGANTAR
Alhamdulillah atas segala rahmat, karunia dan hidayah yang dianugerahkan Allah SWT kepada penulis sehingga dapat menyelesaikan skripsi ini yang diberi judul “ Pemanfaatan Pati Garut Kultivar Creole sebagai Substrat dalam Proses Produksi Siklodekstrin”.
Terwujudnya tulisan ini tidak lepas dari dukungan dan bantuan dari semua pihak, baik berupa bantuan materil maupun moril, untuk itu penulis mengucapkan terima kasih dan penghargaan yang tulus kepada :
1. Dr. Ir. Erliza Noor selaku dosen pembimbing I atas bimbingan, arahan, nasihat, semangat, dan bekal kepada penulis selama kuliah sampai penyelesaian tugas akhir.
2. Ir. Nur Richana, MSi selaku pembimbing II yang telah memberikan bimbingan, arahan selama penelitian di Balai Pasca Panen Cimanggu Bogor serta masukan selama penyelesaian skripsi .
3. Ir. Dwi Setyaningsih, MSi selaku dosen penguji atas arahan, bimbingan dan nasehat selama penyelesaian tugas akhir.
4. Ibu Rini di labotarium Teknologi Kimia, Ibu Sri di Laboratorium Pengawasan Mutu serta seluruh staf departemen TIN atas bantuan yang telah dib erikan selama penulis melaksanakan penelitian.
5. Pimpinan Pusat Penelitian Bioteknologi IPB atas ijin penggunaan fasilitas tempat dan alat selama penelitian.
6. Bapak Achmad Chusen, Ibu Hidayati, Murni Mulyaningsih, Zaenuri, Arif Budi Santoso, Sumiati,SP atas segala doa, dukungan dan kesabaran sehingga penulis dapat menyelesaikan tugas akhir ini.
7. Teman-teman seperjuangan TIN 35, TIN 36, IMM Bogor, LSM F-Sigma, Pondok AA, Motil dan Emas atas kebersamaan dan motivasinya selama penyelesaian tugas akhir ini.
8. Semua pihak yang telah banyak membantu dan semua rekan yang tidak dapat saya sebutkan.
Penulis menyadari bahwa banyak kekurangan yang terdapat dalam skripsi ini, oleh karena itu kritik, saran, dan masukan yang bersifat membangun
dari semua pihak akan sangat membantu dalam rangka meningkatkan kemampuan penulis dalam penulisan laporan ilmiah di kemudian hari. Akhir kata penulis berharap semoga skripsi ini bermanfaat bagi semua pihak.
Bogor, 2005
DAFTAR ISI
Halaman
KATA PENGANTAR... i
DAFTAR ISI... iii
DAFTAR TABEL ... iv
DAFTAR GAMBAR ... v
DAFTAR LAMPIRAN ... vi
I. PENDAHULUAN ... 1
II. TINJAUAN PUSTAKA... 4
A. UMBI GARUT... 4
B. PATI GARUT... 5
C. SIKLODEKSTRIN ... 8
D. ENZIM CGTase (Cyclodextrin Glycosil Transferase) ... 10
E. ENZIM ALPHA-AMILASE... 13
III. METODE PENELITIAN ... 15
A. BAHAN DAN ALAT ... 15
B. METODE PENELITIAN... 15
IV. HASIL DAN PEMBAHASAN ... 18
A. ANALISIS BAHAN BAKU ... 18
1. Ekstraksi Pati... 18
2. Analisis Proksimat... 18
B. ANALISIS LIKUIFIKASI PATI... 20
C. PENENTUAN KONSENTRASI CGTase DAN LAMA REAKSI DALAM PEMBENTUKAN SIKLODEKSTRIN ... 22
D. PENENTUAN KONSENTRASI SUBSTRAT TERBAIK UNTUK MENGHASILKAN SIKLODEKSTRIN... 26
V. KESIMPULAN DAN SARAN ... 29
A. KESIMPULAN ... 29
B. SARAN ... 29
DAFTAR PUSTAKA ... 30
DAFTAR TABEL
Halaman Tabel 1. Komposisi zat gizi dalam umbi garut... 5 Tabel 2. Kandungan gizi pati garut (per 100 gram) ... 8 Tabel 3. Hasil analisis komposisi kimia pati garut kultivar creole ... 19
DAFTAR GAMBAR
Halaman
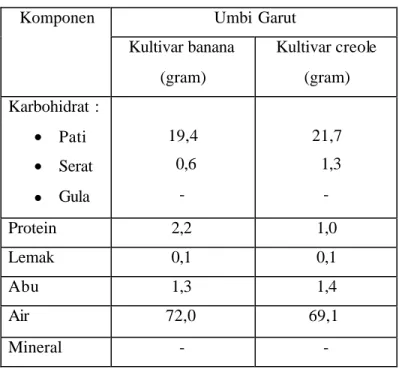
Gambar 1. Struktur amilosa (a) dan amilopektin (b) (Osman, 1972) ... ..6 Gambar 2. Struktur molekul á-siklodekstrin (a), ß-siklodekstrin (b), dan
ã–siklodekstrin (c) (Komiyama, 1984) ... ..9 Gambar 3. Keistimewaan siklodekstrin dengan sifat hidrofobik pada bagian
dalam rongga dan hidrofilik pada bagian kulit luar
(Komiyama, 1984) ... 10 Gambar 4. Reaksi katalisis oleh CGTase (Dijkhuizen et al, 2000)... 12 Gambar 5. Mekanisme kerja á-amilase dalam pemecahan ikatan
á-1,4-D-gliklosidik (Robyt, 1984 Di dalam Whistler)... 14 Gambar 6. Diagram alir proses ekstraksi pati garut ... 16 Gambar 7. Analisis amilograph pati garut kultivar creole ... 20 Gambar 8. Pola perubahan kadar pati sisa pada berbagai tingkat
konsentrasi enzim á-amilase dengan konsentrasi substrat
pati garut kultivar creole 5 % pada suhu 85oC... 21 Gambar 9. Jumlah siklodekstrin pada berbagai tingkat konsentrasi
CGTase dengan penggunaan substrat 5 % dan enzim á-amilase 0,5 % pada suhu 60oC selama 60 menit ... 23 Gambar 10. Pola perubahan total gula pada berbagai tingkat konsentrasi
CGTase dengan penggunaan substrat 5 % dan enzim á-amilase 0,5 % pada suhu 60oC selama 60 menit ... 25 Gambar 11. Pola perubahan gula pereduksi pada berbagai tingkat
konsentrasi CGTase dengan penggunaan substrat 5 % dan
enzim á-amilase 0,5 % pada suhu 60oC selama 60 menit ... 26 Gambar 12. Pola perubahan jumlah siklodekstrin pada berbagai tingkat
substrat dengan penambahan á-amilase 0,5 % (v/b) se lama 30 menit dan CGTase 30 unit pada suhu 60oC selama 40 menit ... 27 Gambar 13. Pola perubahan nilai konversi pada berbagai tingkat substrat
dengan penambahan á-amilase 0,5 % (v/b) selama 30 menit dan CGTase 30 unit pada suhu 60oC selama 40 menit ... 28
DAFTAR LAMPIRAN
Halaman
Lampiran 1. Metode analisis ... 33 Lampiran 2. Jumlah pati sisa pada berbagai tingkat á-amilase pada
proses likuifikasi ... 39 Lampiran 3. Nilai konversi pati sisa pada berbagai tingkat á-amilase
pada proses likuifikasi... 40 Lampiran 4. Perolehan siklodekstrin pada berbagai tingkat konsentrasi
enzim CGTase... 41 Lampiran 5. Jumlah total gula pada berbagai tingkat konsentrasi enzim
CGTase ... 42 Lampiran 6. Jumlah gula pereduksi pada berbagai tingkat konsentrasi
enzim CGTase... 43 Lampiran 7. Perolehan siklodekstrin, gula total, gula pereduksi, pati
sisa dan nilai konversi pada berbagai tingkat konsentrasi
PENDAHULUAN
A. LATAR BELAKANG
Indonesia adalah negara agraris yang memiliki sumber daya alam melimpah tetapi baik budidaya maupun pengolahannya belum baik. Garut (Maranta arundinaceae) merupakan salah satu tanaman jenis umbi-umbian yang memiliki potensi besar untuk dikembangkan, baik secara budidaya maupun pengolahannya. Tanaman garut secara agroteknis memiliki kelebihan, misalnya umurnya relatif pendek, perbanyakan bibitnya dapat dilakukan dengan mudah oleh petani, dan dapat ditanam di bawah naungan tegakan di lahan pekarangan atau hutan (Sapuan, 1998). Produksi umbi garut berkisar antara 7 – 47 ton/ha rimpang segar pada umur 8 – 12 bulan (Richana et al., 1998).
Garut (Maranta arundinaceae) memiliki dua jenis kultivar penting, yaitu banana dan creole, yang memiliki perbedaan karakteristik. Kultivar creole memiliki umbi yang lebih panjang dan langsing dengan pertumbuhan umbi yang lebih menyebar dan lebih masuk ke dalam tanah. Kultivar banana memiliki umbi lebih pendek dan gemuk serta pertumbuhan umbi yang terletak lebih dekat pada permukaan tanah dan tidak terlalu dalam sehingga lebih mudah dipanen. Kultivar creole mempunyai umur simpan selama tujuh hari setelah pemanenan, sedangkan kultivar banana hanya bertahan selama dua hari setelah pemanenan (Kay, 1973).
Pada umumnya pati digunakan untuk produk pangan. Penggunaan pati dalam dunia industri, termasuk industri pangan, dibatasi oleh sifat yang dimilikinya. Oleh karena itu perlu dilakukan upaya menghasilkan pati termodifikasi untuk pemanfaatan pati yang lebih luas.
Siklodekstrin merupakan salah satu jenis pati termodifikasi yang dihasilkan secara biokimiawi oleh enzim Cyclodextrin Glicosyl Transferase (CGTase). Siklodekstrin didefinisikan sebagai oligosakarida non reduksi berbentuk siklik yang terdiri dari 6 – 8 monomer glukosa yang dihubungkan
oleh ikatan á-1,4 glikosidik. Siklodekstrin mempunyai sifat yang khas dibandingkan pati termodifikasi lainnya, yaitu memiliki struktur molekul berbentuk torus siklik dengan lapisan luar bersifat hidrofilik dan bagian rongga bersifat hidrofobik, sehingga memiliki kemampuan membentuk senyawa kompleks inklusi. Selain itu, sik lodekstrin juga mampu meningkatkan kelarutan senyawa organik, tahan terhadap kerusakan kimiawi dan biokimiawi serta dapat menstabilkan senyawa flavor. Pemanfaatan siklodekstrin dalam dunia industri cukup luas, di antaranya adalah untuk mengatur pengeluaran flavor, menutup bau dan rasa, meningkatkan kestabilan emulsi, meningkatkan kekuatan pembusaan, mengontrol dan menutupi warna serta melindungi kandungan makanan dari proses oksidasi, reaksi akibat cahaya, dekomposisi panas dan pengurangan kadar air akibat evaporasi.
Pembentukan siklodekstrin dipengaruhi oleh substrat dan enzim CGTase yang digunakan. Whistler (1984) menyatakan bahwa produksi siklodekstrin dipengaruhi oleh jumlah amilosa dalam substrat pati. Penggunaan enzim CGTase dalam konsentrasi tinggi akan mempercepat proses pembentukan siklodekstrin. Kainuma (1992) menyatakan bahwa enzim CGTase stabil pada pH 6,5 – 9 di bawah temperatur 50°C dan memiliki aktivitas optimum pada pH 6,0 – 6,5 dengan temperatur 60°C, sedangkan Laga dan Darwis (2001) melakukan pembentukan siklodek strin dengan menggunakan substrat pati tapioka yang dilarutkan dalam buffer fosfat 0,2 M dengan pH 6,0 yang dioperasikan pada suhu 60°C dengan kecepatan agitasi 200 rpm.
Pada penelitian ini digunakan pati garut kultivar creole sebagai substrat dalam produksi siklodekstrin serta dilakukan pemilihan kondisi operasi (suhu, pH) dan kondisi kimia (konsentrasi substrat dan konsentrasi enzim) untuk menghasilkan siklodekstrin yang terbaik. Dengan demikian, penelitian ini diharapkan dapat mengoptimalkan pemanfaatan pati garut.
B. TUJUAN
Penelitian ini memiliki beberapa tujuan sebagai berikut:
1. Menentukan konsentrasi enzim á-amilase dan lama reaksi terbaik pada proses likuifikasi pati.
2. Menentukan konsentrasi CGTase dan lama reaksi terbaik pada proses pembentukan siklodekstrin.
TINJAUAN PUSTAKA
UMBI GARUT
Tanaman garut merupakan tanaman jenis rumput-rumputan tegak yang termasuk ke dalam kelas Marantaceae, dan species Maranta arundinaceae L (Kay, 1973). Tanaman garut termasuk tanaman setahun dengan ukuran tinggi 60 – 180 cm dengan sistem perakaran yang dangkal dan rhizoma menuju ke dalam tanah. Umbi garut merupakan rhizoma dari tanaman garut. Rhizoma garut atau umbi garut memiliki ukuran panjang antara 20 – 45 cm dan diameter antara 2 – 5 cm. Garut memiliki umbi yang berwarna putih, dilindungi sisik berwarna putih hingga coklat muda yang tersusun secara tumpang tindih. Batang tanaman garut yang berbentuk pelepah membentuk dua barisan dengan sisik yang tidak sama. Tanaman garut diperkirakan berasal dari wilayah Amerika yang beriklim tropis, yaitu Saint Vincent. Saat ini tanaman garut telah tersebar di berbagai negara yang memiliki iklim tropis seperti Brazil, India, Srilangka, Filipina serta Indonesia. Tanaman garut dikenal dengan nama yang berbeda-beda di setiap daerah, seperti arrowroot, West Indian arrowroot, atau St. Vincent arrowroot. Richana et al. (1998) mengatakan bahwa cara bercocok tanam garut tidak sulit, dapat hidup di daerah terlindung dan telah dilakukan pengembangan tanaman garut terutama di bawah tegakan hutan rakyat. Oleh sebab itu tanaman garut cocok digunakan sebagai tanaman tumpang sari dengan tanaman tahunan seperti jati. Tanaman garut memiliki umur tanam yang relatif pendek. Pada umur tanam 10 – 11 bulan tanaman garut sudah dapat dipanen (Kay, 1973).
Kay (1973) menyatakan bahwa umbi garut memiliki dua jenis kultivar penting, yaitu creole dan banana. Kedua jenis kultivar tersebut memiliki umbi yang berwarna putih meskipun karakteristiknya berbeda satu sama lain. Kultivar creole memiliki umbi yang lebih panjang dan langsing dengan pertumbuhan yang lebih menyebar dan masuk ke tanah lebih dalam. Sedangkan kultivar banana mempunyai umbi lebih mudah dipanen. Kultivar
creole memiliki umur simpan hingga tujuh hari setelah pemanenan sedangkan kultivar banana hanya bertahan selama dua hari setelah pemanenan.
Menurut Kay (1973), komposisi zat gizi antara kultivar banana dan creole berbeda. Perbedaan komposisi tersebut ditampilkan pada Tabel 1.
Tabel 1. Komposisi zat gizi dalam umbi garut Umbi Garut Komponen Kultivar banana (gram) Kultivar creole (gram) Karbohidrat : • Pati • Serat • Gula 19,4 0,6 - 21,7 1,3 - Protein 2,2 1,0 Lemak 0,1 0,1 Abu 1,3 1,4 Air 72,0 69,1 Mineral - - Sumber: Kay (1973); PATI GARUT
Pati merupakan salah satu jenis polisakarida yang tersebar dalam organ tanaman sebagai cadangan makanan (Belitz, 1999). Pati terdapat pada tanaman hijau yang disimpan dalam berbagai tempat: biji (sereal), akar dan rimpang (tapioka, kentang), batang (sagu) dan buah-buahan (pisang) yang semuanya digunakan sebagai makanan (Vail, 1978).
Menurut Hodge dan Osman (1976), pati merupakan hasil reaksi antara karbon dari udara dengan air dari dalam tanah pada proses fotosintesis dengan menggunakan energi sinar matahari dalam bentuk bahan organik polisakarida. Sedangkan Kay (1973) mengungkapkan bahwa pati merupakan salah satu
bentuk karbohidrat alami yang paling murni dan memiliki kekentalan yang tinggi.
Pati terdiri dari dua fraksi polisakarida, yaitu amilosa dan amilopektin. Amilosa merupakan rantai lurus dari D-glukosa yang dihubungkan oleh ikatan á-1,4 glikosidik. Pada amilosa akan ditemukan titik percabangan setelah lebih dari 500 unit glukosa yang membentuk rantai lurus (Fennema, 1976). Amilopektin merupakan rantai cabang polimer D-glukosa yang dihubungkan dengan ikatan á-1,6 glikosidik. Pada amilopektin banyak ditemukan titik percabangan karena pada setiap 20 – 25 unit rantai lurus akan membentuk satu titik percabangan (Fennema, 1976). Winarno (1997) menyatakan bahwa pati terdiri dari dua fraksi yang dapat dipisahkan dengan air panas. Fraksi terlarut disebut amilosa dan fraksi tidak larut disebut amilopektin. Amilosa mempunyai struktur lurus dengan ikatan á-(1,4)-D-glukosa, sedangkan amilopektin memiliki titik cabang dengan ikatan á-(1,6)-D-glukosa sebanyak 4 – 5 % dari berat total. Struktur amilosa dan amilopektin ditampilkan pada Gambar 1.
Gambar 1. Struktur amilosa (a) dan amilopektin (b) (Osman, 1972)
Masih menurut Winarno (1997), pati yang berikatan dengan iodin (I2)
akan menghasilkan warna biru. Sifat ini dapat digunakan untuk menganalisis adanya pati. Pati akan merefleksikan warna biru bila berupa polimer glukosa yang lebih besar dari dua puluh, misalnya molekul-molekul amilosa. Bila
polimernya kurang dari dua puluh seperti amilopektin, maka akan dapat dihasilkan warna merah. Perbedaan warna ini dapat dijadikan sebagai dasar dalam penentuan kadar amilosa.
Menurut Winarno (1997), jika suspensi pati dalam air dipanaskan, beberapa perubahan selama terjadinya gelatinisasi dapat diamati. Pada awalnya suspensi pati dalam air berwarna keruh seperti susu. Lama-kelamaan pada suhu tertentu suspensi pati akan berwarna jernih, suhu yang terjadi berbeda-beda untuk setiap jenis pati. Winarno (1997) menjelaskan proses masuknya air ke dalam butiran pati pada proses gelatinisasi disebabkan oleh semakin kuatnya energi kinetik molekul-molekul air dibandingkan dengan daya tarik antar molekul di dalam granula pati. Setelah masuk dalam butiran pati, daya serap air menjadi semakin besar dengan semakin besarnya jumlah gugus hidroksil dalam pati. Hal tersebut akan disertai dengan proses pembengkakan granula pati. Pada proses tersebut diikuti dengan peningkatan viskositas karena air yang pada awalnya berada di luar granula dan bergerak bebas kini berada dalam butiran-butiran pati dan tidak dapat lagi bergerak secara bebas.
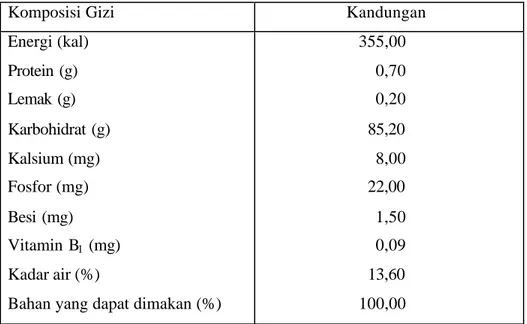
Kawabata et. al (1984) mengungkapkan bahwa pati garut mengandung amilosa sebesar 19,4 % dengan kandungan mineral kalium dalam jumlah yang cukup besar, sedangkan Swinkels (1984) menyatakan kadar amilosa pati garut sebesar 20 % dan amilopektin 80 %. Kandungan pati garut sangat dipengaruhi oleh jenis kultivar, umur panen dan kondisi pertumbuhan tanaman garut. Pada Tabel 2 berikut ini diperlihatkan kandungan gizi dari pati garut.
Tabel 2. Kandungan gizi pati garut (per 100 gram)
Komposisi Gizi Kandungan
Energi (kal) Protein (g) Lemak (g) Karbohidrat (g) Kalsium (mg) Fosfor (mg) Besi (mg) Vitamin B1 (mg) Kadar air (%)
Bahan yang dapat dimakan (%)
355,00 0,70 0,20 85,20 8,00 22,00 1,50 0,09 13,60 100,00 Sumber (Anonim, 1981)
Kay (1973) mengungk apkan bahwa pati garut yang berkualitas komersial di St. Vincent adalah pati garut yang putih dan bersih, dengan kadar air tidak lebih dari 18,5 %, kadar abu dan kadar serat rendah, pH antara 4,5 – 7 serta viskositas maksimum antara 512 – 640 Brabender Unit (BU), sedangkan Brautlecht (1953) menyatakan bahwa pati garut komersial mengandung 80 – 86 % pati, kadar air 12 – 18 % dan bahan pengotor berupa protein dan serat sekitar 2 % dengan ukuran granula relatif besar dan berbentuk oval.
SIKLODEKSTRIN
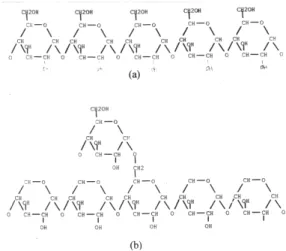
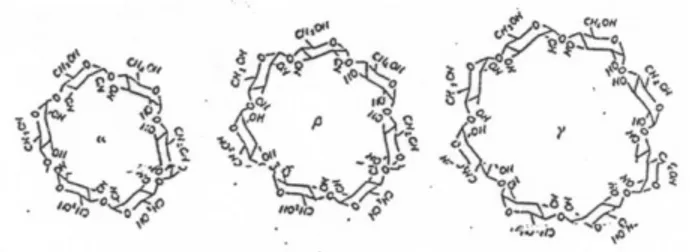
Kainuma (1998) mendefinisikan siklodekstrin sebagai oligosakarida non reduksi berbentuk siklik yang terdiri dari 6, 7 dan 8 monomer glukosa yang dihubungkan dengan ikatan á-1,4 glikosidik. Berdasarkan monomer glukosa yang menyusunnya, siklodekstrin dibedakan menjadi á-siklodekstrin dengan 6 monomer glukosa, ß-siklodekstrin dengan 7 monomer glukosa dan ã–siklodekstrin dengan 8 monomer glukosa (Komiyama, 1984). Kitahata (1988) menyatakan bahwa jenis siklodekstrin diklasifikasikan ke dalam tiga jenis yaitu á-siklodekstrin, ß-siklodekstrin dan ã–siklodekstrin. Ketiga produk tersebut dihasilkan oleh berbagai jenis bakteri. Bacillus macerans adalah
golongan bakteri penghasil enzim yang memproduksi siloheptaamilase (ß-siklodekstrin) sedangkan ã–siklodekstrin dihasilkan oleh Bacillus sp. A16. Struktur molekul dari á, ß dan ã–siklodekstrin dapat dilihat pada Gambar 2.
Gambar 2. Struktur molekul á-siklodekstrin (a), ß-siklodekstrin (b), dan ã–siklodekstrin (c) (Komiyama, 1984).
Komiyama dan Bender (1984) mengatakan bahwa kemampuan rongga
siklodekstrin untuk menampung senyawa lain sangat tergantung pada ukuran
“molekul tamu”. Jika ukuran “molekul tamu” cocok atau lebih kecil dari
rongga siklodekstrin maka molekul tersebut dapat tertampung secara
sempurna. Tetapi jika “molekul tamu” lebih besar dari rongga siklodekstrin
maka interaksi antara siklodekstrin dengan “molekul tamu” menjadi bersifat
parsial dan bersifat lemah. Interaksi siklodekstrin dengan senyawa lain
membentuk keseimbangan dinamik.
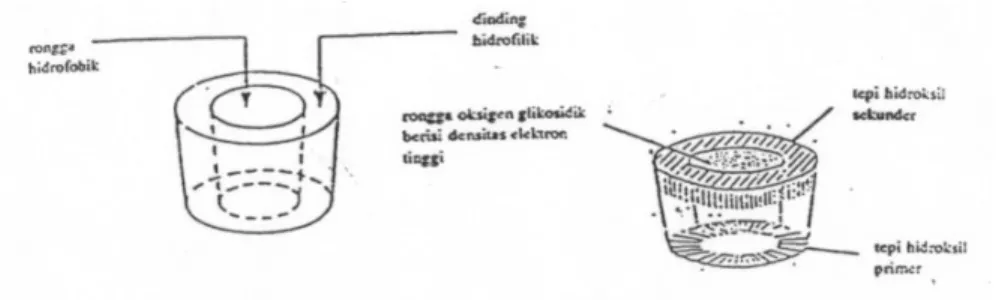
Siklodekstrin memiliki struktur molekul yang siklik berbentuk torus seperti kue donat (Gambar 3). Charoenlap (2004) menyatakan bahwa siklodekstrin memiliki rongga bagian dalam yang bersifat hidrofobik dan permukaan luar yang bersifat hidrofilik. Oleh sebab itu, siklodekstrin dapat mengikat senyawa organik yang bersifat hidrofobik dan dapat membantu kelarutan dalam air.
Gambar 3. Keistimewaan siklodekstrin dengan sifat hidrofobik pada bagian dalam rongga dan hidrofilik pada bagian kulit luar (Komiyama, 1984).
Kim et al. (1997) mengemukakan bahwa siklodekstr in diproduksi dari pati oleh CGTase melalui proses likuifikasi oleh enzim amilase terlebih dahulu. Proses ini dilakukan dengan panas untuk mengoptimalkan kerja enzim dalam reaksi hidrolisis. Pada konsentrasi pati yang tinggi, proses ini akan menjadi sulit dilakukan karena viskositas larutan pati akan meningkat dengan cepat pada saat proses likuifikasi.
ENZIM CGTase (Cyclodextrin Glycos yl Transferase)
Enzim CGTase digolongkan ke dalam enzim transferase (CGTase, EC. 2. 4. 1. 19), berperan dala m sintesis ata u siklisasi dekstrin membentuk siklodekstrin dan mengkatalis pemindahan glikosil sehingga enzim tersebut digolongkan ke dalam enzim transferase (Kitahata, 1988).
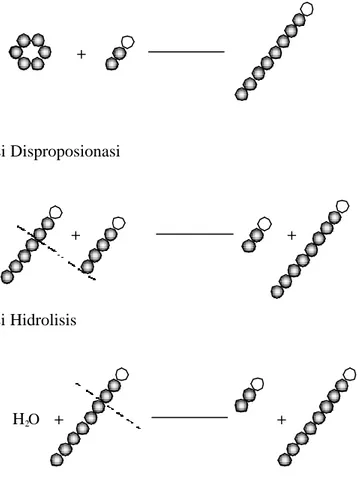
Menurut Kitahata (1988) CGTase dapat mengkata lisis tiga jenis reaksi yaitu :
Transglikosilasi intramolekul
Transglikosilasi intramolekul adalah pemindahan gugus glukosil pada satu molekul di kedua ujung. Pembentukan siklik (siklodekstrin) dari maltooligosakarida rantai lurus untuk jumlah glukosil lebih dari 6 (maltohek sosa. G6) dilakukan proses transglikosilasi intramolekul dengan menggunakan bagian luar dari ikatan á -1,4 glikosida pada gula non pereduksi.
Pati (á, â, ã-) siklodekstrin
Transglikosilasi intermolekuler adalah pemindahan gugus glukosa pada satu molekul dengan molekul yang lain. Mo lekul tersebut dapat sejenis (maltosa dengan maltosa) atau berbeda jenis (maltosa dengan maltotriosa, siklodekstrin dengan maltosa), salah satu molekul berperan sebagai aseptor. Aseptor yang paling efe ktif pada aksi transfer intermolekul oleh CGTase adalah tipe piranisol yang sama konfigurasinya dengan glukopiranosa yaitu yang mempunyai gugus –OH (hidroksil) bebas pada C2 -, C3- dan C4 - seperti sorbose dan sukrosa. Dengan adanya aseptor yang cocok sepert i glukosa atau sukrosa, pada residu glukosil yang ditransfer dari á-1,4-glukan atau dari siklodekstrin ke aseptor melalui reaksi perangkaian (coupling reaction) atau reaksi disproposionasi.
Pati + Sukrosa (sebagai aseptor) Maltooligosil-sukrosa
Reaksi hidrolisis pati
Reaksi hidrolisis pati adalah kemampuan untuk memecah ikatan á-D-1,4-glikosida pada suatu ikatan. Rantai panjang glikosida dilakukan secara acak, CGTase dapat melakukan aktivitas hidrolisis pada pati dan siklodekstrin yang akan menghasilkan hidrolisat berupa beberapa maltooligosakarida.
Pati
Maltooligosakarida Siklodekstrin
Konversi pati menjadi siklodekstrin ter jadi melalui reaksi intramolekular transglikosilasi oleh CGTase dengan cara memotong rantai oligosakarida dan selanjutnya gula pereduksi yang baru ditransfer menjadi gula non pereduksi dari rantai yang sama yang selanjutnya terjadi reaksi siklisasi (Dijkhuizen, 2000). Masih menurut Dijkhuizen (2000), CGTase juga mengkatalisis dua reaksi intermolekular transglikosilasi, yaitu reaksi coupling dan disproposionasi (Gambar 4). a. Reaksi Siklisasi b. Reaksi Coupling + CGTase hidrolisis
c. Reaksi Disproposionasi
d. Reaksi Hidrolisis
Gambar 4. Reaksi katalisis oleh CGTase (Dijkhuizen et al, 2000).
Aktivitas CGTase sangat dipengaruhi oleh pH dan suhu inkubasi. CGTase stabil pada pH 6,0 – 6,5 pada temperatur di bawah 50oC dan aktivitas optimumnya untuk menghasilkan siklodekstrin adalah pada pH 6,0 – 6,5 dengan suhu 60°C (Kainuma, 1984).
ENZIM ALPHA-AMILASE
Enzim alpha amilase dikenal dengan nama “dextrogenic amylase” karena hasil utama dari hidrolisisnya terhadap pati adalah dekstrin (Meyer, 1973). Enzim alpha amilase akan menghidrolisis ikatan á-1,4-D-glikosidik yang terdapat di dalam rantai amilosa dan amilopektin meskipun tidak dapat memecah ikatan á-1,6-D-glikosidik yang terdapat di dalam polimer bercabang (Reilly, 1985).
+
+ +
+
Mekanisme kerja á-amilase dalam pemecahan ikatan á-1,4-D-glikosidik digolongkan dalam tiga pola. Pertama, single chain attack, yaitu dengan cara mendegradasi sebuah molekul polimer sampai selesai sebelum mulai memecah polimer lain. Kedua, multi chain attack, yaitu dengan cara enzim meninggalkan satu polimer setelah berhasil melepaskan satu produk pertama atau menyelesaikan satu serangan hidrolitik dan memecah polimer yang lain. Ketiga, multiple attack, yaitu enzim memecah satu polimer kemudian beberapa kali memecahkan sejumlah produk pertama sebelum memecah polimer lain. Mekanisme kerja á-amilase dapat dilihat pada Gambar 5.
a. Single c hain
b. Multichain atau Single attack
c. Multiple a ttack 7 6 5 4 3 2 1 1 2 1 1 1 0 9 8 1 8 1 7 1 6 1 5 1 4 1 3 1 9 3 2 1 4 3 2 1 1 0 9 8 7 6 5 1 5 1 4 1 3 1 2 1 1
Gambar 5. Mekanisme kerja á-amilase dalam pemecahan ikatan á-1,4-D-glikosidik (Robyt, 1984 Di dalam Whistler).
Umumnya á-amilase memotong ikatan di bagian tengah rantai sehingga menurunkan kemampuan pati mengikat zat warna yodium dan kekentalan larutan pati dengan cepat (Reilly, 1985). Kerja á-amilase pada amilosa berlangsung dalam dua langkah. Pertama, degradasi sempurna dan cepat menjadi maltosa dan maltotriosa. Tahap á-amilolisis ini adalah hasil serangan enzim secara acak. Degradasi ini terjadi dengan cepat yang diikuti dengan penurunan viskositas secara cepat pula. Langkah kedua jauh lebih lambat dari yang pertama dan meliputi hidrolisis oligasakarida dengan pembentukan glukosa dan maltosa yang terjadi secara tidak acak dimulai dari ujung pereduksi (Winarno, 1983). Hidrolisis amilopektin oleh á-amilase menghasilkan glukosa, maltosa dan satu seri á- limit dekstrin, serta oligosakarida dengan empat atau lebih unit glukosa yang semuanya mengandung ikatan á-1,6-D-glikosidik yang tidak dapat dihidrolisis oleh á-amilase (Winarno, 1983).
Alpha -amilase umumnya stabil pada pH antara 5,5 – 9,5 dan aktivitasnya akan meningkat bila ditambahkan kalsium. Aktivitas optimum á-amilase terjadi pada pH antara 5,5 – 6,5 (Reilly, 1985).
III. METODOLOGI PENELITIAN
A. BAHAN DAN ALAT
Pada penelitian ini digunakan pati garut kultivar creole sebagai substrat untuk proses produksi siklodekstrin. Bahan-bahan yang digunakan dalam penelitian produksi siklodekstrin terdiri dari umbi garut yang diperoleh dari Balai Industri Tanaman Tradisional dan Obat (Balitro) Sukabumi, HCl, NaOH, indikator pp, KI, I2, H2SO4, amilosa standar, Na2HPO4, K-tartarat,
aquades, fenol, aseton, buffer fosfat 0,2 M pH 6,0, larutan DNS, enzim á-amilase, dan enzim CGTase yang diperoleh dari NUVO Enzyme Denmark.
Alat-alat yang digunakan adalah erlenmeyer, inkubator goyang, spektrofotometer, neraca analitik, timbangan kasar, oven, pH meter, hot plate, termometer, kertas saring, sentrifuse, stirer dan pengaduk magnetik, desikator, gelas piala, labu ukur, tabung reaksi, pipet, mikropipet, tanur, cawan porselin dan saringan 80 mesh.
B. METODE PENELITIAN
Penelitian ini meliputi dua tahap yaitu penelitian pendahuluan dan penelitian utama.
Penelitian Pendahuluan
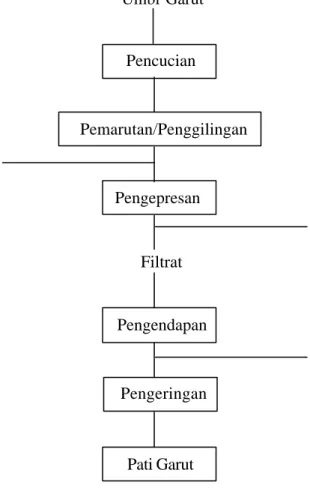
Pada tahap ini dilakukan proses ekstraksi pati garut dari umbi garut kultivar creole dengan metode ekstraksi basah yang selanjutnya dilakukan analisis fisiko kimia. Diagram alir proses ekstraksi pati garut disajikan pada Gambar 6.
Gambar 6. Diagram alir proses ekstraksi pati garut.
Analisis fisiko kimia meliputi analisis proksimat untuk mengetahui kadar air, kadar serat, kadar abu, kadar lemak, kadar protein, kadar pati dan kadar amilosa (AOAC, 1995). Analisis amilograph dilakukan untuk mengetahui titik gelatinisasi awal dan gelatinisasi akhir serta viskositas pati. Prosedur analisis ditampilkan pada Lampiran 1.
Penelitian Utama
Penelitian utama dilakukan untuk proses pembuatan siklodekstrin. Penelitian ini meliputi beberapa tahap, yaitu:
1. Menentukan konsentrasi enzim á-amilase serta lama reaksi terbaik pada proses likuifikasi pati.
Umbi Garut Pencucian Pemarutan/Penggilingan Pengepresan Pengeringan Filtrat Pengendapan Pati Garut Ampas Air Air
Pada tahap ini digunakan pati dengan konsentrasi 5 % (b/v) sebagai substrat yang dilarutkan dalam buffer fosfat 0,2 M pH 6,0. Larutan pati dipanaskan hingga suhu 82,5 – 85oC, di atas suhu gelatinisasi maksimum serta dilakukan agitasi dengan kecepatan 200 rpm. Selanjutnya ditambahkan enzim á-amilase dengan taraf perlakuan 0,1; 0,3; 0,5; 0,75 dan 1,0 % (v/b) atau setara dengan 18,89 unit, 56,68 unit, 94,47 unit, 141,70 unit dan 188,94 unit yang selanjutnya dilakukan pengamatan setiap 15 menit selama 150 menit. Parameter yang diamati adalah kadar pati sisa dengan menggunakan metode iod (Lampiran 1).
2. Menentukan konsentrasi CGTase dan lama reaksi te rbaik pada proses pembentukan siklodekstrin.
Larutan pati dengan konsentrasi 5 % (b/v) ditambahkan enzim á-amilase yang merupakan hasil terbaik dari tahap proses likuifikasi, kemudian ditambahkan enzim CGTase dengan taraf perlakuan 10, 20, 30, 40, dan 50 Unit. Proses ini dilakukan pada suhu 60oC dengan kecepatan agitasi 200 rpm. Pengamatan dilakukan setiap selang 10 menit selama 60 menit. Parameter yang diamati meliputi kadar gula total dan kadar gula pereduksi (Lampiran 1).
3. Menentukan konsentrasi substrat pati terbaik pada pembentukan siklodekstrin.
Larutan pati dengan konsentras i 5, 10, 15 dan 20 % (b/v) dilarutkan dalam buffer fosfat 0,2 M pH 6,0. Terhadap larutan tersebut kemudian dilakukan proses likuifikasi dengan konsentrasi enzim á-amilase dan lama reaksi terbaik, dan selanjutnya ditambahkan enzim CGTase dengan konsentrasi dan lama reaksi terbaik. Proses lik uifikasi dilakukan pada suhu 82,5 – 85oC dan dilanjutkan dengan proses pembentukan siklodekstrin pada suhu 60oC dengan kecepatan agitasi 200 rpm. Selanjutnya dilakukan pengamatan pada akhir reaksi terhadap kadar gula total dan gula pereduksi.
IV. HASIL DAN PEMBAHASAN
A. ANALISIS BAHAN BAKU
1. Ekstraksi Pati
Rendemen pati yang diperoleh dari hasil ekstraksi adalah sebesar 9,81 % (b/b). Kay (1973) menyatakan bahwa umbi garut kultivar creole memiliki kadar pati sebesar 21,7 % (b/b). Rendahnya rendemen pati disebabkan proses pemarutan yang hanya dilakukan satu kali sehingga umbi tidak hancur dengan maksimal. Kadar air dalam umbi segar kultivar creole cukup tinggi yaitu sebesar 69,1 % (b/b). Dengan demikian, bobot terbesar dalam umbi garut adalah air.
2. Analisis Proksimat
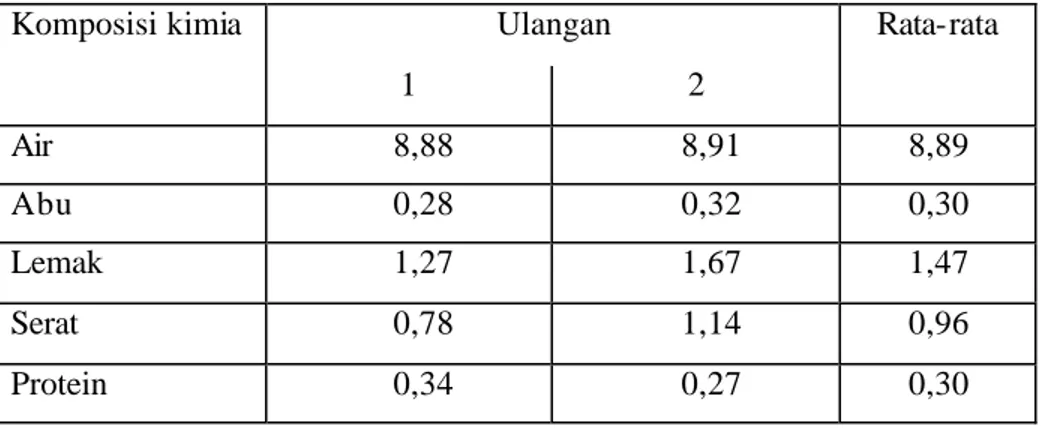
Analisis proksimat yang dilakukan meliputi analisis sifat kimia dan analisis sifat fisik pada pati garut hasil ekstraksi. Analisis kimiawi yang dilakukan meliputi kadar air, kadar abu, kadar serat, kadar lemak, kadar protein, kadar pati dan kadar amilosa. Pati garut kultivar creole memiliki kandungan air 8,89 % sehingga pati yang diperoleh benar-benar kering. Kadar ini cukup jauh berada pada kisaran kadar air yang diperbolehkan pada pati komersial yaitu 18 %. Hasil analisis sifat kimia disajikan pada Tabel 3.
Tabel 3. Hasil analisis komposisi kimia pati garut kultivar creole Ulangan Komposisi kimia 1 2 Rata-rata Air 8,88 8,91 8,89 Abu 0,28 0,32 0,30 Lemak 1,27 1,67 1,47 Serat 0,78 1,14 0,96 Protein 0,34 0,27 0,30
Pati 90,31 90,14 90,22
Amilosa 20,63 22,65 20,64
Pati komersial mensyaratkan kandungan abu dan serat yang rendah meskipun nilainya tidak ditetapkan dengan jelas. Nilai kadar serat yang cukup tinggi sebesar 0,96 % disebabkan pencucian (Gambar 6) yang kurang sempurna pada proses ekstraksi pati sehingga serat terbawa pada endapan pati. Pati garut varietas creole memiliki kadar pati sebesar 90,22 %. Hasil ini lebih besar dibandingkan kadar pati yang diperoleh Richana et. al (1998) sebesar 84,69 %. Kandungan amilosa di dalam pati hasil ekstraksi adalah sebesar 20,64 %, sisanya adalah amilopektin. Hasil ini hampir sama dengan kadar amilosa yang diperoleh Kawabata et. al (1984) yaitu sebesar 19,4 %. Kadar amilosa berpengaruh besar dalam perolehan siklodekstrin karena merupakan bahan dasar reaksi enzimatis dalam produksi siklodekstrin.
Analisis sifat fisik yang dilakukan meliputi derajat putih, suhu gelatinisasi awal dan suhu gelatinisasi akhir serta viskositas pati. Hasil analisis pati garut kultivar creole memiliki nilai derajat putih sebesar 75,06 % BaSO4. Hasil ini lebih rendah dibandingkan hasil penelitian
Richana et. al (1998) sebesar 86,60 % BaSO4.
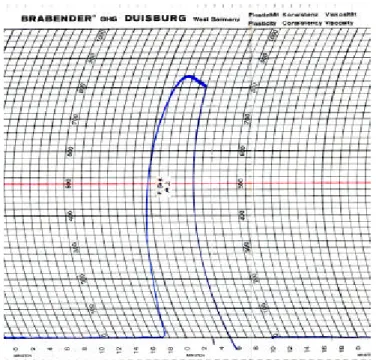
Hasil analisis amilograph pati garut kultivar creole menunjukkan nilai titik gelatinisasi awal 69,5oC dan titik gelatinisasi akhir 82,5oC. Pada selang kondisi tersebut, granula -granula pati mengalami pembengkakan dan pada suhu tertentu granula pati pecah sehingga lebih mudah untuk dihidrolisis.
Viskositas maksimum menunjukkan angka 840 Brabender Unit (BU) di atas viskositas maksimum pati garut komersial, yaitu sebesar 640 BU. Perbedaan nilai ini diduga karena pengaruh jenis kultivar pati garut dan kondisi tempat tanam.
Pati garut yang dihasilkan pada umumnya telah memenuhi persyaratan sebagai pati garut komersial. Pati garut komersial mensyaratkan pati garut harus berwarna putih dan bersih, kandungan pati tidak kurang dari 80 %, kadar abu dan kadar serat rendah, pH antara 4,5 – 7,0, viskositas maksimum antara 512 – 640 BU dan kadar air tidak lebih dari 18 % (Kay, 1973).
Keterangan:
- Garis horizontal (sejajar sumbu x) menunjukkan suhu gelatinisasi (satu kotak setara dengan 2,5oC).
- Garis vertikal (sejajar sumbu y) menunjukkan nilai viskositas (satu kotak setara dengan 20 Brabender Unit).
Gambar 7. Analisis amilograph pati garut kultivar creole.
B. ANALISIS LIKUIFIKASI PATI
Proses likuifikasi pati pada prinsipnya dilakukan dengan me nambahkan enzim á-amilase ke dalam substrat untuk memecah rantai ikatan á-1,4-D-glikosidik dengan tujuan untuk memaksimalkan kerja enzim CGTase dalam proses pembentukan siklodekstrin (siklisasi). Pada proses ini substrat pati dipanaskan sampai suhu 82oC, lebih tinggi dari suhu gelatinisasi maksimum (80oC). Hal ini berbeda dengan likuifikasi asam yang menggunakan kondisi operasi pada suhu 90 – 95oC (Tjokroadikoesoemo, 1986). Perbedaan ini terjadi dikarenakan penyesuaian kondisi optimum enzim yang digunakan selama reaksi berlangsung. Pada kondisi tersebut granula pati terpecah. Sebagai akibatnya terjadi pemisahan fraksi amilosa dan amilopektin sehingga memudahkan reaksi hidrolisis oleh enzim á-amilase. Proses ini ditandai
dengan penurunan kekentalan substrat pati secara cepat. Fenomena yang terjadi adalah larutan yang awalnya berbentuk gel berubah menjadi larutan yang lebih encer.
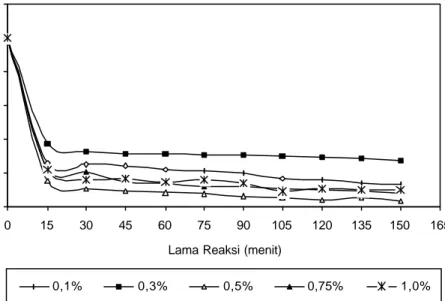
Parameter yang dianalisis adalah kadar pati sisa terhadap penambahan konsentrasi á-amilase dengan perlakuan 0,1; 0,3; 0,5; 0,75 dan 1,0 % (v/b) atau setara dengan 18,89 unit, 56,68 unit, 94,47 unit, 141,70 unit dan 188,94 unit serta lama reaksi dari waktu awal reaksi selama 150 menit dengan pengamatan setiap selang waktu 15 menit. Hasil analisis kadar pati sisa menunjukkan penurunan secara drastis pada 15 menit awal pada semua tingkat konsentrasi enzim á-amilase. Pola perubahan kadar pati sisa pada berbagai tingkat konsentrasi enzim á-amilase ditampilkan pada Gambar 8. Data jumlah pati sisa pada berbagai taraf perlakuan selama proses likuifikasi disajikan pada Lampiran 2, sedangkan nilai konversinya disajikan pada Lampiran 3.
Kadar Pati Sisa
0.00 10.00 20.00 30.00 40.00 50.00 60.00 0 15 30 45 60 75 90 105 120 135 150 165
Lama Reaksi (menit)
Kadar Pati Sisa (g/L)
0,1% 0,3% 0,5% 0,75% 1,0%
Gambar 8. Pola perubahan kadar pati sisa pada berbagai tingkat konsentrasi enzim á-amilase. Konsentrasi substrat pati garut kultivar creole 5 % pada suhu 85oC.
Hasil analisis menunjukkan kadar pati sisa berbagai tingkat konsentrasi enzim á-amilase selama reaksi berada pada kisaran 1,6 – 18,7 g/L dari kadar
pati sisa awal reaksi sebesar 50 g/L. Nilai tertinggi dihasilkan oleh penambahan enzim á-amilase 0,3 % pada 15 menit awal reaksi sedangkan nilai terendah dihasilkan pada menit ke-150 oleh penambahan enzim á-amilase sebesar 0,5 %. Penuruna n kadar pati sisa terjadi selama proses berlangsung sampai akhir reaksi. Penurunan yang sangat drastis terjadi pada 15 menit awal. Hasil analisis menunjukkan bahwa penurunan kadar pati sisa terbesar terjadi pada penambahan á-amilase 0,5 % selama proses berlangsung dengan nilai konversi pada akhir reaksi mencapai 96,6 %. Pada taraf perlakuan tersebut, perubahan nilai konversi pati terbesar terjadi di antara menit ke-15 dan ke-30 yaitu sebesar 4,8 % dari nilai konversi 84,6 % pada 15 menit awal reaksi.
Secara umum hasil analisis likuifikasi pati menunjukkan bahwa peningkatan konsentrasi enzim yang ditambahkan menghasilkan penurunan kadar pati sisa yang lebih besar. Artinya reaksi hidrolisis enzim á-amilase terhadap substrat akan semakin cepat untuk setiap peningkatan konsentrasi enzim á-amilase. Pada penambahan á-amilase 0,3 %, nilai konversi pati sisa terkecil sebesar 62,5 % pada 15 menit awal reaksi dan terbesar pada akhir reaksi sebesar 72,9 %. Pada penambahan á-amilase 0,5 %, nilai konversi pati sisa terkecil ditunjukkan pada menit ke-15 sebesar 84,6 % dan terbesar pada akhir reaksi sebesar 96,6 %. Berdasarkan data hasil analisis dapat disimpulkan bahwa kondisi terbaik untuk proses likuifikasi pati adalah pada penambahan enzim á-amilase sebesar 0,5 % (v/b) dan lama reaksi 30 menit. Pada kondisi tersebut terjadi perubahan penurunan nilai kadar pati sisa terbesar yaitu sebesar 5,26 g/L dari konsentrasi substrat awal sebesar 50 g/L. Hasil ini lebih kecil dibandingkan hasil penelitian Rahadian (2003) sebesar 8,55 g/L dari konsentrasi substrat awal sama yang menggunakan pati garut kultivar banana. Hal ini disebabkan nilai kadar amilosa pati garut kultivar creole sebesar 20,64 % lebih tinggi dibandingkan kultivar banana sebesar 21,07 %. Hidrolisis substrat tapioka pada penelitian Amran (2001) dengan kadar amilosa 23,74 % oleh enzim á-amilase 0,1 % (v/b) pada suhu 75oC selama 30 menit menghasilkan nilai konversi sebesar 80,3 %. Nilai ini lebih besar dibandingkan hidrolisis pati garut kultivar creole oleh enzim dengan
konsentrasi yang sama serta lama reaksi 30 menit yaitu sebesar 75,00 %. Hal ini kemungkinan disebabkan oleh kadar amilosa tapioka sebesar 23,74 % lebih tinggi daripada kadar amilosa pati garut sebesar 20,64 % sehingga lebih banyak pati yang dapat dihidrolisis oleh á-amilase. Hasil pada tahap ini selanjutnya digunakan sebagai dasar untuk tahap proses reaksi pembentukan siklodekstrin.
C. PENENTUAN KONSENTRASI CGTase DAN LAMA REAKSI DALAM PEMBENTUKAN SIKLODEKSTRIN
Perolehan siklodekstrin dapat diketahui dengan cara pengurangan gula total dengan gula pereduksi (Kitahata, 1988). Hal ini menunjukkan bahwa jumlah siklodekstrin dipengaruhi oleh jumlah gula total dan gula pereduksi. Kadar gula total diperoleh melalui analisis dengan menggunakan metode fenol, sedangkan kadar gula pereduksi diperoleh melalui analisis dengan metode DNS (Lampiran 1).
Analisis dengan pendekatan metode Kitahata (1988) menunjukkan bahwa penambahan CGTase mengakibatkan perubahan pada jumlah siklodekstrin yang dihasilkan. Data perolehan siklodekstrin disajikan pada Lampiran 4, sedangkan pola perubahan siklodekstrin disajikan pada Gambar 9. 0 10 20 30 40 50 0 10 20 30 40 50 60 70
Lama Reaksi (menit)
Jumlah Siklodekstrin (g/L)
Gambar 9. Jumlah siklodekstrin pada berbagai tingkat konsentrasi CGTase dengan penggunaan substrat 5 % dan enzim á-amilase 0,5 % pada suhu 60oC selama 60 menit.
Pada akhir inkubasi diperoleh siklodekstrin pada taraf perlakuan 10 IU, 20 IU, 30 IU, 40 IU dan 50 IU masing- masing sebesar 41,8 g/L; 42,7 g/L; 42,8 g/L ;35,6 g/L dan 18,3 g/L. Penambahan CGTase 50 IU sampai akhir inkubasi menunjukkan perolehan siklodekstrin terkecil. Penurunan ini diakibatkan oleh pembentukan hasil samping selama inkubasi yang diakibatkan oleh terjadinya reaksi coupling, yaitu pemecahan rin g (cincin) siklodekstrin dan mengubahnya menjadi maltooligosakarida. Reaksi lain yang terjadi adalah reaksi disproposionasi, yaitu pemecahan maltooligosakarida menjadi maltooligosakarida baru dan gula pereduksi. Dijkhuizen (2000) menyatakan bahwa enzim CGTase tidak hanya dapat memproduksi siklodekstrin tetapi juga dapat mendegradasi siklodekstrin yang terbentuk bila terdapat ko-substrat seperti glukosa, maltosa dan sukrosa. Hal ini mengakibatkan jumlah siklodekstrin yang diproduksi menurun. Sesuai dengan penjelasan Kitahata (1988) bahwa di dalam suatu media dengan sumber karbon adalah fraksi amilosa dan amilopektin (tanpa aseptor), CGTase hanya akan mengkatalisis reaksi pembentukan siklodekstrin (siklisasi) sedangkan jika di dalam media terdapat aseptor seperti maltosa dan maltotriosa maka CGTase akan mengkatalisis transglikosilasi intermolekul maltosa dan maltotriosa membentuk maltooligosakarida dan selanjutnya siklodekstrin diproduksi dari maltooligosakarida. Siklodekstrin yang terbentuk akan mengalami penurunan karena maltosa dan maltotriosa sebagai aseptor menyebabkan siklodekstrin terdekomposisi.
Pada taraf perlakuan 10 – 40 IU terjadi peningkatan perolehan siklodekstrin sampai akhir waktu inkubasi. Peningkatan perolehan siklodekstrin yang terjadi pada taraf perlakuan tersebut dari taraf perlakuan yang terkecil sampai terbesar masing-masing sebesar 10,4 g/L; 11,2 g/L; 11,4 g/L dan 4,1 g/L sedangkan pada taraf perlakuan 50 IU terjadi penurunan sebesar 13,0 g/L.
Perolehan siklodekstrin terbesar pada akhir inkubasi adalah pada taraf perlakuan 30 IU yaitu sebesar 42,8 g/L atau terjadi konversi substrat sebesar 85,7 %, sedangkan perolehan siklodekstrin terkecil yang terjadi pada akhir inkubasi adalah pada taraf perlakuan 50 IU sebesar 18,3 g/L atau terkonversi sebesar 36,7 % atau terjadi penurunan pe rolehan siklodekstrin sebesar 41,5 % dibandingkan perolehan pada awal reaksi (Lampiran 3 ).
Berdasarkan metode Kitahata (1988) bahwa perolehan siklodekstrin dapat diketahui dengan cara pengurangan gula total dengan gula pereduksi, gula total memiliki penga ruh positif terhadap perolehan siklodekstrin. Pada menit ke-0 jumlah gula total adalah sebesar 54,8 g/L. Setelah inkubasi selama 60 menit jumlah gula total pada taraf perlakuan dari yang terkecil hingga terbesar masing- masing sebesar 65,8 g/L; 66,6 g/L; 67,1 g/L; 59,3 g/L dan 42,5 g/L. Data hasil analisis kadar gula total disajikan pada Lampiran 5 sedangkan pola perubahan kadar gula total ditampilkan pada Gambar 10.
0 10 20 30 40 50 60 70 80 0 10 20 30 40 50 60 70
Lama Reaksi (menit)
Jumlah Total Gula (g/L)
10 IU 20 IU 30 IU 40 IU 50 IU
Gambar 10. Pola perubahan total gula pada berbagai tingkat konsentrasi CGTase dengan penggunaan substrat 5 % dan enzim á-amilase 0,5 % pada suhu 60oC selama 60 menit.
Gula pereduksi memiliki pengaruh negatif terhadap pembentukan siklodekstrin. Gula- gula pereduksi ini memiliki rantai kurang dari tujuh gugus
glukosa sehingga tidak dapat terjadi reaksi transglikolisasi intramolekul (siklisasi) membentuk siklodekstrin. Hal ini sesuai dengan pernyataan Kainuma (1998) bahwa siklodekstrin didefinisikan sebagai oligosakarida non reduksi yang berbentuk siklik.
Secara umum nilai kadar gula pereduksi cenderung mengalami peningkatan selama inkubasi. Hal ini terjadi karena pada setiap proses siklisasi, maltodekstin ditransfer menjadi siklodekstrin dan gula pereduksi sehingga peningkatan jumlah siklodekstrin selalu diiringi dengan peningkatan jumlah gula pereduksi. Pada awal inkubasi, nilai kadar gula pereduksi sebesar 23,3 g/L sedangkan pada akhir waktu inkubasi, nilai kadar gula pereduksi pada taraf perlakuan dari yang terkecil hingga terbesar adalah sebesar 23,9 g/L; 23,9 g/L; 24,2 g/L; 23,7 g/L dan 24,1 g/L. Data jumlah gula pereduksi disajikan pada Lampiran 6 sedangkan pola perubahan jumlah gula pereduksi ditampilkan pada Gambar 11.
0 10 20 30 40 50 60 70 80 0 20 40 60 80
Lama Reaksi (menit)
Jumlah Gula Pereduksi (g/L)
10 IU 20 IU 30 IU 40 IU 50 IU
Gambar 11. Pola perubahan gula pereduksi pada berbagai tingkat konsentrasi CGTase dengan penggunaan substrat 5 % dan enzim á-amilase 0,5 % pada suhu 60oC selama 60 menit.
Peningkatan jumlah gula pereduksi diakibatkan terjadinya reaksi disproposionasi, yaitu pemecaha n maltooligosakarida menjadi
sehingga akumulasi gula pereduksi mengakibatkan jumlah gula pereduksi mengalami peningkatan. Menurut Dijkhuizen et al (2000), pada setiap reaksi siklisasi menghasilkan siklodekstrin dan gula pereduksi sehingga akan terjadi peningkatan jumlah gula pereduksi selama proses berlangsung proses pembentukan siklodekstrin.
Berdasarkan data hasil analisis diperoleh konsentrasi enzim CGTase terbaik pada taraf perlakuan 30 IU selama inkubasi 40 menit. Taraf konsentrasi enzim tersebut memiliki perolehan jumlah siklodekstrin terbesar bila dibandingkan taraf perlakuan yang lain selama masa inkubasi yang sama.
D. PENENTUAN KONSENTRASI SUBSTRAT TERBAIK DALAM PRODUKSI SIKLODEKSTRIN
Penentuan konsentrasi substrat terbaik dilakukan dengan empat taraf perlakuan yaitu 5 %, 10 %, 15 % dan 20 % (b/v). Sebelumnya masing- masing taraf diperlakukan proses likuifikasi dilanjutkan proses siklisasi dengan konsentrasi enzim dan lama reaksi terbaik. Substrat yang digunakan pada masing-masing taraf pada awal reaksi adalah sebesar 50 g/L, 100 g/L, 150 g/L dan 200 g/L. Pada akhir reaksi, siklodekstrin yang terbentuk pada taraf terkecil hingga yang terbesar adalah sebesar 42,0 g/L; 59,0 g/L; 85,3 g/L dan 104,2 g/L.
Perbedaan jumlah perolehan siklodekstrin disebabkan oleh peningkatan jumlah gula total yang dihasilkan selama inkubasi. Peningkatan jumlah gula total ini sebanding dengan peningkatan jumlah substrat yang digunakan. Gula pereduksi yang dihasilkan juga sebanding dengan peningkatan substrat. Hal ini dipengaruhi oleh kemampuan enzim yang digunakan selama proses berlangsung. Penggunaan enzim á-amilase sebesar 0,5 % (v/b) telah mampu memecah rantai pati sebesar 89,4 % sedangkan penggunaan enzim CGTase 30 IU telah mampu mengkonversi pati menjadi siklodekstrin sebesar 64,2 %. Data perolehan siklodekstrin pada masing- masing taraf perlakuan disajikan pada Lampiran 7 sedangkan pola perubahannya disajikan pada Gambar 12.
0 20 40 60 80 100 120 0 5 10 15 20 25 Konsentrasi Substrat (% b/v) Jumlah Siklodekstrin (g/L)
Gambar 12. Pola perubahan jumlah siklodekstrin pada berbagai tingkat substrat dengan penambahan 0,5 % (v/b) selama 30 menit dan CGTase 30 unit pada suhu 60oC selama 40 menit.
Nilai konversi siklodekstrin berbanding terbalik dengan pe ningkatan jumlah substrat. Taraf perlakuan dari yang terkecil hingga terbesar menunjukkan nilai konversi sebesar 84,1 %; 59,0 %; 56,8 % dan 52,1 %. Data nilai konversi pada masing-masing taraf perlakuan disajikan pada Lampiran 7 sedangkan pola perubahannya disajikan pada Gambar 13.
0 20 40 60 80 100 0 5 10 15 20 25 Konsentrasi substrat (% b/v) Nilai konversi (%)
Gambar 13. Pola perubahan nilai konversi pada berbagai tingkat substrat dengan penambahan 0,5 % (v/b) selama 30 menit dan CGTase 30 unit pada suhu 60oC selama 40 menit.
Penentuan konsentrasi substrat terbaik dilakukan berdasar pada nilai persen konversi terbesar. Nilai ini ditunjukkan pada taraf perlakuan 5 %
dengan nilai konversi sebesar 84,1 % atau diperoleh siklodekstrin sebesar 42 g/L dari substrat pati awal yang digunakan sebesar 50 g/L. Namun penggunaan substrat konsentrasi 5 % untuk aplikasi dalam dunia industri tidak efisien. Oleh karena itu penggunaan substrat konsentrasi 10 – 15 % lebih baik untuk diaplikasikan dalam dunia industri. Dengan demikian taraf perlakuan 15 % merupakan konsentrasi substrat terbaik dengan nilai konversi sebesar 56,8 %.
V. KESIMPULAN DAN SARAN
A. KESIMPULAN
1. Umbi garut kultivar creole dengan kadar pati sebesar 90,22 % mempunyai potensi yang sangat baik untuk menghasilkan produk siklodekstrin.
2. Kondisi terbaik untuk proses likuifikasi diperoleh pada suhu 82,5 – 85oC dengan penggunaan α-amilase 0,5 % serta lama reaksi 30 menit.
3. Kondisi terbaik untuk proses siklisasi diperoleh pada suhu 60oC dengan penggunaan CGTase 30 IU dan lama reaksi 40 menit serta konsentrasi substrat 15 %.
B. SARAN
1. Pengkajian penggunaan enzim penghidrolisis selain á-amilase pada proses likuifikasi.
2. Pengkajian penggunaan konsentrasi enzim penghidrolisis, enzim CGTase, substrat serta lama reaksi yang lebih besar.
3. Penggunaan analisis HPLC untuk menentukan perolehan siklodekstrin 4. Pengkajian proses pemurnian siklodekstrin.
DAFTAR PUSTAKA
Anonim. 1981. Kandungan Gizi Tepung Garut Di dalam Hutan dan Kebun Sebagai Sumber Pangan Nasional. Departemen Kehutanan Republik Indonesia.
AOAC. 1995. Official Methods of Analysis of the Association of Official Analytical Chemistry. Washington.
Belitz, H.D. dan W. Grosch. 1999. Food Chemistry. Springer. New York.
Brautlecht, C.A. 1953. Starch Its Sources, Production and Uses. Reinhold Publishing Corporation. New York.
Charoenlap, N., S. Dharmsthiti, S. Sirisansaneeyakul dan S. Lertsiri. 2004. Optimization of cyclodextrin production from sago starch. J. Bioresource Technol. 92: 49-54.
Dijkhuizen, L., B.W. Dijkstra, B.A. Van der Veen, J.C. Uitdehag, G.M.V. Alebeek dan L.M. Smith. 2000. Rational design of cyclodextrin glycosyltransferase from bacillus circulans strain 251 to increase á-cyclodextrin production. J. Mol. Biol. 296 : 1027-1038.
Fennema, O.R. 1976. Principle of Food Science. Marcell Dekker Inc., New York.
Hodge, G.E. dan Osman, E.M. 1976. Carbohydrate Di dalam O.R. Fennema (ed.). Food Chemistry. Marcel Dekker Inc, New York.
Kainuma K. 1984. Starch Oligosaccharides: Linear, Branched, and Cyclic Di dalam R.L. Whistler, J.N. BeMiller dan E.F. Paschall. Starch: Chemistry and Technology (2n d ed). Academic Press. Inc. New York
Kawabata, A., S. Sawayana, N. Nagashima dan R.R. del Rosario. 1984. Phsyco Chemical Properties of Starches Crops Postharvest Physiology and Processing Di dalam, B. Haryanto dan P. Pangloli. Potensi dan Pemanfaatan Sagu. Kanisius. Jakarta.
Kay, D. E. 1973. Root Crops. The Tropical Product Institute Foreig n and Common Wealth Office, London.
Kim, T.J., B.C. Kim dan H.S. Lee. 1997. Production of cyclodextrin using raw corn starch without a pretreatment. J. Enzyme Microb Technol. 20: 506-509.
Kitahata, S. 1988. Cyc lomaltodextrin Glucotransferase Di dalam T. Yamamoto dan S. Kitahata (eds.). Handbook of Amylase and Related Enzyme. Their Source, Isolation, Method, Properties, and Applications. Pergamon Press, New York.
Komiyama, M. dan M. L. Bender. 1984. Cyclodextrin as Enzyme Models Di dalam M. I. Page (ed.). The Chemistry of Enzyme Action. Elsevier Science Publisher, New York.
Laga, A dan A.A. Darwis. 2001. Produksi Siklodekstrin dengan Minimalisasi Aseptor pada Substrat Pati Tapioka Terlikuifikasi. Thesis Pasca Sarjana Teknologi Industri Pertanian. FATETA-IPB. Bogor.
Meyer, L.H. 1982. Food Chemistry (4t h ed). The AVI Publishing Company, Inc. Westport, Connecticut.
Osman, E.M. 1972. Starch and Others Polysaccaharides Di dalam Paul, P.J. dan Polmer (eds). Food Theory and Applications. John Wiley and Sons. Inc. New York.
Reilly, P.J. 1985. Enzymaic Degradation of Starch Di dalam G.M.A. van Beynum dan J.A. Roels (eds). Starch Conversion Te chnology. Marcel Dekker Inc, New York.
Rahadian, D. 2003. Pemanfaatan Pati Garut Kultivar Banana Sebagai Substrat dalam Proses Produksi Siklodekstrin. Skripsi. Fakultas Teknologi Pertanian. Institut Pertanian Bogor. Bogor.
Richana, N., P. Lestari, N. Chilmijati dan S. Widowati. 1998. Karakterisasi Bahan Berpati (Tapioka, Garut dan Sagu) dan Pema nfaatannya Menjadi Glukosa Cair. Balai Pasca Panen. Bogor.
Robyt, J.F. 1984. Enzymes in the Hydrolysis and Synthesis of Starch Di dalam R.L. Whistler, J.N. BeMiller dan E.F. Paschall (eds). Starch: Chemistry and Technology (2n d ed). Academic Press. Inc, New York.
Sapuan. 1998. Pengembangan Tepung Alternatif dan Potensi Pasarnya Di dalam Ekoyanto Pudjiono. 1998. Pengembangan Mesin Pengolahan Garut. Makalah Semiloka Agroindustri Kerakyatan BPPT Jakarta. Jakarta.
Swinkels, J.J.M. 1985. Sources of Starch, Its Chemistry and Physics Di dalam G.M.A. van Beynum dan J.A. Roels (eds). Starch Conversion Technology. Marcel Dekker Inc, New York.
Tjokroadikoesoemo, P.S. 1986. HFS dan Industri Ubi Kayu Lainnya. PT. Gramedia. Jakarta
Vail, G.E., J.A. Phillips, L.O. Rust, R. M. Griswold dan M.M. Justin. 1978. Foods (7t h ed). Houghton Mifflin Company, Boston.
Whistler, R.L., J.N. BeMiller dan E.F. Paschall. 1984. Starch: Chemistry and Technology (2n d ed). Academic Press. Inc , New York.
Winarno, F. G. 1983. Enzim Pangan. PT. Gramedia. Jakarta.
Winarno, F. G. 1997. Kimia Pangan dan Gizi. PT. Gramedia Pustaka Utama, Jakarta.
Lampiran 1. Metode Analisis
1. Kadar Air (AOAC, 1995)
Pengukuran kadar air dilakukan dengan metode oven. Sampel sebanyak 2 – 10 gram ditimbang dalam cawan kosong yang telah d itimbang dan diketahui bobotnya. Selanjutnya sampel dikeringkan dalam oven dengan suhu 105oC selama 5 jam. Kemudian sampel didinginkan dalam desikator. Setelah dingin, sampel ditimbang sampai mencapai bobot yang konstan.
Kadar air diperoleh dari perhitunga n sebagai berikut:
Kadar air (%) = − a b a x 100 %
Keterangan : a = bobot awal sampel (gram) b = bobot akhir sampel (gram)
2. Kadar Abu (AOAC,1995)
Sampel sebanyak 2 gram ditempatkan ke dalam cawan porselin yang telah diketahui bobotnya. Sela njutnya sampel dimasukkan ke dalam tanur yang bersuhu 600oC. Proses pengeringan dilakukan selama 2 jam, kemudian sampel didinginkan dalam desikator. Setelah dingin sampel ditimbang hingga mencapai bobot konstan.
Kadar abu diperoleh dari perhitungan sebagai berikut:
Kadar abu (%) = a b x 100 % Keterangan: a = bobot awal sampel
b = bobot akhir sampel
3. Kadar Serat Kasar
Sebanyak 1 gram contoh ditimbang dengan teliti, kemudian ditambahkan 50 ml asam sulfat 0,325 N dan dididihkan selama 30 menit di dalam gelas piala. Ke dalam gelas tersebut ditambahkan 25 ml NaOH 1,25 N dan dididihkan selama 30 menit.
Kertas saring whatman No. 41 dikeringkan dalam oven pada suhu 105oC, kemudian didinginkan dan selanjutnya ditimbang. Campuran yang telah didid ihkan disaring dengan kertas saring whatman No. 41 dalam corong Buchner. Selanjutnya serat dicuci berturut-turut dengan menggunakan 50 ml air panas, 50 ml H2SO4, 50 ml air panas dan terakhir 25 ml aceton.
Kertas saring bersama seratnya dikeringkan dalam oven pada suhu 105oC selama 1 – 2 jam sampai bobotnya tetap.
Kadar serat kasar diperoleh dari perhitungan sebagai berikut:
Kadar Serat Kasar =
BobotAwal BobotAkhir
x 100%
4. Kadar Lemak
Penetapan kadar lemak dilakukan dengan menggunakan alat sokhlet. Labu lemak yang akan digunakan terlebih dahulu dikeringkan dalam oven bersuhu 105oC selama 1 jam. Kemudian ditimbang hingga bobot labu lemak konstan (A).
Sampel dengan bobot 2 gram yang telah dibungkus dalam kertas saring berbentuk seperti tabung dimasukkan dalam tabung sokhlet. Labu lemak yang telah kering dihubungkan dengan labu sokhlet. Selanjutnya ditambahkan pelarut heksan sebanyak 100 ml ke dalam labu soxhlet. Alat sokhlet kemudian disambungkan dengan alat pendingin. Sampel diekstraksi selama 6 jam dalam waterbath. Setelah 6 jam sampel dalam labu sokhlet dikeluarkan. Pelarut heksan yang tertampung dalam labu lemak kemudian dipekatkan. Selanjutnya labu lemak dikeringkan dalam oven pada suhu 105oC selama 5 jam. Setelah dingin, labu lemak ditimbang hingga mencapai bobot kanstan (B).
Nilai kadar lemak diperoleh dari perhitungan sebagai berikut:
Kadar Lemak = h bobotconto A B− x 100% 5. Kadar Pati
Prinsip: Sampel dihidrolisis berulang-ulang dengan menggunakan alkohol 80 % di dalam waterbath. Kemudian endapan dipisahkan dari
larutannya. Endapan dihidrolisis kembali dengan menggunakan HClO4 9,2 N
secara berulang- ulang. Selanjutnya dinetralkan dengan menggunakan NaOH 1 N. Setelah itu sampel direduksi dengan pereaksi Cu dan pereaksi nelson. Sampel diukur kadar pati dengan menggunakan spektrofotometer pada panjang gelombang 500 nm.
Sampel yang telah dihaluskan sebanyak 2 gram dimasukkan ke dalam tabung sentrifuse/erlenmeyer kemudian ditambahkan 20 ml alkohol 80 %. Selanjutnya dipanaskan dalam waterbath pada suhu 100oC selama 15 menit. Larutan sampel dipisahkan dari endapan. Endapan ini yang akan digunakan untuk pengujian kadar pati sedangkan larutan digunakan untuk analisa gula.
Endapan dala m tabung sentrifuse dikeringkan kemudian ditambahkan 2 ml aquades dan dipanaskan kembali selama 3 menit. Kemudian ditambahkan 2 ml HClO4 9,2 N dan panaskan kembali selama 15 menit.
Tambahkan 25 ml aquades ke dalam sampel. Kemudian tambahkan lagi 2 ml HClO4 dan dipanaskan kembali selama 15 menit. Proses ini dilakukan
sekurang-kurangnya tiga kali. Setelah hidrolisis oleh HClO4 selesai, sampel
disaring dalam labu ukur 100 ml. Tepatkan volume labu ukur dengan aquades hingga tera. Larutan sampel dikocok-kocok hingga merata.
Sebanyak 2 ml larutan sampel dimasukkan dalam tabung reaksi 25 ml. Kemudian ditambahkan pereaksi phenol red sebanyak satu tetes sehingga sampel berwarna merah jambu. Netralkan kembali dengan menggunakan NaOH 1 N. Kemudian ke dalam sampel ditambahkan pereaksi Cu sebanyak 2 ml hingga menimbulkan warna ungu. Selanjutnya sampel dipanaskan dalam waterbath selama 10 menit hingga berwarna merah tua. Sampel didinginkan selama 10 menit kemudian ditambahkan lagi pereaksi nelson sebanyak 2 ml hingga sampel berwarna biru tua. Cukupkan volume labu ukur hingga tepat 25 ml dengan aquades. Selanjutnya sampel diukur absorbansinya dengan menggunakan spektrofotometer pada panjang gelombang 500 nm.
Standar pati dilakukan dengan menggunakan pati standar pada konsentrasi 0, 5, 10, 15, 20 dan 25 ppm.
Kadar pati diperoleh dengan perhitungan sebagai berikut: Kadar Pati = − 000 . 000 . 1 .. 100 tan ..
..ppm s dar x bobot contoh x pengenceran rata
rata
Abscontoh
x 100 %
6. Kadar Amilosa
Sampel dihidrolisis dengan menggunakan etanol dan NaOH 1 N sehingga terbentuk amilum. Kemudian direaksikan dengan pereaksi KI dan I2
dan asam asetat sehingga dihasilkan yod amilum. Kadar amilosa diukur dengan menggunakan spektrofotometer pada panjang gelombang 620 nm. Sampel sebanyak 0,1 gram dimasukkan ke dalam labu ukur 100 ml. Kemudian ditambahkan 1 ml etanol absolut dan 9 ml NaOH 1 N. Sampel dikocok secara perlahan kemudian dibiarkan selama 24 jam.
Cukupkan sampel hingga tepat 100 ml menggunakan aquades. Kocok sampel hingga merata. Sebanyak 5 ml sampel dipipet ke dalam labu ukur 50 ml. Standar amilosa dibuat dengan konsentrasi 0, 10, 20, 30, 40 dan 50 ppm. Sebanyak 1 ml CH3COOH 1 N ditambahkan ke dalam contoh
kemudian ditambahkan lagi 2 ml pereaksi KI dan I2. Kemudian tepatkan
hingga tanda tera dan diamkan selama 30 menit. Selanjutnya sampel diukur absorbansinya dengan alat spektrofotometer pada panjang gelombang 620 nm.
Kadar amilosa diperoleh dengan perhitungan sebagai berikut:
Kadar Amilosa = − − 000 . 000 . 1 .. 100 tan .
..ppms dar x bobotcontoh x pengenceran rata
rata
rata AbsRata
x 100 %
7. Kadar Pati Sisa Metode Iod (AOAC, 1995)
Hidrolisat terdiri dari komponen gula sederhana dan molekul pati. Prinsip analisis ini, komponen hidrolisat dengan panjang rantai 12 unit glukosa tidak memberikan warna bila bereaksi dengan senyawa iod. Komponen pati dalam hidrolisat akan berwarna ungu merah-biru bila bereak si dengan senyawa iod. Intensitas warna biru akan berbeda tergantung dari kadar pati dalam hidrolisat.
Cara kerja:
Buat kurva standar dengan menggunakan Soluble starch pada kisaran 0,01 – 0,1 persen. Pipet masing- masing 1 ml ke dalam tabung reaksi, panaskan hingga suhu 80oC (pati menjadi larut) setelah didinginkan tambahkan 0,1 ml larutan iod (0,2 g iod dan 2 g KI dalam 100 ml air), kemudian tambahkan aquades masing- masing 3 ml. Selanjutnya ukur intensitas warnanya pada spektrofotometer dengan panjang gelombang 610 nm.
Penetapan contoh dilakukan dengan mengambil contoh 1 ml yang telah diencerkan, panaskan hingga suhu 80oC (di atas titik gelatinisasi maksimum), dinginkan lalu tambahkan dengan larutan iod 0.1 ml kemudian tambahkan aquades 3 ml. Ukur intensitas warnanya pada spektrofotometer dengan panjang gelombang 610 nm. Data yang diperoleh diplotkan pada kurva standar.
8. Total Gula Metode Fenol (Apriyantono et al., 1989) a. Pembuatan kurva standar
Dipipet sebanyak 2 ml larutan glukosa standar yang mengandung 0, 10, 20, 30, 40, dan 50 µL glukosa masing- masing dimasukkan ke dalam tabung reaksi. Larutan fenol 5 persen sebanyak 1 ml ditambahkan dalam tabung tersebut dan dikocok. Larutan asam sulfat pekat sebanyak 5 ml dengan cepat ditambahkan secara tegak lurus ke permukaan larutan. Dibiarkan selama 10 menit, dikocok lalu ditempatkan dalam penangas air selama 15 menit. Absorbansinya diukur pada panjang gelombang 490 nm dan dibuat kurva standarnya.
b. Penetapan contoh
Untuk menetapkan total gula, contoh disiapkan terlebih dahulu dengan penambahan Pb asetat diikat dengan Na-fosfat 8 % sehingga terjadi endapan. Larutan bening yang dihasilkan kemudian disaring dan siap digunakan untuk analisis. Prosedur pengukuran total gula pada contoh dilakukan sama seperti pembuatan kurva standar. Hasil yang didapat dibandingkan dengan kurva standar.
y = 0,0118x + 0,1095 R2 = 0,9787 0 0,1 0,2 0,3 0,4 0,5 0,6 0,7 0,8 0 10 20 30 40 50 60 Konsentrasi (ppm) Absorbansi
Gula Total Linear (Gula Total)
9. Gula Pereduksi Metode DNS a. Pembuatan kurva standar
Dipipet sebanyak 1 ml larutan glukosa standar yang mengandung 0, 10, 20, 30, 40 dan 50 µL glukosa masing- masing dimasukkan ke dalam tab ung reaksi. Larutan DNS sebanyak 3 ml ditambahkan dalam tabung reaksi tersebut dan dikocok. Masukkan ke dalam air mendidih selama 5 menit, angkat dan dinginkan. Absorbansinya diukur pada panjang gelombang 550 nm dan dibuat kurva standarnya.
b. Penetapan contoh
Sebanyak 1 ml larutan contoh diambil dan dimasukkan ke dalam tabung reaksi. Larutan DNS sebanyak 3 ml ditambahkan ke dalam tabung reaksi kemudian dikocok-kocok. Larutan contoh kemudian dipanaskan dalam air mendidih selama 5 menit, angkat dan dinginkan. Setelah dingin, larutan contoh diukur absorbansinya pada panjang gelombang 550 nm.