i ANALISA Salmonella Sp PADA PRODUK TUNA (Thunnus Sp) LOIN
TUGAS AKHIR
IRWAN MUSTAAN 1422030368
TEKNOLOGI PENGOLAHAN HASIL PERIKANAN
POLITEKNIK PERTANIAN NEGERI PANGKAJENE DAN KEPULAUAN 2017
iv RINGKASAN
Irwan mustaan 1422030368 Analisis Bakteri Salmonella Sp Pada Produk Tuna (Thunnus Sp) Loin Dibimbing Oleh Fifi Arfini, dan Zulfitriyani.
Penanganan pasca panen di Indonesia saat ini masih sangat memprihatinkan dari segi keamanannya termasuk proses penanganan ikan pasca mortem. Kurangnya pengetahuan tetang penanganan ikan setelah ditangkap mengakibatkan ikan yang sampai ke tangan penjual terakhir sebelum konsumen,mutunya sudah menurun, mengandung cemaran kimia, fisik,maupun mikrobiologi. Diantara ketiga cemaran ini yang paling memprihatinkan adalah cemaran mikrobiologi. Cemaran mikrobiologi dapat menyebabkan berbagai potensi sakit dikarenakan bakteri pencemar adalah bakteri patogen / sebagai kontaminan dimana asal bakteri ini bukan dari produk ikan itu sendiri tapi dari lingkungan yang terkontaminasi ke produk.
Tujuan penulisan tugas akhir ini untuk mengidentifikasi bakteri Salmonella Sp pada daging ikan Tuna (Thunnus Sp) Loin, sehingga produk tersebut dinyatakan aman untuk dikonsumsi dan memenuhi persyaratan untuk ekspor.
Penyusunan tugas akhir ini menggunakan metode praktek langsung dan hasil wawancara pihak yang terkait di laboratorium balai karantina ikan pengendalian mutu dan keamanan hasil perikanan kelas II manado.
Prinsip pengujian Salmonella Sp dimulai dari tahap prapengkayaan, pengkayaan, tahap media selektif agar yang digunakan sesuai SNI antara lain Bhismut Sulfit Agar (BSA), Xylase Lysine Desoxycholate (XLD) dan Hektoen Enteric (HE).
Hasil pengujian dari beberapa produk hasil perikanan khususnya produk tuna (Thunnus Sp) loin dinyatakan negatif mengandung bakteri Salmonella dan memenuhi syarat untuk konsumsi dan eksfor.
v KATA PENGANTAR
Puji syukur kita panjatkan kehadirat Allah SWT karena atas limpahan rahmat, taufik, serta hidayah-Nya sehingga penulis dapat menyelsaikan tugas akhir ini yang berjudul “ Analisa Bakteri Salmonella Sp Pada Produk Tuna (Tunnus Sp)” Loindengan baik dan tepat waktu.
Penyusun laporan ini tidak lepas dari bantuan berbagai pihak. Oleh karena itu penulis mengucapkan terima kasih kepada :
1. Kedua orang tua Tercinta ayahanda (Mustaan) ibunda (Sareah) saudara (erwin mustaan, ikhwan mustaan, Muhammad Khaikal) serta seluruh keluarga yang selalu memberi semangat, motivasi, dan Doa.
2. Bapak Dr.Ir.H.Darmawan,M.P. Selaku direktur Politeknik Pertanian Negeri Pangkajene Dan Kepulauan.
3. Ibu Ir.Nurlaeli Fattah,M.Si. Selaku Ketua Jurusan Teknologi Pengolahan Hasil Perikanan.
4. Terimakasih dan penghargaan setinggi-tingginya penulis sampaikan kepada ibu Fifi Arfini,S.TP.M.Si selaku Pembimbing I dan Ibu Zulfitriyani DM,SP,MP selaku pembimbing II yang telah memberikan bimbingan dan arahan dalam melaksanakan Pengalaman Kerja Praktek Mahasiswa (PKPM) serta dalam penyusunan laporan ini.
5. Terima kasih yang sebesar-besarnya kepada ibu Jane Sumarauw selaku pembimbing lapangan yang telah memberikan bimbingan serta arahan mengenai pengujian.
6. Kepada teman-teman seperjuangan dan satu kos (erwin, umar, Muh. Ardi, Abdullah halik) yang selalu ada untuk memberikan motivasi.
Penulis menyadari bahwa dalam penulisan laporan ini masih jauh dari kata sempurna, karena manusia tidak lepas dari yang namanya kekurangan, khilaf dan kesalahan. Semoga laporan ini bermanfaat bagi saya pribadi dan bagi semua pembaca.
Pangkep Juli 2017
vi DAFTAR ISI
Halaman
HALAMAN PENGESAHAN ... i
HALAMAN PERSETUJUAN PENGUJI ... .. ii
RINGKASAN ... iii
KATA PENGANTAR ... iv
DAFTAR ISI ... v
DAFAR TABEL ... vii
DAFTAR GAMBAR ... viii
DAFTAR LAMPIRAN ... ix
I. PENDAHULUAN 1.1 Latar Belakang ... 1
1.2 Manfaat dan Tujuan ... 3
II. TINJAUAN PUSTAKA 2.1 Deskrifsi Ikan Tuna (Thunnus Sp) ...4
2.2 Komposisi Nilai Gizi Ika Tuna ... 5
2.3 Kemunduran Mutu Ikan Tuna ... 5
2.3.1. Kemunduran Mutu Secara Kimiawi ... 5
2.3.2. Kemunduran Mutu Secara Autolisis ...,... 6
2.3.3. Kemunduran Mutu Secara Oksidasi ... 6
2.3.4. Kemunduran Mutu Secara Fisik ... 7
2.3.5. Kemunduran Mutu Secara Bakteriologis ... 8
2.4. Salmonella Sp ... 8 2.5. Morfologi ... 9 2.6. Sifat Biokimia ... 10 2.7. Kontaminasi ... 11 2.8. Salmonellosis ... 12 2.9. Penularan ... 12 2.10. Patogenis ... 12 2.11. Media Pengujian ... 13
vii III. METODOLOGI
3.1 Waktu dan Tempat ... 15
3.2 Metode Pelaksanaan ... 15
3.3 Metode Pengumpulan Data ... 15
3.4 Alat dan Bahan ... 15
3.5 Prosedur Kerja ...17
IV. HASIL DAN PEMBAHASAN 4.1 Hasil ... 25
4.2 Pembahasan ... 25
V. KESIMPULAN DAN SARAN 5.1 Kesimpulan ... 28
5.2 Saran ... 28 DAFTAR PUSTAKA
LAMPIRAN
viii DAFTAR TABEL
No. Halaman
1. Komposisisi Nilai Gizi Beberapa Jenis Ikan Tuna... 5
2. Karakteristik Biokimia Salmonella Sp ... 11
3. Reaksi Kimia Salmonella Sp Pada TSIA Dan LIA ... 20
4. Reaksi Biokimia Dan Serologi Untuk Salmonella Sp... 24
ix DAFTAR GAMBAR
No. Halaman
1. Gambar Ikan Tuna ... 4 2. Gambar Salmonella Sp ... 10
x DAFTAR LAMPIRAN
No. Halaman
1. Skema Pengujian Salmonella Sp ... 31 2. Gambar Alur Proses Pengujian Salmonella Sp... 32
1 1. PENDAHULUAN
I.1. Latar Belakang
Indonesia memiliki banyak wilayah laut, pesisir dan pulau-pulau kecil yang strategis sebagai pilar pembangunan ekonomi sosial. Khusus untuk perikanan tangkap potensi indonesia sangat melimpah sehingga diharapkan menjadi sektor unggulan perekonomian nasional. Peningkatan jumlah hasil tangkapan perikanan, harus juga didukung dengan penangan yang baik terhadap hasil tangkapan tersebut. Ikan merupakan salah satu bahan makanan yang mudah membusuk sehingga dibutuhkan penanganan atau perlakuan yang tepat agar mutunya tidak menurun.
Penanganan pasca panen di indonesia saat ini masih sangat memprihatinkan dari segi keamanannya termasuk proses penanganan ikan pasca mortem. Kurangnya pengetahuan tetang penanganan ikan setelah ditangkap mengakibatkan ikan yang sampai ke tangan penjual terakhir sebelum konsumen,mutunya sudah menurun, mengandung cemaran kimia,fisik,maupun mikrobiologi. Diantara ketiga cemaran ini yang paling memprihatinkan adalah cemaran mikrobiologi. Adanya cemaran mikrobiologi pada produk perikanan, mengidentifikasikan terjadinya penurunanan mutu produk perikanan. Banyak faktor yang bisa menjadi penyebabnya seperti kondisi peralatan, kondisi penyimpanan, proses penanganan, kemasan serta bahan lainnya yang terkontak langsung dengan produk tidak dalam kondisi yang bersih sehingga terjadi kontaminasi. Cemaran mikrobiologi dapat menyebabkan berbagai potensi sakit dikarenakan bakteri pencemar adalah bakteri patogen / sebagai kontaminan dimana asal bakteri ini bukan dari produk ikan itu sendiri tapi dari lingkungan yang terkontaminasi ke produk.
Jenis bakteri patogen sebagai kontaminan pada produk perikanan segar yaitu Salmonella, Shigella, E.coli, Vibrio parahaemolyticus, V.cholera, Clostridium perfringens, Clostridium botulinum, Listeria monocitigenes, Staphylococus aureus, dll.
Salah satu bakteri patogen yang sangat mengkhawatirkan adalah Salmonella. Berdasarkan habitat utamanya Salmonellahidup pada saluran
2 pencernaan manusia dan hewan, sehingga ketika bakteri tersebut bisa ditemukan pada produk perikanan baik olahan maupun ikansegar hal ini menggambarkan bahwa prosedur pengolahan/ teknik penanganan produk tersebut tidak dilakukan dengan benar. Beberapa negara sepertiTaiwan (Chio dan Chen, 1981), India (Varmaet al, 1985), Sri Lanka (Fonseka, 1990), Thailand (Rattagool et al, 1990) termasuk Indonesia (Sunarya et al, 1990), beberapa negara Eropa dan Amerika produk perikanannya bermasalah karena terkontaminasi bakteri Salmonella. Bagi Indonesia secara umum dan unit-unit pengolahan produk perikanan secara khusus dampak yang ditimbulkan akibat kejadian tersebut sangatlah besar. Beberapa negara konsumen menolak masuknya produk perikanan dari indonesia ke negara mereka.
Beberapa produk perikanan khsusnya Daging Tuna (Thunnus sp) Loin,besar kemunngkinan mengandung bakteri Salmonella sp sehingga sebelum di eksporikan terlebih dahulu dilakukan pemeriksaan bakteri Salmonella sp. Pegujian bakteri Salmonella sp sangat rutin dilakukan di Labratorium Balai Karantina Ikan Pengendalian Mutu dan Kemanan Hasil Perikanan Kelas II Manado.
3 I.2. Tujuan dan Manfaat
1.2.1. Tujuan
Tujuan penulisan tugas akhir adalah untuk menganalisis dan mengidentifikasi Salmonella sp pada produk Tuna (Thunnus sp) loin.
1.2.2. Manfaat
Manfaat dari penulisan tugas akhir ini, untuk mengetahui secara lansung
proses pengujian Salmonella Sp pada produk Tuna ((Thunnus sp) loin dan sebagai
refrensi dan informasi mengenai keterampilan dalam pengujian Salmonella sp.
Serta dapat meningkatkan kompetensi baik keterampilan, wawasan dan etos kerja
4 II. TINJAUAN PUSTAKA
2.1. Deskrifsi Ikan Tuna (Thunnus sp)
Ikan tuna adalalah ikan laut yang termasuk dalam keluarga scomroidae, dengan ciri –ciri tubuh yang seperti cerutu, mempunyai dua sirip punggung, sirip depan yang biasanya pendek dan terpisah dari sirip belakang. Mempunyai jari-jari sirip tambahan (finlet)di belakang sirip punggung dan sirip dubur. Sirip dada terletak agak ke atas, sirip perut kecil, sirip ekor bercagak agak kedalam dengan jari-jari penyokong menutup seluruh ujung hipural.Tubuh ikan tuna tertutup oleh sisik-sisik kecil, berwarna biru tua dan agak gelap pada bagian atas tubuhnya, sebagian besar memiliki sirip tambahan yang berwarna kuning cerah dengan pinggiran berwarna gelap (Satrio,2008).
Gambar 1. Ikan Tuna(Thunnus sp)
Klasifikasi ikan Tuna (Thunnus sp) menurut satriani, (2007) adalah sebagai berikut:
Phylum : Chardata Sub phylum : Vetabrata Class : Teostei Famili : Scombridae Sub class : Actinopterygii Ordo : Percomopphi Sub Ordo : Scombroldea Genus : Thunnus sp Spesies : Thunnus sp
5 2.2. Komposisi Nilai Gizi Ikan Tuna
Ikan tuna adalah jenis ikan dengan kandungan protein tinggi dan lemak yang rendah. Ikan tuna mengandung protein 22,6-27,9%. Komponen yang paling banyak terdapat dalam daging ikan adalah air, protein dan lemak, sedangkan lainnya terdapat dalam jumlah yang sedikit (Hadiwiyoto 1993). Komposisi nilai gizi beberapa jenis ikan tuna dapat dilihat pada Tabel 1.
Tabel 1. Komposisi nilai gizi beberapa jenis ikan tuna per 100 g daging.
Komposisi
Jenis Ikan
Tuna Satuan
Bluefin Skipjack Yellowfin
Energi 121,00 131,00 105,00 Kal Protein 22,60 26,20 24,10 g Lemak 2,70 2,10 0,20 g Abu 1,20 1,30 1,20 g Kalsium 8,00 8,00 9,00 Mg Posfor 190,00 220,00 220,00 Mg Besi 2,70 4,00 1,10 Mg Sodium 90,00 52,00 78,00 Mg Kibovlavin 0,06 0,15 0,10 Mg Niasin 10,00 18,00 12,00 Mg
Sumber: Departemen Of Health Educetion And Welfare (1972)
2.3. Kemunduran Mutu Ikan Tuna
Ikan tuna yang mati setelah ditangkap akan mengalami serangkaian perubahan yang mengarah pada proses penurunan mutu yang disebabkan oleh tiga kegiatan utama yaitu penurunan secara bakteriologis, kimia, dan fisik. Seluruh proses perubahan ini pada akhirnya dapat mengarah pada pembusukan (Murniyati dan Sunarman 2000).
2.3.1. Kemunduran Mutu Secara Kimiawi
Menurut Hadiwiyoto (1993) penurunan mutu secara kimia adalah penurunan mutu yang berhubungan dengan komposisi kimia dan susunan tubuhnya. Penurunan mutu secara kimia terdiri dari penurunan mutu secara autolisis, oksidasi dan akibat histidin.
6 2.3.2. Kemunduran Mutu Secara Autolisis
Autolisis adalah penguraian protein dan lemak menjadi senyawa yang lebih sederhana seperti asam amino dan asam lemak. Menurut Ilyas (1983) enzim yang berperan dalam autolisis yaitu enzim proteolysis (pengurai protein) dan enzim liposis (pengurai lemak). Penurunan mutu ditandai dengan rasa, warna, tekstur, dan kenampakan yang berubah. Penurunan mutu secara autolisis berlangsung sebagai aksi kegiatan enzim yang merupakan proses penguraian pertama setelah ikan tuna mati.
Kecepatan autolisis sangat tergantung pada suhu, semakin rendah suhu semakin lambat kecepatan autolisis. Kecepatan autolisis tidak dapat dihentikan namun dapat memperlambat laju autolisis. Kegiatan enzim dapat direduksi dan dikontrol dengan cara pendinginan, penggaraman, pengeringan, dan pengasaman atau dapat dihentikan dengan cara pemasakan ikan (Ilyas 1983).
2.3.3. Kemunduran mutu secara oksidasi
Menurut Faustman dan Cassens (1990), oksidasi adalah reaksi antara suatu senyawa kimia dengan oksigen. Salah satu kemunduran mutu ikan tuna yang disebabkan oleh proses oksidasi yaitu terjadinya penambahan kation Fe2+ (ferrous) dalam mioglobin menjadi bentuk Fe3+ (ferric) yang dapat mengakibatkan perubahan warna daging ikan tuna dari merah segar menjadi coklat.
Penyuntikan karbonmonoksida pada daging ikan tuna dapat mempertahankan warna merah daging ikan tuna pada saat penyimpanan dan pengangkutan. Senyawa karbonmonoksida dapat bereaksi dengan myoglobin menjadi karboksimioglobin yang merupakan bentuk stabil dari pigmen merah dalam daging ikan tuna. Karboksimioglobin dapat mencegah terjadinya proses oksidasi dibanding oksimioglobin karena senyawa karbonmonoksida memiliki daya ikat yang lebih kuat terhadap mioglobin dibanding oksigen (Livingston dan Brown 1981).
7 2.3.4. Kemunduran mutu secara fisik
Penurunan mutu secara fisik adalah kerusakan pada bagian luar tubuh ikan tuna yang terjadi akibat penanganan dan perlakuan yang kurang baik sehingga dapat mempengaruhi mutu. Penanganan lebih awal akan sangat berpengaruh terhadap kualitas mutu yang dihasilkan. Menurut Kushardiyanto (2010), perubahan fisik ikan yang terjadi pada proses kematian ikan karena diangkat dari air adalah:
1. Lendir yang berada dipermukaan ikan akan keluar secara berlebih saat ikan mati dan ikan akan menggelepar mengenai benda disekelilingnya. Ikan yang terkena benturan benda yang keras, kemungkinan besar tubuh ikan akan menjadi memar dan luka-luka.
2. Ikan mati akan mengalami kekakuan tubuh (rigormortis) yang diawali dari ujung ekor menjalar ke arah bagian kepalanya. Lama kekakuan tergantung dari tingkat kelelahan ikan pada saat kematiannya. Kerusakan ikan akan mulai terlihat yaitu berupa perubahan-perubahan seperti berkurangnya kekenyalan perut dan daging ikan, berubahnya warna insang, berubahnya kecembungan dan warna mata ikan, sisik lebih mudah lepas dan kehilangan kecemerlangan warna ikan, berubahnya bau dari segar menjadi asam.
3. Perubahan tersebut akan meningkat intensitasnya sesuai dengan bertambahnya tingkat penurunan mutu ikan, sehingga ikan menjadi tidak layak untuk dikonsumsi atau busuk.
Kesegaran ikan dapat dinilai menggunakan metode inderawi atau organoleptik dengan mengamati bagian tubuh ikan yang sensitif terhadap perubahan mutu dagingnya. Perubahan mutu tersebut seperti warna, rasa, kekenyalan dan kekompakan daging, kondisi mata, kondisi insang, dinding perut, bau atau aroma.
8 2.3.5. Kemunduran mutu secara bakteriologis
Penurunan mutu secara bakteriologis yaitu suatu proses penurunan mutu yang terjadi karena adanya kegiatan bakteri yang berasal dari lingkungan dan dalam tubuh ikan (Junianto 2003). Menurut Sarmono (2002), ikan hidup memiliki kemampuan untuk mengatasi aktivitas bakteri yang terdapat dalam tubuh ikan. Bakteri yang hidup dalam saluran pencernaan, insang, saluran darah, serta permukaan kulit tidak dapat menyerang bagian-bagian tubuh ikan karena masih memiliki daya tahan terhadap serangan bakteri.
Menurut Murniyati dan Sunarman (2000), ikan yang telah mati tidak dapat mempertahankan aktivitas bakteri karena kemampuan daya tahan tubuh ikan telah hilang, sehingga bakteri mulai berkembang biak dengan sangat pesat dan menyerang tubuh ikan. Bakteri menjadikan daging ikan sebagai makanan dan tempat hidupnya. Sasaran utamanya adalah protein ataupun hasil-hasil penguraiannya dalam proses autolisis, dan substansi-substansi non-nitrogen. Penguraian yang dilakukan oleh bakteri ini (disebut bacterial decomposition) menghasilkan pecahan-pecahan protein yang sederhana dan berbau busuk, seperti CO2, H2S, amoniak, indol, skatol, dan lain-lain.
Menurut Murniyati dan Sunarman (2000), setiap jenis bakteri memerlukan suhu tertentu untuk dapat hidup dengan baik.. Pencegahan yang dilakukan untuk menghambat aktivitas bakteri yaitu dengan menurunkan suhu hingga di bawah 00C atau menaikkan hingga di atas 1000C.
2.4. Salmonella sp
Bakteri Salmonella sp pertama kali ditemukan tahun 1885 pada tubuh babi oleh Theobald Smith (yang terkenal akan hasilnya pada anafilaksis), namun Salmonella sp dinamai dari Daniel Edward Salmon, ahli patologi Amerika (Ryan dan Ray, 2004) dalam (Masita, 2015).
Salmonella adalah bakteri gram negatif berbentuk batang bukan pembentuk spora yang terdiri dari sekitar 2500 serotipe yang kesemuanya diketahui bersifat patogen baik pada manusia atau hewan, aerob atau fakultatif anaerob. Dapat memfermentasi glukosa dengan membentuk asam atau gas dan dapat mereduksi
9 nitrat menjadi nitrit.Mempunyai sifat katalase positif dan oksidase negatif serta mudah tumbuh pada kebanyakan media. Bakteri ini bukan indikator sanitasi, melainkan bakteri indikator keamanan pangan. Artinya, karena semua serotipe Salmonella yang diketahui di dunia ini bersifat patogen maka adanya bakteri ini dalam air atau makanan dianggap membahayakan kesehatan karena dapat menyebabkan gangguan seperti tifoid (tipus). Oleh karena itu berbagai standar air minum maupun makanan siap santap mensyaratkan tidak ada Salmonella dalam 100 ml air minum atau 25 gram sampel makanan ( Dewanti R dan Hariyadi, 2005).
2.5. Morfologi
Salmonella sp merupakan bakteri batang lurus, Gram negatif, tidak berspora, dan bergerak dengan flagel peritrik kecuali Salmonella pullorum dan Salmonella gallinarum (Jawet’z, dkk, 2005). Bakteri ini bersifat fakultatif anaerob yang dapat tumbuh pada suhu dengan kisaran 5–45°C dengan suhu optimum 35– 37°C dan akan mati pada pH di bawah 4,1. Salmonella tidak tahan terhadap kadar garam tinggi dan akan mati jika berada pada media dengan kadar garam di atas 9%. Salmonella berbentuk bacillus dan berupa rantai filamen panjang ketika berada pada suhu ekstrim yaitu 4-8°C atau pada suhu 45°C dengan kondisi pH 4.4 atau 9.4. Panjang rata-rata Salmonella 2-5 μm dengan lebar 0.8 – 1.5 μm (Jay et all., 2005). Ciri-ciri lainnya yaitu berkembang biak dengan cara membelah diri, mudah tumbuh pada medium sederhana, resisten terhadap bahan kimia tertentu (misal, brilian hijau, natrium tetrationat, natrium deoksikolat) yang menghambat bakteri enterik lain, oleh karena itu senyawa–senyawa tersebut berguna untuk inokulasi isolat Salmonella dari feses pada medium, serta struktur sel bakteri Salmonella terdiri dari inti (nukleus), sitoplasma, dan dinding sel. Karena dinding sel bakteri ini bersifat Gram negatif, maka memiliki struktur kimia yang berbeda dengan bakteri Gram positif (Pratiwi, 2011).
10 Taksonomi dari Salmonella sp adalah sebagai berikut :
Kingdom : Bacteria Filum : Proteobakteria
class : Gamma proteobakteria Ordo : Enterobakteriales Family : Enterobakteriaceae Genus : Salmonella
Spesies : Salmonella sp (D’aoust, 2001)
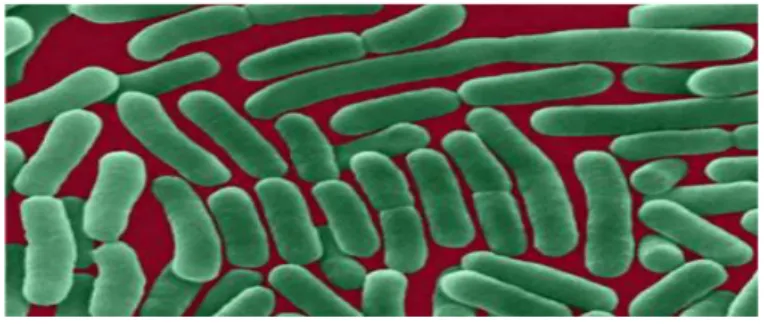
Gambar 2. Bakteri Salmonella Sumber : (Aguskrisno, 2012)
2.6. Sifat Biokimia
Salmonella merupakan bakteri yang tidak mampu memfermentasikan laktosa, sukrosa atau salicin, katalase positif, oksidase negatif dan manitol untuk memproduksi asam atau gas. Salmonella tidak dapat dibedakan dengan E. coli jika dilihat dengan mikroskop ataupun dengan menumbuhkannya pada media yang mengandung nutrien umum. Salmonella dapat tumbuh optimum pada media pertumbuhan yang sesuai dan memproduksi koloni yang tampak oleh mata dalam jangka waktu 24 jam pada suhu 37°C. Salmonella sensitif terhadap panas dan tidak tahan pada suhu lebih dari 70OC dan pasteurisasi pada suhu 71,1oC selama 15 menit (Cox et al, 2000). Salmonella mampu memfermentasi glukosa dan monosakarida lainnya dengan menghasilkan gas, lalu menggunakan sitrat sebagai satu-satunya sumber karbon disaat genus lainnya membutuhkan sumber karbon kompleks sebagai sumber nutrisinya. Beberapa Salmonella kecuali S. typhi
11 memproduksi gas selama proses fermentasi. Salmonella mampu mengubah nitrat menjadi nitrit dan tidak membutuhkan NaCl untuk pertumbuhannya. (Hanes, 2003). Karakteristik biokimia dari Salmonella dapat dilihat pada Tabel 1.
Tabel 2. Karakteristik Biokimia Salmonella
Karakteristik Reaksi
Katalase +
Oksidase _
Produksi gas dari glukosaa +
Indol _
Produksi urease _
Produksi H2S dari triple sugar iron agar (TSIA)a +
Sitrat sebagai sumber karbonb +
Metil red +
Voges-proskauer _
Lisin dekarboksilase +
Ornitin dekarboksilase +
+ = reaksi positif, - = reaksi negatif
a = pengecualian bagi Salmonella paratyphi A b = pengecualian bagi Salmonella typhi
*Sumber : Bell dan Kyriakides (2002) di dalam Bell dan Kyriakides (2003) 2.7. Kontaminasi
Bahan pangan yang sering terkontaminasi oleh bakteri Salmonella adalah dairy product, seperti susu, daging, dan lain–lain. Kontaminasi ini terjadi akibat pakan yang dikonsumi oleh hewan ternak telah terinfeksi oleh bakteri patogen, sehingga berdampak pada tumbuhnya bakteri Salmonella dalam tubuh hewan ternak (Masniari et al., 2006). Salmonella juga dapat mencemari makanan siap saji. Hal ini dikarenakan adanya kontaminasi silang yang terjadi antara bahan mentah. Proses pengolahan yang tidak tepat serta alat–alat yang digunakan selama pengolahan dapat dijadikan sebagai media penyalur bagi Salmonella (Lawley et al., 2008). Selain itu, makanan yang sering terkontaminasi Salmonella yaitu telur dan hasil olahannya, ikan dan hasil olahannya, daging ayam, daging sapi, serta susu dan hasil olahannya seperti es krim dan keju. Salmonella hidup secara fakultatif anaerob. Bakteri ini tidak dapat berkompetisi secara baik dengan
12 mikroba-mikroba umum yang terdapat di dalam makanan. Pertumbuhannya sangat terhambat dengan adanya bakteri-bakteri lain, misalnya bakteri pembusuk, bakteri genus Escherichiae dan bakteri asam laktat (Supardi dan Sukamto, 1999).
2.8. Salmonellosis
Bakteri Salmonella sp merupakan mikroba patogen penyebab food borne disease yang dapat menyebabkan kematian, yang disebut sebagai Salmonellosis. Hal ini dapat terjadi karena mengkonsumsi makanan yang tercemar oleh bakteri tersebut (Dominguez, et al., 2002). Pang et al. (1995) di dalam del Portillo (2000) menyebutkan bahwa peristiwa typoid salmonellosis (demam enterik) relatif stabil dengan jumlah terendah terjadi di daerah negara maju, tetapi peristiwa non-typhoid salmonellosis (gastroenteritis) relatif meningkat di seluruh negara. Kasus gastroenteritis (diare) akut adalah 1,3 milyar kasus dengan tiga juta jiwa meninggal, sedangkan kasus demam enterik adalah 16 juta kasus dengan kematian sebanyak 600 ribu kasus.
2.9. Penularan
Semua jenis Salmonella merupakan patogen fakultatif intraseluler dan dianggap sangat patogenik dan dapat menyerang macrophages, dendritic dan sel epitel (Bhunia 2008). Infeksi salmonella biasanya disebabkan karena mengonsumsi pangan mentah atau kurang matang yang telah terkontaminasi atau air yang mengandung materi fekal. Pangan juga dapat terkontaminasi oleh penjamah yang terinfeksi, binatang peliharaan dan hama, atau melalui kontaminasi silang akibat higiene yang buruk. Penularan dari satu orang ke orang lain juga dapat terjadi selama infeksi. Semakin tinggi jumlah Salmonella di dalam suatu makanan, semakin besar timbulnya gejala infeksi pada orang yang menelan makanan tersebut, dan semakin cepat waktu inkubasi sampai timbulnya gejala infeksi (Supardi dan Sukamto, 1999).
2.10. Patogenis
Salmonella akan berkembang biak di dalam alat pencernaan penderita, sehingga terjadi radang usus (enteritis). Radang usus serta penghancuran lamina
13 propria alat pencernaan oleh penyusupan (proliferasi) Salmonella inilah yang menimbulkan diare, karena Salmonella menghasilkan racun yang disebut cytotoxin dan enterotoxin (Dharmojono, 2001). Salmonella yang terbawa melalui makanan ataupun benda lainnya akan memasuki saluran cerna. Di lambung, bakteri ini akan dimusnahkan oleh asam lambung, namun yang lolos akan masuk ke usus halus. Bakteri ini akan melakukan penetrasi pada mukosa baik usus halus maupun usus besar dan tinggal secara intraseluler dimana mereka akan berproliferasi. Ketika bakteri ini mencapai epitel dan IgA tidak bisa menanganinya, maka akan terjadi degenerasi brush border. Kemudian, di dalam sel bakteri akan dikelilingi oleh inverted cytoplasmic membrane mirip dengan vakuola fagositik (Dzen, 2003).
2.11. Media pengujian
Media adalah suatu kumpulan zat-zat organik dan nonorganik yang dibutuhkan untuk pertumbuhan bakteri, virus, jamur, parasit (binatang bersel satu) dan mikroba dengan syarat-syarat tertentu, diantaranya derajat keasaman dan tingkat inkubasi tertentu. Media pertumbuhan mikroorganisme adalah suatu bahan yang terdiri dari campuran zat-zat makanan yang diperlukan untuk mikrorganisme tumbuh. Mikroorganisme memanfaatkan nutrisi dari media berupa molekul-molekul kecil yang dirakit untuk menyusun komponen sel, dengan media pertumbuhan dapat dilakukan isolat mikroorganisme menjadi kultur murni dan juga manipulasi komposisi media pertumbuhan (Pratiwi, 2011).
Menurut Waluyo (2007), penggunaan isolasi seleksi dan diferensiasi biakan yang didapat. Artinya penggunaan beberapa jenis zat tertentu yang mempunyai pengaruh terhadap pertumbuhan dan perrkembangbiakkan mikroba, banyak juga dilakukan dan digunakan. Sehingga masing-masing media mempunyai sifat (spesifikasi) tersendiri sesuai dengan maksudnya. Berdasarkan sifat-sifatnya, media dibedakan menjadi:
14 1. Media dasar/ umum
Yaitu media pembiakan sederhana yang mengandung zat-zat yang umum diperlukan oleh sebagian besar mikroorganisme dan dipakai juga sebagai komponen dasar untuk membuat media pembiakan lain.
2. Media diperkaya
Media ini dibuat dari media dasar dengan penambahan bahan-bahan lain umtuk mempersubur pertumbuhan mikroba tertentu yang pada media dasar tidak dapat tumbuh dengan baik. Untuk itu dibutuhkan beberapa penambahan nutrisi pengaya kedalam media dasar yang dapat menyokong pertumbuhan mikroba, misalnya dengan menambahkan darah, serum atau ekstrak hati.
3. Media deferensial
Media ini digunakan untuk membedakan bentuk dan karakter koloni mikroba yang tumbuh. Beberapa mikroba dapat tumbuh di dalam media ini, tetapi hanya beberapa jenis saja yang mempunyai penampilan pertumbuhan yang khas. Media ini berfungsi untuk isolasi dan identifikasi bakteri.
4. Media selektif
Media ini digunakan untuk menyeleksi pertumbuhan mikroba yang diperlukan dari campuran mikroba-mikroba lain yang terdapat dalam bahan yang akan diperiksa. dengan penambahan zat-zat tertentu mikroba yang dicari dapat dipisahkan dengan mudah. Media ini sangat berguna untuk identifikasi.
15 III. METODOLOGI
3.1. Waktu dan Tempat
Penulisan Tugas Akhir ini berdasarkan Pengalaman Kerja Praktek Mahasiswa (PKPM) dilaksanakan di Laboratorium Kantor Balai Karantina Ikan Pengendalian Mutu Kelas II Manado, Sulawesi Utara yang dilaksanakanmulai tanggal 16 januari – 16 maret 2017.
3.2. Metode pelaksanaan
Metode yang digunakan dalam pelaksanaan kegiatan pengalaman kerja peraktek mahasiswa yang dilaksanakaunn di BKIPM Kelas II manado adalah praktek lansung dan berperan aktif dari awal kegiatan, melakukan pengamatan serta melakukan tanya jawab secara lansung dengan analis selama proses kegiatan.
3.3. Metode pengumpulan data
Adapun metode yang digunakan dalam pengumpulan data penyusunan tugas akhir ini yaitu:
1. Pengumpulan data primer
Data primer dipeoleh dengan cara melaksanakan dan memgikuti lansung semua kegiatan yang dilakukan di lapangan dan melakukan tanya jawab kepada pembimbing lapangan serta analis lainnya.
2. Pengumpulan data skunder
Data skunder diperoleh melalui studi pustaka dan mengumpulkan data dari buku-buku yang berkaitan dengan pembahasan mengenai pengujian Salmonella sp pada produk perikanan.
3.4. Alat dan bahan
Alat dan bahan yang berhubungan dengan prosedur pengujian dan peralatan yang berkaitan dengan pelaksanaan praktekmengacu pada SNI 01.2332.2:2006 tentang indentifikasi bakteri Salmonella sp pada produk perikanan
16 Alat
- Timbangan dengan ketelitian 0,1 g - pinset
- Bunsen - Stomacher - Plastik stomacher - Botol pengencer
- Tabung reaksi ukuran 16 mm x 150 mm dan 20 x 150 mm
- Jarum inokulasi - PH meter - Pipet - Vortex
- Rak tabung reaksi - Pipet steril - Inkubator 350C ± 10C - Waterbath 430C ± 0,2 0C - Waterbath 420C ± 0,2 0C - Waterbath 480C±500 C - Ingkubator 370 C ± 0,50 C - Autoclave - spatula - oven
Bahan uji / sampel yang digunakan dalam pelaksanaan praktek adalah bahan baku (sampel) dari perusahaan perikanan baik berupa row material/ bahan baku hingga produk akhir perusahaan perikanan.
Bahan (media)
- LactoseBroth (LB)
- Rappaport-Vassiliadis(RV) medium - TetrathionateBroth(TTB)
- BismuthSulfite Agar (BSA) - HectoenEnteric(HE) Agar
- XyloseLysineDesoxycholate(XLD) Agar - Lysine Iron Agar (LIA)
- Triple Sugar Iron(TSI) - Brain heart infusion broth - Lysine decarboxylase broth - Malonate broth
- Motilility test medium
- Aquadest - Salmonella polyvalent somatis O antiserum - Salmonella polyvalent flagellar H antiserum - Natrium agar - Cairan fluit - NaCl 0,85%
- Selinite cysine broth (SCB)
- Simmon citrate agar - Trypttone broth
17 - MR-VP Broth
- Phenol red carbohydrate broth - Potasium cyanide (KCN) broth - Purple carbohydrate broth
- Larutan formalized physiologikal saline - Reagen kovac’s
- Indikator methyl red
- Larutan physiologikal saline 0,85% - Larutan potasium hydroxide 40% - Reagen VP
- Tripticase soe-triptose brot
- Urea broth
- Urea broth (rapid) - Aquades
- Etanol 70%
- Larutan brilian green dye - Larutan 1 N sodium hidroxide - Larutan 1 N hydrocholoric acid 3.5. Prosedur kerja
a.
Tahap pra-pengkayaan- Metode ini didasarkan pada analisa 25 gr atau 25 ml contoh dengan perbandingan 1: 9 untuk contoh dan media pengkayaan lactose broth (LB). - Untuk contoh dengan berat lebih kecil atau sama dengan 1 kg atau 11 sampai
dengan 4,5 L, timbang contoh padat sebanyak 25 g atau contoh cair sebanyak 25 ml dari contoh yang akan di uji, kemudian masukkan dalam wadah atau plastik steril dan tambahkan 225 ml larutan lactose broth.
- Untuk contoh lebih besar dari 4,5 kg atau 4,51, timbang contoh padat sebanyak 50 ml, kemudian masukkan dalam wadah atau plastic steril dan tambahkan 450 ml laktose broth
- Contoh dihomogenkan (stomacher) selama 2 menit untik di analisa secara aseptis. pindahkan larutan contoh dalam wadah steril yang sesuai. Inkubasi 24 jam ± 2 jam pada suhu 35°C ± 1°C. Lanjutkan pengujian sesuai dengan prosedur.
18
b.
Tahap pengkayaan- Tutup wadah dikencangkan dan perlahan contoh yang dingkubasi dikocok.. Diambil 0,1 ml larutan sampel tambahkan ke dalam 10 ml rappaporr-vasiliadas (RV) medium dan 1 ml larutan contoh ke dalam tettrationat broth (TTB) untuk produk perikanan dengan tingkt kontaminasi tinggi. Sedangkan untuk jenis prodak perikanan lain, 1 ml larutan sampel ke dalam masing masing 10 ml SCB dan 10 ml TTB.
- Untuk prodak perikanan dengan kontaminasi tinggi ingkubasi RV medium selama 24 jam ± 2 jam pada suhu 340 C ± 0,20 C (water bath),ingkubasi TTB selama 24 jam ± 2 jampada suhu 430 C ± 0,20 C (Water bath).
- Untuk prodak perikanan lain, ingkubasi TTB dan SCA selama 24 jam pada suhu 350 C ± 10 C.
c.
Tahap Isolasi- Tabung dikocok (dengan vortex) dan dengan mengggunakan jarum loop (3mm) gores TTB yang diinkubasi ke dalam media HE, XLD dan BSA. Siapkan BSA sehari sebelum digunakan dan simpan di tempat gelap pada suhu ruang. Gores ke dalam media yang sama dari RV Broth atau SCB. Inkubasi cawan BSA, HE dan XLD selama 24 jam pada suhu 35°C ± 1°C. Amati kemungkinan adanya koloni Salmonella.
- Pengamatan morfologi Salmonella
Koloni yang terdugaSalmonelladiambildari masing-masing media Agar selektif setelah 24 jam± 2 jam inkubasi. Koloni-koloni Salmonella yang khas (typical) adalah sebagai berikut:
a. Pada Hectoen Enteri (HE) Agar. Koloni hijau kebiruan sampai biru dengan atau tanpa inti hitam. Umumnya kultur Salmonella membentuk koloni besar, inti hitam mengkilat atau hampir seluruh koloni terlihat berwarna hitam.
b. Pada XLD Agar. Koloni merah jambu (pink) dengan atau tanpa inti hitam. Umumnya kultur Salmonella membentuk koloni besar, inti hitam mengkilat atau hampir seluruh koloni terlihat berwarna hitam.
19 c. Pada BismuthSulphite Agar (BSA). Koloni coklat, abu-abu atau hitam; kadang-kadang metalik. Biasanya media di sekitar koloni pada awalnya berwarna coklat, kemudian berubah menjadi hitam (haloeffect) dengan makin lamanya waktu inkubasi.
d. Secarahati-hati ambil bagian tengah koloni dengan menggunakan jarum inokulasi steril dan goreskan ke permukaan media TSI agar dengan cara menggores agar miring dan menusuk agar tegak. Tanpa mengambil koloni baru, gunakan jarum yang sama untuk menggores media LIA dengan cara menusuk agar tegak lebih dahulu, setelah itu goreskan pada agar miring.
e. TSI dan LIA diingkubasi selama 24 jam ± 2 jam pada suhu 35°C ± 1°C dengan membiarkan tutup sedikit kendur untuk mencegah terbentuknya H2S yang berlebihan. Pada TSI, kultur Salmonella yang khas memberikan reaksi alkali (merah) pada goresan agar miring dan asam (kuning) pada tusukan agar tegak, dengan atau tanpa H2S (warna kehitaman pada agar). Pada LIA, kultur Salmonella yang khas memberikan reaksi alkaline (ungu) pada keseluruhan tabung. Reaksi yang benar-benar kuning pada tusukan dinyatakan sebagai kultur negatif. Jangan hanya melihat diskolorisasi pada tusukan untuk menyatakan kultur negatif. Umumnya kultur Salmonella membentuk H2S pada LIA. Beberapa kultur non Salmonella membentuk reaksi merah bata pada agar miring LIA. Reaksi TSI dan LIA dapat dilihat pada Tabel 2. di bawah ini:
20 Tabel 3. Reaksi biokimia Salmonella sp pada TSI dan LIA
Lanjutkan dengan uji biokimia dan serologi dari kultur TSI jika positif.
d.
Identif ikasi Salmonella sp- Uji urease (konvensional)
Isolasi bakteri dari TSI agar ke dalam Urea Broth. Ingkubasi selama 24 jam ± 2 jam pada suhu 350 C ± 10 C.
- Uji serologi pollypalent Flagellar (H)
a. 1 ose dari TSI agar dipindahkan kedalam 5 ml BHI broth, ingkubasi selama 4-6 jam pada suhu 350 C ± 10 C sampai terlihat pertumbuhan. Tambahkan 2,5 ml larutan formalized physiological saline ke dalam BHI Broth (untuk diuji pada hari yang sama) atau pindahkan 1 ose dari TSI agar ke dalam 5 ml trytecase soy-triptose broth (TSTB) dan ingkubasi selama 24 jam ± 2 jam pada suhu 350 C ± 10 C. Tambahkan 2,5 ml ml larutan formalized physiological saline ke dalam TSTB.
b. Dua kultur dari TSI disiapkan (contoh dan kontrol) yang telah di beri formalized physioligical saline dari uji dengan Salmonella polypalent flagellar (H) atisera. Masukkan ± 0,5 ml larutan Salmonella polypalent flagellar (H) asitera dalam tabung. Siapkan kontrol saline dengan mencampur 0,5 ml formalizedf physiological saline dengan 0,5 ml formalized antigen. Ingkubasi campuran tersebut dalam water bath pada suhu 480 C - 500 C. Amati setiap interval waktu 15 menit dan amati hasilnya selama 1 jam.
Media Agar Miring (Goresan) Agar Tegak (tusukan) Gas H2S TSI Alkalin / K (merah) Asam / A (kuning) +/- +/- LIA Alkalin / K (ungu) Alkalin / K (ungu) +/- +/-
21 c. Positif apabila terjadi penggumpalan dalam uji campuran dan tidak ada
penggumpalan dalam kontrol.
e.
Phenol red dulitol atau purple broth base dengan 0,5 % dulkitol- Dari media TSI di pindahkan 1 ose ke dalam media dulkitol broth. Ingkubasi selama 48 jam ± 2 jam pada suhu 350 ± 10 C, tetapi amati setelah 24 jam. Pada umumnya Salmonella memberikan hasil positif, ditandai dengan pembentukan gas dalam tabung durham dan pH asam(kuning) pada media. - Dari media TSI di pindahkan 1 ose dalam media triptone broth. Ingkubasi
selama 24 jam pada suhu 350 C dan lanjutkan denganuji : - Potasium Cyanida (KCN) Broth
1 ose dari TB 24 jam di pindahkan kedalam media KCN Broth. Tabung ditutup rapat dan lapisi dengan kertas prafilim. Ingkubasi selama 48 jam ± 2 jam pada suhu 450 C tetapi amati setelah 24 jam. Umumnya Salmonella tidak tumbuh pada media ini yang ditandai dengan tidak terjadi kekeruhan.
f.
Malonate brothTB yang telah diingkubasi 24 jam di ambil 1 ose kedalam media malonate broth. Ingkubasi selama 48 jan ± 2 jam pada suhu 350 C ± 10 C, tetapi amati setelah 24 kam. Umumnya samonella memberikan reaksi negatif (hijau atau tidak ada perubahan warna pada media).
g.
Uji indolDari TB 24 jam di pindahkan 5 ml kedalam tabung kosong dan ditambahkan 0,2 ml-0,3 ml reagen kovacs. Perubahan yang terjadi diamati. Umumnya Salmonella memberikan raksi negatif (tidak terbentuk cincin merah pada permukaan media).
h.
Uji serologi Polivalent somaticKultur dari TSI yang telah diingkubasi selama 24-48 jam di ambil 1 ose dan letakkam diatas gelas preparat. Tetesidengan larutan saline 0,85% steril dan emulsikan. Letakkan 1 tetes Salmonella polyvalent somatic (O) Antiserum disamping suspensi koloni. Campurkan koloni antiserum sedikit demi sedikit
22 dengan suspensi koloni sampai tercampur sempurna. Lakukan kontrol dengan menggunakan larutan saline dan antiserum. Miringkan campuran tersebut kikiri dan ke kanan dan amati segera pada latar belakang yang gelap. Umumnya salmonella memberikan reaksi positif dimana terjadi penggumpalan pada larutan kultur dan tidak terjadi penggumpalan pada larutan kontrol.
i.
Uji phenol red laktose atau purple laktose brothDari TSI agar miring yang telah di ingkubasi selama 24 jam-48 jam dipindahkan 1 ose kedalam phenol red lactose atau purple lactose. Ingkubasi selama 48 jam ± 2 jam pada suhu 350 C, tetapi amati setelah 24 jam. Salmonella memberikan hasil negatif ditunjukkan dengan tidak terbentuknya gas pada tabung durham dan warna merah (phenol red sebagai indikator) atau ungu (bromcesol purple sebagai indikator) pada media.
j.
Uji phenol red sucrose atau purple sucrose brothDari TSI agar miring yang telah di ingkubasi selama 24 jam-48 jam dipindahkan 1 ose kedalam phenol red sucrose atau purple sucrose broth. Ingkubasi selama 48 jam ± 2 jam pada suhu 350 C ± 10 C amati setelah 24 jam. Salmonella memberikan hasil negatif, ditunjukkan dengan terbentuknya gas pada tabung durham dan warna merah atau ungu pada saluran media.
k.
Uji methyl Red-voges proskauer (MR-VP) Broth1 ose dari TSI agar miring dipindahkan ke dalam media MR-VP Broth dan di ingkubasi selama 48 jam ± 1 jam pada suhu 350 C ± 10 C.
Lakukan uji VP pada suhu ruangan sebagai berikut :
- 1 ml MR-VP Broth yang telah diingkubasi selama 48 jam ± 2 jam pada suhu 350 C ± 10 C dipindahkan kedalam tabung reaksi steril dan kembali MR-VP Broth diingkubasi selama 48 jam ± 2 jam pada suhu 350 ± 10 C untuk pengujian MR. Ditambahkan 0.6 ml alpha alphanaphol dan kocok. 0.2 ml larutan 40% KOH dan kocok kembali. Untuk mempercepat reaksi tambahkan sedikit kristal kreatin dan amati hasilnya setelah 4 jam. Salmonella umumnya memberi reaksi VP negatif/Uji MR :
23 - Ditambahkan 5 tetes – 6 tetes indikator MR kedalam media MR-VP yang telah diingkubasi selama 96 jam. Amati hasilnya . umumnya Salmonella memberikan raeksi positif ditandai dengan terjadinya difusi warna merah pda media.
L. Uji simons citrat agar
1 ose dari TSI agar miring dipindahkan kedalam media simmon citrate agar miring dengan cara menggores agar miring dan menusuk agar tegak. Ingkubasi selama 96 jam ± 2 jam pada suhu 350 C ± 10 C.
Umumnya Salmonella memberikan hasil citrate positif yang ditandai dengan adanya pertumbuhan dan diikuti perubahan warna menjadi biru.
24 Tabel 4. Reaksi Biokimia dan Serologi untuk Salmonella
No Pengujian Hasil reaksi
Salmonella reaksi spesies Positif Negatif
1. Glukosa (TSI) Tusukan kuning Tusukan merah + 2. Lysine dekarboxilase Tusukan ungu Tidak kuning +
3. H2S (TSI dan LIA) Hitam Tidak hitam +
4. Urease Ungu sampai
Merah
Tidak ada
pe-rubahan warna _ 5. Lysinedekarboxylase
broth (LDB)
Ungu Perubahan
Warna kuning +
6. Phenol red dulcition Broth
Kuning dan atau Gas
Tidak ada ter-bentuk gas dan
Tidak berubah Warna
+
7. KCN Broth Pertumbuhan Tidak ada
Pertunbuhan _
8. Malonate broth Warna biru Tidak ada
pe-rubahan warna _ 9. Uji indol Warna violet
Pada permukaan Warna kuning pada permukaan _ 10. Uji serologi Polyvlent flagellar (H)
Penggumpalan Tidak ada
Penggumpalan +
11.
Uji serologi polyvalen
Somatic
Penggumpalan Tidak ada
Penggumpalan +
12. Penol red laktose BrotH
Warna kuning Dan/ atau gas
Tidak ada Pembentukan
gas/tidak berubah warna
_
13. Phenol red sucrose broth
Warna kuning Dan/ atau gas
Tidak ada Pembentukan
gas, tidak Berubah warna
_
14. Uji voges proskauer Merah muda Sampai merah
Tidak ada Perubahan
warna
_
15. Uji methyl red Warna merah Menyebar
Warna kuning
Menyebar +
16. Simmons citrate Adapertumbuha Warna biru
Tidak terjadi