TINJAUAN PUSTAKA
Tiram Mutiara Pinctada maxima (Jameson)
Tiram mutiara spesies P. maxima termasuk moluska laut, dengan tubuh dilindungi atau ditutupi oleh sepasang cangkang, termasuk kelas Bivalvia dan famili Pteriidae (Cahn 1949).
P. maxima merupakan salah satu jenis tiram penghasil mutiara yang mempunyai nilai ekonomis paling tinggi dan ukuran paling besar. Di pasaran internasional, mutiara yang diproduksi sering kali disebut dengan nama “South Sea Pearl” (Shirai 1981). Spesies ini mempunyai diameter dorso-ventral dan anterior-posterior hampir sama sehingga bentuknya agak bundar. Bagian dorsal berbentuk datar dan panjang serta dihubungkan oleh semacam engsel berwarna hitam (Takemura and Kafuku 1957).
Tiram muda atau spat mempunyai warna cangkang bervariasi dengan warna dasar kuning pucat, kuning tua atau kuning kecoklatan, coklat kemerahan, merah anggur dan kehijauan. Pada cangkang bagian luar terdapat garis-garis radier yang menonjol seperti sisik, berwarna lebih terang dari warna dasar cangkang, berjumlah 10 – 12 buah dan ukurannya lebih besar dibandingkan pada spesies lain.
Umumnya setelah dewasa warna cangkang menjadi kuning tua sampai kuning kecoklatan, warna garis radier biasanya sudah memudar. Cangkang bagian dalam (nacre) berkilau dengan warna putih-keperakan, bagian tepi nacre (nacreous-lip) ada yang berwarna keemasan sehingga sering disebut “Gold-lip Pearl Oyster” dan yang berwarna perak disebut juga “Silver-lip Pearl Oyster”. Pada bagian luar nacre (non-nacreous border) berwarna coklat kehitaman.
Habitat dan Daerah Penyebaran
P. maxima disebut juga Shirocho-gai merupakan spesies tiram mutiara yang ukurannya paling besar (Shirai 1981; Takemura and Kafuku 1957). Tempat hidupnya mulai dari perairan dangkal dengan dasar perairan berpasir, atau pasir berkarang yang ditumbuhi tanaman lamun sampai laut dalam berkarang. Umumnya hidup menempel
pada karang hingga kedalaman 10–75 m. Ditemukan juga di perairan laut dalam dengan substrat bersedimen di daerah yang berdekatan dengan landas kontinen dan paparan pulau, dimana airnya agak keruh. Biasanya dapat ditemukan banyak individu tergeletak di atas substrat tanpa bisus (Gervis and Sims 1992; Tun and Winanto 1987; Yukihira et al. 1999, 2006). Di lokasi sekitar budidaya mutiara sering kali ditemukan hidup menempel pada karang di kedalaman 50–100 cm (Winanto et al. 1992).
Daerah penyebaran P. maxima mulai dari laut Arafuru, Australia bagian Utara, Philipine, Myanmar, Thailand, Papua New Guiniea dan Indonesia. Di perairan Indonesia Pinctada maxima dapat ditemukan mulai dari Kep Aru, Papua, Laut Banda, Kep. Maluku, Kep. Bacaan, Laut Seram, Nusa Tenggara Barat, Nusa Tenggara Timur, Sulawesi Tenggara, pantai Utara Jawa Barat dan Banten, Kalimantan Barat dan Bangka-Belitung. Namun demikian polulasi terbesar berada di daerah Indonesia bagian Tengah dan Timur (Tun and Winanto 1987; Winanto et al. 1992).
Siklus Hidup dan Reproduksi
Tiram mutiara mempunyai jenis kelamin terpisah, kecuali pada beberapa kasus tertentu ditemukan sejumlah individu yang hermaprodit. Perubahan kelamin (sex reversal) biasanya terjadi pada sejumlah individu setelah memijah atau pada stadia awal perkembangan gonad. Fenomena sex reversal juga diamati Wada and Wada (1939) dalam Cahn (1949) terhadap tiram P. maxima, hasilnya menunjukkan bahwa jenis kelamin tiram ternyata tidak tetap, sejumlah jantan berubah menjadi betina dan sebaliknya betina bisa menjadi jantan.
Bentuk gonad tebal-menggembung, pada kondisi matang penuh gonad menutupi seluruh organ dalam (perut, hati dan yang lain) kecuali bagian kaki. Secara eksternal sulit untuk membedakan antara gonad jantan dan betina, utamanya pada stadia awal, keduanya berwarna krem kekuningan. Tetapi setelah stadia matang penuh, gonad tiram P. maxima jantan berwarna putih krem, sedang yang betina berwarna kuning tua. Sedangkan menurut Chellam (1987); CMFRI (1991) gonad jantan P. fucata berwarna krem pucat keputihan dan betina berwarna krem kekuningan sampai kuning.
Tingkat kematangan gonad tiram mutiara dikelompokkan menjadi lima stadia (deskripsi perkembangan gonad ini hanya didasarkan pada tiram betina) yaitu :
Stadia I : Tahap tidak aktif/salin/ istirahat (inactive/spent/resting); Stadia II: Perkembangan/ pematangan (developing/maturing); Stadia III: Matang (mature); Stadia IV: Matang penuh/memijah sebagian (fully maturation/partially spawned); Stadia V : Salin (spent). Pada stadia awal perkembangan gonad, tiram jantan dan betina menunjukkan perkembangan reproduksi yang sama, oleh karena itu pada stadia II dan III warna gonad krem pucat. Pada stadia gametogonesis yang lain, gonad jantan dan betina nampak sama jika diamati secara ekternal (Chellam 1987; CMFRI 1991; Winanto 2004).
Pada berbagai kasus di lapangan, para praktisi (breeder) sering kali menggunakan induk stadia III dan IV untuk pemijahan. Spesifikasi induk betina stadia III adalah gonad tersebar merata hampir di seluruh jaringan organ, biasanya berwarna krem kekuningan. Sebagian besar oocyt berbentuk buah peer, dengan ukuran 68 x 50 .μm, ukuran inti 25 μm. Sedangkan induk Stadia IV mempunyai ciri-ciri gonad menggembung, tersebar merata dan secara konsisten akan keluar dengan sendirinya atau jika ada sedikit trigger. Oocyt bebas dan terdapat di seluruh dinding kantong gonad. Hampir semua oocyt berbentuk bulat dan berinti, dengan ukuran rata-rata 51,7 .μm.
Menurut Wada et al. (1995) pengetahuan tentang biologi reproduksi tiram mutiara sangat dibutuhkan untuk pengembangan industri budidaya mutiara, khususnya memahami perkembangan gonad dan dinamika populasinya di alam. Pengetahuan ini dapat digunakan untuk mengembangkan teknik pembenihan dan perbaikan teknik penempatan inti bulat di dalam gonad pada budidaya mutiara.
Hasil pengamatan Winanto et al. (2002) terhadap stadia kematangan gonad dan musim pemijahan P. maxima di Teluk Hurun, Lampung dari tahun 1996–2002 menunjukkan, bahwa kematangan gonad terjadi setiap bulan, namun stadia kematangan gonad penuh (TKG IV) hanya terjadi pada bulan Maret, Mei dan Agustus sampai Nopember. Gonad dalam masa istirahat (resting phase) terjadi pada bulan Desember, stadia I dan II terjadi hampir sepanjang tahun. Selama tujuh tahun pengamatan, dicatat stadia perkembangan gonad tertinggi hanya sampai TKG II terutama pada bulan April dan Juni. Sedangkan TKG III terjadi pada bulan Januari– Maret dan Juli–Desember.
Chellam (1987); CMFRI (1991) menyatakan bahwa beberapa jenis tiram mutiara dapat dijumpai matang gonad sepanjang tahun. Sedangkan Chacko (1970) dan Rao (1970) melaporkan bahwa musim pemijahan Pinctada spp terjadi setiap bulan sepanjang tahun. Musim puncak kematangan gonad identik dengan musim puncak pemijahan. Pada musim tertentu, induk tiram di alam yang telah dewasa akan bertelur. Telur-telur tersebut kemudian akan dibuahi oleh sel kelamin jantan (sperma) dan pembuahan terjadi secara eksternal di dalam air.
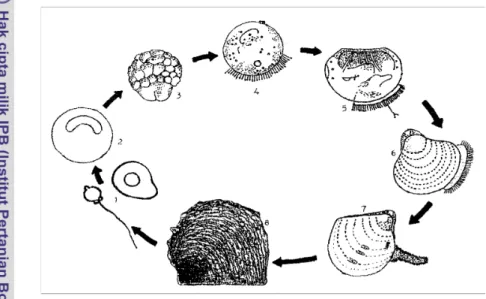
Telur yang telah dibuahi akan mengalami perubahan bentuk, mula-mula terjadi penonjolan polar, lalu membentuk polar lobe II yang merupakan awal proses pembelahan sel dan akhirnya menjadi multisel. Tahap berikutnya adalah fase trocofor, dengan bantuan bulu-bulu getar trocofor dapat berenang-renang dan bergerak berputar-putar. Beberapa jam kemudian trocofor akan berkembang menjadi veliger atau larva bentuk D (Gambar 3), dengan ditandai tumbuhnya organ mulut dan pencernaan. Larva mulai makan dan tubuhnya telah ditutupi cangkang tipis. Perkembangan selanjutnya adalah tumbuh velum, pada fase ini biasanya sangat sensitif terhadap cahaya dan sering berenang-renang di permukaan air. Selama stadia planktonis, larva biasanya berenang-renang dengan menggunakan bulu-bulu getar atau menghanyut dalam arus air.
Pada saat mencapai stadia umbo (Gambar 3) secara bertahap cangkang juga ikut berkembang. Bentuk sepasang cangkangnya sama dan mantel sudah berfungsi secara permanen. Pada akhir stadia umbo, larva bergerak dengan menggunakan velum.
Stadia pediveliger (Gambar 3) ditandai dengan berkembangnya kaki, gerakan-gerakan sederhana dari berenang sampai berputar-putar dilakukan dengan velum dan kaki. Setelah kaki berfungsi dengan baik velum akan menghilang, lembaran-lembaran insang mulai nampak jelas.
Proses pencarian tempat atau substrat untuk menempel dan menetap dimulai sejak larva mencapai stadia pediveliger. Pertumbuhan awal cangkang terlihat pada bagian tepi cangkang, bentuknya sangat tipis, transparan, tersusun oleh selaput tipis conchiolin. Pada waktu yang sama kelenjar bisus akan mensekresikan benang-benang bisus untuk menempel. Organ lain yang berkembang yaitu labial palp dan insang. Stadia pertumbuhan setelah pediveliger ini biasanya disebut Plantigrade (Gambar 3).
Perkembangan akhir larva yaitu perubahan stadia plantigrade menjadi spat (Gambar 3). Bentuk spat menyerupai tiram dewasa, mempunyai engsel, auricula depan dan belakang serta terdapat takik bisus pada bagian anterior. Cangkang sebelah kiri lebih cembung dari pada yang kanan. Spat-spat bisa menempel pada substrat dengan bantuan benang-benang bisus. Laju pertumbuhan dari stadia larva sampai spat pada satu tempat dan tempat yang lain berbeda-beda, tergantung dari faktor lingkungan.
Gambar 3. Siklus hidup tiram mutiara Pinctada maxima (modifikasi dari Tun and Winanto 1987; Winanto 1988; Ikenoue and Kafuku 1992). (1) Telur dan sperma. (2) Telur dibuahi. (3) Pembelahan sel. (4) Gastrula. (5) Larva bentuk-D. (6) Stadia umbo. (7) Spat. (8) Dewasa.
Sistem Pencernaan
Seperti halnya pada jenis kekerangan yang lain, tiram mutiara mampu memanfaatkan phytoplankton yang terdapat secara alamiah di sekitarnya. Tiram mutiara bersifat filter feeder atau mengambil makanan dengan jalan menyaring pakan yang ada di dalam air laut. Getaran silia pada insang menimbulkan arus air yang masuk ke dalam rongga mantel. Gerakan silia akan memindahkan phytoplankton yang berada di sekeliling insang dan dengan bantuan labial palp atau melalui simpul bibir yang bergerak-gerak akan membawa masuk makanan ke dalam mulut (Gosling 2004; Velayudhan and Gandhi 1987).
Mulut terletak pada bagian ujung depan saluran pencernaan atau di sebelah atas kaki. Makanan yang ditelan masuk dari mulut kemudian melalui kerongkongan
yang pendek langsung masuk perut, atau saluran kantong tipis pada perut dengan kulit luar (cuticle) kasar yang berfungsi untuk memisah-misahkan makanan. Dari perut sisa makanan (kotoran) akan dibuang melalui saluran usus yang relatif pendek dan bentuknya seperti huruf S kemudian keluar lewat anus (Velayudhan and Gandhi 1987).
Sistem Pernafasan
Insang merupakan organ yang mempunyai peran fungsional baik dalam pernafasan maupun osmoregulasi. Sel-sel yang berperan pada proses osmoregulasi adalah sel-sel chlorida yang terletak pada bagian dasar lembaran-lembaran insang. Insang berjumlah empat buah, berbentuk sabit, dua insang berada di sisi kanan dan kiri, menggantung pada pangkal mantel seperti lipatan buku (Velayudhan and Gandhi 1987).
Air yang masuk melalui saluran inhalen akan terhenti pada bagian mantel, lalu secara cepat dan kompak bekerjasama dengan insang sehingga dapat memanfaatkan udara yang terangkut dan air dikeluarkan kembali melaui saluran ekshalen. Air serta darah yang tidak berwarna masuk melalui beberapa filamen tunggal lalu mengalir ke luar menuju pinggir insang, kemudian melintas ke atas berputar kembali melalui filamen dan masuk ke branchial atau ctenidial. Dengan bantuan silia-silia pada branchial dapat menimbulkan arus yang masuk ke bilik palial dan melintas keatas, melalui lamela branchial. Jadi selain menjalankan fungsi pernafasan, filamen pada insang dan mantel dapat memperlancar peredaran darah (Gosling 2004; Velayudhan and Gandhi 1987).
.
Kualitas Air
Perkembangan, pertumbuhan dan sintasan tiram mutiara sangat dipengaruhi oleh kualitas air di lingkungan tempat hidupnya. Beberapa parameter kualitas air tersebut antara lain suhu, kecerahan, salinitas, Oksigen terlarut (DO), pH. dan pakan hidup (CMFRI 1991; Gricourth et al. 2006; O’Connor and Lawler 2004; Soria et al. 2007; Yokihira et al. 2000; 2006).
Suhu
Perubahan suhu memegang peranan penting dalam aktivitas biofisiologi tiram mutiara di dalam air. Menurut Cahn (1949) suhu yang baik untuk kelangsungan hidup tiram mutiara berkisar antara 25−30 oC. Sedangkan menurut Suharyanto et al. (1993), suhu air pada kisaran 27−31 oC dianggap cukup layak untuk kehidupan tiram mutiara P. margaritifera (japing-japing).
Menurut Nayar dan Mahadevan (1987); Alagarswami et al. (1983 a), selama pemeliharaan di dalam laboratorium, suhu yang bervariasi dapat mempengaruhi waktu penempelan larva tiram mutiara. Pada suhu 28,2−29,8 oC, larva akan menempatkan diri untuk menetap-melekat pada substrat setelah umur 24 hari. Selanjutnya pada rentang suhu 24,3−27,2 oC larva baru akan melekat setelah 32 hari. Pada suhu yang rendah, sebagian besar waktu tiram mutiara akan dihabiskan untuk melakukan metamorfose secara lengkap dan melekatkan diri untuk menetap.
Suhu air sangat berperan dalam mengendalikan proses metabolisme. Perubahan suhu walaupun kecil selama pemeliharaan larva dapat mengakibatkan kematian. Pada suhu antara 24−30 oC, tiram mutiara P. margaritifera sangat aktif melakukan kegiatan metabolisme, sedangkan pada suhu 18−20 oC tidak aktif lagi. Suhu air yang baik untuk pemeliharaan larva berkisar antara 25−27 oC (Hisada dan Komatsu, 1985; Holliday et al. 1993; Shokita et al. 1991). Di Balai Budidaya Laut Lampung, Larva dan spat P maxima menunjukkan pertumbuhan dan kelangsungan hidup yang baik pada kisaran suhu 26 – 28 oC (BBL 2001).
Kecerahan
Kecerahan air berpengaruh terhadap fungsi dan struktur invertebrata dalam air. Lama penyinaran akan berpengaruh terhadap proses pembukaan dan penutupan cangkang. Cangkang tiram akan terbuka sedikit bila ada cahaya, dan terbuka lebar bila suasananya gelap. Oleh sebab itu ruang pemeliharaan larva dan spat biasanya dibuat agak gelap, dengan tujuan agar organisme yang dipelihara merasa nyaman dan cangkang bisa bebas terbuka, sehingga proses filtrasi pakan dapat berlangsung maksimal dan alami (CMFRI 1991; Gosling 2004; Nayar and Mahadevan 1987).
Kecerahan yang tidak terlalu tinggi dapat melindungi tubuh larva stadia veliger dari radiasi sinar ultra violet. Karena larva masih bersifat fototaksis positif dan umumnya di dalam proses metamorfose menghendaki sinar yang sesuai (CMFRI 1991).
Lokasi pemeliharaan induk sebaiknya mempunyai kecerahan antara 4,5–6,5 m. Apabila kecerahan lebih dari kisaran tersebut akan menyulitkan pemeliharaan, karena demi kenyamanan induk harus dipelihara di kedalaman melebihi tingkat kecerahan yang ada (Tun and Winanto 1987).
Salinitas
Dilihat dari habitatnya tiram mutiara lebih menyukai hidup pada salinitas yang tinggi. Tiram mutiara toleran terhadap kisaran salinitas 24 dan 50 %o, namun hanya untuk jangka waktu yang pendek yaitu sekitar 2–3 hari.
Lokasi pembenihan sebaiknya dipilih di lokasi perairan yang memiliki salinitas antara 32–35 %o, karena baik untuk pertumbuhan dan kelangsungan hidup larva dan spat. Pada salinitas 14 %o dan 50 %o, dapat mengakibatkan kematian tiram mutiara sampai 100 % (BBL 2001; Tun and Winanto 1987).
Oksigen terlarut (DO)
Bagi organisme akuatik yang dibudidayakan, oksigen terlarut dapat menjadi faktor pembatas kelangsungan hidup, perkembangan dan pertumbuhan. Menurut Imai (1982), tiram dapat hidup dengan baik pada perairan dengan kandungan oksigen terlarut berkisar antara 5,20−6,60. Pengamatan Darmaraj (1983) di daerah populasi alami tiram P. sugilata menunjukkan bahwa kadungan rata-rata oksigen terlarut di bagian permukaan air 4,22 ml/l dan dasar perairan 4,37 ml/l. Sadangkan pengamatannya di daerah budidaya mencatat kandungan oksigen terlarut di bagian permukaan 5,05 ml/l dan di dasar perairan 4,77 ml/l.
Pendapat yang berbeda disampaikan oleh Nayar dan Mahadevan (1987), bahwa tiram mutiara tidak akan mengalami banyak stres pada kisaran konsentrasi oksigen terlarut yang terbatas. Hal ini merupakan fakta, karena metabolisme pada
kebanyakan moluska tergantung pada batas tekanan oksigen terlarut, sampai mencapai batas tekanan terendah hingga oksigen terlarut akan naik kembali.
Hasil penelitian Dharmaraj (1983) tentang kebutuhan oksigen terlarut tiram mutiara P. fucata, menunjukkan bahwa tiram berukuran 40−50 mm mengkonsumsi oksigen 1,339 μl/l; ukuran 50−60 mm mengkonsumsi 1,650 μl/l dan ukuran 60−70 mm mengkonsumsi 1,810 μl/l.
Di tempat pemeliharaan yang terkendali seperti hatchery, sebenarnya kebutuhan oksigen terlarut tidak menjadi masalah, karena ketersediaannya dapat diatasi dengan memberikan pengudaraan buatan menggungkan alat blower (CMFRI 1991).
pH
pH air yang layak untuk kehidupan tiram mutiara P. maxima berkisar antara 7,8–8,6 (Matsui 1960). Sedangkan pada pH 7,9–8,2 tiram mutiara dapat berkembang biak dan tumbuh dengan baik.
Menurut Mahadevan and Nayar (1974); Nayar and Mahadevan (1987), pada prinsipnya habitat tiram mutiara berada pada perairan dengan pH lebih tinggi dari 6,75. Tiram tidak akan bereproduksi kembali bila pH lebih tinggi dari 9,00. Aktivitas tiram akan meningkat pada pH 6,75–7,00 dan menurun pada pH 4–6,5., pada kisaran pH tersebut jumlah tiram yang normal hanya sekitar 10 %.
Pakan Hidup
Pakan merupakan salah satu faktor penentu di dalam keberhasilan kegiatan pembenihan tiram mutiara. Ketersediaan pakan yang tepat waktu, jumlah dan jenis akan sangat mendukung sukses produksi massal spat. Pakan utama yang biasa diberikan pada larva tiram mutiara yaitu jenis flagelata, berukuran kurang dari 10 mikron. Beberapa jenis alga yang umum diberikan untuk pakan antara lain Isochrysis galbana, Pavlova lutheri/Monochrysis lutheri, Chromulina sp., Chaetoceros sp., Nannochloropsis sp., dan Dicrateria sp. Untuk fase pertumbuhan sampai menjelang spat dapat diberi variasi berbagai jenis alga tersebut. Namun untuk stadia awal larva, jenis fitoplankton flagelata yang paling penting untuk pakan adalah I. galbana (Klas:
Haptophyceae) dengan ukuran sekitar 7 μm. Adakalanya digunakan jenis Tetraselmis tetrathele dan Chlorella sp., terutama untuk stadia spat atau sebagai pakan campuran induk (Alagarswami et al. 1987; Dharmaraj et al. 1991; Winanto el al. 2001; Winanto 2004). Menurut Martinez-Fernandez (2004) beberapa jenis mikroalga yang digunakan sebagai pakan larva Pteria sterna antara lain Nannochloris sp, Pavlova lutheri, Isochrysis galbana, Phaeodactilum tricornutum, Chaetoceros meulleri, Chaetoceros calcitran, Thalassiosira weisflogii, Dunaliella salina, Tetraselmis tetrathele, Tetraselmis suecica (Tabel 1). Namun mikroalga yang dapat dicerna oleh larva hanya Nannochloris sp., Pavlova lutheri dan Isochrysis galbana.
Tabel 1. Spesies mikroalga yang digunakan sebagai pakan larva Pteria sterna Kelompok
(Devisi) Kelas Spesies Ukuran (μm) Karakteristik
Diatom (Bacillariophyta) Alga hijau (Chlorophyta) Flagelata (Haptophyta) Bacillariophyceae Coscinodiscophyceae Chlorophyceae Prasinophyceae Prymnesiophyceae Phaeodactilum tricornutum (Bohlin) Chaetoceros meulleri (Paulsen) Takano C. calcitran (Lemmermann) Thalassiosira weisflogii (Grun) Dunaliella salina (Teodoresco) Nannochloris sp Tetraselmis tetrathele (G.S. West) T. suecica (Kylin) Isochrysis aff. galbana (Green)
Pavlova lutheri (Droop)
25 x 5 4–5 5 x 5 11 x 4 8–10 2–3 8 x 16 12–15 6–8 5
Sel memanjang, spines besar
Dinding sel kaku, spines besar
Sel besar motile, flagela dua
Sangat kecil, dinding sel berserat glikoprotein Sel besar motile, flagela 4 Dinding sel dilindungi bahan organik
Flagela dua, bentuk bulat – oval. Dinding sel dilapisi polisakarida
Sumber: Martinez-Fernandez (2004)
Preferensi larva terhadap pakan sangat tergantung pada ukuran dan spesies, masing–masing jenis tiram mempunyai kemampuan yang berbeda-beda dalam memilah dan mengambil makanan yang disukai. Pada prinsipnya, mikro alga yang digunakan sebagai pakan larva tiram atau organisme laut lainnya adalah mempunyai ukuran yang tepat untuk dimakan atau sesuai dengan bukaan mulut larva/spat, mudah dibudidayakan, cepat tumbuh dengan kepadatan tinggi dan tidak menghasilkan substansi racun (Coutteau 1996; Ponis et al. 2006).