PROSES PEMBENTUKAN KANTUNG MUTIARA
PADA TIRAM Pinctada maxima
LA EDDY
SEKOLAH PASCASARJANA
INSTITUT PERTANIAN BOGOR
PERNYATAAN MENGENAI DISERTASI DAN
SUMBER INFORMASI SERTA PELIMPAHAN HAK CIPTA*
Dengan ini saya menyatakan bahwa disertasi berjudul “Proses pembentukan kantung mutiara pada tiram Pinctada maxima” adalah benar karya saya dengan arahan dari komisi pembimbing dan belum diajukan dalam bentuk apa pun kepada perguruan tinggi mana pun. Sumber informasi yang berasal atau dikutip dari karya yang diterbitkan dari penulis lain telah disebutkan dalam teks dan dicantumkan dalam Daftar Pustaka di bagian akhir Disertasi ini.
Dengan ini saya melimpahkan hak cipta dari karya tulis saya kepada Institut Pertanian Bogor.
Bogor, Agustus 2014
La Eddy
NRP B161090081
RINGKASAN
LA EDDY. Proses pembentukan kantung mutiara pada tiram Pinctada maxima. Dibimbing oleh WASMEN MANALU, RIDWAN AFFANDI, dan NASTITI KUSUMORINI
Mutiara yang berkualitas sangat bergantung pada kantung mutiara yang terbentuk. Untuk mendapatkan kantung mutiara yang baik maka harus melakukan kajian tentang pemilihan saibo, posisi peletakan inti yang tepat, umur yang tepat untuk dijadikan saibo, jenis kelamin, dan tempat pemeliharaan selama perkembangan kantung mutiara.
Penelitian ini terdiri atas beberapa tahap yang bertujuan untuk mengetahui pengaruh penggunaan saibo yang berasal dari tiram jenis lain pada proses pembentukan kantung mutiara tiram Pinctada maxima, pengaruh posisi peletakan saibo dan inti yang berbeda pada proses pembentukan kantung mutiara tiram Pinctada maxima, pengaruh penggunaan saibo yang berasal dari tiram dengan umur yang berbeda pada proses pembentukan kantung mutiara tiram Pinctada maxima, pengaruh perbedaan jenis kelamin pada pembentukan kantung mutiara tiram Pinctada maxima, pengaruh kedalaman pada pembentukan kantung mutiara tiram Pinctada maxima. Parameter yang diukur dan diamati meliputi jumlah kumulatif tiram yang mengalami kematian dan penolakan inti, persentasi tiram yang berhasil membentuk kantung mutiara, kecepatan dan persentasi penutupan inti mutiara, konsumsi oksigen, kadar glukosa, kadar kalsium dan fosfor hemolimf, perkembangan histologis struktur kantung mutiara, data pendukung meliputi suhu, salinitas, dan pH air.
Hasil penelitian menunjukkan bahwa implantasi pada tiram Pinctada maxima dapat menggunakan saibo dari tiram jenis lain, pembentukan kantung mutiara pada penggunaan saibo tiram Pinctada margaritifera lebih baik bila dibandingkan dengan saibo tiram Pteria penguin dan saibo tiram Atrina vexillum. Pembentukan kantung mutiara dapat dilakukan pada bagian usus, anus, dan ventral gonad. Pembentukan kantung mutiara pada posisi implantasi inti di ventral gonad lebih baik bila dibandingkan dengan implantasi di bagian usus dan anus. Pembentukan kantung mutiara dengan menggunakan saibo dari tiram yang telah berumur 28 bulan lebih baik bila dibandingkan dengan saibo dari tiram yang berumur 14 dan 21 bulan. Pembentukan kantung mutiara pada tiram berjenis kelamin betina lebih baik bila dibandingkan dengan jenis kelamin jantan. Pembentukan kantung mutiara pada kedalaman 3 dan 6 meter lebih baik bila dibandingkan dengan kedalaman 9 dan 12 meter.
SUMMARY
LAEDDY. Pearls Sac Formation in Pinctada maxima Oyster. Supervised by WASMEN MANALU, RIDWAN AFFANDI, and NASTITI KUSUMORINI
Pearl quality in cultured pearl is determined by the pearl sac formed around the implanted nucleus. To get a good pearl sac formation, it was conducted a study on the selection of donor oyster as a source of saibo, position of implantation in the body of the host oyster, age of donor oyster as a donor of saibo, sex of the host oyster, and the depth of rearing of host oyster during the development of the pearl sac.
This study consisted of several steps to determine the effect of different species and genus of donor oysters, different positions of nucleus implantation, different ages of donor oyster, different sexes of host oysters, and different depths of rearing on the pearl sac formation in the Pinctada maxima host osyters. Parameters observed were the cumulative number of oysters that experience death and rejection of nucleus, percentage of successful oyster to form the pearl sac, speed of pearl sac growth and percentage of nucleus coverage by pearl sac, oxygen consumption, haemolymph glucose, calcium and phosphorus concentrations, histological structure of pearl sac development, marine water temperature, salinity, and pH.
The results showed that the Pinctada maxima oyster implantation can use other species and genuses of oysters as sources of saibo. Pearl sac formation in the Pinctada maxima host oyster implanted with saibo obtained from Pinctada margaritifera oyster was better when compared with those implanted with saibo obtained from Pteria penguin and Atrina vexillum donor oysters. Pearl sac formation can be done on the the intestine, anus, and ventral gonad. Pearl sac formation in the Pinctada maxima host oyster was better when nucleus was implanted in the ventral position of the gonads as compared when implantation was conducted at the intestine and anus. Pearl sac formation in Pinctada maxima host oyster was better when using saibo from donor oyster with the age of 28 months when compared with the ages of 14 and 21 months. Pearl sac formation in the female oyster was better than in the male oyster. Pearl sac formation was better when the host oyster was reared at a depth of 3 and 6 meters as compared to when the host oysters were reared at the depth of 9 and 12 meters.
© Hak Cipta Milik IPB, Tahun 2014
Hak Cipta Dilindungi Undang-Undang
Dilarang mengutip sebagian atau seluruh karya tulis ini tanpa mencantumkan atau menyebutkan sumbernya. Pengutipan hanya untuk kepentingan pendidikan, penelitian, penulisan karya ilmiah, penyusunan laporan, penulisan kritik, atau tinjauan suatu masalah; dan pengutipan tersebut tidak merugikan kepentingan IPB
Disertasi
sebagai salah satu syarat untuk memperoleh gelar Doktor
pada
Program Studi Ilmu-ilmu Faal dan Khasiat Obat
PROSES PEMBENTUKAN KANTUNG MUTIARA
PADA TIRAM Pinctada maxima
SEKOLAH PASCASARJANA INSTITUT PERTANIAN BOGOR
BOGOR 2014
Penguji pada Ujian Tertutup:
1. Dr drh. Damiana Rita Ekastuti, MS
Staf Pengajar Departemen AFF, Fakultas Kedokteran Hewan IPB 2. Dr.Ir. Fredinan Yulianda, M.Sc
Staf Pengajar Departemen MSP, Fakultas Perikanan dan Kelautan IPB
Penguji pada Ujian Terbuka : 1. Dr.drh.Yulvian Sani
Peneliti Madya pada BALITVET Bogor 2. Dr. Ir. Slamet Soebjakto, M.Si
Judul Disertasi : Proses pembentukan kantung mutiara pada tiram Pinctada maxima
Nama : La Eddy
NRP : B161090081
Disetujui oleh Komisi Pembimbing
Diketahui oleh
Tanggal ujian : 21 Juli 2014 Tanggal lulus : Prof. Ir.Wasmen Manalu, Ph.D
Ketua
Prof. Dr. Ir. Ridwan Affandi, DEA Anggota
Ketua Program Studi/Mayor Ilmu-ilmu Faal dan Khasiat Obat
Prof. Dr. Drh. Agik Suprayogi, M.Sc, AIF
Dekan Sekolah Pascasarjana
Dr. Ir. Dahrul Syah, M.ScAgr Dr. dra. Nastiti Kusumorini
PRAKATA
Puji dan syukur penulis panjatkan kepada Allah SWT atas segala karunia-Nya sehingga karya ilmiah ini berhasil diselesaikan. Penelitian ini dilaksanakan sejak bulan September 2011 sampai Desember 2012 dengan judul Proses Pembentukan Kantung Mutiara pada Tiram Pinctada Maxima.
Terima kasih penulis sampaikan kepada Bapak Prof. Ir. Wasmen Manalu, Ph.D, Bapak Prof. Dr. Ir. Ridwan Affandi, DEA dan Ibu Dr. Dra. Nastiti Kusumorini selaku komisi pembimbing yang telah banyak memberi saran. Terima kasih juga penulis sampaikan kepada Dr drh. Damiana Rita Ekastuti, MS dan Dr.Ir. Fredinan Yulianda, M.Sc selaku penguji luar komisi pada ujian sidang tertutup, serta Dr. drh.Yulvian Sani dan Dr. Ir. Slamet Soebjakto, M.Si selaku penguji luar komisi pada ujian sidang terbuka. Terima kasih penulis sampaikan kepada Bupati Kabupaten Halmahera Selatan dan Kepala Desa Baru, Kabupaten Halmahera Selatan. Di samping itu, penghargaan penulis sampaikan kepada seluruh staf pengajar Program Studi Ilmu-ilmu Faal dan Khasiat Obat IPB. Penghargaan penulis sampaikan juga kepada Pemilik, Manager dan seluruh karyawan perusahaan CV. Duta Aru Indah Cabang Pulau Obi (Pulau Garaga dan Teluk Dalam). Ibu Hj. Asmarida, Ibu Sri, dan Pak Wawan dari Laboratorium Fisiologi dan Farmakologi IPB, Bapak Edy Sukma Ramdani, Ibu Dian Anggraeni dari Laboratorium Nutrisi, Fakultas Peternakan IPB, atas bantuan dan kerja samanya. Terima kasih juga kepada rekan-rekan mahasiswa IFO dan Akuakultur yang telah banyak membantu penulis.
Ungkapan terima kasih juga disampaikan kepada ayah, ibu, mertua, istri, Dirwan, Lukman serta seluruh keluarga, atas doa dan kasih sayangnya.
Semoga karya ilmiah ini bermanfaat.
Bogor, Agustus 2014
DAFTAR ISI
Faktor-Faktor Ekologi yang Mempengaruhi Pertumbuhan Tiram
Mutiara 11
Fisiologi Pembentukan Mutiara 13
3 HISTOLOGI DAN PERUBAHAN FISIOLOGIS SELAMA
PEMBENTUKAN KANTUNG MUTIARA PADA TIRAM Pinctada maxima DENGAN IMPLANTASI SAIBO DARI GENUS DAN
4 HISTOLOGI DAN PERUBAHAN FISIOLOGI PEMBENTUKAN KANTUNG MUTIARA TIRAM Pinctada maxima YANG DIIMPLANTASI PADA USUS, ANUS, DAN VENTRAL GONAD 41
Pendahuluan 43 Pinctada maxima DENGAN MENGGUNAKAN SAIBO YANG
DIDAPATKAN DARI UMUR TIRAM YANG BERBEDA 62
Pendahuluan 64
Pinctada maxima JANTAN DAN BETINA 79
Bahan dan Metode 82
Hasil 83
Pembahasan 91
Simpulan 94
7 PEMBENTUKAN KANTUNG MUTIARA PADA TIRAM Pinctada maxima YANG DIPELIHARA PADA KEDALAMAN BERBEDA 94
Pendahuluan 96
1 Kerangka konseptual pendekatan masalah dan tahapan penelitian
pembentukan kantung mutiara. 4
2 Tiram mutiara Pinctada maxima (Winanto 2004). 5
3 Anatomi tubuh tiram Pinctada fucata yang terdiri atas otot adductor (AM), byssus (B), visceral mass (VM), Mantel (M), Mulut (F), proses pertumbuhan (GP), insang (G) (Acosta-Salmón et al. 2004). 6 4 Morfologi cangkang luar dan cangkang dalam tiram Pinctada maxima
(Wilbur dan Saleuddin 1983) 8
5 Fotograf zona mantel Pinctada margaritifera yang terdiri atas zona marginal (Mz), zona sentral (Cz), zona pallial (Pz), dan isthmus (It) (OF), outer epithelium (OE), periostracal groove (PG), periostracum
(P), ekstrapallial space (EPS). 10
8 Teori pembentukan mutiara secara alami (Strack 2006). 15 9 Peletakan inti pada dinding cangkang bagian dalam untuk
menghasilkan mutiara blister (setengah lingkaran). 16 10 Peletakan inti pada bagian ventral gonad untuk menghasilkan mutiara
bulat. 16
11 Berbagai macam warna mutiara yang dapat dihasilkan melalui budi
daya mutiara. 16
12 Berbagai macam ukuran, bentuk, permukaan, dan kilauan mutiara. 17 13 Deskripsi jenis saibo yang diambil dari beberapa jenis tiram Atrina
vexillum (A), Pteria penguin (B), Pinctada margaritifera (C), dan
Pinctada maxima (D). 24
14 Jumlah kumulatif tiram Pinctada maxima yang mengalami kematian selama 4 minggu setelah diimplantasi dengan saibo dari jenis tiram lain. Keterangan : saibo Atrina vexillum (), Pteria penguin (), Pinctada margaritifera (), Pinctada maxima (). 25 15 Jumlah kumulatif tiram Pinctada maxima yang mengalami kematian
selama 4 minggu setelah diimplantasi dengan saibo dari jenis tiram lain. Keterangan : saibo Atrina vexillum (), Pteria penguin (), Pinctada margaritifera (), Pinctada maxima (). 25 16 Persentase tiram Pinctada maxima yang berhasil membentuk kantung
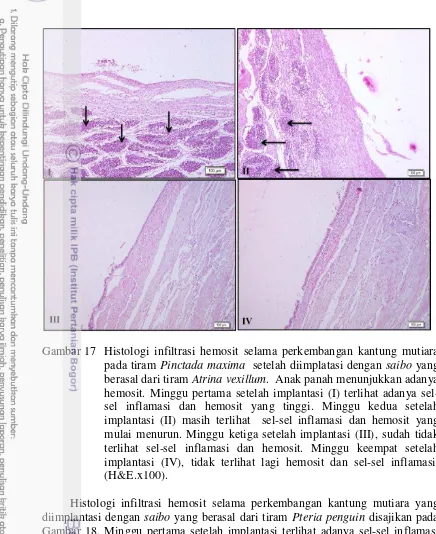
mutiara setelah 4 minggu diimplantasi dengan saibo dari jenis tiram lain. Keterangan : saibo tiram Atrina vexillum (), Pteria penguin (), Pinctada margaritifera (), Pinctada maxima (). 26 17 Histologi infiltrasi hemosit selama perkembangan kantung mutiara
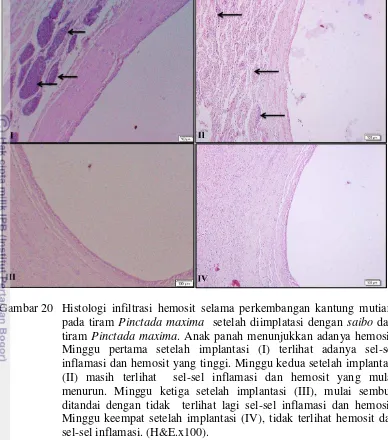
pada tiram Pinctada maxima setelah diimplatasi dengan saibo yang berasal dari tiram Atrina vexillum. Anak panah menunjukkan adanya hemosit. Minggu pertama setelah implantasi (I) terlihat adanya sel-sel inflamasi dan hemosit yang tinggi. Minggu kedua setelah implantasi (II) masih terlihat sel-sel inflamasi dan hemosit yang mulai menurun. Minggu ketiga setelah implantasi (III), sudah tidak terlihat sel-sel inflamasi dan hemosit. Minggu keempat setelah implantasi (IV), tidak terlihat lagi hemosit dan sel-sel inflamasi. (H&E.x100). 28 18 Histologi infiltrasi hemosit selama perkembangan kantung mutiara
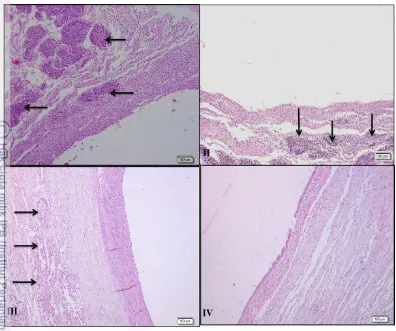
pada tiram Pinctada maxima setelah diimplatasi dengan saibo yang berasal dari tiram Pteria penguin. Anak panah menunjukkan adanya hemosit. Minggu pertama setelah implantasi (I) terlihat adanya sel-sel inflamasi dan hemosit yang tinggi. Minggu kedua setelah implantasi (II) masih terlihat sel-sel inflamasi dan hemosit yang mulai menurun. Minggu ketiga setelah implantasi (III), masih terlihat jumlah sel-sel inflamasi dan hemosit. Minggu keempat setelah implantasi (IV), tidak terlihat lagi hemosit dan sel-sel inflamasi. (H&E.x100). 29 19 Histologi infiltrasi hemosit selama perkembangan kantung mutiara
implantasi (II) masih terlihat sel-sel inflamasi dan hemosit yang mulai menurun. Minggu ketiga setelah implantasi (III), tidak terlihat jumlah sel-sel inflamasi dan hemosit (mulai sembuh). Minggu keempat setelah implantasi (IV), tidak terlihat lagi hemosit dan sel-sel
inflamasi. (H&E.x100). 30
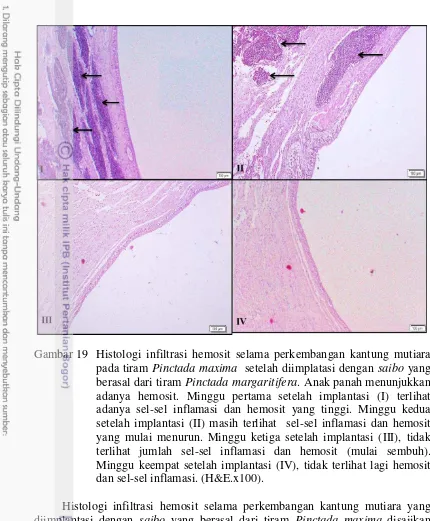
20 Histologi infiltrasi hemosit selama perkembangan kantung mutiara pada tiram Pinctada maxima setelah diimplatasi dengan saibo dari tiram Pinctada maxima. Anak panah menunjukkan adanya hemosit. Minggu pertama setelah implantasi (I) terlihat adanya sel-sel inflamasi dan hemosit yang tinggi. Minggu kedua setelah implantasi (II) masih terlihat sel-sel inflamasi dan hemosit yang mulai menurun. Minggu ketiga setelah implantasi (III), mulai sembuh ditandai dengan tidak terlihat lagi sel-sel inflamasi dan hemosit. Minggu keempat setelah implantasi (IV), tidak terlihat hemosit dan sel-sel inflamasi.
(H&E.x100). 31
21 Histologi perkembangan kantung mutiara selama 4 minggu pengamatan dengan perlakuan saibo tiram Atrina vexillum. Minggu pertama (21A), Minggu kedua (21B), Minggu ketiga (21C), dan Minggu keempat (21D): (a) Nukleus, (b) Lapisan sel-sel epitel mukosa yang terdiri atas sel-sel epitel kuboidal (c) Basement membrane, (d) Lapisan submukosa, (e) Tunika muskularis, (f) Vakuola, (g) Pyknosis, dan (h) Hemosit. (H&E. x400). 32 22 Histologi perkembangan kantung mutiara selama 4 minggu
pengamatan dengan perlakuan saibo tiram Pteria penguin. Keterangan: Minggu pertama (22A), Minggu kedua (22B), Minggu ketiga (22C), dan Minggu keempat (22D): (a) Nukleus, (b) Lapisan sel-sel epitel mukosa yang terdiri atas sel-sel epitel kuboidal (c) Basement membrane, (d) Lapisan submukosa, (e) Tunika muskularis, (f) Vakuola, (g) Pyknosis, dan (h) Hemosit. (H&E. x400). 33 23 Histologi perkembangan kantung mutiara selama 4 minggu
pengamatan dengan perlakuan saibo tiram Pinctada margaritifera. Keterangan : Minggu pertama (23A), Minggu kedua (23B), Minggu ketiga (23C) dan Minggu keempat (23D): (a) Nukleus, (b) Lapisan sel-sel epitel mukosa yang terdiri atas sel-sel epitel kuboidal (c) Basement membrane, (d) Lapisan submukosa, (e) Tunika muskularis, (f) Vakuola, dan (g) Pyknosis. (H&E. x400). 34 24 Histologi perkembangan kantung mutiara selama 4 minggu
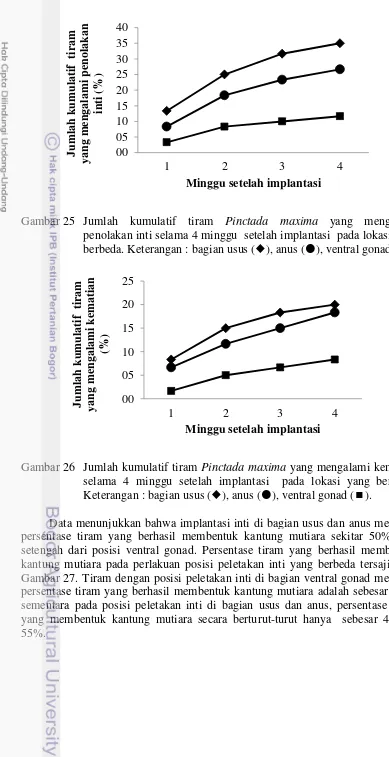
pengamatan dengan perlakuan saibo tiram Pinctada maxima. Keterangan : Minggu pertama (24A), Minggu kedua (24B), Minggu ketiga (24C), dan Minggu keempat (24D): (a) Nukleus, (b) Lapisan sel-sel epitel mukosa yang terdiri atas sel-sel epitel kuboidal (c) Basement membrane, (d) Lapisan submukosa, (e) Tunika muskularis, (f) Vakuola, (g) Pyknosis, dan (h) Hemosit. (H&E. x400). 35 25 Jumlah kumulatif tiram Pinctada maxima yang mengalami penolakan
26 Jumlah kumulatif tiram Pinctada maxima yang mengalami kematian selama 4 minggu setelah implantasi pada lokasi yang berbeda. Keterangan : bagian usus (), anus (), ventral gonad (). 46 27 Persentase tiram Pinctada maxima yang berhasil membentuk kantung
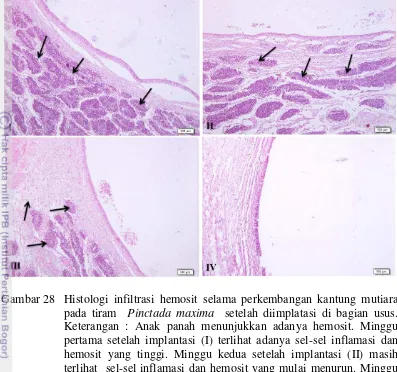
mutiara setelah 4 minggu implantasi pada lokasi berbeda. Keterangan: bagian usus (), anus () and ventral gonad (). 47 28 Histologi infiltrasi hemosit selama perkembangan kantung mutiara
pada tiram Pinctada maxima setelah diimplatasi di bagian usus. Keterangan : Anak panah menunjukkan adanya hemosit. Minggu pertama setelah implantasi (I) terlihat adanya sel-sel inflamasi dan hemosit yang tinggi. Minggu kedua setelah implantasi (II) masih terlihat sel-sel inflamasi dan hemosit yang mulai menurun. Minggu ketiga setelah implantasi (III), masih terlihat jumlah sel-sel inflamasi dan hemosit. Minggu keempat setelah implantasi (IV), tidak terlihat lagi hemosit dan sel-sel inflamasi yang terbentuk. (H&E.x100). 49 29 Histologi infiltrasi hemosit selama perkembangan kantung mutiara
pada tiram Pinctada maxima setelah diimplatasi di bagian anus. Keterangan: anak panah menunjukkan adanya hemosit. Minggu pertama setelah implantasi (I) terlihat adanya sel-sel inflamasi dan hemosit yang tinggi. Minggu kedua setelah implantasi (II) terlihat sel-sel inflamasi dan hemosit yang mulai menurun. Minggu ketiga setelah implantasi (III), jumlah sel-sel inflamasi dan hemosit sangat sedikit, luka mulai sembuh. Minggu keempat setelah implantasi (IV), tidak terlihat lagi hemosit dan sel-sel inflamasi, luka telah sembuh. (H&E.
x100). 50
30 Histologi infiltrasi hemosit selama perkembangan kantung mutiara pada tiram Pinctada maxima setelah diimplantasi di bagian ventral gonad. Keterangan: Anak panah menunjukkan adanya hemosit. Minggu pertama setelah implantasi (I) terlihat adanya sel-sel inflamasi dan hemosit yang tinggi. Minggu kedua setelah implantasi (II) jumlah sel-sel inflamasi dan hemosit sangat sedikit dan hampir tidak terlihat. Minggu ketiga setelah implantasi (III), tidak terlihat lagi sel-sel inflamasi dan hemosit. Minggu keempat setelah implantasi (IV), tidak terlihat lagi hemosit dan sel-sel inflamasi, jaringan telah sembuh
(H&E. x100). 51
31 Histologi perkembangan kantung mutiara selama 4 minggu pengamatan pada tiram Pinctada maxima yang diimplantasi di bagian usus. Keterangan: Minggu pertama (31A), Minggu kedua (31B), Minggu ketiga (31C) dan Minggu keempat (31D): (a) Nukleus, (b) Lapisan sel-sel epitel mukosa yang terdiri atas sel-sel epitel kuboidal (c) Basement membrane, (d) Lapisan submukosa, (e) Tunika muskularis, (f) Vakuola, dan (g) Pyknosis. (H&E. x400). 52 32 Histologi perkembangan kantung mutiara selama 4 minggu
Lapisan sel-sel epitel mukosa yang terdiri atas sel-sel epitel kuboidal (c) Basement membrane, (d) Lapisan submukosa, (e) Tunika muskularis, (f) Vakuola, dan (g) Pyknosis. (H&E. x400). 53 33 Histologi perkembangan kantung mutiara selama 4 minggu
pengamatan pada tiram Pinctada maxima yang diimplantasi di bagian ventral gonad. Keterangan : Minggu pertama (33A), Minggu kedua (33B), Minggu ketiga (33C) dan Minggu keempat (33D): (a) Nukleus, (b) Lapisan sel-sel epitel mukosa yang terdiri atas sel-sel epitel kuboidal (c) Basement membrane, (d) Lapisan submukosa, (e) Tunika muskularis, (f) Vakuola, dan (g) Pyknosis. (H&E. x400). 54 34 Jumlah kumulatif tiram mutiara yang mengalami kematian setelah
diimplantasi dengan menggunakan saibo yang berasal dari tiram dengan umur berbeda selama 4 minggu pengamatan. Keterangan : 14
bulan (), 21 bulan (), 28 bulan (). 66
35 Jumlah kumulatif tiram yang mengalami penolakan inti setelah diimplantasi dengan menggunakan saibo yang berasal dari tiram dengan umur berbeda selama 4 minggu pengamatan. Keterangan: 14
bulan (), 21 bulan (), 28 bulan (). 66
36 Persentase tiram yang berhasil membentuk kantung mutiara pada tiram Pinctada maxima setelah diimplantasi dengan menggunakan saibo yang berasal dari tiram dengan umur berbeda selama sebulan pengamatan. Keterangan : 14 bulan (), 21 bulan () dan 28 bulan
bulan (). 67
37 Histologi infiltrasi hemosit selama perkembangan mutiara pada tiram Pinctada maxima setelah diimplatasi dengan saibo yang berasal dari tiram yang berumur 14 bulan. Keterangan: Anak panah menunjukkan adanya hemosit. Minggu pertama setelah implantasi (I) terlihat adanya sel-sel inflamasi dan hemosit yang tinggi. Minggu kedua setelah implantasi (II) masih terlihat sel-sel inflamasi dan hemosit yang mulai menurun. Minggu ketiga setelah implantasi (III), masih terlihat jumlah sel-sel inflamasi dan hemosit. Minggu keempat setelah implantasi (IV), tidak terlihat lagi hemosit dan sel-sel inflamasi. (H&E. x100). 69 38 Histologi infiltrasi hemosit selama perkembangan mutiara pada tiram
Pinctada maxima setelah diimplatasi dengan saibo yang berasal dari tiram yang berumur 21 bulan. Keterangan: Anak panah menunjukkan adanya hemosit. Minggu pertama setelah implantasi (I) terlihat adanya sel-sel inflamasi dan hemosit yang tinggi. Minggu kedua setelah implantasi (II) terlihat sel-sel inflamasi dan hemosit yang mulai menurun. Minggu ketiga setelah implantasi (III), jumlah sel-sel inflamasi dan hemosit sangat sedikit, luka mulai sembuh. Minggu keempat setelah implantasi (IV), tidak terlihat lagi hemosit dan sel-sel inflamasi, luka telah sembuh. (H&E. x100). 70 39 Histologi infiltrasi hemosit selama perkembangan mutiara pada tiram
sel-sel inflamasi dan hemosit yang tinggi. Minggu kedua setelah implantasi (II) jumlah sel-sel inflamasi dan hemosit yang mulai menurun. Minggu ketiga setelah implantasi (III), tidak terlihat lagi sel-sel inflamasi dan hemosit. Minggu keempat setelah implantasi (IV), tidak terlihat lagi hemosit dan sel-sel inflamasi, jaringan telah sembuh
(H&E. x100). 71
40 Histologis perkembangan kantung mutiara dengan menggunakan saibo tiram Pinctada maxima yang telah berumur 14 bulan. Keterangan : Minggu pertama (40A), Minggu kedua (40B), Minggu ketiga (40C) dan Minggu keempat (40D): (a) Nukleus, (b) Lapisan sel-sel epitel mukosa yang terdiri atas sel-sel epitel kuboidal (c) Basement membrane, (d) Lapisan submukosa, (e) Tunika muskularis, (f) Vakuola (g) Pyknosis, dan (h) Hemosit. (H&E. x400). 72 41 Histologi perkembangan kantung mutiara dengan menggunakan saibo
tiram Pinctada maxima yang telah berumur 21 bulan. Keterangan: Minggu pertama (41A), Minggu kedua (41B), Minggu ketiga (41C) dan Minggu keempat (41D): (a) Nukleus, (b) Lapisan sel-sel epitel mukosa yang terdiri atas sel-sel epitel kuboidal, (c) Basement membrane, (d) Lapisan submukosa, (e) Tunika muskularis, (f) Vakuola (g) Pyknosis, dan (h) Hemosit. (H&E. x400). 73 42 Histologi perkembangan kantung mutiara dengan menggunakan saibo
tiram Pinctada maxima yang telah berumur 28 bulan. Keterangan: Minggu pertama (42A), Minggu kedua (42B), Minggu ketiga (42C) dan Minggu keempat (42D): (a) Nukleus, (b) Lapisan sel-sel epitel mukosa yang terdiri atas sel-sel epitel kuboidal (c) Basement membrane, (d) Lapisan submukosa, (e) Tunika muskularis, (f) Vakuola, (g) Pyknosis, dan (h) Hemosit. (H&E. x400). 74 43 Jumlah kumulatif tiram Pinctada maxima yang mengalami kematian
selama 4 minggu implantasi pada jenis kelamin berbeda. Keterangan : tiram jantan (--), dan betina (∙∙∙∙). 83 44 Jumlah kumulatif tiram Pinctada maxima yang mengalami penolakan
inti selama 4 minggu implantasi pada jenis kelamin berbeda. Keterangan : tiram jantan (--), dan betina (∙∙∙∙). 84 45 Persentase tiram Pinctada maxima yang berhasil membentuk kantung
mutiara selama 4 minggu implantasi dengan jenis kelamin berbeda. Keterangan : tiram jantan () dan betina (). 84 46 Histologi infiltrasi hemosit selama perkembangan kantung mutiara
47 Histologi infiltrasi hemosit selama perkembangan kantung mutiara pada tiram Pinctada maxima betina. Keterangan: Anak panah menunjukkan adanya hemosit. Minggu pertama setelah implantasi (I) terlihat adanya sel-sel inflamasi dan hemosit yang tinggi. Minggu kedua setelah implantasi (II) terlihat sel-sel inflamasi dan hemosit yang mulai menurun. Minggu ketiga setelah implantasi (III), jumlah sel-sel inflamasi dan hemosit sudah tidak terlihat, luka mulai sembuh. Minggu keempat setelah implantasi (IV), tidak terlihat lagi hemosit dan sel-sel inflamasi, luka telah sembuh. (H&E.x100). 87 48 Histologi perkembangan kantung mutiara selama 4 minggu
pengamatan pada tiram betina. Keterangan: Minggu pertama (48A), Minggu kedua (48B), Minggu ketiga (48C) dan Minggu keempat (48D): (a) Nukleus, (b) Lapisan sel-sel epitel mukosa yang terdiri atas sel-sel epitel kuboidal (c) Basement membrane, (d) Lapisan submukosa, (e) Tunika muskularis, (f) Vakuola, (g) Pyknosis, dan (h)
Hemosit (H&E. x400). 88
49 Histologi perkembangan kantung mutiara selama 4 minggu pengamatan pada tiram jantan. Keterangan: Minggu pertama (49A), Minggu kedua (49B), Minggu ketiga (49C) dan Minggu keempat (49D): (a) Nukleus, (b) Lapisan sel-sel epitel mukosa yang terdiri atas sel-sel epitel kuboidal (c) Basement membrane, (d) Lapisan submukosa, (e) Tunika muskularis, (f) Vakuola, (g) Pyknosis dan (h)
hemosit (H&E. x400). 89
50 Jumlah kumulatif tiram mutiara yang mengalami kematian setiap minggu selama sebulan pengamatan yang dipelihara pada kedalaman berbeda. Keterangan: 3 meter (), 6 meter (), 9 meter (), 12
meter (). 98
51 Jumlah kumulatif tiram mutiara yang mengalami penolakan inti setiap minggu selama sebulan pengamatan yang dipelihara pada kedalaman berbeda. Keterangan : 3 meter (), 6 meter (), 9 meter (), 12
meter (). 99
52 Persentase tiram yang berhasil membentuk kantung mutiara tiram Pinctada maxima selama sebulan yang dipelihara pada kedalaman berbeda. Keterangan: 3 meter (), 6 meter (), 9 meter (), 12 meter
(). 99
53 Histologi infiltrasi hemosit selama perkembangan kantung mutiara pada tiram Pinctada maxima yang dipelihara pada kedalaman 3 meter selama 4 minggu pengamatan. Keterangan: Anak panah menunjukkan adanya hemosit. Minggu pertama setelah implantasi (I) terlihat adanya sel-sel inflamasi dan hemosit yang tinggi. Minggu kedua setelah implantasi (II) masih terlihat sel-sel inflamasi namun mulai menurun. Minggu ketiga setelah implantasi (III), tidak terlihat lagi inflamasi dan hemosit. Minggu keempat setelah implantasi (IV), luka sayatan saat
operasi inti telah sembuh. (H&E.x100). 101
selama 4 minggu pengamatan. Keterangan: Anak panah menunjukkan adanya hemosit. Minggu pertama setelah implantasi (I) terlihat adanya sel-sel inflamasi dan hemosit yang tinggi. Minggu kedua setelah implantasi (II) masih terlihat sel-sel inflamasi namun mulai menurun. Minggu ketiga setelah implantasi (III), tidak terlihat lagi inflamasi dan hemosit. Minggu keempat setelah implantasi (IV), luka sayatan saat
operasi inti telah sembuh. (H&E.x100). 102
55 Histologi infiltrasi hemosit selama perkembangan kantung mutiara pada tiram Pinctada maxima yang dipelihara pada kedalaman 9 meter selama 4 minggu pengamatan. Keterangan: Anak panah menunjukkan adanya hemosit. Minggu pertama setelah implantasi (I) terlihat adanya sel-sel inflamasi dan hemosit yang tinggi. Minggu kedua setelah implantasi (II) masih terlihat sel-sel inflamasi namun mulai menurun. Minggu ketiga setelah implantasi (III), masih ada terlihat inflamasi dan hemosit. Minggu keempat setelah implantasi (IV), luka sayatan saat operasi inti telah sembuh. (H&E.x100). 103 56 Histologi infiltrasi hemosit selama perkembangan kantung mutiara
pada tiram Pinctada maxima yang dipelihara pada kedalaman 12 meter selama 4 minggu pengamatan. Keterangan: Anak panah menunjukkan adanya hemosit. Minggu pertama setelah implantasi (I) terlihat adanya sel-sel inflamasi dan hemosit yang tinggi. Minggu kedua setelah implantasi (II) jumlah sel-sel inflamasi dan hemosit yang mulai menurun. Minggu ketiga setelah implantasi (III), masih ada sel-sel inflamasi dan hemosit. Minggu keempat setelah implantasi (IV), tidak terlihat lagi hemosit dan sel-sel inflamasi dan jaringan
telah sembuh (H&E.x100). 104
57 Histologi perkembangan kantung mutiara pada tiram Pinctada maxima yang dipelihara pada kedalaman 3 meter selama 4 minggu pengamatan. Keterangan: Minggu pertama (57A), minggu kedua (57B), minggu ketiga (57C) dan minggu keempat (57D): (a) Nukleus, (b) Lapisan sel-sel epitel mukosa yang terdiri atas sel-sel epitel kuboidal (c) Basement membrane, (d) Lapisan submukosa, (e) Tunika muskularis, (f) Vakuola, (g) Pyknosis dan (h) Hemosit. (H&E. x400). 105 58 Histologi perkembangan kantung mutiara pada tiram Pinctada
maxima yang dipelihara pada kedalaman 6 meter selama 4 minggu pengamatan. Keterangan: Minggu pertama (58A), minggu kedua (58B), minggu ketiga (58C) dan minggu keempat (58D): (a) Nukleus, (b) Lapisan sel-sel epitel mukosa yang terdiri atas sel-sel epitel kuboidal (c) Basement membrane, (d) Lapisan submukosa, (e) Tunika muskularis, (f) Vakuola, (g) Pyknosis dan (h) Hemosit. (H&E. x400). 106 59 Histologi perkembangan kantung mutiara pada tiram Pinctada
kuboidal (c) Basement membrane, (d) Lapisan submukosa, (e) Tunika muskularis, (f) Vakuola, (g) Pyknosis, dan (h) Hemosit. (H&E. x400). 107 60 Histologi perkembangan kantung mutiara pada tiram Pinctada
maxima yang dipelihara pada kedalaman 12 meter selama 4 minggu pengamatan. Keterangan: Minggu pertama (60A), minggu kedua (60B), minggu ketiga (60C) dan minggu keempat (60D): (a) Nukleus, (b) Lapisan sel-sel epitel mukosa yang terdiri atas sel-sel epitel kuboidal (c) Basement membrane, (d) Lapisan submukosa, (e) Tunika muskularis, (f) Vakuola, (g) Pyknosis, dan (h) Hemosit. (H&E. x400). 108
DAFTAR TABEL
1 Rataan kecepatan saibo mengelilingi inti mutiara dan persentase penutupan inti pada tiram Pinctada maxima dengan menggunakan saibo yang diambil dari tiram Atrina vexillum, Pteria penguin, Pinctada margaritifera, dan Pinctada maxima 27 2 Rataan kuantitatif infiltrasi hemosit, jumlah lapisan sel-sel epitel,
jumlah sel-sel epitel yang mengalami pyknosis dan vakuola pada tiram Pinctada maxima dengan menggunakan saibo yang diambil dari tiram Atrina vexillum, Pteria penguin, Pinctada margaritifera dan Pinctada maxima 36
3 Rataan konsumsi oksigen, kadar glukosa, kalsium, dan fosfor hemolimf pada tiram Pinctada maxima dengan menggunakan saibo yang diambil dari tiram Atrina vexillum, Pteria penguin, Pinctada
margaritifera, dan Pinctada maxima 37
4 Rataan kecepatan saibo mengelilingi inti mutiara dan persentase penutupan inti pada tiram Pinctada maxima dengan posisi peletakan
inti yang berbeda 48
5 Rataan kuantitatif infiltrasi hemosit, jumlah lapisan sel-sel epitel, jumlah sel-sel epitel yang mengalami pyknosis dan vakuola pada tiram Pinctada maxima dengan posisi implantasi yang berbeda 55 6 Rataan konsumsi oksigen, kadar glukosa, kadar kalsium, dan kadar
fosfor hemolimf pada tiram Pinctada maxima dengan posisi
peletakan inti yang berbeda. 56
7 Rataan kecepatan saibo mengelilingi inti mutiara dan persentase penutupan inti pada tiram Pinctada maxima dengan perlakuan umur saibo yang berbeda selama 4 minggu pengamatan. 68 8 Rataan kuantitatif infiltrasi hemosit, jumlah lapisan sel-sel epitel,
jumlah sel-sel epitel yang mengalami pyknosis dan vakuola pada tiram Pinctada maxima dengan dengan perlakuan umur saibo yang berbeda
selama 4 minggu pengamatan. 75
10 Rataan kecepatan saibo mengelilingi inti mutiara dan rataan persentase penutupan inti mutiara pada tiram Pinctada maxima jantan
dan betina selama 4 minggu pengamatan. 85
11 Rataan kuantitatif infiltrasi hemosit, jumlah lapisan sel-sel epitel, jumlah sel-sel epitel yang mengalami pyknosis dan vakuola pada tiram
Pinctada maxima jantan dan betina 90
12 Rataan konsumsi oksigen, kadar glukosa, kadar kalsium dan fosfor hemolimf pada tiram Pinctada maxima jantan dan betina selama 4
minggu pengamatan. 91
13 Rataan kecepatan saibo mengelilingi inti mutiara dan persentase penutupan inti pada tiram Pinctada maxima yang dipelihara pada kedalaman berbeda selama 4 minggu pengamatan. 100 14 Rataan kuantitatif infiltrasi hemosit, jumlah lapisan sel-sel epitel,
jumlah sel-sel epitel yang mengalami pyknosis dan vakuola pada tiram Pinctada maxima yang dipelihara pada kedalaman berbeda selama 4
minggu pengamatan. 109
15 Kelimpahan plankton di lokasi pemeliharaan tiram Pinctada maxima. 110 16 Rataan konsumsi oksigen, rataan kadar glukosa, kadar kalsium, dan
kadar fosfor hemolimf pada tiram Pinctada maxima yang dipelihara pada kedalaman berbeda selama 4 minggu pengamatan. 111
DAFTAR LAMPIRAN
1 Prosedur kerja penelitian 127
2 Prosedur penentuan parameter pengamatan 128
1 PENDAHULUAN
Latar Belakang
Tiram merupakan salah satu moluska yang dapat menghasilkan mutiara, tetapi tidak semua tiram dapat menghasilkan mutiara yang bagus dan memiliki nilai jual yang tinggi. Tiram penghasil mutiara umumnya berasal dari famili Pteriidae, beberapa jenis famili ini dapat ditemukan di perairan laut Indonesia seperti Pinctada maxima, Pinctada margaritifera, Pinctada fucata, Pinctada chimnitzii, dan Pteria penguin (Winanto 2009).
Mutiara dapat dihasilkan secara alami dan budi daya. Teori pembentukan mutiara alami terjadi akibat adanya partikel padat yang terjebak dalam tubuh tiram, terutama di antara bagian mantel dan cangkang bagian dalam. Mantel kemudian menyelubungi partikel padat tersebut dan bagian mantel inilah yang disebut sebagai kantung mutiara. Namun, belum ada bukti ilmiah yang mendukung teori ini karena dari beberapa mutiara alami yang dibedah menunjukkan bahwa bagian inti mutiara bukanlah partikel padat (Strack 2006).
Mutiara hasil budi daya akan melewati serangkaian proses dengan campur tangan manusia. Bentuk rekayasa ini dikenal dengan istilah implantation atau implantasi, yaitu menyisipkan inti mutiara bersama saibo (irisan mantel tiram mutiara lain) ke dinding gonad tiram mutiara. Mantel yang dijadikan saibo diambil dari zona pallial mantel karena zona ini berisi banyak jaringan saraf dan arteri pallial. Saibo yang disisipkan akan berkembang mengelilingi inti menyerupai kantung sehingga disebut kantung mutiara (Acosta-Salmón dan Southgate 2005). Selain saibo, pembentukan mutiara melibatkan peran nacre pada cangkang. Nacre merupakan bagian permukaan yang berkilau dari mutiara atau bagian yang berkilau dari dalam cangkang. Komposisi nacre pada cangkang adalah 95-99% kalsium karbonat dan 1-5% matriks organik (Duplat et al. 2006). Nacre pada cangkang diistilahkan sebagai mother of pearl (ibu dari mutiara) sedangkan nacre yang melekat di inti disebut mutiara (Mamangkey dan Southgate 2009).
mempengaruhi hasil akhir mutiara, seperti warna, kulit, bentuk, deposisi nacre, dan bobot mutiara. Deposisi nacre ditemukan lebih tinggi di xenografts yang terdiri atas Pinctada maxima sebagai donor dan Pinctada margaritifera sebagai tiram inang (host) dari pada xenograft timbal balik dan allografts. Warna dan permukaan mutiara juga sangat dipengaruhi oleh jenis tiram donor yang digunakan sebagai xenografts, misalnya tiram Pinctada maxima sebagai tiram inang (host) yang diimplantasi dengan saibo dari Pinctada margaritifera hasilnya akan memproduksi lebih banyak mutiara berwarna hitam dan bila sebaliknya maka akan memproduksi mutiara berwarna perak (McGinty et al. 2010). Kajian tentang umur tiram yang akan dijadikan saibo sampai saat ini masih terus dilakukan. Sayatan histologis mantel tiram Pinctada fucata yang telah berumur 1 tahun dan 7 tahun memperlihatkan adanya conchiolin secretion atau protein yang terlibat dalam pelapisan mutiara sehingga dapat disimpulkan bahwa secara in vivo tiram Pinctada fucata yang telah berumur 7 tahun memiliki kemampuan regenerasi mantel yang lebih baik sehingga dapat dijadikan sebagai tiram donor. Namun, penelitian ini masih perlu dibuktikan karena harus dilanjutkan ke proses implantasi saibo sehingga dapat diketahui pembentukan kantung mutiara (Rao et al. 2010).
Saibo yang telah terimplantasi akan berkembang menyerupai kantung yang mengelilingi inti kemudian mensekresikan bahan-bahan yang diperlukan pada pelapisan mutiara. Secara histologi, pada tiram Pinctada margaritifera Polynesia Prancis terlihat bahwa bagian dalam mantel (innermantel) mengalami degradasi dan hanya tersisa bagian luar mantel (outer mantel). Bagian luar mantel inilah yang akan mengalami pertumbuhan dan perkembangan kemudian membentuk kantung mutiara yang membutuhkan waktu rata-rata sekitar 30 hari. Waktu yang dibutuhkan untuk pembentukan kantung mutiara sering kali berbeda-beda pada setiap tiram, bila terlalu lama maka akan mempengaruhi kualitas mutiara karena mengurangi waktu proses pelapisan inti (Cochennec-Laureau et al. 2010).
Tujuan Penelitian
Penelitian ini bertujuan untuk mengkaji proses fisiologis pembentukan kantung mutiara pada tiram Pinctada maxima dengan beberapa faktor penentu pada saibo dan faktor kedalaman. Penelitian ini dilakukan dengan lima tahap yang terdiri atas :
a. Penelitian tahap I bertujuan untuk mengetahui pengaruh penggunaan saibo yang berasal dari tiram jenis lain pada proses pembentukan kantung mutiara tiram Pinctada maxima.
b. Penelitian tahap II bertujuan untuk mengetahui pengaruh posisi peletakan saibo dan inti yang berbeda pada proses pembentukan kantung mutiara tiram Pinctada maxima.
c. Penelitian tahap III bertujuan untuk mengetahui pengaruh penggunaan saibo yang berasal dari tiram dengan umur yang berbeda pada proses pembentukan kantung mutiara tiram Pinctada maxima.
d. Penelitian tahap IV bertujuan untuk mengetahui pengaruh perbedaan jenis kelamin tiram inang pada pembentukan kantung mutiara tiram Pinctada maxima.
e. Penelitian tahap V bertujuan untuk mengetahui pengaruh kedalaman pada pembentukan kantung mutiara tiram Pinctada maxima.
Manfaat Penelitian
Informasi yang diperoleh dari penelitian ini akan melengkapi data biologis dan fisiologi pada budi daya mutiara. Selain itu, temuan ini diharapkan dapat digunakan sebagai dasar teknik implantasi mutiara agar mendapatkan mutiara secara efektif dan efisien dengan kualitas maksimal.
Kebaruan Penelitian (Novelty)
Belum pernah dilaporkan penelitian tentang fisiologis pembentukan kantung mutiara dengan menggunakan saibo dari jenis tiram lain, lokasi implantasi inti yang berbeda, perbedaan jenis kelamin dan kedalaman dengan profil kadar glukosa, kadar kalsium, dan fosfor hemolimf pada tiram inang Pinctada maxima.
2 TINJAUAN PUSTAKA
Jenis-Jenis Tiram Mutiara
Tiram Pinctada maxima (Gambar 2) termasuk dalam filum mollusca dan famili Pteriidae dengan klasifikasi sebagai berikut (Tëmkin 2006)
Filum : Mollusca Kelas : Pelecypoda
Ordo : Anycomyria
Famili : Pteriidae Genus : Pinctada
Spesies : Pinctada maxima
Gambar 2 Tiram mutiara Pinctada maxima (Winanto 2004).
Famili ini umumnya dapat menghasilkan mutiara. Ciri morfologi tiram Pinctada maxima adalah tubuhnya dilindungi oleh sepasang cangkang yang tipis dan keras. Selain jenis ini, ada beberapa jenis tiram mutiara yang dapat ditemukan di perairan Indonesia, yakni Pinctada margaritifera, Pinctada fucata, Pinctada chimnitzii, dan Pteria penguin. Semua anggota famili ini hidup di laut. Moluska lain penghasil mutiara yang sejauh ini dikenal berasal dari kelompok abalone dan beberapa gastropoda lain serta beberapa jenis bivalvia air tawar (Winanto 2004).
Pada prinsipnya, semua molluska bercangkang dapat menghasilkan mutiara, akan tetapi tidak semua dapat menghasilkan mutiara yang baik dan memiliki kualitas tinggi. Mutiara yang dihasilkan dari jenis bivalvia air tawar memiliki nilai jual yang rendah dibandingkan mutiara yang dihasilkan tiram air laut.
Anatomi Tubuh Tiram Mutiara
hewan yang memiliki otot tunggal dengan fungsi untuk membuka dan menutup cangkang. Secara keseluruhan tubuh internal tiram mutiara tersaji pada Gambar 3.
Gambar 3 Anatomi tubuh tiram Pinctada fucata yang terdiri atas otot adductor (AM), byssus (B), visceral mass (VM), Mantel (M), Mulut (F), proses pertumbuhan cangkang (GP), insang (G) (Acosta-Salmón et al. 2004). Tiram mutiara memiliki serabut otot adduktor posterior, terletak melintang di setiap katup, berbentuk seperti baji dan berakhir sempit tepat di belakang ventrikel jantung. Bagian terminal rektum menjulur sepanjang garis tengah permukaan posterior, dengan dua daerah yang berbeda, yaitu satu strip tendonous sempit yang terbuat dari serat putih berkilau membentuk batas posterior dan yang lain terdiri atas serat semitranslucent (Saucedo et al. 2008), sedangkan kaki memiliki berkas otot retraktor yang simetris sepanjang horizontal tubuh. Otot-otot yang berbentuk V dan berasal dari kelenjar byssal melekat pada kanan dan kiri katup cangkang bagian dalam. Kaki memiliki empat levators, dua anterior dan dua posterior. Kontraksi levator anterior menyebabkan kaki dapat ditarik kembali dan mengangkat bagian punggung, sedangkan levator posterior berada setingkat dengan mulut dan tidak terlalu penting. Otot-otot branchial menyebabkan pemendekan insang dan penarikan kaki posterior.
Tiram mutiara bersifat filter feeder atau mengambil makanan dengan jalan menyaring pakan yang ada di dalam air laut. Getaran silia pada insang menimbulkan arus air yang masuk ke dalam rongga mantel. Gerakan silia akan memindahkan fitoplankton yang berada di sekeliling insang. Labial palp atau simpul bibir akan membawa masuk makanan ke dalam mulut (Saucedo et al. 2008).
Mulut terletak pada bagian ujung depan saluran pencernaan atau di sebelah atas kaki. Makanan yang ditelan masuk ke dalam mulut kemudian melalui kerongkongan yang pendek langsung masuk ke perut, atau saluran kantong tipis pada perut dengan kulit luar (cuticle) kasar yang berfungsi untuk memisah-misahkan makanan. Dari perut sisa makanan (kotoran) akan dibuang melalui saluran usus yang relatif pendek dan bentuknya seperti huruf S kemudian keluar lewat anus (Saucedo et al. 2008).
Jantung terdiri atas ventrikel tunggal dan sepasang kontraktil auricles berdinding tipis. Jantung menerima darah dari tubuh (insang dan mantel) masuk ke ventrikel jantung, aliran darah balik dicegah oleh semacam katup, kemudian darah dialirkan lewat aorta anterior dan posterior dan, akhirnya darah dialirkan ke otot adduktor, rektum, dan anus. Darah dialirkan ke seluruh tubuh dengan aorta anterior melalui serangkaian arteri kecil dan bersirkulasi perlahan-lahan, sedangkan darah deoksigenasi dikumpulkan dalam vena kemudian dibawa ke dalam insang atau organ ekskretoris. Darah dari ginjal dialirkan ke mantel dan hati. Selanjutnya darah kembali ke jantung melalui vena branchial eferen. Darah dari tiram mutiara tidak berwarna (Saucedo et al. 2008). Sistem ekskresi tiram mutiara terdiri atas sepasang kelenjar nephridia dan banyak perikardial kecil dari proyeksi dinding auricles. Setiap nephridium terhubung ke perikardium dengan saluran lebar. Pericardial merupakan kelenjar aksesori di dinding auricles yang memiliki fungsi sekretoris. Sistem saraf tiram mutiara berbentuk lateral simetris dan memiliki tiga pasang ganglia yang terdiri atas ganglia otak pada sisi kerongkongan, pedal bergabung untuk membentuk ganglion tunggal di dasar kaki dan ganglia parieto-splanknik pada permukaan anterior otot adduktor.
Bagian Cangkang
Tiram mutiara memiliki sepasang cangkang yang berfungsi melindungi organ bagian dalam, terbentuk sejak masih larva yang mengalami tiga tahap metamorfosis, yakni tahap prodissconch I, prodissconch II, dan tahap dissconch. Tahap prodissconch I terjadi saat gastrulasi, tepatnya fase trochopore (fase ini membentuk sel epitel yang tebal pada bidang periostracum). Cangkang telah mengandung amorphous calcium carbonate sejak tahap prodissconch I, aragonite pada tahap prodissconch II, dan pembentukan kristal seperti calcite atau aragonite pada tahap dissconch (Gardner 2008). Pada spesies Pinctada maxima, cangkang dihubungkan oleh semacam engsel berwarna hitam, memiliki diameter dorso-ventral anterior-pasterior hampir sama sehingga bentuknya agak bundar, seperti tersaji pada Gambar 4.
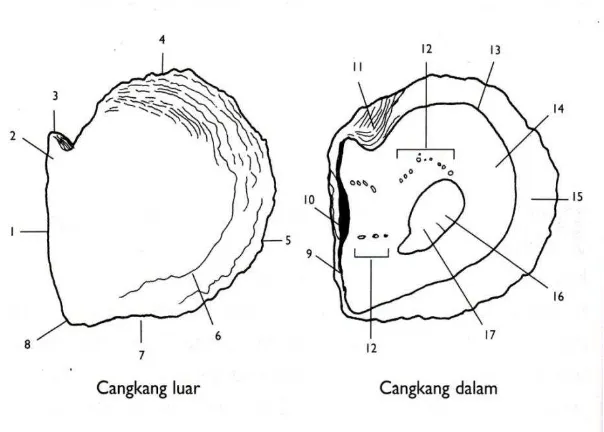
Gambar 4 Morfologi cangkang luar dan cangkang dalam tiram Pinctada maxima (Wilbur dan Saleuddin 1983)
Keterangan:
.
Bagian Mantel
Mantel adalah organ tubuh tiram yang menutupi organ bagian dalam dan sebagian melekat dengan otot aduktor. Secara makro, mantel terdiri atas 4 zona, yaitu zona sentral, zona marginal, zona pallial, dan isthmus (tersaji pada Gambar 5). Zona sentral berfungsi untuk melindungi organ dalam, zona marginal merupakan zona bagian luar yang berhubungan dengan periostracal groove, isthmus berhubungan dengan engsel bagian dalam, serta zona pallial yang sangat
1. 1. Dorsal margin (tepi bawah) 2. β. Umbo
3. γ. Anterior ear (telinga depan) 4. 4. Anterior margin (tepi depan) 5. 5. Ventral margin (tepi atas)
6. 6. Growth line (garis pertumbuhan)
7. 7. Posterior margin (tepi belakang) 8. 8. Posterior ear (telinga belakang) 9. 9. Hinge line (garis engsel)
10. 10. Ligamen
11. Byssus notch (takik bisus)
1β. Impressions of pallial muscles (bekas otot pallial) 1γ. Pallial line (garis pallial)
14. Nacre
15. Non-nacreous border (batas bukan nacre)
16. Impression of adductor (bekas otot aduktor)
penting karena dipakai sebagai saibo ketika implantasi dilakukan serta berisi jaringan saraf dan arteri pallial (Acosta-Salmón dan Southgate 2005).
Gambar 5 Fotograf zona mantel Pinctada margaritifera yang terdiri atas zona marginal (Mz), zona sentral (Cz), zona pallial (Pz), dan isthmus (It) (Acosta-Salmón dan Southgate 2005).
Mantel mempunyai peranan penting dalam mineralisasi cangkang dan pelapisan mutiara, karena terdiri atas sel-sel epitel yang dapat meregulasi ion-ion dari lingkungan yang melewati insang, kemudian hemolimf, diteruskan ke bagian luar epitel mantel dan masuk ke bagian dalam epitel mantel. Ion-ion melewati mantel selama mineralisasi yang dapat dilakukan dengan beberapa cara, yaitu secara pasif ke gradien elektrokimia, transport aktif, dan pergerakan Ca yang harus bergandengan dengan ion lain. Epitel mantel bagian luar sebagian melekat pada cangkang (periostracum) dan sebagian lagi menjulur ke lingkungan, mengandung sel kuboiodal yang dilingkari oleh sel-sel mukus, hal yang sama juga ada pada bagian epitel mantel lainnya. Bagian-bagian mantel yang berhubungan dengan cangkang tersaji pada Gambar 6 (Wilbur dan Saleuddin 1983).
Secara histologi, mantel terdiri atas selaput jaringan penghubung yang dilindungi sel-sel epitel, bagian yang berhubungan dengan cangkang sebelah dalam disebut epitel luar, mengeluarkan zat kapur untuk membentuk cangkang. Sel epitel luar ini juga menghasilkan kristal kalsium karbonat (CaCO3) dalam bentuk kristal aragonit, lebih dikenal sebagai ―nacre‖ dan kristal heksagonal kalsite yang merupakan pembentuk lapisan seperti prisma pada cangkang. Sel-sel ini juga mengeluarkan zat organik dan protein yang disebut conchiolin (C32H48N2O11), dengan bahan kristal yang mengandung kapur sebagai perekat dan seperti lendir (Cahn 1949).
Menurut Marin et al. (2007) cairan diseksresikan ke dalam ekstrapallial selama proses mineralisasi dan merupakan bagian penting dalam proses perkembangan cangkang.
Gambar 6 Bagian mantel dan cangkang (Wilbur dan Saleuddin 1983). Keterangan : lapisan cangkang prismatic (PR), lapisan nacreus cangkang (NC), pallial line (PL), pallial muscle (PM), inner epithelium (IM), mucosa cell (MC), pallial nerve (PN), longitudinal pallial muscle (LPM), inner fold (IF), middle fold (MF), outer fold (OF), outer epithelium (OE), periostracal groove (PG), periostracum (P), ekstrapallial space (EPS).
Bagian Cairan Ekstrapallial
Secara garis besar, pada cairan ekstrapallial moluska air tawar maupun air laut ditemukan kation seperti Na, K, dan Ca, serta anion seperti HCO3, Cl, dan SO4 (Ma et al. 2007). Kalsium (Ca2+) dan karbonat (HCO3-) akan membentuk kristal CaCO3 dengan melibatkan hemolimf dan jaringan tubuh seperti bagian ekstrapallial serta cangkang.
Formasi cangkang dibentuk dengan memproduksi CaCO3 sesuai dengan reaksi:
CO2 + H2O H2CO3 H+ + HCO3- H+ + CO32- Ca2+ + HCO3- CaCO3 + H+
pertukaran Ca/H melewati membran luar dari epitel mantel (Wilbur dan Saleuddin 1983).
Reproduksi Tiram Mutiara
Tiram mutiara mempunyai jenis kelamin terpisah, kecuali pada beberapa kasus tertentu ditemukan sejumlah individu yang hermaprodit. Perubahan kelamin biasanya terjadi setelah memijah atau pada fase awal perkembangan gonad. Berdasarkan deskripsi perkembangan gonad, tingkat kematangan gonad tiram mutiara betina dikelompokkan menjadi lima fase. Fase I ialah tahap tidak aktif atau istirahat (inactive atau resting). Pada fase ini gonad berukuran kecil dan bening transparan, pada beberapa kasus gonad berwarna jingga. Pengamatan pada fase ini sangat sulit dilakukan. Fase II ialah perkembangan atau pematangan (developing atau maturing). Pada fase ini material gametogenik atau sel kelamin mulai ada dalam gonad, saat mencapai fase lanjut, gonad mulai menyebar di sepanjang bagian posterior sekitar otot refraktor dan lebih terlihat jelas di bagian anterior dorsal. Sebagian besar oocyte (bakal telur) bentuknya belum beraturan dan inti belum terlihat. Fase III, yaitu fase matang (mature), gonad tersebar merata hampir di seluruh organ pencernaan, biasanya berwarna krem kekuningan dan sebagian besar oocyte berbentuk seperti buah pir dengan ukuran 68 μm x 50
μm dan inti berukuran β5 μm. Fase IV memiliki ciri matang penuh atau memijah sebagian (fully maturation atau partially spawned), gonad mengembung, tersebar merata, secara konsisten akan keluar dengan sendirinya bila ada sedikit getaran. Oocyte terdapat di seluruh dinding kantong serta hampir semuanya berbentuk bulat dan berinti, oocyte berukuran rata-rata 51,7 β μm. Fase V ialah fase salin (spent). Pada fase ini bagian permukaan gonad mulai menyusut dan mengkerut dengan sedikit gonad tertinggal di dalam lumen (saluran-saluran di dalam organ reproduksi) dan kembali ke fase I (Eckelbarger dan Davis 1996a, 1996b)
Faktor-Faktor Ekologi yang Mempengaruhi Pertumbuhan Tiram Mutiara
Batasan-batasan faktor ekologi yang dapat digunakan untuk mengevaluasi reproduksi tiram mutiara seperti pada pembenihan adalah lokasi terlindung, dasar perairan, arus, salinitas, suhu, kecerahan, pH air, dan oksigen terlarut (Winanto et al. 2001; Winanto 2004; Winanto et al. 2009)
Lokasi terlindung
Dasar perairan
Kondisi dasar perairan seperti karang berpasir atau berkarang merupakan lokasi yang baik untuk peletakan inlet atau pipa untuk mengambil air laut guna keperluan operasional pembenihan. Selain itu dapat memilih lokasi dengan dasar perairan pecahan-pecahan karang.
Arus
Arus yang kuat dapat mengaduk dasar perairan sehingga parairan menjadi keruh dan dapat bercampur dengan substansi lain yang tidak diinginkan. Selain itu, pasang surut air laut harus diperhatikan karena dapat menyediakan dan menggantikan air secara total dan terus-menerus sehingga perairan terhindar dari kemungkinan adanya limbah atau bahan pencemar lainnya.
Salinitas
Tiram mutiara tidak dapat hidup pada salinitas di bawah 15 ppt dan di atas 50 ppt karena dapat mengakibatkan kematian hingga 100%. Tiram mutiara dapat hidup pada salinitas antara 24-50 ppt. Salinitas yang optimal bagi pertumbuhan tiram mutiara adalah 32-35 ppt, oleh karena itu pemilihan lokasi pembenihan sebaiknya di perairan yang memiliki salinitas kisaran ini.
Suhu
Umumnya, tiram mutiara tidak dapat hidup di bawah suhu 18oC , sedangkan untuk kelangsungan hidup tiram mutiara membutuhkan lingkungan dengan suhu berkisar 25-30oC. Suhu air kisaran 27-30oC juga dianggap cukup layak untuk kehidupan tiram mutiara.
Dalam kondisi laboratorium, suhu yang bervariasi dapat mempengaruhi waktu penempelan larva tiram mutiara. Pada suhu 28,2-29,8°C, larva akan menempatkan diri untuk menetap dan melekat pada substrat setelah berumur 24 hari. Selanjutnya, pada rentang suhu 24,3-27,2°C, larva baru akan melekat setelah 32 hari. Sementara pada suhu rendah, sebagian besar tiram mutiara akan menghabiskan waktunya untuk melakukan metamorfosis secara lengkap dan melekatkan diri untuk menetap. Selain itu suhu air dapat mempengaruhi proses metabolisme. Perubahan suhu, walaupun kecil, selama pemeliharaan larva dapat mengakibatkan kematian. Pada suhu 24-30°C, tiram mutiara (Pinctada margaritifera) sangat aktif melakukan kegiatan metabolisme, sedangkan pada suhu 18-20°C tiram mutiara tidak aktif lagi. Suhu air yang baik untuk pemeliharaan larva berkisar 25-27°C. Di Balai Budi Daya Laut Lampung, larva dan spat Pinctada maxima menunjukkan kelangsungan hidup dan pertumbuhan yang baik pada kisaran suhu antara 26-28°C.
Kecerahan
Pada saat larva masih stadia veliger, kecerahan yang tidak terlalu tinggi akan melindungi tubuhnya dari radiasi sinar ultraviolet karena larva masih bersifat fototaksis positif (menyukai cahaya) dan umumnya proses metamorfosis memerlukan sinar yang sesuai dan kebutuhan sinar pada tiap spesies tidak sama. Kecerahan air antara 4,5-6,5 m sangat baik untuk dijadikan lokasi pemeliharaan induk.
Derajat keasaman (pH) air
Tiram mutiara tidak dapat hidup pada derajat keasaman air atau pH perairan yang lebih tinggi dari 9 dan kurang dari 4. Tiram mutiara dapat hidup pada pH berkisar 6,75-8,6 sedangkan pH optimum bagi pertumbuhan tiram mutiara berkisar 6,75-7,00. Pada pH 4,0-6,5, tiram mengalami penurunan pertumbuhan dan jumlah tiram yang normal hanya sekitar 10%.
Oksigen terlarut (DO)
Oksigen terlarut dapat menjadi faktor pembatasan kelangsungan hidup dan perkembangannya. Tiram mutiara dapat hidup baik pada perairan dengan kandungan oksigen terlarut berkisar 5,2-6,6 ppm. Pendapat yang berbeda menyatakan bahwa tiram mutiara tidak akan mengalami banyak stress pada kisaran konsentrasi oksigen terlarut yang terbatas. Hal ini merupakan fakta karena metabolisme pada kebanyakan moluska bergantung pada batas tekanan oksigen terlarut dan dapat bertahan sampai mencapai batas tekanan terendah hingga oksigen terlarut akan naik kembali.
Hasil penelitian menunjukkan bahwa kebutuhan oksigen terlarut tiram mutiara Pinctada fucata berukuran 40-50 mm mengonsumsi oksigen sebanyak 1,339 µL/L, ukuran 50-60 mm mengonsumsi 1,650 µL/L, dan ukuran 60-70 mm mengonsumsi 1,810 µ L/L. Di tempat pemeliharaan yang terkendali, seperti hatchery, sebenarnya kebutuhan oksigen terlarut tidak menjadi masalah. Ketersedian oksigen terlarut dapat diatasi dengan membuat udara buatan melalui alat blower.
Fisiologi Pembentukan Mutiara
Pembentukan Kantung Mutiara
Kantung mutiara berasal dari potongan mantel tiram mutiara lain (saibo) yang diimplantasikan bersama-sama dengan inti. Potongan mantel tersebut mengalami perkembangan membentuk seperti kantung mengelilingi inti yang kemudian mensekresikan bahan-bahan yang diperlukan dalam pelapisan mutiara.
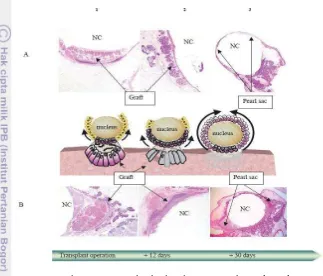
kantung mutiara hampir terbentuk yang terdiri atas lapisan sel epitel pipih dan berbentuk kubus yang didukung oleh serat-serat halus stroma. Matriks organik teramati pada rongga inti yang menandai tahap awal proses mineralisasi, namun matriks organik sering terdistorsi oleh hadirnya sisa-sisa atau puing-puing sel gamet di dalam rongga inti. Setelah 30 hari, kantung mutiara telah terbentuk sempurna, sebagaimana tersaji pada Gambar 7 (Cochennec-Laureau et al. 2010).
Gambar 7 Pola tahapan yang berbeda dalam pembentukan kantung mutiara pada tiram Pinctada fucata. Keterangan : (1) Inti dimasukkan ke bagian gonad, (2) Setelah 15 hari, kantung mutiara menyatu dengan jaringan ikat (inti telah diterima oleh tiram inang = A, inti ditutupi oleh gamet = B), (3) Setelah 30 hari, sebuah kantung mutiara lengkap dapat diamati dengan struktur homogen (Cochennec-Laureau et al.
2010).
Pembentukan Mutiara
Gambar 8 Teori pembentukan mutiara secara alami (Strack 2006). Keterangan :
1. Adanya partikel padat yang terjebak antara mantel dan cangkang bagian dalam.
2. Sel-sel epitel mantel akan memisahkan partikel padat dengan cara menyelubunginya.
3. Sel-sel epitel mantel telah menyelubungi partikel padat dan sel-sel epitel mantel inilah yang disebut kantung mutiara.
Gambar 9 Peletakan inti pada dinding cangkang bagian dalam untuk menghasilkan mutiara blister (setengah lingkaran).
Gambar 10 Peletakan inti pada bagian ventral gonad untuk menghasilkan mutiara bulat.
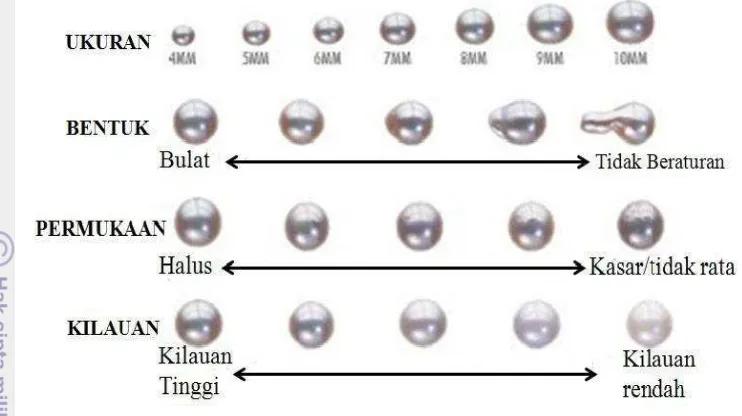
Gambar 12 Berbagai macam ukuran, bentuk, permukaan, dan kilauan mutiara. Proses pelapisan inti mutiara membutuhkan biomineralisasi yang rumit sehingga sampai sekarang belum jelas ditetapkan, walaupun telah banyak penelitian dilakukan untuk mengungkap hal ini. Proses pembentukan mutiara hasil budi daya membutuhkan campur tangan manusia karena harus melakukan implantasi pada bagian gonad dengan memasukkan inti dan saibo (irisan mantel tiram mutiara lain). Organ mantel ini diambil dari individu tiram mutiara yang lain dan berperan sebagai donor. Inti dan irisan mantel ditempatkan di bagian gonad tiram setelah sebelumnya dibuat irisan kecil pada dinding gonad, irisan daging mantel akan membentuk kantung mutiara (pearl sac) dan nantinya akan memproduksi nacre, bila implantasi hanya memasukkan inti saja maka mutiara tidak terbentuk (Strack 2006). Jika potongan mantel yang diambil dari tiram dimasukkan ke dalam organ bagian dalam (gonad), maka sel epitel mantel tersebut dapat memproduksi sel-sel baru dan terus berkembang di samping menghasilkan bahan kapur (calcareous). Fungsi sel epitel ialah memproduksi sel-sel baru sel-selama proses pembentukan lapisan mutiara (Wada dan Komaru 1994).
polos, gerakan intraseluler, memori, pertumbuhan saraf, dan respons imun. Saat tiram mutiara mengalami luka sayatan akibat implantasi inti maka diduga akan mempengaruhi kerja sel, terutama kerja fosfolipase C (PLC) yang menghidrolisis ikatan fosfodiester pada phosphatidylinositol 4,5-bisphosphate untuk menghasilkan diasilgliserol (DAG) dan inositol 1,4,5-trifosfat yang dikenal dengan second mesenger. Sinyal IP3 menyebabkan pelepasan kalsium dari retikulum endoplasma dengan bantuan pompa Ca2+-ATPase (Ca2+ terkumpul dalam sitosol akibat disekresikan oleh RE), dan pelepasan kalsium dari mitokondria dengan bantuan antiport Ca2+-Na+. Phosphatidylserine akan mengaktivasi phosphokinase C (PKC) untuk berikatan dengan DAG. Selain itu, akibat kelebihan Ca2+ sitosolik maka sel akan terus mentranspor Ca2+ ke CES sehingga Ca2+ sitosol menjadi normal kembali. CAM mengalami perubahan konformasi pada saat mengikat kalsium, yang memungkinkan untuk mengikat protein khusus untuk penanganan khusus. CAM memiliki bobot molekul sekitar 16.700 yang dapat mengikat hingga empat ion kalsium, dan dapat menjalani modifikasi pascatranslasi sehingga dapat disesuaikan dengan kebutuhan sel target, seperti pelapisan mutiara.
Fungsi CaLP (Calmodulin-Like Protein) ialah mengikat protein untuk memfasilitasi trasformasi kalsite di lapisan prismatik menjadi aragonite pada lapisan nacre (Marin dan Luquet 2004; Marin et al. 2007). Penelitian lain tentang CaLP pada tiram mutiara jenis Pinctada fucata menemukan bahwa dengan pewarnaan imunohistologi pada cangkang dideteksi CaLP di sekitar lapisan prismatik (kalsite) dan bagian nacre (aragonite). Secara in vitro CaLP berpengaruh pada pembentukan kristal kalsite, serta CaLP berkombinasi dengan protein yang larut dalam air akan membentuk kristal aragonite pada nacre, sehingga CaLP dimungkinkan berperan selama pembentukan nacre pada mutiara (Yan et al. 2007).
Peran matriks protein sangat penting dalam mencapai proses biomineralisasi (Michenfelder et al. 2003) karena secara histologi matriks protein sudah mulai terlihat setelah beberapa hari implantasi (Cochennec-Laureau et al. 2010). Enzim alkaline fosfatase sangat berperan dalam biomineralisasi mutiara karena menurut Chen et al. (2005) pada Pinctada fucata, asam amino arginina dan lisina merupakan substrat yang diaktifkan oleh enzim alkaline fosfatase selama pembentukan mutiara di nacre. Hal ini menjadi menarik karena tidak menjelaskan peran enzim alkaline fosfatase pada organ lain selama pembentukan mutiara, sehingga Xie et al. (2007) menemukan bahwa enzim alkaline fosfatase terdistribusi di hepatic duct sampai diverkula pencernaan serta Jing et al. (2007) menjelaskan bahwa secara imunohistokimia, asam fosfat positif ditemukan pada bagian kelenjar pencernaan dan filament atau lembaran insang. Fungsi signal protein C yang tertinggi terletak pada lipatan luar mantel dan insang, serta adanya peranan enzim alkaline fosfatase dalam proses tersebut (Chen et al. 2004).
ekspresi gen ke dalam tiga kategori, yaitu OMPs yang ada dalam lapisan nacreous, di lapisan prismatik, dan di antara kedua lapisan tersebut (ruang ektrapallial). Sebagian besar OMPs diperkirakan menjalani modifikasi posttranslasi, terutama untuk nacrein (Miyamoto et al. 2005), glikosilasi dengan oligosakarida yang mengandung sulfit dan asam sialat (Takakura et al. 2008). Selain komponen protein, matriks organik dari tiram mutiara berisi struktur polisakarida dan kitin (Suzuki dan Nagasawa 2007). Lebih jauh lagi Kong et al. (2009) telah melaporkan bahwa prisilkin-39 memiliki dua fungsi, yaitu pembentukan kitin dan regulasi bahan-bahan mineral pada bagian prismatik cangkang tiram Pinctada fucata.
Dengan demikian, komponen matriks organik dari cangkang tiram mutiara telah mengungkapkan adanya berbagai molekul yang mungkin berinteraksi dan berkoordinasi untuk pembentukan dan penentuan struktur cangkang polimorfik (Matsushiro et al. 2003). Menurut Jackson et al. (2010) bahwa informasi tentang OMPs masih dapat dilakukan melalui analisis transkriptome dari jaringan mantel. Fungsi dari berbagai komponen matriks organik dalam kaitannya dengan pembentukan dan penentuan struktur cangkang polimorfik telah diselidiki oleh kombinasi pendekatan yang berbeda, yaitu kristalisasi secara in vitro kalsium karbonat (Zaremba et al. 1996) dan secara in vivo dari seluruh proses pembentukan cangkang dengan " flat pearl" " (Fritz et al. 1994). Eksperimen terbaru yang dilakukan secara invivo oleh Suzuki et al. (2009) dengan menggunakan metode interferensi RNA untuk memodifikasi sintesis salah satu matriks protein, yaitu Pif97 dan Pif80, ke dalam sel-sel epitel luar. Hasilnya menunjukkan bahwa Pif97 dan Pif80 berperan dalam mengatur kristalisasi kalsium karbonat pada pembentukan nacre Pinctada fucata.
Hal-hal tersebut di atas telah menjelaskan bahwa komponen matriks organik memainkan peran penting dalam penentuan struktur cangkang. Sel-sel epitel luar memainkan peran sentral dalam pembentukan cangkang. Ion anorganik untuk kristalisasi kalsium karbonat diangkut ke ruang extrapallial dan semua komponen matriks cangkang disintesis dan disekresikan oleh sel-sel ini. Pembentukan mutiara juga digambarkan seperti hal-hal tersebut di atas.
3 HISTOLOGI DAN PERUBAHAN FISIOLOGIS SELAMA
PEMBENTUKAN KANTUNG MUTIARA PADA TIRAM Pinctada maxima
DENGAN IMPLANTASI SAIBO DARI GENUS DAN SPESIES TIRAM
DONOR YANG BERBEDA
La Eddy1), Wasmen Manalu2), Ridwan Affandi3) Nastiti Kusumorini 2)
1
maxima. Sebanyak tiga ratus dua puluh tiram Pinctada maxima digunakan sebagai tiram inang dengan rancangan acak lengkap 4 x 4 pola faktorial dengan 20 ulangan. Faktor pertama adalah sumber saibo yang terdiri atas 4 level, yakni Atrina vexillum, Pteria penguin, Pinctada margaritifera, dan Pinctada maxima. Faktor kedua adalah waktu setelah implantasi inti dengan 4 level, yakni 1, 2, 3, dan 4 minggu. Parameter yang diamati adalah persentase tiram yang berhasil membentuk kantung mutiara, kecepatan pertumbuhan kantung mutiara dan persentase penutupan inti oleh kantung mutiara, perkembangan histologis kantung mutiara, konsumsi oksigen, serta kadar glukosa, kalsium, dan fosfor hemolimf. Tiram inang Pinctada maxima diimplantasi dengan saibo dari genus yang berbeda, yaitu Atrina vexillum dan Pteria penguin, hanya berhasil membentuk kantung mutiara masing-masing sebesar 30 dan 45%. Namun, pada tiram Pinctada maxima yang diimplantasi dengan saibo dari genus yang sama (Pinctada margaritifera) memiliki persentase tiram yang berhasil membentuk kantung mutiara mencapai 70% dan saat saibo berasal dari spesies yang sama (Pinctada maxima) memiliki persentase tiram berhasil membentuk kantung mutiara sedikit lebih tinggi mencapai 80%. Namun, kecepatan pembentukan kantung mutiara dan persentase penutupan inti oleh kantung mutiara tiram Pinctada maxima dengan implantasi saibo dari jenis tiram Pteria penguin, Atrina vexillum dan Pinctada margaritifera hanya sekitar 20% lebih rendah dibandingkan dengan spesies yang sama (Pinctada maxima). Konsentrasi glukosa hemolimf dan konsumsi oksigen tidak terpengaruh oleh spesies dan genus tiram donor yang berbeda. Pembentukan kantung mutiara pada tiram Pinctada maxima dengan saibo dari spesies yang sama memberikan hasil terbaik dibandingkan dengan spesies yang berbeda, seperti tiram Pinctada margaritifera serta dari genus yang berbeda, seperti Pteria penguin dan Atrina vexillum.
Kata kunci : Kantung Mutiara, Saibo, Pinctada maxima, Pinctada margaritifera, Pteria penguin, Atrina vexillum
HISTOLOGICAL AND PHYSIOLOGICAL CHANGES DURING
PEARL SAC FORMATION IN Pinctada maxima HOST OYSTERS
IMPLANTED WITH SAIBOS FROM DIFFERENT GENUS AND SPECIES
OF DONOR OYSTERS
La Eddy1), Wasmen Manalu2), Ridwan Affandi3) Nastiti Kusumorini 2)
1
Doctoral Programme Majoring in Physiology and Pharmacology, Graduate School, Bogor Agricultural University. 2Majoring in Physiology and Pharmacology, Graduate School, Bogor Agricultural University, 3Majoring in Aquaculture, Graduate School, Bogor Agricultural University.
ABSTRACT