Prosiding Seminar Nasional ISSN : 1410-5667 FUNDAMENTAL DAN APLIKASI TEKNIK KIMIA 2002
Surabaya, 31 Oktober – 1 November 2002
MODEL KINETIKA PEMBUATAN TITANYL SULFAT
DENGAN UNREACTED CORE MODEL
Ahmad Fadli dan Komalasari
Laboratorium Korosi dan Material
Jurusan Teknik Kimia Fakultas Teknik Universitas Riau
Telp./Fax. (0761)566937 Email : [email protected] , [email protected]
Abstrak
Telah diajukan pemodelan matematis pada kinetika reaksi pembuatan Titanyl sulfat (TiOSO4) oleh Fadli dkk.
dengan menganggap model regim campuran dengan ukuran butir berkurang (Shrinking Core Model). Titanyl sulfat (TiOSO4) merupakan bahan antara untuk membuat rutil (TiO2). Titanyl sulfat dapat diperoleh
dengan cara mendestruksi mineral ilmenit dengan asam sulfat. Proses destruksi mineral ilmenit membutuhkan model matematik dengan system heterogen yang melibatkan proses perpindahan massa dan reaksi kimia sekaligus. Pada makalah ini akan dilakukan pemodelan pada reaksi yang sama yaitu model regim campuran dengan ukuran butir tetap (Unreacted Core Model). Berdasarkan hasil pengolahan data diperoleh nilai konstanta kecepatan reaksi (kr) yang didekati dengan persamaan Arrhenius, kr = 0,6697e -10334/(RT) , dengan R adalah konstanta gas ideal dan T adalah suhu absolut. Dari nilai koefisien perpindahan
massa yang relatif tetap dapat dinyatakan bahwa kecepatan pengadukan relatif tidak mempengaruhi kecepatan reaksi secara keseluruhan.
Kata kunci : Model Kinetika, Ilmenit, Unreacted Core Model, Destruksi.
Abstract
Fadli et. al (2002) have proposed a mathematical modeling with assumsed a shrinking core mixed chemical-dynamic model in reaction kinetic on titanyl sulfat (TiOSO4) production. Titanyl sulfat (TiOSO4) is an
intermediate material to preparation of Rutile (TiO2). It could be produced by destruction of the ilmenite
mineral with sulfuric acid. The design process of destruction needs mathematical modeling which is similar to heterogeneous system that involves both mass transfer and chemical reaction simultaneously. In this article will to improve modeling in the same of reaction is an unreacted-core mixed chemical-dynamic regime model. Based on the results, from this model it was obtained that the value of reaction rate constant (kr) could be
approached by the Arrhenius equation, as the following kr = 0,6697e-10334/(RT), in which R is the gas constant
and T is the absolute temperature. It was obtained that the value of mass transfer coefficient was not significantly influenced by the rate of stirring.
Pendahuluan
Titania sintetis, TiO2, baik dalam bentuk tetragonal rutile ataupun anatase sangat banyak dipakai dalam industri. Penggunaan tersebut antara lain sebagai pigment pemutih, pigment warna superior (warna putih), bahan utama keramik untuk elektronik (BaTiO3), bahan baku untuk pembuatan TiO2 polimeric precursor
yang sangat penting untuk pembuatan bahan-bahan keramik maju, antara lain pelapisan optik (film-optic), bahan electro-optic dan bahan komposit polimer ceramic (Ceramer).
Bahan baku untuk membuat TiO2 sintetis banyak terdapat di alam, termasuk di Indonesia, baik sebagai deposit utama/deposit batuan keras ataupun sebagai secondary / placer deposite (yang pada umumnya dalam bentuk pasir pantai). Mineral-mineral yang ada dalam deposit tersebut ada yang berbentuk mineral ilmenite (FeO.TiO2), rutile (tetragonal TiO2), anatase (tetragonal TiO2), brookite (rhombic TiO2) dan perovskite (CaO.TiO2).
Di Indonesia, mineral yang mengandung TiO2 yang dijumpai terdapat dalam hasil samping penambangan timah di Pulau Bangka dan juga dalam deposit (placer deposite) pasir besi di pantai selatan Pulau Jawa (Jawa Tengah). Sampai saat ini belum dilakukan pengolahan/pemanfaatan yang memberikan nilai tambah yang besar, seiring dengan perkembangan kebutuhan TiO2 sintetis dan perkembangan teknologi bahan keramik maju.
Tinjauan Pustaka
Salah satu proses yang dipakai untuk mendapatkan TiO2 dengan bahan baku mineral ilmenit adalah proses sulfat. Pada proses ini ilmenit didestruksi terlebih dahulu dengan asam sulfat untuk mendapatkan Titanyl sulfat (TiOSO4). Reaksi keseluruhan (Reed J. S, 1988) sebagai berikut :
FeO.TiO2 + 2H2SO4 + 5H2O FeSO 150oC−180oC
→
→
4. 7H2O + TiOSO4 (1) TiO.SO4 + 2H2O TiO(OH) 90oC
→
2 + H2SO4 (2) TiO(OH)2 TiO 900oC−1000oC
2 + H2O (3) RutileUntuk mendeskripsikan kinetika reaksi yang terjadi pada pembuatan titanyl sulfat dengan asam sulfat ini telah diajukan Shrinking Core model dengan reaksi kimia dan transfer massa mengontrol (regim campuran) oleh Fadli dkk., 2002.
Landasan Teori
Langkah-langkah reaksi antara asam sulfat di cairan dengan ilmenit di butir padatan dengan reaksi seperti pada persamaan 1 dapat diuraikan menjadi 3 langkah.
a) Langkah 1. Transfer massa asam sulfat dari cairan ke lapisan antara cairan dengan permukaan butir padatan yang dapat dinyatakan dengan persamaan,
- rC = kssas . ( CC - CCS ) (4) Karena jumlah mol asam sulfat yang disediakan berlebihan dari kebutuhan mol asam sulfat secara stoikiometri (10 mol H2SO4/mol ilmenit) maka difusivitas ion sulfat yang menuju permukaan butiran dianggap besar sekali atau dengan kata lain tidak ada hambatan difusi pada transfer massa asam sulfat dari cairan ke permukaan butir padatan sehingga tidak terjadi perbedaan konsentrasi asam sulfat di cairan dengan konsentrasi asam sulfat di permukaan butir padatan, artinya CC ≈ CCS.
b) Langkah 2. Reaksi antara asam sulfat dengan ilmenit pada permukaan butir padatan yang mengikuti persamaan :
- rD = kr . mn (5) dengan m adalah massa butir padatan setelah reaksi. Jika m0 adalah massa butiran mula-mula, dapat ditulis,
dengan θ adalah fraksi Ti dalam butir padatan mula-mula dan X adalah besarnya konversi Ti yang didefinisikan sebagai, X = mula mula n padata butir dalam ada yang Ti Jumlah cairan dalam ada yang Ti Jumlah − (7) Jika β1 = m0 . θ dan β0 = 1/θ maka persamaan (6) dapat juga ditulis sebagai,
m = β1. (β0 – X) (8) Substitusi persamaan (8) ke persamaan (5) didapat :
-rD = kr . β1n . (β0 – X)n (9) c) Langkah 3. Langkah ini merupakan transfer massa hasil reaksi (TiOSO4) dari permukaan butir padatan melewati lapisan cair-padat menuju ke cairan yang dinyatakan dengan persamaan :
rE = ksas (CES –CE) (10) Diagran ketiga langkah reaksi ini dapat dianggap seperti gambar 1.
CE 3 2 CES FeO.TiO2 + 2H2SO4 + 5H2O CCS 1 Cc Lapisan cair Cairan FeSO4.7H2O + TiOSO4
Gambar 1. Diagram langkah-langkah reaksi antara asam sulfat dan ilmenit dalam butir padatan
Akan diajukan Unreacted Core model dengan reaksi kimia dan transfer massa mengontrol (regim campuran). Model ini telah disusun oleh Fadli A dkk. dengan hasil sebagai berikut :
dt
dm
= -3
4
. π . r03 . kr . nm
m
0 0 1.
β
.
β
(11)dt
dC
ES =V
r
.
3
.
.
4
π
03 . kr . nm
m
0 0 1.β
.
β
- ksas . (CES – CE) (12)dt
dC
E = ksas . (CES – CE) (13) Persamaan (11), (12) dan (13) dapat diselesaikan serentak secara numerik dengan Metode Runge Kutta (Jenson and Jeffreys, 1977) dengan kondisi batas t = 0 maka CE = 0, dan r = R0 maka CES = 0. Jika harga kr, ksas dan n ditentukan, maka dapat dihitung nilai CE dari simulasi yang dekat dengan nilai CE dari data percobaan. Nilai kr, ksas dan n yang dipilih adalah yang memberikan SSE minimal dimana :Pengaruh Suhu. Menurut Johnstone dan Thring (1957), besar kecilnya suhu berpengaruh pada nilai konstanta kecepatan reaksi dan koefisien transfer massa yang mengikuti persamaan Arrhenius. Jika suhu dinaikkan, nilai konstanta kecepatan reaksi maupun koefisien transfer massa akan bertambah besar. Pada kondisi atmosferik, bila suhu dinaikkan sebesar sepuluh derajat celcius mengakibatkan kenaikkan harga konstanta kecepatan reaksi dua kali lipat atau lebih, maka umumnya reaksi mengontrol dan berlaku regim kimia. Jika lebih kecil dari 1,5 maka umumnya proses transfer massa mengontrol dan berlaku regim dinamik. Bilangan ini lazim dikenal dengan istilah koefisien 10 derajat (Johnstone dan Thring , 1957). Hubungan antara kr dengan suhu mengikuti persamaan Arhenius :
kr = Ae-E/RT (15) Pengaruh pengadukan. Menurut Johnstone dan Thring (1957), pengaruh pengadukan disini erat sekali hubungannya dengan sistem pendispersian butir padatan ke dalam cairan. Pendispersian butir padatan ke dalam cairan dengan cara pengadukan dapat meningkatkan luas kontak dan memperbesar tumbukan antara molekul-molekul dalam cairan. Pengaruh kecepatan pengadukan (G), terhadap koefisien transfer massa (ks) menurut Johnstone dan Thring (1957), dapat dinyatakan dengan persamaan :
ks = λGz1 (16) dengan λ adalah tetapan dan z1 adalah indeks Reynolds.
Jika nilai indeks Reynolds kecil (mendekati nol) maka berlaku regim kimia dan bila indeks Reynolds antara 0,5 – 0,8 akan berlaku regim dinamik dengan fixed interface yaitu sistem padat-cair.
Apabila harga koefisien sepuluh derajat sebesar 1,5 (lebih kecil dari 2) dan indeks Reynolds sebesar 0,5 (lebih kecil dari 0,6), dijumpai keadaan dimana reaksi kimia dan transfer massa keduanya mempengaruhi reaksi dan berlaku regim campuran.
Metodologi Penelitian
Ilmenit, dari bahan buangan PT Tambang Timah Bangka. Berbentuk serbuk pasir dan berwarna kehitam-hitaman. Hasil analisa dengan AAS: TiO2 = 42,57%, Fe2O3 = 30,99%, Na2O = 11,53%, MnO = 2,91%, SiO2 = 1,48%, Al2O3 = 0,52%, MgO = 0,15%, CaO = 0,14%, K2O = 0,04%. Hasil analisa dengan XRD: FeO.TiO2= 25,517%, TiO2 (amorphus) = 29, 14%. Asam sulfat, hasil analisa : Kadar = 94%, Baume = 65,51o, Berat Jenis = 1,83 gr/cc. Aquadest.
Proses dimulai dengan memasukkan ilmenit dengan berat tertentu ke dalam Autoklaf, kemudian secara perlahan-lahan dimasukkan juga asam sulfat dengan volume tertentu, lalu autoklaf ditutup rapat. Selanjutnya autoklaf dipanaskan dengan kawat pemanas listrik yang dililitkan pada sisi luar dinding autoklaf sampai temperatur tertentu. Setelah temperatur yang diinginkan tercapai, hidupkan motor untuk memutar autoklaf tersebut. Kecepatan putaran dan temperatur autoklaf diatur dengan powerstat. Setelah waktu tertentu, proses dihentikan dan diambil sampel dari dalam reaktor menggunakan pipa pengambil sampel yang dilengkapi kran. Selanjutnya sampel yang diperoleh diencerkan dengan cara menambahkan aquadest dengan volume tertentu, kemudian diendapkan lalu disaring dengan kertas saring. Cairan yang diperoleh dianalisa dengan UV
Spectrophotometer (Priyana, dkk., 1979).
Hasil Penelitian dan Pembahasan
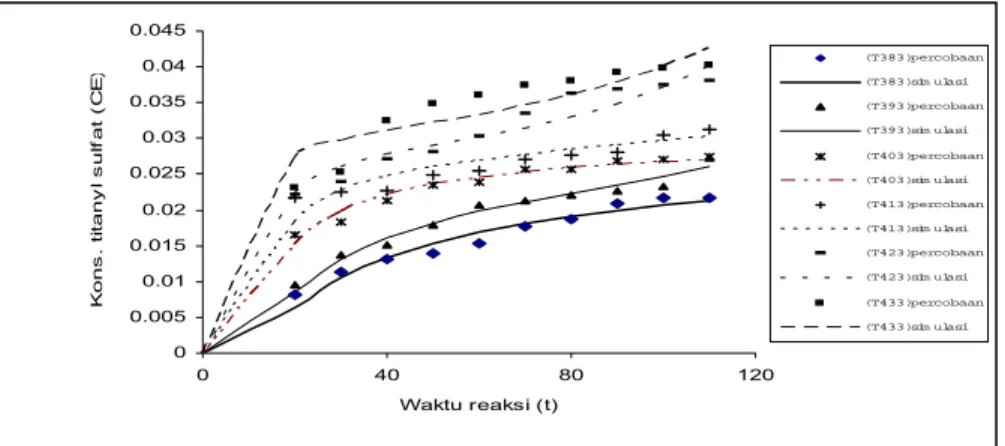
Pengaruh suhu reaksi yang dipelajari yaitu pada kisaran 110 oC – 160 oC. Hasil pengukuran konsentrasi titanyl sulfat (CE) di cairan pada berbagai waktu dan suhu dengan hasil simulasi untuk model dapat dilihat pada grafik gambar 2.
0 0.005 0.01 0.015 0.02 0.025 0.03 0.035 0.04 0.045 0 40 80 120 Waktu reaksi (t) K ons . ti tany l s u lf at (C E ) (T383)percobaan (T383)sim ulasi (T393)percobaan (T393)sim ulasi (T403)percobaan (T403)sim ulasi (T413)percobaan (T413)sim ulasi (T423)percobaan (T423)sim ulasi (T433)percobaan (T433)sim ulasi
Gambar 2. Hubungan waktu reaksi (t) dengan konsentrasi titanyl sulfat (CE) pada berbagai suhu (T)
Pengaruh Pengadukan yang dipelajari pada kisaran 60 rpm – 125 rpm. Perubahan konsentrasi titanyl sulfat
untuk tiap waktu pada berbagai kecepatan pengadukan secara percobaan dan perhitungan model dapat dilihat pada grafik gambar 3.
0 0.005 0.01 0.015 0.02 0.025 0.03 0.035 0.04 0.045 0.05
0 Waktu reaksi (t), menit40 80 120
K ons . t it any l s u lf at gr m o l/ m L (G 60))percobaan (G 60)sim ulasi (G 77)percobaan (G 77)sim ulasi (G 96)percobaan (G 96)sim ulasi (G 110)percobaan (G 110)sim ulasi (G 125)percobaan (G 125)sim ulasi
Gambar 3. Hubungan waktu reaksi (t) dengan konsentrasi titanyl sulfat (CE) pada berbagai kecepatan pengadukan (G)
Menentukan orde reaksi (n) dilakukan dengan mencoba n = 0 sampai n = 3 seperti dan akan diperoleh nilai
SSE paling minimum berada pada nilai orde reaksi (n) 1,2 maka kita simpulkan bahwa orde reaksi yang cocok untuk model ini adalah 1,2 (Fadli, dkk 2002).
Pengaruh suhu terhadap konstanta kecepatan reaksi (kr)
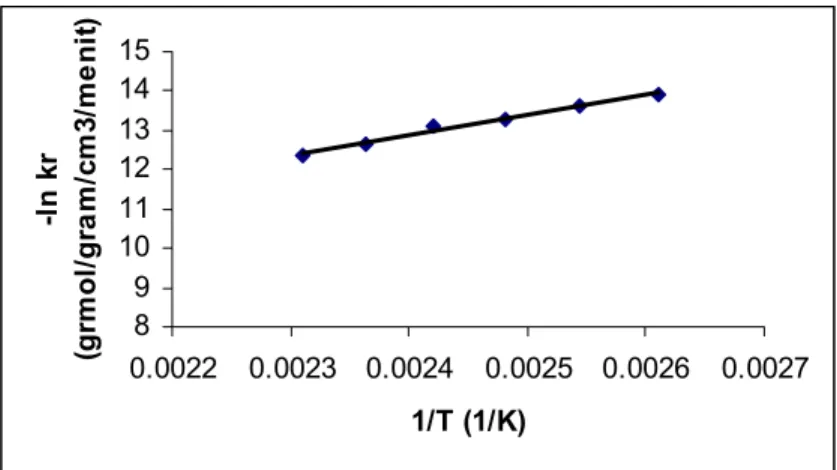
Hubungan konstanta kecepatan reaksi dengan suhu jika dinyatakan dengan persamaan Arrhenius adalah
kr = 0,6697e-10334/(RT) (17)
dengan ralat rerata 1,0%.
8 9 10 11 12 13 14 15 0.0022 0.0023 0.0024 0.0025 0.0026 0.0027 1/T (1/K) -l n k r (g rm o l/ g ra m/ cm 3/ me n it )
Gambar 5. Hubungan -ln kr dengan 1/T
Jika kita melihat hasil perhitungan konstanta kecepatan reaksi (kr) maka kita dapat menyimpulkan bahwa nilai kr ternyata dipengaruhi oleh suhu reaksi (T). semakin tinggi suhu akan semakin besar pula nilai kr. Ini sesuai dengan persamaan Arrhenius. Adapun kenaikan rata-rata nilai kr terhadap kenaikan suhu 10 derajat adalah 1,948 kali. Menurut Johnstone dan Thring, jika kenikan kr terhadap kenaikan 10 derajat suhu reaksi lebih besar dari 1,5 dan lebih kecil dari 2 maka regim yang berpengaruh pada sistem tersebut adalah regim campuran.
Pengaruh pengadukan terhadap nilai koefisien transfer massa (ksas) dapat dilihat pada daftar I.
Daftar I. Hasil optimasi ksas pada berbagai kecepatan pengadukan Kecepatan pengadukan
(rpm) Koefisien transfer massa, ksas (1/menit)
60 20,00238 77 19,99717 96 20,00138 110 20,00342 125 19,99878
Dari hasil optimasi ternyata pengadukan hampir tidak mempengaruhi nilai koefisien transfer massa (ksas). Nilai ksas rata rata yang diperoleh adalah 20,001 menit-1.
Kesimpulan
Untuk kecepatan pengadukan 60 rpm, model yang relatif cocok untuk meninjau kinetika reaksi pembuatan titanyl sulfat dari mineral ilmenit adalah unreacted core model dan regim yang berpengaruh adalah regim campuran dan reaksi terjadi di permukaan butir padatan ilmenit. Untuk kecepatan pengadukan pada kisaran 60 rpm –125 rpm, ternyata kecepatan pengadukan tidak mempengaruhi nilai koefisien transfer massa (ksas). Hubungan antara konstanta kecepatan reaksi (kr) terhadap suhu (T) pada kisaran 383 K – 433 K dapat didekati dengan persamaan Arrhenius kr = 0,6697e-10334/(RT) dengan ralat rerata 1,0%.
Ucapan Terima Kasih
Penyusun mengucapkan terima kasih kepada Bapak Ir. Supranto, MSc, Ph.D dan Bapak Ir. P. Sumardi, SU yang telah memberikan masukan-masukan perbaikan dalam penelitian ini.
Daftar Pustaka
[1] Fadli A. dan Sunarno, (2002), “Model Kinetika Pembuatan Titanyl Sulfat dari Mineral Ilmenit”, Prosiding Seminar Nasional Rekayasa Kimia dan Proses 2002, UNDIP, Semarang.
[2] Johnstone, R. E. and Thring, M. W., (1957), “Pilot Plants, Models and Scale-up Method in Chemical
Engineering”, p.p. 66 - 71, McGraw-Hill Book Co., New York.
[3] Levenspiel O., (1972), “Chemical Reaction Engineering”, 2nd ed., p.p. 357-376, John-Wiley & Sons, New York.
[4] Reed J. S., (1988), “Introduction to the Principles of Ceramic Processing”, A Wiley-Interscience Publication, John Wiley & Sons Inc., New York.
[5] Priyana, Mudjiran, Narsito dan Akhmad S., (1979), “Analisa Kimia Unsur-Unsur Utama dalam
Bahan-Bahan Bumi”, Laporan penelitian, Proyek Pengembangan Ilmu dan Teknologi, Fakultas Ilmu Pasti dan
alam, Universitas Gadjah Mada, Yogyakarta.
[6] Sediawan, W.B. dan Prasetya, A., (1997), “Pemodelan Matematis dan Penyelesaian Numeris dalam
Teknik Kimia”, Andi Offset, Yogyakarta.
[7] Shreeve N., B. and Brink J., A., Jr., (1977), “Chemical Process Industries”, Forth editian, Mc Graw-Hill Book Company, New York.
[8] Sumardi P. C., (1999), “Pembuatan Rutil (TiO2) Sintetis dari Ilmenit Hasil Samping Penambangan Timah Bangka”, Prosiding Lokakarya Eksploitasi, Eksplorasi dan Pengolahan Sumberdaya Mineral, Fakultas teknik, Jurusan Teknik Geologi, Universitas Gadjah Mada, Yogyakarta.