1
PENINGKATAN KELARUTAN ETIL p-METOKSISINAMAT
DENGAN PEMBENTUKAN KOKRISTAL MENGGUNAKAN
METODE SOLVENT EVAPORATION DAN KOFORMER UREA
Revika Rachmaniar1*, Deby Tristiyanti1, Fakhri Humaidi Triyadi1
1 Departemen Farmasetika, Sekolah Tinggi Farmasi Indonesia, Jl. Soekarno-Hatta No.354 (Parakan Resik 1), Bandung, Jawa Barat, Indonesia.
*Alamat korespondensi: [email protected] Abstrak
Etil p-metoksisinamat (EPMS) merupakan isolat dengan persentase terbesar pada kencur (Kampferia
galanga), tetapi sifatnya yang sukar larut air menyebabkan keterbatasan pada disolusi dan
bioavailabilitas. Bioavailabilitas yang terbatas mengakibatkan aktivitas farmakologi yang rendah. Untuk mengatasi permasalahan tersebut, kelarutan EPMS dalam air perlu ditingkatkan. Penelitian ini bertujuan untuk meningkatkan kelarutan EPMS melalui pembentukan kokristal menggunakan metode
solvent evaporation dan koformer urea. EPMS dan urea dengan perbandingan 1:1, 1:2, 1:3, dan 2:1
dilarutkan dalam etanol kemudian diuapkan. Kokristal EPMS-urea yang diperoleh dikarakterisasi menggunakan mikroskop digital, High Performance Liquid Chromatography (HPLC), spektrofotometer Fourier Transform Infrared (FT-IR), Powder X-Ray diffraction (PXRD), dan uji kelarutan di dalam air. Hasil penelitian menunjukkan kokristal EPMS-urea terbentuk akibat terjadinya ikatan hidrogen dan mengalami penurunan ukuran partikel, penurunan kristalinitas, dan peningkatan kelarutan. Kadar EPMS dalam sistem kokristal sebesar 91 – 106%. Peningkatan kelarutan kokristal EPMS-urea 1:1, 1:2, 1:3, 2:1 dalam air secara berturut-turut sebesar 1,5; 1,6; 1,2; 1,3 kali dibandingkan dengan EPMS. Berdasarkan penelitian ini, dapat disimpulkan bahwa kokristal EPMS-urea menggunakan solvent evaporation berhasil terbentuk dan mengalami peningkatan kelarutan dalam air hingga 1,6 kali-nya pada perbandingan kokristal EPMS-urea 1:2.
Kata kunci: etil p-metoksisinamat, urea, kokristal, solvent evaporation.
Abstract
Ethyl p-methoxycinnamate (EPMC) is the isolate with the largest percentage of kencur (Kampferia galanga), but it's poorly water-soluble causes limitations on dissolution and bioavailability. Limited bioavailability results in low pharmacological activity. To overcome these problems, the solubility of EPMC in water needs to be increased. This study aims to increase the solubility of EPMC through the formation of cocrystals using solvent evaporation and coformer urea methods. EPMC and urea in a ratio of 1:1, 1:2, 1:3, and 2:1 were dissolved in ethanol and then evaporated. The obtained EPMC-urea cocrystals were characterized using a digital microscope, High Performance Liquid Chromatography (HPLC), Fourier Transform Infrared (FT-IR) spectrophotometer, Powder X-Ray diffraction (PXRD), and water solubility assay. The results showed that EPMC-urea cocrystals were formed due to hydrogen bonding. The EPMC-urea cocrystal showed decreased particle size, decreased crystallinity, and increased solubility. The concentration of EPMC in the cocrystal system was 91 – 106%. Water solubility enhancement of EPMC-urea cocrystals 1:1, 1:2, 1:3, 2:1 was1.5; 1.6; 1.2; 1.3 folds compared to EPMC respectively. It can be concluded that the EPMC-urea cocrystal using solvent evaporation was successfully formed and increased its solubility in water up to 1.6 folds at the ratio of 1:2 EPMC-urea cocrystal.
2 PENDAHULUAN
Kencur (Kaemferia galanga L.) adalah tumbuhan obat yang sering dimanfaatkan oleh masyarakat Indonesia. Kandungan metabolit dalam ekstrak kencur diantaranya ialah asam propionat (4,7%), pentadekan (2,08%), asam tridekanoat (1,81%), 1,21 docosadiene
(1,47%), beta- sitosterol (9,88%), dan komponen terbesar adalah etil p-metoksisinamat (EPMS) (80,05%) (Umar, et
al., 2012). EPMS dapat diisolasi dengan mudah
menggunakan tahap ekstraksi, evaporasi, pendinginan, pencucian, dan rekristalisasi sehingga metabolit sekunder ini dapat mudah diperoleh (Riasari dan Rachmaniar, 2018). EPMS termasuk ke dalam senyawa ester yang mengandung cincin benzen dan gugus metoksi yang bersifat non polar, dan juga gugus karbonil yang mengikat etil yang bersifat sedikit polar sehingga cenderung tidak larut dalam air (Barus, 2009). EPMS memiliki kelarutan dalam air sebesar 0,0301 mg/mL atau praktis tidak larut (Rachmaniar, et al., 2020a). Kelarutan obat memainkan peranan penting dalam penentuan khasiat dan aktivitas obat (Bavishi and Borkhataria, 2016; Riasari, et al., 2016).
EPMS berkhasiat sebagai antiinflamasi dengan cara menghambat aktivitas enzim COX-1 dan COX-2 (Umar, et al., 2012), di mana enzim ini berguna dalam pembentukan prostaglandin yang merupakan mediator inflamasi (Gosal, et al., 2012). Selama berlangsungnya peristiwa inflamasi, banyak mediator kimiawi yang dilepaskan secara lokal sehingga menimbulkan gejala seperti kalor, rubor, tumor, dolor, dan functiolaesa
(Gunawan, et al., 2012). Gejala-gejala inflamasi tersebut membuat keadaan pasien tidak nyaman sehingga mengharuskan penanganan inflamasi cepat dilakukan. Oleh sebab itu, EPMS harus ditingkatkan kelarutannya untuk mencapai kosentrasi terapeutik dan mempercepat timbulnya efek anti inflamasi. Efek anti inflamasi ini tergantung pada bioavailabilitas yang ditentukan oleh kelarutan dan kecepatan disolusi (Jung, et al., 2010). Kelarutan penting dalam meramalkan derajat absorpsi obat dalam saluran cerna. Obat dengan kelarutan kecil dalam air seringkali menunjukkan bioavailabilitas yang rendah (Zaini, et al., 2011).
Sebelumnya EPMS berhasil ditingkatkan kelarutannya menggunakan teknik kokristalisasi menggunakan metode liquid
assisted grinding dengan koformer asam sitrat
(Rachmaniar, et al., 2020a) dan asam tartrat (Rachmaniar, et al., 2020b). Akan tetapi, peningkatan kelarutan kokristal EPMS-asam sitrat dan kokristal EPMS-asam tartrat dalam air tidak signifikan. Sementara itu, metode kokristalisasi ini adalah metode yang sangat berpotensi menghasilkan zat aktif baru yang tidak ruah dengan eksipien sehingga dapat mudah diformulasi menjadi bentuk sediaan farmasi. Kokristal terdiri dari dua senyawa yakni zat aktif farmasi dan koformer (pembentuk kokristal) yang pada umumnya berada pada posisi netral (Qiao, et al., 2011). Koformer merupakan eksipien dengan bobot molekul kecil yang dibutuhkan dalam jumlah yang kecil dalam pembentukan kokristal sebab perbandingan koformer dan obat dalam
3 membentuk kokristal menggunakan
perbandingan stoikiometri. Perbandingan stoikiometri digunakan dalam membentuk kokristal karena kokristal membutuhkan interaksi molekul dalam proses pembentukannya, seperti ikatan hidrogen dan ikatan van der Waals (Rachmaniar, et al., 2020a; Rachmaniar, et al., 2020b). Ikatan hidrogen ini akan membentuk formasi supermolekular sinton yang terdiri dari dua jenis formasi, yaitu homosinton dan heterosinton yang dapat membentuk kokristal dengan kuat (Qiao, et al., 2011).
Untuk memperbaiki kelarutan EPMS menggunakan metode kokristalisasi, pada penelitian ini digunakan koformer urea. Urea diketahui mampu meningkatkan kelarutan obat karena sifatnya yang larut air serta memiliki satu akseptor hidrogen dan dua donor hidrogen sehingga memungkinkan membentuk ikatan
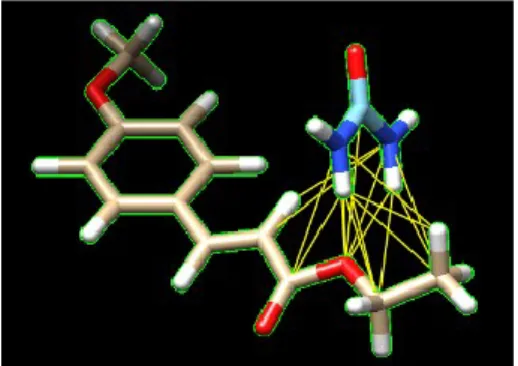
hidrogen dan Van der Waals dengan EPMS. Urea sendiri telah berhasil meningkatkan kelarutan clarithromycin 4 kali (Rajbhar, et al., 2016), diacerein 7,84 kali (Thenge, et al., 2017), dan lesinurad 43 kali (Palanisamy, et al., 2019). Secara kimia EPMS memiliki gugus metoksi dan karbonil yang dapat berinteraksi dengan gugus amida (NH2) dari urea. Kokristal EPMS-urea dapat dibuat menggunakan empat perbandingan, yaitu 1:1, 1:2, 1:3, dan 2:1. EPMS memiliki gugus penarik elektron yaitu O sebanyak 3 buah. Hal ini memungkinkan terjadinya jumlah ikatan hidrogen dengan urea sebanyak lima buah pada perbandingan 1:1, tiga buah pada perbandingan 1:2, tiga buah pada perbandingan 1:3, dan satu buah pada perbandingan 2:1. Ilustrasi interaksi struktur molekul EPMS dan urea dapat dilihat pada Gambar 1.
Gambar 1. Ilustrasi interaksi struktur molekul EPMS dan urea Dalam proses preparasi kokristal
EPMS-urea, metode yang dapat digunakan adalah metode solvent evaporation. Solvent evaporation cukup mudah karena prinsipnya
adalah mencampurkan zat aktif dan koformer dilarutkan dalam pelarut yang sesuai, kemudian
diuapkan secara perlahan. Jumlah pelarut pada
solvent evaporation lebih banyak daripada
pelarut yang digunakan pada liquid assisted
grinding. Hal ini memungkinkan pelarut yang
digunakan pada metode solvent evaporation dapat meningkatkan kemungkinan interaksi
4 hidrogen antara EPMS dan urea, menyusun kisi
kristal baru, dan menghasilkan kokristal EPMS yang memiliki sifat fisikokimia lebih baik daripada metode liquid assisted grinding.
Pada penelitian ini EPMS dibuat bentuk kokristal menggunakan koformer urea dengan metode solvent evaporation. Dengan terbentuknya kokristal EPMS-urea diharapkan kelarutan EPMS dalam air dapat meningkat sehingga ke depannya kokristal EPMS-urea dapat diaplikasikan menjadi suatu sediaan farmasi.
METODOLOGI Alat
Alat yang digunakan dalam penelitian ini adalah timbangan analitik (Ohaus), vortex (Type 37600), orbital shaker (IKA KS 130 basic), fourier transform infra red (Thermo Scientific Micolet 1S5), Powder x-ray
diffraction (BRUKER D8 ADVANCE) dan
aplikasi Match!3, spektrofotometer UV-Vis (Shimadzu UV 1800), High Performance
Liquid Chromatography (SHIMADZU
LC-20AD), mikropipet (Thermo scientific, Finn pipette F3), sentrifuga (Hettich Zentrifugen D- 78532 Tuttlingen), disposable syringe 5cc (OneMed), sonikator (ElmaS30H), dan alat-alat gelas (Pyrex) yang biasa digunakan di laboratorium.
Bahan
Bahan yang digunakan dalam penelitian ini adalah kristal EPMS (STFI Bandung), standar EPMS 99,9% (Tokyo Chemical
Industry), akuades (Amidis), urea teknis
(Pudak), kaca objek (Microscope slide Cat No. 7101), cover glass (Manzel Glaser), kertas perkamen, membran filter 0,45 μm (Whatman PESS w/pp), dan etanol 96% (Fulltime). Preparasi Kokristal EPMS-Urea
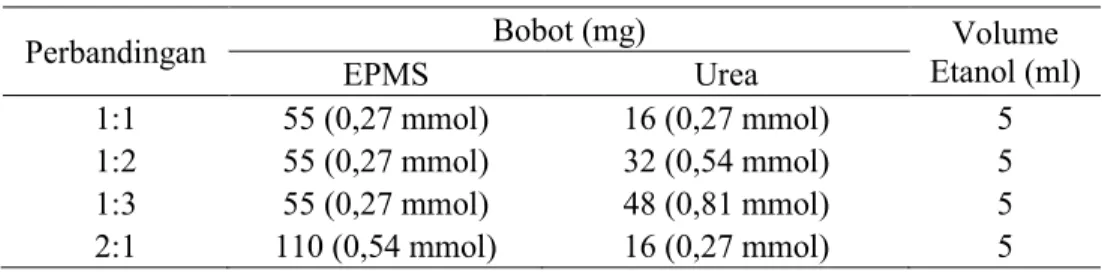
Preparasi kokristal EPMS-Urea menggunakan metode solvent evaporation dengan perbandingan stoikiometri 1:1, 1:2, 1:3, dan 2:1 seperti pada Tabel 1.
Tabel 1. Formula Kokristal EPMS-urea
Perbandingan Bobot (mg) Etanol (ml) Volume
EPMS Urea
1:1 55 (0,27 mmol) 16 (0,27 mmol) 5
1:2 55 (0,27 mmol) 32 (0,54 mmol) 5
1:3 55 (0,27 mmol) 48 (0,81 mmol) 5
2:1 110 (0,54 mmol) 16 (0,27 mmol) 5 EPMS dan urea dilarutkan dalam etanol
96% lalu disonikasi selama 10 menit. Pelarut diuapkan pada temperatur ruang selama 24 jam sampai terbentuk kokristal.
Karakterisasi Kokristal EPMS-Urea
Kokristal EPMS-Urea dikarakterisasi menggunakan mikroskop digital untuk menganalisis morfologi permukaannya. Uji dilakukan dengan meletakkan kurang lebih 3
5 mg sampel di atas gelas objek, ditetesi etanol
1-2 tetes, dan morfologi kristal yang terbentuk diamati.
Kokristal EPMS-urea yang telah terbentuk selanjutnya ditetapkan kadarnya untuk mengetahui jumlah EPMS yang terjerap dalam sistem kokristal. Penetapan kadar dilakukan dengan melarutkan kokristal EPMS-urea menggunakan aqua pro injection secukupnya. Larutan tersebut dikocok menggunakan alat Vortex hingga homogen dan disentrifugasi dengan kecepatan 3000 rpm selama 10 menit. Endapan tersebut dikeringkan menggunakan oven kemudian dilarutkan dengan metanol : air (70:30) dan diencerkan hingga 10 ppm dan dianalisis menggunakan HPLC. Fase gerak yang digunakan methanol : air (70:30) dan fase diam C18.
EPMS dan kokristal EPMS-urea dikarakterisasi menggunakan spektrofotometer FTIR-ART (attenuated total reflectance) untuk menganalisis gugus fungsinya. EPMS dan kokristal EPMS-urea masing-masing diletakkan pada holder yang digunakan adalah ZnSe ATR.
EPMS dan kokristal EPMS-urea dikarakterisasi menggunakan Powder X-Ray
Diffrection (PXRD) untuk menganalisis
perubahan kristalinitasnya. Sebanyak 200 mg sampel EPMS diletakkan pada wadah sampel dan diratakan dengan spatula. Pola difraksi serbuk direkam dengan difraktometer sinar-X
menggunakan logam Cu, filter Kα sebagai sumber. Difraktogram dicatat pada kondisi tegangan 45 kV, arus 25 mA, dan kecepatan
scanning 0,05 oC per detik. Persentase kristalinitas dihitung dengan menggunakan aplikasi match!3 dengan memasukkan data hasil XRD dalam bentuk XRDML.file ke dalam aplikasi tersebut. Aplikasi match!3 akan menetapkan degree of crystallinity (DOC) dari data hasil XRD.
Kokristal EPMS-urea diuji untuk menganalisis peningkatan kelarutan yang terjadi. EPMS dan kokristal EPMS-urea ditimbang setara 50 mg EPMS, dilarutkan ke dalam 50 ml akuades. Larutan diagitasi menggunakan shaker dengan kecepatan 400 rpm selama 24 jam pada temperatur 25 oC. Larutan disaring menggunakan membran filter 0,45 μm, kemudian konsentrasi EPMS dalam filtrat dianalisis mengunakan spektrofotometer UV-Vis pada panjang gelombang maksimum EPMS, yaitu 310 nm. Kurva kalibrasi spektrofotometer UV-Vis standar EPMS dibuat dengan menganalisis konsentrasi standar EPMS 2, 3, 4, 5, dan 6 ppm.
HASIL DAN PEMBAHASAN
Kokristal EPMS-urea yang telah terbentuk diamati di bawah mikroskop. Morfologi EPMS, urea, dan kokristal EPMS-urea dapat dilihat pada Gambar 2.
6 Gambar 2. Morfologi (a). EPMS, (b). Urea, (c). kokristal Urea 1:1, (d). kokristal
EPMS-Urea 1:2, (e). kokristal EPMS-EPMS-Urea 1:3, (f). kokristal EPMS-EPMS-Urea 2:1 (Perbesaran 40x) Kokristal EPMS-urea yang dihasilkan
dari metode solvent evaporation memiliki bentuk kristal prismatik. Selain itu, ukuran kokristal EPMS-urea cenderung lebih kecil dibandingkan dengan ukuran EPMS meskipun perlu analisis lebih jauh lagi untuk memastikan secara kuantitatif ukuran partikel kokristal EPMS-urea ini. Namun demikian, ukuran kokristal EPMS-urea yang cenderung lebih kecil menunjukkan peningkatan luas permukaan partikel merupakan salah satu sebab peningkatan luas area partikel yang kontak dengan air. Hal tersebut menyebabkan peningkatan kelarutan kokristal EPMS-urea dibandingkan dengan EPMS.
Kokristal EPMS-urea ditetapkan kadarnya menggunakan HPLC untuk memastikan bahwa EPMS terjerap dalam
sistem kokristal. Hasil analisis menunjukkan bahwa EPMS masih terjerap dalam sistem kokristal dengan kadar 91 – 106% di mana kadar ini masih memenuhi rentang toleransi zat aktif pada farmakope yaitu tidak kurang dari 90% dan tidak lebih dari 110% (Departemen Kesehatan RI, 2014).
EPMS dan kokristal EPMS-urea dikarakterisasi menggunakan spektrofotometer FTIR untuk menganalisis interaksi hidrogen yang terjadi antara EPMS dan urea sehingga dapat memastikan bahwa kokristal terbentuk, serta memastikan tidak terbentuk gugus fungsi baru yang akan mempengaruhi efek farmakologi EPMS. Gambar 3 menunjukkan spektrum FTIR EPMS, urea, dan kokristal EPMS-urea.
7 Gambar 3. Spektrum FTIR (a) EPMS, (b) Urea, (c) Kokristal EPMS-Urea 1:1, (d) Kokristal
EPMS-Urea 1:2, (e) Kokristal EPMS-Urea 1:3, dan (f) Kokristal EPMS-Urea 2:1 Berdasarkan hasil karakterisasi
menggunakan FTIR pada Gambar 3, proses pembentukan kokristal dengan metode solvent
evaporation tidak merusak ikatan yang terdapat
dalam EPMS. Pola spektrum kokristal EPMS-urea secara umum memiliki kesesuaian dengan spektrum EPMS dan urea. Puncak pada bilangan gelombang 824 cm-1 (kokristal EPMS-urea 1:1), 828 cm-1 (kokristal EPMS-urea 1:2), 826 cm-1 (kokristal EPMS-urea 1:3), 826 cm-1 (kokristal EPMS-urea 2:1) menunjukkan adanya ikatan C-H para yang bersesuaian dengan puncak EPMS (825 cm-1). Puncak pada bilangan gelombang 2972 cm-1 (kokristal EPMS-urea 1:1), 2971 cm-1 (kokristal EPMS-urea 1:2), 2973 cm-1 (kokristal EPMS-urea 1:3), 2973 cm-1 (kokristal EPMS-urea 2:1) menunjukkan adanya ikatan =C-H aromatik yang bersesuaian dengan puncak EPMS (2971
cm-1). Puncak pada bilangan gelombang 1158 cm-1 (kokristal EPMS-urea 1:1), 1164 cm-1 (kokristal EPMS-urea 1:2), 1165 cm-1 (kokristal EPMS-urea 1:3), 1166 cm-1 (kokristal EPMS-urea 2:1) menunjukkan adanya ikatan C-O yang bersesuaian dengan puncak EPMS (1167 cm-1). Puncak tampak pada bilangan gelombang 1741 cm-1 (kokristal EPMS-urea 1:1), 1760 cm-1 (kokristal EPMS-urea 1:2), 1721 cm-1 (kokristal EPMS-urea 1:3), 1731 cm -1 (kokristal EPMS-urea 2:1) menunjukkan adanya ikatan C=O yang bersesuaian dengan puncak EPMS (1699 cm-1). Pergeseran puncak C=O pada kokristal ke arah bilangan gelombang lebih besar dimungkinkan karena telah terbentuknya ikatan hidrogen antara EPMS dan urea (Rohman, 2014). Ikatan O-H merupakan ikatan yang cukup kuat. Ikatan yang kuat akan bervibrasi pada bilangan gelombang yang lebih
8 besar. Puncak pada bilangan gelombang 3331
cm-1 dan 1498 cm-1 (kokristal EPMS-urea 1:1), 3426 cm-1 dan 1497 cm-1 (kokristal EPMS- urea 1:2), 3428 cm-1 dan 1509 cm-1 (kokristal EPMS-urea 1:3), 3429 cm-1 dan 1509 cm-1 (kokristal EPMS-urea 2:1) menunjukkan adanya ikatan N-H yang bersesuaian dengan puncak urea (3330 cm- 1 dan 1548 cm-1). Berdasarkan analisis FTIR, ikatan hidrogen antara EPMS dan urea terbentuk dalam sistem kokristal EPMS-urea, dan dengan tidak terbentuknya gugus fungsi baru dihipotesiskan bahwa efek farmakologi EPMS tidak akan terganggu.
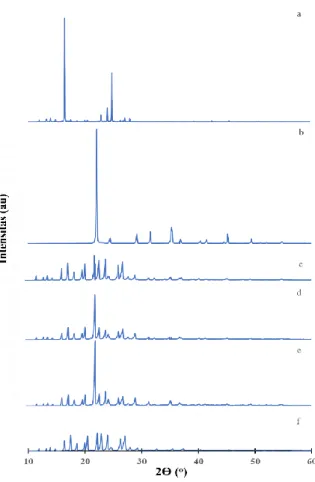
Gambar 4 menunjukkan difraktogram EPMS, urea, dan kokristal EPMS-urea.
Karakterisasi menggunakan PXRD dilakukan untuk mengidentifikasi bentuk kristal, dengan membandingkan letak dan intensitas garis pada difraktogram terhadap garis pada foto sampel yang telah diketahui (Qiao, et.al., 2011). Difraksi sinar-X merupakan metode yang handal untuk karakterisasi interaksi padatan antara dua komponen padat (solid state
interaction), apakah terbentuk fase kristalin
baru atau tidak. Jika terbentuk fase kristalin baru dari hasil interaksi antara kedua komponennya, maka akan teramati secara nyata gambaran difraktogram sinar-X yang berbeda antara komponen tunggal dan komponen campurannya (Trask et al., 2006).
Gambar 4. Pola Difraksi X-ray (a) EPMS, (b) Urea, (c) Kokristal EPMS-Urea 1:1, (d) Kokristal EPMS-Urea 1:2, (e) Kokristal EPMS-Urea 1:3, dan (f) Kokristal EPMS-Urea 2:1
9 Proses pembentukan kokristal
menyebabkan perubahan pola XRD memperlihatkan puncak baru, perubahan puncak, dan intensitas yang mengindikasikan terbentuknya kisi kristal baru (Dhunmal, 2010). Berdasarkan pola difraksi sinar-X, diketahui EPMS, urea, dan kokristal EPMS-Urea memiliki pola difraksi yang tajam yang menunjukkan bentuk kristal. Hal ini dapat dilihat dari intensitas dan lebar FWHM (Full
Width at Half Maximal) 2θ atau lebar setengah
tinggi difraksi sinar-X. FWHM tersebut dapat memberikan informasi tentang kristalinitas suatu kristal. FWHM difraktogram EPMS, urea, dan kokristal EPMS-urea terlihat sempit, berarti EPMS, urea, dan kokristal EPMS-urea memiliki persen kristalinitas yang tinggi atau bentuknya kristal. Kokristal EPMS-urea menunjukkan puncak-puncak baru yang berbeda dengan EPMS dan urea.
Pada difraktogram kokristal EPMS-urea
1:1 (Gambar 4c) terlihat adanya puncak baru pada 2θ = 18,6° dan 23,96°. Kokristal EPMS-urea 1:2 (Gambar 4d) menunjukkan adanya puncak baru pada 2θ = 18,53°; 19,93°; dan 23,96°. Kokristal EPMS-urea 1:3 (Gambar 4e) menunjukkan adanya puncak baru pada 2θ = 18,56° dan 23,94°. Kokristal EPMS-urea 2:1 (Gambar 4f) menunjukkan adanya puncak baru pada 2θ = 18,56° dan 23,98°. Adanya puncak baru tersebut mengidentifikasikan terbentuknya formasi kisi kristal baru. Difraktogram menunjukkan kristalinitas EPMS sebesar 71,68%, kristalinitas urea sebesar 99,98%, kristalinitas kokristal EPMS-urea 1:1 sebesar 30,70%, kristalinitas kokristal EPMS-urea 1:2 sebesar 29,49%, kristalinitas kokristal EPMS-urea 1:3 sebesar 51,29%, dan kristalinitas kokristal 2:1 sebesar 56,09%.
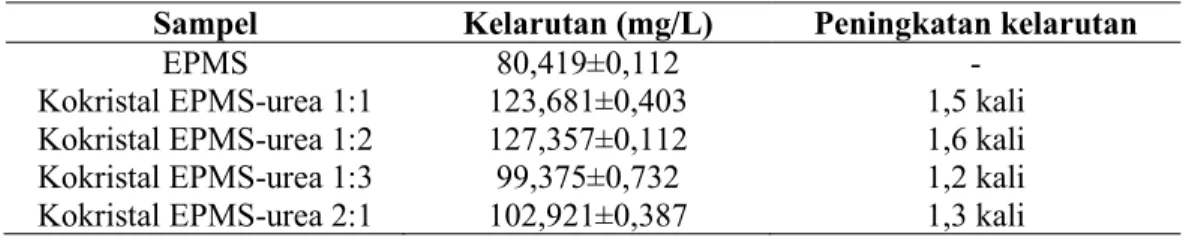
Uji kelarutan EPMS dan kokristal EPMS-urea pada semua perbandingan dapat dilihat pada Tabel 2.
Tabel 2. Uji Kelarutan EPMS dan Kokristal EPMS-Urea
Sampel Kelarutan (mg/L) Peningkatan kelarutan
EPMS 80,419±0,112 -
Kokristal EPMS-urea 1:1 123,681±0,403 1,5 kali Kokristal EPMS-urea 1:2 127,357±0,112 1,6 kali Kokristal EPMS-urea 1:3 99,375±0,732 1,2 kali Kokristal EPMS-urea 2:1 102,921±0,387 1,3 kali Tabel 2 menunjukkan bahwa kokristal
EPMS-urea pada semua perbandingan mengalami peningkatan kelarutan. Terdapat beberapa faktor yang dapat meningkatkan kelarutan kokristal EPMS-urea berdasarkan karakterisasinya. Urea sebagai koformer yang mudah larut dalam air berkontribusi dalam peningkatan kelarutan EPMS dengan
meningkatkan keterbasahan EPMS sehingga dapat mempermudah air kontak dengan EPMS pada proses pelarutan. Kokristal EPMS-urea memiliki ukuran lebih kecil dibandingkan EPMS jika dilihat di bawah mikroskop. Ukuran kokristal EPMS-urea menyebabkan luas permukaannya besar saat kontak dengan air sehingga kelarutan kokristal EPMS-urea dalam
10 air meningkat. Ikatan hidrogen antara EPMS
dan urea, selain berkontribusi membentuk kokristal, ikatan hidrogen ini juga dapat meningkatkan kelarutan (Rachmaniar, et al., 2020a; Rachmaniar, et al., 2020b). Hal ini disebabkan ikatan hidrogen pada kokristal EPMS-urea mudah pecah saat kontak dengan air. Berdasarkan data XRD, kristalinitas kokristal EPMS-urea lebih rendah dibandingkan EPMS. Kristalinitas kokristal EPMS-urea yang rendah menunjukkan susunan atomnya kurang teratur dan ikatannya lemah sehingga saat kontak dengan air ikatan antara atomnya akan mudah pecah tanpa membutuhkan energi yang tinggi. Dengan demikian, kokristal EPMS-urea akan lebih mudah larut dalam air dibandingkan EPMS yang kristalinitasnya lebih tinggi.
Secara berturut-turut, kelarutan kokristal EPMS-urea 1:1, 1:2, 1:3 dan 2:1 meningkat 1,5 kali; 1,6 kali; 1,2 kali; 1,3 lebih tinggi dibandingkan dengan kelarutan EPMS. Hal ini berkesesuaian dengan tingkat kristalinitas masing-masing kokristal EPMS-urea. Semakin tinggi kristalinitas, semakin rendah kelarutan dalam air. Terdapat perbedaan pada kokristal EPMS-urea 1:3 dan 2:1 dimana semakin tinggi kristalinitas, semakin besar kelarutan EPMS, tetapi tidak berbeda secara signifikan. Kokristal EPMS-urea 1:2 menunjukkan peningkatan kelarutan paling tinggi sebab jumlah koformer urea dalam sistem kokristal tersebut sudah optimal untuk membentuk kokristal dengan kristalinitas yang paling rendah. Kokristal EPMS-urea 1:3 menunjukkan kelarutan yang paling rendah sebab koformer urea yang
digunakan berlebih sehingga kemungkinan tidak membentuk ikatan dengan EPMS. Kokristal EPMS-urea 2:1 menunjukkan kelarutan yang rendah dan tidak berbeda signifikan dengan kokristal EPMS-urea 1:3 sebab jumlah EPMS lebih banyak dibandingkan urea sehingga tidak cukup untuk ditingkatkan keterbasahannya oleh urea. SIMPULAN
Berdasarkan hasil penelitian, dapat disimpulkan bahwa kokristal EPMS-urea berhasil dibentuk menggunakan metode solvent
evaporation. Kadar EPMS dalam sistem
kokristal yang terbentuk adalah sebesar 91 – 106%. Kelarutan kokristal EPMS-urea dalam air lebih tinggi dibandingkan dengan kelarutan EPMS. Kelarutan kokristal EPMS-urea dengan perbandingan 1:1; 1:2; 1:3; 2:1 dalam air secara berturut-turut meningkat 1,5; 1,6; 1,2; 1,3 kalinya dibandingkan dengan EPMS. Untuk penelitian selanjutnya, dapat dilakukan pembentukan kokristal EPMS menggunakan koformer dari golongan asam amino atau gula untuk dapat meningkatkan kelarutan EPMS lebih tinggi.
UCAPAN TERIMA KASIH
Kami ucapkan terima kasih atas dukungan Yayasan Hazanah yang mendukung dan mendanai penelitian ini dalam Hibah Fundamental untuk Sekolah Tinggi Farmasi Indonesia dengan No. 12/LPPM/STFI/03/2019. DAFTAR PUSTAKA
Barus, R. 2009. “Amidasi Etil p-Metoksisinamat yang Diisolasi dari Kencur (Kaempferia galanga, Linn).”
11
Tesis. Medan: Universitas Sumatera
Utara. Hal. 23.
Bavishi, D.D, and Borkhataria, C.H. 2016. “Spring and parachute: How cocrystals enhance solubility.” Progress in Crystal
Growth and Characterization of Materials, 62(3): 1-8.
Departemen Kesehatan RI. 2014. Farmakope
Indonesia edisi V. Jakarta: Depkes RI.
Dhumal, R., Kelly, A.L., York, P., Coates, P.D., and Paradkar, A. 2010. “Crystallization and Stimultaneous Aggromeration Using Hot Melt Extrusion.” Journal Pharm
Research, 27: 2725-2733.
Gosal, F., Paringkoan, B., and Tandean, N.W. 2012. “Patofisiologi dan Penanganan Gastropati Obat Antiinflamasi.” Journal of the Indonesian Medical Association, 62 (11):
445-446.
Gunawan, S.G., Setiabudy R., Nefrialdi., and Elysabeth. 2012. Farmakologi dan
Terapi, Ed. 5. Depok: Universitas
Indonesia. Hal. 232.
Jung, Min-Sook, Jeong-Soo, Kim, Min- Soo, Kim, Amjad, A., Wonkyung, Cho, Sung-Joo, Hwang, and Sitaram, P. Velaga. 2010. “Bioavailability of Indometacin-Saccharin Cocrystal.” Journal of Pharmacy and Pharmacology, 62:
1560-1568.
Palanisamy, V., Sanphui, P., Prakasha, M., and Chernyshev, V. 2019. “Multicomponent solid forms of the uric acid reabsorption inhibitor lesinurad and cocrystal polymorphs with urea: DFT simulation and solubility study.” Acta Cryst, 75: 1-16.
Qiao, N., Li, M., Schlindwein, W., Malek, N., Davies, A., and Trappitt, G. 2011. “Pharmaceutical cocrystals: An overview.” International Journal of
Pharmaceutics, 419 (1-2): 1–11.
Rachmaniar, R., Riasari, H., Fauziah, L., Kenti., dan Ferdiansyah, R. 2020a. “The
effect of cocrystallization method and citric acid as coformer on water solubility of ethyl p-metoxycinnamate particle.” AIP Conference Proceedings, 2219: 0800131-5.
Rachmaniar, R., Warya, S., Ferdiansyah, R., Riasari, H., Gumelar, A., dan Kenti. 2020b. “Pharmaceutical Cocrystal of Ethyl p-Methoxycinnamate: Formulation and Characterization.”
Advances in Health Sciences Research,
26:96-101.
Rajbhar, P., Gautam, S.S., Prasad, R.K., Patel, A.K., and Sahu, A.K. 2016. “Co-Crystals Formation of Clarithromycin with Urea: An Efficient Approach to Enhance the Solubility and Dissolution Rate.”
American Journal of Advanced Drug Delivery, 4 (2): 012-0202.
Riasari, H., Rachmaniar, R., and Febriani, Y. 2016. “Effectiveness of Anti- Inflammatory Plaster from Kencur (Kaempferia galanga L.) Rhizome Ethanol Extract.” International Journal
of Pharmaceutical Science and
Research, 7 (4): 1746.
Riasari, H., and Rachmaniar, R. 2018. “Prospect of Patch Design From Crystal Etil p- metoxycinnamate of Kencur as an Alternative Drug Delivery System Antiinflamation.” Journal of Pharmaceutical Sciences and Research,
8: 90-99.
Rohman, A. 2014. Spektroskopi Inframerah
dan Kemometrika untuk Analisis Farmasi. Yogyakarta: Pustaka Pelajar.
Hal. 9-30.
Thenge, R.R, Patond, V.B., Adhao, V.S., Ajmire, P.V., Barde, L.N., Mahajan, N.M., and Tekade, N.P. 2017. “Preparation and Characterization Of Co-Crystals of Diacerein.” Indonesian J.
Pharm., 28 (1): 34-41.
Trask, A.V., Haynes, D.A., Motherwell, W.D.S., and Jones W. 2006. “Screening of crystalline salts via mechanochemistry.” Chem. Commun.,
12 Hal. 51-53.
Umar, M.I., Asmawi, M.A., Sadikun, A., Atangwho, I.J., Yam, M.F., Altaf, R., and Ahmed, A. 2012. “Bioactivity-Guided Isolation of Ethyl-p-methoxycinnamate, an Anti- inflammatory Constituent, from Kaempferia galanga L. Extracts.”
Molecules, 17 (7): 8720-8734.
Zaini, E., Auzal, H., Sundani, N.S., and Dwi, S. 2011. “Peningkatan Laju Pelarutan Trimetoprim Melalui Metode Ko-Kristal dengan Nikotinamida.” Jurnal Farmasi