VALIDASI METODE KOLORIMETRI DENGAN PEREAKSI ALUMINIUM KLORIDA UNTUK PENETAPAN KADAR FLAVONOID TOTAL DALAM
SEDIAAN GEL BASIS NATRIUM CARBOXYMETHYLCELLULOSE
LSKRIPSI
Diajukan untuk Memenuhi Salah Satu Syarat Memperoleh Gelar Sarjana Farmasi (S.Farm)
Program Studi Ilmu Farmasi
Oleh:
Laurentius Dian Ardiyanto NIM : 048114013
FAKULTAS FARMASI UNIVERSITAS SANATA DHARMA
ii
VALIDASI METODE KOLORIMETRI DENGAN PEREAKSI ALUMINIUM KLORIDA UNTUK PENETAPAN KADAR FLAVONOID TOTAL DALAM
SEDIAAN GEL BASIS NATRIUM CARBOXYMETHYLCELLULOSE
SKRIPSI
Diajukan untuk Memenuhi Salah Satu Syarat Memperoleh Gelar Sarjana Farmasi (S.Farm)
Program Studi Ilmu Farmasi
Oleh:
Laurentius Dian Ardiyanto NIM : 048114013
FAKULTAS FARMASI UNIVERSITAS SANATA DHARMA
Skripsi
VALIDASI METODE KOLORIMETRI DENGAN PEREAKSI ALUMINIUM
KLORIDA UNTUK PENETAPAN KADAR FLAVONOID TOTAL DALAM
SEDIAAN GEL BASIS NATRIUM CARBOXYMETHYLCELLULOSE
Yang diajukan oleh: Laurentius Dian Ardiyanto
NIM : 048114013
telah disetujui oleh
Pembimbing
Jeffry Julianus, M.Si
iv
Pengesahan Skripsi Berjudul
VALIDASI METODE KOLORIMETRI DENGAN PEREAKSI ALUMINIUM
KLORIDA UNTUK PENETAPAN KADAR FLAVONOID TOTAL DALAM
SEDIAAN GEL BASIS NATRIUM CARBOXYMETHYLCELLULOSE
Oleh :
Laurentius Dian Ardiyanto NIM : 048114013
Dipertahankan di hadapan Panitia Penguji Skripsi Fakultas Farmasi
Universitas Sanata Dharma pada tanggal : 22 Mei 2008
Mengetahui Fakultas Farmasi Universitas Sanata Dharma
Dekan
(Rita Suhadi, M.Si., Apt) Pembimbing :
(Jeffry Julianus, M.Si)
Panitia Penguji :
Tanda Tangan
1. Jeffry Julianus, M.Si ...
Untuk
k para e
Wit
emanue
th hope.
elku terc
...
vi
LEMBAR PERNYATAAN PERSETUJUAN
PUBLIKASI KARYA ILMIAH UNTUK KEPENTINGAN AKADEMIS
Yang bertanda tangan di bawah ini, saya mahasiswa Universitas Sanata Dharma :
Nama : Laurentius Dian Ardiyanto
Nomor Mahasiswa : 048114013
Demi pengembangan ilmu pengetahuan, saya memberikan kepada Perpustakaan
Universitas Sanata Dharma karya ilmiah saya yang berjudul :
VALIDASI METODE KOLORIMETRI DENGAN PEREAKSI ALUMINIUM KLORIDA UNTUK PENETAPAN KADAR FLAVONOID TOTAL DALAM SEDIAAN GEL BASIS NATRIUM CARBOXYMETHYLCELLULOSE
beserta perangkat yang diperlukan (bila ada). Dengan demikian saya memberikan kepada
Perpustakaan Universitas Sanata Dharma hak untuk menyimpan, me-ngalihkan dalam
bentuk media lain, mengelolanya dalam bentuk pangkalan data, mendistribusikan secara
terbatas, dan mempublikasikannya di Internet atau media lain untuk kepentingan
akademis tanpa perlu meminta ijin dari saya maupun memberikan royalti kepada saya
selama tetap mencantumkan nama saya sebagai penulis.
Demikian pernyataan ini yang saya buat dengan sebenarnya.
Dibuat di Yogyakarta
Pada tanggal : 27 Mei 2008
Yang menyatakan
PRAKATA
Alleluia…Alleluia…Alleluia...
Puji syukur kepada Allah Bapa, Putra dan Roh kudus atas penyertaannya dari awal penelitian hingga laporan akhir ini selesai. Laporan akhir penelitian ini disusun untuk memenuhi salah satu persyaratan untuk memperoleh gelar Sarjana Strata Satu Program Studi Ilmu Farmasi (S.Farm).
Berbagai kesulitan telah berhasil dilewati dan akhirnya ucapan terimakasih yang setulus-tulusnya dihaturkan kepada pihak-pihak yang telah memberikan bantuan hingga akhir penelitian.
Penulis mengucapkan terimakasih kepada :
1. Papa, Mama, dan Ayu atas kasih sayang dan doanya yang menguatkan
2. Rita Suhadi, M.Si., Apt. selaku Dekan Fakultas Farmasi Universitas Sanata Dharma
3. Jeffry Julianus, M.Si selaku pembimbing skripsi atas segala bimbingan dan arahannya selama penelitian berlangsung
4. Christine Patramurti, M.Si., Apt. dan Yohanes Dwiatmaka, M.Si.selaku dosen penguji atas kritik, saran, dan bantuannya hingga laporan ini selesai
5. Prof. Dr. Sudibyo Martono, M.S., Apt. atas diskusinya yang banyak membantu penulis selama penelitian
viii
7. Romo Drs. P. Sunu Hardijanto, S.J., S.Si, M.Sc. atas diskusi-diskusinya tentang statistik dan etika penelitian
8. Enade Perdana Istyastono, S.F., Apt. dan A. Nora Iska Harnita M.Si, Apt. atas bantuannya untuk memperoleh literatur untuk penelitian ini
9. Teman-teman Tea Project Agung ‘Simbah’, Resty ‘Simak’, Yoyo, Dona ‘Donce’, Ika ‘Monyi’, Tere, Rinta, Selvi, dan Fhery atas kerjasamanya. Terutama untuk Resty atas bantuannya menyediakan sampel untuk penelitian dan Selvi partner penelitian hingga akhir.
10.Mas Kunto, Pak Parlan, Pak Prapto, dan Mas Sarwanto atas segala bantuan selama penulis bekerja di laboratorium.
11.Pipit, Ayu, Rudy, Desy, Silvia ‘Cipi’ atas kebersamaan selama studi di Fakultas Farmasi USD
12.Rohkaters 04, gereja kecilku atas suka duka dan pengalaman iman yang mendewasakan
13.Teman-teman di Fakultas Farmasi terutama FST 04 dan kelas A 04
14.Semua pihak yang membantu selama penulis menyelesaikan penelitian ini yang tidak dapat disebutkan satu-persatu.
Tak ada gading yang tak retak, untuk itu segala kritik dan saran terhadap penelitian ini amat diharapkan. Semoga penelitian ini bermanfaat bagi para pembaca.
PERNYATAAN KEASLIAN KARYA
Saya menyatakan dengan sesungguhnya bahwa skripsi yang saya tulis ini tidak memuat karya atau bagian karya orang lain, kecuali yang telah disebutkan dalam kutipan dan daftar pustaka, sebagaimana layaknya karya ilmiah.
Yogyakarta, 27 Mei 2008 Penulis
x
DAFTAR ISI
HALAMAN JUDUL ... ii
HALAMAN PERSETUJUAN PEMBIMBING ... iii
HALAMAN PENGESAHAN ... iv
HALAMAN PERSEMBAHAN ... v
HALAMAN PERSETUJUAN PUBLIKASI ... vi
PRAKATA ... vii
PERNYATAAN KEASLIAN KARYA ... ix
DAFTAR ISI ... x
DAFTAR TABEL ... xiv
DAFTAR GAMBAR ... xv
DAFTAR LAMPIRAN ... xvi
INTISARI ... xvii
ABSTRACT ... xviii
BAB I. PENDAHULUAN ... 1
A. Latar Belakang ... 1
B. Permasalahan ... 3
C. Tujuan Penelitian ... 3
D. Manfaat Penelitian ... 3
E. Keaslian Karya ... 3
BAB II. TINJAUAN PUSTAKA ... 5
1. Sifat-sifat fisika-kimia flavonoid ... 5
2. Reaksi kimia flavonoid ... 6
3. Flavonoid teh hijau ... 7
B. Kuersetin ... 7
C. Analisis Sediaan Gel ... 8
D. Deskripsi Senyawa Eksipien Penyusun Formula Gel ... 9
1. Natrium carboxymethylcellulose ... 9
2. Asam sitrat ... 10
3. Propilen glikol ... 10
4. Metil paraben ... 11
5. Etanol ... 11
E. Spektrofotometer UV-Vis ... 11
F. Kolorimetri ... 14
1. Penetapan kadar flavonoid secara kolorimetri ... 15
2. Absorpsi radiasi elektromagnetik oleh senyawa kompleks ... 16
G. Parameter Validitas Metode Analisis ... 16
1. Akurasi ... 17
2. Presisi ... 17
3. Spesifisitas ... 17
4. Batas deteksi ... 18
5. Batas kuantitasi ... 18
6. Linearitas ... 18
xii
H. Keterangan Empiris ... 19
BAB III. METODOLOGI PENELITIAN ... 21
A. Jenis dan rancangan penelitian ... 21
B. Variabel penelitian ... 21
C. Definisi Operasional ... 21
D. Bahan Penelitian ... 22
E. Alat Penelitian ... 22
F. Tatacara Penelitian ... 22
1. Pembuatan pelarut dan pereaksi ... 22
2. Pembuatan sampel ... 23
3. Pembuatan blangko ... 23
4. Pembuatan larutan baku ... 23
5. Penentuan operating time (OT) ... 24
6. Penetapan panjang gelombang maksimum ... 24
7. Pembuatan kurva baku ... 24
8. Preparasi sampel ... 25
9. Penetapan kadar flavonoid dalam sampel ... 26
G. Analisis Hasil ... 26
BAB IV. HASIL DAN PEMBAHASAN ... 27
A. Optimasi Kondisi Pengukuran ... 27
1. Penentuan operating time (OT) ... 27
2. Penentuan panjang gelombang maksimum ... 28
C. Preparasi Sampel ... 31
1. Isolasi analit dari sampel ... 32
2. Tahap hidrólisis ... 34
3. Ekstraksi cair-cair ... 35
D. Penetapan Kadar Flavonoid dalam Sampel... 36
E. Analisis Validitas Metode ... 38
1. Spesifisitas ... 38
2. Akurasi ... 38
3. Presisi ... 39
4. Linearitas ... 39
BAB V. KESIMPULAN, SARAN DAN KETERBATASAN ... 41
A. Kesimpulan ... 41
B. Saran ... 41
C. Keterbatasan ... 41
DAFTAR PUSTAKA ... 42
LAMPIRAN ... 45
xiv
DAFTAR TABEL
Tabel I. Daftar beberapa reagen untuk flavonoid ... 6
Tabel II. Formula gel untuk penelitian ... 9
Tabel III. Kategori metode analisis dan persyaratan validasi ... 19
Tabel IV. Hubungan kadar kuersetin dengan absorbansi ... 30
DAFTAR GAMBAR
Gambar 1. Rangka dasar flavonoid ... 5
Gambar 2. Sistem penomoran pada cincin flavonoid ... 5
Gambar 3. Sruktur kimia kuersetin ... 8
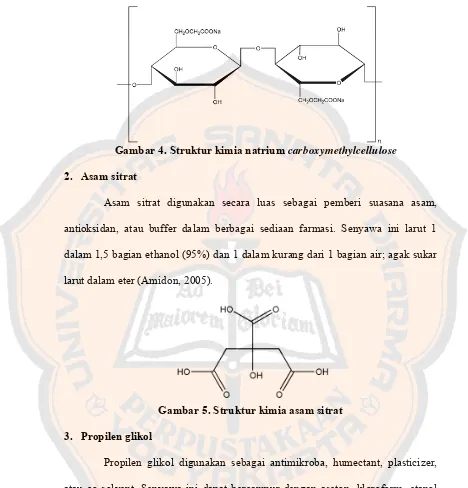
Gambar 4. Struktur kimia natrium carboxymethylcellulose ... 10
Gambar 5. Struktur kimia asam sitrat ... 10
Gambar 6. Struktur kimia propilen glikol ... 10
Gambar 7. Struktur kimia metil paraben ... 11
Gambar 8. Diagram transisi elektron ... 14
Gambar 9. Reaksi pembentukan kompleks antara kuersetin dengan aluminium klorida dalam suasana asam ... 15
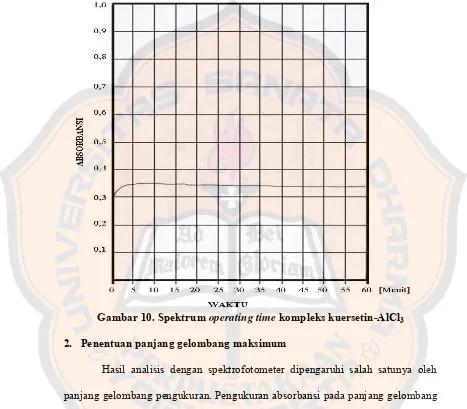
Gambar 10. Spektrum operating time kompleks kuersetin-AlCl3 ... 28
Gambar 11. Spektrum panjang gelombang maksimum kompleks kuersetin-AlCl3 ... 29
Gambar 12. Kurva baku kuersetin ... 31
Gambar 13. Ikatan hidrogen natrium carboxymethylcellulose membentuk cross link ... 32
Gambar 14. Endapan CMC-Na yang terbentuk pada akhir proses isolasi ... 34
Gambar 15. Reaksi hidrolisis flavonoid ... 35
xvi
DAFTAR LAMPIRAN
Lampiran 1. Penimbangandan contoh perhitungan kadar larutan baku ... 45
Lampiran 2. Penimbangan dan contoh perhitungan kadar teoritis sampel ... 47
Lampiran 3. Data dan contoh perhitungan % recovery ... 48
Lampiran 4. Perhitungan koefisien variansi (CV) ... 50
INTISARI
Untuk melengkapi penelitian optimasi formula sediaan gel sunscreen teh hijau dengan gelling agent natrium carboxymethylcellulose (CMC-Na) dikembangkan suatu metode analisis kuantitatif yang dapat digunakan dalam kontrol kualitas. Metode kolorimetri dengan pereaksi Aluminium klorida yang digunakan untuk menetapkan kadar flavonoid total diadaptasi untuk maksud ini. Adaptasi suatu metode analisis dengan sampel yang berbeda membutuhkan proses validasi kembali untuk menjaga validitas metode. Penelitian ini bertujuan untuk mengetahui akurasi dan presisi metode kolorimetri dengan pereaksi aluminium klorida untuk penetapan kadar flavonoid dalam bentuk sediaan gel.
Penelitian ini difokuskan pada proses preparasi sampel yang terdiri dari tiga tahap, isolasi analit dari basis gel menggunakan aseton, hidrolisis untuk memecah ikatan glikosida dengan HCl 25%, dan ekstraksi cair – cair untuk memisahkan aglikon dengan glikon. Proses ini diharapkan mampu mempertahankan validitas metode.
Hasil penelitian menunjukkan metode ini memiliki akurasi dan presisi yang dapat diterima. Akurasi ditunjukkan dengan nilai % recovery sebesar 91,09%. Presisi ditunjukkan dengan nilai CV sebesar 5,25%. Hasil ini membuktikan bahwa metode kolorimetri dengan pereaksi aluminium klorida memiliki validitas yang baik ketika digunakan pada sediaan gel.
xviii ABSTRACT
To complete research of optimization formula of green tea gel dosage forms as sunscreen, a quantitative analysis method which can be used in quality kontrol had been developed. Colorimetry method with aluminium chloride as reagent for total flavonoid assay had been adapted for this purpose. Adaptation some analytical method with different sample require revalidation process to maintain method validity. The aim of this research is to find out accuration and precision of colorimetry method with aluminium chloride reagents for quantitative analysis of flavonoids in gel dosage forms.
This research had focused in sample preparation included three steps, analite isolation from gel base using acetone, hydrolysis to brake glycosidic bonds with HCl 25%, and liquid – liquid extraction to separate aglicon and glicon. This process had expected to maintain method validity.
Result of this research show that this methods has acceptable accuration and precision. Accuration showed by 90,53% for % recovery value. Precision showed by 5,378% for coefficient of variance value. This result proved that colorimetry method with aluminium chloride as reagent has good validity when it used in gel dosage forms.
BAB I
PENDAHULUAN
A. Latar Belakang
Svobodova et al. (2003) dalam artikelnya memberikan penjelasan tentang sejumlah senyawa fenolik alam dengan struktur yang digambarkan sebagai suatu fenol (cincin aromatik yang berikatan dengan gugus hidroksil) seperti asam kafeat, asam ferulat, kuersetin, apigenin, genistein, resveratrol, asam nordihidroguaiaretat, asam karnosat, silimarin, polifenol teh, dan tanin. Senyawa-senyawa fenolik tersebut terbukti mempunyai efek protektif terhadap kerusakan kulit yang diinduksi radiasi UV. Untuk mempermudah penggunaan senyawa-senyawa fenolik alam tersebut, Wijayanti (2008) telah melakukan penelitian optimasi formula sediaan gel teh hijau sebagai dengan basis natrium
carboxymethylcellulose.
Dengan adanya perkembangan, terutama berkaitan dengan GMP (Good Manufacturing Practice), formulasi sediaan yang baik hendaknya juga didukung dengan kontrol kualitas yang baik pula. Bidang analisis kuantitatif terutama, memainkan peranan yang penting dalam kontrol kualitas. Dalam kaitannya dengan penelitian Wijayanti (2008), untuk melengkapi hasil penelitian tersebut, maka perlu disusun suatu metode analisis kuantitatif yang dapat digunakan dalam kontrol kualitas sediaan gel yang telah dikembangkan.
Polifenol teh hijau yang bertanggungjawab terhadap efek sunscreen
yang digolongkan dalam kelas flavonoid. Syah (2006) menyebutkan empat polifenol utama dalam teh hijau yaitu katekin, epikatekin, epigallokatekin, dan epigallokatekingalat. Ditinjau dari struktur kimianya keempat polifenol tersebut merupakan flavonoid (Robinson, 1991). Oleh karenanya metode analisis kuantitatif flavonoid dapat menjadi metode analisis yang rasional dalam kontrol kualitas sediaan gel teh hijau.
Aluminium klorida (AlCl3) diketahui dapat membentuk kompleks
berwarna dengan gugus hidroksi fenolik yang bertetangga dengan gugus karbonil dan dengan gugus orto dihidroksi fenolik dalam senyawa flavonoid (Markham, 1982). Gugus ini dimiliki oleh senyawa-senyawa flavonoid yang ditemukan dalam teh (Anonim, 1999).
Penelitian Pertiwi (2006), telah membuktikan validitas analisis kuantitatif flavonoid secara kolorimetri dengan pereaksi AlCl3. Selain itu peneliti yang
bersangkutan juga telah menggunakannya pada penetapan kadar flavonoid total dalam beberapa fraksi teh. Penggunaan metode tersebut untuk analisis kuantitatif sampel sediaan bentuk gel membutuhkan beberapa penyesuaian untuk menjamin validitas metode. Akurasi dan presisi yang dipengaruhi oleh proses preparasi sampel menjadi parameter utama untuk menunjukkan validitas metode ketika diterapkan dalam analisis dalam sampel gel. Untuk mengetahui validitas metode kolorimetri dengan pereaksi AlCl3 pada penetapan kadar flavonoid total dalam
B. Permasalahan
Apakah penetapan kadar flavonoid total dalam sediaan gel teh hijau secara kolorimetri dengan pereaksi aluminium klorida mempunyai akurasi dan presisi yang baik?
C. Tujuan Penelitian
Mengetahui akurasi dan presisi penetapan kadar flavonoid total dalam sediaan gel teh hijau secara kolorimetri dengan pereaksi aluminium klorida.
D. Manfaat Penelitian Manfaat yang diharapkan dari penelitian ini adalah: a. Manfaat teoritis
Memberikan pengetahuan akan metode penetapan kadar flavonoid dalam sediaan gel
b. Manfaat praktis
Menyediakan metode untuk kontrol kualitas sediaan gel dengan basis natrium
carboxymethylcellulose terutama dengan kandungan flavonoid
E. Keaslian Karya
Perbedaan penelitian ini dengan penelitian sebelumnya adalah pada sampel yang digunakan. Penelitian Pertiwi (2006) menggunakan produk teh hijau dan teh hitam sebagai sampel. Penelitian ini menggunakan sampel berupa sediaan gel. Sejauh pengetahuan penulis penelitian validasi metode kolorimetri dengan pereaksi aluminium klorida untuk penetapan kadar flavonoid total dalam sediaan gel basis natrium carboxymethylcellulose belum pernah dilakukan.
BAB II
TINJAUAN PUSTAKA
A. Flavonoid
Flavonoid ditemukan pada berbagai macam tumbuhan dengan berbagai struktur yang semuanya memiliki rangka dasar 15 atom karbon dan tersusun dalam konfigurasi C6–C3–C6. Konfigurasi tersebut menggambarkan dua gugus
benzena yang dihubungkan tiga atom karbon, dapat berupa rantai alifatik atau rantai siklik yang membentuk cincin piran sebagai cincin ketiga. Sistem penomoran cincin A dan C menggunakan angka biasa, sedangkan cincin B menggunakan angka aksen. Flavonoid banyak ditemukan terikat sebagai glikosida dengan struktur flavonoid-O-glikosida atau flavonoid-C-glikosida (Riyanto, 1990).
Gambar 1. Rangka dasar flavonoid Gambar 2. Sistem penomoran pada cincin flavonoid
1. Sifat-sifat fisika-kimia flavonoid
dengan gula (glikon) dapat meningkatkan kelarutan dari aglikon flavonoid dalam pelarut polar namun menjadikannya kurang reaktif (Markham, 1982).
Flavonoid, seperti senyawa fenol lainnya, mudah mengalami reaksi oksidasi pada suasana netral dan basa. Stabilitas flavonoid diperoleh pada suasana asam, tetapi dalam suasana asam baik panas atau dingin dalam waktu yang lama, glikosida dapat terhidrolisis (Robinson, 1991).
Flavonoid dapat mengalami perubahan kimia karena panas, enzim, keberadaan air dan pH. Untuk mencegahnya, bahan baku yang masih segar biasanya dipanaskan hingga suhu 100oC dengan oven untuk menghentikan reaksi enzimatik dan menghilangkan air (Riyanto, 1990).
2. Reaksi kimia flavonoid
Flavonoid dapat bereaksi dengan beberapa reagen untuk keperluan analisis kualitatif maupun kuantitatif. Oleh karena flavonoid biasa ditemukan dalam bentuk glikosida, maka terlebih dahulu perlu dilakukan hidrolisis yang akan memisahkan glikon dengan aglikon flavonoid. Hidrolisis dapat dilakukan dengan tiga macam cara, yaitu dengan katalis asam, enzim, atau basa (Riyanto, 1990).
Tabel 1. Daftar beberapa reagen untuk flavonoid
Nama Reagen Sasaran
Natrium metoksida gugus yang peka terhadap basa Natrium asetat anhidrat identifikasi gugus hidroksil
paling basa
Aluminium klorida
gugus hidroksi dan keton yang bertetangga, gugus orto
dihidroksi
Asam borat anhidrat dua gugus hidroksi pada posisi orto
Kondisi hidrolisis flavonoid berbeda untuk jenis flavonoid-O-glikosida dan flavonoid-C-glikosida. Flavonoid-O-glikosida lebih mudah dihidrolisis dibandingkan flavonoid-C-glikosida. Jenis glikon dan tempat glikon itu terikat pada inti flavonoid juga menentukan kondisi untuk hidrolisis (Markham, 1982).
3. Flavonoid teh hijau
Teh (Camellia sinensis (L.) O. Kuntze) mengandung sejumlah flavonoid golongan flavanol terutama katekin dan senyawa turunannya seperti epikatekin, epigallokatekin, dan epigallokatekingalat (Syah, 2006). Selain itu terdapat pula flavonoid golongan flavonol seperti kuersetin, kaempferol, mirisetin, dan kuercitrin serta beberapa golongan flavonoid yang lain (Anonim, 1999). Katekin, yang merupakan flavonoid utama dalam teh, ditemukan lebih banyak dalam teh hijau dibandingkan dalam teh hitam. Hal ini disebabkan enzim polifenol oksidase yang mengoksidasi katekin diinaktivasi pada proses pembuatan teh hijau, sedangkan pada pembuatan teh hitam, katekin dibiarkan teroksidasi membentuk senyawa baru yang memiliki warna merah kecoklatan (Syah, 2006).
B. Kuersetin
Gambar 3. Struktur kimia kuersetin
C. Analisis Sediaan Gel
Gel tersusun atas sejumlah kecil komponen padatan yang terdispersi dalam sejumlah besar cairan. Komponen padat dari gel membentuk jaringan tiga dimensi yang membentuk rigiditas gel. Oleh karena itu, meskipun sebagian besar komponennya berupa cairan, gel memiliki kemampuan untuk mempertahankan bentuknya dengan pemberian sedikit tekanan. Padatan yang lazim digunakan dalam gel adalah polimer meskipun beberapa gel tersusun atas padatan inorganik. Contoh polimer yang biasa digunakan sebagai gelling agent antara lain carbomer, poloxamer, CMC-Na, Hidroxy Propyl Methyl Cellulose (HPMC), dan karaginan (Swarbick and Boylan, 1992)
Elektrolit dapat digunakan untuk mengendapkan zat terdispersi yang memiliki sifat terionkan. Elektrolit yang digunakan adalah elektrolit dengan sifat yang berlawanan dengan sifat ion zat terdispersi. Polimer kationik dapat diendapkan dengan penambahan senyawa anionik begitu pula sebaliknya (Gillard
et.al, 1985).
D. Deskripsi Senyawa Eksipien Penyusun Formula Gel Tabel 2. Formula gel untuk penelitian Natrium Carboxymethylcellulose (CMC-Na) 4
Asam sitrat 0,5
Propilen Glikol 10
Metil paraben 0,3
Etanol 11,7
Fraksi teh hijau 0,03
Aquades 72,5
(Wijayanti, 2008)
1. Natrium carboxymethylcellulose
Gambar 4. Struktur kimia natrium carboxymethylcellulose
2. Asam sitrat
Asam sitrat digunakan secara luas sebagai pemberi suasana asam, antioksidan, atau buffer dalam berbagai sediaan farmasi. Senyawa ini larut 1 dalam 1,5 bagian ethanol (95%) dan 1 dalam kurang dari 1 bagian air; agak sukar larut dalam eter (Amidon, 2005).
Gambar 5. Struktur kimia asam sitrat 3. Propilen glikol
Propilen glikol digunakan sebagai antimikroba, humectant, plasticizer, atau co-solvent. Senyawa ini dapat bercampur dengan aseton, kloroform, etanol (95%), gliserin dan air; larut 1 dalam 6 bagian eter ( Owen and Weller, 2005).
4. Metil paraben
Metil paraben digunakan sebagai antimikroba dalam produk makanan, dan sediaan farmasi. Senyawa ini dapat digunakan sendiri atau dikombinasikan dengan paraben yang lain.
Metil paraben mudah larut dalam etanol (95%), dan eter; agak sukar larut dalam gliserin. Kelarutan dalam air meningkat dengan kenaikan suhu. Pada suhu kamar 1 bagian metil paraben larut dalam 400 bagian air (Johnson and Steer, 2005).
O
OH
O
Gambar 7. Struktur kimia metil paraben 5. Etanol
Etanol biasa digunakan sebagai pelarut dalam berbagai sediaan farmasi. Senyawa ini dapat bercampur dengan kloroform, eter, gliserin dan air (Owen, 2005).
F. Spektrofotometer UV-Vis
tingkat energi yang lebih tinggi. Peristiwa absorpsi ini terjadi melalui satu atau lebih dari beberapa cara di bawah ini :
1. Transisi elektronik (electronic transition)
Energi dari radiasi elektromagnetik mempromosikan elektron pada orbital ikatan (bonding orbital) menuju orbital anti-ikatan (antibonding orbital) yang memiliki energi lebih tinggi.
2. Transisi vibrasional (vibrational transition)
Energi radiasi elektromagnetik bekerja meningkatkan vibrasi atau osilasi dari atom yang membentuk ikatan kimia.
3. Transisi rotasional (rotational transition)
Energi radiasi elektromagnetik meningkatkan rotasi dari atom yang
membentuk ikatan kimia.
Dari ketiga cara tersebut, transisi elektronik adalah yang paling berperan dalam analisis pada daerah UV-Vis (Cairns, 2003).
Elektron dalam molekul diklasifikasikan menjadi empat tipe : 1. Elektron pada kulit yang tertutup (closed-shell electrons)
Elektron tipe ini tidak berperan dalam pembentukan ikatan dan memiliki energi eksitasi yang sangat tinggi sehingga tidak berperan dalam absorpsi pada area UV-Vis.
2. Elektron ikatan kovalen tunggal (covalent single-bond electrons)
Elektron tipe ini disebut juga elektron sigma (σ). Elektron σ ini memiliki energi eksitasi yang tinggi sehingga tidak berperan dalam absorpsi pada area UV-Vis.
3. Pasangan elektron bebas (n)
Elektron tipe ini memiliki energi eksitasi yang lebih rendah dari elektron σ dan dapat berperan dalam absorpsi pada area UV-Vis. Contohnya adalah pasangan elektron bebas pada atom N, O, S dan halogen.
4. Elektron pada orbital phi (π)
Elektron tipe ini adalah yang paling mudah tereksitasi dan berperan penting dalam pembentukan spektrum pada daerah UV-Vis.
(Christian, 2004)
Peristiwa transisi elektron dalam molekul menuju tingkat energi yang lebih tinggi digolongkan menjadi 4 macam yaitu transisi σ- σ*, transisi n- σ*, transisi n-π*, dan transisi π-π*. Dari keempat transisi tersebut transisi n-π* dan π-π* merupakan jenis transisi yang berperan dalam analisis pada daerah UV-Vis
Gambar 8. Diagram transisi elektron
Aspek kuantitatif spektrofotometer dinyatakan dalam hukum Lambert-Beer yang secara matematis ditulis menurut persamaan berikut :
A ‐log T log 1T abc
Dimana : A : absorbansi T : transmitan
a : konstanta absorptivitas
b : jarak (tebal kuvet)
c : konsentrasi
(Christian, 2004)
G. Kolorimetri
Suatu senyawa yang menyerap pada panjang gelombang UV yang ingin ditetapkan kadarnya pada panjang gelombang visibel, perlu diubah terlebih dahulu menjadi senyawa berwarna (Rohman, 2007). Pengubahan senyawa ini mampu meningkatkan selektivitas dan sensitivitas metode (Fell, 1986). Penggunaan reagen tertentu mampu merubah analit menjadi senyawa baru yang mengabsorpsi pada panjang gelombang visibel. Syarat dari reagen ini adalah :
a. Reaksinya selektif dan sensitif
b. Reaksi berlangsung cepat, bersifat kuantitatif, dan reprodusibel π
σ*
π*
σ
c. Produk berwarna yang dihasilkan stabil selama proses analisis berlangsung (Rohman, 2007)
1. Penetapan kadar flavonoid secara kolorimetri
Senyawa flavonoid memberikan absorpsi pada panjang gelombang UV. Ketika flavonoid akan ditetapkan kadarnya pada panjang gelombang visibel, maka reagen tertentu perlu ditambahkan untuk mengubahnya menjadi senyawa berwarna. Salah satu reagen yang lazim digunakan adalah aluminium klorida (AlCl3). Senyawa flavonoid yang memiliki gugus hidroksi fenolik yang
bertetangga dengan gugus karbonil dan gugus dihidroksi fenolik mampu bereaksi membentuk kompleks dengan AlCl3. Gugus hidroksi fenolik yang bertetangga
dengan gugus karbonil membentuk kompleks tahan asam sedangkan gugus dihidroksi fenolik membentuk kompleks tidak tahan asam (Markham, 1982).
OH
Gambar 9. Reaksi pembentukan kompleks antara kuersetin dengan Aluminium klorida dalam suasana asam (Markham, 1982)
Kompleks yang terbentuk antara AlCl3 dengan flavonoid merupakan
pasangan elektron kepada ion logam sebagai asam Lewis dan membentuk kompleks (Amiji, 2003).
2. Absorpsi radiasi elektromagnetik oleh senyawa kompleks
Absorpsi radiasi elektromagnetik senyawa kompleks pada daerah UV-Vis terjadi melalui salah satu atau lebih peristiwa transisi, yaitu eksitasi ion logam, eksitasi molekul ligan, dan transfer muatan. Dua proses yang pertama tidak memberikan peran yang signifikan dalam analisis kuantitatif senyawa kompleks. Untuk kepentingan analisis kuantitatif, transfer muatan memegang peranan penting dalam absorpsi radiasi sinar UV-Vis. Ketika senyawa kompleks menyerap radiasi, elektron dari ligan berpindah ke ion logam atau sebaliknya. Transisi ini meliputi promosi elektron dari level π dalam ligan atau dari orbital ikatan σ menuju orbital kosong (unoccupied orbital) dari ion logam, atau promosi elektron ikatan σ menuju orbital π yang kosong dari ligan (Christian, 2004).
H. Parameter Validitas Metode Analisis
1. Akurasi
Akurasi merupakan kedekatan nilai terukur dengan nilai sebenarnya. Akurasi metode analisis ditetapkan dalam range metode tersebut (Anonim, 2004b). Akurasi dihitung sebagai persen perolehan kembali (% recovery) .
Ada tiga metode penentuan akurasi :
a. Menganalisa sampel yang telah diketahui konsentrasinya dan membandingkan nilai terukur dengan nilai sebenarnya.
b. Spiked – placebo recovery method. Sejumlah zat aktif murni ditambahkan pada blanko formulasi (formula tanpa zat aktif) dan hasil analisis dibandingkan dengan nilai teoritis.
c. Metode standar adisi. Pada metode ini, suatu sampel dianalisis, sejumlah zat aktif murni ditambahkan lalu dianalisis kembali. Perbedaan dua hasil analisis tersebut dibandingkan dengan hasil teoritis.
(Anonim, 2004a) 2. Presisi
Presisi menyatakan kedekatan hasil analisis satu dengan yang lain ketika dilakukan pada sampel yang sama dan homogen. Standar deviasi atau standar deviasi relatif (RSD), disebut juga koefisien variansi (CV), digunakan untuk menyatakan presisi (Anonim, 2004b).
3. Spesifisitas
ketiadaan senyawa pengganggu yang mengacaukan hasil analisis seperti senyawa pengotor (impurities), degradasi produk atau komponen lain dalam sampel (Anonim, 2004a).
4. Batas deteksi
Batas deteksi merupakan jumlah analit terendah yang masih dapat dideteksi namun tidak dapat dikuantifikasi dengan nilai yang tepat. (Anonim, 2004b).
5. Batas kuantitasi
Batas kuantitasi merupakan kadar terendah suatu analit yang masih dapat dihitung dan memberikan akurasi dan presisi yang dapat diterima (Anonim, 2004b).
6. Linearitas
Linearitas merupakan kemampuan suatu metode analisis untuk mendapatkan hasil uji yang secara langsung proporsional dengan jumlah analit dalam sampel (Mulya dan Hanwar, 2003). Linearitas ditentukan dengan membuat plot hubungan antara kadar dengan respon analisis lalu ditentukan koefisien korelasi antar keduanya (Anonim, 2004a).
7. Range
Tabel III. Kategori metode analisis dan persyaratan validasi Kategori
I II III IV
Kuantitatif Limit test
Akurasi Ya Ya * * Tidak
* Mungkin dibutuhkan tergantung sifat dari metode analisis
United States Pharmacopeia (USP) 28 membedakan metode analisis menjadi 4 kategori dan masing-masing kategori memiliki persyaratan parameter validasi yang berbeda.
a. Kategori I merupakan metode analisis kuantitatif untuk senyawa murni obat dan zat aktif termasuk pengawet dalam sediaan farmasi
b. Kategori II mencakup metode analisis kualitatif dan kuantitatif untuk menganalisis senyawa pengotor dan produk hasil degradasi dalam sediaan farmasi
c. Kategori III meliputi metode analisis untuk menentukan karakteristik suatu sediaan farmasi, seperti kecepatan disolusi dan kecepatan pelepasan obat. d. Kategori IV mencakup uji identifikasi
Tabel III menunjukkan keempat kategori tersebut beserta kebutuhan parameter validitasnya.
I. Keterangan Empiris
dengan kadar flavonoid. Teh hijau mengandung polifenol yang merupakan senyawa golongan flavonoid. Maka analisis kuantitatif dengan pereaksi aluminium klorida dapat digunakan pada sampel sediaan gel teh hijau.
Gel tersusun atas padatan berupa polimer yang terdispersi dalam medium pendispers. Penggunaan pelarut yang tidak melarutkan padatan terdispersi namun melarutkan medium terdispersi mampu memisahkan kedua komponen gel tersebut.
BAB III
METODOLOGI PENELITIAN
A. Jenis dan Rancangan Penelitian
Penelitian ini termasuk penelitian non-eksperimental rancangan deskriptif karena tidak ada manipulasi yang dilakukan terhadap subyek uji.
B. Variabel Penelitian
Variabel dalam penelitian ini adalah kadar kuersetin yang diukur dengan metode kolorimetri dengan pereaksi aluminium klorida.
C. Definisi Operasional
1. Flavonoid total yang dimaksud dalam penelitian ini adalah semua flavonoid dalam sediaan gel teh hijau yang dapat membentuk kompleks dengan aluminium klorida
2. Sediaan gel teh hijau yang digunakan dalam penelitian ini adalah formula hasil penelitian Wijayanti (2008) dengan komponen CMC-Na, propilen glikol, metil paraben, asam sitrat, fraksi teh hijau dan aquades
3. Kadar flavonoid total dalam sediaan gel teh hijau dinyatakan sebagai kadar flavonoid ekuivalen dengan kuersetin.
4. Akurasi dinyatakan sebagai % recovery
D. Bahan Penelitian
Bahan yang digunakan meliputi baku kuersetin p.a (Sigma), etil asetat p.a (J.T. Bakker), aseton p.a (Merck), HCl p.a (J.T. Bakker), AlCl3.6H2O p.a (Merck),
etanol farmasetis (Brataco), heksamin farmasetis (MKR), natrium sitrat farmasetis (MKR), aquadest. Sampel yang digunakan adalah gel teh hijau hasil penelitian Wijayanti (2008).
E. Alat Penelitian
Alat yang digunakan dalam penelitian ini meliputi alat-alat gelas ( Pyrex-Germany), spektrofotometer Uv-Vis (Perkin-Elmer Lambda 20), waterbath ( Abo-Tech), alat ultrasonik (Retsch tipe T 460 No. V935922013 EY), micropipet 0,5 – 5,0ml (Socorec), neraca analitik BP 160P, neraca analitik Scaltec SBC 22
readibility 0,01 mg.
F. Tata Cara Penelitian 1. Pembuatan pelarut dan pereaksi
a. Larutan asam klorida 25% dalam aquadest. Akuades sebanyak 10 ml ditambahkan asam klorida sebanyak 66,7 ml dalam labu takar 100,0 ml. Larutan tersebut ditambahkan akuades hingga tanda.
b. Larutan heksamin 0,5% dalam aquadest. Heksamin sebanyak 0,5 gram dilarutkan dengan akuades dalam labu takar 100,0 ml sampai tanda.
d. Larutan asam asetat 5% dalam metanol. Asam asetat glasial sebanyak 25,0 ml ditambahkan metanol p.a dalam labu takar 500,0 ml sampai tanda.
e. Larutan aluminium klorida dalam asam asetat 5% dalam metanol. Serbuk aluminium klorida sebanyak 2 gram ditambahkan 25 ml asam asetat 5% dalam metanol dalam labu takar 100,0 ml, lalu dilakukan degassing selama 5 menit untuk membantu melarutkan aluminium klorida. Larutan tersebut ditambahkan asam asetat 5% dalam metanol sampai tanda. Larutan ini dibuat sehari sebelumnya dan disimpan dalam botol coklat dan ditutup rapat (Mabry, 1970).
2. Pembuatan sampel
Sampel berupa basis gel teh hijau (tanpa fraksi teh hijau) dibuat sesuai dengan formula hasil penelitian Wijayanti (2008).
3. Pembuatan blangko
Etil asetat sebanyak 5,0 ml dimasukkan ke dalam labu takar 25,0 ml lalu ditambahkan 1,0 ml larutan AlCl3 2% (dalam asam asetat dalam metanol) dan 0,5
ml natrium sitrat 0,5%. Larutan tersebut ditambahkan asam asetat 5% dalam metanol sampai tanda.
4. Pembuatan larutan baku
b. Larutan intermediet kuersetin 50 ppm. Larutan stok kuersetin 500 ppm sebanyak 2,50 ml diencerkan dengan etil asetat dalam labu takar 25,0 ml sampai tanda.
5. Penentuan Operating Time (OT)
Larutan intermediet kuersetin 50 ppm sebanyak 2,0 ml ditambahkan 1,0 ml larutan AlCl3 2% (dalam asam asetat dalam metanol) dan 0,5 ml natrium sitrat
0,5% dalam labu takar 25,0 ml,. Larutan tersebut ditambahkan asam asetat 5% dalam metanol sampai tanda. Absorbansi diukur tiap 2 menit pada panjang gelombang maksimum teoritis (428nm) selama 60 menit
6. Penetapan panjang gelombang maksimum
Larutan intermediet kuersetin 50 ppm masing-masing sebanyak 1,5; 3,0; dan 4,0 ml dimasukkan ke dalam labu takar 25,0 ml. Masing-masing labu ditambahkan 1,0 ml larutan AlCl3 2% (dalam asam asetat dalam metanol) dan 0,5
ml natrium sitrat 0,5%. Larutan tersebut ditambahkan asam asetat 5% dalam metanol sampai tanda. Serapan diukur pada operating time pada rentang panjang gelombang 400 – 500nm. Panjang gelombang maksimum ditentukan dari spektrum yang dihasilkan.
7. Pembuatan kurva baku
Larutan intermediet kuersetin 50 ppm masing-masing sebanyak 1,5; 2,0; 2,5; 3,0; 3,5; dan 4,0 ml dimasukkan ke dalam labu takar 25,0 ml. Masing-masing labu ditambahkan 1,0 ml larutan AlCl3 2% (dalam asam asetat dalam metanol)
panjang gelombang maksimum. Replikasi dilakukan sebanyak 3 kali. Data yang diperoleh dihitung menggunakan program regresi linear sehingga diperoleh persamaan yang dapat digunakan untuk menghitung kadar kuersetin dalam sampel.
8. Preparasi sampel
a. Pembuatan kuersetin 30 ppm dalam aseton. Baku kuersetin sebanyak 25,0 mg yang ditimbang seksama dilarutkan dengan 15 ml aseton dalam labu takar 50,0 ml, lalu dilakukan degassing selama 5 menit untuk membantu melarutkan kuersetin. Larutan tersebut sebanyak 1,5 ml ditambahkan aseton dalam labu takar 25,0 ml sampai tanda.
penguapan lalu dimasukkan ke dalam corong pisah. Setelah dilakukan penggojogan kuat selama 15 detik, fase etil asetat ditampung dalam labu takar 25,0 ml. Fase air diekstraksi sekali lagi menggunakan 10 ml etil asetat. Fase etil asetat dikumpulkan sebagai larutan sampel. Replikasi dilakukan sebanyak tujuh kali.
9. Penetapan kadar flavonoid dalam sampel
Larutan sampel dalam etil asetat sebanyak 5,0 ml ditambahkan 1,0 ml larutan AlCl3 2% (dalam asam asetat dalam metanol) dan 0,5 ml natrium sitrat
0,5% dalam labu takar 25,0 ml lalu. Larutan tersebut ditambahkan asam asetat 5% dalam metanol hingga tanda.
Larutan didiamkan sampai masuk rentang operating time, lalu diukur serapannya pada panjang gelombang maksimum. Prosedur yang sama dilakukan pada replikasi yang lain.
G. Analisis Hasil
Validitas metode dianalisis menggunakan parameter-parameter berikut :
a. Akurasi
Akurasi dinyatakan dengan parameter %recovery dengan rumus :
% recovery kadar terukur
kadar teoritis×100% b. Presisi
Presisi dinyatakan dengan parameter koefisien variansi (CV) dengan rumus :
CV = SD
BAB IV
HASIL DAN PEMBAHASAN
A. Optimasi Kondisi Pengukuran
Optimasi kondisi pengukuran dilakukan untuk memperoleh kondisi pengukuran yang optimal. Kondisi yang optimal merupakan bagian tak terpisahkan dari suatu metode analisis yang mampu memperkecil kesalahan pengukuran. Dalam konteks penelitian ini, dilakukan optimasi pada dua kondisi yaitu operating time dan panjang gelombang maksimum.
1. Penentuan operating time (OT)
Pembentukan warna hasil reaksi antara kuersetin dengan aluminium klorida membutuhkan waktu tertentu agar diperoleh absorbansi optimum. Untuk itu dilakukan penentuan operating time, yaitu suatu rentang waktu tertentu dimana spektrum menunjukkan kurva absorbansi yang stabil (datar) sebagai tanda reaksi pembentukan kompleks telah optimum.
Penentuan operating time ini penting untuk meminimalkan kesalahan. Sebelum operating time reaksi pembentukan kompleks belum sempurna, sedangkan setelah operating time dimungkinkan kompleks yang terbentuk sudah rusak sehingga pengukuran di luar operating time dapat memberikan kesalahan akibat absorbansi yang terbaca tidak menunjukkan nilai optimum.
klorida ditambahkan. Berdasarkan hasil pengukuran diperoleh operating time
pada rentang 30 – 45 menit. Spektrum operating time dapat dilihat pada gambar 7.
Gambar 10. Spektrum operating time kompleks kuersetin-AlCl3 2. Penentuan panjang gelombang maksimum
Hasil analisis dengan spektrofotometer dipengaruhi salah satunya oleh panjang gelombang pengukuran. Pengukuran absorbansi pada panjang gelombang maksimum dapat meningkatkan sensitivitas dan mengurangi kesalahan analisis. Hal ini disebabkan pada panjang gelombang maksimum perbedaan konsentrasi sedikit saja akan menimbulkan absorbansi yang berbeda (Rohman, 2007).
dibutuhkan karena ada kemungkinan hasil yang diperoleh akan berbeda karena perbedaan waktu, alat, lingkungan, dan personalia penelitian. Farmakope Indonesia IV (1995) memberikan batasan bahwa panjang gelombang maksimum terukur tidak boleh berbeda lebih dari 2 nm terhadap panjang gelombang maksimum teoritis.
Gambar 11. Spektrum panjang gelombang maksimum kompleks kuersetin-AlCl3
pengukuran panjang gelombang maksimum (gambar 8) menunjukkan bahwa panjang gelombang maksimum berada pada 427,4 nm. Perbedaan hasil dengan panjang gelombang maksimum teoritis masih diterima sebab tidak melebihi 2 nm.
B. Pembuatan Kurva Baku
Kurva baku dibuat agar diperoleh persamaan yang dapat digunakan untuk menghitung kadar kuersetin di dalam sampel. Kurva baku dibuat pada rentang kadar 3 – 8 ppm. Menurut Anonim (2004a), untuk keperluan validasi metode dibutuhkan sedikitnya kurva baku yang dibuat pada 6 konsentrasi.
Tabel IV menunjukkan tiga replikasi kurva baku yang diperoleh. Koefisien korelasi ketiga kurva baku (r) menunjukkan nilai yang lebih besar dibandingkan dengan harga r tabel dengan taraf kepercayaan 99%, yaitu 0,875 (De Muth, 1999). Untuk keperluan analisis kuantitatif dipilih kurva baku dengan linearitas terbaik yaitu replikasi 2.
Tabel IV. Hubungan kadar kuersetin dengan absorbansi Replikasi I Replikasi II Replikasi III Kadar
(ppm) Absorbansi
Kadar
(ppm) Absorbansi
Kadar
(ppm) Absorbansi 3,13 0,162 3,06 0,172 3,15 0,183 4,18 0,236 4,09 0,243 4,21 0,241 5,22 0,279 5,11 0,290 5,26 0,315 6,27 0,324 6,13 0,349 6,31 0,346 7,31 0,402 7,15 0,404 7,36 0,405 8,36 0,486 8,17 0,486 8,41 0,476
A -0,0248 A -0,0079 A 0,0152
B 0,05912 B 0,05908 B 0,05402
R 0,9926 R 0,9971 R 0,9960
peningkatan kadar dengan absorbansi. Ini merupakan persyaratan berlakunya hukum Lambert-Beer (Christian, 2004). Dengan demikian persamaan kurva baku yang diperoleh dapat digunakan untuk menghitung kadar kuersetin dalam sampel. Gambar 9 menunjukkan titik-titik pada kurva baku yang hampir membentuk garis lurus, ini menunjukkan koefisien korelasi yang mendekati ±1.
Gambar 12. Kurva baku kuersetin
C. Preparasi Sampel
Preparasi sampel, dalam penelitian ini, merupakan aspek terpenting yang akan mempengaruhi akurasi dan presisi hasil pengukuran kadar analit. Preparasi sampel gel meliputi tiga bagian yaitu isolasi analit kuersetin dari dalam sampel gel, dilanjutkan dengan hidrolisis dan isolasi aglikon yang telah terpisah dengan gula dengan ekstraksi cair – cair.
0.000
0.00 2.00 4.00 6.00 8.00 10.00
Absor
b
a
n
si
1. Isolasi analit dari sampel
Kekhasan dari bentuk sediaan gel adalah kemampuan zat terdispersinya untuk memerangkap medium dispersinya. Kemampuan ini terutama disebabkan kemampuan zat terdispersi yang berupa polimer untuk membentuk cross link yang menghasilkan suatu matriks (Zatz and Kushla, 1996).
Ikatan hidrogen dalam natrium carboxymethylcellulose bertanggung jawab dalam pembentukan cross link. Cross link yang disebabkan oleh ikatan hidrogen dikenal sebagai physical cross link atau non-kovalen cross link. Natrium
carboxymethylcellulose membentuk tipe cross link yang sering disebut random coil. Cross link dalam natrium carboxymethylcellulose dapat dilihat pada gambar 13.
Gambar 13. Ikatan hidrogen natrium carboxymethylcellulose membentuk
cross link
Zat aktif merupakan komponen gel yang larut atau bercampur dalam medium dispersi. Untuk menarik zat aktif keluar dari sistem gel maka medium dispersi perlu dibebaskan dari matriks zat terdispersi.
adalah air dapat bercampur dengan aseton dan flavonoid sendiri mempunyai kelarutan yang baik di dalam aseton (Drużyńska et al., 2007; Chebil et al., 2007), sedangkan CMC-Na sendiri praktis tidak larut dalam aseton. Mekanisme isolasi ini berbeda dengan peristiwa syneresis, yaitu keluarnya medium dispersi dari matriks gel, yang secara alami terjadi pada gel yang tidak stabil. Keluarnya medium dispersi pada peristiwa syneresis disebabkan gaya tarik matriks gel mendorong medium dispersi keluar dari sistem gel, pada proses isolasi ini keluarnya medium dispersi karena ditarik oleh aseton.
Untuk menarik medium dispersi dari sampel seberat 20 gram dibutuhkan 80 ml aseton yang dilakukan dalam empat tahap masing-masing 20 ml. Perubahan bobot sampel akan mengubah volume aseton yang diperlukan. Ini berkaitan dengan kejenuhan campuran air dan aseton, makin banyak air yang harus ditarik makin banyak aseton yang diperlukan untuk menarik.
Penggunaan kekuatan mekanik juga dibutuhkan pada proses ini. Kontak antara aseton dengan permukaan gel menyebabkan matriks CMC-Na di permukaan menyusut dan menghalangi penetrasi aseton ke bagian dalam gel. Untuk mempermudah penetrasi aseton, digunakan tenaga mekanik yang dalam penelitian ini berupa penggerusan dengan mortir dan stamper.
Keterbatasan dari proses isolasi ini terletak pada subyektivitasnya yang tinggi. Subyektivitas ditemui dalam proses penggerusan dengan mortir, hasil yang berbeda mungkin dapat ditemui pada peneliti yang berbeda.
Gambar 14. Endapan CMC-Na yang terbentuk pada akhir proses isolasi 2. Tahap hidrolisis
Hidrolisis dibutuhkan untuk memecah glikosida sehingga dihasilkan aglikon flavonoid. Penggunaan baku berbentuk aglikon kuersetin sebenarnya tidak membutuhkan tahap hidrolisis. Tahap ini dikerjakan pada baku untuk menyamakan perlakuan dengan sampel gel yang mengandung fraksi teh hijau. Hal ini dikarenakan sebagian besar flavonoid yang ditemukan dalam teh hijau terikat sebagai glikosida terutama pada atom C3 dan C4’ yang merupakan gugus potensial untuk reaksi dengan aluminium klorida (Anonim, 1999).
glukosida, galaktosida dan rhamnosida. Ketiga jenis glikon tersebut terhidrolisis dalam waktu kurang dari 30 menit pada suasana asam (Markham, 1982).
O OH Gambar 15. Reaksi hidrolisis flavonoid
Prosedur hidrolisis yang digunakan dalam penelitian ini mengacu pada penelitian Pertiwi (2006). Prosedur hidrolisis tersebut menggunakan asam klorida untuk menghidrolisis flavonoid dalam medium aseton. Heksamin yang juga ditambahkan dalam sistem hidrolisis digunakan untuk menangkap kelebihan ion H+.Reaksi hidrolisis ditunjukkan pada gambar 15.
3. Ekstraksi cair – cair
Ekstraksi cair – cair dengan corong pisah dipilih sebagai metode untuk memisahkan kedua senyawa yang berbeda sifat kelarutan tersebut. Sistem Etil asetat - air digunakan karena keduanya tidak bercampur, dan flavonoid sendiri larut dalam etil asetat.
Aseton yang terdapat dalam sistem hidrolisis, mampu bercampur baik dengan air maupun dengan etil asetat. Pada tahap orientasi diketahui bahwa keberadaan aseton menyebabkan pemisahan kedua fase tidak optimal dan tidak reprodusibel. Fenomena ini dapat disebabkan karena indeks polaritas aseton dan etil asetat yang tidak terlalu berbeda, sehingga dapat bercampur pada saat dilakukan ekstraksi cair – cair. Aseton memiliki indeks polaritas 5,1 sedangkan etil asetat 4,4. Karena itu sebelum dilakukan ekstraksi cair – cair seluruh aseton diuapkan.
D. Penetapan Kadar Flavonoid dalam Sampel
Hingga akhir proses preparasi sampel, belum diperoleh senyawa flavonoid yang murni. Metil paraben yang lebih larut dalam pelarut organik masih ditemukan dalam fase etil asetat yang digunakan sebagai larutan sampel (gambar 16). Kedua senyawa ini, aglikon flavonoid dan metil paraben, memberikan serapan pada daerah UV, sehingga penetapan kadar pada daerah UV tidak dimungkinkan.
gelombang visibel, metil paraben sudah tidak memberikan serapan lagi, sehingga penetapan kadar dapat dilakukan tanpa adanya senyawa pengganggu.
Gambar 16. Alur pengerjaan sampel gel
Pada penelitian ini, reaksi pembentukan kompleks berlangsung dalam suasana asam yang berasal dari pelarut asam asetat dalam metanol. Untuk mempertahankan pH asam dalam sistem, maka digunakan natrium sitrat yang ditambahkan sesaat setelah penambahan aluminium klorida sebagai buffer.
Senyawa berwarna yang terukur dalam penelitian ini merupakan kompleks aluminium dengan gugus hidroksi fenolik yang bertetangga dengan gugus karbonil dan gugus orto dihidroksi fenolik. Kompleks aluminium dengan gugus orto dihidroksi fenolik masih terbentuk pada kondisi ini, meskipun gugus tersebut tidak tahan asam. Hal ini dikarenakan asam yang digunakan adalah asam
Hidrolisis, dan ekstraksi cair - cair Fase padat : endapan CMC-Na Gel
Isolasi dengan aseton
lemah dengan konsentrasi yang rendah. Markham (1982) menerangkan penggunaan asam klorida pekat untuk memutus kompleks aluminium dengan gugus orto dihidroksi fenolik.
E. Analisis Validitas Metode
Penetapan kadar flavonoid total dalam sediaan gel termasuk dalam metode analisis kategori I (Anonim, 2004b). Kategori I mensyaratkan parameter validasi metode spesifisitas, akurasi, presisi, linearitas, dan range. Parameter-parameter yang dapat diperoleh melalui penelitian ini adalah sebagai berikut : 1. Spesifisitas
Informasi mengenai spesifisitas metode diperoleh melalui studi pustaka mengenai kemungkinan reaksi aluminium klorida dengan komponen-komponen gel yang lain. Komponen-komponen gel yang lain tidak memiliki gugus-gugus yang dapat bereaksi dengan aluminium klorida sehingga dapat dikatakan bahwa metode ini spesifik hanya akan menetapkan kadar flavonoid dalam sediaan gel.
Tabel V. Data % recovery dan koefisien variansi metode Replikasi Kadar Terukur
2. Akurasi
Akurasi metode ditentukan berdasarkan nilai % recovery. Metode penentuan recovery yang digunakan pada penelitian ini adalah spiked – placebo recovery method. Anonim (2004a) memberikan batasan % recovery yang diterima untuk sampel di bawah 0,1% adalah 75 – 125%. Tabel V menunjukkan % recovery dari metode sebesar 91,09 ± 4,78%. Hasil ini menunjukkan bahwa metode penetapan kadar masih memenuhi rentang % recovery yang dipersyaratkan.
3. Presisi
Level presisi yang berlaku dalam penelitian ini adalah repeatability. Level presisi ini meliputi kesalahan yang mungkin terjadi pada tahap preparasi sampel seperti penimbangan, pengenceran, dan ekstraksi pada kondisi penelitian yang sama (personalia, alat, waktu, dan laboratorium yang sama). Untuk penentuan repeatability setidaknya dibutuhkan enam sampel (Ermer, 2005).
Repeatability dinyatakan sebagai koefisien variansi (CV). CV dari metode dapat dilihat pada tabel V. Menurut Anonim (2004a) CV yang masih diterima untuk sampel dengan kadar dibawah 0,1% adalah 20%, sedangkan metode ini memberikan CV sebesar 5,25 %. Dengan demikian, CV dari metode yang diteliti masih dapat diterima.
4. Linearitas
kuantitatif adalah sebesar 0,99. Kurva baku yang dibuat pada konsentrasi antara 3 – 8 ppm menghasilkan koefisiean korelasi sebesar 0,9971 menunjukkan bahwa metode ini memberikan linearitas yang baik.
Akurasi dan presisi, yang menjadi parameter utama dalam penelitian ini, terutama dipengaruhi oleh preparasi sampel. Tahap preparasi sampel yang semakin panjang berpotensi menurunkan kualitas akurasi dan presisi metode karena kemungkinan terjadinya kesalahan juga meningkat.
BAB V
KESIMPULAN, SARAN DAN KETERBATASAN
A. Kesimpulan
Metode kolorimetri dengan pereaksi aluminium klorida memberikan akurasi dan presisi yang baik untuk penetapan kadar flavonoid total terhitung kuersetin pada sediaan gel teh hijau.
B. Saran
Penelitian ini perlu dilanjutkan dengan penelitian penetapan kadar flavonoid total dalam sediaan gel teh hijau.
C. Keterbatasan
42
DAFTAR PUSTAKA
Amidon, G.E., 2005, Citric Acid Monohydrate,
http://www.medicinescomplete.com/mc/excipients/current/ 1000293169.htm, diakses tanggal 24 Agustus 2007
Amiji, M. M., 2003, Complexation and Protein Binding, in Brown M., and Sheinis, L. A., Applied Physical Pharmacy, 200-201, The McGraw-Hill Companies, Inc., USA
Anonim, 1995, Farmakope Indonesia, edisi IV, Departemen Kesehatan Republik Indonesia, Jakarta
Anonim, 1999, Assay Camellia Sinensis #1,
http://ukcrop.net/perl/ace/enh_tree/PhytochemDB?name=Camellia%20sinensis %20%231&class=Assay&expand=Result#Result, diakses tanggal 23 Oktober 2007
Anonim, 2004a, Guidelines For the Validation of Analytical Methods For Active Constituent, Agricultural and Veterinary Chemical Products, Australian Pesticides & Veterinary Medicines Authority, Australia
Anonim, 2004b, The United States Pharmacopeia 28, the United States Pharmacopeial Convention, Inc
Anonim, 2005, Material Safety Datasheet Quercetin Dihydrate MSDS, http://www.sciencelab.com/xMSDS-Quercetin_Dihydrate-9924781, diakses tanggal 27 Oktober 2007
Brady, J. E., 1998, General Chemistry Princples & Structure, 5th Ed., Jilid 1, diterjemahkan oleh Sukmariah Maun, Kamianti Anas, dan Tilda S. Sally, 455, Binarupa Aksara, Jakarta
Bruneton, J., 1993, Pharmacognosy Phytochemistry Medicinal Plants, 2nd Ed., translated by Caroline K. Hatton, 1076-1077, Intercept Ltd., Londress, Lavoisier Publishing, Paris
Cairns, D., 2003, Essential of Pharmaceutical Chemistry, 2nd edition, 151; 154, Pharmaceutical Press, Great Britain
Christian, G. D., 2004, Analytical Chemistry, 6th Ed., 468, John Wiley & Sons, Inc., USA
De Muth, J.E., 1999, Basic Statistics and Pharmaceutical Statistical Applications, 585, Marcel Dekker, Inc., USA
Drużyńska, D., Stepniewska, A., Wołosiak, R., 2007, The Influence of Yime and Type of Solvent on Efficiency of the Extraction of Polyphenols from Green Tea and Antioxidant Properties Obtained Extracts, Acta Sci. Pol., Technol. Aliment. 6(1), 27-36
Ermer, J. and Miller, J. H. McB., 2005, Method Validation in Pharmaceutical Analysis, 32, Wiley - VCH Verlag GmbH & Co. KGaA
Fell, A.F., 1986, UV and Visible Fluorescence Spectrophotometric, in Wade (Ed),
Clarke’s Isolation and Identification of Drug, 2nd Ed., 222-225, The Pharmaceutical Press, London
Gillard, P., Pope, C., and Bore, P., 1985, Applications of Spectral Analysis of Polymers in Cosmetics, dalam Bore, P., Cosmetic Analysis: Selective Methods and Techniques, 16-27, Marcell-Dekker, Inc., United States of America
Johnsons. R., and Steer, R., 2005, Methylparaben, http://www.medicinescomplete.com/mc/excipients/current/ 1000293170.htm, diakses tanggal 24 Agustus 2007
Mabry, T. J., Markham, K. R., and Thomas, M. B., 1970, The Systematic Identification of Flavonoids, 35, Springer-Verlag, Berlin
Markham, K.R., 1982, Techniques of Flavonoid Identification, diterjemahkan oleh Kosasih Padmawinata, 5, 25, 47, Penerbit ITB, Bandung
Mulya, M. dan Hanwar, D., 2003, Prinsip-prinsip Cara Berlaboratorium yang Baik (Good Laboratory Practice), Majalah Farmasi Airlangga, Vol. III No.2, 71-76
Owen, S.C., 2005, Alcohol,
http://www.medicinescomplete.com/mc/excipients/current/ 1000293170.htm, diakses tanggal 24 Agustus 2007
Owen, S.C., and Weller, P.J., 2005, Propylene Glycol, http://www.medicinescomplete.com/mc/excipients/current/ 1000303976.htm, diakses tanggal 24 Agustus 2007
Pertiwi, M.V., 2006, Penetapan Kadar Flavonoid Total Terhitung Sebagai Kuersetin dengan Menggunakan Metode Kolorimetri dalam Teh Hijau dan Teh Hitam [merkX], Skripsi, Universitas Sanata Dharma, Yogyakarta
Riyanto, S., 1990, Flavonoid, dalam Mursyidi, A. (Ed), Analisis Metabolit Sekunder, 172; 175, Pusat Antar Universitas Bioteknologi, Universitas Gadjah Mada, Yogyakarta
Robinson, T., 1991, Kandungan Organik Tumbuhan tinggi, 6th Ed., 208, diterjemahkan oleh Kosasih Padmawinata, Penerbit ITB, Bandung
Rohman, A., 2007, Kimia Farmasi Analisis, 251-252, Pustaka Pelajar, Yogyakarta Svobodova, A., Psotova, J., and Walterova, D., 2003, Natural phenolics in
prevention of UV-Induced Skin Damage (A review), Biomed. Papers, 147(2), 137-145
Swarbick, J., and Boylan, J.C., 1992, Encyclopedia of Pharmaceutical Technology, jilid 15, 415, Marcel Dekker Inc., Nem York
Syah, A.N.A., 2006, Taklukkan Penyakit dengan Teh Hijau, 46, AgroMedia Pustaka, Jakarta
Wijayanti, L.R., 2008, Optimasi Formula Gel Sunscreen Ekstrak Kering Polifenol Teh Hijau (Camellia sinensis (L.)) dengan CMC (Carboxymethylcellulose) Sebagai Gelling Agent dan Propilen Glikol Sebagai Humektan dengan Metode Desain Faktorial, Skripsi, Universitas Sanata Dharma, Yogyakarta
Lampiran 1. Penimbangan dan contoh perhitungan kadar larutan baku
I II III
Kertas 0,2029 0,1996 0,1963
Kertas + zat 0,22943 0,22506 0,22226
Kertas + sisa 0,20331 0,19952 0,19665
Zat 0,02612 0,02554 0,02561
Contoh perhitungan kadar larutan baku (replikasi II)
Kuersetin dilarutkan dalam etil asetat hingga volume 50,0 ml (larutan stok) 25,54 mg
Diambil 2,5 ml larutan stok diencerkan dengan etil asetat hingga volume 25,0 ml (larutan intermediet)
510,8 ppm × 2,5 ml = X ppm × 25,0 ppm
X = 510,8 ppm × 2,5 ml 25,0 ml
= 51,08 ppm
Dipipet 1,0; 1,5; 2,0; 2,5; 3,0; 3,5; dan 4,0 ml, ditambahkan pereaksi dan diencerkan dengan pelarut hingga volume 25,0 ml
Kadar III = 51,08 ppm × 2,0 ml
25,0 ml
= 4,09 ppm
Kadar IV = 51,08 ppm × 2,5 ml 25,0 ml
= 5,11 ppm
Kadar V = 51,08 ppm × 3,0 ml 25,0 ml
= 6,13 ppm
Kadar VI = 51,08 ppm × 3,5 ml 25,0 ml
= 7,15 ppm
Kadar VII = 51,08 ppm × 4,0 ml 25,0 ml
= 8,17 ppm
Lampiran 2. Penimbangan dan contoh perhitungan kadar teoritis sampel
1 2 3 4 5 6 7
Kertas 0,1936 0,1986 0,1963 0,1960 0,1972 0,1955 0,1974 Kertas + zat 0,21895 0,22348 0,22226 0,22167 0,22278 0,22114 0,22280 Kertas + sisa 0,19358 0,19886 0,19665 0,19616 0,19728 0,19639 0,19822 Zat 0,02537 0,02462 0,02561 0,02551 0,02550 0,02575 0,02458 Basis gel 20,818 20,424 20,324 20,709 20,103 20,217 20,863
Contoh perhitungan kadar kuersetin dalam sampel (replikasi 1) Kuersetin dilarutkan dalam aseton hingga volume 50,0 ml
25,37 mg
Diambil 1,5 ml diencerkan hingga volume 25,0 ml 507,4 ppm x 1,5 ml = X ppm x 25,0 ml
X = 507,4 ppm × 1,5 ml 25,0 ml
= 30,444 ppm
Diambil 20,0 ml lalu dicampurkan dalam basis gel, sehingga jumlah kuersetin yang ditambahkan kedalam basis gel adalah :
30,444 mg 1000,0 ml
0,609 mg 20,0 ml
Jadi di dalam basis gel terdapat 0,609 mg kuersetin. Kadarnya adalah: 0,609 mg
20,818 g
0,002925 g
100 g 0,002925%
Lampiran 3. Data dan contoh perhitungan % recovery
Replikasi Absorbansi Nilai X Kadar terukur (%)
Contoh perhitungan % recovery (replikasi 1)
Nilai X dihitung dari persamaan kurva baku Y = 0,05908X - 0,0079 0,263 = 0,05908X – 0,0079
X = 0,263 + 0,0079 0,05908
= 4,5853 ppm
Nilai X merupakan kadar kuersetin hasil pengenceran 5 ml larutan sampel dengan pereaksi AlCl3, Na sitrat, dan pelarut asam asetat dalam metanol hingga volume
25,0 ml. Maka kadar kuersetin dalam larutan sampel adalah :
4,5853 ppm × 25
5
=
22,9265 ppm = 22,93 ppmJumlah kuersetin terukur dalam basis gel: 22,93 mg
1000,0 ml
0,573 mg 25,0 ml
Kuersetin terukur dalam basis gel sebanyak 0,573 mg. Kadarnya adalah : 0,573 mg
20,818 g =
0,002753 g
Perhitungan % recovery :
% recovery = ,
, × 100%
= 94,13 %
Lampiran 4. Perhitungan koefisien variansi (CV)
Replikasi x x2
1 94,13 8860,46 2 88,77 7880,11
3 92,22 8504,53
4 86,36 7458,05
5 94,35 8901,92 6 97,54 9514,05 7 84,25 7098,06
∑ 637,62 58217,18
Perhitungan Rata-rata (x)
x = ∑
= 637,62
7 = 91,09
Perhitungan Standar Deviasi (SD)
SD = ∑ ∑
= 7(58217,18 ,
7(7-1) = 4,784
Perhitungan Koefisien Variansi (CV)
CV = SD
= 4,784
Lampiran 5. Gambar endapan CMC-Na yang terbentuk
(a)
Endapan yang terbentuk pada waktu isolasi dengan 40 ml aseton
(b) Endapan yang terbentuk pada waktu isolasi dengan 80 ml aseton
BIODATA PENULIS
Penulis skripsi berjudul VALIDASI METODE KOLORIMETRI DENGAN PEREAKSI ALUMINIUM KLORIDA UNTUK PENETAPAN KADAR FLAVONOID TOTAL DALAM SEDIAAN
GEL BASIS NATRIUM
CARBOXYMETHYLCELLULOSE ini bernama lengkap Laurentius Dian Ardiyanto. Penulis dilahirkan di Yogyakarta pada tanggal 3 Februari 1986 sebagai anak pertama dari pasangan Robertus Rudy Suselo dan Maria Magdalena Gani Linarti.
Pendidikan formal yang pernah ditempuh penulis adalah SD Pangudi Luhur Yogyakarta (tahun 1992 hingga tahun 1998), SLTP Negeri 5 Yogyakarta (tahun 1998 hingga tahun 2001), SMU Negeri 1 Yogyakarta (tahun 2001 hingga tahun 2004). Pada tahun 2004 penulis melanjutkan studi di Fakultas Farmasi Universitas Sanata Dharma. Selama kuliah, penulis pernah mengikuti beberapa kepanitiaan. Penulis juga aktif menjadi asisten beberapa mata praktikum.