1
Arsendi Nugraha, Dr. Sutanto, M.Si, Dra Ardi Muharini, M.Si Program Studi Kimia, Fakultas Matematika dan Ilmu Pengetahuan Alam,
Universitas Pakuan Bogor ABSTRACT
Wiping solution is a solution used to clean the plate from ink spent in a printing industry. This ink mixed solution is not one time used, but its treated with separating and adjustment process for recycling and reusing in wiping solution in the printing process. The method used in this separating process was coagulation with coagulant agent addition. Coagulant were used alum ((K2SO4.Al2(SO4)3.24H2O) and FeCl3.6H2O.
This research was aim to determinate the optimum dose of coagulant alum and iron (III) chloride. Its used to assist the treatment process with right dose and the suitable coagulant type refers to characteristic of the wiping solution.
The optimum dose of alum and FeCl3 determined by jar test method with variety
of dose. Parameter of analysis measured are pH, chemical oxygen demand (COD), total suspended solid (TSS), and total dissolved solid (TDS). COD measured by redox titration with potassium dichromate oxidator, then TSS and TDS measured by gravimetric method.
The research given alum and FeCl3 coagulants had the same optimum dose at
6000 ppm. Alum decreased the value of TSS and COD in the wiping solution up to 94.76% and 41.18%, whereas FeCl3 up to 92.67% and 27.06%. FeCl3 resulted in a
better value of TDS up to 8.37% whereas alum 7.10%.
Keywords : Wastewater, Coagulation, Jar test, Aluminium Sulphate, Iron (III) chloride 1Pendahuluan
Industri cetak dalam kegiatannya menggunakan bahan-bahan yang berpotensi mencemarkan lingkungan. Sumber pencemaran berasal dari proses pembuatan acuan cetakan, proses produksi dan proses finishing. Proses tersebut dapat dihasilkan limbah padatan, berupa sisa potongan kertas yang masih dapat dimanfaatkan. Sedangkan limbah cair industri percetakan terdiri dari tinta yang rusak, bahan pelarut, bahan pencair, bahan pengering, dan bahan penolong. (Herlambang, 2002)
Salah satu sumber limbah yang terdapat dalam industri pecetakan yaitu limbah cair dari larutan penyapu. Larutan penyapu adalah suatu larutan yang digunakan untuk membersihkan
silinder penyapu pada proses cetak yang menggunakan sistem “water wiping”.
Atas dasar efisiensi, larutan pembersih tidak digunakan sekali pakai (one-time used), larutan penyapu yang telah bercampur dengan tinta kemudian dilakukan proses daur ulang untuk memisahkan antara tinta dan larutan penyapu melalui proses pengolahan dan koreksi sehingga larutan tersebut dapat digunakan kembali secara berulang-ulang (recycling/reuse) dalam proses pencetakannya.
Cara pengolahan limbah cair yang digunakan dalam penelitian ini yaitu pengendapan polutan yang terkandung di dalam limbah dengan penambahan koagulan. Limbah cair ini tidak mudah diendapkan hanya dengan penambahan asam-basa, sehingga
2 dibutuhkan penambahan bahan kimia berupa koagulan (bahan pengendap) yang dapat membantu proses pengendapan polutan terutama pengendapan polutan sebagai partikel koloid. Ada beberapa jenis koagulan diantaranya adalah tawas (K2SO4.Al2(SO4)3.24H2O) dan
FeCl3.6H2O.
Setiap koagulan memiliki karakteristik yang berbeda-beda, oleh karena itu perlunya disesuaikan dengan limbah yang akan dikoagulasikan serta dengan penambahan dosis yang tepat. Penentuan jenis dan dosis koagulan yang tepat dapat membantu proses pengolahan larutan penyapu ini menjadi efektif dan efisien.
Pemilihan aluminium sulfat dan besi (III) klorida didasarkan atas kedua koagulan tersebut telah dikenal sebagai koagulan yang baik. Kedua koagulan ini memiliki tiga valensi dari logamnya, sehingga dalam penggunaannya akan lebih sedikit dibandingkan dengan koagulan yang hanya memiliki dua ataupun satu valensi. Aluminium sulfat memiliki kelebihan yaitu harga yang relatif murah, serta terhidrolisis dalam air menghasilkan jumlah kation dan anion yang lebih banyak dibandingkan dengan besi (III) klorida. Ion-ion yang dihasilkan dibutuhkan untuk destabilisasi koloid yang terdapat dalam limbah cair.Besi (III) klorida dapat menghasilkan pembentukan flok yang lebih kuat dibandingkan dengan flok yang dihasilkan dari koagulan alum (Schulz, 1984).
Penelitian ini bertujuan untuk menentukan dosis optimum koagulan aluminium sulfat dan besi (III) klorida dalam mengendapkan limbah larutan penyapu pada proses cetak dalam.
2Metode Penelitian 2.1 Bahan dan Alat
Bahan yang digunakan yaitu larutan kalium dikromat 0,25 N, Asam sulfat pekat, perak sulfat, larutan fero amonium sulfat, dan indikator feroin. Alat yang digunakan adalah neraca analitik, labu ukur 50 mL, 100 mL, alat refluks, erlenmeyer 50 mL, 250 mL, gelas ukur, pipet volumetri 5 mL, 10 mL, 25 mL, 50 mL, buret 25 mL, dan 50 mL.
2.2 Kerangka Penelitian
Penelitian ini dilakukan dalam beberapa tahap, tahap pertama yaitu pengukuran kondisi awal limbah cair larutan penyapu yang meliputi pengukuran pH, COD, TDS dan TSS. Analisis awal ini bertujuan untuk mengetahui karakteristik limbah, dan sebagai pembanding kondisi limbah setelah dilakukan proses koagulasi.
Tahap kedua yaitu yaitu penentuan dosis optimum koagulan. Pengujian ini dilakukan dengan memindahkan sampel ke dalam 5 gelas yang masing-masing sampel akan ditambahkan variasi konsentrasi koagulan yang berbeda. Variasi konsentrasi koagulan tawas yang digunakan yaitu 2000, 4000, 6000, 8000, 10.000 dan 12.000 ppm, sedangkan variasi untuk koagulan FeCl3 yaitu 2000,
4000, 6000, 8000,10.000, dan 12.000 ppm. Varian sampel akan dilakukan perlakuan yang sama, yaitu pengadukan cepat, pengadukan lambat, proses pengendapan, dan analisis COD, dan analisis padatan (TDS dan TSS).
Tahap terakhir yaitu pengolahan data dan penarikan kesimpulan. Hasil analisis COD, TDS, dan TSS dari penentuan dosis optimum diplotkan ke dalam grafik. Dosis koagulan optimum didapat dari hasil analisis terbaik dari varian dosis yang ditambahkan.
3 2.2.1Penentuan Konsentrasi
Optimum Koagulan Alum Sebanyak 300 mL sampel dimasukkan ke dalam 6 gelas kimia 500 mL, kemudian koagulan tawas ditambahkan ke dalam gelas kimia dengan variasi konsentrasi koagulan 2000, 4000, 6000, 8000, 10.000, dan 12.000 mg/L. Larutan dilakukan pengadukan dengan kecepatan 100 rpm selama 1 menit, kemudian dilakukan pengadukan lambat dengan kecepatan 20 rpm selama 15 menit. Dibiarkan mengendap selama 30 menit kemudian fase cairan dilakukan analisis pH, COD, dan analisis padatan (TDS dan TSS). 2.2.2Penentuan Konsentrasi
Optimum Koagulan FeCl3 Sebanyak 300 mL sampel dimasukkan ke dalam 6 gelas kimia 500 mL, kemudian koagulan FeCl3
ditambahkan ke dalam gelas kimia dengan variasi konsentrasi koagulan 2000, 4000, 6000, 8000, 10.000, dan 12.000 mg/L. Larutan dilakukan pengadukan dengan kecepatan 100 rpm selama 1 menit, kemudian dilakukan pengadukan lambat dengan kecepatan 20 rpm selama 15 menit. Dibiarkan mengendap selama 30 menit kemudian fase cairan dilakukan analisis pH, COD, dan analisis padatan (TDS dan TSS). 2.2.3Analisis COD (SNI
06-6989.15-2004)
a.Persiapan Reagen
a.1.Larutan standar kalium dikromat 0,25 N
Digunakan labu takar 100 mL untuk melarutkan 1,228 K2Cr2O7 p.a
yang telah dikeringkan dalam oven 105°C dan didinginkan dalam desikator, tambahkan air suling hingga tanda batas. a.2.Reagen perak (II) sulfat dalam asam sulfat pekat
Ditambahkan Ag2SO4 sebanyak
10 gram dalam 1000 mL asam sulfat
pekat. Pelarutan Ag2SO4 membutuhkan
waktu satu sampai dua hari.
a.3.Larutan standar fero amonium sulfat 0,1 N
Digunakan labu takar 1000 mL untuk melarutkan 39 gram Fe(NH4)2(SO4)2.6H2O dalam 500 mL air
suling, kemudian ditambahkan 20 mL asam sulfat pekat, setelah dingin tanda bataskan dengan menggunakan air suling. Standarisasi selalu dilakukan sebelum titrasi COD.
b.Standarisasi Larutan Titran FAS Larutan standar kalium dikromat 0,10 N dipipet sebanyak 10 mL, kemudian diencerkan dengan akuades hingga 100 mL, ditambahkan dengan asam sulfat pekat sebanyak 2 mL. Setelah dingin dititrasi dengan larutan fero ammonium sulfat dengan menggunakan 3 tetes indikator feroin, titik akhir akan dihasilkan warna larutan menjadi oranye kemerah-merahan. Dilakukan secara duplo. Dicatat volume titran.
c. Analisis Kadar COD
Sampel air limbah dipipet sebanyak 10 mL ke dalam Erlenmeyer 300 mL, kemudian ditambahkan 5 butir batu didih, larutan kalium dikromat 0,25 N sebanyak 10 mL, dan secara perlahan ditambahkan reagen asam sulfat-perak sulfat sebanyak 5 mL, diaduk secara perlahan untuk mencegah penguapan dan larutan tercampur merata. Erlenmeyer tersebut diletakkan di bawah kondenser yang telah dialiri air pendingin, kemudian ditambahkan 25 mL asam sulfat-perak sulfat sebanyak 25 mL sedikit demi sedikit sambil perlahan diaduk. Erlenmeyer dipanaskan di atas pemanas, dilakukan refluks selama 2 jam.
Erlenmeyer dilepaskan dari kondenser, didinginkan, ditambahkan indikator feroin, dilakukan titrasi dengan larutan standar fero ammonium sulfat 0,1 N hingga warna larutan menjadi
4 cokelat–merah. Volume FAS yang terpakai dicatat.Dilakukan dengan blanko. d.Perhitungan a x x m sampel Keterangan :
a = mL FAS yang digunakan untuk titrasi blanko
b = mL FAS yang digunakan untuk titrasi sampel
N = Normalitas larutan FAS Fp= faktor pengenceran
2.2.4Analisis padatan tersuspensi total (SNI 06-6989.3-2004)
a.Penimbangan Kertas Saring Kosong. Kertas saring diletakkan pada alat penyaring dan dibilas tiga kali dengan akuades masing-masing sebanyak 20 mL. Alat pengisap dinyalakan untuk menghisap air yang terdapat pada kertas saring. Kertas saring Whatman Grade 934 AH diambil dan dikeringkan dalam oven dengan suhu 103-1 5 ˚ selama 1 jam. Kemudian didinginkan dalam desikator selama 10 menit dan ditimbang. Penimbangan dilakukan sampai diperoleh bobot konstan.
b.Penyaringan contoh.
Contoh homogen sebanyak 50,0 mL disaring dengan menggunakan kertas saring yang telah diketahui bobot konstannya pada cawan Gooch yang dilengkapi dengan alat pengisap. Kemudian kertas saring dibilas tiga kali dengan akuades masing-masing sebanyak 10 mL. Setelah itu, kertas saring diambil dan dikeringkan dalam oven dengan suhu 103-1 5 ˚ selama 1 jam. Kertas saring didinginkan dalam desikator selama 10 menit dan kemudian ditimbang. Penimbangan dilakukan sampai diperoleh bobot konstan.
c. Perhitungan
Rumus untuk perhitungan TSS adalah sebagai berikut:
o ot esidu pada ke tas sa ing volume ontoh
2.2.5Analisis Padatan Terlarut Total (SNI 06-6989.27-2005)
a. Penimbangan kertas saring kosong. Kertas saring diletakkan pada alat penyaring dan dibilas tiga kali dengan akuades masing-masing sebanyak 20 mL. Alat pengisap dinyalakan untuk menghisap air yang terdapat pada kertas saring. Kertas saring Whatman Grade 934 AH diambil dan dikeringkan dalam oven dengan suhu 103-1 5 ˚ selama 1 jam. Kemudian didinginkan dalam desikator selama 10 menit dan ditimbang. Penimbangan dilakukan sampai diperoleh bobot konstan.
b.Persiapan cawan
Cawan yang telah bersih dipanaskan pada suhu 180°C selama 1 jam di dalam oven. Cawan dipindahkan ke dalam desikator dengan menggunakan penjepit. Setelah dingin ditimbang dengan neraca analitik. Ulangi pemanasan dengan oven dan penimbangan hingga didapat bobot yang konstan.
c. Penyaringan contoh.
Contoh homogen sebanyak 50,0 mL disaring dengan menggunakan kertas saring yang telah diketahui bobot konstannya pada cawan Gooch yang dilengkapi dengan alat pengisap. Filtrat dipipet sebanyak 10,0 mL, dimasukkan ke dalam cawan yang telah diketahui bobotnya. Cawan berisi filtrat dikeringkan hingga semua air telah menguap dalam oven pada suhu 180°C. Dinginkan dalam desikator selama 10 menit dan kemudian ditimbang.. Ulangi pemanasan dengan oven dan penimbangan hingga didapat bobot yang konstan.
5 d.Perhitungan
Rumus untuk perhitungan TDS adalah sebagai berikut:
o ot esidu pada
volume ontoh 3Hasil Dan Pembahasan
Koagulan alum dan FeCl3
dilakukan pengujian melalui jar test
pada berbagai konsentrasi yaitu 2000, 4000, 6000, 10.000, dan 12.000 ppm. Sebelum dan sesudah jar test dilakukan pengujian berbagai parameter yaitu pH, TDS, TSS dan COD.
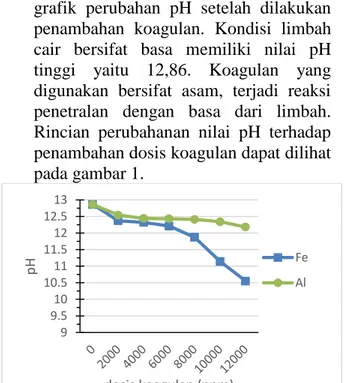
3.1 Pengaruh Dosis Koagulan Terhadap pH Larutan Penyapu
Koagulan yang berupa garam dari logam dan sisa asam yang terlarut dalam air akan terhidrolisis dan memberikan pengaruh terhadap pH larutan tersebut. Gambar dapat dilihat grafik perubahan pH setelah dilakukan penambahan koagulan. Kondisi limbah cair bersifat basa memiliki nilai pH tinggi yaitu 12,86. Koagulan yang digunakan bersifat asam, terjadi reaksi penetralan dengan basa dari limbah. Rincian perubahanan nilai pH terhadap penambahan dosis koagulan dapat dilihat pada gambar 1.
Gambar 1. Grafik hubungan dosis koagulan dengan pH
Penambahan 6000 ppm merupakan awal penurunan pH. Hal ini menunjukkan kesukaran reaksi garam asam dalam mengubah suasana basa berlebih hingga menghasilkan penurunan
pH. Perubahan pH terbesar terjadi pada penambahan koagulan FeCl3 dengan
dosis 12.000 ppm menurunkan pH hingga 10,55. Perbandingan pH pada tiap penambahan dosis koagulan FeCl3
memberikan penurunan pH lebih besar dibandingkan dengan koagulan Al. Semakin tinggi penambahan dosis koagulan akan semakin menurunkan pH limbah, koagulan alum pada penambahan dosis tertinggi menghasilkan penurunan pH menjadi 12,18.
Aluminium sulfat dan besi (III) klorida merupakan garam yang berasal dari asam kuat dan basa lemah, bila dilarutkan dalam air akan menghasilkan larutan yang bersifat asam. Kation M+ dari garam bereaksi dengan ion-ion hidroksil yang dihasilkan oleh disosiasi air, membentuk basa lemah MOH dan meninggalkan ion-ion hidrogen dalam larutan.
M+ + H2O ⇌ MOH + H+
Al3+ + 3H2O ⇌ Al(OH)3 + 3H+
Fe3+ + 3H2O ⇌ Fe(OH)3 + 3H+
ion aluminium termasuk ion amfoter, sehingga terdapat perbedaan antara sifat aluminium dengan besi. Suasana basa berlebih menyebabkan endapan Al(OH)3
dapat melarut kembali. Berbeda dengan endapan Fe(OH)3 yang lebih stabil dan
tidak melarut kembali dalam kondisi basa berlebih sehingga koagulan FeCl3
menyebabkan penurunan pH yang lebih cepat daripada Alum. Endapan Al(OH)3
melarut kembali dalam basa berlebih menghasilkan ion tetrahidroksoaluminat (Vogel, 1990).
Al(OH)3 + OH¯ ⇌ [Al(OH)4]¯
Ion Cl¯dan SO42¯ memberikan
pengaruh terhadap perubahan pH. Ion Cl¯terdisosiasi secara sempurna dalam larutan, sedangkan ion SO42¯
terdisosiasi secara bertahap. Disosiasi tahap pertama terurai secara sempurna, 9 9.5 10 10.5 11 11.5 12 12.5 13 p H dosis koagulan (ppm) Fe Al
6 sedangkan disosiasi tahap kedua sebesar 1,2.10¯2
(Harjadi, 1986).
H2SO4⇌ HSO4¯ + H+………α1
HSO4¯ ⇌ SO42¯ + H+………α2
Penurunan pH yang lebih rendah akan mengurangi nilai ekonomis dalam proses daur ulang limbah air penyapu. Hal ini dikarenakan pada setelah proses koagulasi terdapat pengaturan kembali komposisi dari larutan penyapu. Sehingga semakin rendah nilai pH akan membutuhkan penambahan basa yang lebih banyak untuk memenuhi persyaratan kebutuhan larutan penyapu. Kandungan basa larutan penyapu yang dibutuhkan pada proses cetak yaitu 0,5% NaOH.
3.2 Pengaruh Dosis Koagulan
Terhadap TSS Larutan Penyapu Nilai TSS mengalami penurunan setelah proses koagulasi dari koagulan alum maupun FeCl3. Berdasarkan
Gambar 2, diketahui koagulan alum mencapai dosis optimum pada konsentrasi 6000 ppm, dan koagulan FeCl3 pada 6000 ppm. Kondisi TSS awal
limbah yaitu 382 ppm dan proses koagulasi optimum menghasilkan nilai TSS 20 ppm untuk alum dan 28 ppm untuk FeCl3. Persentase penurunan TSS
setelah dilakukan koagulasi mencapai 94,76% untuk alum, sedangkan untuk koagulan FeCl3 mencapai 92,67%.
Selisih persentase penurunan nilai TSS limbah antara koagulan alum dan koagulan FeCl3 tidak terlampau jauh,
yaitu 2,09%. Rincian perhitungan TSS dapat dilihat pada Lampiran 2.
Gambar 2. Grafik hubungan dosis koagulan dengan TSS
Mekanisme pengendapan suspensi dan koloid yang terjadi pada limbah yaitu koagulan menghasilkan ion M3+ yang kemudian terhidrolisis menjadi M(OH)3 yang berupa koloid bermuatan
positif. Koloid alam yang umumnya bermuatan negatif akan tersisipi koloid positif ini, sehingga antar koloid yang bermuatan negatif dapat saling mendekat, karena hilangnya gaya tolak menolak antar koloid. Akhirnya dengan tidak adanya gaya tolak menolak pada koloid, koloid akan kehilangan kestabilan sehingga gaya yang mengenai koloid hanya gaya tarik massa, sehingga koloid ini akan terendapkan.
Setelah penambahan dosis lebih dari 6000 ppm terjadi peningkatan nilai TSS. Hal ini dikarenakan jumlah koagulan diatas 6000 ppm telah mencapai konsentrasi yang berlebih, sehingga terjadi proses restabilisasi muatan koloid karena terjadinya adsorpsi
counter ion. Bila counter ion yang teradsorp berlebih, muatan partikel koloid akan menjadi positif dan terjadi tolak menolak antar partikel koloid yang bermuatan positif kemudian koloid terdispersi kembali dan menjadi stabil. 3.3 Pengaruh Dosis Koagulan
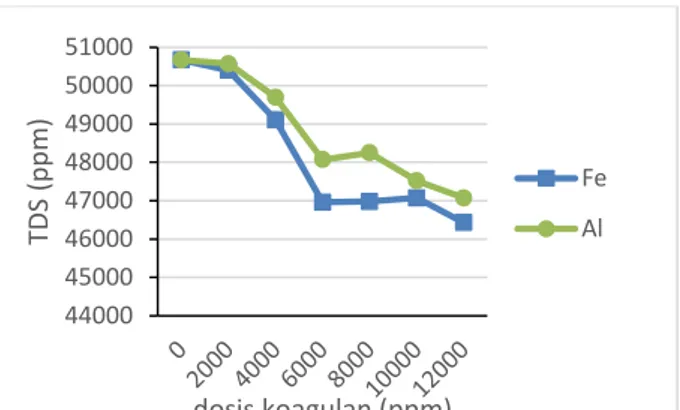
Terhadap TDS Larutan Penyapu Data analisis TDS terhadap penambahan dosis koagulan terlihat pada gambar 8 bahwa setiap penambahan dosis koagulan nilai TDS menurun.
0 50 100 150 200 250 300 350 400 TSS (p p m ) dosis koagulan (ppm) Fe Al
7 Kondisi awal sampel memiliki nilai TDS mencapai 50.670 ppm yang menandakan bahwa kandungan padatan terlarut yang cukup tinggi. Penambahan dosis 6.000 ppm pada koagulan alum menghasilkan penurunan sebesar 5,13%, sedangkan koagulan FeCl3 sebesar 7,32%.
Peningkatan jumlah dosis melebihi 6000 ppm hanya sedikit mempengaruhi penurunan nilai TDS. Selisih persentase penurunan TDS pada koagulan alum antara dosis 6000 dan 12.000 ppm yaitu 1,97% sedangkan pada koagulan FeCl3
dengan rentang dosis yang sama yaitu 1,05%. Hal ini secara ekonomis tidak menguntungkan karena dengan penambahan jumlah dosis sebesar dua kali lipatnya hanya memiliki perbedaan penurunan nilai TDS tidak lebih dari 2%. Sehingga dapat diketahui dosis koagulan optimum baik koagulan alum dan FeCl3
yaitu pada dosis 6.000 ppm. Penambahan koagulan dengan dosis tertinggi menurunkan angka TDS sebesar 8,37% untuk FeCl3, dan 7,10%
untuk alum. Data perhitungan TDS dapat dilihat pada Lampiran 3.
Zat padat yang terdapat dalam cairan terdiri dari zat padat terlarut yaitu berupa garam dan molekul organik, dan zat padat tersuspensi dan koloidal, seperti tanah liat dan kwarts. Analisis TDS merupakan analisis untuk mengetahui jumlah konsentrasi zat padat terlarut dari suatu cairan. Proses koagulasi berpengaruh terhadap zat padat suspensi dan koloid, sedangkan penurunan nilai TDS yang terjadi yaitu adanya zat terlarut yang terjerap ke dalam koloid dan ikut terendapkan.
Gambar 3. Grafik hubungan dosis dengan TDS
Penurunan padatan terlarut dalam limbah yang ditambahkan koagulan ini terjadi karena adanya jerapan partikel terlarut oleh adanya pertukaran ion H+ pada M(OH)3 dengan partikel logam.
Reaksi penjerapan yang terjadi merupakan reaksi pertukaran ion (Manahan, 1994). Reaksi yang terjadi sebagai berikut :
M(OH)3 + Zn → M( H) -Zn-O + 2H+
3.4 Pengaruh Dosis Koagulan
Terhadap COD Larutan Penyapu Nilai COD merupakan nilai yang menunjukkan jumlah kandungan zat organik yang terdapat dalam air limbah. Data hasil analisis COD proses koagulasi terlihat pada gambar 4.
Gambar 4. Grafik hubungan dosis dengan COD
Penambahan koagulan alum dan FeCl3 mampu menurunkan nilai COD.
Penurunan terjadi karena partikel zat organik ikut mengendap dalam proses koagulasi. Penurunan nilai COD lebih baik didapatkan dari koagulasi melalui
44000 45000 46000 47000 48000 49000 50000 51000 TDS (p p m ) dosis koagulan (ppm) Fe Al 35,000 40,000 45,000 50,000 55,000 60,000 65,000 70,000 COD (p p m ) dosis koagulan (ppm) Fe Al
8 koagulan alum. Penambahan koagulan dengan dosis 2000 ppm menghasilkan penurunan nilai COD yang cukup besar, yaitu mencapai 32,94% untuk alum dan 20,59% untuk FeCl3. Penambahan dosis
koagulan melebihi dosis 2000 ppm tetap akan menurunkan nilai COD meskipun penurunan ini tidak terlalu besar jika dibandingkan dengan penurunan pada dosis 2000 ppm. Nilai COD terendah yang didapatkan koagulan alum yaitu 40.080 ppm sedangkan koagulan FeCl3
yaitu 49.699,2 ppm. Rincian nilai COD dapat dilihat pada Lampiran 4.
Penurunannya nilai COD pada penambahan koagulan FeCl3 terlihat
lebih sedikit dibandingkan dengan nilai COD alum. Jika dihubungkan dengan nilai TDS yang lebih rendah untuk koagulan Fe dibandingkan dengan koagulan alum maka dimungkinkan ion Fe3+ yang terbentuk lebih kuat menarik ion atau garam terlarut dari limbah untuk membentuk suatu flok, sehingga kinerja penarikan koloid akan lebih rendah dibandingkan dengan alum.
4Kesimpulan dan Saran 4.1 Kesimpulan
Koagulan Alum dan FeCl3 dapat
digunakan untuk pengolahan limbah yang berasal dari proses larutan penyapu, terbukti dapat menurunkan parameter TSS, TDS, dan COD. Penggunaan koagulan alum dinilai lebih baik karena dengan dosis optimum yang sama dengan FeCl3, yaitu 6000 ppm,
dapat menurunkan parameter TSS dan COD lebih rendah, dibandingkan dengan koagulan FeCl3. Penurunan pH yang
terjadi pada penambahan koagulan FeCl3
hingga 10,55 sedangkan koagulan alum 12,18. Parameter nilai COD dengan menggunakan koagulan alum menghasilkan penurunan hingga 41,18% sedangkan dengan menggunakan FeCl3
hingga 27,06%. Parameter nilai TSS antara koagulan alum dan FeCl3
menghasilkan penurunan yang tidak terpaut jauh, yaitu masing-masing 94,76% dan 92,67%. Penurunan TDS untuk koagulan alum yaitu 7,10% dan koagulan FeCl3 yaitu 8,37%.
4.2 Saran
Kriteria larutan penyapu membutuhkan kondisi pH yang cukup tinggi, akan tetapi proses koagulasi dinilai dapat dioptimalisasi pada pH yang mendekati netral. Sehingga dibutuhkan adanya penelitian lanjutan untuk menentukan pH optimum koagulasi larutan penyapu, serta jumlah kebutuhan basa yang ditambahkan setelah proses koagulasi untuk memenuhi kriteria larutan penyapu dengan pH tinggi.
5DAFTAR PUSTAKA
Alaert, G dan Sri S. S. 1984.Metoda Penelitian Air. Surabaya. Penerbit Usaha Nasional.
Badan Standarisasi Nasional. 2004. SNI 06-6989.3-2004. Air dan Air Limbah – Cara Uji Kadar Padatan Tersuspensi Total. BSN. Serpong.
Badan Standarisasi Nasional. 2005. SNI 06-6989.27-2005. Air dan Air Limbah – Cara Uji Kadar Padatan Terlarut Total. BSN. Serpong.
Badan Standarisasi Nasional. 2004. SNI 06-6989.15-2004. Air dan Air Limbah – Cara Uji kebutuhan Oksigen Kimia dengan Refluks Terbuka. BSN Serpong.
Herlambang, A. 2002. Teknologi Pengolahan Limbah Cair Industri. Pusat Pengkajian dan
Penerapan Teknologi
Lingkungan dan Badan
Pengendalian Dampak
Lingkungan Daerah. Samarinda. Harjadi, W. 1986. Ilmu Kimia Analitik
9 International Finance Corporation. 2007.
Enviromental, Health, and Safety Guidelines for Printing. IFC. London.
Kipphan, Helmut. 2000. Handbook of Print Media, Springer, Berlin. Karamah, EF, Lubis AO. 1998.
Perlakuan Koagulasi dalam Proses Pengolahan Air dengan
Membran : Pengaruh
Pengadukan Pelan Koagulan Aluminium Sulfat terhadap Kinerja Membran. Fakultas Matematika dan Ilmu Pengetahuan Alam. Universitas Indonesia.
Manahan, S.E. 2005. Enviromental Chemistry Eighth Edition. CRC Press. Florida.
Saeni, MS. 1989. Kimia Lingkungan. Dirjen Pendidikan Tinggi Departemen Pendidikan dan Kebudayaan Pusat Antar Universitas Ilmu Hayati IPB.Bogor.
Schulz, C.R., D.A. Okun, 1984, Surface Water Treatment For Communities In Developing Countries, John Wiley & Son Inc., Canada
Senevirate, Mohan., 2007, A Practical Approach to Water Conservation for Commercial and Industrial Facilities, Elsevier LTD, Burlington, USA
Siregar, S.A.2005.Instalasi Pengolahan Air Limbah Penerbit Kanisius ( Anggota IKAPI ).Yogyakarta
Teng ST. 2000. Gambaran Umum Penanganan Limbah. PT. Nusantara Water Centre. Jakarta. Vogel. 1990.Buku Teks Analisis
Anorganik Kualitatif Makro dan Mikro Edisi kelima, Bagian II, PT Kalman Media Pusaka. Jakarta.
Wiratno, E. 2009. Analisa Kelayakan Investasi Pembuatan Sulfonated Castor Oil di Perum Peruri. Universitas Singaperbangsa. Karawang.
10 Lampiran 2. Data pengukuran TSS
Jenis Koagulan Dosis (ppm) bobot kertas (mg) bobot kertas + residu (mg) bobot residu (mg) Volume sampel (mL) TSS (ppm) % penurunan Awal 0 132.8 151.9 19.1 50 382 0.00% Alum 2000 131.9 136.8 4.9 50 98 74.35% 4000 134.9 136.8 1.9 50 38 90.05% 6000 138.1 139.1 1.0 50 20 94.76% 8000 134.9 136.3 1.4 50 28 92.67% 10000 130.7 132.4 1.7 50 34 91.10% 12000 134.4 136.2 1.8 50 36 90.58% FeCl3 2000 178.1 182.8 4.7 50 94 75.39% 4000 180.2 183.1 2.9 50 58 84.82% 6000 174.5 175.9 1.4 50 28 92.67% 8000 177.7 180.0 2.3 50 46 87.96% 10000 177.6 181.6 4.0 50 80 79.06% 12000 175.2 179.4 4.2 50 84 78.01% Contoh perhitungan TSS
Bobot residu = (bobot kertas saring + residu) – bobot kertas saring kosong = 151,9 mg – 132,8 mg = 19,1 mg o ot esidu volume ontoh 5 m 1 382 mg/L
penu unan awal akhi
penu unan
11 Lampiran 3. Data pengukuran TDS
Jenis Koagulan Dosis (ppm) bobot cawan kosong (g) bobot cawan + residu (g) bobot residu (g) Volume sampel (mL) TDS (ppm) % penurunan Awal 0 42.8800 43.3867 0.5067 10 50670 0.00% Alum 2000 42.7013 43.2070 0.5057 10 50570 0.20% 4000 43.3521 43.8491 0.4970 10 49700 1.91% 6000 43.1208 43.6015 0.4807 10 48070 5.13% 8000 42.8790 43.3615 0.4825 10 48250 4.78% 10000 42.9671 43.4423 0.4752 10 47520 6.22% 12000 47.3520 47.8227 0.4707 10 47070 7.10% FeCl3 2000 42.6988 43.2028 0.5040 10 50400 0.53% 4000 43.3532 43.8443 0.4911 10 49110 3.08% 6000 42.9275 43.3971 0.4696 10 46960 7.32% 8000 45.3795 45.8493 0.4698 10 46980 7.28% 10000 43.3496 43.8203 0.4707 10 47070 7.10% 12000 42.8010 43.2653 0.4643 10 46430 8.37% Contoh perhitungan TDS
Bobot residu = (bobot cawan + residu) – bobot cawan kosong = 43,3867 g – 42,8800 mg = 0,5067 g o ot esidu volume ontoh 1 m 1 1 g 50.670 mg/L
penu unan awal akhi
penu unan 5 5 5
12 Lampiran4. Data analisis COD
Koagulan Dosis (ppm) M FAS V blangko (mL) fp v titrasi (mL) vb-vs (mL) COD (ppm) % penurunan Awal 0 0.1002 24.4 50 7.4 17.0 68136.0 0.00% Alum 2000 0.1002 24.4 50 13.0 11.4 45691.2 32.94% 4000 0.1002 24.4 50 13.4 11 44088.0 35.29% 6000 0.1002 24.4 50 13.6 10.8 43286.4 36.47% 8000 0.1002 24.4 50 13.6 10.8 43286.4 36.47% 10000 0.1002 24.4 50 13.4 11 44088.0 35.29% 12000 0.1002 24.4 50 14.4 10 40080.0 41.18% FeCl3 2000 0.1002 24.4 50 10.9 13.5 54108.0 20.59% 4000 0.1002 24.4 50 10.8 13.6 54508.8 20.00% 6000 0.1002 24.4 50 11.1 13.3 53306.4 21.76% 8000 0.1002 24.4 50 11.4 13.0 52104.0 23.53% 10000 0.1002 24.4 50 12.0 12.4 49699.2 27.06% 12000 0.1002 24.4 50 12.0 12.4 49699.2 27.06% Contoh perhitungan a x x x fp m sampel x 1 x x 5 1 m x 1 x x 5 1 m .1 ppm
penu unan awal akhi
penu unan 1 5 1