DAN FeCl
3SERTA PENJERAPAN OLEH ZEOLIT
RETNO SUDIARTI
DEPARTEMEN KIMIA
FAKULTAS MATEMATIKA DAN ILMU PENGETAHUAN ALAM
INSTITUT PERTANIAN BOGOR
BOGOR
2009
RETNO SUDIARTI. Pengolahan Limbah Cair Percetakan dengan Penambahan Koagulan
Tawas dan FeCl
3serta Penjerapan oleh Zeolit. Dibimbing oleh ETI ROHAETI dan
BETTY MARITA SOEBRATA.
Limbah cair pencucian pelat cetak percetakan IPB memiliki nilai kebutuhan oksigen
kimia (COD), kebutuhan oksigen biokimia (BOD), padatan tersuspensi (TSS), logam zink
(Zn), dan pH yang masih cukup tinggi dan tidak memenuhi kriteria baku mutu limbah
cair yang aman bagi lingkungan sehingga diperlukan usaha untuk mengolahnya. Usaha
sederhana pengolahannya adalah dengan penambahan koagulan dan jerapan dengan
zeolit. Penelitian ini dilakukan untuk membandingkan kondisi optimum koagulan tawas
dan FeCl
3melalui keragaman konsentrasi koagulan dan pH koagulasi, menganalisis
endapan hasil koagulasi, dan mengetahui pengaruh penambahan zeolit terhadap filtrat
hasil pengendapan dengan koagulan. Hasil penelitian menunjukkan tawas memiliki
konsentrasi optimum sebesar 110 mg/L dan pH koagulasi optimum pada pH 8 sedangkan
FeCl
3memiliki konsentrasi optimum sebesar 80 mg/L dan pH koagulasi optimum pada
pH 6. Endapan hasil koagulasi mengandung senyawa silikat. Penambahan zeolit dapat
menurunkan nilai COD, BOD
5, TSS, dan logam Zn dalam filtrat hasil pengendapan
dengan koagulan walaupun penurunannya tidak terlalu besar dan nilai COD, BOD
5, TSS,
dan logam Zn masih berada di atas baku mutu air limbah yang aman.
ABSTRACT
RETNO SUDIARTI. Printing Wastewater Treatment by Alum and FeCl
3Coagulants
Additions also Adsorptions by Zeolite. Supervised by ETI ROHAETI and BETTY
MARITA SOEBRATA.
Wastewater mold plate cleaning of IPB printing has high chemical oxygen demand
(COD), biochemical oxygen demand (BOD), total suspended solid (TSS), zinc (Zn), and
pH values and do not meet with standard of safe quality wastewater criteria for
environments and need to the treated. The simplest method for wastewater treatments is
by coagulants addition and its adsorption with zeolite. This research was to compare alum
and FeCl
3coagulant optimum conditions through coagulant concentrations and
coagulation pH variation, analysis sludge product of coagulation, and observe the effect
of zeolite additions to the resulted precipitation filtrate. It was observed that alum had
optimum concentration of 110 mg/L and coagulation pH of 8 whereas FeCl
3had optimum
concentration of 80 mg/L and coagulation pH at 6. Sludge product of coagulation had
silicate. Zeolite additions could reduce COD, BOD
5, TSS, and Zn values in its resulted
precipitation filtrate however the reduction was not significant and COD, BOD
5, TSS,
FeCl
3SERTA PENJERAPAN OLEH ZEOLIT
RETNO SUDIARTI
Skripsi
sebagai salah satu syarat untuk memperoleh gelar
Sarjana Sains pada
Departemen Kimia
DEPARTEMEN KIMIA
FAKULTAS MATEMATIKA DAN ILMU PENGETAHUAN ALAM
INSTITUT PERTANIAN BOGOR
BOGOR
2009
NRP : G44204002
Disetujui
Pembimbing I
Dr. Eti Rohaeti, MS.
NIP 131 663 051
Pembimbing II
Betty Marita Soebrata, S.Si, M.Si.
NIP 131 694 523
Diketahui
Dekan Fakultas Matematika dan Ilmu Pengetahuan Alam
Institut Pertanian Bogor
Tanggal Lulus:
Dr. drh. Hasim, DEA
NIP 131 578 806
dengan rahmat, hidayah, dan inayah-Nya penulis dapat menyelesaikan karya
ilmiah ini sebagai salah satu syarat memperoleh gelar sarjana di Institut Pertanian
Bogor. Shalawat dan salam tidak lupa penulis panjatkan kepada Nabi besar
Muhammad SAW. Karya ilmiah yang berjudul Pengolahan Limbah Cair
Percetakan dengan Penambahan Koagulan Tawas dan FeCl
3serta Penjerapan
oleh Zeolit disusun berdasarkan hasil penelitian yang dilakukan di Laboratorium
Kimia Analitik, Departemen Kimia, Fakultas Matematika dan Ilmu Pengetahuan
Alam, Institut Pertanian Bogor dari bulan Juni sampai Oktober 2008.
Terima kasih penulis ucapkan, terutama kepada Ibu Dr. Eti Rohaeti, MS dan
Ibu Betty Marita Soebrata, S.Si, M.Si selaku dosen pembimbing atas bimbingan,
arahan, serta dorongan semangat selama penelitian dan penyusunan karya ilmiah
ini. Ucapan terima kasih tak lupa penulis ucapkan kepada kedua orang tua tercinta
atas dukungan, semangat, dan doanya, Bapak Endang dan Bapak Ujang dari pihak
percetakan IPB yang telah memberikan bantuan dan izin pengambilan contoh
limbah pencucian pelat cetak, dan Bapak Budi yang telah membantu dalam
pengukuran logam dengan AAS, serta Bapak Eman Suherman, Ibu Nunung, dan
seluruh staf Laboratorium Kimia Analitik atas bantuannya selama penelitian.
Terima kasih juga penulis ucapkan kepada seluruh teman-teman Kimia Angkatan
41 atas dukungan dan bantuannya. Akhir kata semoga karya ilmiah ini
bermanfaat.
Bogor, Januari 2009
Retno Sudiarti
Marzuki dan Siti Mulyati. Penulis merupakan anak pertama dari dua bersaudara.
Penulis melaksanakan pendidikan formal di SMU Negeri I Leuwiliang,
Bogor pada tahun 2001-2004. Pendidikan dilanjutkan di IPB pada tahun 2004
melalui Undangan Seleksi Masuk Institut Pertanian Bogor dengan pilihan
Program Studi Kimia, Departemen Kimia, Fakultas Matematika dan Ilmu
Pengetahuan Alam.
Selama mengikuti perkuliahan, penulis menjadi asisten praktikum Kimia
Dasar TPB, Elektroanalitik dan Teknik Pemisahan, Spektrofotometri dan Aplikasi
Kemometrik, Spektroskopi II Diploma Analisis Kimia, dan Kimia Bahan Alam.
Penulis melakukan Praktik Kerja Lapangan di PT Aneka Tambang Unit Bisnis
Pertambangan Emas Pongkor, Bogor dari Bulan Juli sampai Agustus 2007.
DAFTAR ISI
Halaman
DAFTAR TABEL ... viii
DAFTAR GAMBAR ... viii
DAFTAR LAMPIRAN ... ix
PENDAHULUAN ... 1
TINJAUAN PUSTAKA
Cetak ... 2
Pengendapan Polutan dalam Limbah dengan Koagulan ... 3
Zeolit ... 4
Derajat Keasaman (pH) ... 4
Padatan ... 5
Kebutuhan Oksigen Biokimia ... 5
Kebutuhan Oksigen Kimia ... 5
Zink ... 5
BAHAN DAN METODE
Bahan dan Alat ... 6
Metode Penelitian ... 6
HASIL DAN PEMBAHASAN
Limbah Pencucian Pelat Cetak ... 8
Konsentrasi Koagulan dan pH Koagulasi Optimum ... 8
Aktivasi Zeolit ... 11
Jerapan Zeolit ... 11
Kebutuhan Oksigen Biokimia ... 12
Padatan Tersuspensi Total ... 12
Analisis FTIR ... 13
SIMPULAN DAN SARAN ... 13
DAFTAR PUSTAKA ... 14
DAFTAR TABEL
Halaman
1 Limbah cair pencucian pelat cetak ... 8
2 Bilangan gelombang inframerah dan dugaan gugus fungsi ... 13
DAFTAR GAMBAR
Halaman
1 Skema sumber limbah percetakan ... 3
2 Struktur dasar zeolit ... 4
3 Hubungan antara konsentrasi tawas (mg/L) dan nilai COD (mg/L) ... 9
4 Hubungan antara konsentrasi tawas (mg/L) dan bobot endapan (gram) ... 9
5 Hubungan antara konsentrasi FeCl
3(mg/L) dan nilai COD (mg/L) ... 10
6 Hubungan antara konsentrasi FeCl
3(mg/L) dan bobot endapan (gram) ... 10
7 Konsentrasi Zn dalam limbah dengan dan tanpa perlakuan ... 11
8 Nilai COD limbah dengan dan tanpa perlakuan koagulan dan zeolit ... 12
9 Nilai BOD
5dengan dan tanpa perlakuan koagulan dan zeolit ... 12
DAFTAR LAMPIRAN
Halaman
1 Proses cetak mencetak ... 17
2 Diagram alir kerja ... 18
3 Volume koagulan pada setiap konsentrasi koagulan dalam 150 mL limbah . 19
4 Diagram variasi konsentrasi koagulan dan pH koagulasi ... 20
5 Pembuatan larutan untuk pengukuran COD ... 21
6 Pembuatan larutan untuk pengukuran BOD
5... 21
7 Pengendapan dengan penambahan koagulan ... 22
8 Nilai pH limbah pada berbagai konsentrasi tawas ... 23
9 Nilai pH limbah pada berbagai konsentrasi FeCl
3... 23
10 Nilai COD dengan perlakuan penambahan koagulan tawas ... 24
11 Bobot endapan setelah perlakuan penambahan koagulan tawas ... 25
12 Nilai COD dengan perlakuan penambahan koagulan FeCl
3... 26
13 Bobot endapan setelah perlakuan penambahan koagulan FeCl
3... 27
14 Kapasitas jerapan zeolit terhadap Zn
2+filtrat hasil pengendapan ... 28
15 Perbandingan COD dengan dan tanpa jerapan zeolit ... 29
16 Nilai BOD
5hasil pengendapan koagulan dengan dan tanpa zeolit ... 30
17 Penentuan nilai padatan tersuspensi (TSS) ... 32
18 Spektrum FTIR endapan hasil pengendapan dengan koagulan ... 33
PENDAHULUAN
Institut Pertanian Bogor (IPB) memiliki percetakan yang dinamakan IPB Press untuk memenuhi kebutuhan pendidikan masyarakat IPB. Sebagaimana percetakan pada umumnya, kegiatan IPB Press ini juga tidak terlepas dari masalah limbah yang dihasilkan. Peraturan Pemerintah No. 18 tahun 1999 mencantumkan bahwa limbah cair yang dihasilkan dari kegiatan percetakan dikategorikan sebagai limbah Bahan Berbahaya dan Beracun (B3) dengan kode limbah D212. Limbah B3 merupakan limbah yang memiliki salah satu atau lebih sifat-sifat sebagai berikut: mudah meledak, mudah terbakar, reaktif, beracun, menyebabkan infeksi, dan korosif. Sumber limbah menurut peraturan ini berasal dari
sludge (lumpur) proses produksi dan
penyimpanan, lumpur yang terkontaminasi tinta, sisa proses pencucian, dan pelarut bekas.
Limbah yang menjadi pusat perhatian dalam penelitian ini adalah limbah cair buangan proses pencucian pelat cetak yang ditampung di suatu wadah untuk kemudian dibuang atau disalurkan ke suatu tempat yang berada di sekitar danau kampus IPB Darmaga, Bogor. Walaupun limbah cair tersebut dibuang di suatu tempat penampungan khusus, tidak tertutup kemungkinan limbah cair tersebut ikut bercampur dengan air danau dan mencemari danau. Terlebih lagi, menurut pihak percetakan, selama ini limbah cair percetakan dibuang begitu saja ke tempat penampungan khusus tanpa diolah terlebih dahulu. Oleh karena itu, pengolahan limbah yang baik perlu dilakukan sebelum limbah tersebut dibuang ke lingkungan (danau) agar tercipta kondisi kampus yang bersih dan ramah lingkungan.
Limbah cair pencucian pelat cetak memiliki pH basa, berwarna, dan berbau serta nilai kebutuhan oksigen kimia (chemical
oxygen demand [COD]), kebutuhan oksigen
biokimia (biochemical oxygen demand
[BOD]), padatan tersuspensi total (total
suspended solid [TSS]), dan logam zink (Zn)
yang terkandung di dalamnya masih cukup tinggi dan tidak memenuhi kriteria baku mutu limbah cair yang aman bagi lingkungan (Tim Peneliti Departemen Kimia 2007). Hal ini cukup membuktikan bahwa limbah pencucian pelat cukup berbahaya dan memerlukan pengolahan sebelum dibuang ke lingkungan.
Salah satu cara sederhana pengolahan limbah cair adalah melalui proses pengendapan polutan yang berbahaya. Limbah
cair percetakan tidak mudah diendapkan hanya dengan penambahan asam-basa, sehingga dibutuhkan penambahan bahan kimia berupa koagulan (bahan pengendap) yang dapat membantu proses pengendapan
polutan yang berbahaya terutama
pengendapan polutan sebagai partikel koloid (Teng 2000). Ada beberapa jenis koagulan diantaranya adalah tawas (Al K (SO4)2.
12H2O), FeCl3, dan kapur (Murcott 1999).
Limbah pencucian pelat memiliki pH basa, oleh sebab itu koagulan yang digunakan pada penelitian ini adalah koagulan yang bersifat asam yaitu tawas dan FeCl3. Penambahan
koagulan tawas dan FeCl3 dalam limbah cair
ternyata dapat turut menurunkan kadar COD, BOD, dan TSS yang terkandung dalam limbah cair tersebut (Aminzadeh et al. 2007).
Setiap koagulan memiliki sifat yang berbeda-beda, oleh karena itu kondisi optimum pengendapan dengan koagulan perlu diketahui sehingga dapat pula diketahui jenis koagulan yang efektif dan efisien dengan membandingkan hasil pengendapan dengan koagulan-koagulan tersebut. Aminzadeh et al. (2007) menyatakan bahwa ada dua parameter utama yang mempengaruhi proses koagulasi, yaitu konsentrasi koagulan dan pH koagulasi, oleh karena itu, variasi kedua parameter tersebut dapat dilakukan untuk mencari kondisi optimum pengendapan dengan koagulan.
Pengendapan dengan koagulan tidak cukup untuk menurunkan kadar logam dalam limbah. Hal ini dikarenakan pH optimum pengendapan dengan koagulan berada pada kisaran pH mendekati netral sampai asam (Lugosi & Gajari 2002). Salah satu cara untuk menurunkan kadar logam dalam limbah adalah melalui adsorpsi (jerapan) dengan menggunakan zeolit. Zeolit memiliki luas permukaan besar dan memiliki ruang kosong yang dapat ditempati oleh kation, air, atau molekul lain sehingga dapat dimanfaatkan sebagai penjerap (Ming & Mumpton 1989). Zeolit yang digunakan pada penelitian ini merupakan zeolit alam yang berasal dari Lampung, Sumatera. Di Indonesia, zeolit alam ditemukan melimpah dan tersebar di beberapa daerah di pulau Jawa dan Sumatera.
Penelitian ini bertujuan untuk menentukan dan membandingkan kondisi optimum koagulan tawas dan FeCl3 dalam membantu
pengendapan limbah cair pencucian pelat cetak melalui keragaman konsentrasi koagulan dan pH koagulasi; mengetahui pengaruh penambahan zeolit terhadap filtrat
hasil pengendapan dengan tawas dan FeCl3;
dan menganalisis endapan hasil koagulasi dengan koagulan.
TINJAUAN PUSTAKA
Cetak
Cetak adalah sebuah proses untuk memproduksi tulisan dan gambar dengan tinta di atas kertas menggunakan mesin cetak. Ada beberapa teknik cetak antaranya yaitu
flexography dan lithography (cetak offset). Flexography dapat menghasilkan cetakan
pada plastik, logam, dan karton. Teknik cetak yang digunakan oleh IPB Press adalah cetak
offset dengan media cetak berupa kertas. Citra
(tulisan atau gambar) yang akan dicetak dipindahkan dari pelat cetak ke kain cetak lalu ke media cetak. Teknik ini berdasarkan sifat tolak-menolak antara air dan minyak (tinta). Citra yang akan dicetak mengambil tinta dari penggulung tinta (ink roller) sementara area yang tidak dicetak akan menarik air. Hal ini menyebabkan area yang tidak dicetak bebas dari tinta.
Cetak offset ada dua macam yaitu cetak
offset besar dan offset kecil. Perbedaannya
adalah pada ukuran mesin cetak (mesin cetak
offset besar berukuran lebih besar daripada
mesin cetak offset kecil), ukuran pelat (pelat cetak offset besar dapat memuat delapan halaman kertas folio per pelat, sedangkan pelat offset kecil hanya memuat dua halaman kertas folio per pelat), jenis tinta (tinta cetak
offset dapat berupa tinta hitam dan tinta
warna, sedangkan tinta offset kecil hanya tinta hitam), dan kapasitas produksi (cetak offset besar lebih besar kapasitas produksinya daripada offset kecil) (Pusgrafin 1982). Tahapan proses cetak offset
Gambaran mengenai proses cetak di percetakan IPB dapat dilihat di Lampiran 1. Proses cetak terdiri atas beberapa tahap yaitu
prepress (imaging), press, dan postpress
(finishing), sesuai Gambar 1 (IFC 2007). 1. Prepress (imaging)
Tahap ini merupakan pembuatan image (citra) yang akan dicetak pada pelat cetak. Citra yang akan dicetak, diedit terlebih dahulu melalui komputer lalu dipindahkan langsung ke pelat cetak (Computer to plate [CTP]). Ada pula teknik non-CTP yaitu citra setelah diedit melalui komputer lalu dipindahkan ke film
cetak dan selanjutnya dipindahkan ke pelat cetak.
IPB Press menggunakan teknik non-CTP dengan menggunakan film cetak yang dibuat oleh industri lain. Proses yang terjadi pada pembuatan film cetak yang mengandung partikel perak bromida (AgBr) merupakan reaksi oksidasi-reduksi. Larutan developer (pengembang) hidrokuinon yang digunakan pada pembuatan film cetak akan mereduksi Ag+ yang tereksitasi oleh cahaya menjadi Ag(s) yang akan membentuk bayangan hitam
pada film cetak. Ag+ yang tidak tereduksi akan larut dengan ditambahkannya larutan
fixer berupa sodium tiosulfat (Subiyakto
2008).
Citra film cetak yang telah dibuat, lalu dipindahkan ke pelat cetak yang terbuat dari campuran logam zink (Zn) dengan lapisan atas berwarna hijau. Proses pemindahan citra dari film ke pelat cetak dilakukan menggunakan mesin dengan bantuan vakum dan cahaya lampu. Citra yang telah dipindahkan ke pelat, selanjutnya diberi larutan pengembang:air (1:7) untuk menghilangkan emulsi pada area bukan cetak dan memunculkan citra pada pelat. Pelat selanjutnya dibilas dengan menggunakan air. Limbah hasil proses ini berupa cairan berwarna biru kehijauan, berbau, dan memiliki pH basa (NEWMOA 2006). 2. Press
Tahap ini merupakan tahap pencetakan dengan pemberian tekanan pada mesin cetak. Citra pada pelat cetak dipindahkan ke kain cetak dan selanjutnya ke kertas. Pemberian tinta berlangsung pada tahap ini. Tinta terdiri atas zat warna (pigmen), pengikat (vehicle), pencair (thinner), pengering (drier), dan pengubah (modifier). Pigmen tinta mengandung logam berat diantaranya adalah timbal (Pb), kadmium (Cd), kromium (Cr) dan zink (Zn) yang berfungsi sebagai pemberi warna pada tinta; bahan pengikat dan pencair mempengaruhi pelekatan tinta pada media (kertas); pengering mempengaruhi waktu pengeringan tinta pada media (kertas); dan bahan pengubah mempengaruhi kemampuan tinta terhadap gesekan dan kejelasan tinta pada media (Scheder 1976).
3. Postpress (Finishing)
Tahap ini merupakan tahap akhir proses cetak. Tahap ini meliputi pengaturan halaman dan penjilidan.
Limbah percetakan
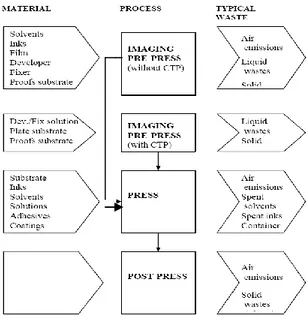
Sebagaimana industri pada umumnya, percetakan menghasilkan limbah pada setiap tahapan proses cetaknya. Gambar 1 menunjukkan skema material (bahan) cetak dan limbah yang dihasilkan pada setiap tahap proses cetak.
Gambar 1 Skema sumber limbah percetakan (Sumber: IFC 2007)
Limbah yang menjadi sampel penelitian ini adalah yang berasal dari tahap prepress yaitu limbah cair proses pencucian pelat.
Pengendapan Polutan dalam Limbah dengan Koagulan
Air limbah percetakan mengandung polutan-polutan yang terdapat sebagai partikel koloid yang tidak bisa dipisahkan hanya dengan penyaringan atau pengendapan biasa. Partikel-partikel koloid tersebut terlalu ringan untuk dapat mengendap dengan pengendapan biasa. Partikel ini bersifat stabil sehingga membutuhkan pengaruh dari luar yaitu dengan penambahan bahan kimia agar partikel menjadi tidak stabil (Teng 2000).
Prinsip pengendapan polutan berupa partikel koloid adalah berdasarkan proses koagulasi dan flokulasi. Koagulasi adalah proses destabilisasi partikel koloid dengan penambahan koagulan yang mempunyai muatan berlawanan dengan muatan partikel koloid. Proses ini biasa disebut juga proses netralisasi partikel koloid yang dibantu dengan pengadukan cepat sehingga
menghasilkan flok (gumpalan). Ada dua jenis koagulan yang dapat membantu proses koagulasi yaitu koagulan yang bersifat asam (tawas (Al K (SO4)2. 12 H2O), FeSO4) dan
koagulan yang bersifat basa (kapur (Ca(OH)2)). Setiap koagulan memiliki kondisi
optimumnya masing-masing dalam
mengendapkan polutan dalam limbah cair. Flokulasi adalah proses penggabungan partikel-partikel yang tidak stabil dengan pengadukan lambat membentuk gumpalan yang lebih besar sehingga dapat lebih cepat dipisahkan (Teng 2000). Pengujian proses koagulasi-flokulasi ini dapat dilakukan dengan menggunakan alat Jar Tests yang kecepatan pengadukan contoh dapat diatur (Hanum 2002).
Mekanisme pengendapan dengan koagulan pada partikel koloid, berkaitan dengan muatan listrik pada partikel koloid tersebut. Umumnya partikel koloid alam bermuatan negatif. Partikel koloid memiliki muatan yang sama satu sama lain. Akibatnya, partikel koloid tolak-menolak satu sama lain sehingga pembentukan partikel yang lebih besar menjadi terhalang. Koagulan yang mengandung muatan yang berlawanan dengan muatan partikel koloid akan menjerap koloid tersebut pada permukaannya dan menurunkan gaya tolak-menolak antar partikel koloid sehingga partikel tidak terhalang lagi untuk membentuk partikel yang lebih besar dan dapat mengendap (Aminzadeh et al. 2007).
Mekanisme pengendapan dengan
penambahan koagulan dapat dijelaskan sebagai berikut: koagulan dalam air akan terurai menjadi M3+ dan mengalami hidrolisis membentuk M(OH)3 (M = Al, Fe). M3+ inilah
yang dapat menyebabkan destabilisasi partikel koloid, mengurangi gaya tolak menolak antar partikel koloid, sehingga partikel koloid dapat bergabung membentuk flok. Hasil hidrolisis koagulan berupa M(OH)3 memiliki kelarutan
yang rendah dan permukaan cukup luas yang dapat menjerap partikel di sekitarnya dan mengendapkannya. Kelarutan M(OH)3 dapat
berubah-ubah bergantung pada pH koagulasi. Kelarutan M(OH)3 dapat meningkat pada pH
asam maupun basa, semakin asam maupun basa maka semakin tinggi kelarutan M(OH)3.
Kemampuan jerapan tersebut dapat menurunkan kadar COD, BOD, TSS, dan logam yang terkandung dalam limbah cair (Patoczka 1998; Aminzadeh et al.2007).
Reaksi penjerapan yang terjadi merupakan reaksi pertukaran ion (Manahan 1994), sebagai contoh:
Untuk senyawa fosfat, terjadi pertukaran antara OH- pada M(OH)3 dengan anion
HPO42- pada senyawa fosfat. Reaksi yang
terjadi adalah sebagai berikut:
M(OH)3 + H2PO4- M(OH)2H2PO4+OH-
Untuk senyawa logam, terjadi pertukaran kation H+ pada M(OH)3 dengan kation
logam. Reaksi yang terjadi adalah sebagai berikut:
M(OH)3 + Zn2+ M(OH)-O-Zn-O + 2H+
Zeolit
Mineral zeolit pertama kali ditemukan pada tahun 1756 oleh Baron Cronsted, seorang ahli mineral berkebangsaan Swedia. Kata zeolit berasal dari kata zein artinya mendidih dan lithos yang berarti batuan. Zeolit didefinisikan sebagai suatu aluminosilikat dengan kerangka struktur berongga yang ditempati oleh molekul-molekul air dan kation yang keduanya dapat bergerak bebas sehingga memungkinkan pertukaran ion tanpa merusak struktur zeolit. Struktur kerangka dasar zeolit dapat dilihat
pada Gambar 2. Dalam proses
pembentukannya, unsur silikon bervalensi empat digantikan oleh unsur aluminium yang bervalensi tiga sehingga terjadi kelebihan muatan negatif. Kelebihan muatan negatif ini dapat dinetralkan oleh adanya kation-kation yang didominasi oleh natrium (Na), Kalium (K), magnesium (Mg), dan Kalsium (Ca) (Ming dan Mumpton 1989). Secara umum rumus kimia untuk zeolit adalah
MxDy[Alx+2ySin-(x+2y)O2n].mH2O, dengan
M : K+, Na+, atau kation monovalen lainnya; D : Mg2+, Ca2+, atau kation bivalen lainnya; x, y : bilangan tertentu;
n : bilangan tertentu; m : jumlah mol air.
Gambar 2 Struktur dasar zeolit (Sumber: Gottardi dan Galli 1985) Zeolit dapat digunakan sebagai bahan penjerap karena zeolit merupakan kristal unik dengan volume kosong berkisar 20–50% dan luas permukaan internalnya mencapai ratusan ribu m2 per kg (Ming & Mumpton 1989). Kristal zeolit mempunyai susunan yang berpori, banyak saluran, dan rongga yang teratur serta saling berhubungan.
Molekul-molekul air dan Molekul-molekul-Molekul-molekul lain yang berukuran lebih kecil dari pori dapat terperangkap dalam kerangka zeolit. Zeolit sebagai bahan penjerap didehidrasi melalui pemanasan untuk menghilangkan molekul air. Ion-ion pada rongga zeolit seperti Na+, Ca2+, K+, Mg2+, dan Sr2+ berguna untuk memelihara kenetralan listrik. Ion-ion tersebut dapat bergerak bebas sehingga memungkinkan terjadinya pertukaran ion. Kemampuan pertukaran ion pada zeolit merupakan salah satu parameter untuk menentukan mutu zeolit. Kapasitas tukar kation (KTK) adalah jumlah miligram ekuivalen (me) ion yang dapat dipertukarkan maksimum oleh 100 gram bahan penukar ion (zeolit) dalam keadaan kesetimbangan. KTK ditentukan oleh derajat substitusi Al3+ atau Fe3+ terhadap Si4+ yang menghasilkan muatan negatif pada kerangka zeolit. Semakin besar derajat substitusi menunjukkan bahwa diperlukan lebih banyak kation alkali atau alkali tanah untuk menetralkan muatan negatif pada kerangka sehingga nilai KTK makin besar (Ming dan Mumpton 1989).
Ada dua metode penjerapan dengan zeolit, yaitu metode tumpak (batch adsorption) dan lapik tetap (fixed bed adsorption). Pada metode tumpak, larutan contoh dicampur dan dikocok bersamaan dengan bahan penjerap sampai tercapai kesetimbangan. Sementara, metode lapik tetap menempatkan penjerap dalam kolom sebagai lapik. Zat yang akan dijerap dan dialirkan ke dalam kolom disebut influen. Larutan yang keluar dari kolom merupakan sisa zat yang tidak terjerap, disebut efluen (Benefield et al. 1990).
Zeolit dapat dibedakan menjadi dua, yaitu zeolit alam dan zeolit sintetik. Zeolit alam terbentuk selama ribuan tahun dalam bentuk sedimen yang terjadi karena pencampuran debu-debu vulkanis dengan air atau larutan basa dari air danau, sedangkan zeolit sintetik adalah zeolit yang dibuat di laboratorium. Zeolit sintetik memiliki kelemahan yaitu komposisinya sangat dipengaruhi oleh reaktan yang digunakan. Zeolit alam yang telah ditambang secara intensif di Indonesia diantaranya terdapat di Lampung, dengan kelimpahan sebesar tiga puluh juta ton (Arryanto et al. 2002).
Derajat Keasaman (pH)
Nilai derajat keasaman (pH) dapat didefinisikan sebagai ukuran dari aktivitas ion hidrogen (H+) yang menunjukkan suasana asam atau basa. Pengukuran pH dapat
digunakan untuk menghitung karbonat, bikarbonat, CO2, dan kesetimbangan
asam-basa dalam air dan air limbah. Lingkungan perairan yang baik mempunyai pH mendekati normal atau basa karena pH tersebut mendorong proses penguraian bahan organik dalam air menjadi mineral-mineral yang dapat digunakan oleh fitoplankton. Penentuan pH harus seketika setelah contoh diambil dan tidak dapat diawetkan karena nilai pH ditentukan oleh interaksi berbagai zat dalam air, termasuk zat-zat yang secara kimia maupun biokimia tidak stabil (Saeni 1989).
Pengaturan pH merupakan hal yang penting dalam proses pengolahan limbah secara kimiawi melalui pengendapan. Hal ini disebabkan karena proses koagulasi-flokulasi terjadi pada pH tertentu tergantung dari bahan koagulan yang digunakan. Pengaturan pH dapat dilakukan dengan penambahan asam atau basa (Teng 2000).
Padatan
Padatan total dalam sampel cairan mengandung padatan terlarut total (total
dissolved solid [TDS]) dan padatan
tersuspensi total (total suspended solid [TSS]). Padatan terlarut total adalah bahan dalam air yang akan melalui saringan dengan diameter pori berukuran 2 µm atau lebih kecil. Material yang ditahan oleh saringan adalah padatan tersuspensi total. Padatan tersuspensi total berupa partikel organik maupun anorganik yang tidak larut dalam air dan mempengaruhi tingkat kekeruhan dan kecerahan air (APHA 2005).
Kebutuhan Oksigen Biokimia Kebutuhan oksigen biokimia (biochemical
oxygen demand [BOD]) adalah jumlah
oksigen yang dibutuhkan oleh
mikroorganisme untuk penghancuran senyawa organik maupun anorganik dalam waktu tertentu (APHA 2005). Oksidasi biokimia ini merupakan proses yang lambat dan membutuhkan waktu agar terjadi reaksi oksidasi yang sempurna. Namun, untuk kepentingan praktis penentuan BOD dilakukan selama lima hari inkubasi dengan tujuan untuk mengurangi pengaruh oksidasi ammonia (nitrifikasi) yang berlangsung pada hari ke-8 hingga hari ke-10. Selama 5 hari inkubasi, diperkirakan kesempurnaan oksidasi mencapai 60-70%. Suhu 20 ˚C merupakan suhu rata-rata daerah perairan iklim sedang, mudah ditiru inkubator, dan suhu optimum pengukuran BOD (Achmad 2004).
Analisis BOD secara titrimetri didahului dengan penentuan oksigen terlarut yang prinsipnya adalah oksigen terlarut akan bereaksi dengan mangan (II) dalam suasana basa menjadi hidroksida mangan dengan valensi yang lebih tinggi (mangan (IV)). Adanya iodida (I-) dalam suasana asam menyebabkan mangan (IV) berubah kembali menjadi mangan (II) dengan menghasilkan iodin (I2) yang setara dengan jumlah oksigen
terlarut (SNI-06-2503-1991).
Kebutuhan Oksigen Kimia Kebutuhan oksigen kimia (chemical
oxygen demand [COD]) adalah jumlah
oksigen yang diperlukan untuk mengoksidasi senyawa organik dan anorganik secara kimia (APHA 2005). Penentuan COD secara titrasi dapat dilakukan dengan menggunakan oksidator kuat (seperti K2Cr2O7) sebagai
titran. Keuntungan uji COD dibandingkan BOD adalah penentuan COD membutuhkan waktu yang lebih singkat yaitu selama 2 jam dibandingkan penentuan BOD selama 5 hari. Nilai COD lebih besar daripada BOD karena jumlah senyawa organik yang dapat teroksidasi secara kimia lebih besar daripada oksidasi secara biokimia, terlebih lagi bila sejumlah senyawa organik yang resisten terhadap oksidasi biokimia (Saeni 1989).
Zink
Zink (Zn) atau seng merupakan jenis logam berat kurang beracun. Logam ini memiliki nomor atom 30, massa atom 65.409 g/mol, massa jenis 7.14 g/cm3, titik didih 1180 K dan titik leleh 692.68 K. Zn dapat mengendap sebagai endapan hidroksida Zn(OH)2 dengan Ksp sebesar 3 x 10-17. Seng
dari segi industri dapat digunakan sebagai material pengisi baterai, pigmen dalam cat dan tinta dan pelapis pelat cetak. Zn dari segi biologis berfungsi sebagai gugus prostetik enzim, katalisator enzim dan hormon, dan sistem kekebalan tubuh.
Walaupun Zn merupakan logam yang cukup esensial bagi tubuh, kelebihan atau akumulasi Zn dalam jangka waktu cukup lama dapat berbahaya, bersifat toksik. Toksisitas Zn diantaranya adalah dapat mengganggu pertumbuhan, sistem pernapasan, dan pencernaan. Selain itu, Zn yang masuk ke dalam tubuh apabila bereaksi dengan asam lambung dapat mengakibatkan iritasi lambung (Slamet 1994).
BAHAN DAN METODE
Bahan dan Alat
Bahan-bahan yang digunakan dalam penelitian ini adalah contoh limbah cair buangan proses pencucian pelat cetak percetakan IPB yang diambil pada tanggal 7 Juli 2008 dan 21 Agustus 2008, koagulan tawas dan FeCl3, larutan K2Cr2O7, larutan
Na-tiosulfat, larutan pengencer BOD, amilum, larutan ferro amonium sulfat (FAS), campuran H2SO4-Ag2SO4, indikator ferroin, kertas
saring Whatman tipe 934AH dengan ukuran pori 0.45 µm, dan air bebas ion.
Alat-alat yang digunakan adalah TOA pH meter HM-20S, alat refluks, botol BOD 250 ml, spektrofotometer serapan atom flame-gas asetilen NovAA 300, dan spektrofotometer inframerah transformasi fourier (Fourier
Transform InfraRed [FTIR]) Bruker.
Metode Penelitian
Penelitian ini dilakukan dalam beberapa tahap, antara lain pengukuran kondisi awal limbah pencucian pelat cetak yang meliputi pengukuran pH awal, COD awal, BOD5 awal,
TSS awal, dan logam Zn dalam limbah, kemudian dilakukan sentrifugasi limbah, dan pencarian kondisi optimum koagulasi melalui keragaman konsentrasi koagulan tawas dan FeCl3 dan keragaman pH. Keragaman
konsentrasi koagulan berkisar pada 20-140 mg/L, sedangkan keragaman pH berkisar pada pH 5-9. Keragaman pH koagulasi dilakukan melalui penambahan H2SO4 1.0 M
(Aminzadeh 2007).
Endapan pada setiap keragaman pH dan konsentrasi koagulan ditimbang bobotnya. Filtrat hasil pengendapan pada kondisi optimum diberi perlakuan dengan dan tanpa penjerapan menggunakan zeolit alam Lampung berukuran 20-40 mesh dengan metode jerapan tumpak. Filtrat hasil jerapan dan tanpa jerapan dengan zeolit diukur kembali kadar BOD5, TSS, dan logam Zn.
Endapan pada kondisi optimum dianalisis dengan menggunakan FTIR (Lampiran 2). Penentuan konsentrasi koagulan dan pH koagulasi optimum
Gelas piala disediakan sebanyak 10 buah dan ke dalam masing-masing gelas piala tersebut ditambahkan 150 mL contoh limbah. Larutan stok koagulan tawas dan FeCl3 dibuat
dengan konsentrasi 10000 mg/L. Selanjutnya ke dalam lima gelas piala pertama
ditambahkan koagulan tawas sehingga konsentrasinya dalam limbah menjadi sebesar 20, 50, 80, 110, dan 140 mg/L. Lima gelas piala berikutnya ditambahkan koagulan FeCl3
sehingga konsentrasinya dalam limbah menjadi sebesar 20, 50, 80, 110, dan 140 mg/L. Banyaknya volume koagulan yang ditambahkan pada setiap keragaman konsentrasi dapat dilihat di Lampiran 3.
Selanjutnya dilakukan pengaturan pH. Mula-mula diukur pH campuran pada sepuluh gelas piala, lalu ditambahkan ke dalam masing-masing gelas piala H2SO4 1 M sampai
didapat pH 5. Contoh diaduk dengan stirer selama 1 menit dengan kecepatan 120 rpm, selanjutnya diaduk kembali dengan kecepatan 40 rpm selama 15 menit dan didiamkan selama 24 jam, kemudian disaring. Filtrat yang diperoleh diukur kembali pHnya dan ditentukan kadar CODnya. Endapan yang terbentuk dikeringkan dalam oven sampai bobot konstan lalu ditimbang. Prosedur diulangi dengan keragaman pH 6, 7, 8, dan 9. Konsentrasi koagulan dan pH koagulasi optimum diperoleh ketika kadar COD terendah atau bobot endapan tertinggi. Diagram keragaman konsentrasi koagulan dan pH koagulasi dapat dilihat di Lampiran 4.
Penyiapan zeolit dan aktivasi zeolit
Zeolit Lampung digerus, lalu diayak sehingga diperoleh zeolit berukuran 20-40 mesh. Selanjutnya zeolit dipanaskan dalam oven pada suhu 200 °C selama 4 jam. Zeolit hasil pemanasan disimpan dalam wadah kedap udara.
Jerapan dengan zeolit
Zeolit Lampung yang telah disiapkan dan diaktivasi, ditimbang sebanyak tiga gram, lalu ditambahkan filtrat hasil pengendapan optimum dan dikocok selama 48 jam dengan kecepatan pengocokan 350 rpm (Kusumawati 2006). Setelah 48 jam, larutan ini disentrifugasi dan filtratnya diukur kadar COD, BOD5, TSS, dan logam Zn.
Penentuan kebutuhan oksigen kimia (SNI 06-6989.15-2004)
Standardisasi larutan ferro amonium sulfat (FAS). Larutan K2Cr2O7 0.025 N
sebanyak 10 mL dipipet, dimasukkan ke dalam Erlenmeyer dan ditambahkan 2 mL H2SO4 pekat dan 3 tetes indikator ferroin.
Kemudian larutan dititrasi dengan larutan FAS 0.1 N dengan perubahan warna dari biru
kehijauan menjadi merah kecoklatan. Volume FAS yang terpakai dicatat.
Uji contoh. Contoh (filtrat hasil penyaringan proses pengendapan limbah) diencerkan 10x, lalu sebanyak 10 mL filtrat hasil pengenceran dimasukkan ke dalam labu didih, ditambahkan 0.2 g HgSO4, 10 mL
K2Cr2O7 0.25 N, dan beberapa batu didih, lalu
dikocok supaya tercampur. Larutan H2SO4
-Ag2SO4 sebanyak 15 mL ditambahkan ke
dalam campuran tersebut dengan hati-hati, dikocok kembali, dan dididihkan (refluks) selama 120 menit, lalu didinginkan. Indikator ferroin sebanyak 2-5 tetes ditambahkan ke dalam larutan contoh, lalu dititrasi dengan larutan FAS yang telah distandardisasi dengan perubahan warna dari biru kehijauan menjadi merah kecoklatan. Volume larutan FAS yang terpakai dicatat. Blanko akuades dibuat dengan perlakuan yang sama seperti sampel. Pembuatan larutan untuk pengukuran COD dapat dilihat di Lampiran 5. Rumus untuk perhitungan COD adalah sebagai berikut:
fp Vcontoh 1000 O BE N x Vtc) -(Vtb COD FAS 2 Keterangan:
Vtb : Volume FAS untuk titrasi blanko Vtc : Volume FAS untuk titrasi contoh fp : faktor pengenceran
Penentuan kebutuhan oksigen biokimia (SNI-06-2503-1991)
Standardisasi natrium tiosulfat. Larutan K2Cr2O7 0.025 N sebanyak 10 mL
dimasukkan ke dalam Erlenmeyer dan ditambahkan 0.5 gram KI dan H2SO4 pekat.
Kemudian larutan dititrasi dengan Na-tiosulfat 0.025 N dengan indikator amilum sampai tidak berwarna. Volume Na-tiosulfat yang terpakai dicatat, lalu konsentrasi Na-tiosulfat ditentukan sebagai Nt
Persiapan contoh. Contoh (filtrat hasil pengendapan pada kondisi optimum) sebanyak 50 mL diencerkan dengan larutan pengencer BOD sampai 1000 mL dan diaerasi selama 15 menit. Setelah itu, contoh dimasukkan ke dalam botol BOD 250 mL (Vb) sampai penuh dan ditutup. Penutupan botol diusahakan tidak ada gelembung udara.
Titrasi contoh. Tutup botol BOD dibuka dan contoh ditambahkan dengan 1 mL larutan MnSO4 dan 1 mL larutan alkali iodida azida
melalui dinding botol. Botol ditutup dengan hati-hati dan dikocok dengan cara membolak-balikkan botol beberapa kali. Campuran
dibiarkan sampai terbentuk endapan. Setelah itu, tutup botol dibuka dan ditambahkan dengan 1 mL larutan H2SO4 pekat melalui
dinding botol, kemudian dinding botol ditutup kembali. Larutan dikocok sampai semua endapan larut. Larutan sebanyak 50 mL (Vc) dimasukkan ke dalam Erlenmeyer dan dititrasi dengan Na-tiosulfat yang telah distandardisasi sampai warna kuning muda. Kemudian larutan ditambahkan 3 tetes amilum dan titrasi dilanjutkan sampai warna biru hilang pertama kali. Volume Na-tiosulfat yang terpakai dicatat sebagai Vt. Blanko larutan pengencer BOD dibuat dengan perlakuan yang sama seperti prosedur contoh. Titrasi contoh dilakukan pula pada hari kelima. Pembuatan larutan untuk pengukuran BOD5 dapat dilihat
di Lampiran 6. Rumus untuk perhitungan BOD adalah sebagai berikut:
Oksigen Terlarut (OT) pada hari ke-t OTt =
2)
-Vb
(
Vc
1000
Vb
O
BE
Nt
Vt
2
BOD = [(OTC0-OTC5)-k(OTB0-OTB5)] x fp
Keterangan:
Nt : Normalitas titran OTC : Oksigen terlarut contoh
OTB : Oksigen terlarut blanko
fp : faktor pengenceran k : (fp-1)/fp
Penentuan kadar padatan tersuspensi total (SNI 06-6989.3-2004)
Penimbangan kertas saring kosong. Kertas saring diletakkan pada alat penyaring dan dibilas tiga kali dengan akuades masing-masing sebanyak 20 mL. Alat pengisap dinyalakan untuk menghisap air yang terdapat pada kertas saring. Kertas saring diambil dan dikeringkan dalam oven dengan suhu 103-105 ˚C selama 1 jam. Kemudian didinginkan dalam desikator selama 10 menit dan ditimbang. Penimbangan dilakukan sampai diperoleh bobot konstan.
Penyaringan contoh. Contoh (filtrat hasil pengendapan optimum) sebanyak 50 mL diaduk sampai homogen dan disaring dengan menggunakan kertas saring yang telah diketahui bobot konstannya pada cawan Goch yang dilengkapi dengan alat pengisap. Kemudian kertas saring dibilas tiga kali dengan akuades masing-masing sebanyak 10 mL. Setelah itu, kertas saring diambil dan dikeringkan dalam oven dengan suhu 103-105 ˚C selama 1 jam. Kertas saring didinginkan dalam desikator selama 10 menit
dan kemudian ditimbang. Penimbangan dilakukan sampai diperoleh bobot konstan. Rumus untuk perhitungan TSS adalah sebagai berikut: TSS = contoh volume saring kertas p ada residu bobot
Pengukuran absorbans dan konsentrasi Zn dalam air limbah
(SNI 06-6989.7-2004)
Contoh diambil sebanyak 25 mL, dikocok sampai homogen, ditambahkan 5 mL larutan HNO3 65%, kemudian dipanaskan sampai
volume tertentu. Selanjutnya, air bebas ion sebanyak 10 mL ditambahkan ke dalam gelas piala tersebut, diaduk, disaring, dan dimasukkan ke dalam labu takar 25 mL. Volume ditepatkan sampai tanda tera dengan air bebas ion. Absorbans dan konsentrasi Zn diukur pada panjang gelombang 213.9 nm dengan AAS.
Analisis FTIR
Endapan yang diperoleh pada konsentrasi koagulan dan pH koagulasi optimum, dikeringkan dalam oven sampai bobot konstan lalu ditimbang. Endapan kering lalu dicampur dengan KBr dan digerus dengan mortar agate, lalu dibuat pelet KBr dengan bantuan vakum. Pelet yang terbentuk dianalisis dengan FTIR.
HASIL DAN PEMBAHASAN
Limbah Pencucian Pelat Cetak Limbah cair pencucian pelat cetak memiliki warna biru kehijauan dan berbau. Data mengenai limbah cair sebelum mendapatkan perlakuan beserta baku mutu air limbah yang aman untuk dibuang ke lingkungan dapat dilihat pada Tabel 1. Tabel 1 Limbah cair pencucian pelat cetak
Parameter Nilai parameter Baku mutu limbah cair sebelum perlakuan [(IFC (2007)] pH 13.31 6-9 COD 7526.4 mg/L 150 mg/L BOD5 417.01 mg/L 30 mg/L TSS 252 mg/L 50 mg/L Tembaga (Cu) 0.125 mg/L 0.5 mg/L Lanjutan Parameter Nilai parameter Baku mutu limbah cair sebelum perlakuan [(IFC (2007)] Seng (Zn) 0.85 mg/L 0.5 mg/L Besi (Fe) 0.625 mg/L 3 mg/L Timbal (Pb) 0.19 mg/L 1 mg/L Kadmium (Cd) 0.01 mg/L 0.1 mg/L Kromium (Cr) 0.155 mg/L 0.5 mg/L Perak (Ag) 0.04 mg/L 0.5 mg/L
Tabel 1 menunjukkan bahwa dari sebelas parameter analisis yang diuji, ada lima parameter yang memiliki nilai yang masih berada di atas baku mutu air limbah yang aman untuk dibuang ke lingkungan menurut IFC 2007. Kelima parameter tersebut adalah pH, COD, BOD5, TSS, dan logam Zn. Hal ini
cukup membuktikan bahwa limbah cair pencucian pelat cetak cukup berbahaya. Dari kelima parameter tersebut, parameter COD yang memiliki nilai yang sangat tinggi dan sangat jauh di atas baku mutu. Oleh karena itu, parameter uji COD inilah yang dijadikan sebagai parameter utama dalam penentuan konsentrasi koagulan dan pH koagulasi
optimum. Nilai COD yang tinggi
menunjukkan bahwa limbah cair pencucian pelat cetak mengandung banyak senyawa organik dan anorganik.
Konsentrasi Koagulan dan pH Koagulasi Optimum
Limbah cair pencucian pelat cetak dapat diendapkan dengan penambahan koagulan tawas dan FeCl3 (Lampiran 7). Limbah ini
disentrifugasi terlebih dahulu sebelum penambahan koagulan untuk memisahkan padatan limbah dari cairannya. Penambahan kedua koagulan ini dapat menurunkan pH limbah walaupun penurunannya tidak terlalu besar (Lampiran 8 dan 9). Setiap koagulan memiliki konsentrasi dan pH koagulasi optimum yang berbeda-beda. Pada penelitian ini, parameter yang digunakan dalam penentuan konsentrasi koagulan dan pH koagulasi optimum adalah COD dan bobot endapan yang terbentuk.
Tawas
Tawas adalah garam aluminium yang dapat membantu proses pengendapan partikel dalam limbah. Gambar 3 menunjukkan
hubungan antara konsentrasi tawas dan nilai COD pada setiap variasi pH koagulasi.
0 500 1000 1500 2000 2500 3000 3500 4000 4500 5000 20 50 80 110 140 Konsentrasi tawas (mg/L) N il a i C O D ( m g /L )
Gambar 3 Hubungan antara konsentrasi tawas (mg/L) dan nilai COD (mg/L), dengan pH 5, pH 6, pH 7
x pH 8, pH 9
Berdasarkan hasil tersebut dapat diketahui bahwa konsentrasi optimum tawas sebesar 110 mg/L. Pada kondisi tersebut COD yang diperoleh minimum yaitu sebesar 768 mg/L. Data lengkap nilai COD pada setiap keragaman konsentrasi tawas dan pH koagulasi dapat dilihat di Lampiran 10.
Oleh karena yang memiliki kemampuan untuk menjerap senyawa organik maupun anorganik dengan penambahan koagulan tawas adalah Al(OH)3, maka tercapainya
kondisi optimum pengendapan dapat dikaitkan dengan jumlah Al(OH)3 yang
terbentuk. Tercapainya kondisi optimum koagulan tawas pada konsentrasi 110 mg/L dapat dijelaskan sebagai berikut: pada konsentrasi di bawah 110 mg/L, Al(OH)3
yang terbentuk belum maksimum, artinya Al(OH)3 masih dapat terbentuk dengan
ditambahkannya kembali konsentrasi tawas sehingga COD masih dapat turun sampai pada konsentrasi 110 mg/L. Pada konsentrasi di atas 110 mg/L, COD kembali naik karena semakin banyak konsentrasi tawas yang dihasilkan maka semakin banyak pula H+ yang dihasilkan dalam reaksi hirolisisnya, dengan kata lain suasana semakin asam. Suasana yang semakin asam dapat kembali melarutkan Al(OH)3 yang telah terbentuk.
Penurunan COD pada kondisi optimum dengan penambahan koagulan tawas cukup besar yaitu sebesar 89.79 % (Lampiran 9). Akan tetapi persen penurunan COD yang cukup besar ini memiliki nilai COD yang masih berada di atas baku mutu COD air limbah menurut IFC (2007) (Tabel 1).
Kondisi optimum pengendapan dengan koagulan tawas tercapai pada pH 8. Hal ini sesuai dengan kisaran pH optimum koagulan tawas yang berkisar antara pH 6 dan 8 (Lugosi & Gajari 2002). Berdasarkan hasil penelitian, urutan pH koagulasi dari mulai COD terendah sampai COD tertinggi adalah pH 8, 7, 6, 5, dan 9. Hal ini berarti koagulasi cenderung berlangsung dengan baik pada pH mendekati netral sampai dengan asam. Hal ini dapat dijelaskan sebagai berikut: pada pH optimum, reaksi tawas dalam air menghasilkan Al(OH)3
yang dapat menjerap partikel di sekitarnya dan memiliki kelarutan yang rendah sehingga dapat mengendap bersama-sama partikel. Pada pH di bawah pH optimum (pH asam), kelarutan Al(OH)3 akan meningkat
membentuk muatan positif [Al(OH)2)]+,
[Al(OH)]2+ dan pada pH di atas pH optimum (pH basa), kelarutan Al(OH)3 akan meningkat
pula membentuk muatan negatif [Al(OH)4]-.
Kelarutan Al(OH)3 yang meningkat
menyebabkan berkurangnya jumlah Al(OH)3
yang menjerap partikel di sekitarnya. Reaksi penjerapan yang terjadi merupakan rekasi pertukaran ion (Manahan 1994).
0.4 0.45 0.5 0.55 0.6 0.65 20 50 80 110 140 Konsentrasi tawas (mg/L) B o b o t e n d a p a n ( g ra m )
Gambar 4 Hubungan antara konsentrasi tawas (mg/L) dan bobot endapan (gram), dengan pH 5, pH 6, pH 7
x pH 8, pH 9
Gambar 4 menunjukkan hubungan antara konsentrasi tawas dan bobot endapan yang terbentuk pada setiap variasi pH koagulasi. Hasil tersebut juga menunjukkan bahwa konsentrasi optimum tawas sebesar 110 mg/L dan pH koagulasi optimum pada pH 8 dengan bobot endapan terbesar sebesar 0.6209 g. Data lengkap bobot endapan pada setiap variasi konsentrasi tawas dan pH koagulasi dapat dilihat di Lampiran 11. Data bobot endapan ternyata berbanding terbalik dengan data COD, artinya semakin rendah nilai COD, maka semakin banyak endapan yang
optimum
terbentuk. Hal ini berarti endapan yang terbentuk mengandung senyawa organik maupun anorganik, sehingga kandungan senyawa organik dan anorganik dalam filtrat menurun.
FeCl3
FeCl3 merupakan garam besi yang dapat
membantu proses pengendapan partikel dalam limbah. Gambar 5 menunjukkan hubungan konsentrasi FeCl3 dan nilai COD pada setiap
variasi pH koagulasi. 0 500 1000 1500 2000 2500 3000 3500 4000 4500 20 50 80 110 140 Konsentrasi FeCl3 (mg/L) N il a i C O D ( m g /L )
Gambar 5 Hubungan antara konsentrasi FeCl3
(mg/L) dan nilai COD (mg/L), dengan pH 5, pH 6, pH 7
x pH 8, pH 9
Berdasarkan hasil tersebut dapat diketahui bahwa konsentrasi optimum FeCl3 sebesar 80
mg/L. Pada kondisi tersebut COD yang diperoleh minimum yaitu sebesar 520.80 mg/L. Data lengkap nilai COD pada setiap variasi konsentrasi FeCl3 dan pH koagulasi
dapat dilihat di Lampiran 12.
Konsentrasi optimum FeCl3 lebih kecil
daripada konsentrasi optimum tawas. Hal ini dikarenakan luas permukaan Fe(OH)3 lebih
besar daripada luas permukaan Al(OH)3. Luas
permukaan Fe(OH)3 sebesar 200-400 m2/g
sedangkan luas permukaan Al(OH)3 sebesar
160-230 m2/g (Mahvi et al. 2005). Semakin luas permukaan hidroksida logam koagulan, maka semakin besar kemampuannya dalam menjerap partikel yang ada di sekelilingnya, sehingga semakin kecil konsentrasi optimum koagulan tersebut. Persen penurunan COD dengan koagulan FeCl3 pada kondisi optimum
cukup besar yaitu sebesar 93.91% (Lampiran 12), akan tetapi walaupun persen penurunan COD cukup besar, nilai COD yang masih berada di atas baku mutu COD air limbah menurut IFC (2007) (Tabel 1).
Berdasarkan hal tersebut, maka dapat disimpulkan bahwa koagulan FeCl3 lebih baik
dan efisien daripada koagulan tawas karena
untuk memperoleh COD minimum,
konsentrasi FeCl3 yang dibutuhkan lebih kecil
daripada tawas (konsentrasi optimum FeCl3
sebesar 80 mg/L sedangkan konsentrasi optimum tawas sebesar 110 mg/L) dan persen penurunan COD yang dihasilkan oleh FeCl3
pada kondisi optimum lebih besar daripada tawas (persen penurunan COD oleh FeCl3
sebesar 93.91% sedangkan oleh tawas sebesar 89.79%).
Koagulasi optimum oleh FeCl3 dicapai
pada pH 6. Hal ini sesuai dengan kisaran pH optimum koagulan FeCl3 yang berkisar antara
pH 4 dan 7 (Lugosi & Gajari 2002). Urutan pH koagulasi dari COD terendah sampai COD tertinggi adalah pH 6, 5, 7, 8, dan 9. Hal ini berarti koagulasi cenderung berlangsung dengan baik pada pH mendekati netral sampai asam. Sama seperti tawas, hal ini dapat dijelaskan sebagai berikut: pada pH optimum, reaksi FeCl3 dalam air menghasilkan Fe(OH)3
yang dapat menjerap partikel di sekitarnya dan memiliki kelarutan yang rendah sehingga dapat mengendap bersama-sama partikel. Pada pH di bawah pH optimum (pH asam), kelarutan Fe(OH)3 akan meningkat
membentuk muatan positif [Fe(OH)2)]+,
[Fe(OH)]2+ dan pada pH di atas pH optimum (pH basa), kelarutan Fe(OH)3 akan meningkat
pula membentuk muatan negatif [Fe(OH)4]-.
Kelarutan Fe(OH)3 yang meningkat
menyebabkan berkurangnya jumlah Fe(OH)3 yang menjerap partikel di sekitarnya. Reaksi penjerapan yang terjadi merupakan rekasi
pertukaran ion (Manahan 1994).
0.5 0.55 0.6 0.65 0.7 0.75 20 50 80 110 140 Konsentrasi FeCl3 (mg/L) B o b o t e n d a p a n ( g ra m )
Gambar 6 Hubungan antara konsentrasi FeCl3
(mg/L) dan bobot endapan (gram), dengan pH 5, pH 6, pH 7
x pH 8, pH 9
Optimum
Hubungan antara konsentrasi FeCl3 dan
bobot endapan yang terbentuk pada setiap variasi pH koagulasi juga menunjukkan bahwa konsentrasi optimum FeCl3 yang
diperoleh sebesar 80 mg/L dengan pH koagulasi optimum pada pH 6 (Gambar 6). Data lengkap bobot endapan pada setiap variasi konsentrasi FeCl3 dan pH koagulasi
dapat dilihat pada Lampiran 13. Sama seperti tawas, hubungan antara nilai COD dan bobot endapan yang terbentuk setelah penambahan FeCl3 adalah berbanding terbalik, artinya
semakin rendah nilai COD, maka semakin banyak endapan yang terbentuk.
Aktivasi Zeolit
Zeolit yang digunakan adalah zeolit Lampung. Zeolit Lampung termasuk jenis klinoptilolit yang berwarna putih dan keras. Zeolit Lampung termasuk zeolit alam dengan kadar Si sedang dan nisbah Si/Al sebesar 5.24. Daya pertukaran ion dari zeolit maksimum bila perbandingan Si/Al mendekati 1. Nilai KTK zeolit Lampung sebesar 89.62 me/100 g dengan luas permukaan spesifik sebesar 37.7768 m2/g (Aningrum 2006). Ukuran zeolit yang digunakan sebesar 20-40 mesh karena kapasitas jerapannya cukup besar. Dan metode jerapan tumpak dipilih karena kapasitas jerapan metode tumpak lebih besar daripada kapasitas jerapan metode lapik tetap (Kusumawati 2006).
Aktivasi zeolit dengan pemanasan bertujuan untuk mengeluarkan air yang terdapat dalam rongga zeolit. Apabila molekul air yang terdapat dalam rongga zeolit telah dikeluarkan, maka molekul-molekul yang memiliki jari-jari lebih kecil dari rongga zeolit dapat masuk ke dalam rongga zeolit (Sastiono 1993).
Jerapan Zeolit
Limbah cair pencucian pelat cetak memiliki kandungan logam Zn yang masih berada di atas baku mutu logam Zn dalam air limbah menurut IFC (2007) (Tabel 1). Untuk mengurangi atau mengendapkan logam Zn diperlukan suasana basa yaitu pada pH 9-10 (Armenante 1999). Oleh karena pH optimum koagulan tawas dan FeCl3 berada pada yang
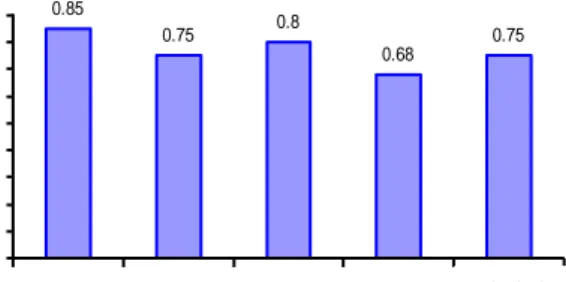
suasana kurang basa, maka diperlukan usaha pengolahan limbah kembali untuk mengurangi kandungan logam Zn dalam limbah. Salah satu cara untuk mengurangi kandungan logam Zn dalam limbah adalah dengan jerapan menggunakan zeolit. 0.85 0.75 0.8 0.68 0.75 0 0.1 0.2 0.3 0.4 0.5 0.6 0.7 0.8 0.9 Limbah tanpa perlakuan Limbah + tawas Limbah + FeCl3 Limbah + tawas + zeolit Limbah + FeCl3 + zeolit K on se nt ra si Z n (m g/ L )
Gambar 7 Konsentrasi Zn dalam limbah tanpa perlakuan dan dengan perlakuan penambahan koagulan dan zeolit Gambar 7 menunjukkan penambahan koagulan dapat menurunkan kadar logam Zn dalam limbah, walaupun penurunannya tidak terlalu besar. Persen penurunan kadar Zn dalam limbah cair dengan penambahan koagulan tawas lebih besar daripada dengan penambahan koagulan FeCl3. Persen
penurunan kadar Zn dengan penambahan koagulan tawas dan FeCl3 berturut-turut
sebesar 11.76% dan 5.88%. Hal ini dapat disebabkan oleh faktor pH. Filtrat hasil pengendapan optimum dengan tawas memiliki pH yang lebih basa daripada filtrat hasil pengendapan optimum dengan FeCl3.
Semakin basa pH filtrat maka semakin besar pula kemungkinan Zn2+ yang akan terendapkan (Armenante 1999). Mekanisme jerapan yang terjadi merupakan pembentukan kompleks antara permukaan Al(OH)3 dan
Fe(OH)3 dengan ion logam (Manahan 1994).
Gambar 7 juga menunjukkan bahwa konsentrasi Zn dapat diturunkan dengan penambahan zeolit. Akan tetapi penurunannya masih berada di atas baku mutu logam Zn dalam air limbah yang aman menurut IFC (2007) (Tabel 1).
Salah satu mekanisme jerapan dengan zeolit adalah melalui pertukaran kation. Hal ini dapat dijelaskan sebagai berikut: kation dari larutan, dalam hal ini Zn2+ yang memiliki jari-jari ion berukuran 1.38 Å, masuk ke dalam rongga atau pori zeolit yang berdiameter 2.9-7 Å, kemudian terjadi pertukaran antara kation zeolit dengan kation Zn2+ dari larutan, sehingga kandungan Zn2+ dalam limbah berkurang. Proses pertukaran akan berakhir saat mencapai kesetimbangan yaitu keadaan dengan perbandingan konsentrasi kation yang terjerap pada zeolit terhadap kation dalam larutan mencapai maksimum. Keadaan setimbang memiliki laju
Limbah + FeCl3 Limbah tanpa perlakuan Limbah + tawas Limbah + tawas + zeolit Limbah + FeCl3 + zeolit
penjerapan adsorbat oleh adsorben sama dengan laju desorpsi (pelepasan adsorbat yang telah terikat kembali ke dalam larutan) (Ming dan Mumpton 1989).
Penurunan logam Zn oleh zeolit pada filtrat hasil pengendapan dengan FeCl3 lebih
kecil daripada filtrat hasil pengendapan dengan tawas. Persen penurunan kadar Zn oleh zeolit pada filtrat hasil pengendapan dengan FeCl3 dan tawas berturut-turut sebesar
11.76% dan 20%. Hal ini dikarenakan filtrat hasil pengendapan dengan FeCl3 memiliki pH
yang lebih asam daripada filtrat hasil pengendapan dengan tawas. Semakin asam pH maka semakin besar kemungkinan masih terdapatnya logam-logam terlarut lainnya selain Zn2+ yang dapat menjadi pengganggu proses masuknya Zn2+ ke dalam rongga zeolit mupun proses pertukaran antara kation zeolit dengan Zn2+. Kation logam-logam terlarut tersebut dapat berkompetisi dengan Zn2+ sehingga menyebabkan Zn2+ yang terjerap pada zeolit menjadi lebih sedikit.
Nilai kapasitas jerapan zeolit terhadap Zn2+ yang terdapat pada filtrat hasil pengendapan dengan tawas dan FeCl3
berturut-turut sebesar 0.0036 me/100 g dan 0.0025 me/100 g (Lampiran 14). Nilai kapasitas jerapan zeolit terhadap Zn2+ ini sangat kecil jika dibandingkan dengan nilai KTK zeolit Lampung sebesar 89.62 me/100 g (Aningrum 2006), dengan kata lain Zn2+ pada filtrat hasil pengendapan dengan tawas dan FeCl3 yang terjerap oleh zeolit berturut-turut
sebesar 0.004% dan 0.003% dari total kation dapat tukar. 378.4 550.4 447.2 756.8 7430.4 0 1000 2000 3000 4000 5000 6000 7000 8000 Limbah tanpa perlakuan Limbah + tawas Limbah + FeCl3 Limbah + tawas + zeolit Limbah + FeCl3 + zeolit N il a i C O D ( m g/ L )
Gambar 8 Nilai COD tanpa perlakuan dan dengan perlakuan penambahan koagulan dan zeolit
Penambahan zeolit pada filtrat hasil pengendapan dengan koagulan ternyata masih dapat menurunkan nilai COD filtrat tersebut, hanya saja persen penurunannya tidak terlalu besar (penurunan dibandingkan terhadap COD filtrat hasil pengendapan dengan koagulan)
(Gambar 8) dan masih berada di atas baku mutu COD air limbah yang aman. Persen penurunan COD oleh zeolit pada filtrat hasil pengendapan dengan tawas dan FeCl3
berturut-turut sebesar 27.27% dan 15.38% (Lampiran 15).
Kebutuhan Oksigen Biokimia
41.9 59.48 48.24 76.17 417.01 0 50 100 150 200 250 300 350 400 450 Limbah tanpa perlakuan Limbah + tawas Limbah + FeCl3 Limbah + tawas + zeolit Limbah + FeCl3 + zeolit N il ai B O D 5 (m g/ L )
Gambar 9 Nilai BOD5 tanpa perlakuan dan
dengan perlakuan penambahan koagulan dan zeolit
Gambar 9 menunjukkan nilai BOD5
menurun dengan adanya penambahan koagulan maupun zeolit. Penurunan BOD5
dengan penambahan FeCl3 lebih besar
daripada dengan penambahan tawas dan penurunannya lebih besar lagi dengan penambahan zeolit. BOD5 minimum sebesar
41.9 mg/L diperoleh pada perlakuan penambahan koagulan FeCl3 dan zeolit.
Walaupun pada BOD5 minimum sebesar 41.9
mg/L memiliki persen penurunan BOD5 yang
sudah cukup besar yaitu sebesar 89.95% (Lampiran 16), akan tetapi nilai ini masih berada di atas baku mutu BOD5 air limbah
yang aman untuk dibuang ke lingkungan (Tabel 1).
Padatan Tersuspensi Total
122 132 128 138 252 0 50 100 150 200 250 300 Limbah tanpa perlakuan Limbah + tawas Limbah + FeCl3 Limbah + tawas + zeolit Limbah + FeCl3 + zeolit N il ai T S S ( m g/ L )
Gambar 10 Nilai TSS tanpa perlakuan dan dengan perlakuan penambahan koagulan dan zeolit
Limbah tanpa perlakuan Limbah tanpa perlakuan Limbah + tawas Limbah + FeCl3 Limbah + FeCl3 Limbah + tawas Limbah + tawas + zeolit Limbah + tawas + zeolit Limbah + FeCl3 + zeolit Limbah + FeCl3 + zeolit Limbah tanpa perlakuan Limbah + tawas Limbah + FeCl3 Limbah + tawas + zeolit Limbah + FeCl3 + zeolit
Gambar 10 menunjukkan nilai TSS menurun dengan adanya penambahan koagulan maupun zeolit. Contoh perhitungan nilai TSS dapat dilihat di Lampiran 17. Penurunan TSS dengan penambahan koagulan FeCl3 lebih besar daripada penambahan tawas
dan penurunan kembali terjadi lagi dengan penambahan zeolit walaupun penurunannya tidak besar. Persen penurunan TSS pada nilai minimum 122 mg/L sebesar 51.59% (Lampiran 17) dan nilai ini masih berada di atas baku mutu TSS air limbah yang aman (Tabel 1).
Analisis FTIR
Spektrum inframerah endapan hasil pengendapan koagulan tawas dan FeCl3
hampir sama (Lampiran 18), karena pada dasarnya endapan yang dianalisis berasal dari limbah yang sama, hanya berbeda jenis koagulan yang ditambahkannya. Kedua hasil spektrum IR tersebut memiliki uluran OH pada kisaran bilangan gelombang 3427.43-3369.72 cm-1, Si-OH pada kisaran bilangan gelombang 2800-2900 cm-1, ulur Si-O pada kisaran bilangan gelombang 1620-1645 cm-1, tekuk Si-O pada kisaran bilangan gelombang 450-1000 cm-1. Selain itu, serapan Al-O dengan kisaran bilangan gelombang 1000-1110 cm-1 muncul pada spektrum IR endapan hasil pengendapan dengan tawas dan serapan Fe-O dengan kisaran bilangan gelombang 1039.6- 1120 cm-1 muncul pada spektrum IR hasil pengendapan dengan FeCl3 (Nakamoto
1997) (Tabel 2).
Tabel 2 Bilangan gelombang inframerah dan dugaan gugus fungsi
Endapan Puncak Dugaan serapan (cm-1) gugus fungsi Pengendapan 3435.05 OH dengan 2860.6 Si-OH
tawas 1622.15 Ulur Si-O
1107.09 Ulur Al-O 810.27 Ulur Si-O 619.9 Tekuk Si-O 465.18 Tekuk Si-O Pengendapan 3437.68 OH dengan 2858.69 Si-OH
FeCl3 1622.79 Ulur Si-O
1108.34 Ulur Fe-O 809.91 Ulur Si-O 620.17 Tekuk Si-O
467.36 Tekuk Si-O
Pelat cetak dicuci dengan larutan pengembang:air (1:7), sehingga senyawa yang terkandung dalam limbah pencucian pelat cetak merupakan senyawa yang terkandung dalam larutan pengembang dan air. Hasil identifikasi menunjukkan bahwa endapan hasil koagulasi mengandung senyawa silikat, terlihat dari munculnya serapan Si-O pada spektrum inframerah (Lampiran 18). Hal ini sesuai dengan senyawa yang terkandung dalam larutan pengembang. Larutan pengembang yang digunakan di percetakan IPB merupakan larutan pengembang jenis Superdot Posidev 90. Senyawa dalam larutan pengembang ini sebagian besar air dan natrium silikat. Penjelasan tentang larutan pengembang ini dapat dilihat di Lampiran 19. Serapan Al-O dan Fe-O juga muncul pada spektrum inframerah. Kedua serapan tersebut berasal dari Al(OH)3 dan Fe(OH)3 yang
memiliki kelarutan yang rendah. Serapan OH pun muncul pada spektrum inframerah. Serapan OH ini dapat berasal dari hidroksida hasil hidrolisis koagulan dan silanol.
SIMPULAN DAN SARAN
Simpulan
Limbah cair pencucian pelat cetak dapat diendapkan dengan penambahan koagulan. Konsentrasi optimum koagulan tawas dalam mengendapkan limbah cair adalah sebesar 110 mg/L dengan pH koagulasi optimum pada pH 8, sedangkan kosentrasi optimum koagulan FeCl3 dalam mengendapkan limbah cair
adalah sebesar 80 mg/L dengan pH koagulasi optimum pada pH 6. Koagulan FeCl3
menghasilkan persen penurunan COD, BOD5
dan TSS limbah yang lebih besar daripada koagulan tawas. Akan tetapi persen penurunan kadar Zn dalam limbah lebih besar dengan penambahan koagulan tawas daripada koagulan FeCl3. Endapan hasil koagulasi
mengandung senyawa silikat.
Zeolit dapat membantu mengurangi nilai COD, BOD5, TSS, dan logam Zn dalam
limbah. Perlakuan FeCl3-zeolit menghasilkan
persen penurunan COD, BOD5, TSS yang
lebih besar daripada perlakuan tawas-zeolit. Akan tetapi persen penurunan kadar Zn dalam limbah lebih besar dengan perlakuan tawas-zeolit daripada FeCl3-zeolit. Nilai COD,
BOD5, TSS, dan logam Zn yang diperoleh
pada setiap perlakuan masih berada di atas baku mutu air limbah yang aman untuk dibuang ke lingkungan.
Saran
Penelitian lebih lanjut perlu dilakukan untuk mengetahui jenis koagulan lain atau cara lain pengolahan limbah cair pencucian pelat cetak agar COD, BOD5, TSS, dan logam
Zn dalam limbah dapat turun nilainya sampai di bawah baku mutu air limbah yang aman untuk dibuang ke lingkungan.
DAFTAR PUSTAKA
Achmad R. 2004. Kimia Lingkungan. Ed ke-1. Yogyakarta: ANDI.
Aminzadeh B, Sarparastzadeh H, Saeedi M, Naeimpoor F. 2007. Pretreatment of municipal wastewater by enhanched chemical coagulation. International Journal of Enviromental Research.
1:104-113.
Aningrum S. 2006. Optimalisasi jerapan kromium trivalent oleh zeolit Lampung dengan metode lapik tetap dan perlakuan kromium limbah penyamakan kulit [skripsi]. Bogor: Fakultas Matematika dan Ilmu Pengetahuan Alam, Institut Pertanian Bogor.
[APHA] American Public Health Association. 2005. Standard Methods for the Examination of Water and Wastewater. Ed
ke-21. Washington: APHA.
Armenante PM. 1999. Precipitation of heavy metal from wastewaters. [terhubung berkala]. http://www.cls06-2.pdf [14 April 2008].
Arryanto et al. 2002. Prospects of natural zeolites in Indonesia for industrial
separation and environmental
management. J Zeolit Indones. 1:1-14. Benefield LD, Joseph FJ, Borro LW. 1990.
Process Chemistry For Water and
Wastewater Treatment. New Jersey:
Prentice-Hall.
[BSN] Badan Standardisasi Nasional. 1991. SNI SNI-06-2503-1991. Air dan Air
Limbah-Cara Uji Kebutuhan Oksigen Biokimia (BOD). Serpong: BSN.
[BSN] Badan Standardisasi Nasional. 2004a. SNI 06-6989.15-2004. Air dan Air
Limbah-Cara Uji Kebutuhan Oksigen Kimia (COD) dengan Refluks Terbuka.
Serpong: BSN.
[BSN] Badan Standardisasi Nasional. 2004b. SNI 06-6989.3-2004 Air dan Air
Limbah-Cara Uji Kadar Padatan Tersuspensi Total (TSS) secara Gravimetri. Serpong:
BSN.
[BSN] Badan Standardisasi Nasional. 2004c. SNI 06-6989.7-2004 Air dan Air
Limbah-Cara Uji Seng (Zn) dengan Metode Spektrofotometri Serapan Atom (SSA)-Nyala. Serpong: BSN.
[Pusgrafin] Pusat Grafika Indonesia, Peningkatan Sarana dan Jasa Grafika. 1982. Melayani Mesin Cetak-Offset. Ed ke-2. Jakarta: Pusat Grafika Indonesia. [IFC] International Finance Corporation.
2007. Enviromental, Health, and Safety
Guidelines for Printing. London: IFC.
Febrianti R. 2008. Pengaruh ion Na+, K+, Mg2+, dan Ca2+ pada penjerapan kromium trivalent oleh zeolit Lampung [skripsi]. Bogor: Fakultas Matematika dan Ilmu Pengetahuan Alam, Institut Pertanian Bogor.
Gottardi G, Galli E. 1985. Natural Zeolites. Berlin: Springer Verlag.
Hanum F. 2002. Proses pengolahan air sungai untuk keperluan air minum. [terhubung berkala]. http://www.USU digital library [14 April 2008].
Khopkar SM. 2007. Konsep Dasar Kimia
Analitik. A Saptorahardjo, penerjemah.
Jakarta: UI Press. Terjemahan dari: Basic
Concepts of Analitycal Chemistry.
Kusumawati T. 2006. Jerapan kromium limbah penyamakan kulit oleh zeolit Cikembar dengan metode lapik tetap [skripsi]. Bogor: Fakultas Matematika dan Ilmu Pengetahuan Alam, Institut Pertanian Bogor.
Lugosi R, Gajari J. 2002. Influence of Natural
Organic Matter on Coagulation
Efficiency. Hungary: University of