PENGARUH EKSTRAK DAUN KELOR (Moringa oleifera)
TERHADAP KECEPATAN ANGIOGENESIS PASKA
EKSTRAKSI GIGI TIKUS WISTAR
(Penelitian Eksperimental Laboratoris)
SKRIPSI
Oleh :
ELOK AMANDA KHARISMA PUTRI
NIM : 021311133079
FAKULTAS KEDOKTERAN GIGI
UNIVERSITAS AIRLANGGA
PENGARUH EKSTRAK DAUN KELOR (Moringa oleifera)
TERHADAP KECEPATAN ANGIOGENESIS PASKA
EKSTRAKSI GIGI TIKUS WISTAR
(Penelitian Eksperimental Laboratoris)
SKRIPSI
Oleh :
ELOK AMANDA KHARISMA PUTRI
NIM : 021311133079
FAKULTAS KEDOKTERAN GIGI
UNIVERSITAS AIRLANGGA
PENETAPAN PANITIA PENGUJI SKRIPSI
Skripsi ini telah diuji tanggal 29 November 2016PANITIA PENGUJI SKRIPSI:
1. Roberto Manahan Y. S., drg., MS., Sp.BMM(K) (Ketua penguji)
2. Dr. David B. Kamadjaja, drg.,MDS.,Sp.BMM(K) (Sekretaris penguji)
3. Prof. Dr. Peter Agus, drg., Sp.BMM(K) (Pembimbing utama)
UCAPAN TERIMAKASIH
Segala puji bagi Allah Subhanahu Wa Ta’aala, atas kehendak, rahmat dan
karunia-Nya sehingga dapat menyelesaikan karya tulis yang berjudul “Pengaruh Ekstrak Daun Kelor (Moringa Oleifera) terhadap Kecepatan Angiogenesis Paska Ekstraksi Gigi Tikus Wistar.” Tulisan ini disusun sebagai prasyarat untuk menyelesaikan Program Pendidikan Dokter Gigi Strata 1 Fakultas Kedokteran Gigi Universitas Airlangga Surabaya.
Dalam penyusunan karya tulis ini, penulis mendapat banyak masukan dan arahan yang berharga dari berbagai pihak. Sepatutnya, penulis mengucapkan terima kasih kepada:
1. Dr. R. Darmawan Setijanto, drg. M.Kes selaku Dekan Fakultas Kedokteran Gigi Universitas Airlangga yang telah memberi kesempatan untuk menempuh pendidikan dokter gigi di Fakultas Kedokteran Gigi Universitas Airlangga.
2. Roberto Manahan Y. S.., drg., MS., Sp.BMM(K) selaku Ketua Departemen Bedah Mulut dan Maksilofasial yang telah memberikan ijin dalam pembuatan skripsi di Departemen Bedah Mulut.
3. Prof. Dr. Peter Agus, drg., Sp.BMM (K) selaku Dosen Pembimbing Utama yang telah memberikan arahan, masukan, evaluasi serta koreksi selama penyusunan skripsi.
5. Roberto Manahan Y. S, drg., MS., Sp.BMM(K), Dr. David Buntoro Kamadjaja drg., MDS., Sp.BMM(K) selaku Dosen penguji yang telah memberi saran, pengetahuan baru dan membantu menyelesaikan skripsi. 6. Dr. Retno Pudji Rahayu drg., M. Kes selaku Dosen Patologi Mulut yang
telah membimbing dan memberikan pengetahuan dalam tahap penghitungan pembuluh darah di Departemen Patologi Anatomi Fakultas Kedokteran Gigi Universitas Airlangga
7. Adi Hapsoro, drg., MS selaku Dosen Ilmu Kesehatan Gigi Masyarakat yang telah membimbing dan memberi arahan dalam tahap pengolahan data di Departemen Ilmu Kesehatan Gigi Masyarakat Fakultas Kedokteran Gigi Universitas Airlangga.
8. Pak Heri yang telah membantu dalam pemeliharaan dan pencabutan gigi tikus wistar di Laboratorium Biokimia Fakultas Kedokteran Universitas Airlangga.
9. Kedua orangtuaku, Ayahanda Muftalichan dan Ibunda Tutik Amiati serta kakakku Nizar Syauchi yang telah memberikan semangat, masukan, dorongan moral dan spiritual dan perhatian yang selalu tercurah.
ABSTRACT
The Role of Drumstick Leaves (Moringa oleifera) Extract in Increasing Angiogenesis Post Tooth Extraction of Wistar Rats
Background: Tooth extraction always cause tissue damage and wound. The process of wound healing after tooth extraction becomes a major concern because of many complications and makes the patient feel discomfort and pain suffered. Angiogenesis is one of the indications of wound healing. The composition of the drumstick leaves such as saponin and flavonoid will increasing angiogenesis process. Objective: To prove the effect of 15% drumstick leaves extract in increasing angiogensis post tooth extraction of wistar rats. Method: Wistar rats divided into 2 control groups and 2 treatment groups. CMC-Na was applied on control groups and 15% drumstick leaves extract gel applied on treatment groups. The observations were made on the third and fifth day after tooth extraction by counting the blood vessel lumen using histopathological samplings. Data were analyzed using Independent T-test. Result: drumstick leaves extract gel topically applied in wistar rats socket after tooth extraction, can increase blood vessel lumen. In statictical test (p<0.05), the significant difference between control groups and treatment groups can be obtained. Conclusion: the effect of drumstick leaves gel increase angiogenesis process in wound healing on the third day compared to the control groups.
DAFTAR ISI
HALAMAN JUDUL
Lembar Pengesahan ... ii
Penetapan Panitia Penguji ... iii
Ucapan Terima Kasih ... iv
2.3 Faktor yang Mempengaruhi Penyembuhan Luka ... 10
2.4 Penyembuhan Luka paska Ekstraksi Gigi ... 11
BAB 3 KERANGKA KONSEPTUAL DAN HIPOTESIS ... 18
4.5 Definisi Operasional... 23
4.6 Waktu dan Tempat Penelitian ... 25
4.7 Instrumen Penelitian... 25
4.8 Alat dan Bahan ... 25
4.8.1 Alat ... 25
4.8.2 Bahan ... 26
4.9 Cara Kerja ... 27
4.9.1 Persiapan Hewan Coba ... 27
4.9.2 Pembuatan Gel Ekstrak Daun Kelor ... 27
4.9.3 Proses Pencabutan Gigi Tikus Wistar ... 28
4.9.4 Pembuatan Sediaan Histologis ... 28
4.10 Prosedur Pengambilan Data ... 32
4.11 Pengolahan dan Analisis Data ... 32
DAFTAR GAMBAR
DAFTAR TABEL
DAFTAR LAMPIRAN
Lampiran 1. Keterangan Laik Etik ... 45
Lampiran 2. Tabel Hasil Penelitian ... 46
Lampiran 3. Kandungan Ekstrak Daun Kelor ... 47
Lampiran 4. Proses Penelitian ... 48
Lampiran 5. Hasil Uji Statistik ... 49
BAB 1
PENDAHULUAN
1.1 Latar belakang
Pencabutan gigi termasuk tindakan bedah yang melibatkan jaringan keras dan jaringan lunak yang ada di rongga mulut. Umumnya luka setelah pencabutan gigi dapat sembuh dengan alami sebagai bentuk respon tubuh terhadap jaringan yang rusak, namun tidak jarang pula mengalami hambatan yang akan memperlambat proses penyembuhan misalnya infeksi, perdarahan dan dry socket (Balaji, 2007). Untuk mendapatkan integritas secara anatomis dari bagian yang terluka serta mendapatkan kembali fungsi normal terjadilah proses penyembuhan pada luka (Miloro, 2004).
2003). Pengelolaan luka yang baik akan menentukan hasil akhir dari proses penyembuhan luka.
Dalam beberapa tahun terakhir, banyak penelitian yang memanfaatkan bahan alam sebagai salah satu bahan yang berpotensi mempercepat penyembuhan luka (Pramono, 2002). Hal ini dipengaruhi oleh kecenderungan masyarakat mencari alternatif bahan herbal karena mahalnya harga obat modern yang ada di pasaran saat ini. Salah satu tanaman herbal yang dikembangkan adalah tanaman kelor atau yang sering disebut “miracle tree” karena semua bagian tumbuhan kelor sangat bermanfaat bagi kehidupan baik daun, kulit batang, biji dan akarnya (Johni dkk, 2008). Di Indonesia pohon kelor banyak ditanam sebagai pagar hidup, ditanam di sepanjang ladang atau tepi sawah, berfungsi sebagai tanaman penghijau, selain itu tanaman kelor juga dikenal sebagai tanaman obat berkhasiat dengan memanfaatkan seluruh bagian dari tanaman kelor mulai dari daun, kulit batang, biji, hingga akarnya (Katharina, dkk, 2007). Penelitian terdahulu menunjukkan kandungan daun kelor berpengaruh terhadap waktu lamanya perdarahan (Unuigbe, 2014). Senyawa aktif yang dimiliki daun kelor adalah saponin, tanin, flavonoid, alkaloid dan terpenoid yang didapat dari proses ekstraksi (Yudistira, 2013).
kelor merupakan senyawa polifenol yang menunjukkan potensi tertinggi antioksidan dibanding pada bagian lain dari tanaman, disamping itu mampu mengganggu keutuhan membran sel bakteri (Rajalakshmi dan S. Narasimhan, 1985; Gardner et al, 2000; Juliantina, 2008).
Berdasarkan hal-hal tersebut peneliti ingin menguji efek saponin dan flavonoid dalam kandungan ekstrak daun kelor terhadap kecepatan angiogenesis paska ekstraksi gigi tikus wistar. Penelitian ini diharapkan bermanfaat bagi masyarakat karena dapat menjadi solusi penyembuhan luka yang alami, murah, mudah didapat dan aman.
1.2 Rumusan masalah
Apakah pemberian ekstrak daun kelor dapat mempercepat proses angiogenesis paska ekstraksi gigi tikus wistar?
1.3 Tujuan
1.3.1 Tujuan umum
Mengetahui pengaruh pemberian ekstrak daun kelor terhadap kecepatan proses angiogenesis pada tikus wistar.
1.3.2 Tujuan khusus
1.4 Manfaat
BAB 2
TINJAUAN PUSTAKA
2.1 Ekstraksi Gigi
Ekstraksi gigi yang ideal yaitu mengeluarkan gigi dengan trauma atau nyeri seminimal mungkin sehingga jaringan yang rusak dapat sembuh dengan baik (Balaji, 2007).
Perawatan gigi memiliki tujuan utama mempertahankan keberadaan gigi selama mungkin di dalam rongga mulut, namun terkadang pencabutan gigi diindikasikan sebagai tindakan terbaik untuk mencegah keadaan yang lebih buruk. Indikasi dan kontraindikasi sebaiknya perlu diketahui sebelum tindakan pencabutan gigi agar dapat mencapai hasil yang maksimal (Angganisa, 2011).
Paska tindakan ekstraksi gigi tidak jarang terjadi komplikasi, hal ini bisa menjadi masalah yang serius dan fatal apabila tidak tertangani dengan baik. Menurut Pederson (1996), komplikasi adalah suatu respon pasien tertentu yang dianggap sebagai kelanjutan normal dari pembedahan, yaitu perdarahan, rasa sakit dan edema. Tetapi apabila berlebihan maka perlu ditinjau apakah termasuk morbiditas yang biasa terjadi atau komplikasi. Komplikasi paska bedah menurut Pederson (1996) berupa perdarahan, nyeri, edema dan reaksi terhadap obat.
2.2 Penyembuhan luka
akut akan mencapai penyembuhan normal dalam jangka waktu tertentu. Luka akut biasanya terjadi pada individu normal, sehat dan dapat dilakukan penutupan luka secara primer atau dibiarkan menyembuh secara sekunder. Sebagian besar luka yang terjadi akibat trauma pada organ atau jaringan dapat dikategorikan sebagai luka akut (Pramesti, 2012).
Tubuh memiliki kemampuan untuk menghilangkan atau menghambat proses infeksi oleh mikroba dengan tujuan untuk mempertahankan keutuhan jaringan. Selain itu tubuh juga memiliki kemampuan secara seluler dan biokimia untuk memperbaiki integritas jaringan dan kapasitas fungsional akibat adanya luka yang diketahui sebagai proses penyembuhan luka (Miloro, 2004; Sofianty, 2010). Luka paska pencabutan gigi merupakan salah satu hal yang perlu diperhatikan. Penyembuhan luka adalah perbaikan yang meliputi regenerasi dan pengendapan jaringan ikat (fibrosis atau parut). Regenerasi sel umumnya melibatkan proliferasi dan berdiferensiasi untuk menggantikan sel yang mati (Pramesti, 2012). Proses penyembuhan luka terjadi pada awal inflamasi, selanjutnya terjadi perusakan, pelarutan dan penghancuran sel atau agen penyebab kerusakan sel. Pada saat yang sama terjadi proses reparasi, proses pembentukan kembali jaringan yang rusak. Proses ini baru selesai sempurna sesudah agen penyebab kerusakan sel dinetralkan. Selama proses reparasi berlangsung, jaringan rusak diganti oleh regenerasi sel parenkimal dengan cara mengisi bagian yang rusak dengan jaringan fibroblas (Prabakti, 2014).
Fisiologi penyembuhan luka dapat dibagi ke dalam 3 fase utama, yaitu fase inflamasi, fase proliferasi dan fase remodelling (Miloro, 2004):
1. Fase inflamasi akut terhadap cedera, mencakup hemostasis, pelepasan histamin dan mediator lain dari sel-sel yang rusak dan migrasi sel darah putih (neutrofil dan makrofag) ke tempat yang rusak tersebut dan pembersihan jaringan yang mati.
2. Fase proliferasi, yaitu pada saat pembuluh darah baru yang dapat diperkuat oleh jaringan ikat yang menginfiltrasi luka.
3. Fase remodelling/maturasi, mencakup re-epitelisasi, kontraksi luka dan reorganisasi jaringan ikat.
2.2.1 Fase inflamasi
Inflamasi merupakan reaksi awal bila tubuh terkena jejas. Fase ini terjadi segera setelah cedera dan dapat berlangsung selama 3-5 hari. Reaksi awal adalah vasokonstriksi dengan terjadinya vasodilatasi lokal, keluarnya darah dan cairan menuju ruangan ekstravaskuler dan terhambatnya aliran limfatik (Miloro, 2004). Banyak proses yang terjadi pada fase ini antara lain (Moenadjat et al, 2009):
a. Vasokonstriksi dan Hemostasis
Pembuluh darah dan pembuluh limfa mengalami vasokonstriksi dalam beberapa menit setelah trauma terjadi. Trombosit beragregasi disekitar endotelium yang cedera. Segera setelah cedera, kaskade koagulasi dimulai.
b. Vasodilatasi dan Peningkatan Permeabilitas
c. Fagositosis dan Chemotactic Growth Factor
Beberapa jam setelah cedera, neutrofil/PMN (polymorphonuclear cell) muncul di daerah cedera, jumlahnya mencapai puncak pada satu hingga dua hari setelah cedera terjadi. Jumlah neutrofil akan menurun pada hari ketiga jika tidak terjadi infeksi. Jumlah monosit mencapai puncak pada hari keempat. Jumlah limfosit mencapai puncak pada hari keenam.
2.2.2 Fase Proliferasi
Pada proses penyembuhan luka yang normal dan sehat, fase ini dimulai pada hari ke 3-5 setelah cedera terjadi.
a. Angiogenesis dan Granulasi
Pelepasan faktor pertumbuhan menginduksi migrasi dan proliferasi sel endotel yang akhirnya menyebabkan angiogenesis. Pembuluh darah yang terbentuk kemudian menembus matriks fibrin luka dan membentuk jejaring pembuluh darah. Jejaring pembuluh darah tersebut kemudian membentuk jaringan granulasi.
Jaringan granulasi terbentuk dari kolagen, leukosit, fibroblas dan sel endotel muda.
b. Pembentukan Matriks Ekstraseluler
Dua hingga tiga hari setelah cedera, fibroblas bermigrasi ke daerah luka dan akan aktif memproduksi kolagen. Kolagen yang pertama dihasilkan adalah kolagen. Penumpukan kolagen yang merupakan langkah awal yang menyebabkan integritas kulit muncul kembali. Pembentukan kolagen membutuhkan hidroksilasi
c. Re-epitelisasi
Re-epitelisasi membutuhkan migrasi, proliferasi dan diferensiasi keratinosit. Proses ini dimulai dari tepi-tepi luka beberapa jam setelah luka (Miloro, 2004).
2.2.3 Fase Maturasi
Fase ini merupakan tahap yang paling lama dari proses penyembuhan luka, tahap ini dapat berlangsung selama 3 minggu hingga 2 tahun setelah luka terjadi. Walaupun kecepatan sintesis kolagen menurun pada minggu ketiga, akan tetapi tetap terjadi ikatan antar kolagen dapat berlangsung sampai beberapa bulan. Tahap maturasi jaringan ini dipengaruhi faktor usia, perbedaan ras, jenis luka dan lamanya inflamasi (Cockbill, 2002; Li, Chen & Kirsner, 2007).
2.3 Faktor yang Mempengaruhi Penyembuhan Luka
Penyembuhan luka dapat tergantung oleh penyebab dari dalam tubuh sendiri (endogen) atau oleh penyebab dari luar (eksogen).Penyebab endogen terpenting adalah gangguan koagulasi yang disebut koagulopati dan ganguan sistem imun. Proses penyembuhan luka tidak hanya terbatas pada proses regenerasi yang bersifat lokal saja pada luka, namun dipengaruhi pula oleh faktor intrinsik dan faktor ekstrinsik (InETNA, 2004). Faktor-faktor yang dapat mempengaruhi penyembuhan luka (Damayanti dkk, 2015):
a. Vaskularisasi
b. Anemia
Anemia dapat memperlambat proses penyembuhan luka karena pada dasarnya penyembuhan luka membutuhkan kadar protein yang cukup. Oleh sebab itu, orang yang mengalami kekurangan kadar hemoglobin dalam darah akan mengalami proses penyembuhan yang relatif lebih lama.
c. Usia
Kecepatan perbaikan sel berlangsung sejalan dengan pertumbuhan dan kematangan usia seseorang. Namun selanjutnya, proses penuaan dapat menurunkan sistem perbaikan sel sehingga dapat memperlambat proses penyembuhan luka.
d. Penyakit lain
Penyakit lain atau biasanya penyakit sistemik mempengaruhi lamanya proses penyembuhan luka. Penderita diabetes melitus dan ginjal akan menyebabkan proses penyembuhan luka yang lambat.
e. Nutrisi
Nutrisi merupakan unsur utama dalam membantu perbaikan sel, terutama karena kandungan zat gizi yang terdapat didalamnya. Misalnya vitamin A membantu proses epitelisasi atau penutupan luka dan sintesis kolagen.
f. Medikasi
2.4 Penyembuhan Luka Paska Ekstraksi Gigi
Setelah pencabutan gigi, soket akan terisi darah. Pada tahap awal penyembuhan luka yaitu proses pembekuan darah. Jaringan fibrin yang terbentuk secara perlahan menutup pembuluh darah yang rusak diikuti terjadinya vasodilatasi yang kemudian terjadi migrasi leukosit dan pembentukan lapisan fibrin. Pada hari yang sama terjadi proses inflamasi, neutrofil migrasi ke daerah luka dan memfagosit jaringan nekrotik (Miloro, 2004). Monosit akan berubah menjadi makrofag saat keluar dari mikrosirkulasi yang berperan sebagai fagositosis. Jumlah neutrofil akan menurun ketika terjadi inflamasi kronis. Limfosit dan sel plasma mulai migrasi ke area luka (Topazian & Goldberg, 2002)
Proses proliferasi epitel pada permukaan bekuan darah akan terjadi pada hari ketiga paska ekstraksi gigi, selain itu terjadi pula proliferasi fibroblas yang berasal dari dinding tulang alveolar dan menyebar masuk ke dalam bekuan darah. Proliferasi fibroblas merupakan hasil mediator kimia dari makrofag atau yang disebut jaringan granulasi (Topazian & Gorldberg, 2002).
Pada bekuan darah terdapat benang-benang fibrin yang dicerna oleh enzim jaringan dan perbaikan awal jaringan telah selesai. Osteoklas akan terakumulasi sepanjang alveolar bone crest dan mengatur tahap resorpsi crest yang aktif. Proses angiogenesis terjadi pada daerah bekas ligamen periodontal. Semakin lama tensile strength akan meningkat. Osteoid akan memanjang dari bekuan darah ke alveolar
2.5 Angiogenesis
Angiogenesis adalah suatu proses dimana pembuluh darah baru tumbuh di daerah luka setelah cedera. Granulasi jaringan merupakan kombinasi dari elemen seluler termasuk fibroblas dan sel inflamasi, yang bersamaan dengan timbulnya pembuluh darah di jaringan penghubung di area luka (Singer & Clark, 1999).
Pada saat terjadi kerusakan jaringan, proses angiogenesis mampu mempertahankan kelangsungan fungsi jaringan dan organ melalui terbentuknya pembuluh darah baru untuk menggantikan pembuluh darah yang telah rusak jaringan pada penyembuhan luka memerlukan suplai oksigen dan nutrisi supaya dapat berproliferasi dengan baik. Oleh karena itu dibutuhkan suatu proses yang dapat memfasilitasi hal tersebut yaitu angiogenesis (Friska dkk, 2007).
Proses angiogenesis terjadi pada proses penyembuhan luka ketika fase proliferasi, yaitu antara 2 hari sampai 3 minggu setelah injuri. Proses ini merupakan proses alami yang penting untuk mengembalikan aliran darah pada daerah yang luka sehingga mendapatkan suplai nutrisi yang cukup (Miloro, 2004, p.5).
2.6 Moringa oleifera
Gambar 2.1 Daun kelor (Moringa oleifera)
2.6.1 Klasifikasi
Klasifikasi Moringa oleifiera (Krisnadi, 2008):
Kingdom : Plantae
Subkingdom : Tracheobionta Super Divisi : Spermatobphyta Divisi : Magnoliophyta Kelas : Magnoliopsida Sub Kelas : Dilleniidae
Ordo : Capparales
Famili : Moringaceae
Genus : Moringa
Spesies : Moringa oleifera 2.6.2 Morfologi Moringa oleifera
(biji) maupun vegetatif (stek batang). Tumbuh di dataran rendah maupun dataran tinggi sampai di ketinggian ± 1000 m dpl, banyak ditanam sebagai tapal batas atau pagar di halaman rumah atau ladang (Krisnadi, 2008).
Daun kelor merupakan jenis daun bertangkai karena hanya terdiri atas tangkai dan helaian saja. Tangkai daun berbentuk silinder dengan sisi atas agak pipih, menebal pada pangkalnya dan permukaannya halus. Daunnya berbentuk bulat atau bundar (orbicularis), pangkal daunnya tidak bertoreh dan termasuk ke dalam bentuk bangun bulat telur. Ujung dan pangkal daunnya membulat (rotundatus) dimana ujungnya tumpul dan tidak membentuk sudut sama sekali, hingga ujung daun merupakan semacam suatu busur. Susunan tulang daunnya menyirip (penninervis), dimana daun kelor mempunyai satu ibu tulang yang berjalan dari pangkal ke ujung dan merupakan terusan tangkai daun (Krisnadi, 2008).
2.6.3 Kandungan
Tabel 2.1: Kandungan fitokimia daun kelor (Unuigbe, 2014)
Phytochemical Inference
- indicates absence of compound
Daun kelor memiliki senyawa aktif yang dapat dimanfaatkan diantaranya adalah saponin, tanin, flavonoid, alkaloid dan terpenoid yang didapat dari proses ekstraksi (Yudistira dkk, 2013).
a. Saponin
Saponin adalah senyawa glikosida yang terdiri gabungan glukosa dengan sapogenin yang memiliki berbagai sifat farmakologis yaitu antibakteri, anti inflamasi dan antioksidan. Berdasarkan struktur kimianya dibagi menjadi 3 kelas utama yaitu kelas steroid, kelas alkaloid dan kelas triterpenoid. (Rachmawati, 2010). Saponin membantu proses penyembuhan luka karena mempunyai efek antioksidan dengan membentuk hidrogen peroksida. Disamping itu, saponin juga berperan sebagai anti bakteri yang dapat mengakibatkan kerusakan membran sel bakteri sehingga menyebabkan keluarnya komponen penting bakteri seperti asam nukleat, protein dan nukleotida (Faradisa, 2008). Saponin bereaksi dengan porin pada membran luar dinding sel bakteri membentuk ikatan polimer yang sangat kuat mengakibatkan rusaknya porin sehingga akan mengurangi permeabilitas membran sel bakteri. Menurunnya permeabilitas sel bakteri mengakibatkan sel akan kekurangan nutrisi, sehingga pertumbuhan bakteri terhambat atau mati (Rachmawati, 2015).
b. Flavonoid
Flavonoid merupakan zat golongan fenol alami terbesar yang mempunyai berbagai manfaat seperti anti inflamasi, antivirus, antibakteri, anti jamur dan meningkatkan kerja pembuluh darah kapiler (Marais et al, 2006). Senyawa polifenol pada daun menunjukkan potensi tertinggi antioksidan dibanding pada bagian lain dari tanaman kelor sesuai dengan penelitian sebelumnya (Gardner et al, 2000). Komponen bioaktif fenol utama daun kelor merupakan quercetin yang mempunyai kemampuan untuk mengikat atom bagi radikal bebas (Amijaya dkk, 2013).
Flavonoid bersifat antibakteri dengan cara mendenaturasi protein yang menyebabkan aktiftas metabolisme sel bakteri berhenti karena semua aktifitas metabolisme sel bakteri dikatalisis. Berhentinya aktifitas metabolisme ini akan mengakibatkan kematian sel bakteri sehingga mampu mempercepat penyembuhan luka (Pambudi, 2013).
2.7 Gel Ekstrak Daun Kelor
BAB 3
KERANGKA KONSEPTUAL DAN HIPOTESIS
3.1 Kerangka Konseptual
Pada hari ke-3 dan 5
Keterangan:
: yang diteliti Pencabutan gigi
insisif RB kiri
Soket paska pencabutan
Angiogenesis
Pembuluh darah baru
Ekstrak Daun Kelor
Saponin Flavonoid
Aktifitas Makrofag
Penyembuhan Luka
bFGF VEGF
Penjelasan Kerangka Konsep
Ekstraksi gigi merupakan tindakan bedah berupa pengeluaran gigi dari soketnya yang dapat mengakibatkan kerusakan jaringan sekitarnya baik jaringan lunak maupun jaringan keras. Dalam prosesnya jika terjadi gangguan atau komplikasi paska pencabutan maka proses penyembuhan luka tidak akan berjalan secara optimal.
Daun kelor diketahui memiliki beberapa kandungan penting dalam mempercepat penyembuhan luka, kandungan penting tersebut yaitu saponin dan flavonoid. Saponin dalam ekstrak daun kelor membentuk hidrogen peroksida yang berperan sebagai antioksidan, selain itu saponin mampu menurunkan aktifitas bakteri dengan cara mengganggu stabilitas membran sel bakteri yang menyebabkan kerusakan sel.
Flavonoid yang terdapat dalam ekstrak daun kelor juga memiliki aktifitas antioksidan dengan cara mengikat elektron terluar dari radikal bebas yang bersifat tidak stabil. Antioksidan yang telah berikatan akan menyebabkan radikal bebas lebih stabil sehingga kerusakan membran sel dapat berkurang. Disamping sebagai antioksidan flavonoid juga mampu mendenaturasi protein sel bakteri dan merusak membran sel tanpa dapat diperbaiki lagi sehingga penyembuhan luka akan terjadi lebih cepat.
3.2 Hipotesis
BAB 4
METODE PENELITIAN
4.1 Jenis Penelitian
Jenis penelitian yang dilakukan adalah eksperimental laboratoris secara in vivo pada hewan coba tikus wistar.
Desain penelitian darahnya pada hari ke 3
P5 = kelompok perlakuan 2, dengan ekstrak daun kelor 15%, dilihat pembuluh darahnya pada hari ke 5
4.2 Rancangan Penelitian
4.3 Sampel dan Besar Sampel
4.3.1 Jenis Sampel
Sampel penelitian menggunakan tikus wistar jantan yang diperoleh dari Laboratorium Biokimia Fakultas Kedokteran Universitas Airlangga Surabaya. 4.3.2 Kriteria Sampel
Subyek penelitian dievaluasi secara klinis, sebelum mendapat perlakuan penelitian dan pengambilan sampel dilakukan secara random sampling. Beberapa kriteria sampel yang harus dipenuhi yaitu:
a. Tikus wistar b. Umur 2-3 bulan
c. Berat badan 150-250 gram d. Jenis kelamin jantan
e. Sehat, ditandai dengan gerakan yang aktif dan memungkinkan untuk dijadikan sampel penelitian
Binatang coba yang digunakan dalam penelitian ini adalah tikus wistar jantan. Pemilihan tikus jantan dalam penelitian ini untuk menghindari adanya kemungkinan variasi hormonal yang dapat terjadi pada tikus wistar jenis kelamin betina.
4.3.3 Besar Sampel
𝑛 = 2𝛿2(𝑍1−𝛼+ 𝑍1−𝛽)
2
(𝜇1− 𝜇2)2
Keterangan:
n : banyaknya sampel tiap kelompok δ : standar deviasi kelompok kontrol
Z1-α : nilai pada distribusi normal standar yang sama dengan tingkat kemaknaan (untuk 0,05 adalah 1,64)
Z1-β : nilai pada distribusi normal standar yang sama dengan power test sebesar yang diinginkan (untuk β= 0.10 adalah 1.282)
(μ1 – μ2)2 : beda rata-rata masing-masing kelompok (μ1=16,33 ; μ2 = 11,00)
Dalam rumus ini didapatkan besar sampel minimal adalah 6, pada penelitian ini digunakan sampel sejumlah 7 ekor tikus wistar untuk masing-masing kelompok. Maka, jumlah hewan coba yang digunakan adalah 28 ekor tikus wistar.
4.4 Variabel Penelitian
1. Variabel Bebas
Gel ekstrak daun kelor dengan konsentrasi 15% 2. Variabel Terikat
Jumlah pembuluh darah dalam sediaan preparat dari soket bekas pencabutan gigi tikus wistar pada hari ke-3 dan 5
3. Variabel Terkendali
a. Kriteria sampel
d. Penjahitan luka pasca pencabutan gigi tikus wistar e. Teknik pengambilan dan penghitungan data.
4.5 Definisi Operasional
1. Gel ekstrak daun kelor merupakan hasil dari pengolahan daun kelor dengan ethanol.
2. Proses angiogenesis diartikan sebagai jumlah pembuluh darah yang terlihat pada sediaan preparat soket gigi dari tiap sampel yang dilihat dengan mikroskop pada hari ke-3 dan 5 melalui pemeriksaan HPA dengan menggunakan mikroskop.
3. Tikus wistar dibagi menjadi 4 kelompok, masing-masing kelompok terdiri dari 7ekor tikus Wistar yaitu :
a. Kelompok K3 : kelompok kontrol 1. Kelompok tikus Wistar yang tidak diberi kandungan ekstrak daun kelor dan dilihat jumlah pembuluh darahnya pada hari ke 3.
b. Kelompok K5 : kelompok kontrol 2. Kelompok tikus Wistar yang tidak diberi kandungan ekstrak daun kelor dan dilihat jumlah pembuluh darahnya pada hari ke 5.
c. Kelompok P3 : kelompok perlakuan 1. Kelompok tikus Wistar yang diberi kandungan ekstrak daun kelor 15% dan dilihat jumlah pembuluh darahnya pada hari ke 3.
4. Pemeliharaan tikus dilakukan selama masa adaptasi dan masa penelitian. Masa adaptasi sekitar satu minggu sedangkan pada masa penelitan dilakukan pengambilan data pada hari ke-3 dan 5.
5. Kandang tikus berukuran 60 cm x 65 cm x 80 cm, yang cukup untuk empat hingga lima ekor tikus.
6. Lingkungan tempat tinggal tikus berupa ruangan dengan suhu kamar (25o -270C) yang memiliki cukup udara dan cahaya agar tidak lembab, jauh dari kebisingan dan tidak terpapar matahari secara langsung.
7. Makanan tikus dari jagung segar, pakan dan minuman diberikan dalam jumlah yang sama pada setiap tikus.
8. Pencabutan pada gigi tikus menggunakan gigi insisivus rahang bawah dengan menggunakan modifikasi dari needle holder di bawah efek anestesi ketamin sebanyak 0,1-0,2 ml.
9. Dosis gel ekstrak daun kelor yang digunakan dalam penelitian ini 15%. Pembuatan gel ekstrak daun kelor diperoleh dari pembuatan ekstrak di Badan Penelitian dan Konsultasi Surabaya
10.Teknik pemberian ekstrak daun kelor dengan teknik topikal pada soket pasca pencabutan gigi tikus wistar dengan menggunakan syringe sampai soket penuh, yaitu ± 0.1 ml.
4.6 Waktu dan Tempat Penelitian
Penelitian ini dilakukan pada bulan Agustus-November tahun 2016, dengan rincian tempat penelitiannya, adalah:
a. Pembuatan ekstrak di Badan Penelitian dan Konsultasi Surabaya.
b. Pemeliharaan dan pemberian perlakuan pada hewan coba dilakukan di Laboratorium Biokimia Fakultas Kedokteran Universitas Airlangga. c. Pembuataan sediaan HPA dilakukan di Laboratorium Patologi Anatomi
Fakultas Kedokteran Universitas Airlangga.
d. Penghitungan jumlah pembuluh darah baru di Laboratorium Patologi Mulut Fakultas Kedokteran Gigi Universitas Airlangga.
4.7 Instrumen Penelitian
Instrumen yang digunakan pada penelitian ini adalah preparat HPA. Preparat HPA tersebut dibuat dari hasil biopsi soket bekas ekstraksi gigi tikus pada hari ke 3 dan 5 pasca pencabutan. Dari preparat pemeriksaan HPA tersebut dilakukan indentifikasi dengan mikroskop, yaitu identifikasi jumlah pembuluh darah yang tampak dengan perbesaran 400x.
4.8 Alat dan Bahan
4.8.1 Alat Penelitian
1. Kandang hewan coba berupa bak plastik berukuran 60x65x80 cm dan di atasnya diberi penutup berupa jaring-jaring yang terbuat dari kawat serta diberi alas sekam
2. Timbangan binatang
4. Gunting bedah 5. Pinset anatomi
6. Tang untuk pencabutan gigi 7. Scalpel
8. Needle holder
9. Jarum jahit dan benang 10.Syringe
11.Kotak kaca untuk pembiusan
12.Toples kaca untuk fiksasi dan dekalsifikasi 13.Peralatan untuk pembuatan sediaan
14.Mikroskop cahaya 15.Kamera digital 16.Alas kerja
4.8.2 Bahan Penelitian
1. Ekstrak daun kelor dengan konsentrasi 15 %
2. Gel CMC Na (Carboxyl Methyl Selulose Natrium) 3% 3. Ethanol, sebagai pelarut
4. Makanan tikus wistar (berbahan dasar jagung) 5. Air putih untuk minum tikus wistar setiap harinya 6. Obat general anestesi
7. Larutan Formalin 10% untuk fiksasi jaringan 8. Larutan HNO3,5%, 10%, 15%, untuk dekalsifikasi 9. Alkohol 70%, 95%, 100% untuk dehidrasi
11.Parafin
12.Larutan Haematoxylin Eosin untuk pengecatan 13.Kapas
4.9 Cara kerja
4.9.1 Persiapan Hewan Coba
a. Memilih 24 ekor tikus wistar jantan usia diantara 2-3 bulan dengan berat badan 150-250 g.
b. Tikus wistar dibagi menjadi 4 kelompok, masing-masing kelompok terdiri dari 7ekor tikus wistar.
4.9.2 Pembuatan gel dari ekstrak daun kelor
Pembuatan gel dari ekstrak daun kelor, terdiri dari 3 tahap yaitu: 1. Persiapan Sampel
Daun kelor diambil dari perkebunan Agrowisata Indomas, Menganti, Gresik. Sampel berupa daun kelor, dikumpulkan, dicuci dan dikeringkan dengan temperatur ruang selama 7 hari. Pengeringan bertujuan agar mendapatkan berat tetap dari daun kelor sesuai berat yang digunakan untuk ekstrak. Sampel yang sudah kering dihancurkan menggunakan blender.
2. Proses Ekstraksi Daun Kelor
kandungan ethanol yang minimal. 1kg daun kelor + 1liter ethanol kemudian diuapkan sehingga dapat diperoleh 20-30gr residu ekstrak daun kelor cair berwarna kehijauan.
3. Pembuatan Sediaan Gel
Pada penelitian ini ekstrak daun kelor dibuat dalam bentuk sediaan gel. Ekstrak akan lebih mudah diaplikasikan dalam bentuk sediaan gel pada luka pasca pencabutan gigi karena sifatnya yang semisolid, lembut dan elastik. Sediaan gel mempermudah substansi ekstrak dapat mudah masuk dalam soket (Khoswanto, 2010). Bahan gel yang akan digunakan adalah CMC Na 3% sebanyak 3gr, dimasukkan dalam gelas kemudian ditambah 100ml aquades diaduk selama 6 jam sehingga diperoleh gel sempurna 3%. Ekstrak daun kelor 15% dimasukkan ke dalam gelas kemudian ditambahkan 85ml gel diaduk selama 30 menit, sehingga diperoleh gel ekstrak daun kelor.
4.9.3 Proses Pencabutan Gigi Tikus Wistar
1.Tikus wistar dilakukan tindakan pembiusan umum dengan menggunakan klorofom secara inhalasi dengan dosis letal
2.Tikus wistar dilakukan pencabutan gigi insisif kiri rahang bawah dengan menggunakan tang.
4.9.4 Pembuatan Sediaan Histologis
4.9.4.1 Fiksasi Jaringan
Setelah tikus wistar tidak bernyawa lagi, proses selanjutnya adalah melakukan pengambilan jaringan tubuh yang diinginkan, yaitu pemotongan mandibula tikus wistar dengan melakukan insisi dari sudut mulut ke arah posterior sampai rahang bawah terlepas dari tengkorak, selanjutnya dimasukkan kedalam larutan fiksasi. Larutan fiksasi yang digunakan adalah larutan formalin 10%, untuk mencegah perubahan jaringan post mortem agar tidak membusuk, mencegah autolisis jaringan dan mengeraskan jaringan.
4.9.4.2 Pengolahan Jaringan
Pengolahan dilakukan dengan alat autotechnicom selama 24 jam dengan tahapan:
a. Dehidrasi
Dehidrasi merupakan proses menarik air dari dalam jaringan dengan menggunakan alkohol secara bertahap sehingga jaringan dapat diisi parafin untuk membuat blok preparat. Caranya dengan memasukkan jaringan kedalam alkohol secara berurutan mulai dari konsentrasi :
b. Clearing
Clearing atau menjernihkan jaringan, yaitu tahap untuk mengeluarkan alkohol dari jaringan dan menggantinya dengan suatu larutan yang dapat berikatan dengan parafin. Jaringan tidak dapat langsung dimasukkan ke dalam parafin karena alkohol dan parafin tidak bisa saling melarutkan, larutan yang digunakan adalah xylol. Setelah jaringan dikeluarkan dari cairan dehidrasi, jaringan dimasukkan ke dalam xylol sebanyak 2 kali masing-masing dilakukan selama 30 menit. Jaringan akan menjadi bening.
c. Impregnasi/Embedding
Merupakan proses untuk mengeluarkan cairan (clearing agent) dari jaringan dan diganti dengan parafin. Pada tahap ini jaringan harus benar- benar bebas dari clearing agent karena cairan tersebut dapat mengkristal dan sewaktu dipotong dengan mikrotom akan menyebabkan jaringan mudah robek. Zat pembenam (bahan impregnasi) yang digunakan adalah parafin cair panas yang mempunyai temperatur rendah (melting temperature) kira-kira 560C. Jaringan kemudian direndam dalam parafin cair 1 dengan titik lebur 560C selama 21⁄2 jam, kemudian dimasukkan dalam parafin cair 2 selama 4 jam. Setelah itu jaringan siap dimasukkan dalam blok parafin.
d. Pengecoran (Blocking)
e. Pemotongan (mounting)
Dilakukan dengan rotary microtome. Selama pemotongan, suhu blok diusahakan rendah yaitu 5-10oC, dengan mendinginkan blok dan pisau pemotong dengan air es agar sediaan tetap basah, sehingga blok dapat terpotong dengan baik. Blok yang mengandung jaringan lalu dipindahkan secara hati-hati menggunakan kuas ke dalam waterbath yang temperaturnya diatur 37- 400C dan biarkan beberapa saat hingga blok parafin tersebut mengembang.
Setelah blok parafin terkembang dengan baik, blok parafin tersebut ditempelkan pada kaca objek dengan cara memasukkan kaca objek itu ke dalam waterbath dan menggerakkannya ke arah blok parafin, dengan menggunakan kuas kemudian dilekatkan pada kaca objek. Setelah melekat kaca objek digerakkan keluar dari waterbath dengan hati-hati agar blok parafin tidak terlipat.
Kaca objek yang berisi blok parafin diletakkan di atas hotplate/termoplate, dibiarkan selama beberapa jam. Cara lainnya adalah dengan melewatkan kaca objek di atas api sehingga blok parafin melekat erat di atas kaca objek.
f. Pengecatan jaringan
Jaringan yang telah dipotong diberi pewarnaan sehingga unsur jaringan menjadi dapat diamati dengan mikroskop. Kemudian, dilakukan pengecatan Hematoksilin Harris-Eosin (HE) dengan prosedur sebagai berikut:
1. Deparafinisasi, yang bertujuan menghilangkan parafin yang menempel pada irisan jaringan sehingga bahan cat dapat melekat. Dilakukan dengan memasukkan dalam larutan xylol.
3. Direndam dalam larutan Hematoksilin Harris selama 15 menit. 4. Dibilas dalam air mengalir dalam waktu yang singkat.
5. Dicelupkan dalam HNO3 secara cepat 3-10 x celup, kemudian dilakukan pengecekan diferensiasi warna di bawah mikroskop.
6. Dibilas dalam air mengalir dalam waktu yang singkat.
7. Dicelup sebanyak 3-5 kali dalam larutan amonium atau litium hingga potongan berwarna biru cerah.
8. Dicuci dalam air mengalir selama 10-20 menit. Bila pencucian tidak maksimal jaringan akan sulit diwarnai oleh Eosin.
9. Direndam dalam Eosin selama 15 detik - 2 menit.
10. Dilakukan dehidrasi dalam alkohol dengan konsentrasi yang meningkat secara perlahan, masing-masing selama 2 menit.
11. Dimasukkan dalam larutan xylol 2x2 menit.
12. Ditutup dengan kaca penutup dan preparat siap untuk dilakukan pemeriksaan di bawah mikroskop cahaya.
4.10 Prosedur Pengambilan Data
4.11 Pengolahan Data Analisis
4.12 Alur Penelitian
Pengambilan sampel dari soket gigi tikus, kemudian dibuat sediaan HPA
Sediaan dilihat di bawah mikroskop dengan pembesaran 400x kemudian dihitung jumlah pembuluh darah yang ditemukan
Analisis data dengan menggunakan uji statistik independent t-test
Kelompok P5
BAB 5
HASIL PENELITIAN DAN ANALISIS DATA
5.1 Data hasil penelitian
Data hasil pengamatan diambil dari perhitungan jumlah pembuluh darah pada hari ke-3 dan ke-5 paska pencabutan gigi tikus wistar yang telah dibuat sediaan, kemudian diamati dan dihitung menggunakan mikroskop dengan perbesaran 400x. Jumlah pembuluh darah secara lengkap sebagai berikut:
Tabel 5.1 Jumlah pembuluh darah yang terlihat pada hari ke 3 paska pencabutan
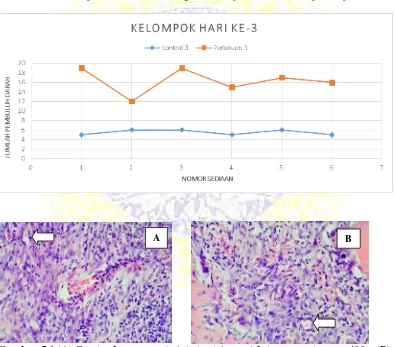
Gambar 5.1 (A) Gambar Lumen pembuluh darah kontrol 3 dengan perbesaran 400x, (B)
Gambar Lumen pembuluh darah perlakuan 3 dengan perbesaran 400x.
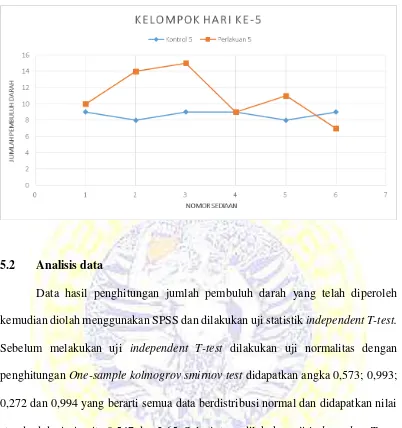
Tabel 5.2 Jumlah pembuluh darah yang terlihat pada hari ke 5 paska pencabutan
5.2 Analisis data
BAB 6
PEMBAHASAN
Pada penelitian ini peneliti menggunakan tikus wistar (Ratus norvegicus) sebagai hewan coba sejumlah 24 ekor. Tikus dibagi menjadi 4 kelompok yaitu 2 kelompok kontrol dan 2 kelompok perlakuan. Masing-masing tikus perlakuan akan diberi ekstrak daun kelor dengan konsentrasi 15% dalam bentuk gel pada hari ke 3 dan ke 5 paska pencabutan gigi insisif kiri rahang bawah, kemudian diberi ekstrak daun kelor dan dilakukan suturing pada soket bekas pencabutan.
Dalam penelitian Handoko dan Andriani (2015) menyebutkan bahwa ekstrak daun kelor 15% berpengaruh terhadap rata-rata waktu perdarahan pada tikus Sprague-Dawley. Ekstrak daun kelor pada penelitian ini dipilih karena daun kelor mempunyai kandungan flavonoid dan saponin yang tinggi. Senyawa polifenol pada flavonoid menunjukkan potensi tertinggi antioksidan dibanding pada bagian lain dari tanaman kelor. Sedangkan saponin mengandung antioksidan dan anti bakteri yang dapat mengakibatkan kerusakan membran sel bakteri sehingga dapat meminimalisir bakteri patogen.
Hasil pengamatan yang telah dilakukan peneliti, jumlah pembuluh darah pada hari ke 3 paska ekstraksi gigi diamati secara histopatologi diperoleh rata-rata pembuluh darah kelompok kontrol 3 adalah 5,5 dan kelompok perlakuan 3 adalah 16,3. Sedangkan kelompok kontrol 5 didapatkan rata-rata sebesar 8,6 dan kelompok perlakuan 5 dengan rata-rata sebesar 11. Dari hasil penghitungan tersebut diketahui bahwa terjadi peningkatan terbesar pada hari ke 3. Pengamatan ini dilakukan pada hari ke 3 dimana luka sudah memasuki tahap proliferasi. Pada hari ke 3 sel radang kronis seperti limfosit dan makrofag mencapai jumlah maksimal. Hipoksia pada jaringan akan memacu makrofag yang diikuti pelepasan faktor pertumbuhan untuk menginduksi terjadinya migrasi dan proliferasi sel endotel sehingga menyebabkan terjadinya angiogenesis. Pembuluh darah yang terbentuk kemudian menembus matriks fibrin luka dan membentuk jejaring pembuluh darah.
mempunyai kandungan flavonoid, saponin, tanin, klorofil, vitamin K dan poliphenol yang memberikan nutrisi dan melindungi luka dari bakteri, bersifat anti inflamasi dan meningkatkan kerja pembuluh darah kapiler.
Flavonoid mampu meingkatkan hormon pertumbuhan yang dibutuhkan saat proses penyembuhan luka yaitu EGF, TGFα, PDGF, VEGF, FGF dan TGFβ
sehingga proses penyembuhan akan lebih cepat (Li, Chen & Kirsner, 2007). Sedangkan saponin mempunyai efek hemostatik dengan membantu membentuk fibrin untuk memperkuat bekuan darah, sehingga proses penyembuhan luka pada fase hemostatik berlangsung lebih singkat dan mempercepat untuk masuk dalam fase inflamasi sehingga penyembuhan luka terjadi lebih cepat dari proses fisiologis umumnya (Venny, 2010).
BAB 7
KESIMPULAN DAN SARAN
7.1 Kesimpulan
1. Gel ekstrak daun kelor 15% dapat meningkatkan kecepatan angiogenesis pada proses penyembuhan luka paska ekstraksi gigi tikus wistar jika dibandingkan dengan kelompok kontrol.
2. Peningkatan jumlah pembuluh darah tertinggi terjadi pada hari ke 3 paska pencabutan gigi tikus wistar yang diberi gel ekstrak daun kelor.
7.2 Saran
1. Perlu dilakukan penelitian lebih lanjut untuk mengetahui :
a. Pengamatan pembuluh darah pada hari pertama, kedua dan keempat untuk mengetahui perubahan yang terjadi secara detail.
b. Penelitian selanjutnya meningkatkan konsentrasi ekstrak daun kelor untuk mengetahui perbedaan jumlah pembuluh darah dengan konsentrasi yang berbeda.
DAFTAR PUSTAKA
Adair dan Montani. 2012. Angiogenesis. San Rafel: Morgan Clay Pool Life Sciences. Hal 2
Adi, N & Linus, S. 2012. Pengaruh Kadar CMC Na sebagai Bahan Pengental terhadap Sifat Fisik Lotion Replain Minyak Atsiri Akar Wangi (Vetivera zizanoides (L) Nogh. Akademi Farmasi Theresiana. Semarang, hal. 18.
Angganisa, H E. 2014. Perbedaan Efektifitas Manajemen Nyeri pasca Ekstraksi Gigi di Rsud Dr. Soehadi Prijonegoro Sragen dan Puskesmas Sidoharjo Sragen. Universitas Diponegoro, Fakultas Kedokteran Gigi.
Amijaya, A. P., Sri, Muwarni, Wisnu, Wardhana. 2013. Efek Ekstrak Air Daun Kelor (Moringa Oleifera) terhadap KadarTumor Necrosis Factor Alpha (Tnf-Α) dan Gambaran Histopatologi Sel Endotel Arteri Coronaria pada Tikus Putih (Rattus Norvegicus) yang Diberi Diet Aterogenik. Fakultas Kedokteran Hewan. Universitas Brawijaya.
Balaji, S.2007. Textbook of Oral and Maxillofacial Surgery 1stEd. New Delhi: Elseveir.P.211
Bisono.2003.Petunjuk Praktis Operasi Kecil. Jakarta: penerbit buku kedokteran EGC. Hal. 15-17.
Cockbill.2002.The Healing Process. J hospital pharmacist vol 9. Pp 1-5.
Damayanti, Ika P, Risa, Pitriani, Yulrina Ardhiyanti. 2015. Panduan Lengkap Keterampilan Dasar Kebidanan II. Yogyakarta: Deepublish. Hal. 66-67.
Faradisa, M. 2008. Uji Efektifitas Antimikroba Senyawa Saponin dari Batang tanaman Belimbing Wuluh (Averrhoa Bilimbi Linn). Skripsi, Fakultas sains dan teknologi universitas islam negeri Malang, pp. 24-39.
Friska, Sardoko, Caroline T., Sandra F. 2009. Angiogensis: Patofisiologi dan Aplikasi Klinis. JKM vol. 8, no. 2. P. 174
Gardner, P.T., T.A.C. White, D.B. McPhail & G.G. Duthie (2000). The relative contributions of vitamin C, carotenoids and phenolics to the antioxidant potential of fruit juices. Food Chemistry 68: 471-474
Gulcin, Ilhami, Mshvildadze, Vakhtang, Akcahan, Gepdiremen, Riad Elias. 2004. Antioxidant Activities from Ivy: α-Hederin, Hederasaponin-C, Hederacolchiside-E and Hederacolchiside-F. Planta Med. Pp. 561-563. Handoko, Galang, Andriani, Ika. 2015. Pengaruh Pemberian Ekstrak Etanol Daun
Indonesia Enterostomal Therapy Nurse Association (InETNA). 2004. Perawatan Luka. Makalah Mandiri. Jakarta: RS Dharmais. Hal 13
Juliantina., Farida R. Manfaat Sirih (Piper crocatum) sebagai Agen Anti Bakterial terhadap Gram Positif dan Gram Negatif. JKKI – Jurnal Kedokteran dan Kesehatan Indonesia; 2009 No 1 (I).H.5.
Juniantito, V & Prasetyo. 2006. Aktivitas Sediaan Gel dari Ekstrak Lidah Buaya (Aloe barbadensis Mill.) pada Proses Penyembuhan Luka Mencit (Mus musculus albinus). J II Pert Indon. vol. 11, no. 1, hal. 19.
Khoswanto, C 2010, The Effect of Mengkudu Gel (Morinda citrifolia Linn.) In Accelerating the Escalation of Fibroblast Post Extraction. Dent J. vol. 43, no.1, pp. 32, 33.
Katharina, Simbolan, J.M., M. Simbolan. 2007. Cegah Malnutrisi dengan Kelor. Yogyakarta: Kanisius.
Krisnadi, A. D. (2008). KELOR Super Nutrisi. Blora, Jawa Tengah, Indonesia: KELORINA.
Li, J., Chen, J., Kirsner, R. 2007. Pathophysiology of Acute Wound Healing. J. Dermatology. vol 25. no 1, pp 9-18.
Marais, Jannie P.J., Betina, Deavours, Richard A., Dixon, Ferreira, Daneel. 2006. The Stereochemistry of Flavonoid. New York: Springer. P. 1-2.
Miloro M., 2004. Peterson’s Prinviples of Oral and Maxillofacial Surgery 2nd Ed. BC Decker Inc. London pp.3-5.
Moenadjat Y. 2009. Luka Bakar: Masalah dan Tata Laksana. Jakarta: Fakultas Kedokteran Universitas Indonesia.
Pambudi, Ari P. 2013. Uji Daya Antibakteri Ekstrak Daun Kelor (Moringa oleifera) terhadap Bakteri Edwardsisella tarda Secara In Vitro. Universitas Airlangga.
Pederson W. Gordon. 1996. Buku Ajar Praktis Bedah Mulut. 1st ed, Penerbit Buku Kedokteran. EGC. Jakarta: pp. 36-44, 60.
Permatasari KI, Periadnadi, Nasir N. 2013. Uji antimikroba ekstrak segar jahe-jahean (Zingiberaceae) terhadap Staphylococcus aureus, Escherichia coli dan Candida albicans. Jurnal Biologi Universitas Andalas. 2(1): pp. 20-4
Pramesti. 2012. Luka akut dan Luka Kronik. Available from http://dokumen.tips/ documents/makalah-luka-akut-kronik.html
Pusponegoro AD, 2005. Luka Dalam: Buku Ajar Ilmu Bedah 2nd . Jakarta: EGC. Pp 66-88.
Rachmawati, F., M.C. Nuria, Sumantri. 2010. Uji Aktivitas Antibakteri Fraksi Kloroform Ekstrak Etanol Etanol Pegagan (Centella asiatica (L) Urb) serta Identifikasi Senyawa Aktifnya. Universitas Wahid Hasyim. Semarang.
Rajalakshmi, D dan S. Narasimhan. 1985. Food Antioxidants: Sources and Methods of Evaluation. Dalam D.L. Madhav., Food Antioxidant, Technological, Toxilogical and Health Perspectives. Hongkong: Marcel Dekker Inc.
Ravindra, V., Karadi, Avneet, B., Gadge,, K. R., and Alagawadi, R. V. S. 2005. Effect of Moringa oleifera Lam. root-wood on ethylene glycol induced urolithiasis in rats. K.L.E.S's College of Pharmacy, India. Journal of Ethnopharmacology Volume 105, Issues 1–2, 21 April 2006, pages 306–311 Setyawan, Ari. 2007. Na-CMC. Universitas Brawijaya.
Shahid, I., Bhanger, M. I. 2004. Effect of Season And Production Locatio on Antioxidant Activity of Moringa Oleifera Leaves Grown In Pakistan. University of Sindh, Pakistan. Journal of Food Composition and Analysis Volume 19, Issues 6–7, September– November 2006, pages 544–551
Sihombing C.N., Nasrul W., & Taofik R.. 2009. Formulasi Gel Antioksidan Ekstrak Buah Buncis (Phaseolus vulgaris L.) dengan Menggunakan Basis Aquapec 505 HV. Jurnal Farmaka. 7 : 3.
Singer AJ, Clark RAF. 1999. Cutaneous wound healing. The New England J of Med 341 : 738 – 746
Sofianty, Dian. 2010. Minimalisir Trauma Pencabutan Gigi di Puskesmas. http://www/surabayahealth.org/berita/minimalisir-traumapencabutan-gigi-di-puskesmas.html. Diakses tanggal 8 Maret 2016
Ueno, C., Hunt, T. K., Hopf, H.W. 2006. Using physiology to Improve Surgical Wound Outcomes. J. Plastic reconstruction Surgery. Vol. 1, pp 59-71. Unuigbe, Charles, Henry A. Okeri, Osayemwenre Erharuyi , Emmanuel E.
Oghenero1 and Dominic A. Obamedo. 2014. Phytochemical and antioxidant evaluation of Moringa oleifera (Moringaceae) leaf and seed. Vol. 11 no. 2, pp. 51-57.
Venny LA,. 2010. Percepatan Pembekuan Darah Ekstrak Etanol Daun Sendok (Plantago mayor L.). Skripsi Faskultas Kedokteran Gigi Universitas Airlangga Surabaya: p. 7
LAMPIRAN
4. Proses Penelitian
Tikus wistar diadaptasi selama 7 hari
Tikus wistar dianastesi menggunakan ketamin
Dilakukan pencabutan gigi insisif rahang bawah
5. Hasil Uji Statistik
1. Uji Distribusi Normal
One-Sample Kolmogorov-Smirnov Test
Std. Deviation 0.54772 2.65832 0.51640 3.03315
Most
Kolmogorov-Smirnof Z 0.782 0.430 0.998 0.421
Asymp. Sig. (2-tailed) 0.573 0.993 0.272 0.994
a. Test distribution is normal
b. Calculated from data
t-test for Equality of Means
3. Independent t – Test Kelompok 5
t-test for Equality of Means
(2-6. Preparat Pembuluh Darah
Pembuluh darah kontrol hari ke 3 Pembuluh darah perlakuan hari ke 3