20
Kegiatan penelitan ini meliputi kegiatan kultivasi kandidat bakteri probiotik dari saluran pencernaan ikan sidat (Anguilla bicolor), uji aktivitas probiotik melalui seleksi in vitro dan analisis molekuler gen 16S rRNA. Ikan sidat (Anguilla bicolor) yang digunakan sebagai objek penelitian berasal dari komoditas budidaya sidat di Desa Cisondari, Ciwidey, Jawa Barat. Bakteri patogen (Aeromonas hydrophila) yang digunakan untuk uji in vitro kandidat bakteri probiotik berasal dari koleksi Laboratorium Bioteknologi Perikanan Fakultas Perikanan dan Ilmu Kelautan Universitas Padjadjaran.
Kegiatan kultivasi bakteri probiotik, uji aktivitas probiotik dan analisis molekuler gen 16S rRNA dilakukan di Laboratorium Bioteknologi Perikanan Fakultas Perikanan dan Ilmu Kelautan Universitas Padjadjaran. Penelitian ini akan dilaksanakan pada bulan Januari 2013 sampai April 2013.
3.2 Alat dan Bahan Penelitian
3.2.1 Alat
Berikut ini adalah alat-alat yang digunakan untuk kegiatan : a. Nekropsi Ikan Sidat (Gold cross dissecting kit)
- Pisau bedah untuk membedah perut ikan. - Gunting untuk memotong usus ikan.
- Pinset untuk memindahkan sampel pada media buffer. b. Isolasi dan Pemurnian Bakteri
- Cawan petri untuk tempat MRS (Mann Rogosa Sharpe) agar dan isolasi mikroba.
- Mikro pipet untuk mengambil cairan dari sampel yang dihaluskan dalam jumlah kurang dari 1 ml.
- Inkubator untuk melakukan inkubasi. - Autoklaf untuk melakukan sterilisasi uap.
- Oven untuk melakukan sterilisasi kering.
- Hot plate memanaskan saat pembuatan medium. - Erlenmeyer untuk menyimpan medium.
- Magnetic Stirer untu membantu menghomogenkan medium - Tabung reaksi untuk menyimpan NaCl Fisiologis.
- Rak tabung reaksi untuk menyimpan tabung reaksi. - Gelas ukur untuk mengukur volume larutan.
- Bunsen untuk mencegah kontaminasi saat isolasi bakteri. - L Glass untuk meratakan hasil ekstraksi pada medium. - Jarum ose untuk melakukan penggoresan bakteri. - Pinset untuk mengambil sampel.
c. Pengamatan dan Pewarnaan Bakteri
- Objek glass untuk tempat pembuatan preparat. - Mikroskop untuk mengamati preparat.
- Pipet untuk meneteskan pewarna. - Bunsen untuk mencegah kontaminasi. d. Uji Produksi Asam
- Cawan petri untuk tempat medium dan pengujian - Jarum ose untuk mengambil bakteri.
- Hot plate memanaskan saat pembuatan medium. - Erlenmeyer untuk menyimpan medium.
- Magnetic Stirer untu membantu menghomogenkan medium - Gelas ukur untuk mengukur volume larutan.
- Bunsen untuk mencegah kontaminasi saat isolasi bakteri. - Inkubator untuk menginkubasi isolat bakteri.
d. Uji Aktivitas Antimikroba
- Cawan petri untuk tempat medium dan pengujian
- Mikropipet dan mikrotips untuk mengambil supernatan bakteri - Microtube 1,5 ml untuk tempat kultur cair
- Digital caliper untuk mengukur diameter zona hambat
- Gelas ukur untuk mengukur volume larutan.
- Spektrofotometri untuk melihat kekeruhan suspensi bakteri - Centrifuge untuk memisahkan larutan.
- Inkubator untuk menginkubasi isolat bakteri. e. Identifikasi Bakteri dengan 16S rRNA
1) Kultur Cair
- Botol Duran Schott untuk menyimpan medium. - Jarum ose untuk memindahkan biakan bakteri.
- Bunsen untuk mencegah kontaminasi saat pemindahan bakteri. - Shaker Incubator untuk inkubasi bakteri.
- Rak tabung reaksi untuk menyimpan tabung reaksi
- Erlenmeyer 150 ml dan 250 ml untuk menyimpan media cair - Magnetic Stirer untu membantu menghomogenkan medium 2) Isolasi DNA
- Rak microtube untuk menyimpan microtube.
- Mikropipet untuk mengambil larutan DNA dan larutan kimia. - Centrifuge untuk memisahkan larutan.
- Microtube 1,5 ml untuk menyimpan ekstrak DNA. - Timbangan analitik untuk menimbang berat sampel. - Waterbath untuk inkubasi ekstrak DNA.
- Vortex untuk menghomogenkan larutan. 3) Polymerase Chain Reaction (PCR)
- Thermal cycler untuk melakukan amplifikasi DNA. - Microtube 0,2 ml untuk wadah sampel DNA bakteri. 4) Elektroforesis Gel Agarose
- Gelas ukur untuk mengukur volume larutan TAE. - Timbangan analitik untuk menimbang agarose.
- Cetakan gel agarose (sisir) untuk mencetak gel agarose dan membuat sumur-sumur untuk penempatan hasil ekstraksi.
- Hot Plate dan Magnetic Stirrer untuk membuat larutan agarosa dengan pelarut TBE.
- Sendok pipih untuk memindahkan gel agarose.
- Alat elektroforesis untuk memisahkan pita DNA dengan bantuan arus listrik.
- Power supply untuk penyalur arus listrik.
- Ultraviolet Transilluminator untuk melihat hasil akhir elektroforesis.
3.2.2. Bahan
Berikut ini adalah bahan-bahan yang dibutuhkan untuk kegiatan : a. Nekropsi ikan sidat
- NaCl fisiologis - Es batu - Kertas label - Plastik - Kertas tissue b. Isolasi bakteri - Medium MRS agar - Medium MRS broth - Akuades - Alkohol 70% - NaCl fisiologis - Kapas - Kain kasa
- Plastik tahan panas - Plastik wrap - Alumunium foil - Sampel usus ikan sidat - Kertas label
c. Pengamatan dan pewarnaan bakteri - Alkohol
- Akuades
- Lugol
- Pewarna II (air fuchsin) d. Uji produksi asam
- MRS agar
- Bromocresol purple e. Uji aktivitas antimikroba
- Medium kultur cair MRS broth - Media Nutrient Agar (NA) - Akuades - NaCl 1M - Kertas label - Kapas - Kain kasa - Plastik
f. Identifikasi bakteri secara molekuler 1) Kultur Cair
- Media MRS broth - Akuades
2) Isolasi DNA
- Wizard® Genomic DNA Purification Kit (Promega) - EDTA 50 mM
- Isopropanol (suhu ruang) - Ethanol 70% (suhu ruang) - Lysozyme 10 mg/l
3) Amplifikasi Gen 16S rRNA - DNA template
- PCR Master Mix (Go Taq Green Master Mix) - Primer Forward F 16S rRNA
- Primer Reverse R 16S rRNA - Nuclease Free Water
4) Elektroforesis - Gel agarose
- Larutan Tris Borat EDTA (TBE) - Ethidium Bromide (EtBr)
- DNA Ladder 1 kb (Geneaid) - Akuades
3.3 Metode Penelitian
Metode penelitian yang digunakan untuk karakterisasi bakteri probiotik dari saluran pencernaan ikan sidat (Anguilla bicolor) direncanakan menggunakan metode deskriptif melalui tiga tahapan pengujian. Tahapan penelitian yang akan dilakukan dapat dilihat pada gambar 6.
3.4 Prosedur Penelitian
3.4.1 Sterilisasi alat dan medium
Sebelum melakukan isolasi ataupun pemurnian bakteri, perlu dilakukan sterilisasi alat guna mencegah kontaminasi dari alat ataupun medium yang digunakan. Sterilisasi dilakukan dengan 2 cara, yaitu sterilisasi uap dengan menggunakan autoklaf dan sterilisasi kering menggunakan oven.
Sterilisasi uap dengan autoklaf dilakukan dengan menyimpan alat atau medium yang akan digunakan didalam autoklaf, lalu autoklaf dinyalakan hingga mencapai suhu 1210C, setelah mencapai suhu tersebut biarkan selama 15 menit untuk membunuh kontaminan yang kemungkinan dapat mengkontaminasi alat ataupun medium (Hadioetomo 1993).
Sterilisasi kering dilakukan dengan menyimpan alat yang telah terbungkus dengan kertas sterilisasi di dalam oven dengan suhu 1800C selama 2 jam kemudian dikeluarkan dari dalam oven dan disimpan dalam rak khusus peralatan steril (Hadioetomo 1993). Pemilihan sterilisasi uap dan sterilisasi kering bergantung pada alat dan bahan yang akan disterilisasi.
Diagram Alir Skema Penelitian :
Tahap Pertama :
Autoklaf 121ºC, selama 15 menit Oven 180ºC, selama 2 jam
Distreak dinding usus (+) NaCl fisiologis Isolasi Bakteri
Inkubasi 30ºC, 48 jam
Seleksi koloni bakteri
(+) NaCl fisiologis
(+) Pewarna, 30 detik
Tahap Kedua :
Diukur diameter zona hambat Ditebar A. hydrophila Tahap Ketiga : Inkubasi 37ºC, 24 jam Gambar 6. Diagram alur penelitian
(+)Deionized water
(+)Go Taq Green Master Mix
(+)Primer 16S rRNA forward (+)Primer 16S rRNA reverse
(+)DNA template
Sequencing
Sterilisasi Alat dan Media
Kultivasi Bakteri
Sampel Usus dan Lambung Ikan
Kultivasi Bakteri pada Media MRS Broth Agar
Subkultur Sampai Dengan Isolat Tunggal
Karakteristik Gram Bakteri
Uji Aktivitas Antimikrobial
Uji/Screening Aktivitas Antimikrobial (Media TSA)
Pengambilan 2 Isolat Probiotik Terbaik
Analisis Molekuler Gen 16S rRNA
Kultur Bakteri Dengan (Nutrient Broth)
Isolasi DNA Genom Bakteri
Amplifikasi DNA Dengan PCR
Elektroforesis
3.4.2 Kultivasi bakteri probiotik dan pemurnian
Kultivasi bakteri merupakan modifikasi dari Syukur dan Hidayat (2005) dalam Trisna (2012) yang dilakukan melalui beberapa tahapan sebagai berikut :
- Sampel yang telah diambil dihaluskan menggunakan mortar dengan tambahan NaCl fisiologis.
- Sebanyak 1 ml sampel diambil dengan menggunakan pipet 1 ml. - Sampel dimasukkan kedalam tabung reaksi yang berisi 9 ml larutan
NaCl fisiologis steril.
- Dilakukan pengenceran hingga 10-7.
- Sebanyak 0,3 ml larutan diambil dari hasil pengenceran 10-6 dan 10-7 menggunakan mikropipet.
- Larutan hasil pengenceran dimasukkan ke dalam cawan petri kemudian disusul dengan memasukkan medium MRS (Mann Rogosa Sharpe) agar yang masih berupa larutan hangat.
- Masing-masing cawan petri yang telah berisi medium MRS (Mann Rogosa Sharpe) agar dimasukkan hasil pengenceran tersebut.
- Sampel diratakan menggunakan L Glass.
- Cawan petri ditutup dan dilapisi dengan plastik wrap.
- Sampel disimpan dalam inkubator dengan suhu 320C selama 2 x 24 jam.
Pemurnian bakteri dilakukan melalui beberapa tahap, yaitu: - Bakteri yang telah dikultivasi diambil.
- Koloni bakteri yang terpisah diambil dengan menggunakan jarum ose. - Koloni bakteri yang akan dimurnikan diambil berdasarkan pada
bentuk, warna dan kenampakan lainnya.
- Bakteri yang akan dimurnikan diambil dengan menggunakan jarum ose.
- Bakteri yang telah diambil dipindahkan ke cawan petri yang berisi medium MRS agar lain menggunakan metode gores.
Proses tersebut diulangi hingga mendapatkan isolat murni dimana hanya terdapat bakteri yang sama dalam isolat tersebut. Isolat yang dianggap telah murni harus diuji kembali untuk mengetahui bakteri tersebut termasuk dalam golongan bakteri gram positif atau negatif, maka dilakukan pewarnaan (Lewaru 2012) dan pengamatan mikroskop dengan prosedur sebagai berikut:
- Objek glass dibasahi dengan alkohol, lalu dikeringkan diatas bunsen. - NaCl fisiologis diteteskan sebanyak 1 tetes diatas objek glass.
- Isolat bakteri yang akan diamati diambil dengan menggunakan jarum ose.
- Isolat yang telah diambil dengan menggunakan jarum ose dioleskan pada NaCl fisiologis yang ada pada objek glass dan meratakannya. - NaCl yang tercampur dengan bakteri yang akan diamati dikeringkan
diatas Bunsen.
- Diteteskan pewarna I (gentian violet) diatas NaCl pada bakteri yang telah dikeringkan lalu diratakan dan dianginkan selama 30 detik. - Hasil pewarnaan dibilas dengan akuades dan dikeringkan.
- Cairan lugol diteteskan dan diratakan pada objek glass kemudian dianginkan selama 30 detik.
- Cairan lugol yang telah kering dibilas dengan akuades dan dikeringkan diatas bunsen.
- Objek glass dibilas dengan alkohol kemudian dikeringkan.
- Objek glass yang telah kering dibilas dengan akuades kemudian dikeringkan.
- Pewarna II (air fuchsin) diteteskan pada objek glass lalu diratakan dan dianginkan selama 30 detik.
- Objek glass kemudian dibilas dengan akuades dan dikeringkan kembali diatas Bunsen.
- Koloni yang terbentuk dan warna (Gram) diamati dengan menggunakan mikroskop.
3.4.3 Uji produksi asam bakteri kandidat probiotik sebagai bakteri asam laktat
Uji ini dilakukan untuk mengetahui bakteri yang diisolasi dari usus ikan sidat merupak bakteri penghasil senyawa asam, khususnya asam laktat. Sebanyak 0,002 gram bromocresol purple sebagai indikator warna dicampurkan dengan 3,1 gram media MRS agar dan 50 ml akuades di dalam tabung erlenmeyer. Media agar yang telah tercampur bromocresol purple disterilisasi selama setengah jam, setelah itu media dituangkan ke dalam cawan petri. Tunggu hingga agar mengeras dan lakukan kultur bakteri dengan menggunakan media tersebut. Setelah dilakukan kultur bakteri, dilakukan inkubasi selama 48 jam pada suhu 300C kemudian amati perubahan warna yang terjadi.
3.4.4 Uji aktivitas anti Aeromonas secara in vitro
Tahap ini dilakukan untuk memperoleh kandidat bakteri yang memiliki kemampuan probiotik dalam menghambat aktivitas bakteri patogen. Setelah isolat murni didapatkan, kemudian diuji daya hambatnya terhadap Aeromonas hydrophila secara in vitro dengan metoda Agar Diffusion Assay (Ariole dan Oha 2013 dimodifikasi) yakni dengan mengamati diameter zona hambat pada media agar NA (Nutrient Agar). Isolat kandidat bakteri probiotik dikultur di dalam microtube 1,5 ml dengan menggunakan media MRS broth selama 18 jam pada suhu 370C (108 CFU/ml). Kultur bakteri kandidat probiotik kemudian disentrifugasi pada putaran 6000 rpm selama 15 menit untuk mendapatkan supernatan bakteri.
Isolat Aeromonas hydrophila yang berumur 24 jam diencerkan dengan larutan NaCl fisiologis, kemudian dilihat kekeruhannya pada alat spektrofotometri dengan panjang gelombang 595 nm dan tingkat absorbansi 0,009 A sekitar 10-6 CFU/ml. Selanjutnya Aeromonas hydrophila disebar pada media Nutrient Agar sebanyak 100 μl. Media NA dilubangi dengan pangkal pipet Pasteur (diameter 6 mm), lubang tersebut kemudian ditetesi supernatan bakteri kandidat probiotik sebanyak 20 μl. Larutan kontrol yang digunakan adalah media MRS broth. Selanjutnya diinkubasi pada suhu 300C selama 24 jam. Setelah itu diukur zona
bening yang terbentuk menggunakan digital caliper pada 2 posisi dari setiap lubang, kemudian dirata-ratakan. Isolat bakteri yang memiliki ukuran zona hambat tertinggi dan terendah dipilih untuk dianalisis secara molekuler berdasarkan gen 16S rRNA.
3.4.5 Analisis molekuler gen 16S rRNA
Analisis molekuler gen 16S rRNA dimaksudkan untuk mengidentifikasi isolat bakteri yang memiliki ukuran zona hambat tertinggi dan terendah. Kegiatan ini membutuhkan beberapa tahapan untuk mendapatkan jenis bakteri yang memiliki aktivitas probiotik terbaik, tahapan tersebut diantaranya :
a. Kultur bakteri dengan menggunakan media cair
Sebelum melakukan isolasi DNA genom dari bakteri, dilakukan kultur cair pada media Nutrient Broth kemudian diinkubasi pada suhu 370C selama 24 jam, kegiatan ini dimaksudkan untuk memperbanyak jumlah bakteri.
b. Isolasi DNA genom bakteri
Isolasi DNA genom bakteri dimaksudkan untuk mendapatkan DNA murni bakteri. Metode yang digunakan adalah metode Wizard® Genomic DNA Purification Kit Protocol dari Promega yang diuraikan pada keterangan di bawah ini :
- Setelah bakteri hasil kultur cair (overnight culture) dalam medium Nutrient Broth siap, dilakukan pemindahan setiap kultur ke dalam tabung ependorf 1,5 ml dan dilakukan sentrifugasi selama 2 menit dengan kecepatan tinggi (13.000-16.000 x g) dengan microcentrifuge.
- Pellet DNA diambil dari hasil sentrifugasi.
- Larutan Resuspension Solution 480 μl EDTA 50 mM ditambahkan kedalam setiap tabung kemudian tabung ditutup dan dilakukan resuspensi menggunakan vortex.
- Larutan Lysis Solution sebanyak 120 μl Lysozyme ditambahkan ke dalam tabung lalu dicampurkan dengan cara membolak-balik tabung beberapa kali dan dibiarkan lysis selama 2-3 menit.
- Sampel diinkubasi pada suhu 370C selama 30-60 menit, kemudian disentrifuse selama 2 menit pada kecepatan 13.000-16.000 xg. Setelah itu diambil supernatannya.
- Larutan Neucleic Lysis Solution ditambahkan sebanyak 600 μl.
- Tabung diputar-balikan kembali secara lembut beberapa kali sehingga DNA bakteri tercampur.
- Sampel diinkubasi pada suhu 800C selama 5 menit untuk melisiskan sel, kemudian dinginkan pada suhu kamar.
- Sebanyak 3 μl RNase Solution ditambahkan, kemudian tabung diputar-balikan sebanyak 2-5 kali agar tercampur.
- Sampel diinkubasi pada suhu 370C selama 15-60 menit, kemudian dinginkan pada suhu kamar.
- Presipitasi sampel dengan menambahkan Protein Precipitation Solution sebanyak 200 μL, menghomogenkan menggunakan vortex berkecepatan tinggi selama 20 detik.
- Sampel diinkubasi di atas es selama 5 menit.
- Sampel disentrifugasi pada kecepatan 13.000-16.000 x g selama 3 menit. - Supernatan yang mengandung DNA bakteri dipindahkan ke dalam
microtube 1,5 ml steril yang sudah berisi Isopropanol sebanyak 600 μl (suhu ruang).
- Sampel dihomogenkan (secara perlahan) dengan cara inversi sampai terlihat benang-benang halus dalam sampel.
- Sampel disentrifugasi pada kecepatan 13.000-16.000 x g selama 2 menit. - Supernatan yang terbentuk dibuang dengan menuangkannya pada tissue
bersih, kemudian menambahkan 600 μl etanol 70% ke dalam microtube dan putar-balik secara perlahan untuk mencuci pellet DNA.
- Sampel disentrifugasi pada kecepatan 13.000-16.000 x g selama 2 menit. - Supernatan yang terbentuk kembali dibuang di atas tissue bersih,
kemudian kering udarakan pellet DNA selama 10-15 menit.
- Sebanyak 100μl larutan rehidrasi DNA ditambahkan ke dalam tabung dan dilakukan rehidrat DNA dengan menginkubasi pada 650C selama 1 jam,
atau rehidrat DNA dengan menginkubasi sampel selama semalam pada suhu kamar atau pada suhu 40C.
- Sampel DNA disimpan pada suhu -200C. c. Amplifikasi DNA dengan PCR
Amplifikasi gen pengkode 16S rRNA dilakukan dengan Polymerase Chain Reaction (PCR) untuk mendapatkan sekuen gen 16S rRNA yang akan digunakan sebagai bahan sekuensing untuk menentukan jenis bakteri. Proses amplifikasi mengikuti protokol produk Go Taq Green Master Mix dengan menset suhu predenaturasi dan denaturasi sebesar 950C, suhu annealing 550C dan suhu elongasi 72 0C menggunakan mesin Thermalcycler.
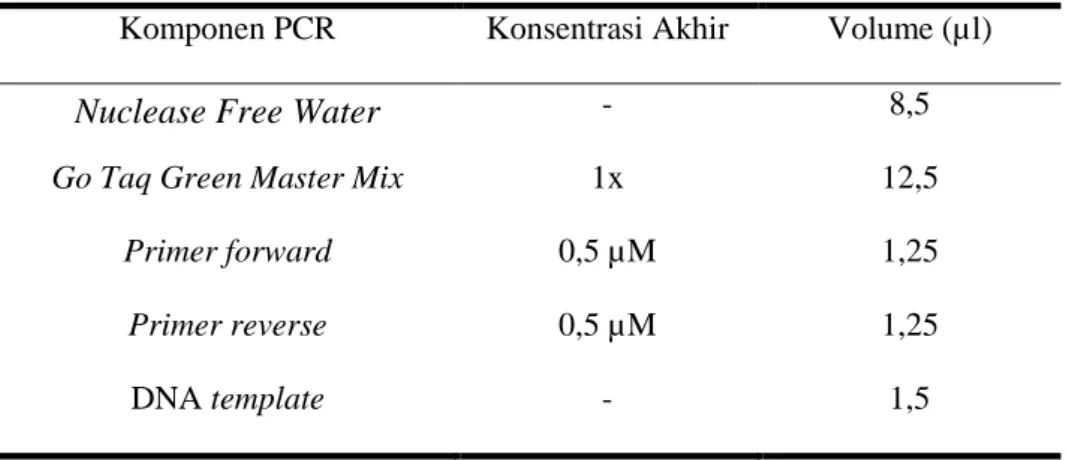
Komposisi reaksi PCR adalah Nuclease Free Water, Go Taq Green Master Mix, Primer 16S rRNA forward, Primer 16S rRNA reverse, DNA template dari isolat bakteri yang telah dimurnikan. Primer yang digunakan adalah primer 16S rRNA universal dengan urutan nukleotida sebagai berikut:
Tabel 1. Primer 16S rRNA Universal
Primer Urutan Nukleotida(5’-3’)
Forward primer Reverse primer
27f : 5’ AGAGTTTGATCCTGGCTCAG 3’ 1492r : 5’ GGTTACCTTGTTACGACTT 3’
Sumber : Tajabadi et al. (2012)
Tabel 2. Komponen Reaksi PCR4
Komponen PCR Konsentrasi Akhir Volume (µl)
Nuclease Free Water - 8,5
Go Taq Green Master Mix 1x 12,5
Primer forward 0,5 µM 1,25
Primer reverse 0,5 µM 1,25
DNA template - 1,5
4
Tabel 3. Pengaturan Program PCR5
Siklus Suhu Waktu Jumlah Siklus
Inisialisasi 95 C 2 menit 1 - Denaturasi - Annealing - Elongasi 95 C 55 C 72 C 2 menit 1 menit 2 menit 30
Final elongasi 72 C 7 menit 1
Final hold 4 C - 1
d. Elektroforesis
Elektroforesis digunakan untuk memisahkan ukuran DNA genom dengan menggunakan medan listrik. Setelah dilakukan kegiatan PCR, 3 μl DNA ditambahkan dengan 5 μl loading dying buffer pada 1.000 voltase selama 40 menit pada 1 % gel agarose dalam 0.5 x TBE. Sebagai marker digunakan 1 kb DNA (Geneaid) ladder. Gel kemudian diletakkan di dalam wadah ditambah lagi dengan TBE sampai terendam serta zat warna ethidium bromide (5 μl) direndam sambil terus digoyang selama 15 menit. Gel kemudian dilihat di bawah lampu UV Transilluminator (Mustopa 2009).
Proses elektroforesis produk amplifikasi, digunakan DNA Ladder 1 kb (Geneaid) terdiri dari fragmen mulai dari 200 sampai 10.000 bp (base pair) dengan fragmen. Amplifikasi PCR mengunakan primer 16S rRNA yang memiliki daerah target amplifikasi ~1.500 bp (base pair).
3.5 Analisis Data
Setelah mendapatkan data hasil kegiatan sekuensing, dilakukan analisis data penelitian dengan menggunakan perangkat bioinformatik kemudian dicocokan dengan data pada situs National Center for Biotechnology Information (NCBI), www.ncbi.nih.nlm.gov. Program Basic Local Alignment Search Tool (BLAST)
5
yang terdapat dalam situs akan mencocokan secara otomatis dengan Genbank®
sehingga isolat tersebut dapat diketahui jenisnya dengan mudah (Elrod and Stansfield 2002). Data yang telah diperoleh dari hasil penelitian kemudian dianalisis secara deskriptif.