RINGKASAN MATERI KELAS X
STRUKTUR ATOM
Disusun untuk memenuhi tugas mata kuliah Kimia Sekolah
Dosen pengampu: Khamidinal, S.Si., M.Si.
Disusun oleh:
1. Uswatun Hasanah
15670009
2. Sindi Rahmawati
15670016
3. Fatikah Giyana Cahyani
15670024
4. Veni Jumila Danin
15670032
5. Siti Daniar Sobriawati
15670042
6. Muhammad Muhibullah
15670049
UNIVERSITAS ISLAM NEGERI SUNAN KALIJAGA
YOGYAKARTA
2017
Tujuan Pembelajaran:1. Peserta didik dapat menjelaskan teori tentang atom
2. Peserta didik dapat menjelaskan struktur atom dan perkembangan model atom
3. Peserta didik dapat mengenal tanda atom
4. Peserta didik dapat menuliskan konfigurasi elektron
5. Peserta didik dapat menentukan konfigurasi elektron berdasarkan kulit, subkulit, dan gas mulia
A. Perkembangan Teori Atom 1. Model Atom Dalton
Pada tahun 1808 ilmuwan berkebangsaan Inggris, Jhon Dalton mengemukakan teorinya tentang materi atom yang dipublikasikan dalam
A New System of Chemical Philosophy. Teori nya memuat lima pernyataan:
a. Materi terdiri atas atom yang tidak dapat dibagi lagi.
b. Semua atom unsur kimia tertentu mempunyai massa yang sama begitu pula semua sifat lainnya.
c. Unsur kimia yang lain memiliki jenis atom yang berbeda.
d. Atom tidak dapat dihancurkan dan tidak dapat diubah selama reaksi kimia.
e. Suatu senyawa terbentuk dari unsur-unsurnya melalui penggabungan atom yang tidak sejenis dengan perbandingan yang sederhana.
Adapun kelebihan dari model atom Dalton adalah:
a. Dapat menerangkan Hukum Kekekalan Massa (Hukum Lavoisier). b. Dapat menerangkan Hukum Perbandingan Tetap (Hukum Proust). Sementara kelemahannya adalah:
a. Tidak dapat menerangkan sifat listrik atom.
b. Pada kenyataanya atom dapat dibagi lagi partikel yang lebih kecil lagi yang disebut partikel subatomik.
Gambar Model Atom Dalton (bola pejal)
Seorang fisikawan Inggris bernama Joseph John Thomson pada tahun 1897 menemukan elektron, yaitu suatu partikel bermuatan negatif yang lebih ringan daripada atom. Dia memperlihatkan bahwa elektron merupakan partikel subatomik. Atas penemuannya ini, Thomson mengemukakan hipotesis berikut: “Karena elektron bermuatan negatif, sedangkan atom bermuatan listrik netral, maka haruslah dalam atom ada muatan listrik positif yang mengimbangi muatan elektron tersebut”. Maka diusulkanlah suatu model yang dikenal dengan model atom roti kismis sebagai berikut:
a. Atom berbentuk bola pejal bermuatan positif yang homogen.
b. Elektron bermuatan negatif tersebar didalamnya (seperti kismis yang tersebar di dalam roti).
Kelebihan dari model atom Thomson yaitu:
a. Dapat menerangkan adanya partikel yang lebih kecil dari atom yang disebut partikel subatomik.
b. Dapat menerangkan sifat listrik atom.
Sementara kelemahan model atom Thomson adalah tidak dapat menerangkan fenomene penghamburan sinar alfa pada lempeng tipis emas.
Gambar Model Atom Thomson (roti kismis)
3. Model Atom Rutherford
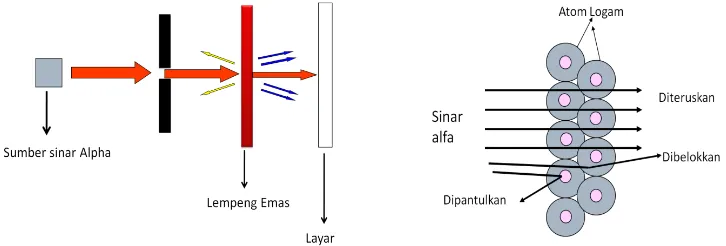
Tahun 1911, seorang fisikawan Inggris bernama Ernest Rutherford bersama temannya Goiger dan Mersden melakukan eksperimen yang dikenal dengan penghamburan sinar alfa oleh lempeng tipis emas.
Gambar Eksperimen Rutherford
Hasil dari eksperimen tersebut menunjukkan bahwa:
b. Sedikit dari pertikel alfa (yang bermuatan posisif) dibelokkan oleh sesuatu, hal ini menunjukkan adanya sesuatu yang bermuatan positif yang dapat membelokkan partikel alfa.
c. Sedikit dari partikel yang terpantul oleh emas, hal ini menunjukkan adanya sesuatu yang sangat kecil (belakangan disebut sebagai inti) namun massa terpusat di sana sehingga partikel yang menumbuk pusat massa itu akan terpantulkan.
Dari fenomena percobaan diatas, maka Rutherford mengusulkan suatu model yang disebut dengan Model Atom Nuklir Rutherford, sebagai berikut:
a. Atom terdiri dari dari inti atom bermuatan positif dan hampir seluruh massa atom terpusat pada inti.
b. Elektron beredar mengelilingi inti.
c. Jumlah muatan inti sama dengan jumlah muatan elektron, sehingga atom bersifat netral.
d. Sebagian ruangan dalam atom merupakan ruangan kosong. Kelebihan model atom Rutherford:
a. Dapat menerangkan fenomena penghamburan sinar alfaoleh lempeng tipis emas.
b. Mengemukakan keberadaan intu atom.
Sementara kelemahannya adalah bertentangan dengan teori elektrodinamika klasik, dimana suatu partikel yang bermuatan listrik apabila bergerak akan memancarkan energi. Elektron yang beredar mengelilingi inti akan kehilangan energi terus menerus, sehingga akhirnya akan membentuk lintasan spiral dan jatuh ke inti.
Gambar Model Atom Rutherford
4. Model Atom Niels Bohr
Tahun 1913, pakar fisika Denmark bernama Niels Bohr menyempurnakan model atom Rutherford. Berdasarkan hasil pengamatan pada spektrum atom hidrogen yang berbentuk garis, Bohr menyusun model atom sebagai berikut:
a. Atom terdiri atas inti atom yang mengandung proton bermuatan positif dan elektron bermuatan negatif yang mengelilingi inti atom.
b. Elektron-elektron yang mengelilingi inti atom tidak memancarkan energi dan berada pada tingkat energi tertentu yang bergerak secara stasioner.
energi tinggi, maka elektron akan menyerap energi, peristiwa ini disebut eksitasi. Sebaliknya disebut deeksitasi.
d. Elektron dapat berpindah dari lintasan yang satu ke intasan yang lain dengan menyerap atau melepaskan energi. Energi yang dipancarkan atau diserap ketika terjadi transisi elektron terekam sebagai spektrum atom.
Kelebihan model atom Bohr:
a. Mengaplikasikan teori kuantum untuk menjawab kesulitan dalam model atom rutherford.
b. Menerangkan dengan jelas garis spektrum pancaran (emisi) atau serapan (absorpsi) dari atom hidrogen.
Kelemahan model atom Bohr:
a. Tidak berlaku pada atom berelektron banyak. Teori ini hanya mampu menjelaskan spektrum atom hidrogen tetapi tidak mampu menjelaskan spektrum atom yang lebih kompleks. Terjadi penyimpangan untuk atom yang lebih besar dari hidrogen.
b. Tidak dapat menerangkan efek Zeeman, yaitu spektrum atom yang lebih rumit bila atom ditempatkan pada medan magnet.
c. Orbit/kulit elektron mengelilingi inti atom bukan berbentuk lingkaran melainkan berbentuk elips.
Model Atom Niels Bohr
5. Model Atom Mekanika Kuantum
Tahun 1920 beberapa ahli fisika menemukan teori atom modern disebut juga teori atom mekanika kuantum. Menurut model atom mekanika kuantum, elektron dalam atom memiliki sifat partikel dan sifat gelombang. Model atom ini dikemukakan juga oleh Heisenberg yang dikenal sebagai asas ketidakpastian Heisenberg yaitu tidak mungkin dapat mengetahui pada waktu bersamaan baik momentum maupun posisi dengan tepat suatu partikel, seperti elektron. Daerah di sekitar inti atom dengan kebolehjadian untuk mendapatkan elektron disebut orbital. Asumsi dari model atom mekanika kuantum:
a. Elektron dalam mengelilingi inti bergerak seperti gelombang.
b. Karena gerak gelombang dari elektron ini maka kedudukan elektron di sekeliling inti menjadi tak tentu (asas ketidakpastian)
Model Atom Mekanika Kuantum
Prinsip Ketidakpastian Heisenberg:
Menurut Heisenberg: elektron yang bergerak menimbulkan perubahan dalam posisi dan momentum setiap saat sehingga posisi dan kecepatan elektron yang bergerak secara bersama-sama tidak dapat dilakukan secara tepat.
Prinsip ketidakpastian Heisenberg: keberadaan elektron dalam lintasan tidak dapat ditentukan dengan pasti, yang dapat ditemui hanyalah kebolehjadian ditemukannya elektron.
B. Tanda Atom
Atom tersusun dari pertikel-partikel subatom yaitu: elektron, proton, dan neutron. Setiap atom dapat diidentifikasi berdasarkan jumlah proton dan neutron yang dikandungnya.
1. Nomor Atom
Nomor atom adalah jumlah proton dalam inti atom. Proton merupakan partikel khas penyusun atom. Artinya tiap atom akan mempunyai jumlah proton yang berbeda dengan atom lain. Bila atom-atom diurutkan berdasarkan jumlah protonnya, maka atom hidrogen memiliki nomor 1 karena memiliki sebuah proton, helium nomor 2 karena memiliki dua buah proton, dan seterusnya. Jumlah proton yang terdapat dalam inti atom disebut nomor atom(Z).
Z = n
Z = nomor atom n = Jumlah proton Contoh:
Nomor atom nitrogen adalah 7; berarti setiap atom netral nitrogen memiliki 7 proton dan 7 elektron.
2. Nomor Massa
Massa atom merupakan massa dari seluruh partikel penyusun atom. Oleh karena sangat kecil, maka massa elektron dapat diabaikan sehingga massa atom sangat dianggap merupakan jumlah massa proton dan
neutron saja. Jumlah proton dan neutron disebut sebagai nomor massa
(A) dari suatu atom. Kecuali hidrogen, semua atom mempunyai neutron.
A = p+n
A= nomor massa p= jumlah proton
Contoh: nomor massa fluorin adalah 19 dan nomor atomnya adalah 9; berarti 19 – 9 = 10. Jadi jumlah neutron dalam inti adalah 10.
3. Penulisan Tanda Atom/ Lambang Atom
X = lambang atom A = nomor massa Z = nomor atom
Berikut contoh penerapannya pada atom netral
Dapat diketahui bahwa unsur Al mempunyai nomor massa = 27 dan nomor
atom = 13. Bagaimana cara menentukan jumlah elekktron, proton, dan neutron berdasarkan nomor atom dan nomor massa tersebut? Jawab : e= 13, p=13, dan n= 27-13=14.
Ion Positif = melepas elektron sebanyak muatan positif Ion negatif = menarik elektron sebanyak muatan negatif
4. Isotop, Isobar, dan Isoton
a. Isotop, adalah unsur-unsur yang nomor atomnya sama, tetapi nomor massa berbeda.
b. Isobar, adalah unsur-unsur yang nomor atomnya berbeda, tetapi nomor massanya sama.
c. Isoton, adalah unsur-unsur yang nomor atom dan nomor massanya berbeda, tetapi jumlah neutronnya sama.
C. Bilangan Kuantum
Bilangan kuantum adalah bilangan yang menentukan letak keberadaan elektron pada kulit atom. Ada 4 bilangan kuantum, yaitu:
a. Bilangan Kuantum Utama
Utama (n) menyatakan kulit atom/tingkat energi. n = 1 → kulit K
n = 2
→
kulit L n = 3 → kulit M n = 4→
kulit N, dstb. Bilangan Kuantum Azimuth
Azimuth ( l ) menyatakan subkulit atom (n > l ). Harga bilangan
kuantum azimuth ( l )=0 sampai dengan (n-1).
l
= 0→
subkulit sl = 1 → subkulit p
l
= 2→
subkulit dBilangan kuantum ini menunjukkan di subkulit (sublintasan) mana elektron bergerak dan juga menentukan bentuk orbital
subkulit l = 0 juga disebut orbital s (sharp) subkulit
l
= 1 juga disebut orbital p (principle) subkulit l = 2 juga disebut orbital d (diffuse) subkulitl
= 3 juga disebut orbital f (fundamental)Setiap kulit mempunyai subkulit sesuai nomor kulitnya, misalnya : n = 1 (kulit K) mempunyai harga l = 0,... (1-1) = 0
Kulit ke-1 (K) mempunyai subkulit, yaitu subkulit
l
= 0 atau orbital 1sn = 2 (kulit L) mempunyai harga l = 0,... (2-1) = 0, 1
Kulit ke-2 (L) mempunyai subkulit, yaitu subkulit
l
= 0 atau orbital 2s dan subkulitl
=1 atau orbital 2pc. Bilangan Kuantum Magnetik (m)
Magnetik (m) menyatakan posisi orbital dalam subkulit
l = 0 → m = 0
l
= 1→
m = -1, 0, +1l = 2 → m = -2, -1, 0, +1, +2
d. Bilangan Kuantum Spin (s)
Spin (s) menyatakan arah rotasi elektron dalam orbital. Dalam setiap orbital berisi maksimum 2 elektron dengan arah spin yang berlawanan, yaitu searah jarum jam / ke atas (+½) dan berlawanan arah jarum jam / ke bawah (-½).
1. Bentuk-bentuk Orbital
Orbital pada suatu subkulit mempunyai bentuk tertentu yang
bergantung pada bilangan kuantum azimuth ( l ).
a. Orbital s
Orbital s berbentuk bola dengan arah ruang yang sama ke seluruh sudut. Orbital 1s, 2s, dan 3s.
b. Orbital p
Orbital p dengan nilai m = -1, 0, +1, mempunyai 3 kemungkinan orientasi dalam ruang yang masing-masing terletak pada koordinat Cartesius X, Y, dan Z sehingga dapat dibedakan menjadi px, py, dan pz.
c. Orbital d dan f
Orbital d dengan nilai m = -2, -1, 0, +1, +2, mempunyai 5 kemungkinan orientasi dalam ruang yaitu dx2- y2, dz2, dxy, dxz, dan dyz.
D. Konfigurasi Elektron 1. Berdasarkan Kulit
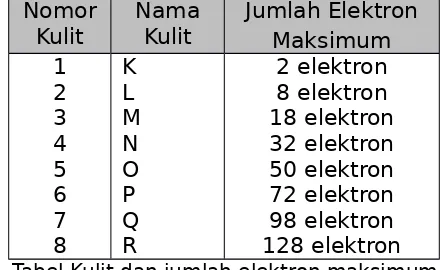
Konfigurasi elektron adalah susunan elektron pada masing-masing kulit. Menurut model atom Neils Bohr, elektron-elektron mengelilingi inti pada lintasan-lintasan tertentu yang disebut kulit elektron atau tingkat energi. Lintasan elektron yang terletak paling dekat dengan inti memiliki energi yang paling rendah. Semakin jauh lintasan elektron, semakin tinggi tingkat energinya. Lintasan tersebut disebut juga sebagai kulit elektron dimana kulit yang paling dekat dengan inti diberi lambang K, kulit kedua L, kulit ketiga M, dan seterusnya. Aturan pengisian elektron, yaitu:
a. Pengisian elektron dimulai pada kulit K, kemudian kulit L, M, N dan seterusnya.
b. Jumlah maksimum elektron pada kulit ke-n adalah 2n (n = nomor kulit).2 a. Jumlah maksimum elektron pada kulit K ( n = 1) = 2 x 12 = 2
elektron.
b. Jumlah maksimum elektron pada kulit L ( n = 2) = 2 x 22 = 8
elektron, dan seterusnya.
c. Jumlah maksimum elektron pada kulit terluar adalah 8.
Gambar Model atom Bohr Nomor Kulit
Tabel Kulit dan jumlah elektron maksimum
Jumlah elektron yang ditemukan dalam setiap kulit elektron tidaklah sama. Daerah dengan kemungkinan terbesar menemukan elektron disebut
orbital.
Rumus praktis aturan konfigurasi elektron :
a. Nomor atom 1-20
a. Menggunakan rumus: 2 8 8 2
b. Contoh: 126C: 2 4 dan 39
19K : 2 8 8 1
b. Nomor atom 21-30
a. Menggunakan rumus: 2 8 18 2
b. Pengisian: 2 8 ... 2 baru sisanya diletakkan di depan angka 2.
c. Contoh: 2145Sc : 2 8 9 2
c. Nomor atom 31-36
b. Contoh: 8035Br : 2 8 18 7
d. Nomor atom 37-38
a. Menggunakan rumus: 2 8 18 8 2
b. Contoh:8838Sr : 2 8 18 8 2
e. Nomor atom 39-48
a. Menggunakan rumus: 2 8 18 18 2
b. Pengisian: 2 8 18 ... 2 baru sisanya diletakkan di depan angka 2.
c. Contoh:10847Ag: 2 8 18 17 2
f. Nomor atom 49-54
a. Menggunakan rumus: 2 8 18 18 8
b. Contoh: 12753I : 2 8 18 18 7
Dari susunan (konfigurasi) elektron tersebut, dapat diketahui jumlah kulit yang dimiliki oleh suatu atom serta jumlah elektron pada msing-masing kulit. Jumlah elektron yang menempati kulit terluar disebut
elektron valensi. Contohnya, elektron valensi 19K = 2 8 8 1 adalah 1
dan elektron valensi 15P = 2 8 5 adalah 5.
Latihan soal !
Buatlah konfigurasi elektron dari atom-atom dibawah ini berdasarkan kulit elektron atau tingkat energi !
1. 11Na
Konfigurasi elektron adalah khas untuk suatu atom. Sebagai contoh, walaupun sama-sama subkulit 1s tetapi tingkat energi dari subkulit 1s
untuk atom natrium tidak sama dengan tingkat energi 1s untuk atom magnesium. Meskipun demikian, terdapat suatu aturan yang bersifat umum dalam memperkirakan penataan elektron dalam suatu atom.
a. Aturan Aufbau (Membangun)
Prinsip: elektron dalam suatu atom akan berada dalam kondisi yang stabil bila mempunyai energi yang rendah, sedangkan elektron-elektron akan berada orbital-orbital yang bergabung membentuk subkulit.
Jadi, elektron mempunyai kecenderungan untuk menempati subkulit yang tingkat energinya rendah.
Tabel Nilai (n + l) dan tingkat energi subkulit
Berdasarkan tabel tersebut, maka urutan tingkat energi dari yang palimg rendah ke yang paling tinggi adalah sebagai berikut.
1s < 2s < 3s < 3p < 4s < 3d < 4p < 4d < 5s <, .... dan seterusnya. Cara lain untuk mengetahui urutan tingkat energi adalah dengan menggunakan deret pancaran cahaya, sebagai berikut :
Gambar Kenaikan tingkat energi
b. Larangan Pauli
“tidak boleh ada dua atom yang memiliki keempat bilangan kuantum
yang sama”. Artinya apabila orbital yang sama akan mempunyai bilangan kuantum n, l, dan m yang sama, namun bilangan kuantum spin (s) yang akan membedakan. Jadi, setiap orbital hanya dapat berisi 2 elektron dengan spin (arah putar) yang berlawanan.
Sehingga adanya larangan Pauli ini, menyebabkan elektron yang dapat menempati suatu subkulit terbatas hanya dua kali dari jumlah orbitalnya. Dengan demikian, jumlah maksimum elektron adalahsebagai berikut:
a. Subkulit s terdiri dari 1 orbital, dapat ditempati maksimum 2 elektron.
b. Subkulit p terdiri dari 3 orbital, dapat ditempati maksimum 6 elektron.
c. Subkulit d terdiri dari 5 orbital, dapat ditempati maksimum 10 elektron.
d. Subkulit f terdiri dari 7 orbital, dapat ditempati maksimum 14 elektron.
Dengan demikian dua aturan tersebut dapat digambarkan konfigurasi elektron dari suatu atom.
Contoh:
a. 21Sc :
2 2 6 2 6 2 1
1s 2s 2p 3s 3p 4s 3d
b. 25Mn :
2 2 6 2 6 2 5
1s 2s 2p 3s 3p 4s 3d
Latihan soal !
Buatlah konfigurasi elektron dari atom-atom dibawah ini ! 1. 11Na
2. 14Si
3. 20Ca
4. 26Fe
5. 31Ga
6. 36Kr
7. 37Rb
8. 40Zr
9. 43Tc
3. Konfigurasi dengan Notasi Gas Mulia
Atom dengan banyak elektron, memiliki notasi yang sangat panjang. Gas mulia (2 He, 10 Ne, 18 Ar, 36 Kr, 54 Xe, dan 86 Rn) bisa digunakan untuk
mewakili notasi tertentu. Kaidah ini sangat berguna untuk membantu memahami konfigurasi elektron yang panjang.
Contoh: 12Mg
Gas mulia terdekat sebelumnya adalah
Maka konfigurasinya dapat disingkat
4. Aturan Hund
Atruan ini mengikat bahwa:
Proses pengisian elektron ke dalam orbital pertama kali akan mengisi semua orbital dengan tingkat energi yang sama terlebih dahulu sebelum memasangkan dengan elektron lain di orbital yang setengah penuh.
Jadi tidak boleh mengisi langsung dua elektron pada satu orbital yang sama. Diagram orbital adalah cara visual untuk merekonstruksi konfigurasi dengan menunjukkan masing-masing orbital secara terpisah berikut putaran elektronnya menggunakan kotak dan tanda panah (↿).
Contoh:
Konfigurasi elektron pada unsur Nitrogen (Z=7) adalah 1s2 2s2 2p3 maka pengisian elektron pada orbitalnya yang tepat adalah
5. Orbital penuh dan setengah penuh
6. Konfigurasi Ion
Unsur yang mengalami ionisasi akan mengalami perubahan jumlah elektron. Misalnya adalah besi (Fe) yang mempunyai nomor atom 26 dan mempunyai konfigurasi elektron [Ar] 3d64s2. Jika Fe terionisasi menjadi
Fe2+, maka elektron Fe berkurang 2 dari jumlah asal. Sehingga konfigurasi
Fe2+ adalah [Ar] 3d6.
DAFTAR PUSTAKA
Haniah, Munnal. (2010). Intisari dan Kumpulan Rumus Kimia Untuk SMA Kelas X.
Yogyakarta: Tunas Publishing.
Kamaludin, Agus & Suprihatiningrum Jamil. (2010). Soal dan Penyelesaian Uji Kompetensi Kimia. Yogyakarta: Pusaka Pelajar.
Sudarmo, Unggul. (2016). Kimia Untuk SMA/MA Kelas X Kelompok Peminatan Matematika dan Ilmu-Ilmu Alam. Jakarta: Erlangga.
NAMA : NIM :
LATIHAN SOAL STRUKTUR ATOM
Selesaikanlah soal-soal di bawah ini dengan benar!
1. Reaksi kimia merupakan
pemisahan, penggabungan, atau penyusunan kembali atom-atom, sehingga atom tidak bisa dibuat atau dimusnahkan. Teori ini dikemukakan oleh ....
A. Dalton D.
Rutherford
B. Thomson E. Max Planck
C. Niels Bohr
2. Kulit-kulit atom bukan merupakan kedudukan yang pasti dari suatu elektron, melainkan hanyalah suatu kebolehjadian elektron. Pernyataan ini dikemukakan oleh ....
A. Heisenberg D. J.J Thomson B. Niels bohr E. Goldstein C. Rutherford
3. Elektron dapat berpindah dari suatu lintasan ke lintasan yang lain sambil menyerap atau memancarkan energi. Teori ini merupakan penyempurnaan teori
atom Rutherford yang
dikemukakan oleh ....
A. Becquerel D. Rontgen
B. Bohr E. Thomson
C. Dalton
4. Kelemahan model atom
Rutherford adalah ....
A. Tidak dapat menerangkan alasan elektron tidak jatuh ke dalam inti
B. Atom merupakan bola
beronggga yang terdiri atas proton
C. Elektron Bergerak mengitari inti dengan menyerap energi D. Tidak dapat menggambarkan
letak dan lintasan elektron
E. Jarak elektron dengan inti terlalu jauh sehingga tidak ada gaya gravitasi
5. Rutherford mengemukakan bahwa di dalam atom terdapat inti atom yang bermuatan positif. Hasil tersebut diperoleh setelah melakukan percobaan dengan ....
A. Belum menggambarkan letak dan lintasan elektron dalam
7. Pernyataan yang tepat mengenai atom dan partikel penyusun atom adalah ....
A. Neutron terdapat pada kulit
atom dan bergerak
mengelilingi proton
C. Neutron terletak pada inti atom dan bergerak bersama elekron
D. Jumlah proton pada setiap atom lebih banyak dari jumlah elektronnya
E. Elektron bermuatan negatif dan tersebar dalam kulit-kulit sebab inti atom mengandung .... A. Hanya neutron
B. Proton dan neutron
C. Elektron lebih sedikit daripada neutron
B. Nomor massa E. Lintasan
atom
12.Atom Cl mempunyai nomor atom 17 dan nomor massa 35, maka
B. Tingkat energi elektron dalam atom
C. Kecepatan pergerakan elektron D. Kedudukan elektron terhadap
elektron lain
E. Keadaan elektron tereksitasi 14.Unsur dalam keadaan dasar
memiliki konfigurasi elektron 1s2
2s2 2p6 3s2 3p6 3d8 4s2. Elektron
terakhir memiliki bilangan
kuantum....
D. n = 3; l = 1; m = 0; s = -E. Kedudukan elektron tehadap
elektron lain
19.Kulit M dalam konfigurasi elektron akan terisi penuh ....
A. 2 elektron D. 32 elektron
B. 8 elektron E. 50 elektron C. 18 elektron
23.Suatu atom X mempunyai nomor massa 39 dan jumlah neutron 20. Maka atom itu mempunyai terluarnya mempunyai elektron valensi terbanyak adalah ....
25.Suatu unsur dengan nomor atom 9 akan mempunyai ....
D. Tujuh kulit elektron dan tujuh elektron valensi
E. Tiga kulit elektron dan dua elektron valensi
26.Suatu unsur Z mempunyai 3 kulit atom dan 5 elektron valensi. Nomor atom unsur itu adalah ....
A. 3 D. 10
B. 5 E. 15
C. 8
27.Unsur 3919K mempunyai konfigurasi
elektron ....
A. 2 8 8 1 D. 2 6 8 3
B. 2 8 9 E. 2 2 8 7
28.Unsur 5525Mn mempunyai
konfigurasi elektron ....
A. 2 8 8 7 D. 2 6 8 9
B. 2 8 15 E. 2 2 8 8 5
C. 2 8 13 2
29.Suatu unsur X mempunyai massa atom 31 dan neutron 16. Konfigurasi elektron unsur tersebut yang benar adalah ....
A. 1s 2s 2p 3s 3p 4s 3d 4p2 2 6 2 6 2 10 1 kulit terluarnya mempunyai elektron paling banyak adalah ....
A. 4Be D. 12Mg
diagram orbital yang paling tepat untuk elektron terakhir dari
34.Konfigurasi elektron yang benar untuk 24 Cr adalah ....