Sifat Periodik Unsur
Kata Kunci: Afinitas Elektron, energi ionisasi, Jari-jari Atom, keelektronegatifan
Ditulis oleh Ratna dkk pada 14-04-2009
Sifat yang berubah secara beraturan menurut kenaikan nomor atom dari kiri ke kanan dalam satu periode dan dari atas ke bawah dalam satu golongan disebut sifat periodik. Sifat periodik
meliputi jari-jari atom, energi ionisasi, afinitas electron dan keelektronegatifan.
Jari-jari Atom
Jari-jari atom adalah jarak elektron di kulit terluar dari inti atom. Jari-jari atom sulit untuk ditentukan apabila unsur berdiri sendiri tanpa bersenyawa dengan unsur lain. Jari-jari atom secara lazim ditentukan dengan mengukur jarak dua inti atom yang identik yang terikat secara kovalen. Pada penentuan jari-jari atom ini, jari- jari kovalen adalah setengah jarak antara inti dua atom identik yang terikat secara kovalen.
Penentuan jari-jari atom
Kurva hubungan jari-jari atom dengan nomor atom memperlihatkan bahwa jari-jari atom dalam satu golongan akan semakin besar dari atas ke bawah. Hal ini terjadi karena dari atas ke bawah jumlah kulit bertambah sehingga jari-jari atom juga bertambah.
Jari-jari atom unsur
Unsur-unsur dalam satu periode (dari kiri ke kanan) berjumlah kulit sama tetapi jumlah proton bertambah sehingga jari-jari atom juga berubah. Karena jumlah proton bertambah maka muatan inti juga bertambah yang mengakibatkan gaya tarik menarik antara inti dengan elektron pada kulit terluar semakin kuat. Kekuatan gaya tarik yang semakin meningkat menyebabkan jari-jari atom semakin kecil. Sehingga untuk unsur dalam satu periode, jari-jari atom semakin kecil dari kiri ke kanan.
Jari-jari ion digambarkan sebagai berikut:
Perbandingan jari-jari atom dengan jari-jari ion
Energi minimum yang dibutuhkan untuk melepas elektron atom netral dalam wujud gas pada kulit terluar dan terikat paling lemah disebut energi ionisasi. Nomor atom dan jari-jari atom mempengaruhi besarnya energi ionisasi. Semakin besar jari-jari atom maka gaya tarik antara inti dengan elektron pada kulit terluar semakin lemah. Hal ini berarti elektron pada kulit terluar semakin mudah lepas dan energi yang dibutuhkan untuk melepaskan elektron tersebut semakin kecil. Akibatnya, dalam satu golongan, energi ionisasi semakin kecil dari atas ke bawah. Sedagkan dalam satu periode, energi ionisasi semakin besar dari kiri ke kanan. Hal ini
disebabkan dari kiri ke kanan muatan iti semakin besar yang mengakibatkan gaya tarik antara inti dengan elektron terluar semakin besar sehingga dibutuhkan energi yang besar pula untuk melepaskan elektron pada kulit terluar.
Energi ionisasi
Hubungan energi ionisasi dengan nomor atom
Kurva tersebut menunjukkan unsur golongan 8A berada di puncak grafik yang mengindikasikan bahwa energi ionisasinya besar. Hal sebaliknya terjadi untuk unsur golongan 1A yang berada di dasar kurva yang menunjukkan bahwa energi ionisasinya kecil. Atom suatu unsur dapat
Afinitas Elektron
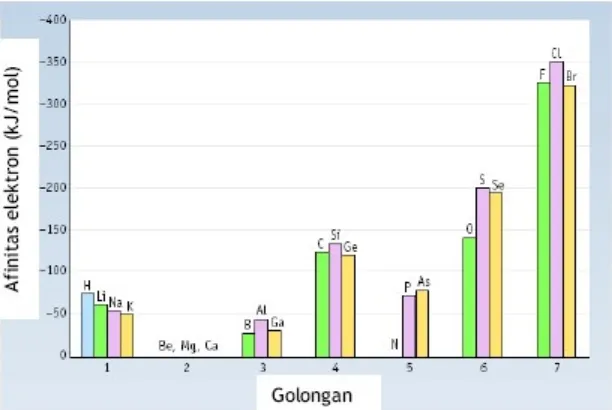
Afinitas elektron merupakan enegi yang dilepaskan atau diserap oleh atom netral dalam bentuk gas apabila terjadi penangkapan satu elektron yang ditempatkan pada kulit terluarnya dan atom menjadi ion negatif. Afinitas elektron dapat berharga positif dan negatif. Afinitas elektron berharga negatif apabila dalam proses penangkapan satu elektron, energi dilepaskan. Ion negatif yang terbentuk akibat proses tersebut bersifat stabil. Hal sebaliknya terjadi apabila dalam proses penangkapan satu elektron, energi diserap. Penyerapan energi menyebabkan ion yang terbentuk bersifat tidak stabil. Semakin negatif harga afinitas lektron suatu atom unsur maka ion yang ter bentuk semakin stabil.
Afinitas elektron golongan 1, 2, 3, 4, 5, 6 dan 7
Gambar menunjukkan bahwa atom unsur golongan 2A dan 8A mempunyai afinitas elektron yang berharga positif. Hal ini mengindikasikan bahwa unsur golongan 2A dan 8A sulit menerima elektron. Afinitas elektron terbesar dimiliki oleh unsur golongan halogen karena unsur golongan ini paling mudah menangkap elektron. Jadi secara umum dapat dikatakan bahwa afinitas
elektron, dalam satu periode, dari kiri ke kanan semakin negatif dan dalam satu golongan dari atas ke bawah, semakin positif.
Keelektronegatifan
Elektronegatifitas
Keelektronegatifan skala Pauling