TOKSISITAS MERKURI
HIDUP, PERTUMBUHAN, GAMBARAN DARAH DAN KERUSAKAN ORGAN PADA
DEPARTEMEN
FAKULTAS PERIKANAN DAN ILMU KELAUTAN
TOKSISITAS MERKURI (Hg) TERHADAP TINGKAT KELANGSUNGAN PERTUMBUHAN, GAMBARAN DARAH DAN KERUSAKAN
ORGAN PADA IKAN NILA Oreochromis niloticus
VIKA YUNIAR
DEPARTEMEN BUDIDAYA PERAIRAN
FAKULTAS PERIKANAN DAN ILMU KELAUTAN
INSTITUT PERTANIAN BOGOR
2009
TINGKAT KELANGSUNGAN PERTUMBUHAN, GAMBARAN DARAH DAN KERUSAKAN
Oreochromis niloticus
PERNYATAAN MENGENAI SKRIPSI DAN SUMBER
INFORMASI
Dengan ini saya menyatakan bahwa Skripsi yang berjudul:
TOKSISITAS MERKURI (Hg) TERHADAP TINGKAT
KELANGSUNGAN HIDUP, PERTUMBUHAN, GAMBARAN DARAH DAN KERUSAKAN ORGAN PADA IKAN NILA Oreochromis niloticus
Adalah benar merupakan hasil karya yang belum diajukan dalam bentuk apa pun kepada perguruan tinggi mana pun. Semua sumber data dan informasi yang berasal atau dikutip dari karya yang diterbitkan maupun tidak diterbitkan dari penulis laintelah disebutkan dalam teks dan dicantumkan dalam Daftar Pustaka di bagian akhir Skripsi ini.
Bogor, November 2009
VIKA YUNIAR C14052363
RINGKASAN
VIKA YUNIAR
.
Toksisitas Merkuri (Hg) Terhadap Tingkat Kelangsungan Hidup, Pertumbuhan, Gambaran Darah dan Kerusakan Organ pada Ikan NilaOreochromis niloticus. Dibimbing olehKUKUH NIRMALA
.
Masalah pencemaran lingkungan terutama masalah pencemaran air mendapat perhatian yang besar dari pemerintah, karena air merupakan salah satu unsur penting bagi makhluk hidup dan kehidupan. Sejalan dengan meningkatnya industrialisasi, konsentrasi unsur logam berat di dalam perairan juga meningkat, sehingga memungkinkan tercapainya tingkat konsentrasi toksik bagi kehidupan akuatik. Salah satu logam berat yang terus meningkat konsentrasinya adalah Merkuri. Merkuri masuk ke dalam jaringan tubuh makhluk hidup melalui beberapa jalan, yaitu saluran pernapasan, pencernaan dan penetrasi melalui kulit. Merkuri yang masuk dalam tubuh organisme air tidak dapat dicerna, dan merkuri dapat larut dalam lemak. Logam yang larut dalam lemak mampu untuk melakukan penetrasi pada membran sel, sehingga akhirnya ion-ion logam merkuri akan menumpuk (terakumulasi) di dalam sel dan organ-organ lain. Akumulasi terbesar terdapat pada hati dan ginjal.
Salah satu jenis hewan yang direkomendasikan oleh EPA (Environmental
Protection Agency) sebagai hewan uji adalahOreochromis niloticus, karena ikan
tersebut memenuhi persyaratan yaitu penyebarannya cukup luas, banyak dibudidayakan, mempunyai kemampuan yang tinggi dalam mentolerir lingkungan yang buruk dan mudah dipelihara di laboratorium. Dalam kondisi normal, ikan berinteraksi dengan lingkungannya. Aspek yang sangat penting akibat dari adanya perubahan lingkungan yaitu melalui gambaran darah dan pengamatan jaringan dari insang, hati dan ginjal yang terganggu karena kedua indikator tersebut menggambarkan suatu perubahan sejalan dengan perubahan yang terjadi pada sistem lingkungan.
Ikan nila Oreochromis niloticus yang diperiksa berjumlah 12 ekor sesuai dengan banyaknya perlakuan dan ulangan. Setiap ikan diukur dan dicatat panjang dan bobotnya serta diambil darahnya dibawah tulang vertebrae. Setelah itu ikan diambil organ insang, hati dan ginjal untuk dibuat preparat histologi. Data tingkat kelangsungan hidup, pertumbuhan dan gambaran darah dianalisis dengan metode RAL kemudian di uji lanjut dengan menggunakan uji Duncan. Sedangkan pada hasil kerusakan jaringan dianalisis secara deskriptif.
Hasil penelitian ini menunjukkan bahwa semakin tinggi tingkat konsentrasi merkuri, maka semakin rendah tingkat kelangsungan hidup dan pertumbuhan. Merkuri berpengaruh terhadap struktur mikroanatomi insang, hati dan ginjal serta gambaran darah ikan nila (Oreochromis niloticus). Insang ikan nila mengalami hipertropi, hiperplasia, hemoragi, tengaliaktasis, deskuamasi dan edema. Sedangkan pada hati dan ginjal ikan nila terjadi kongesti hingga nekrosis. Hipertropi dan hiperplasia merupakan jenis kerusakan akibat bertambahnya ukuran dan komponen dalam jaringan atau sel. Hemoragi, kongesti, tengaliektasis dan edema merupakan gangguan akibat terganggunya sirkulasi darah. Nekrosis merupakan kelainan akibat adanya gangguan pada metabolisme tubuh, sedangkan deskuamasi dan edema merupakan hancurnya bentuk – bentuk lamella insang
akibat dari renggangnya jaringan epitel sehingga tidak berbentuk lagi. Kerusakan jaringan ini, termasuk dalam tingkatan ringan sampai sedang.
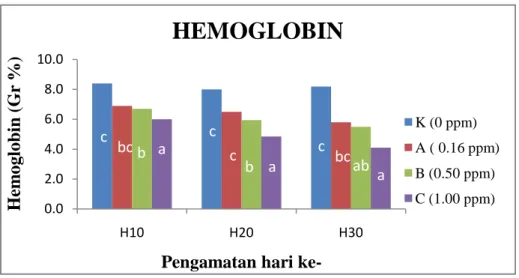
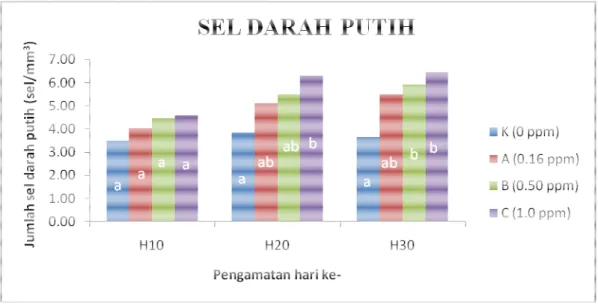
Adanya paparan Hg pada media tempat hidup ikan mengakibatkan terjadinya anemia pada ikan sehingga nilai hematokrit, hemoglobin dan eritrosit pada masing-masing perlakuan cenderung menurun. Namun, jumlah sel darah putih cenderung meningkat. Meningkatnya sel darah putih tersebut dikarenakan ikan nila meningkatkan respon imun dan ikan dapat mempertahankan diri terhadap pengaruh paparan Hg.
TOKSISITAS MERKURI (Hg) TERHADAP TINGKAT KELANGSUNGAN HIDUP, PERTUMBUHAN, GAMBARAN DARAH DAN KERUSAKAN
ORGAN PADA IKAN NILA Oreochromis niloticus
VIKA YUNIAR
SKRIPSI
Sebagai salah satu syarat untuk memperoleh gelar Sarjana Perikanan pada Fakultas Perikanan dan Ilmu Kelautan
Institut Pertanian Bogor
DEPARTEMEN BUDIDAYA PERAIRAN
FAKULTAS PERIKANAN DAN ILMU KELAUTAN
INSTITUT PERTANIAN BOGOR
2009
Judul Skripsi : Toksisitas Merkuri (Hg) Terhadap Tingkat Kelangsungan Hidup, Pertumbuhan, Gambaran Darah dan Kerusakan Organ Pada Ikan Nila Oreochromis niloticus
Nama Mahasiswa : Vika Yuniar Nomor Pokok : C14052363 Disetujui, Pembimbing I Dr. Kukuh Nirmala NIP. 196106251987031001 Mengetahui
Dekan Fakultas Perikanan dan Ilmu Kelautan
Prof. Dr. Indra Jaya, M. Sc NIP 196104101986011002
DAFTAR ISI
Halaman
DAFTAR TABEL……….. i
DAFTAR GAMBAR………... ii DAFTAR LAMPIRAN……… iii
I. PENDAHULUAN………....
1.1Latar Belakang………. 1.2Tujuan………..
.
II. TINJAUAN PUSTAKA………..…....
2.1Karakteristik logam berat………. 2.2Kandungan logam berat dalam air………... 2.3Logam Berat Merkuri………... 2.4Toksisitas Merkuri Terhadap Organisme………. 2.5Histologi………..………... 2.5.1 Jaringan Insang……….... 2.5.2 Organ Hati……….... 2.5.3 Organ Ginjal………... 2.6Gambaran Darah……….. 2.7Kualitas Air……….. 2.7.1 Suhu………. 2.7.2 Oksigen Terlarut……….. 2.7.3 Nilai pH……….... 2.7.4 Amonia………... 2.7.5 Alkalinitas……… 2.7.6 Kesadahan………
III.METODE PENELITIAN………...
3.1Waktu dan Tempat………... 3.2Alat dan Bahan………. 3.3Metode Penelitian………
3.3.1 Persiapan Wadah dan Ikan Uji………. 3.3.2 Uji Pendahuluan………... 3.3.3 Uji Akut……… 3.3.4 Uji Subkronik………... 3.3.5 Parameter yang Diamati………... 3.3.5.1Tingkat Kelangsungan Hidup……… 3.3.5.2Pertambahan Bobot……… 3.3.5.3Penghitungan Parameter Gambaran Darah……… 3.3.5.4Pembuatan Preparat Histopatologi………... 3.4Kualitas Air……….. 3.5Analisa Data……….
IV. HASIL DAN PEMBAHASAN...
4.1Hasil………. 1 1 3 4 4 6 7 9 12 13 14 19 19 22 22 22 23 24 24 25 26 26 26 27 27 28 29 30 31 31 31 31 34 35 35 36 36
4.1.1 Uji Pendahuluan………... 4.1.2 Uji Akut……….... 4.1.2.1Tingkat Kelangsungan Hidup (%)………... 4.1.3 Uji Sub Kronik………. 4.1.3.1Tingkat Kelangsungan Hidup……… 4.1.3.2Pertumbuhan……….. 4.1.4 Parameter Gambaran Darah………. 4.1.4.1Kadar Hematokrit……….. 4.1.4.2Kadar Hemoglobin………. 4.1.4.3Jumlah Sel Darah Merah……… 4.1.4.4Jumlah Sel Darah Putih………. 4.1.5 Kerusakan Organ……….. 4.1.6 Kualitas Air………...………... 4.2Pembahasan……….. 4.2.1 Uji Akut……… 4.2.2 Uji Sub Kronik………. 4.2.2.1Tingkat Kelangsungan Hidup dan Pertumbuhan………... 4.2.3 Gambaran Darah……….. 4.2.4 Kerusakan Organ……….. 4.2.5 Kualitas Air………..
V. KESIMPULAN DAN SARAN………
DAFTAR PUSTAKA………... LAMPIRAN……….. 36 37 37 38 38 39 40 40 41 42 43 45 51 52 52 53 53 54 57 62 64 65 69
DAFTAR TABEL
Halaman
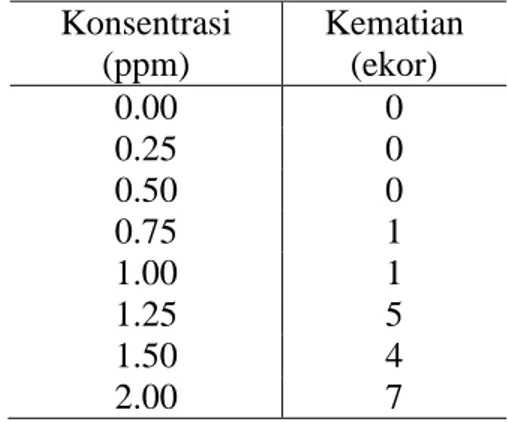
1. Standar baku mutu air terhadap logam berat... 8
2. Nilai konsentrasi, jumlah ikan dan lama perlakuan pada tiap-tiap uji …... … 30 3. Jumlah kematian ikan pada uji pendahuluan ... 38
4. Jumlah kematian ikan pada uji akut ………... 39 5. Kerusakan organ pada pengamatan hari ke 10………... 47
6. Kerusakan organ pada pengamatan hari ke 20……… 49
7. Kerusakan organ pada pengamatan hari ke 30……… 51
DAFTAR GAMBAR
Halaman
1. Proses yang terjadi bila logam berat masuk ke lingkungan laut (EPA, 1973 dalam Destiany, 2007)……….………... 2. Diagramatik pola-pola bioakumulasi suatu bahan kimia Xenobiotik
dalam suatu makhluk hidup perairan (Connel, 1995)………. 3. Bagian dari lamella insang (Destiany, 2007)…..……… 4. Mikroanatomi hati ikan bandeng normal (Alifia dan Djawad, 2000)… 5. Diagram alir tahap penelitian……… 6. Persentase kematian ikan nila (Oreochromis niloticus) selama 96 jam
yang telah terpapar Hg……… 7. Derajat kelangsungan hidup ikan nila (Oreochromis niloticus) pada uji
sub kronik……….... 8. Laju pertumbuhan ikan nila selama uji sub kronis (30 hari)…………... 9. Kadar hematokrit selama perlakuan (%)………. 10.Kadar hemoglobin selama perlakuan (g %)……… 11.Jumlah sel darah merah selama perlakuan……….. 12.Jumlah sel darah putih selama perlakuan………
6 11 15 16 29 39 40 41 42 43 44 45
KATA PENGANTAR
Puji syukur penulis panjatkan kehadirat Allah SWT yang memberi rahmat dan hidayah-Nya sehingga penulis dapat menyelesaikan skripsi dari penelitian yang telah dilakukan. Tema yang dipilih dalam penelitian yang dilaksanakan pada bulan Mei-Juli 2009 adalah Pengaruh Merkuri Klorida, dengan judul “Toksisitas
Merkuri (Hg) Terhadap Tingkat Kelangsungan Hidup, Pertumbuhan, Gambaran Darah dan Kerusakan Organ Pada Ikan Nila Oreochromis
niloticus”
Pada kesempatan ini Penulis mengucapkan terimakasih kepada:
1. Dr. Kukuh Nirmala selaku Dosen Pembimbing yang telah memberikan baik bimbingan, arahan, maupun masukan dalam pelaksanaan penelitian dan penyusunan skripsi.
2. Dr. Dinamella Wahjuningrum dan Ir. Harton Arfah, M.Si yang telah bersedia menjadi Penguji dalam ujian akhir dan memberikan masukan atas tercapainya kesempurnaan skripsi ini
3. Ir. Mia Setiawati, M.Si sebagai Pembimbing Akademik yang telah banyak memotivasi serta mendidik selama menjadi mahasiswa
4. Ayahanda Juremi H.S, S.Pd, Ibunda Sumirah, Kakak Dany Satria, serta segenap keluarga besar yang telah membantu dan mendukung sehingga skripsi ini dapat diselesaikan.
5. Bapak Jajang dan Kang Abe sebagai staf Laboratorium Lingkungan serta Bapak Ranta sebagai staf Laboratorium Kesehatan Ikan (LKI) Departemen Budidaya Perairan yang telah banyak membantu dalam penelitian
6. Teman dekat saya yaitu Bayu Prasetya Wibowo yang telah memberikan motivasi, bimbingan dan arahan
7. Teman-teman BDP 42 khususnya anak environmentalist (Dina, Yeni, Lina, Zizah, Esse, Rizky, Sandre), LKI crew (Icha, Tyas, Majek, Uyung, Teteh, Dewi, Eka, Anet dkk), Nutritionist (Bunda, Johan, Angga, mb nita, wastu) PBI, Genetikers, Sistekers dan semua pihak yang telah membantu.
8. Teman-teman wisma bintang (Hanum, Jane, Fidry, Nira, Lina, Reikha, Eny, Mery, Gamma, Siska, Ary, Iip, Kokom, Mb yuli dan Mb zahro) yang sudah banyak menemani ku dalam susah dan senang.
Semoga skripsi ini dapat bermanfaat bagi semua yang membutuhkan.
Bogor, November 2009
DAFTAR RIWAYAT HIDUP
Penulis dilahirkan di Cirebon pada 22 Juni 1988 dari Ayah Juremi H.S, S.pd dan Ibu Sumirah. Penulis merupakan anak kedua dari dua bersaudara.
Penulis memulai pendidikannya di Taman Kanak- Kanak Pertiwi Cirebon pada tahun 1992, kemudian SDN 1 Gebang Udik Cirebon dan lulus pada tahun 1999, SLTPN 1 Babakan pada tahun 2002 dan SMUN 1 Babakan pada tahun 2005. Pada tahun 2005 penulis diterima di IPB melalui USMI (Undangan Seleksi Masuk IPB) dan pada tahun 2006 penulis diterima di Mayor Teknologi dan Manajemen Perikanan Budidaya dengan Minor Teknologi Penanganan dan Transportasi Biota Perairan.
Selama mengikuti perkuliahan, penulis penulis pernah Praktek Lapang di Balai Besar Pengembangan Budidaya Laut, Lampung pada tahun 2008. Penulis menjadi Asisten Mata Kuliah Fisika Kimia Perairan (2008-2009), Tekhnologi Produksi Plankton, Benthos dan Alga (2008-2009), Dasar-Dasar Akuakultur (2009-2010), dan Manajemen Kualitas Air (2009-2010). Selain itu penulis juga aktif menjadi pengurus Himpunan Mahasiswa Akuakultur (HIMAKUA) periode 2006/2008, Panitia Seminar Nasional Aquaculture 2007 Divisi Bendahara dan Panitia Sense of Aquaculture 2008 Divisi Bendahara.
Untuk menyelesaikan studi di Fakultas Perikanan dan Ilmu Kelautan, penulis melakukan penelitian yang berjudul “Toksisitas Merkuri (Hg)
Terhadap Tingkat Kelangsungan Hidup, Pertumbuhan, Gambaran Darah dan Kerusakan Organ Pada Ikan Nila Oreochromis niloticus”
I.PENDAHULUAN
1.1 Latar Belakang
Masalah pencemaran lingkungan terutama masalah pencemaran air mendapat perhatian yang besar dari pemerintah, karena air merupakan salah satu unsur penting bagi makhluk hidup dan kehidupan. Sejalan dengan meningkatnya industrialisasi, konsentrasi unsur logam berat di dalam perairan juga meningkat, sehingga memungkinkan tercapainya tingkat konsentrasi toksik bagi kehidupan akuatik. Salah satu logam berat yang terus meningkat konsentrasinya adalah Merkuri. Kandungan merkuri di badan air Kali Surabaya, telah mencapai seratus kali lipat dari Baku mutu yang ditetapkan Pemerintah yaitu 0,001 mg/l. Kajian ECOTON mendeteksi adanya peningkatan kandungan merkuri pada tahun 2001 sebesar 0,0011 – 0,0049 mg/l, meningkat pada tahun 2002 menjadi 0,004 – 0,089 mg/l (Anonim, 2004c). Pencemaran merkuri juga terjadi di perairan umum
Cakung Dalam, Jakarta Utara. Tahun 2003 kadar merkuri meningkat dari 0,0012 ppm menjadi 0,0079 ppm dan telah melebihi Baku mutu Hg air Golongan C sehingga kurang layak dimanfaatkan untuk perikanan (Anonim, 2003).
Dalam keseharian, pemakaian merkuri telah berkembang sangat luas. Merkuri digunakan dalam bermacam-macam perindustrian, untuk peralatan-peralatan elektris digunakan untuk alat-alat ukur dalam dunia pertanian dankeperluan yang lainnya. Demikian luasnya pemakaian merkuri mengakibatkan semakin mudah pula organisme mengalami keracunan merkuri. Merkuri telah digunakan untuk menambang emas selama berabad-abad karena racun tersebut harganya murah, mudah digunakan, dan relatif efisien. Namun dampak yang ditimbulkannya juga dapat dirasakan sampai berabad-abad kemudian. Merkuri merupakan suatu toksin yang bersifat kuat dapat merusak bayi dalam kandungan, sistem saraf pusat manusia, organ-organ reproduksi dan sistem kekebalan tubuh. Insiden besar yang diakibatkan oleh pencemaran mercuri terjadi di teluk minimata, jepang. Ancaman kematian akibat bahan beracun itu semakin luas karena penggunaannya yang kini beragam. Merkuri juga digunakan untuk termometer, bahan penambal gigi, juga baterai . Pada industri manufaktur Vinilkhlorida di Jepang, merkuri digunakan sebagai katalis. Pemakaian merkuri
pada industri tersebut telah mengakibatkan terjadinya pencemaran merkuri pada bidang perairan Teluk Minamata.
Merkuri masuk ke dalam jaringan tubuh makhluk hidup melalui beberapa jalan, yaitu saluran pernapasan, pencernaan dan penetrasi melalui kulit. Merkuri yang masuk dalam tubuh organisme air tidak dapat dicerna, dan merkuri dapat larut dalam lemak. Logam yang larut dalam lemak mampu untuk melakukan penetrasi pada membran sel, sehingga akhirnya ion-ion logam merkuri akan menumpuk (terakumulasi) di dalam sel dan organ-organ lain. Akumulasi tertinggi biasanya dalam organ detoksikasi (hati) dan organ ekskresi (ginjal) (Palar, 1994). Rand (1980) dalam Muhammad (2002), mengatakan bahwa salah satu jenis hewan yang direkomendasikan oleh EPA (Environmental Protection
Agency) sebagai hewan uji adalah Oreochromis niloticus, karena ikan tersebut
memenuhi persyaratan yaitu penyebarannya cukup luas, banyak dibudidayakan, mempunyai kemampuan yang tinggi dalam mentolerir lingkungan yang buruk dan mudah dipelihara di laboratorium. Ikan pada umumnya mempunyai kemampuan menghindarkan diri dari pengaruh pencemaran air. Namun demikian, pada ikan yang hidup dalam habitat yang terbatas (seperti sungai, danau, dan teluk), ikan sulit melarikan diri dari pengaruh pencemaran.
Dalam kondisi normal, ikan berinteraksi dengan lingkungannya. Dalam interaksi ini semua sistem tubuh (pencernaan, osmoregulasi, respirasi, reproduksi dan metabolisme) bekerja. Apabila kondisi perairan tempat ikan hidup mengalami perubahan karena polutan (dalam hal ini logam berat) yang masuk secara terus menerus dalam jangka waktu yang lama, akan menyebabkan perubahan pada sistem imun, gambaran darah dan struktur organ/jaringan pada ikan (uji histologi). Hal ini terjadi karena darah berfungsi mengalirkan semua zat yang dibutuhkan oleh tubuh seperti zat-zat makanan, hormon, dan nutrien ke seluruh tubuh. Sehingga apabila dalam lingkungan tersebut terdapat benda asing yang masuk, maka darah merupakan agen yang menyalurkan benda asing tersebut masuk kedalam jaringan dan organ ikan. Sedangkan histologi menggambarkan perubahan sel, jaringan bahkan organ tubuh ikan baik karena gangguan penyakit maupun karena adanya gangguan polutan dalam media hidupnya. Sehingga tepat apabila pendekatan biologis tersebut dijadikan acuan untuk melihat kesehatan
lingkungan, karena kedua indikator tersebut menggambarkan suatu perubahan sejalan dengan perubahan yang terjadi pada sistem lingkungan.
Menurut Takashima dan Hibiya (1995) di dalam bidang akuakultur, studi histologi memiliki arti yang penting di dalam diagnosis, etiologi dan pencegahan penyakit. Dengan teknik histologi maka perubahan-perubahan atau kelainan pada level jaringan yang disebabkan oleh sutu benda asing akan dapat diketahui. Pada penelitian ini dicoba mendiagnosis kerusakan jaringan yang terjadi pada organ tubuh ikan nila serta perubahan gambaran darah akibat dari paparan logam Hg.
1.2 Tujuan
Penelitian ini bertujuan untuk menganalisis kerusakan atau kelainan organ pada insang, hati, dan ginjal serta perubahan gambaran darah yang meliputi sel darah merah, sel darah putih, hematokrit, dan hemoglobin pada ikan nila
Oreochromis niloticus akibat dari paparan Hg dan apakah tingkat kerusakan
organ tersebut dapat dijadikan bioindikator awal dari pencemaran Hg dilingkungan atau tidak.
II. TINJAUAN PUSTAKA
2.1 Karakteristik Logam Berat
Logam berasal dari kerak bumi yang berupa bahan-bahan murni, organik dan anorganik. Logam merupakan bahan pertama yang dikenal oleh manusia dan digunakan sebagai alat-alat yang berperanan penting dalam sejarah peradaban manusia. Logam mula-mula diambil dari pertambangan di bawah tanah (kerak bumi), yang kemudian dicairkan dan dimurnikan dalam pabrik menjadi logam-logam murni.
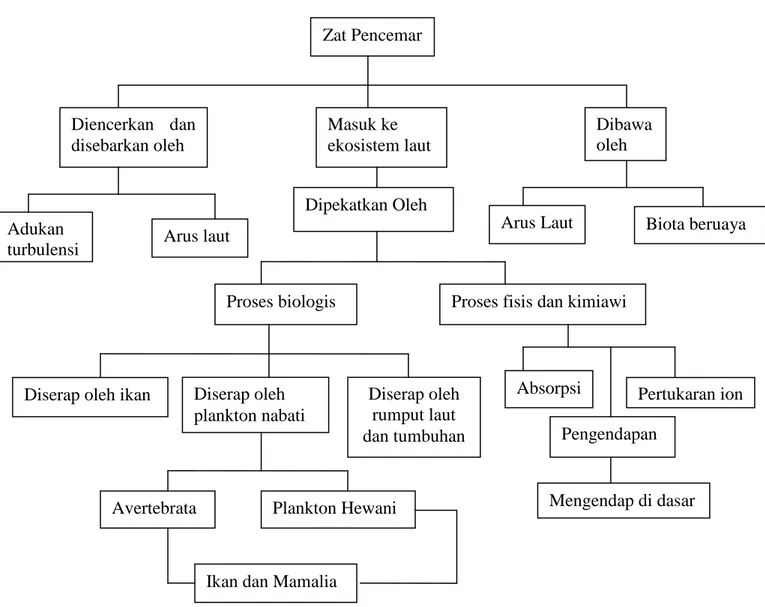
Logam berat adalah unsur-unsur yang mempunyai daya hantar panas dan daya hantar listrik yang tinggi. Logam berat biasanya bernomor atom 22-29 dan periode 3 sampai 7 dalam susunan berkala unsur-unsur kimia. Beberapa unsur logam berat tersebut antara lain Hg, Pb, Cd, Cr, Zn, dan Cu. Pada umumnya semua logam berat tersebar di seluruh permukaan bumi baik di tanah, air dan udara. Logam berat ini dapat berbentuk organik, anorganik terlarut, atau terikat dalam suatu partikel. Unsur logam berat ini dapat terakumulasi dalam tubuh organisme sebagai akibat terjadinya interaksi antara logam berat dan sel atau jaringan tubuh organisme tersebut. Bila kadar logam berat yang terlalu rendah di suatu perairan dapat menyebabkan kehidupan organisme mengalami defisiensi, namun bila unsur logam berat dalam jumlah yang berlebihan dapat bersifat racun. Bahan cemaran ini akan mengalami tiga macam proses akumulasi yaitu proses fisik, kimia dan biologi (Gambar 1).
Gambar 1. Proses yang terjadi bila logam berat masuk ke lingkungan laut (EPA, 1973 dalam Destiany, 2007).
Tingginya kandungan logam berat di suatu perairan dapat menyebabkan kontaminasi, akumulasi bahkan pencemaran terhadap lingkungan seperti biota, sedimen, air dan sebagainya (Lu, 1995). Berdasarkan kegunaannya, logam berat dapat dibedakan menjadi dua golongan, yaitu :
1. Golongan yang dalam konsentrasi tertentu berfungsi sebagai mikronutrien yang bermanfaat bagi kehidupan organisme perairan, seperti Zn, Fe, Cu, Co.
2. Logam yang sama sekali belum diketahui manfaatnya bagi organisme perairan, seperti Hg, Cd, dan Pb.
Zat Pencemar Diencerkan dan disebarkan oleh Masuk ke ekosistem laut Dibawa oleh Adukan
turbulensi Arus laut
Dipekatkan Oleh
Arus Laut Biota beruaya
Proses biologis Proses fisis dan kimiawi
Diserap oleh ikan Diserap oleh plankton nabati Diserap oleh rumput laut dan tumbuhan Absorpsi Pengendapan Pertukaran ion Mengendap di dasar Avertebrata Plankton Hewani
Selanjutnya Hutagalung (1984) dalam Destiany (2007) menyatakan bahwa senyawa logam berat banyak digunakan untuk kegiatan industri sebagai bahan baku, katalisator, biosida maupun sebagai additive. Limbah yang mengandung logam berat ini akan terbawa oleh sungai dan karenanya limbah industri merupakan sumber pencemar logam berat yang potensial bagi pencemaran laut.
2.2 Kandungan Logam Berat Dalam Air
Air merupakan elemen penting bagi kehidupan organisme perairan. Untuk menjaga kualitas perairan yang mendukung kehidupan berbagai organisme maka diperlukan suatu pengontrolan dari berbagai aktifitas manusia yang memanfaatkan perairan baik secara langsung maupun tidak langsung. Salah satu kegiatan manusia yang memanfaatkan perairan adalah kegiatan industri. Sebagaimana diketahui secara umum bahwa hasil buangan akhir dari sebuah pabrik atau kegiatan industri bermuara ke perairan disekitarnya, meskipun perusahaan atau pabrik tersebut telah memiliki IPAL (instalasi pengolahan air limbah). Air buangan yang telah di olah tidak terlepas akan sisa atau residu yang mengandung bahan berbahaya bagi kehidupan perairan baik dalam kadar yang banyak atau sedikit.
Konsentrasi bahan pencemar yang masuk ke perairan bisa mempengaruhi kehidupan organisme terutama yang menjadi topik disini adalah spesies ikan. Salah satu jenis unsur kimia yang bisa menyebabkan terjadi kerusakan ekosistem perairan adalah unsur logam berat. Sebagaimana diketahui unsur logam berat yang masuk ke perairan berasal dari berbagai kegiatan indutsri selain bersumber dari alam sendiri. Untuk itu sangat diperlukan suatu kajian yang melihat seberapa besar pengaruh unsur-unsur logam berat tersebut bisa mempengaruhi ekosistem perairan terutama yang berhubungan langsung dengan kualitas airnya.
Tabel 1. Standar baku mutu air terhadap logam berat Logam Simbol Standar Baku Perikanan (mg/l)1 EPA(ppm)2 Kadmium Cd 0.01 0.0043 Krom Cr 0.05 0.016 Timbal Pb 0.01 0.065 Seng Zn 0.02 0.12 Merkuri Hg 0.002 0.0014 Keterangan : 1. PP No 82 tahun 2001
2. Environmental Protection Agency. 1973. Water Quality Criteria
Logam berat biasanya sangat sedikit dalam air secara ilmiah kurang dari 1 g/l. Menurut Palar (2004) kelarutan dari unsur-unsur logam dan logam berat dalam badan air dikontrol oleh :
(1) pH badan air,
(2) jenis dan konsentrasi logam
Logam berat yang dilimpahkan ke perairan, baik di sungai ataupun laut akan dipindahkan dari badan airnya melalui beberapa proses yaitu : pengendapan, dan absorbsi oleh organisme perairan. Logam berat mempunyai sifat yang mudah mengikat bahan organik dan mengendap di dasar perairan dan bersatu dengan sedimen sehingga kadar logam berat dalam sedimen lebih tinggi dibandingkan dalam air (Harahap (1991) dalam Destiany (2007)).
2.3 Logam Berat Merkuri
Logam merkuri atau air raksa mempunyai nama kimia hydragyrum yang berarti perak cair (Palar, 1994). Merkuri dan senyawa-senyawanya tersebar luas di alam, mulai dari batuan, air, udara dan bahkan dalam tubuh organisme hidup di alam. Menurut Palar (1994), secara umum logam merkuri mempunyai sifat-sifat sebagai berikut:
a. Berwujud cair pada suhu kamar (250C) dengan titik beku paling rendah sekitar –390C, sehingga mudah menyebar di permukaan air dan sulit dikumpulkan. b. Masih berwujud cair pada suhu 3960C, pada temperatur 3960C ini telah terjadi
c. Merupakan logam yang paling mudah menguap jika dibandingkan dengan logam yang lain.
d. Tahanan listrik yang dimiliki sangat rendah, sehingga menempatkan merkuri sebagai logam yang sangat baik untuk menghantarkan daya listrik.
e. Dapat melarutkan bermacam-macam logam untuk membentuk alloy yang disebut dengan amalgam.
f. Merupakan unsur yang sangat beracun bagi semua makhluk hidup, baik itu dalam bentuk unsur tunggal (logam) ataupun dalam bentuk persenyawaan. Merkuri berada dalam bentuk senyawa, satu diantaranya yang paling utama adalah sinabar (HgS) yang sudah ditambang sejak 700 SM. Pada saat ini digunakan dalam industri dalam tiga bentuk: senyawa logam, senyawa organik, dan senyawa anorganik. Penggunaan paling besar adalah dalam produksi alat elektronik. Penggunaan kedua terbesar adalah dalam industri kloro-alkali, yang memproduksi klorine dan soda kaustik dengan menggunakan merkuri sebagai katoda dalam sel elektrolisis. Merkuri di alam terdapat dalam berbagai bentuk sebagai berikut:
a. Merkuri anorganik, termasuk logam merkuri (Hg2+) dan garam-garamnya
seperti merkuri klorida (HgCl2) dan merkuri okside (HgO).
b. Komponen merkuri organik/organomerkuri, terdiri dari aril merkuri, alkil merkuri dan alkoksialkil merkuri.
Merkuri klorida (HgCl2) termasuk dalam senyawa merkuri anorganik dan
ada dalam bentuk garam Hg yang penggunaannya semakin meluas antara lain digunakan dalam industri elektronik, pembuatan plastik, fungisida, germisida. Merkuri klorida dalam sedimen di dasar laut dan sungai akan diubah oleh mikroorganisme menjadi senyawa organik metil merkuri (R – O – Hg), yang tetap akan larut di dalam air. Di perairan, metal merkuri masuk ke tubuh ikan kemudian terakumulasi pada pemangsa alaminya hingga meracuni manusia (Anonim, 2004
b).
Baik garam-garam Hg maupun senyawa-senyawa Hg organik bersifat toksik, tetapi senyawa-senyawa Hg organik memiliki daya racun yang lebih tinggi dari Hg anorganik. Merkuri anorganik dapat berubah menjadi merkuri organik yaitu metil merkuri (CH3-Hg) oleh aktifitas mikroorganisme. Metil merkuri
mempunyai sifat racun, daya ikat yang kuat dan kelarutan yang tinggi terutama dalam tubuh hewan air. Hal tersebut mengakibatkan merkuri terakumulasi melalui proses bioakumulasi dan biomagnifikasi dalam jaringan tubuh hewan-hewan air, sehingga kadar merkuri dapat mencapai level yang berbahaya baik bagi kehidupan hewan air maupun kesehatan manusia yang mengkonsumsi (Sanusi, 1980 dalam Budiono, 2003).
2.4 Toksisitas Merkuri Terhadap Organisme
Toksisitas adalah kemampuan suatu molekul atau senyawa kimia dalam menimbulkan kerusakan pada bagian yang peka di dalam maupun di bagian luar tubuh makhluk hidup (Durham, 1975 dalam Tandjung, 1995). Tolok ukur pengujian efek bahan pencemar yang saat ini dianggap paling tepat adalah derajat toksisitas dengan metode Bioassay. Menurut Connel (1995), respon makhluk hidup yang diuji dapat dimasukkan dalam kategori-kategori sebagai berikut: a. Pengaruh akut, yaitu respon makhluk hidup terhadap suatu keadaan yang cukup
parah sehingga menyebabkan suatu respon cepat biasanya dalam waktu 96 jam.
b. Pengaruh subakut, yang merupakan respon makhluk hidup terhadap suatu kondisi yang kurang parah dan biasanya terjadi setelah waktu yang lebih lama. c. Pengaruh kronis, yang merupakan respon makhluk hidup terhadap suatu
kondisi berkesinambungan yang terjaga tetap.
Merkuri masuk ke dalam tubuh organisme hidup terutama melalui makanan yang dimakannya, karena hampir 90% logam berat (merkuri) masuk ke dalam tubuh melalui jalur makanan. Logam merkuri masuk pada jalur tersebut melalui dua cara, yaitu lewat air (minuman) dan tanaman (bahan makanan). Sisanya akan masuk secara difusi atau perembesan lewat jaringan dan melalui pernafasan (insang) (Palar, 1994). Merkuri anorganik di perairan akan mengalami metilasi oleh bakteri anaerob sebagai methyl merkuri dan membebaskannya ke perairan. FAO (1971) dalam Budiono (2003) mengemukakan, bahwa merkuri yang dapat diakumulasi oleh ikan atau shellfish adalah berbentuk methyl merkuri. Methyl merkuri yang terbentuk, bersifat tidak stabil sehingga mudah dilepaskan
ke dalam perairan yang kemudian masuk ke hewan maupun tumbuhan air dan mengalami akumulasi.
Ochiai dalam Connel dan Miller (1995), telah membagi mekanisme toksisitas ion-ion logam secara umum ke dalam tiga kategori yaitu:
a. Menahan gugus fungsi biologi yang esensial dalam biomolekul (misalnya protein dan enzim).
b. Menggantikan ion logam esensial dalam biomolekul. c. Mengubah konformasi biomolekul.
Proses akumulasi bahan kimia dalam suatu makhluk hidup perairan digambarkan dalam Gambar 2.
Makhluk perairan Makanan Konsumsi Pengeluaran Kesetimbangan dengan air
Gambar 2. Diagramatik pola-pola bioakumulasi suatu bahan kimia dalam suatu makhluk hidup perairan (Connel, 1995).
Makanan yang telah terkontaminasi merkuri akan dikonsumsi makhluk perairan termasuk ikan dan akan masuk dalam alur pencernaan. Dari alur pencernaan (gastrointestinal) melalui dinding-dindingnya akan menuju ke cairan sirkulatori. Bahan-bahan kimia setelah dari cairan sirkulatori ada yang di metabolisme dan ada yang bertemu dengan kebanyakan jaringan badan dan selanjutnya ditimbun dalam jaringan lemak. Bahan-bahan kimia (senyawa merkuri) dalam cairan sirkulatori akan teroksidasi menjadi Hg2+ dan akan
terakumulasi dalam hati. Di hati akan dimetabolisme, merkuri dalam hati akan diinaktifkan oleh enzim-enzim di dalam hati sehingga terjadi biotransformasi
zat-Alur Pencernaan
Cairan sirkulator
Metabolisme
Insang atau pengambilan O2 melalui permukaan
zat berbahaya menjadi zat-zat yang tidak berbahaya yang kemudian diekskresikan oleh ginjal dan mengalami pertukaran.
Seluruh biota perairan memperoleh pasokan oksigen lewat insang dengan difusi melalui membran bagian luarnya. Pengambilan oksigen kedalam jaringan-jaringan tubuh melalui permukaan terjadi pada makhluk hidup kecil, seperti jasad renik, namun pada makhluk hidup yang lebih besar termasuk ikan, bahan-bahan kimia mendifusi ke dalam cairan sirkulatori.
Senyawa-senyawa kimia selain masuk melalui saluran pencernaan, juga bisa masuk melalui saluran pernafasan (insang). Senyawa kimia tersebut akan masuk melalui insang yang langsung bersentuhan dengan lingkungan air. Setelah melewati insang, bahan-bahan kimia termasuk merkuri akan ikut ke dalam sistem pernafasan sampai akhirnya akan menembus sel epitel endothelial kapiler darah untuk masuk ke dalam darah. Selanjutnya akan terikut ke dalam aliran darah dan akhirnya ikut dalam proses metabolisme (Connel, 1995).
Beberapa pengaruh toksisitas logam pada ikan yang telah terpapar logam berat yaitu pada insang, alat pencernaan dan ginjal (Dinata, 2004). Jumlah merkuri yang terakumulasi pada tubuh ikan tergantung dari ukuran, umur dan kondisi ikan. Distribusi dan akumulasi logam tersebut sangat berbeda-beda untuk organisme air. Hal ini tergantung pada spesies, konsentrasi logam dalam air, pH, fase pertumbuhan dan kemampuan untuk pindah tempat (Darmono, 1995).
Sanusi (1980) dalam Darmono (2003), mengemukakan bahwa terjadinya proses akumulasi merkuri di dalam tubuh hewan air terjadi karena kecepatan pengambilan merkuri (uptake rate) oleh organisme air lebih cepat dibandingkan dengan proses ekskresi. Merkuri merupakan logam yang terlibat dalam proses enzimatik, terikat dengan protein (ligan binding). Ikatan merkuri dengan protein jaringan membentuk senyawa metallotionein. Metallotionein merupakan protein aditif yang berperan dalam proses homeostatis organisme dalam mentolelir logam berat.
Senyawa-senyawa kimia yang telah berikatan dengan protein dan membentuk metallotionein tersebut akan dibawa oleh darah (Darmono, 1995). Senyawa merkuri yang masuk bersama makanan, akan masuk ke dalam alur pencernaan, setelah mengalami absorbsi di usus, senyawa merkuri akan dibawa
ke hati oleh vena porta hepatik. Selanjutnya di dalam hati senyawa merkuri mengalami metilasi lambat menjadi Hg2+, dan kemudian akan masuk ke dalam
darah dan akan teroksidasi sempurna menjadi merkuri bivalensi (Hg2+). Bersama
peredaran darah, Hg2+ yang masuk ke hati akan mengalami metabolisme,
terdegradasi dan melepaskan Hg2+, sehingga dapat menghambat enzim proteolitik
dan menyebabkan kerusakan sel (Lu, 1995). Merkuri yang tadinya masuk ke dalam hati akan terbagi dua yaitu sebagian akan terakumulasi pada hati, sedangkan sebagian lainnya akan dikirim ke empedu. Dalam kantong empedu, akan dirombak menjadi senyawa merkuri anorganik yang kemudian akan dikirim lewat darah ke ginjal, dimana sebagian akan terakumulasi pada ginjal dan sebagian lagi dibuang bersama urin (Palar, 1994).
Hati merupakan kelenjar tubuh yang paling besar dan memiliki multifungsi kompleks. Pada sel hati terdapat banyak retikulum endoplasma kasar dan retikulum endoplasma halus, hal ini menunjukkan bahwa hati mempunyai peran dalam metabolisme. Retikulum endoplasma (RE) merupakan tempat sejumlah enzim dalam sel. Enzim yang banyak terdapat dalam retikulum endoplasma adalah Sitokrom P–450. Logam merkuri dapat sampai ke saluran pencernaan selain melalui makanan, juga dapat terjadi melalui air yang mengandung logam merkuri. Setelah melewati sistem pencernaan, logam merkuri masuk ke peredaran darah dan menuju ke organ tubuh secara sistematik (Lu, 1995).
2.5.1Histologi
Histologi merupakan ilmu yang mempelajari susunan sel, jaringan atau organ yang menyusun suatu makhluk hidup. Perubahan pada histologi hewan sebenarnya dapat menunjukkan suatu kejadian atau peristiwa yang sedang atau telah dialami oleh suatu makhluk hidup. Sedangkan Anonim (2004) menjelaskan bahwa histologi adalah bidang biologi yang mempelajari tentang struktur jaringan secara detail menggunakan mikroskop pada sediaan jaringan yang dipotong tipis. Sedangkan histopatologi adalah ilmu yang mempelajari pengamatan sel, jaringan atau organ makhluk hidup (hewan) di bawah mikroskop untuk melihat diagnosa
suatu penyakit. Histologi jaringan yang akan diamati perbedaannya yaitu pada jaringan insang, organ hati dan ginjal.
2.5.2 Jaringan Insang
Beberapa pengaruh toksisitas logam pada ikan yang telah terpapar logam berat yaitu pada insang, alat pencernaan, hati dan ginjal (Dinata, 2004). Insang merupakan organ yang dimiliki ikan sebagai alat utama pernafasan. Insang selain sebagai alat pernafasan ikan, juga digunakan sebagai pengatur tekanan antara air dan dalam tubuh ikan (osmoregulasi). Oleh sebab itu insang merupakan organ yang penting pada ikan. Sebagian besar kematian ikan yang disebabkan oleh bahan pencemar terjadi karena kerusakan pada bagian insang dan organ-organ yang berhubungan dengan insang. Karena letaknya di luar dan berhubungan langsung dengan air sebagai media hidupnya, maka organ inilah yang pertama kali mendapat pengaruh apabila lingkungan air tercemar oleh bahan pencemar baik yang terlarut maupun yang tersuspensi. Insang merupakan organ yang langsung berhubungan dengan air, sehingga apabila air mengandung polutan akan mengakibatkan kerusakan pada organ ini dan organ-organ yang berhubungan dengan insang. Hal inilah yang menyebabkan ikan mati di perairan.
Pada umumnya ikan Teleostei mempunyai lima pasang lengkung insang, yaitu empat pasang lamella primer dan satu pasang lamella sekunder. Lamella primer bentuknya tipis, berupa dua garis melengkung ke belakang dan saling berhubungan. Lamella sekunder berbentuk setengah lingkaran mengelilingi semua bagian dari lamella primer (Takasima dan Hibiya, 1995). Insang terdiri dari sepasang filamen insang, di mana setiap filamen terdiri dari serat melintang yang tertutup epithelium yang tipis disebut lamella. Lamella merupakan penyusun filamen. Sebuah rangkaian lamella pada satu sisi dari septum interbranchiale disebut hemibranchium. Dua hemibranchium dan septum interbranchia membentuk insang lengkap disebut holobranchia (Lagler et al.,1977).
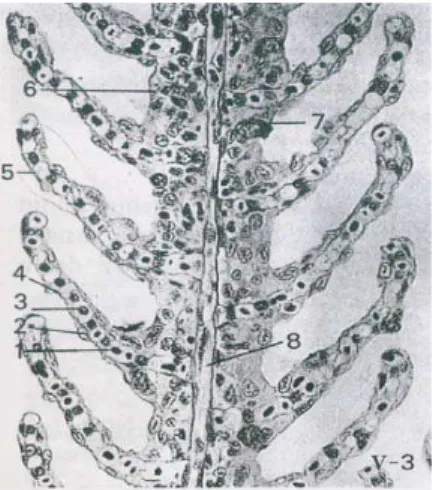
Keterangan: 1. Eritrosit 2. Epitelium 3. Sel pillar 4. Lumen kapiler 5. Lamella
6. Sel sel interlamella 7. Sel mukus
8.Tulang rawan penopang Gambar 3. Bagian dari lamella insang (Destiany, 2007).
Pada filamen insang terdapat sejumlah besar lamella. Tepi-tepi bebas lamella sangat tipis ditutupi epithelium berisi jaringan kapiler yang disokong oleh sel pilaster. Sel pilaster berfungsi membatasi sel epithelium dengan kapiler darah. Lamella sekunder kaya akan eritrosit. Lamella sekunder insang berupa lipatan lembaran melintang, tipis, dinding luarnya terdiri dari selapis sel epithelium pipih dan di bawahnya terdapat lapisan sub epithelium yang sangat tipis dan terdiri dari jaringan ikat. Selubung epithelium dibungkus oleh lapisan vaskuler medial, merupakan anyaman kapiler darah dari arteri brachialis efferent sel-sel pilaster dari eritrosit (Lagler et al.,1977).
2.5.3 Organ Hati
a. Struktur Hati
Hati merupakan organ terbesar dalam tubuh yang terletak pada bagian sirip perut, dalam rongga peritoneal dan melingkupi viscera. Hati memiliki bentuk seperti huruf U dan berwarna merah kecoklatan (Anonim, 2004 a).
Struktur utama hati adalah sel hati atau hepatosit. Hepatosit (sel parenkim hati) bertanggung jawab terhadap peran sentral hati dalam metabolisme. Sel-sel ini terletak diantara sinusoid yang berisi darah dan saluran empedu. Sel kupffer melapisi sinusoid hati dan merupakan bagian penting dalam sistem retikuloendotelial tubuh (Lu, 1995). Sel kupffer merupakan sistem monositmakrofag dan fungsi utamanya adalah menelan bakteri dan benda asing
lain dalam darah. Sehingga hati merupakan salah satu organ utama sebagai pertahanan terhadap invasi bakteri dan agen toksik (Anderson, 1995).
Sel hati berbentuk polihedral, dengan enam permukaan atau lebih. Sel hati mempunyai satu / dua buah inti bulat, banyak retikulum endoplasma halus dan kasar, serta mempunyai banyak mitokondria yang berbentuk ovoid atau sferis. Sel hati berkelompok dalam lempeng-lempeng dan saling berhubungan sedemikian rupa sehingga membentuk bangunan lobulus hati. Di dalam lobulus hati, sel hati tersusun secara radier. Diantara lempengan sel hati terdapat kapiler-kapiler yang dinamakan sinusoid. Sinusoid adalah pembuluh darah kapiler yang merupakan percabangan dari vena porta dan arteri hepatika. Tidak seperti kapiler lain, sinusoid dibatasi oleh sel fagositik atau sel kupffer (Anderson, 1995). Mikroanatomi hati ikan normal digambarkan dalam Gambar 2.
2.
1.
3
Gambar 4. Mikroanatomi hati ikan bandeng normal (Alifia dan Djawad, 2000) Perbesaran 40X10. Pewarnaan : Hematoxylin-Eosin
Keterangan gambar: 1. Vena sentral; 2. Hepatosit; 3. Sinusoid.
b. Sirkulasi darah pada Hati
Sirkulasi darah pada hati meliputi sistem vena porta dan sistem arteri. Sekitar sepertiga darah yang masuk adalah darah arteri dan sekitar dua per tiga adalah darah dari vena porta. Darah dipasok melalui vena porta dan arteri hepatika, dan disalurkan melalui vena sentral ke vena hepatika kemudian ke vena cava. Aliran darah pada hati mengalir dari perifer ke pusat lobulus, sehingga metabolit-metabolit dan semua zat toksik atau non toksik yang diabsorbsi dari usus mula-mula mencapai sel perifer dan kemudian ke sel–sel tengah lobules.
c. Fungsi Hati
Pada organ hati memiliki beberapa fungsi, antara lain detoksikasi, yaitu hati bertanggung jawab atas biotransformasi zat-zat berbahaya menjadi zat-zat yang tidak berbahaya yang kemudian diekskresi oleh ginjal. Suatu toksikan dalam hati akan diinaktifkan oleh enzim-anzim di dalam hati, tapi apabila toksikan di berikan secara terus-menerus, kemungkinan toksikan di dalam hati akan menjadi jenuh (enzim tidak mampu mendetoksifikasi toksikan lagi), sehingga terjadi penurunan aktifitas metabolisme dalam hati. Hal ini akan menyebabkan proses detoksifikasi tidak efektif lagi, maka senyawa metabolit akan dapat bereaksi dengan unsur sel dan hal tersebut dapat menyebabkan kematian sel. Fungsi yang lain adalah pembentukan dan eksresi empedu, metabolisme garam empedu, metabolisme karbohidrat (Glikogenesis, glikogenolisis, glukoneogenesis), sintesis protein, metabolisme dan penyimpanan lemak (Anderson, 1995).
d. Kerusakan Hati
Kerusakan hepatosit menurut Ressang (1984) dapat dibagi menjadi dua yaitu taksohepatik dan trofohepatik. Kerusakan akibat taksopatik disebabkan oleh pengaruh langsung dari agen yang toksik, baik berupa zat kimia maupun kuman. Kerusakan akibat trofopatik disebabkan adanya kekurangan faktor-faktor penting untuk kehidupan sel seperti oksigen atau zat makanan, baik secara langsung maupun tidak langsung. Hati sangat rentan terhadap pengaruh berbagai zat kimia dan sering menjadi organ sasaran utama dari efek racun zat kimia. Oleh karena itu, hati merupakan organ tubuh yang paling sering mengalami kerusakan.
Menurut Lu (1995) hal ini disebabkan sebagian besar toksikan yang masuk ke dalam tubuh setelah diserap oleh usus halus di bawa ke hati oleh Vena porta hati. Melihat fungsi hati tersebut, maka dapat dipahami bahwa hati merupakan organ yang mudah terkena efek toksik senyawa asing. Peristiwa tersebut dapat terjadi dikarenakan:
1.) Senyawa kimia yang diberikan secara oral akan diabsorbsi dari saluran cerna ke dalam hati melalui vena porta dapat meracuni hati;
2) Senyawa kimia yang dimetabolisme di dalam hati dieksresikan ke dalam empedu dan kembali lagi ke duodenal;
3) Senyawa asing yang dimetabolisme di dalam hati sebagian dilokalisir di dalam hati.
Dengan demikian hati merupakan organ yang banyak berhubungan dengan senyawa kimia sehingga mudah terkena efek toksik (Loomis, 1978). Diantara berbagai zat yang masuk ke dalam hati bersama darah, kemungkinan ada zat yang mampu menginduksi kerusakan hati. Zat yang dimaksud antara lain logam berat dan salah satunya logam merkuri (Hg). Darmono (1995) mengatakan kongesti dan hemoragi atau pendarahan terlihat pada hepatopankreas yang terakumulasi oleh logam berat. Ogura (1959) dalam Darmono (1995) juga menyatakan bahwa pada crustacea Penaeus merguiensis, kadmium dan nikel banyak ditemukan dalam sel-sel hepatopankreas. Hal ini didukung dari hasil penelitian Damar (2004) dalam Darmono (1995) yang menyebutkan bahwa hati ikan yang tercemar logam timbal (Pb), kadmium (Cd), copper (Cu), merkuri (Hg) mengalami kerusakan berupa pembendungan, hemoragi dan degenerasi vakuola.
Degenerasi vakuola atau pembekakan sel merupakan salah satu indikasi terjadinya perlemakan hati, pada keadaan ini sel hati tampak membesar. Perlemakan hati merupakan tahap awal terjadinya kerusakan dalam hati. Menurut Ressang (1984) perlemakan yang berlangsung lama dapat menyebabkan terjadinya kerusakan hati yaitu kongesti. Kongesti adalah terjadinya pembendungan darah pada hati yang disebabkan adanya gangguan sirkulasi yang dapat mengakibatkan kekurangan oksigen dan zat gizi. Pada sel hati, kongesti didahului dengan pembengkakan sel hati dimana sel hati membesar yang mengakibatkan sinusoid menyempit sehingga aliran darah terganggu. Hal ini menyebabkan terjadinya pembendungan darah pada beberapa tempat (Ressang, 1984). Hemoragi adalah keluarnya darah dari sirkulasi kardiovaskuler dan biasanya terdapat kerusakan pada susunan kardiovaskuler tersebut (arteri, vena dan kapiler) (Sudiono, 2003). Nekrosis adalah terjadinya kematian sel hati. Kematian sel terjadi bersama dengan pecahnya membran plasma. Perlemakan hati adalah hati yang mengandung berat lipid lebih dari 5% atau telah terjadi penimbunan lipid dalam hati. Atrofi adalah menurunnya ukuran ukuran jaringan yang disebabkan berkurangnya jumlah sel atau ukuran sel.
Tingkat kerusakan hati menurut Darmono (1995), dibagi menjadi tiga yaitu ringan, sedang dan berat. Perlemakan hati termasuk dalam tingkat ringan yang ditandai dengan pembengkakan sel. Tingkat kerusakan sedang yaitu kongesti dan hemoragi, sedangkan tingkat berat adalah kematian sel atau nekrosis. Kerusakan hati akibat logam berat Hg disebabkan aktifitas logam tersebut dalam mempengaruhi kerja enzim/hormon proteolitik (Lu, 1995).
Merkuri merupakan logam yang terlibat dalam proses enzimatik, terikat dengan protein dan lebih reaktif terhadap ikatan logam dengan sulfur dan nitrogen. Merkuri juga dapat bersenyawa dengan protein jaringan dan tertimbun dalam jaringan, terutama dalam hati dan ginjal (Darmono, 1995). Merkuri bersama ion-ion logam lain akan dapat membentuk ion-ion yang dapat larut dalam lemak. Ion-ion logam yang dapat larut dalam lemak itu mampu untuk melakukan penetrasi pada membran sel sehingga akhirnya ion-ion logam tersebut akan terakumulasi di dalam sel dan organ-organ lain, logam dapat terikat pada protein plasma (Achmad, 2004). Keberadaan dari suatu toksikan dapat mempengaruhi kerja dari enzim–enzim biologis. Toksikan ini mempunyai kemampuan berikatan dengan enzim, ikatan ini terjadi karena logam berat mempunyai kemampuan untuk menggantikan gugus logam yang berfungsi sebagai co-faktor enzim (Palar, 1994). Racun yang masuk ke dalam tubuh, dalam hal ini adalah logam berat akan mengalami proses detoksikasi di dalam hati oleh fungsi hati (hepar). Senyawa toksik akan diubah menjadi senyawa lain yang sifatnya tidak lagi beracun terhadap tubuh. Jika zat toksik yang masuk ke dalam tubuh relatif kecil atau sedikit dan fungsi detoksikasi hati baik maka tidak akan terjadi keracunan. Namun apabila zat toksik dalam jumlah besar, maka fungsi detoksikasi hati akan mengalami kerusakan.
Kerusakan sel hati yang disebabkan oleh zat kimia yang bersifat racun antara lain: perlemakan hati, nekrosis dan sirosis (Lu, 1995). Kerusakan hati yang sangat akut pada dasarnya dibedakan menjadi tiga macam, yakni (1) sitotoksik (hepatoseluler) yaitu kerusakan parenkim hati, dapat berupa steatosis (degenerasi melemak) dan atau nekrosis sel – sel hati; (2) kolestik berupa hambatan aliran empedu dengan sedikit atau tanpa kerusakan sel – sel hati, baik karena luka pada kanalikuler atau luka pada saluran empedu dan dapat pula tanpa adanya luka atau
kanalikuler; (3) campuran keduanya yaitu kombinasi sitotoksik dan kolestik (Zimmerman, 1998)
2.5.4 Organ Ginjal
Pada ikan tubule ginjal merupakan bentuk berpasangan yang terletak memanjang pada dinding dorsal rongga tubuh. Setiap tubule ginjal menuju ke ureter yang masuk ke kandung kemih. Urine kemudian dikeluarkan lewat lubang urogenital pada tubuh ikan (Black, 1957 dalam Angka, 1984).
Menurut Hoar dan Randall (1969) dalam Angka (1984), ginjal Cyprinidae terbagi menjadi 2 bagian yaitu kepala ginjal dan tubule ginjal. Tubule ginjal air tawar terdiri dari glomerulus, segmen leher terbuka (proximal convoluted tubule) yang terdiri dari 2 segmen cytology yang berbeda (distal convoluted tubule) dan tubule pengumpul mula. Urine terbentuk oleh saringan glomerulus ke dalam tubuli ginjal. Khususnya ikan mas (Cyprinus sp. dan Carassius sp.). Jumlah nitrogen yang dikeluarkan insang 6-10 kali lebih banyak daripada ginjal ikan pada umumnya. Ginjal ikan air tawar yang berglomeruli gunanya untuk mengeluarkan kembali air yang secara osmotis diserap. Karena konsentrasi cairan tubuhnya lebih besar daripada lingkungan, maka fungsi ginjal ikan air tawar adalah sebagai regulator hiperosmotik.
2.5.5 Gambaran Darah Ikan
Darah merupakan jaringan sirkulasi yang terdiri atas cairan plasma, sel-sel darah merah, sel-sel darah putih dan keping darah. Fernandez dan Mazon (2003) menyebutkan bahwa parameter darah seperti hemoglobin, jumlah sel darah merah, sel darah putih dan hematokrit erat kaitannya dengan respon individu terhadap perubahan parameter lingkungan. Karakteristik parameter darah merupakan salah satu sarana yang penting sama halnya dengan analisis parasit dalam rangka untuk mengetahui tingkat kesehatan populasi ikan budidaya (Martin
et al., 2004). Respon ikan terhadap stressor bergantung pada jenis stress yang
dialami oleh ikan tersebut, dimana peningkatan jumlah sel darah putih, penurunan kadar hematokrit dan peningkatan neutrofil bergantung pada jenis stress yang dialami (Martin et al., 2004).
Darah ikan tersusun atas plasma dan sel-sel darah. Plasma darah merupakan cairan koloid jernih yang mengandung mineral terlarut, hasil-hasil metabolisme seluler dan jaringan, enzim, gas terlarut, protein dan antibodi yaitu serum, glukosa darah, kalsium, magnesium, kalium, natrium, Chlor, fosfor, dan sulfat. Sedangkan sel darah terdiri atas sel darah merah (eritrosit), sel darah putih (leukosit) dan keping darah (trombosit).
Secara umum, fungsi darah diantaranya sebagai alat transportasi oksigen, karbondioksida, hormon dan makanan, membuang hasil metabolisme seperti urea, asam uric, keratin dan air melalui ginjal, kulit dan usus, menjaga keseimbangan suhu tubuh, asam basa tubuh dan air dalam tubuh. Selain itu, darah juga memegang peranan penting dalam sistem pertahanan tubuh dalam proses pembekuan darah (Rastogi, 1977). Fungsi utama darah adalah untuk mensuplai nutrien seperti oksigen, glukosa dan elemen-elemen penting ke jaringan dan untuk mengangkut hasil buangan metabolisme seperti karbon dioksida dan asam laktat. Selanjutnya disebutkan bahwa dalam darah juga terdapat sel-sel darah putih dan materi-materi lain seperti asam amino, lemak dan hormon.
Bond (1979) menyatakan bahwa darah juga berfungsi sebagai pembawa oksigen dan berbagai materi lainnya. Materi-materi lain yang dibawa oleh darah antara lain ion anorganik dan senyawa organik seperti hormon, vitamin dan beberapa protein plasma. Protein plasma ini berperan dalam respon kekebalan, penyangga didalam perubahan pH dan untuk pengaturan tekanan osmotik darah.
Pada ikan yang normal, jumlah sel darah merah berkisar antara 1.05-3.00x106 sel/mm3 darah (Robert, 1978), sel darah merah ikan berkisar antara 20.000-3.000.000 sel tiap mm3 darah. Berdasarkan penelitian yang dilakukan oleh Wells et al. (2005), pada ikan salmon catfish Arius leptaspis dan ikan tarpon
Megalops cyprinoides, didapat hasil bahwa pada ikan Tarpon yang dapat
mengambil oksigen langsung dari udara memiliki jumlah sel darah merah yang lebih tinggi jika dibandingkan salmon catfish.
Berdasarkan ada tidaknya granula atau butir-butir dalam sel, sel darah putih dikelompokkan menjadi dua bagian yaitu granulosit, merupakan sel darah putih yang memiliki granula dan sel agranulosit, merupakan sel darah putih yang tidak memiliki granula dalam selnya. Granulosit terdiri dari limfosit, monosit dan
trombosit. Sedangkan agranulosit terdiri dari netrofil, eosinofil dan basofil. Well
et al. (1991) menyebutkan bahwa eosinofil dan basofil tidak ditemukan pada ikan
mas, nila dan lele dumbo.
Jumlah sel darah putih pada ikan berkisar antara 20.000-150.000 sel/mm3 darah (Rastogi, 1977). Sel darah putih ini memiliki bentuk mulai dari lonjong sampai bulat (Lagler et al. 1977). Pada ikan sehat, jumlah dan proporsi masinng-masing komponen darah relatif konstan. Dikemukakan oleh Randall (1970) bahwa volume darah pada ikan teleotei, holostei, dan chondrostei adalah sekitar 3% dari bobot tubuh. Amlecher (1970) menyatakan bahwa darah akan mengalami perubahan serius khususnya bila terkena penyakit infeksi. Beberapa parameter yang dapat memperlihatkan perubahan patologi pada darah adalah kadar hematokrit, hemoglobin, jumlah sel darah merah dan jumlah sel darah putih.
Hematokrit merupakan perbandingan antara sel darah merah dengan plasma darah, serta berpengaruh terhadap pengaturan sel darah merah. Hematokrit merupakan sarana bagi akuakulturis untuk mengetahui apakah ikan yang dibudidayakan mengalami anemia atau tidak. Hematokrit adalah persentase volume eritrosit di dalam darah, dan nilainya berhubungan dengan jumlah sel darah merah. Peningkatan kadar hematokrit ini dipengaruhi oleh dua faktor yaitu perubahan parameter lingkungan terutama suhu perairan serta keadaan fisiologi ikan terkait dengan energi yang dibutuhkan (Jawad et al. 2004).
Faktor suhu lingkungan berpengaruh langsung terhadap parameter-parameter darah terutama hematokrit, juga terhadap daya ikat oksigen oleh darah yang akan menurunkan kadar hemoglobin (Wells, 1999). Nilai hematokrit darah ikan berkisar antara 5-60% (Snieszko et al. 1960). Apabila ikan terserang penyakit atau kehilangan nafsu makan karena sebab-sebab yang tidak jelas, nilai hematokrit menjadi lebih rendah (Snieszko et al. 1960). Angka et al. (1985) menyatakan bahwa apabila ikan terkena penyakit atau nafsu makannya menurun, nilai hematokrit darah menjadi lebih rendah.
Hemoglobin merupakan karakteristik dari eritrosit, warna merah dalam darah segar disebabkan adanya Hb dalam sel darah merah (Lagler et al.1977). Secara fisiologis, hemoglobin menentukan tingkat ketahanan tubuh ikan
dikarenakan hubungannya yang sangat erat dengan adanya daya ikat oksigen oleh darah. Hemoglobin adalah protein dalam eritrosit yang tersusun atas protein globin tidak berwarna dan pigmen heme yang dihasilkan dalam eritrosit. Wells et
al.(2005) mengatakan bahwa 1 gram hemoglobin dapat mengikat kira-kira 1,34
ml oksigen.
2.6 Kualitas Air 2.6.1 Suhu
Suhu adalah pengatur utama dalam proses-proses alami di lingkungan perairan. Daya toleransi ikan terhadap suhu sangat bervariasi bergantung pada spesies dan stadia hidupnya. Suhu optimal bagi ikan nila adalah 250C-300C. Pada kisaran tersebut konsumsi oksigen cukup tinggi sehingga nafsu makan tinggi sementara pada suhu dibawah 200C nafsu makan menurun.
2.6.2 Oksigen Terlarut
Pada lingkungan perairan, kandungan oksigen dalam air dapat dilihat melalui kandungan oksigen terlarut. Berdasarkan hasil penelitian kualitas air dan kontaminasi polutan membuktikan bahwa oksigen terlarut (dissolved oxygen) merupakan parameter paling penting sebagai penunjang kehidupan organisme akuatik. Oksigen digunakan oleh organisme akuatik untuk proses respirasi. Ketersediaan oksigen sangat berpengaruh terhadap metabolilsme dalam tubuh dan untuk kelangsungan hidup suatu organisme. Oksigen terlarut dalam air dapat berasal dari difusi dengan udara dan adanya proses fotosintesis dari tanaman air. Kelarutan oksigen di air menurun dengan semakin meningkatnya salinitas, setiap peningkatan salinitas sebesar 9 mg/l mengurangi kelarutan oksigen sebanyak 5 % dari yang seharusnya di air tawar (Boyd, 1982).
Kebutuhan organisme akan oksigen sangat bervariasi bergantung pada umur ikan, ukkuran ikan, dan kondisi ikan (Boyd, 1979). Menurut Brett (1979), jika kandungan oksigen terlarut dalam air pada wadah budidaya kurang dari 3 mg/l dan suhu air berkisar antara 200C-320C dapat menyebabkan laju pertumbuhan, efisiensi pakan, dan jumlah pakan yang diberikan menurun. Penurunan kadar oksigen terlarut hingga di bawah 5 mg/l dapat menyebabkan
gangguan pada sistem reproduksi, pertumbuhan, dan kematian organisme budidaya.
2.6.3 Nilai pH
Nilai pH mengekspresikan konsentrasi molar dari ion hydrogen yang berupa logaritma negatif (pH = - log [H+] adalah indicator utama yang digunakan untuk mengevaluasi kualitas dari air permukaan dan kecocokan untuk pemanfaatan tertentu. Kebanyakan biota akuatik sensitive terhadap perubahan pH. Kematian, reduksi, dan perubahan dari spesies terjadi ketika pH berubah diluar limit toleransi biota itu. Sebagian besar spesies akuatik lebih menyukai pH mendekati netral tetapi dapat bertahan juga pada rentang 6 sampai 8.5. Dekomposisi bahan organik dan respirasi dalam perairan akan menurunkan kandungan oksigen terlarut dan menaikkan kandungan CO2 yang akan berpengaruh terhadap penurunan nilai pH. Penurunan nilai pH dapat mengakibatkan terlepasnya logam berat dari tanah sebagai substrat, peningkatan kandungnan ammonia, dan CO2 yang bersifat racun (toksik) bagi organisme akuatik (Boyd, 1982).
Kisaran pH yang dapat diterima untuk pemeliharaan ikan dan produktivitas perairan adalah 6.5-8.5 (Boyd dan Lichkoppler, 1979). Walaupun kebanyakan perairan alami tidak mengandung bahan kimia pada konsentrasi yang cukup besar diatas batas ketahanan ikan. Pada pH 5.5 perkembangan ikan sangat sensitive terhadap bakteri parasit dan biasanya mati dalam waktu singkat pada kondisi lebih rendah atau sama dengan 4.5.
2.6.4 Amonia
Pada perairan, nitrogen berupa nitrogen anorganik dan nitrogen organik. Nitrogen anorganik terdiri dari ammonium (NH4+), nitrit (NO2-), dan nitrat (NO3 -). Nitrogen organic berupa protein, asam amino, dan urea. Amonia (NH3) dan garam-garamnya bersifat mudah larut dalam air. Sumber ammonia di perairan adalah pemecahan nitrogen organic (urea dan protein) dan nitrogen anorganik di dalam tanah dan air yang berasal dari dekomposisi bahan organic (tumbuhan dan biota akuatik yang telah mati) oleh mikroba dan jamur (Effendi, 2003).
Dua produk utama hasil metabolisme adalah CO2 dan NH3, yaitu produksi ammonia berjumlah sekitar 1/10 dari jumlah produksi karbondioksida. Amonia dieksresikan oleh banyak organisme akuatik dan terus diproduksi sebagai hasil dari dekomposisi ekskresi dari organisme mati. Persentase ammonia bebas meningkat dengan meningkatnya nilai pH dan suhu perairan. Selain terdapat dalam bentuk gas, ammonia membentuk kompleks dengan beberapa ion logam. Amonia juga dapat terserap ke dalam bahan-bahan tersuspensi dan koloid sehingga mengendap di dasar perairan. Amonia di perairan dapat menghilang melalui volatisasi karena tekanan parsial ammonia dalam larutan meningkat dengansemakin meningkatnya pH. Hilangnya ammonia ke atmosfer juga dapat di tingkatkan oleh kecepatan angin dan suhu. Konsentrasi ammonia dipengaruhi oleh pH, suhu air, salinitas, konsentrasi oksigen, dan konsentrasi natrium serta kesadahan (Wedemeyer, 1996).
Menurut Boyd (1982), tingkat keracunan ammonia tiap spesies berbeda-beda tetapi pada kadar 0.6 mg/l dapat membahayakan organisme tersebut. Kandungan NH3 – H di perairan tropika tidak lebih dari 1 mg/l agar kehidupan menjadi normal.
2.6.5 Alkalinitas
Alkalinitas adalah gambaran kapasitas air untuk menetralkan asam atau dikenal dengan sebutan acid neutralizing capacity (ANC) atau kuantitas anion di dalam air yang dapat menetralkan kation hydrogen. Alkalinitas juga diartikan sebagai kapasitas penyangga (buffer capacity) terhadap perubahan pH perairan.
Kalsium karbonat merupakan senyawa yang member kontribusi terhadap nilai alkalinitas dan kesadahan di perairan tawar. Kelarutan kalsium karbonat menurun dengan meningkatnya suhu dan karbondioksida (Effendi, 2003). Satuan alkalinitas dinyatakan dengan mg/l kalsium karbonat (CaCO3) atau miliekuivalen/l. Selain bergantung pada pH, alkalinitas juga dipengaruhi oleh komposisi mineral, suhu, dan kekuatan ion. Nilai alkalinitas yang baik berkisar 30-500 mg/l (Effendi, 2003).
2.6.6 Kesadahan
Kesadahan menggambarkan kandungan Ca2+ dan Mg2+ serta ion logam polivalen lainnya. Kesadahan air yang paling banyak adalah akibat hadirnya ion Ca2+ dan Mg2+ sehingga dalam pengukurannya hanya diarahkan pada penetapan Ca2+ dan Mg2+ dalam air (Boyd, 1982). Kesdahan yang kurang dari 15 mg/l CaCO3 akuivalen, akan menyebabkan pertumbuhan organisme perairan menjadi lambat dan bahkan akan menyebabkan kematian. Kesadahan yang berkisar 20-150 mg/l CaCO3 ekuivalen dalam perairan baik untuk menunjang kehidupan perairan.
III. METODE PENELITIAN
3.1 Waktu dan Tempat
Penelitian ini dilaksanakan di Laboratorium Lingkungan dan Laboratorium Kesehatan Ikan, Departemen Budidaya Perairan, Fakultas Perikanan dan Ilmu Kelautan, Institut Pertanian Bogor. Penelitian ini dilakukan pada bulan Mei sampai dengan Juli 2009.
3.2 Alat dan Bahan
Alat yang digunakan selama penelitian adalah perangkat hemasitometer, jarum suntik, tabung eppendorf, sentrifuse, mikroskop, timbangan digital, seperangkat alat bedah untuk mengambil organ dalam ikan uji, seperangkat alat untuk pembuatan preparat histologi. Sedangkat alat yang digunakan untuk mengukur kualitas air meliputi termometer, pH meter, DO meter, Spektrofotometer, Buret dan Vortex. Wadah budidaya yang digunakan adalah akuarium ukuran 25x35x40 cm3 sebanyak 12 buah, sarinngan/serokan, peralatan aerasi serta selang siphon.
Bahan yang digunakan untuk penelitian ini adalah merkuri (Hg) sebagai bahan toksik yang sudah ditentukan konsentrasinya, ikan nila ( Oreochromis
niloticus) dengan bobot 15.70±1.13 gram. Bahan-bahan lainnya meliputi larutan
Hayem, Turk’s, Na-sitrat 3.8%, akuades dan HCl 0.1 N, larutan Bouins, xylol, paraffin, alkohol 50%, alkohol 70%, alkohol 80%, alkohol 90%, alkohol 95% dan alkohol 100%.
3.3 Metode Penelitian
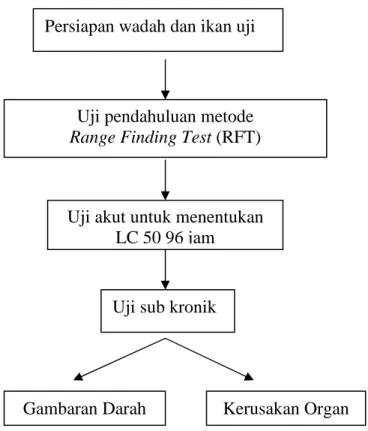
Tahap penelitian meliputi :
Gambar 5. Diagram alir tahap penelitian
3.3.1 Persiapan Wadah dan Ikan Uji
Akuarium didesinfeksi dengan menggunakan Kalium Permanganat dengan dosis 25 ppm dan dibilas dengan menggunakan air bersih. Air yang digunakan sebagai media hidup ikan sebelumnya harus diendapkan terlebih dahulu dalam tandon. Akuarium kemudian diisi dengan air hingga ketinggian mencapai 20 cm dan dipasang aerasi. Setiap akuarium di isi 8 ekor ikan uji. Masa pemeliharaan diawali dengan mengadaptasikan ikan terhadap lingkukngan yang baru selama 3 hari. Ikan uji diberi pakan buatan berupa pellet terapung (kadar protein 28%) secara ad satiation pada pukul 07.00, 12.00, dan 16.00. Untuk menjaga kualitas air selama penelitiandilakukan penyiponan dan penggantian air sebanyak 1/3 bagian setiap hari sekali pada pagi hari.
Persiapan wadah dan ikan uji
Uji pendahuluan metode
Range Finding Test (RFT)
Uji akut untuk menentukan LC 50 96 jam
Uji sub kronik
3.3.2 Uji Pendahuluan
Sebanyak 80 ekor hewan uji yang dibagi menjadi 8 perlakuan. Uji pendahuluan ini bertujuan untuk memperkirakan dosis merkuri yang menyebabkan mortalitas 100% dan mengetahui batas bawah dan batas atas penggunaan merkuri dengan menggunakan metode Range Finding Test (RFT). Lama perlakuan satu hari (24 jam). Berdasarkan hasil uji pendahuluan, dilakukan uji akut untuk toksisitas merkuri. Sebanyak 70 ekor hewan uji dibagi menjadi tujuh perlakuan, yaitu satu kelompok kontrol dan enam kelompok perlakuan, masing–masing terdiri dari 10 ekor. Perlakuan dengan enam macam konsentrasi dengan interval yang lebih sempit berdasarkan hasil uji pendahuluan. Lama perlakuan selama 96 jam atau empat hari.
Untuk mengetahui struktur mikroanatomi insang, hati, ginjal serta hematologi ikan nila, dilakukan uji Sub kronik dengan menggunakan 36 ekor hewan uji yang terbagi dalam empat kelompok perlakuan. Setelah masa perlakuan selesai (1 bulan) maka dari masing-masing perlakuan diambil 2 ekor ikan setiap 10, 20 dan 30 hari untuk pengamatan hematologi dan diambil insang, hati serta ginjal untuk difiksasi dengan formalin 10%, kemudian dibuat preparat mikroanatomi dengan metode paraffin dan pewarnaan hematoxylin-Eosin (HE). Matrik penelitian dapat dilihat pada tabel 2.
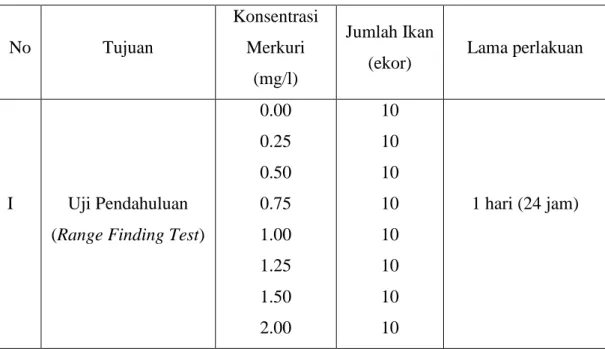
Tabel 2. Nilai konsentrasi, jumlah ikan dan lama perlakuan pada tiap-tiap uji
No Tujuan
Konsentrasi Merkuri
(mg/l)
Jumlah Ikan
(ekor) Lama perlakuan
I Uji Pendahuluan (Range Finding Test)
0.00 0.25 0.50 0.75 1.00 1.25 1.50 2.00 10 10 10 10 10 10 10 10 1 hari (24 jam)
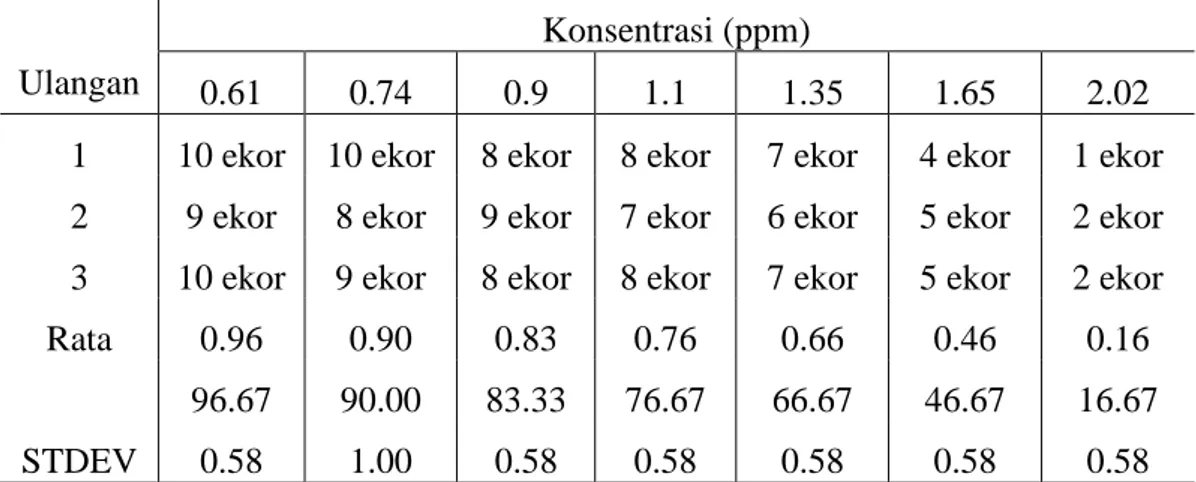
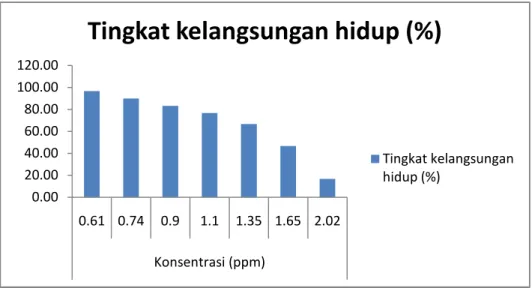
II Uji Akut 0.61 0.74 0.90 1.10 1.35 1.65 2.02 10 10 10 10 10 10 10 4 hari (96 jam)
III Uji Sub kronik
0 0.16 0.50 1.00 8 8 8 8 30 hari Total 190
Penentuan nilai konsentrasi pada uji pendahuluan yaitu dengan menggunakan Range Finding Test yaitu dengan memperkirakan dosis merkuri yang dapat mengakibatkan kematian 100%.
3.3.3 Uji Akut
Tahap ini dipergunakan untuk menentukan toksisitas merkuri. Langkah yang dilakukan adalah sebanyak 70 ekor hewan uji dibagi menjadi 7 perlakuan ( masing- masing terdiri dari 10 ekor ). Hewan uji tersebut diperlakukan dengan memberikan merkuri pada akuarium perlakuan dengan 7 macam konsentrasi yaitu 0.61 ppm, 0.74 ppm, 0.90 ppm, 1.10 ppm, 1.35 ppm, 1.65 ppm dan 2.02 ppm. Hasil penelitian menunjukkan harga LC 50-96 jam yaitu pada konsentrasi 1.6 ppm. Konsentrasi pada uji akut tersebut didapat dari rumus logaritma dibawah ini. Penentuan harga tersebut adalah dengan menggunakan cara Quantal Responses menurut cara Finney ( 1971 ) dalam Destiany (2007 ). Dari harga LC 50-96 jam tersebut dapat dicari batas aman penggunaan merkuri bagi ikan nila yang akan digunakan pada uji sub kronik.
Dengan : N = konsentrasi ambang atas n = konsentrasi ambang bawah
a = konsentrasi terkecil dalam deret konsentrasi yang ditentukan k = jumlah interval konsentrasi yang di uji
Sedangkan untuk menentukan konsentrasi pada uji sub kronik menggunakan rumus sebagai berikut (Destiany, 2007):
Pada penelitian ini harga LC 50-96 jam adalah 1.6 ppm sehingga diperoleh batas aman pemberian merkuri adalah 0.16 ppm.
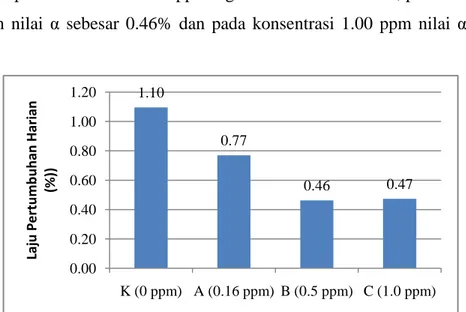
3.3.4 Uji Sub Kronik
Tahap ini bertujuan untuk mengetahui pengaruh merkuri klorida pada organ insang, hati dan ginjal ikan nila serta perubahan gambaran darah pada ikan nila. Pada penelitian ini digunakan empat konsentrasi yaitu di bawah harga LC 50 – 96 jam dan di atas harga LC 50 – 96 jam yaitu pada konsentrasi 0 ppm, 0.16 ppm (batas aman), 0.5 ppm dan 1.0 ppm. Pemberian merkuri klorida ini dilakukan setiap dua hari sekali dengan mengganti air yang dibuang lewat proses penyiponan dengan air berkonsentrasi HgCl2 yang sama. Air yang dibuang melalui penyiponan yaitu sebanyak 1/3 bagian dari volume total. Sehingga kadar merkuri yang berada di media pemeliharaan memiliki konsentrasi yang tetap. Setiap 10 hari sekali diambil sampel insang, hati, ginjal untuk dibuat preparat histologi serta dilakukan pengamatan parameter darah seperti sel darah merah, sel darah putih, hemoglobin dan hematokrit.
Batas aman = 10% x LC 50-96 jam Log (ܰ/݊) = k log(a/n)