ISOLASI DAN IDENTIFIKASI GOLONGAN SENYAWA FENOLIK DARI DAUN TUMBUHAN JARAK
KEPYAR (Ricinus communis L.)
SKRIPSI
HESRI ELPRIYANTI GINTING 170822080
PROGRAM STUDI S1 KIMIA
FAKULTAS MATEMATIKA DAN ILMU PENGETAHUAN ALAM UNIVERSITAS SUMATERA UTARA
MEDAN 2020
ISOLASI DAN IDENTIFIKASI GOLONGAN SENYAWA FENOLIK DARI DAUN TUMBUHAN JARAK
KEPYAR (Ricinus communis L.)
SKRIPSI
Diajukan untuk melengkapi tugas dan memenuhi syarat mencapai gelar sarjana sains
HESRI ELPRIYANTI GINTING 170822080
PROGRAM STUDI S1 KIMIA
FAKULTAS MATEMATIKA DAN ILMU PENGETAHUAN ALAM UNIVERSITAS SUMATERA UTARA
MEDAN 2020
Judul : Isolasi dan Identifikasi Golongan Senyawa Fenolik Dari Daun Tumbuhan Jarak Kepyar (Ricinus communis L.)
Kategori : Skripsi
Nama : Hesri Elpriyanti Ginting
Nomor Induk Mahasiswa : 170822080 Program Studi : Sarjana Kimia
Fakultas : Matematika Dan Ilmu Pengetahuan Alam Universitas Sumatera Utara
Disetujui di Medan, Januari 2020
Ketua Program Studi, Pembimbing,
Dr. Cut Fatimah Zuhra, M.Si Dr. Helmina Br Sembiring, M.Si
NIP: 197404051999032001 NIP.197602022000122002
ISOLASI DAN IDENTIFIKASI GOLONGANSENYAWA FENOLIK DARI DAUN TUMBUHAN JARAK
KEPYAR (Ricinus communis L.)
SKRIPSI
Saya menyatakan bahwa skripsi ini adalah karya sendiri, kecuali beberapa kutipan dan ringkasan yang masing masing disebutkan sumbernya.
Medan, Januari 2020
Hesri Elpriyanti Ginting
170822080
Puji dan syukur penulis panjatkan kepada Tuhan Yesus Kristus karena atas berkat dan kasihNya sehingga penulis mampu menyelesaikan perkuliahan, penelitian dan penulisan skripsi ini dengan judul Isoalsi dan Identifikasi Golongan Senyawa Fenolik dari Daun Tumbuhan Jarak Kepyar (Ricinus communis L.).
Ucapan terimakasih penulis sampaikan kepada Ibu Dr. Helmina Br Sembiring, M.Si selaku dosen pembimbing sekaligus sebagai Kepala Laboratorium Kimia Bahan Alam Hayati FMIPA USU yang telah banyak memberikan bimbingan, motivasi dan pengajaran kepada penulis selama penelitian hingga menyelesaikan penulisan skripsi ini, dan kepada Bapak Dr. Lamek Marpaung, M.Phil yang juga telah banyak memberikan arahan dan bimbingan kepada penulis selama penelitian.
Terimakasih kepada Dekan dan Wakil Dekan FMIPA USU, Ibu Dr. Cut Fatimah Zuhra selaku Ketua Departemen Kimia FMIPA USU dan Bapak Dr. Firman Sebayang, MS selaku koordinator Kimia Ekstensi dan beserta seluruh Staf, Dosen dan Pegawai Departemen Kimia FMIPA USU, Bapak Drs. Albert Pasaribu M.Sc selaku dosen pembimbing akademik sekaligus seabagai Ketua Bidang Laboratorium Kimia Bahan Alam Hayati FMIPA USU yang telah memberikan arahan kepada penulis selama masa perkuliahan, beserta seluruh Dosen, Staff di Departemen Kimia FMIPA USU.
Ucapan terima kasih yang tak terhingga penulis sampaikan kepada Bapak J.
Ginting dan Ibu S. Br Tarigan selaku orang tua penulis dan adik penulis (Ridho dan Fika) doa dan dukungan yang luar biasa kepada penulis. Terima kasih kepada sahabat dan teman-teman semua serta teman seperjuangan Kimia ekstensi 17 yang tidak bisa disebutkan satu persatu dan kepada Citra Cost atas doa dan dukungan yang diberikan kepada penulis.
Akhir kata penulis berharap semoga skripsi ini bermanfaat bagi penelitian dan kemajuan ilmu pengetahuan.
Medan, Januari 2020
Hesri Elpriyanti Ginting
ISOLASI DAN IDENTIFIKASI GOLONGAN SENYAWA FENOLIK DARI DAUN TUMBUHAN JARAK
KEPYAR (Ricinus communis L.)
ABSTRAK
Isolasi dan identifikasi golongan senyawa fenolik yang terkandung di dalam daun tumbuhan jarak kepyar (Ricinus communis L.) telah dilakukan. Daun tumbuhan jarak kepyar diekstraksi maserasi dengan pelarut metanol. Ekstrak pekat metanol dilarutkan dengan etil asetat secara berulang-ulang sampai larutan tersebut negatif fenolik. Ekstrak pekat etil asetat dilarutkan dengan metanol dan dipartisi n-heksan.
Ekstrak pekat metanol di analisis kromatografi lapis tipis dan dipisahkan dengan kromatografi kolom dengan eluen kloroform : metanol (90:10; 80:20; 70:30.
Senyawa yang diperoleh dimurnikan dengan kromatografi lapis tipis preparatif, dihasilkan 12 mg padatan amorf berwarna kuning kecokelatan dengan harga Rf 0,56 menggunakan eluen kloroform : etil asetat (70:30) v/v. Berdasarkan spektrum UV- Vis dengan pelarut metanol menunjukkan panjang gelombang (λ max) 282 nm dengan adsorbansi 0,880. Spektrum FT-IR menunjukkan adanya gugus OH, C-H sp2 dari proton aromatis, C-H sp3 dari OCH3, C=O ester, C=C aromatis dan gugus C-O.
Spektrum Resonansi Magnetik Inti Proton (1H-NMR) menunjukkan adanya proton H-2 dan H-6 pada cincin aromatis senyawa fenolik, dan proton dari -OCH3.
Berdasarkan data yang diperoleh diduga bahwa senyawa hasil isolasi yang diperoleh adalah senyawa fenolik golongan asam fenolat yaitu metil galat.
Kata Kunci : Isolasi, Jarak Kepyar , Fenolik, Asam Fenolat, Metil Galat.
(Ricinus communis L.)
ABSTRACT
Isolation and identification of phenolic which contained in Jarak Kepyar leaves (Ricinus commuis L.) has been done. Jarak Kepyar leaves were extracted maceration by methanol solvent. The concentrated extract of methanol then dissolved with ethyl acetate until the solution negative phenolic. The concentrated extract of ethyl acetate then dissolved with methanol and partition extract with n-hexane. The concentrated of methanol was analyzed by thin layer chromatography and separated by column chromatography with eluent chloroform: methanol (90:10; 80;20; 70:30).
The compound was purified with TLC preparative amorphous solids with weight 12 mg with Rf 0,56 use eluent chloroform : ethyl acetate (70:30) v/v. Based on UV- Visible spectrum, the wavelength (λ max) of 282 nm with adsorption of 0,88. Infrared spectrum (FT-IR) showed the presence of OH groups, C-H sp2 from aromatic protons, C-H sp3 from OCH3, C=O ester, C=C aromatic and C-O groups. Based on the magnetic resonance spectrum of the proton nucleus (1H-NMR) shows the presence proton H-2 and H-6 in the aromatic ring of phenolic compounds, and protons from –OCH3. From these data, it was estimated that the compound phenolic was estimated as phenolic acid of methyl gallate.
Keywords: Isolation, Jarak Kepyar, Phenolic, Phenolic Acid, Methyl Gallate.
Halaman
PENGESAHAN SKRIPSI i
PERNYATAAN ORISINALITAS ii
PENGHARGAAN iii
ABSTRAK iv
ABSTRACT v
DAFTAR ISI vi
DAFTAR TABEL viii
DAFTAR GAMBAR ix
DAFTAR LAMPIRAN x
BAB 1 PENDAHULUAN
1.1 Latar Belakang 1
1.2 Permasalahan 2
1.3 Tujuan Penelitian 3
1.4 Manfaat Penelitian 3
1.5 Metodologi Penelitian 3
BAB 2 TINJAUAN PUSTAKA
2.1 Tumbuhan Jarak Kepyar 4
2.1.1 Morfologi Tumbuhan Jarak Kepyar 4 2.1.2 Klasifikasi Ilmiah Tumbuhan Jarak Kepyar 5
2.2 Senyawa Organik Bahan Alam 5
2.3 Senyawa Fenolik 5
2.3.1 Klasifikasi Senyawa Fenolik 6
2.4 Teknik Pemisahan 14
2.4.1 Ekstraksi 14
2.4.2 Partisi 15
2.4.3 Kromatografi 15
2.4.3.1 Kromatografi Lapis Tipis 15
2.4.3.2 Kromatografi Kolom 16
2.4.3.3 Kromatografi Lapis Tipis Preparatif 17
2.5 Teknik Spektroskopi 18
2.5.1 Spektofotometer Ultraviolet-Visibel ( UV-Vis ) 18 2.5.2 Spektroskopi Inframerah ( FT-IR ) 19 2.5.3 Spektroskopi Resonansi Magentik Inti Proton (1H-NMR) 20
3.2.1 Alat Penelitian 21
3.2.2 Bahan Penelitian 21
3.3 Penyediaan Sampel 22
3.4 Uji Pendahuluan Terhadap Ekstrak Daun Tumbuhan
Jarak Kepyar 22
3.5 Ekstraksi Daun Tumbuhan Jarak Kepyar 22
3.6 Analisis Kromatografi Lapis Tipis 22
3.7 Pemisahan Senyawa Fenolik dengan Kromatografi Kolom 23
3.8 Pemurnian Senyawa Hasil Isolasi 23
3.9 Identifikasi Senyawa Hasil Isolasi 24
3.9.1 Identifikasi dengan Spektofotometer UV-Vis 24 3.9.2 Identifikasi dengan Spektroskopi FT-IR 24 3.9.3 Identifikasi dengan Spektroskopi (1H-NMR) 24
3.10 Bagan Penelitian 25
3.10.1 Bagan Uji Skrining Fitokimia 25
3.10.2 Bagan Pemisahan Senyawa Fenolik dari Daun
Tumbuhan Jarak Kepyar 26
BAB 4 HASIL DAN PEMBAHASAN
4.1 Hasil Penelitian 27
4.2 Pembahasan 30
BAB 5 KESIMPULAN DAN SARAN
5.1 Kesimpulan 33
5.2 Saran 33
DAFTAR PUSTAKA 34
LAMPIRAN 37
Nomor Judul Halaman Tabel
2.1 Klasifikasi Senyawa Fenolik 7
2.2 Klasifikasi tanin berdasarkan struktur kimia dan monomernya 13 4.1 Panjang Gelombang UV-Visible Senyawa Hasil
Isolasi 28
4.2 Hasil Analisa Spektrum FT-IR Senyawa Hasil Isolasi 29 4.3 Pergeseran kimia dan jenis peak 1H-NMR senyawa
hasil isolasi 30
Nomor Judul Halaman Gambar
2.1 Struktur Fenol 6
2.2 Struktur Floroglukokinol 6
2.3 Struktur 3 (a). Vanilin, (b). Syringaldehyde
dan (c). 8
2.4 Struktur Struktur (a) Asam p-kumarat;
(b) p-koumaril aldehid; (c) p-koumaril Alkohol 8 2.5 Struktur (a). Plumbagin, (b). Alkanin, dan (c). Lawsone 9
2.6 Struktur Xanton 9
2.7 Struktur Stilben 9
2.8 Struktur Dasar Flavonoid 10
2.9 Sistem Penomoran Flavonoid 10
2.10 Struktur Koniferol Alkohol 10
2.11 Struktur Hinokiflavon 11
2.12 Struktur Asam Galat 11
2.13 Struktur (a) Metil Galat, (b) Fenil Galat , (c) Triaseton Asam 12 Galat, (d) Asam Galat Metil Ester, (e) Etil Galat
4.1 Senyawa Hasil Isolasi 27
4.2 Spektrum UV-Vis Senyawa Hasil Isolasi 27 4.3 Spektrum Infra Merah ( FT-IR ) Senyawa Hasil Isolasi 28 4.4 Spektrum 1H-NMR Senyawa Hasil Isolasi 29 4.5 Struktur Metil Galat 32
Nomor Judul Halaman Lampiran
1 Tumbuhan Jarak Kepyar 37
2 Hasil Determinasi Tumbuhan Jarak Kepyar
(Ricinus commnunis L.) Sebelum Kromatografii Kolom 38 3 Kromatografi Lapis Tipis Ekstrak Pekat Metanol Daun
Tumbuhan Jarak Kepyar Sebelum Penggabungan Fraksi 39 4 Kromatografi Lapis Tipis Fraksi I-III Hasil Penggabungan
Setelah Kromatografi Kolom 40
5 Kromatografi Lapis Tipis Fraksi I Sebelum Kromatografi
Lapis Tipis Preparatif 41
6 Kromatografi Lapis Tipis Senyawa Hasil Isolasi 42
7 Spektrum 1H-NMR Senyawa Pembanding 43
1.1 Latar Belakang
Indonesia dikenal sebagai mega biodiversity country, yaitu bangsa yang memiliki keanekaragaman hayati. Di hutan tropis Indonesia terdapat sekitar 30.000 tumbuhan, jauh melebihi daerah tropis lainnya di dunia, seperti Amerika Selatan dan Afrika Barat. Hanya Brasil yang mampu menyamai kekayaan flora Indonesia.
Diduga dari jumlah tersebut sekitar 9.600 spesies diketahui berkhasiat obat, dan sekitar 200 spesies di antaranya merupakan tumbuhan obat penting bagi industri obat tradisional (Kardinan dan Kusuma, 2004).
Setiap tumbuhan memiliki senyawa kimia yang terkandung di dalam tumbuhan. Beragam jenis dan senyawa kimia yang terkandung dalam tumbuhan akan memiliki khasiat dan manfaat. Upaya pencarian tumbuhan berkhasiat obat telah lama dilakukan, baik untuk mencari senyawa baru ataupun menambah keanekaragaman senyawa yang telah ada. Pencarian tersebut dilakukan dengan berbagai pendekatan seperti cara empiris, etnobotani dan etnofarmakalogi (Djauhariya dan Hermani, 2004).
Senyawa metabolit sekunder merupakan senyawa kimia yang terdapat dalam suatu organisme yang tidak terlibat secara langsung dalam proses pertumbuhan, perkembangan, dan reproduksi organisme. Salah satu senyawa metabolit sekunder adalah senyawa-senyawa fenolik ( Herbert, 1995).
Senyawa fenolik atau polifenol merupakan salah satu kelompok senyawa terpenting yang terdapat pada tumbuhan. Istilah fenolik atau polifenol dapat diartikan sebagai suatu senyawa yang memiliki cincin aromatik yang mengandung satu atau lebih gugus hidroksil. Senyawa fenolik tersebut dapat ditemukan pada semua bagian tumbuhan tingkat tinggi, termasuk daun, akar, ranting, kulit, kayu, bunga, dan biji.
Tumbuhan yang digunakan sebagai makanan kaya akan senyawa fenolik. Beberapa senyawa fenolik berperan sebagai antioksidan. Hal ini dikarenakan memiliki penangkal radikal yang menghasilkan aktifitas antioksidan yang berperan sebagai agen pereduksi dan pendonor atom hidrogen (Yuslianti, 2018)
Salah satu tanaman yang dapat digunakan untuk pengobatan adalah tanaman jarak kepyar yang merupakan tumbuhan perdu (Nurcholis dan Sumarsih, 2007).
Daun tumbuhan jarak kepyar ini merupakan tanaman obat yang biasanya digunakan masyarakat untuk mengobati koreng, perut kembung, batuk sesak, hernia, dan demam (Agromedia, 2008).
Berdasarkan hasil uji fitokimia dan uji aktivitas antioksidan daun jarak kepyar mengandung senyawa alkaloid, flavonoid, fenolik, terpenoid dan dengan menggunakan metode DPPH diperoleh fraksi etanol dan fraksi etil asetat yang berpotensi digunakan sebagai antioksidan (Sarfina, dkk 2017).
Mutia dan Rasmi, (2017) melaporkan bahwa efektivitas daun Jarak Kepyar (Ricinus communis L.) sebagai anti-piretik yaitu dengan memblok jalur siklooksigenase (COX-2) dan fosfolipase A2 serta menjadi penghambat mediator inflamasi sehingga dapat menghambat proses terjadinya demam.
Utami dkk, (2016) telah melalukan uji aktivitas larvasida ekstrak daun jarak kepyar (R. Communis L.) terhadap larva nyamuk Aedes aegypti melaporkan bahwa ekstrak etanol daun jarak kepyar efektif sebagai larvasida terhadap larva nyamuk aedes aegypti yang ditunjukkan dengan nilai LC50 sebesar .
Namun belum ada penelitian mengenai isolasi dan identifikasi golongan senyawa fenolik dari daun tumbuhan jarak kepyar sehingga penulis tertark untuk melakukan isolasi dan identifikasi golongan senyawa fenolik dari tumbuhan daun jarak kepyar. Isolasi dilakukan dengan metode ekstraksi maserasi, pemisahan tanin, ekstraksi partisi, pemisahan dengan kromatografi kolom, proses pemurnian, dan analisis kromatografi lapis tipis. Identifikasi golongan senyawa fenolik dilakukan dengan menggunakan spektrofotometer UV-Visibel, Infra Merah (FT-IR) dan Spektrofotometer Resonansi Magnetik Inti Proton (1H-NMR).
1.2 Permasalahan
Permasalahan dalam penelitian ini adalah senyawa fenolik golongan apakah yang terdapat dalam daun tumbuhan jarak kepyar (R. communis L.)
1.3 Tujuan Penelitian
Tujuan dari penelitian ini adalah untuk mengisolasi dan menentukan golongan senyawa fenolik dari daun tumbuhan Jarak Kepyar.
1.4 Manfaat Penelitian
Dari hasil penelitian diharapkan dapat memberikan sumber informasi ilmiah pada bidang Kimia Bahan Alam Hayati khususnya tentang isolasi dan identifikasi golongan senyawa fenolik yang terkandung dalam daun tumbuhan Jarak Kepyar.
1.5 Metodologi Penelitian
Dalam penelitian ini, isolasi senyawa fenolik dilakukan terhadap serbuk daun tumbuhan jarak kepyar yang kering halus. Pada tahap awal dilakukan uji skrining fitokimia untuk senyawa fenolik yaitu dengan merendam daun tumbuhan jarak kepyar menggunakan pelarut etil asetat dengan menggunakan pereaksi FeCl3 5%.
Tahap isolasi yang dilakukan adalah ekstraksi maserasi dengan menggunakan pelarut metanol. Kemudian tahap pemisahan tanin dilakukan dengan ekstrasi partisi dengan etil asetat. Ekstrak bebas tanin dilarutkan dengan pelarut metanol, kemudian diekstrasi partisi dengan pelarut n-heksan. Lapisan metanol dipekatkan lalu dianalisa dengan kromatografi lapis tipis dan pemisahan dilakukan dengan kromatografi kolom sehingga dihasilkan fraksi-fraksi fenolik. Fraksi-fraksi fenolik yang dihasilkan kembali dianalisa dengan kromatografi lapis tipis, kemudian dimurnikan dengan kromatografi lapis tipis preparatif sehingga dihasilkan senyawa fenolik, yang kemudian dianalisa dengan kromatografi lapis tipis sehingga dihasilkan senyawa fenolik yang murni. Identifikasi struktur senyawa murni hasil isolasi dilakukan dengan Spektroskopi UV-Vis, FT-IR, dan 1H-NMR.
BAB 2
TINJAUAN PUSTAKA
2.1 Tumbuhan Jarak Kepyar (R. communis L.) 2.1.1.Morfologi Tumbuhan Jarak Kepyar
Tanaman jarak kepyar, yang bernama ilmiah R. communis L., berasal dari Ethiophia. Nama latin R. communis diberikan oleh seorang ilmuwan Swedia yang bernama Carolus Linneaeus. Ricinus dalam bahasa latin berarti ”serangga”. Buah jarak kepyar berbintik-bintik dan bentuknya sekilas memang mirip serangga.
Tanaman ini pertama kali dibudidayakan oleh bangas Portugis dan Spanyol. Mereka menyebutnya sebagai Agno Casto, bangsa Inggris menyebutnya Castor (Widodo dan Suwarsih, 2007).
Disetiap daerah di Indonesia jarak kepyar dikenal dengan namanya sendiri- sendiri yaitu kaliki (Sunda); jarak (Jawa); kaleke (Madura); gloah (Gayo); jarag, dulang, jarak, kalikih alang, lulang (Sumatera); malasai, alale, tangang jara, peleng kaliki jera (Sulawesi), jarak (Bali); paku perunai (Timor); balacai (Ternate) dan balacai tamekot (Halmahera) (Agromedia, 2008).
Jarak kepyar tumbuh tegak setinggi 2-3 meter. Batang mempunyai ruang dan berwarna kebiru-biruan. Tangkai daun jarak berwarna hijau sampai kemerah- merahan, tergantung varietasnya. Daun berbentuk menjari dan mempunyai 5 sampai 11 lobi dengan tepi daun bergerigi. Warna daun hijau muda sampai hijau tua keabu- abuan. Bunga tersusun dalam bentuk tandan. Buahnya berbentuk bola memanjang berlekuk tiga, mempunyai duri tempel. Bijinya dapat digunakan sebagai bahan baku untuk membuat minyak kastroli, yang dibutuhkan dalam industri farmasi (Nurcholis dan Sumarsih, 2007).
Daun tumbuhan jarak kepyar mengandung saponin, alkaloid, fenolik, terpenoid, senyawa flavonoid antara lain kaemferol-3-rutinoside, nikotoflorin, isoquersetin, rutin, kaempferol, kuersetin, astragalin, reynoutrin, risinin dan vitamin C (Agromedia, 2008; Mutia dan Rasmi, 2017; Sarfina, dkk 2017).
2.1.2 Klasifikasi Ilmiah Tumbuhan Jarak Kepyar
Divisi : Spermatophyta (Tumbuhan Berbiji)
Subdivisi : Angiospermae (Tumbuhan Berbiji Tertutup) Kelas : Dicotyledoneae (Tumbuhan Berbiji Belah Dua)
Suku : Euphorbiaceae
Marga : Ricinus
Spesies : Ricinus comunis L.
(Widodo dan Sumarsih,
2007)
2.2 Senyawa Organik Bahan Alam
Pada hakekatnya kimia bahan alam merupakan pengetahuan yang telah dikenal sejak peradaban manusia tumbuh. Contoh yang dapat segera diketahui adalah pembuatan bahan makanan, pewarnaan benda, obat-obatan atau stimulan, dan sebagainya (Sastrohamidjojo, 1996).
Senyawa bahan alam adalah senyawa organik yang merupakan hasil dari proses metabolisme dalam organisme hidup yang dapat juga disebut sebagai metabolit . Senyawa bahan alam dibedakan menjadi dua berdasarkan fungsi terhadap makhluk hidup pembuatnya yaitu:
a. Metabolit Primer
Metabolit primer pada semua organisme sama meskipun berbeda genetiknya.
Polisakarida, protein, lemak dan asam nukleat merupakan penyusun utama makhluk hidup.
b. Metabolit Sekunder
Metabolit sekuder adalah senyawa yang disintesis oleh mahkluk tumbuhan, mikrobia atau hewan melewati proses biosintesis yang digunakan untuk menunjang kehidupan. Metabolit ini memiliki aktifitas farmakologi dan biologi (Saifudin, 2014)
2.3 Senyawa Fenolik
Senyawa fenolik adalah senyawa yang mempunyai satu atau lebih gugus hidroksil pada cincin aromatiknya. Senyawa fenolik merupakan metabolit sekunder yang paling banyak didistribusikan dan secara universal terdapat dalam kingdom
tumbuhan. Lebih dari 8000 jenis fenolik yang berbeda telah diidentifikasi ( Nollet dan Gutierrez, 2018 ).
Senyawa fenolik secara umum memiliki potensi sebabagi bakterisidal, antiseptik, antioksidan, dan sebagainya (Pangelly, 2006). Senyawa ini dapat digolongkan sebagai antioksidan karena senyawa ini berkemampuan untuk membersihkan spesies oksigen dan nitrogen reaktif (Firdaus dkk, 2013).
Gambar 2.1 Struktur Senyawa Fenol
Fenolik memiliki banyak kemiripan dengan alkohol alifatik dimana kelompok hidroksil terikat pada rantai karbon. Gugus hidroksil pada fenolik dipengaruhi oleh cincin aromatiknya dimana hidrogen pada fenolik bersifat labil menyebabkan fenol bersifat asam lemah. Senyawa fenolik dapat dikarakterisasi dari tanaman dan biasanya ditemukan dalam bentuk ester dan glikosida bukan sebagai senyawa bebas (Vermerris et al., 2006).
2.3.1 Klasifikasi Senyawa Fenolik
Adapun kelas utama dari senyawa fenolik dalam tanaman yaitu:
1. C6 : Fenolik Sederhana
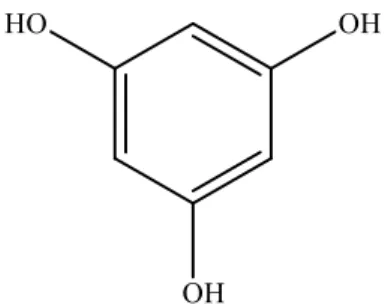
Senyawa dari gugus ini merupakan hasil substitusi dari gugus fenol, dimana substituennya dapat berupa substitusi dalam posisi orto,meta atau para. Contoh asam fenolik sederhana adalah Floroglukinol (Vermerris et al., 2006).
Gambar 2.2 Struktur Floroglukokinol
Tabel 2.1 Klasifikasi Kelas Utama Senyawa Fenolik berdasarkan jumlah atom Karbon
Jumlah atom karbon
Kerangka dasar Kelas Contoh
6 C6 Fenol sederhana
Benzokuinon
Katekol, hidrokuinon 2,6-
Dimetoksibenzokuinon
7 C6-C1 Asam fenolat p-hidroksibenzoat,
salisilat
8 C6-C2 Asetofenon 3-asetil-6-
metoksibenzaldehid Asam fenil asetat p-hidroksibenzaldehid
9 C6-C3 Asam hidroksi
sinamat
Kafeat, ferulat Fenilpropana Mirisitin, eugenol Kumarin Ubelliferon, aeskuletin Isokumarin Bergenin
Kromon Eugenin
10 C6-C4 Naptokuinon Juglone, plumbagin
13 C6-C1-C6 Xanton Mangiferin
14 C6-C2-C6 Stilbenes Asam lunularat
Antarakuinon Emodin
15 C6-C3-C6 Flavonoida Kuersetin, sianidin
Isoflavonoida Genistein
18 (C6-C4)2 Lignan Pinoresinol
Neolignan Eusiderin 30 (C6-C3-C6)2 Biflavonoida Amentoflavon,
Hinokiflavon
(Harborne and Mabry, 1987) 2. C6-C2 : Vanilin dan Syringaldehide
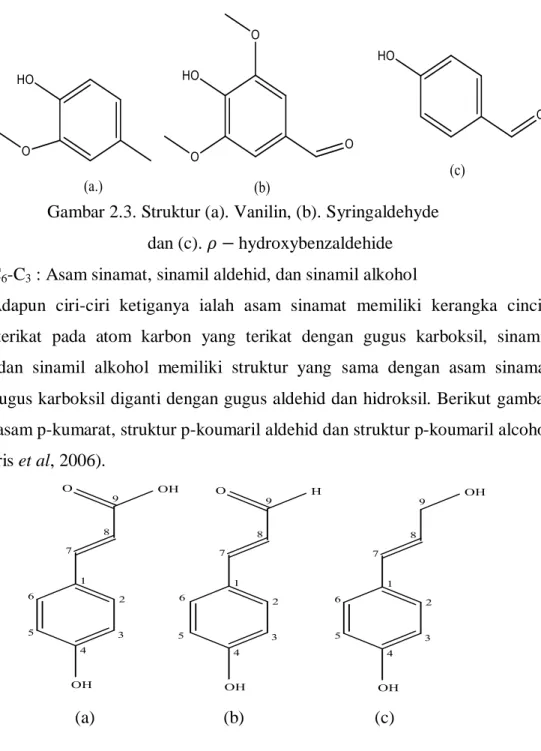
Fenol sederhana (C6) didistribusikan secara luas pada tanaman dan termasuk senyawa seperti timol, resorsinol, dan orcinol. Asam fenolik (C6-C1) berasal dari asam benzoat. Demikian juga, fenolik aldehida (C6-C2) berasal dari asam fenolik dan termasuk senyawa seperti vanilin, syringaldehyde, dan p-hydroxybenzaldehyde (Nollet and Gutierrez, 2018).
Gambar 2.3. Struktur (a). Vanilin, (b). Syringaldehyde dan (c). hydroxybenzaldehide 3. C6-C3 : Asam sinamat, sinamil aldehid, dan sinamil alkohol
Adapun ciri-ciri ketiganya ialah asam sinamat memiliki kerangka cincin benzen terikat pada atom karbon yang terikat dengan gugus karboksil, sinamil aldehid dan sinamil alkohol memiliki struktur yang sama dengan asam sinamat namun gugus karboksil diganti dengan gugus aldehid dan hidroksil. Berikut gambar struktur asam p-kumarat, struktur p-koumaril aldehid dan struktur p-koumaril alcohol (Varmerris et al, 2006).
(a) (b) (c)
Gambar 2.4 Struktur (a) Asam p-kumarat; (b) p-koumaril aldehid; (c) p-koumaril Alkohol
4. C6-C4 : Naftokuinon
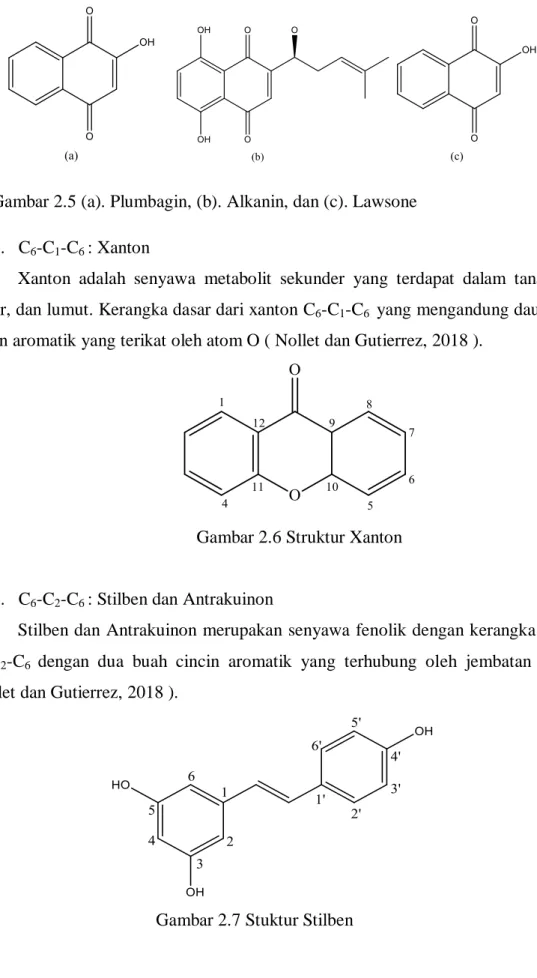
Naftokuinon adalah senyawa fenolik yang tersebar luas pada tanaman, jamur, dan bakteri. Naftokuinon di biosintesis melalui jalur asetat dan mevalonate yang dipadukan dengan jalur sikimat. Beberapa contoh naftokuinon adalah plumbagin, lawson, dan alkanin ( Nollet dan Gutierrez, 2018).
Gambar 2.5 (a). Plumbagin, (b). Alkanin, dan (c). Lawsone 5. C6-C1-C6 : Xanton
Xanton adalah senyawa metabolit sekunder yang terdapat dalam tanaman, jamur, dan lumut. Kerangka dasar dari xanton C6-C1-C6 yang mengandung dau buah cincin aromatik yang terikat oleh atom O ( Nollet dan Gutierrez, 2018 ).
Gambar 2.6 Struktur Xanton
6. C6-C2-C6 : Stilben dan Antrakuinon
Stilben dan Antrakuinon merupakan senyawa fenolik dengan kerangka dasar C6-C2-C6 dengan dua buah cincin aromatik yang terhubung oleh jembatan etilen (Nollet dan Gutierrez, 2018 ).
Gambar 2.7 Stuktur Stilben
7. C6-C3-C6: Flavonoida
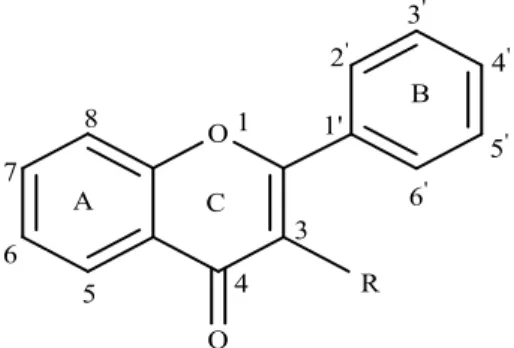
Flavonoid merupakan salah satu golongan senyawa fenol alam yang terbesar dalam tanaman dan tersusun oleh 15 atom karbon sebagai inti dasarnya. Tersusun dari konfigurasi C6-C3-C6 yaitu 2 cincin aromatik dan dihubungkan oleh tiga atom karbon. Seperti yang ditunjukkan oleh gambar berikut ini :
Gambar 2.8 Struktur Dasar Senyawa Flavonoid
Sistem penomoran senyawa flavonoid secara umum dimulai dari cincin C dan A dengan angka biasa dilanjutkan ke cincin B angka yang “beraksen” seperti yang ditunjukkan gambar berikut ini: (Parwata, 2016).
Gambar 2.9 Sistem Penomoran Flavonoid 8. (C6-C3)2: Lignan dan Neolignan.
Lignan dan Neolignan adalah dua kelompok utama senyawa dengan kerangka karbon (C6-C3)2, yang merupakan hasil dari penyatuan kimia dua penilpropana (Nollet dan Gutierrez, 2018 ).
Gambar 2.10 Struktur Arylnaphthalens
9. (C6-C3-C6)2 : Bioflavonoid
Seperti namanya, biflavonoid adalah hasil dari persatuan kovalen antara dua flavonoid. Biflavonoid yang umum termasuk dimer flavon-flavon, flavanon-flavon, flavanon-flavanon, atau subunit flavon-flavonol. Dimer flavonoid dihubungkan baik oleh ikatan C-C atau C-O-C (Nollet dan Gutierrez, 2018 ).
Gambar 2.11 Struktur Amentoflavon 10. C6-C1 : Asam Fenolat
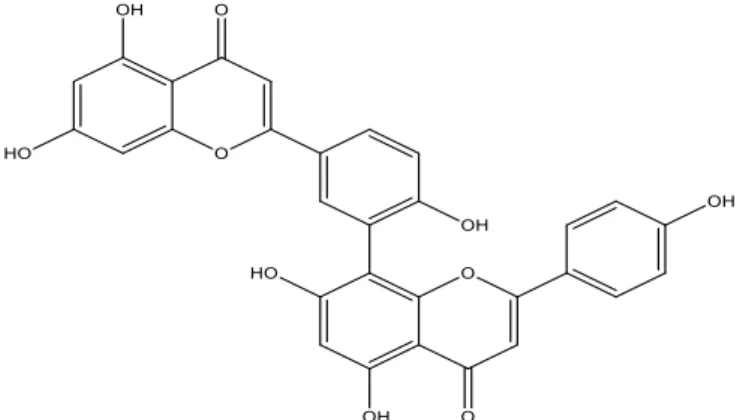
Senyawa fenolik dari golongan asam fenolat adalah fenol yang tersubstitusi oleh gugus karboksil. Contohnya yaitu asam galat yang merupakan trifenol yang biasa terdapat dalam daun teh dalam bentuk teresterifikasi bersama katekin.
OH
OH HO
OH O
Gambar 2.12 Struktur Asam Galat 10.1 Asam Galat
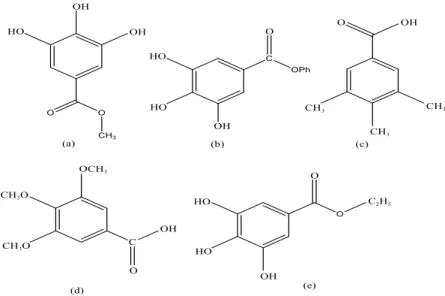
Asam galat atau nama lain 3,4,5-trihidroxyi benzoic acid merupakan salah satu seyawa feol yang memiliki aktifitas antijamur, antivirus, memiliki kemampuan sitotoksis melawan sel kanker tanpa merusak sel tubuh lainnya, antioksidan dan agen antikarsinogenik. Kemungkinan antioksidan dari asam galat lebih kuat dari troloks, suatu analog dari vitamin E yang larut dalam air (Sohi et al, 2003). Asam galat dan sejenisnya umumnya hadir dalam berbagai buah dan jumlah tanaman, selain itu sejumlah besar turunan asam galat yang disintesis juga tersedia. Berikut struktur dari beberapa turunan asam galat (Nayeem et al., 2016).
Gambar 2.13 Struktur (a) Metil Galat, (b) Fenil Galat , (c) Triaseton Asam Galat, (d) Asam Galat Metil Ester, (e) Etil Galat
10.1.1 Metil Galat
Methyl gallate (MG) adalah anti tumor yang ampuh dan agen terapi baru untuk glioma. Metil galat memiliki berbagai sifat biologis yang mencakup aktivitas anti-oksidan, anti-inflamasi, dan anti-mikroba. Metil galat juga secara signifikan mengurangi viabilitas sel, migrasi, dan tingkat fosforilasi dalam pengobatan sel glioma (Lee et al., 2013).
11. Tanin
Senyawa tanin termasuk dalam golongan senyawa polifenol yang merupakan senyawa kompleks turunan dari jenis fenol. Tanin umumnya dikenal sebagai bahan dalam penyamakan hewan agar menjadi kulit yang awet. Tanin juga penyebab timbulnya rasa sepat (astringentcy). Beberapa sifat umum tanin adalah :
a. Warna umumnya putih kekuningan sampai coklat cerah, bentuk amorf.
b. Diketahui banyak terkandung dalam kulit dan buah tanaman.
c. Tanin berciri bau agak memusingkan (faint) dan terasa sepat (astringent taste)
d. Tanin akan berwarna gelap bila terkena udara dan cahaya
e. Tanin mudah teroksidasi oleh enzim yaitu fenolase yang terdapat dalam jaringan tanaman menjadi bentuk ketonnya.
Tanin dapat dibedakan satu dengan lainnya berdasarkan struktur kimia, kelarutan dan kemampuan terekstraknya. Haslam mengelompokkan tanin menjadi
tiga, tergantung pada struktur monomernya yaitu: 1. Proantosianidin atau tanin terkondensasi, 2. Tanin terhidrolisa, dan 3. Phlorotanin. Klasifikasi tanin berdasarkan struktur kimia dan monomernya dapat dilihat pada Tabel 2.2 di bawah ini:
Tabel 2.2 Klasifikasi tanin berdasarkan struktur kimia dan monomernya
Kelompok Monomer Struktur Monomer
1. Tanin
terkondensasi
Katekin
Afzelichin
Gallokatekin
Epikatekin
Epigallokatekin
2. Tanin Terhidrolisa
Asam Galat
Asam Heksahidroksi-
difenik
3. Phlorotanin Phloroglusinol
2.4 Teknik Pemisahan
Teknik pemisahan bertujuan untuk memisahkan komponen yang akan ditentukan berada dalam keadaan murni, tidak tercampur dengan komponen- komponen lainnya. Ada 2 jenis teknik pemisahan:
1. Pemisahan kimia merupakan suatu teknik pemisahan yang berdasarkan adanya perbedaan yang besar dari sifat-sifat fisika komponen dalam campuran yang akan dipisahkan.
2. Pemisahan fisika merupakan suatu teknik pemisahan berdasarkan pada perbedaan-perbedaan kecil dari sifat-sifat fisik antara senyawa-senyawa yang termasuk dalam satu golongan (Muldja, 1995).
2.4.1 Ekstraksi
Ekstraksi merupakan salah satu teknik pemisahan untuk memisahkan atau menarik satu atau lebih senyawa-senyawa (analit) dari suatu sampel dengan
menggunakan pelarut yang sesuai. Ekstraksi padat-cair memiliki prinsip pemisahan didasarkan pada kemampuan atau daya larut analit dalam pelarut tertentu.
Maserasi, perkolasi, dan sokletasi merupakan jenis ekstraksi padat-cair.
Perkolasi merupakan salah satu jenis ekstraksi padat-cair yang dilakukan dengan cara mengalirkan pelarut secara perlahan pada sampel dalam suatu perkolator. Maserasi dilakukan dengan cara merendam sampel menggunakan pelarut yang sesuai pada suhu kamar. Sedangkan, Sokletasi menggunakan alat soklet (Leba, 2017).
.Dalam ekstraksi padat-cair, bahan tanaman ditempatkan dalam sebuah wadah, dan dibiarkan terjadi kontak dengan pelarut. Proses yang terjadi dari seluruh proses dinamis tersebut dapat diuraikan menjadi beberapa tahap, yaitu tahap pertama pelarut akan berdifusi ke dalam sel, kemudian pelarut akan melarutkan metabolit, dan pada proses akhir pelarut akan berdifusi keluat dari sel bersama dengan metabolit (Sarker, 2006).
2.4.2 Partisi
Metode pemisahan yang mungkin paling sederhana adalah partisi, yang banyak digunakan sebagai tahap awal pemurnian ekstrak.Partisi menggunakan dua pelarut tak bercampur yang ditambahkan kedalam ekstrak tersebut, hal ini dapat dilakukan secara terus menerus dengan menggunakan dua pelarut yang tak bercampur yang kepolarannya meningkat (Heinrich et al., 2010).
2.4.3 Kromatografi
Kromatografi adalah suatu teknik pemisahan yang pertama kali dipakai untuk memisahkan zat-zat warna tanaman.Pemisahan dengan teknik ini dijalankan dengan mengadakan manipulasi atas dasar perbedaan sifat-sifat fisik dari zat-zat yang menyusun suatu campuran (Adnan, 1997).
Pada prinsipnya, teknik ini untuk memisahkan suatu persenyawaan dengan struktur yang sama atau berbeda sedikit, dengan adsorpsi secara selektif pada adsorban yang berbeda. Dikenal dua fase pada kromatografi, yaitu fase gerak dan fase diam. Fase gerak dapat berupa cairan atau gas, sedangkan fase diam dapat berupa padatan atau cairan (Heinrich et al., 2010 ).
2.4.3.1 Kromatografi Lapis Tipis
Kromatografi lapis tipis merupakan salah satu metode yang paling banyak digunakan dan paling mudah untuk memurnikan sejumlah kecil komponen. Metode
ini menggunakan lempeng kaca atau aluminium yang telah dilapisi dengan penyerap (misalnya silika gel) dengan ketebalan tertentu tergantung pada jumlah bahan alam yang akan dimuat kedalam lempeng (Heinrich et al, 2010).
Kromatografi Lapis Tipis digunakan untuk tujuan sebagai berikut : 1. Untuk memeriksa komposisi campuran secara tepat
2. Untuk menentukan kondisi percobaan kromatografi kolom 3. Untuk mengetahui kesempurnaan suatu reaksi
4. Untuk mengidentifikasi obat, ekstrak tanaman
5. Untuk mendeteksi kontaminan, pemalsuan dan lain-lain
Adsorben yang umum digunakan dalam kromatografi lapis tipis antara lain silika gel, alumina, tanah diatom, dan serbuk selulosa. Ukuran partikel dan kepadatan lapisan adsorben juga menentukan laju perambatan, yaitu makin halus partikel adsorben, perambatan makin lambat (Harmita, 2009)
Pada kromatografi lapis tipis, dikenal istilah faktor reterdasi (Rf) yang dinyatakan sebagai perbandingan jarak yang digerakkan oleh senyawa dari titik awal terhadap jarak yang digerakkan oleh pelarut dari titik awal aplikasi. Dengan suatu rumusan, keterangan tersebut dinyatakan sebagai:
(Rubiyanto, 2017) Kromatografi lapis tipis memiliki tujuan sebagai berikut:
a. Mencari pelarut untuk kromatografi kolom
b. Analisi fraksi yang diperoleh dari kromatografi kolom
c. Untuk mengetahui perkembangan reaksi seperti hidrolisis atau metilasi d. Identifikasi flavonoida secara ko-kromatografi
e. Isolasi flavonoida murni skala kecil (Markham, 1988).
2.4.3.2 Kromatogafi Kolom
Kromatografi kolom merupakan suatu metode pemisahan preparatif. Metode ini memungkinkan untuk melakukan pemisahan suatu sampel yang berupa campuran dengan berat beberapa gram. Pada prinsipnya kromatografi kolom adalah suatu teknik pemisahan didasarkan pada peristiwa adsorpsi. Sampel yang biasa berupa larutan pekat diletakan pada ujung kolom. Dengan adanya gaya gravitasi atau karena
bantuan tekanan, maka eluen/pelarut akan melewati kolom dan proses pemisahan akan terjadi seperti pada umumnya, eluen/pelarut yang digunakan dimulai dari yang paling nonpolar dan dinaikan secara gradien kepolarannya hingga pemisahan dapat terjadi. Sama halnya pada KLT, pemisahan dapat terjadi karena adanya perbedaan kelarutan senyawa pada eluen/pelarut (Kristanti, 2008).
Pengisian kolom dengan adsorben dapat dilakukan dengan cara kolom diisi homogen dengan adsorben. Prosedur ini dapat dilakukan dengan mencampurkan adsorben dengan pelarut hingga membentuk bubur (slurry), kemudian dituangkan kedalam kolom yang berisi pelarut. Dengan memukul-mukul kolom atau dengan mengaduk campuran didalam kolom, dapat membantu homogenitas kemasan dan menghilangkan gelembung-gelembung udara yang ada. Perluh diperhatikan bahwa sebelum dan selama proses pemisahan, permukaan kolom hars terendam dalam pelarut. Sebelum sampel dimasukkan, ketinggian pelarut ± 1 cm diatas permukaan kolom. Kolom dicuci dengan eluen, kemudian sampel yang telah dilarutkan dengan sejumlah kecil volume eluen dimasukkan kemudian kran dibuka dengan hati-hati. Setelah pemasukkan sampel terjadi proses elusi atau pemisahan komponen-komponen sampel. Elusi diteruskan hingga komponen-komponen terpisah atau hingga tiap-tiap komponen keluar dari kolom. Untuk senyawa yang tidak berwarna, eluat dipisahkan dalam beberapa fraksi, yang masing-masing dengan volume kecil dan penetapan tiap tiap fraksi. Dan tahap yang terakhir yaitu deteksi atau penetapan kadar komponen. Dimana senyawa kemudian ditetapkan dan ditimbang setelah fraksi diuapkan dengan uji bercak, KKt atau KLT atau dengan spektrofotometri (Harmita, 2009).
2.4.3.3 Kromatografi Lapis Tipis Preparatif
Pada KLT preparatif, sampel dilarutkan dalam sedikit pelarut sebelum ditotolkan pada plat pelarut yang baik yang digunakan yaitu pelarut non polar seperti n-heksana, diklorometana, etil asetat. Jika pelarut digunakan sedikit polar akan terjadi pelebaran pita (Hostettman dkk, 1995).
Sampel yang akan dipisahkan ditotolkan berupa garis pada salah satu sisi plat lapisan dan dikembangkan secara tegak lurus pada garis sampel sehingga campuran akan terpisah menjadi beberapa pita. Penampakan pita dilakukan dengan cara yang tidak merusak senyawa yang tidak berwarna dan penjerap yang mengandunng pita
dikerok dari plat kaca kemudian sampel dielusi dengan penjerap dengan pelarut polar (Gritter, 1991).
2.5 Teknik Spektroskopi
Teknik spektroskopi merupakan salah satu teknik analisis fisika-kimia yang mengamati tentang interaksi atom atau molekul dengan radiasi elektromagnetik (REM). Spektometer adalah salah satu instrumen pada teknik spektroskopi yang memakai monokromator celah tetap pada bidang fokus. Apabila spektromoter tersebut dilengkapi dengan detektor yang bersifat fotoelektrik maka disebut spektrofotometer (Muldja,1995).
2.5.1 Spektrofotometer Ultraviolet-Visibel ( UV-Vis )
Spektrofotometer UV-Vis merupakan pengukuran panjang gelombang dan intensitas sinar ultraviolet dan cahaya tampak yang diabsorbsi oleh sampel.Spektrofotometer UV-Vis umumnya digunakan untuk menentukan jenis kromofor, ikatan rangkap terkonjugasi, serta menganalisis senyawa organik secara kuantitatif dengan menggunakan hukum Lambert-Beer.
Sebagai sumber cahaya biasanya digunakan lampu hidrogen atau deuterium untuk pengukuran uv dan lampu tungsten untuk pengukuran pada cahaya tampak.
Panjang gelombang dari sumber cahaya akan dibagi oleh pemisah panjang gelombang (wavelength separator) seperti prisma atau monokromator. Spektrum didapatkan dengan cara scanning oleh wavelength separator sedangkan pengukuran kuantitatif bisa dibuat dari spektrum atau pada panjang gelombang tertentu. Ketika suatu atom atau molekul menyerap cahaya maka energi tersebut akan menyebabkan tereksitasinya elektron pada kulit terluar ke tingkat energi yang lebih tinggi. Tipe eksitasi tergantung pada panjang gelombang cahaya yang diserap. Sinar ultraviolet dan sinar tampak akan menyebabkan elektron tereksitasi ke orbital yang lebih tinggi.
Sistem yang bertanggung jawab terhadap absorbsi cahaya disebut dengan kromofor.
Beberapa istilah penting :
1. Kromofor; merupakan gugus tak jenuh (pada ikatan kovalen) yang bertanggung jawab terhadap terjadinyaabsorbsi elektronik (misalnya C=C, C=O, dan NO2).
2. Auksokrom; merupakan gugus jenuh dengan adanya elektron bebas (tidak terikat), dimana jika gugus ini bergabung dengan kromofor, akan mempengaruhi panjang gelombang dan intensitas absorban.
3. Pergeseran Batokromik; merupakan pergeseran absorban ke daerah panjang gelombang yang lebih panjang karena adanya substitusi atau efek pelarut.
4. Pergeseran Hipsokromik; merupakan pergeseran absorban ke daerah panjang gelombang yang lebih pendek karena adanya substitusi atau efek pelarut.
5. Efek Hiperkromik; merupakan peningkatan intensitas absorban.
6. Efek Hipokromik; merupakan penurunan intensitas absorban (Dachriyanus, 2004)
Senyawa fenolik dapat diidentifikasi dengan mudah dengan menggunakan metode spektroskopi salah satunya adalah spektrofotometer Ultraviolet (UV).
Spektrofotometer Ultraviolet biasanya digunakan untuk mengkarakterisasi dan mengidentifikasi tipe-tipe senyawa fenol. Spektra UV-Vis dari tiap pigmen tumbuhan akan berbeda dikarenakan kromofor yang berbeda-beda.
Saat ini penggunaan spektoskopi UV-Vis paling sering digunakan dalam aplikasi untuk analisa kuantitatif, dan nilai dari metode ini dapat mengurangi perbandingan informasi yang banyak dari teknik spektroskopi yang lainnya seperti NMR dan MS (Andersen et al., 2006).
2.5.2 Spektroskopi Inframerah ( FT-IR )
Spektrum inframerah suatu molekul adalah hasil transisi antara tingkat energi getaran (vibrasi) yang berlainan. Inti-inti atom yang terikat oleh ikatan kovalen mengalami getaran (vibrasi) atau osilasi dengan cara dua bola yang terikat oleh suatu pegas. Bila molekul menyerap radiasi inframerah, energi yang diserap menyebabkan kenaikan dalam amplitude getaran atom-atom yang terikat itu. Jadi, molekul ini dalam keadaan vibrasi tereksitasi, energi yang diserap ini akan dibuang dalam bentuk panas bila molekul itu kembali ke keadaan dasar. Panjang gelombang ekstrak dari absorpsi oleh suatu tipe ikatan yang berlainan (C-H, C-C, C=O, C=C, O-H, dan sebagainya) menyerap radiasi merah pada panjang gelombang yang berlainan.
Dengan demikian spektrometri inframerah dapat digunakan untuk mengidentifikasi adanya gugus fungsi dalam suatu molekul. Banyaknya energi yang diserap juga beraneka ragam dari ikatan ke ikatan. Ini disebabkan sebagian oleh
perubahan dalam momen dipol (µ≠0) pada saat energi diserap. Ikatan nonpolar (seperti C-H atau C-C) menyebabkan absorpsi lemah, sedangkan ikatan polar (seperti misalnya O-H, N-H, dan C=O) menunjukkan absorpsi yang lebih kuat (Supratman, 2010).
2.5.3 Spektrofotometer Resonansi Magnetik Inti proton (1H-NMR)
Spektroskopi resonansi magnetik inti (NMR) merupakan salah satu metoda spektroskopi yang sangat penting bagi kimiawan organik. Spektroskopi resonansi magnetik inti memberikan keterangan tentang jumlah setiap jenis/tipe hidrogen dan juga memberikan tentang sifat lingkungan dari setiap tipe hidrogen tersebut.
Gabungan data IR dan NMR sering cukup untuk menentukan struktur senyawa yang tidak diketahui (Sastrohamidjojo, 2004).
Spektroskopi resonansi magnet proton dapat digunakan untuk menentukan jenis lingkungan atom yang berbeda yang ada dalam molekul; jumlah atom hidrogen pada masing-masing jenis lingkungan hidrogen dan jumlah atom hidrogen pada atom karbon tetangga. Sinyal-sinyal resonansi muncul karena proton-proton dalam molekul berada dalam lingkungan kimia yang berlainan. Sinyal-sinyal resonansi letaknya terpisah karena adanya geseran kimia (chemical shift). Tidak semua sinyal berpola sederhana (berupa garis tunggal atau singlet), beberapa sinyal mengikuti pola pemecahan (splitting) yang karakteristik, seperti doublet, triplet, dan kuartet.
Pemecahan disebabkan oleh penggandengan spin-spin (spin-spin coupling), yaitu interaksi magnetik suatu inti dengan inti yang lain (Harmita, 2009).
Pada beberapa spektrum NMR akan terlihat sinyal TMS pada angka nol sehingga sinyal ini tidak perlu dianalisa. TMS dipilih sebagai standart karena: TMS mempunyai 12 atom hidrogen yang keseluruhannya mempunyai lingkungan kimia yang sama, sehingga menghasilkan singlet yang kuat karena mengandung banyak atom hidrogen. Elektron-elektron pada ikatan C-H dalam senyawa ini berada dekat dengan hidrogen jika dibanding dengan senyawa lain. Ini berarti inti hidrogen sangat terlindung dari medan magnet eksternal sehingga dibutuhkan medan magnet yang besar untuk membawa atom hidrogen ke kondisi resonansi (Dachriyanus, 2004).
BAB 3
METODE PENELITIAN
3.1 Waktu dan Tempat Penelitian
Sampel yang diteliti adalah daun tumbuhan jarak kepyar yang diperoleh dari Desa Cingkes, Kabupaten Simalungun, Sumatera Utara (lampiran 1). Identifikasi sampel dilakukan di Laboratorium Herbarium Medanese (MEDA) Universitas Sumatera Utara (lampiran 2). Penelitian ini dilakukan pada bulan Mei 2019 sampai November 2019 di laboratorium Kimia Bahan Alam Hayati FMIPA USU dan Laboratorium Pascasarjana Kimia FMIPA USU. Identifikasi senyawa meliputi analisis Spektrometer Resonansi Magnetik Inti Proton (1H-NMR) dengan menggunakan pelarut metanol dilakukan di Laboratorium ITB pada tanggal 29 Oktober 2019, Spektrofotometer Inframerah (FT-IR) dan Spektrofotometer UV- Visible dilakukan di Laboratorium Kimia Organik FMIPA UGM pada tanggal 29 Oktober 2019.
3.2 Alat dan Bahan 3.2.1 Alat Penelitian
Spektrofotometer 1H-NMR (Agilent 2NMR 500MHz), Spektrofotometer FT- IR (Shimadzu), Spektrofotometer UV-Vis (Hewlett Packard agilent), Kolom Kromatografi (pyrex), Rotarievaporator (Heidolph), Lampu UV (254nm/356nm), UVGL5 8, Neraca Analitis (Mettler AE 200), Chamber, Ekstraktor, Alat Destilasi, Corong pisah (Pyrex), Beaker glass, Erlenmeyer, Penangas Air, Gelas ukur, Botol vial, Pipa Kapiler, Statif dan klem.
3.2.2 Bahan Penelitian
Serbuk daun jarak kepyar, Metanol (Teknis), Etil asetat (Teknis), n-heksan (Teknis), Silika Gel (70 – 230 mesh, E-merck kgA), FeCl3 5%, Serbuk Mg, HCl(p) ,
H2SO4(p), kapas, kloroform (p.a E.Merck), Plat KLT silika gel 60 F254 (E.Merck Art 554), Plat KLT Preparatif 60 F254, Aseton (p.a Merck).
3.3 Penyediaan Sampel
Daun jarak kepyar dikeringkan diudara terbuka, lalu dihaluskan sampai diperoleh serbuk daun jarak kepyar sebanyak 2000 g.
3.4 Uji Pendahuluan Terhadap Ekstrak Daun Jarak Kepyar
Serbuk kering halus daun jarak kepyar diidentifikasi dengan melakukan uji pendahuluan secara kualitatif dengan reaksi warna dengan cara memasukkan 10 gram serbuk daun jarak kepyar yang telah dikeringkan kedalam gelas Erlenmeyer, kemudian ditambahkan 100 mL etil asetat lalu didiamkan setelah itu disaring.
Ekstrak sampel dimasukkan ke dalam tabung reaksi kemudian ditambahkan dengan pereaksi FeCl3 5% menghasilkan larutan berwarna hitam.
3.5 Ekstraksi Daun Jarak Kepyar
Serbuk daun jarak kepyar ditimbang sebanyak 2000 gram, kemudian dimaserasi menggunakan metanol sebanyak 10 liter hingga semua sampel sampai terendam dan dibiarkan ± 2 hari. Maserat ditampung dan dipekatkan menggunakan alat rotarievaporator sehingga diperoleh ekstrak pekat metanol. Kemudian diuapkan pada penangas air hingga semua pelarut metanol menguap. Lalu dilakukan pemisahan tanin dengan cara melarutkan ekstrak metanol dengan etil asetat kemudian disaring. Filtrat etil asetat kemudian dirotarievaporator lalu diuapkan hingga semua pelarut etil asetat menguap. Fraksi etil asetat dilarutkan kembali dengan metanol dan diekstraksi partisi berulang-ulang dengan n-heksan sampai lapisan n-heksan hampir bening. Lapisan metanol dipisahkan dari lapisan n-heksana, lalu dipekatkan kembali dengan rotarievaporator dan diuapkan kembali sehingga diperoleh ekstrak pekat metanol.
3.6 Analisa Kromatografi Lapis Tipis
Analisa kromatografi lapis tipis dilakukan terhadap ekstrak metanol dengan menggunakan fase diam silika gel 60F254 Merck. Analisis ini dimaksudkan untuk mencari sistem dan perbandingan pelarut yang sesuai untuk kromatografi kolom.
Fase gerak yang digunakan adalah campuran pelarut kloroform : metanol dengan perbandingan 90:10; 80:20; 70:30 (v/v).
Dimasukkan 10 ml campuran larutan fase gerak kloroform : metanol (90:10) v/v kedalam bejana kromatografi, kemudian dijenuhkan. Ditotolkan ekstrak pekat metanol pada plat KLT yang telah diaktifkan. Dimasukkan plat kedalam bejana yang
telah berisi campuran pelarut yang telah dijenuhkan, lalu ditutup dan dielusi. Plat yang telah dielusi dikeluarkan dari bejana, lalu dikeringkan. Diamati noda yang terbentuk dibawah sinar UV, kemudian difiksasi dengan pereaksi FeCl3 5%. Diamati warna bercak yang timbul dan dihitung harga Rf yang diperoleh. Dilakukan perlakuan yang sama untuk perbandingan pelarut kloroform : metanol dengan perbandingan 80:20; 70:30 (v/v).
3.7 Pemisahan Senyawa Fenolik dengan Kromatografi Kolom
Dirangkai alat kromatografi kolom. Terlebih dahulu dibuburkan silika gel 60 (70-230 mesh) dengan menggunakan kloroform, diaduk hingga homogen lalu dimasukkan kedalam kolom kromatografi. Kemudian dielusi dengan menggunakan kloroform 100% hingga silika gel padat dan homogen. Dibuburkan 6,0 gram ekstrak pekat metanol dengan silika gel dengan pelarut metanol, kemudian dimasukkan kedalam kolom kromatografi yang telah berisi bubur silika gel, lalu ditambahkan fase gerak kloroform : metanol (90:10) v/v secara perlahan-lahan. Ditingkatkan kepolaran dengan menambahkan fase gerak kloroform : metanol dengan perbandingan 80:20; 70:30 v/v. Hasil yang diperoleh ditampung dalam botol vial setiap 10 ml, lalu di KLT dan digabung fraksi dengan harga Rf yang sama lalu diuji dengan FeCl3 5%. Kemudian diuapkan sampai terbentuk pasta. Pasta yang diperoleh dianalisis kromatografi lapis tipis dengan eluen kloroform : etil asetat (90:10) v/v.
Kemudian di KLT preparatif dengan fase diam silika gel dan fase gerak kloroform : etil asetat (90:10) (v/v), dikeringkan dan disinari dibawah lampu UV. Digerus dari plat dan dielusi dengan campuran metanol : etil asetat 1:1 dan diuapkan.
3.8 Pemurnian Senyawa Hasil Isolasi
Pasta yang diperoleh dari pemisahan kromatografi kolom dilarutkan kembali dengan metanol lalu dianalisis KLT untuk KLT preparatif. Kloroform : etil asetat 70:30 (v/v) adalah fase gerak yang menunjukkan pemisahan yang paling baik untuk selanjutnya digunakan untuk menjenuhkan bejana KLT preparatif. Pasta yang telah dilarutkan ditotolkan secara perlahan-lahan dan sama rata disepanjang tepi bawah plat KLT. Plat dimasukkan kedalam bejana yang berisi campuran pelarut yang telah dijenuhkan, kemudian ditutup. Setelah dielusi, plat dikeluarkan dari bejana, dikeringkan, dan hasilnya diperiksa dibawah sinar UV. Tiap zona diberi tanda dan dikeruk lalu dielusi dengan metanol : etil asetat (1:1) v/v. Filtrat yang diperoleh
dianalisis dengan kromatografi lapis tipis dengan menggunakan fase diam silika gel 60 F254 dengan fase gerak kloroform : etil asetat 70:30 (v/v).
3.9 Identifikasi Senyawa Hasil Isolasi
Senyawa hasil isolasi dianalisis dengan tiga jenis spektrofotometer yaitu spektrofotometer UV-Visible, Spektrofotometer Infra Merah (FT-IR), dan Spektrofotometer Resonansi Magnet Inti Proton (1H-NMR).
3.9.1 Identifikasi dengan Spektrofotometer Ultraviolet Visible (UV-Vis)
Identifikasi dilakukan dengan alat Spektrofotometer Ultraviolet Visible menggunakan pelarut metanol, dengan :
Spesifikasi Alat : - Merek Shimadzu - UV 1800
Waktu Pengerjaan : 29 Oktober 2019 Teknisi Penanggung Jawab : Roch Fitni
3.9.2 Identifikasi dengan Spektrofotometer Infra Merah (FT-IR)
Identifikasi dilakukan dengan alat Spektrofotometer Infra Merah menggunakan pelet KBR, dengan:
Spesifikasi Alat : - Merek Shimadzu - Prastige 21 Waktu Pengerjaan : 29 Oktober 2019 Teknisi Penanggung Jawab : Roch Fitni
3.9.3 Identifikasi dengan Spektrofotometer Resonansi Magnetik Inti Proton (1H-NMR)
Identifikasi dilakukan dengan Spektrofotometer Resonansi Magnetik Inti Proton menggunakan pelarut metanol, dengan :
Spesifikasi Alat : - Sistem konsol DD2 - Frekuensi 500 MHz (1H) Waktu Pengerjaan : 29 Oktober 2019
Teknisi Penanggung Jawab : Elvira Hermawati
3.10 Bagan Penelitian 3.10.1 Uji Skrining Fitokimia
3.10.2 Pemisahan Senyawa Fenolik Dari Daun Tumbuhan Jarak Kepyar
BAB 4
HASIL DAN PEMBAHASAN
4.1 Hasil Penelitian
Berdasarkan hasil skrining fitokimia terhadap ekstrak etil asetat dari daun tumbuhan jarak kepyar menggunakan pereaksi FeCl3 5% menghasilkan larutan berwarna hitam yang menunjukkan bahwa sampel positif mengandung senyawa fenolik. Hasil isolasi senyawa fenolik dari daun jarak kepyar (R. communis L.) diperoleh senyawa murni berupa padatan amorf berwarna kuning kecoklatan, seberat 12 mg dan nilai Rf 0,56 (Gambar 4.1).
Gambar 4.1 Senyawa Hasil Isolasi
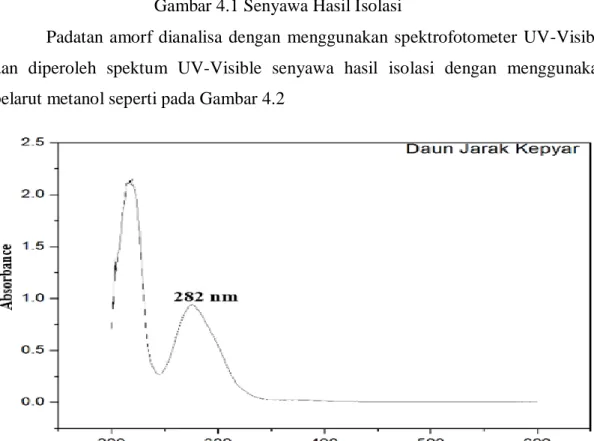
Padatan amorf dianalisa dengan menggunakan spektrofotometer UV-Visible dan diperoleh spektum UV-Visible senyawa hasil isolasi dengan menggunakan pelarut metanol seperti pada Gambar 4.2
Gambar 4.2 Spektrum UV-Vis Senyawa Hasil Isolasi
Dari hasil analisis menggunakan Spektrofotometer UV-Vis menunjukkan adanya satu serapan panjang gelombang maksimum yang ditunjukkan pada Tabel 4.1 Tabel 4.1 Panjang Gelombang UV-Vis Senyawa Hasil Isolasi
Puncak Panjang Gelombang (nm) Absorbansi
I 282 0,880
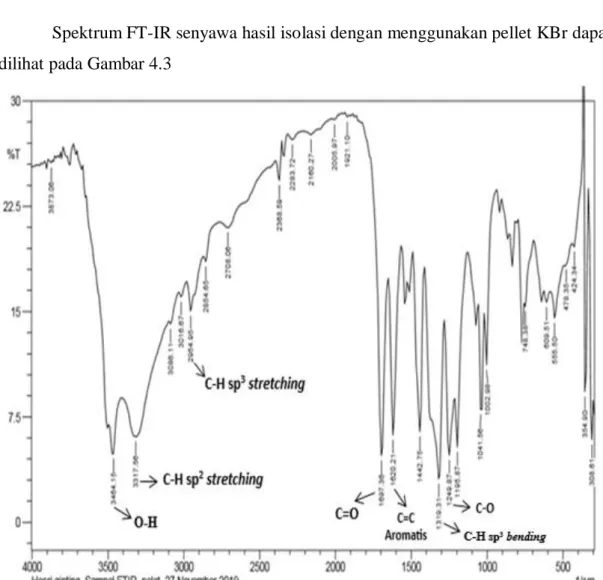
Spektrum FT-IR senyawa hasil isolasi dengan menggunakan pellet KBr dapat dilihat pada Gambar 4.3
Gambar 4.3 Spektrum Inframerah (FT-IR) Senyawa Hasil Isolasi
Hasil analisis spektrometer FT-IR dari senyawa hasil isolasi menghasilkan pita-pita serapan pada daerah bilangan gelombang yang dapat dilihat pada Tabel 4.2
Tabel 4.2 Hasil Analisis Spektrum FT-IR Senyawa Hasil Isolasi Bilangan
Gelombang (cm-1)
Bilangan Gelombang (cm-1) (Harmita, 2009)
Tipe Vibrasi
Gugus Fungsi Intensitas
3464,15 3600-3200 Stretching O-H Tajam
3317,56 Stretching C-H sp2 dari
Proton Aromatis
Melebar
2954,95 2960-2850 Stretching C-H sp3 dari OCH3
Rendah
1697,36 1800-1600 Stretching C=O Ester Tajam
1620,21 1319,31
1680-1600 1450 dan 1375
Stretching Bending
C=C Aromatis C-H sp3
Tajam Tajam
1249,87 1300-1000 Stretching C-O Tajam
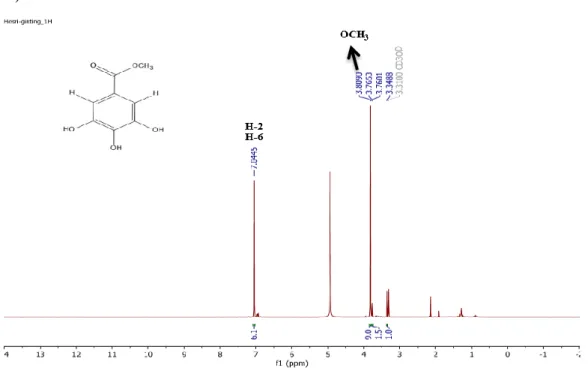
Berikut adalah spektrum 1H-NMR senyawa hasil isolasi dengan menggunakan pelarut metanol (CD3OD) dan TMS sebagai standar internal (Gambar 4.4)
Gambar 4.4 Spektrum 1H-NMR senyawa hasil isolasi
Hasil analisis Spektrofotometer Resonansi Magnetik Inti Proton (1H-NMR) senyawa hasil isolasi dapat dilihat pada Tabel 4.3 berikut:
Tabel 4.3 Pergeseran Kimia 1H-NMR Senyawa Hasil Isolasi Atom H δ H Senyawa Hasil Isolasi
(ppm)
Jenis Puncak
H-2, H-6 7.04 Puncak Singlet
H dari OCH3 3.81 Puncak Singlet
4.2 Pembahasan
Dari hasil isolasi senyawa fenolik dari 2000 g serbuk daun jarak kepyar mulai dari proses ekstraksi maserasi diperoleh 160 g ekstrak pekat metanol dan dilarutkan menggunakan pelarut etil asetat untuk pemisahan senyawa-senyawa yang diduga merupakan tanin dan diperoleh 33 g ekstrak pekat etil asetat. Ekstrak pekat etil asetat yang diperoleh dilarutkan dengan metanol dan dipartisi dengan n-heksan dan diperoleh 9 g ekstrak metanol. Ekstrak metanol yang diduga merupakan senyawa- senyawa fenolik. Kemudian senyawa-senyawa fenolik tersebut dipisahkan dengan cara kromatografi kolom. Sebelum dilakukan kromatografi kolom maka sebelumnya dilakukan analisa kromatografi lapis tipis untuk menentukan eluen yang sesuai.
Dari hasil analisa kromatografi lapis tipis sebelum kromatografi kolom didapat bahwa pelarut yang sesuai adalah kloroform : metanol (90:10) v/v (lampiran 3). Setelah pemisahan dengan kromatografi kolom kemudian dilakukan analisis KLT untuk penggabungan fraksi dengan menggunakan eluen kloroform : etil asetat (90:10) v/v dan didapatkan 3 fraksi (Lampiran 4), dimana noda yang dihasilkan pada plat kromatografi lapis tipis untuk fraksi 1-34 dengan pereaksi FeCl3 5%
menghasilkan pemisahan noda yang paling baik dengan jarak Rf antar noda adalah 0,82; 0,25 dan 0,13 dengan berat 357,5 mg, lalu dianalisis KLT kembali dengan kloroform : etil asetat (70:30) v/v (lampiran 5), yang selanjutnya dikromatografi Lapis Tipis Preparatif dengan sistem pelarut yang sesuai adalah kloroform : etil asetat (70:30) v/v, diamati dengan lampu UV, lalu diambil noda pertama dari batas atas, kemudian silika gel dikerok dan dielusi dengan perbandingan pelarut metanol : etil asetat (1:1) v/v. Senyawa yang diperoleh diuji kemurniannya dengan KLT menggunakan eluen kloroform : etil asetat (60:40) v/v yang menunjukkan hanya satu noda pada senyawa yang dihasilkan dengan harga Rf sebesar 0,56 (lampiran 6).
Hasil yang diperoleh dianalisa dengan menggunakan spektrofotometer UV- Visible untuk menentukan strukturnya berdasarkan panjang gelombang,
spektrofotometer FT-IR berdasarkan gugus fungsi, dan spektrofotometer 1H-NMR berdasarkan jumlah proton.
Dari hasil analisis spektrum UV-Vis dengan pelarut metanol (Gambar 4.2) memberikan serapan dengan panjang gelombang (λ max) 282 nm dengan adsorbansi 0,880. Senyawa fenolik dengan panjang gelombang dengan rentan 270-295 nm adalah golongan asam galat, dihidroflavon, dan juga flavonon (Bhat et al, 2005).
Dari hasil analisis spektrum FT-IR (Gambar 4.3) pada bilangan gelombang 3464,15 cm-1 menunjukkan adanya gugus OH dengan puncak yang tajam karena pada saat analisa larutan yang digunakan sangat encer sehingga gugus OH memiliki puncak yang tajam (Silverstein, 1986), pada bilangan gelombang 3317,56 cm-1 menunjukkan adanya C-H sp2 stretching dari proton aromatis, pada bilangan gelombang 2954,95 cm-1 puncak sedang menunjukkan C-H sp3 stretching dari OCH3
yang didukung oleh vibrasi bending dari C-H sp3 pada bilangan gelombang 1319,31 cm-1 yang menunjukkan puncak tajam dari OCH3, pada bilangan gelombang 1697,36 cm-1 puncak tajam menunjukkan vibrasi stretching dari gugus C=O ester, pada bilangan gelombang 1620,21 cm-1 puncak tajam menunjukkan vibrasi C=C aromatis, pada bilangan gelombang 1249,87 cm-1 puncak tajam menunjukkan vibrasi stretching C-O sesuai dengan data bilangan gelombang daerah spektrum inframerah pada teori (Harmita, 2009).
Dari hasil analisis Spektrometer Resonansi Magnetik Inti Proton (1H-NMR) dengan menggunakan pelarut metanol (CD3OD) dalam standar TMS (Gambar 4.4) menunjukkan adanya pergeseran kimia pada daerah δ 7,04 ppm berupa puncak singlet yang menunjukkan proton H-2 dan H-6 pada cincin aromatis senyawa fenolik, puncak singlet ditunjukkan karena memiliki lingkungan kimia yang sama dan tidak mempunyai proton tetangga sehingga memiliki pergeseran kimia yang sama, dan pergeseran kimia pada daerah δ 3,81 ppm yaitu puncak singlet yang menunjukkan proton dari -OCH3. Spektrum senyawa hasil hasil isolasi tersebut mirip dengan data proton 1H-NMR dari senyawa metil galat yang diisolasi dari Labisa pumila yang memiliki pergeseran kimia pada daerah δ 3,8 ppm yang menunjukkan proton metoksi (-OCH3), dan pada pergeseran kimia δ 7,0 ppm menunjukkan dua proton pada posisi 2 dan 6 (Hisham, 2011) (Lampiran 7).
Berdasarkan analisis data yang dilakukan pada spektrum UV-Visible, Spektrum Inframerah (FT-IR), dan Spektrum 1H-NMR disimpulkan bahwa kemungkinan senyawa hasil isolasi dari daun tumbuhan jarak kepyar adalah senyawa fenolik golongan asam fenolat yaitu metil galat dengan struktur kimia seperti pada Gambar 4.5 .
Gambar 4.5 Struktur Metil Galat
BAB 5
KESIMPULAN DAN SARAN
5.1 Kesimpulan
Hasil isolasi yang diperoleh dari 2000 g daun tumbuhan jarak kepyar (R.
communis L.) senyawa berupa padatan amorf berwarna kuning kecoklatan sebanyak 12 mg dengan harga Rf 0,56 dengan menggunakan eluen kloroform : etil asetat (70:30) v/v. Hasil analisis dengan spektrofotometer UV-Visible, Spektrofotometer Inframerah (FT-IR) dan Spektrofotometer Resonansi Magnetik Inti Proton (1H- NMR) menunjukkan bahwa senyawa hasil isolasi dari daun tumbuhan jarak kepyar (R. communis L.) diduga adalah senyawa fenolik golongan asam fenolat yaitu metil galat.
5.2 Saran
Untuk lebih mendukung struktur senyawa metil galat hasil isolasi, maka sebaiknya perlu dilakukan analisis Spektrofotometer Massa (MS).
DAFTAR PUSTAKA
Adnan, 1997. Teknik Kromatografi Untuk Analisis Bahan Makanan. Penerbit Andi.
Yogyakarta.
Andersen M., Markham KR, 2006. Flavonoids. Taylor & Francis Group. New York Agromedia R, 2008. Buku Pintar Tanaman Obat: 431 Jenis Tanaman Penggempur
Aneka Penyakit. PT Agromedia Pustaka. Jakarta Selatan.
Bhat SV, Nagasampagi BA, Sivakumar, M. 2005. Chemistryof Natural Products.
Naros Publishing House. New Delhi.
Dachriyanus, 2004. Analisis Struktur Senyawa Organik. Andalas University Press.
Padang
Djauhariya E, Hernani, 2004. Gulma Berkhasiat Obat. Cetakan I. Penebar. Jakarta . Firdaus M, Prihanto AA, Nurdiani R, 2013. Tanaman Bakau Biologi dan
Bioaktivitas. Universitas Brawijaya Press (UB Press). Malang
Gritter RJ, 1991. Pengantar Kromatografi. Edisi Kedua. Penerbit ITB. Bandung Harbone JB, Mabry TJ, 1987. Metode Fitokimia. Terbitan Kedua. Penerbit ITB
Bandung
Harmita, 2009. Analisis Fisikokimia Potensiometri dan Spektroskopi. Volume 1 dan 2. Penerbit Buku Kedokteran EGC. Jakarta
Heinrich M, Barnes J, Gibbons S, Williamson EM, 2010. Farmakognosi dan Fitoterapi. Penerbit Buku Kedokteran EGC. Jakarta
Herbert RB, 1995. Biosintesis Metabolit Sekunder. Edisi Kedua. Chapman and Hall.
London.
Hisham MN, Lip MJ, Noh MJ, Normah A, Nabila MF, 2011. Identification And Isolation Of Methyl Gallate As A Polar Chemical Marker For Labisia Pumila Benth. J. Trop. Agric. And Fd. Sc.39(2): 279-284
Hostettmann K, Hoestettmann M, Marston A, 1995. Cara Kromatografi Preparatif, Penggunaan pada Senyawa Bahan Alam. Penerbit ITB. Bandung.
Kardinan A, Kusuma FR, 2004. Meniran Penambah Daya Tahan Tubuh Alami.
Penerbit PT Agromedia Pustaka. Tangerang.
Kristanti NA, Aminah SN, Tanjung M, Kurniadi B, 2008. Buk Ajar Fitokima.
Airlangga University Press. Surabaya.
Leba MA, 2017. Buku Ajar: Ekstraksi dan Real Kromatografi. Penebit deepublish.
Yogyakarta.
Lee SH, Kim JK, Kim DW, Hwang HS, Eum WS, Park J, Han KH, Oh JS, Choi SY, 2013. Antitumor Activity of Methyl Gallate by Inhibition of Focal AdhesionFormation and Akt Phosphorylation in Glioma Cells. Biochimica et Biophysica Acta 1830: 4017-4029.
Markham KR, 1988. Cara Mengidentifikasi Flavonoida. Terjemahan Kosaso Padmawinata. Bandung. ITB Press.
Muldja MH, 1995. Analisis Instrumental. Edisi Keenam. Penerbit ITB. Bandung.
Mutia V, Rasmi ZO, 2017. Efektivitas Daun Jarak Kepyar (Ricinus Communis L.) Sebagai Anti-piretik. Jurnal Fitofarmaka Indonesia Volume 7 Nomor 1.
Nayeem N, SMB A, Salem H, Alfqy SA, 2016. Gallic Acid: A Promising Lead Molecule for Drug Development. Journal of Applied Pharmacy 8:213
Nollet LML, Gutierrez JA, 2018. Food Analysis & Properties Series Phenolic Compounds in Food Characterization and Analysis.. CRC Press, Taylor &
Francis Group. Boca Raton London.
Nurcholis M, dan Sumarsih S, 2007. Seri Budi Daya Jarak Pagar dan Pembuatan Biodiesel. Penerbit Kanisius. Yogyakarta.
Pengelly WL, Vuayaraghavan SJ, Sciaky D, 1986. Neoplatic Progression In Crown Gall In Tobacco Whitout Elevated Auxin Levels. Planta
Parwata IM, 2016. Flavonoid. Universitas Udayana. Denpasar
Rubiyanto D, 2017. Metode Kromatografi Prinsip Dasar Praktikum dan Pembelajaran Kromatografi. Deepublisher CV Bubi Utama. Yogyakarta Saifudin A, 2014.Senyawa Alam Metabolit Sekunder, Teori, Konsep, Dan
Pemurnian. Deepublish. Yogyakarta
Sarfina J, Nurhamidah, Handayani D, 2017. Uji Aktivitas Antioksidan Dan Anti Bakteri Ekstrak Daun Ricinus communis L. Jurnal Pendidikan dan Ilmu Kimia. 1(1): 66-70
Sarker S, 2006. Natural Product Isolation. Second Edition. Humana Press Inc.
New Jersey
Sastrohamidjojo H, 1996. Sintesis Bahan Alam. Gadjah Mada University Press.
Yogyakarta.
Sastrohamidjojo H, 2004. Teknik Pemisahan Kromatografi. UGM Press. Yogyakarta.
Sohi KK, Mittal N, Hundal MK, Khanduja KL, 2003. Gallic acid, and Antioxidant, Exhibits Antiapoptotic potential in Normal Human Lympocytes: A Bcl-2 independent Mechanism. J. Nutr. Sci. Vitaminol 49 (4): 221-227
Supratman U, 2010. Elusidasi Struktur Molekul Organik. Graha Ilmu. Yogyakarta
Utami WW, Ahmad AR, Malik A, 2016. Uji Aktivitas Larvasida Ekstrak Daun Jarak Kepyar (Ricinus communis L.) Terhadap Larva Nyamuk Aedes aegypti.
Jurna Fitokimia Indonesia, Vol. 3 No. 1
Vermerris W, Nicholson R, 2006. Phenolic Compound Biochemistry. Springer.
Netherlands.
Widodo W, Suwarsih S, 2007. Seri Budi Daya Jarak Kepyar. Penerbit Kanisius.
Yogyakarta.
Yuslianti ER, 2018. Pengantar Radikal bebas dan Antioksidan. Penerbit Deepublish.
Yogyakarta.
LAMPIRAN
Lampiran 1. Gambar Daun Tumbuhan Jarak Kepyar ( R. communis L.)
Lampiran 2. Hasil Determinasi Daun Tumbuhan Jarak Kepyar ( R. communis L.)
Lampiran 3. Kromatografi Lapis Tipis Ekstrak Pekat Metanol Daun Tumbuhan Jarak Kepyar ( R. communis L.) Sebelum Kromatografi Kolom
Keterangan :
Fase diam : Kieselgel 60 F254
No Fase Gerak Jumlah
Noda
Rf I Kloroform : Metanol (9 :
1) v/v
2 0,69
0.29