VOLUME MOLAL PARSIAL
A. Tujuan
Mahasiswa dapat menentukan volume molal parsial komponen larutan. B. Dasar Teori
Molal atau molalitas didefinisikan sebagai jumlah mol solut per kg solvent. Berarti merupakan perbandingan antara jumlah mol solut dengan massa solvent dalam kilogram. Dimana:
( )
Jadi, jika ada larutan 1,00 molal maka larutan tersebut mengandung 1,00 mol zat terlarut dalam 1,00 kg pelarut. Secara matematik, volume molal parsial didefinisikan sebagai:
(
) ̅
Dimana ̅i adalah volume molal parsial dari komponen ke-i secara fisik, ̅i berarti kenaikan dalam besaran termodinamik V yang diamati bila 1 mol senyawa ditambah ke suatu sistem yang besar, sehingga komposisisnya tetap konsisten/konstan. Pada P dan T konstan, persamaan diatas dapat ditulis sebagai ∑ ̅ dan dapat diintegrasikan menjadi ∑ ̅
Arti fisik dari integrasi ini adalah bahwa ke suatu larutan yang komposisinya tetap, suatu komponen n1, n2,...,ni ditambah lebih lanjut, sehingga komposisi relatif dari tiap-tiap jenis tetap konstan. Karenanya besaran molal ini tetap sama dan integrasi diambil pada banyaknya mol.
Ada tiga sifat termodinamik molal parsial utama, yaitu (i) volume molal parsial dari masing-masing komponen dalam larutan (disebut sebagai panas differensial larutan), (ii) entalpi molal parsial, dan (iii) energi bebas molal parsial. Sifat-sifat ini dapat ditentukan dengan bantuan (i) grafik, (ii) menggunakan hubungan analitik yang menunjukkan V dan ni, dan (iii) dengan menggunakan fungsi yang disebut besaran molal nyata yang ditentukan sebagai:
̅ ̅ ̅
Dimana ̅i adalah volume molal untuk komponen utama.
Kajian secara kuantitatif larutan telah berkembang dengan pengenalan konsep kuantitas molal parsial. Sifat suatu larutan, sebagai volume campuran alkohol dan air
berubah secara kontinyu akibat komposisi berubah. G. N. Lewis mengembangkan differensial eksak untuk memperoleh kuantitas volume molal parsial. Jika ditinjau sifat ekstensif suatu larutan biner pada P dan T konstan, G merupakan fungsi dua variabel n1 dan n2 yang menyatakan jumlah mol komponen 1 dan 2. Sifat molal parsial didefinisikan dengan: ̅ ( ) ...(1) dan ̅ ( ) ...(2)
Pada P dan T konstan, secara matematis konsep di atas dapat dinyatakan sebagai berikut:
Volume termasuk sifat ekstensive dari suatu larutan, sehingga suatu volume larutan biner dapat dinyatakan sebagai berikut:
( ) ̅ ̅ ...(3)
Volume molal parsial komponen 1 dan 2 diatas ditentukan dengan mengukur densitas larutan
̅ ̅ ...(4)
Metode grafik seperti yang telah digambarkan Lewis dan Randall dapat digunakan sebagai metode pengolahan data. Metode ini menggunakan volume molal semu ϕ untuk perlakuan larutan biner. Volume molal semu didefinisikan sebagai:
...(5)
Dimana V adalah volume larutan yang mengandung komponen n1 dan n2 sedangakan V10 adalah molar solvent murni pada P dan T. Dari persamaan volume molal semu, maka volume larutan adalah:
...(6)
Dipandang larutan dengan molalitas m yang menggunakan pelarut air. Di dalam larutan ini untuk setiap 1000 gram air (55,1 mol), terdapat m mol solut, jadi n1=55,51 mol dan n2=m mol. Volume molal parsial semu menjadi:
...(7)
V10 adalah volume molal air murni yang dapat dihitung dari berat molekul (18,016 untuk air) dibagi dengan berat jenis pada keadaan yang diamati. Untuk larutan tersebut dipenuhi:
...(8)
(
)( )
...(10)
Dengan ρ, ρ0 berturut-turut adalah berat jenis larutan, berat jenis air murni, sedangkan m2 adalah massa molekul relatif atau berat molekul solut. Sehingga volume molal parsial semu menjadi:
(
)( )
...(11)
persamaan tersebut digunakan jika dalam pengukuran berat jenis digunakan piknometer. Dalam persamaan tersebut W, W0, We berturut-turut adalah berat piknometer dipenuhi larutan, piknometer berisi air dan piknometer kosong.
Volume molal parsialsolven (komponen 1) maupun solut (komponen 2) dihitung dari volume molal parsial dan diperoleh hasilnya sebagai berikut:
̅ ( ) ( ) ( )...(12)
̅ ( (
)) (
)...(13)
Untuk larutan elektrolit sederhana misalnya NaCl, ditemukan bahwa ϕ linear terhadap √ , untuk konsentrasi yang tidak pekat, karena:
( √ ) ( √ ) ( √ ) ( √ )...(14)
Sehingga volume molal parsial komponen kedua menjadi: ̅
√ (
√ )...(15)
Jika untuk larutan NaCl ϕ linear terhadap √ , maka:
√ ( √ )...(16) Sehingga,
̅ √ (
√ )...(17)
Untuk volume molal parsial komponen 1 menjadi:
̅ √ (
√ )...(18)
Nilai ϕ0 diperoleh dari ekstrapolasi grafik ϕ larutan √ pada komsentrasi m mendekati nol. Dengan membuat grafik ϕ vs √ yang linear, maka slope
√ dapat dicari dan
volume molal parsial pelarut dapat dihitung. Demikian dari harga lereng
√ dan ϕ
0
C. Alat dan Bahan Alat: 1. Piknometer 25 ml 2. Labu ukur 50 ml 3. Erlenmeyer 250 ml 4. Beker glass 100 ml 5. Pipet volume 6. Ball pipet 7. Neraca digital Bahan: 1. NaCl 2. Aquadest D. Cara Kerja ↓ ↓ ↓ ↓ ↓ ↓
Menimbang 8,775 gram NaCl menggunakan neraca digital
Memasukkan pada labu takar dan menambahkan aquades sambai 50
ml
Mengencerkan NaCl menjadi
Menimbang piknometer kosong
Mengisi piknometer dengan aquades sampai penuh kemudian menimbangnya
Mengisi piknometer dengan NaCl 3M sampai penuh kemudian menimbangnya
Mengulangi percobaan untuk larutan NaCl 1,5M; 0,75M; 0,375M dan 0,1875
E. Data Pengamatan
No. [NaCl] Berat Piknometer (gram) T (0C)
We Wo W 1. 3,0000 M 14,7563 40,2033 43,1784 25 2. 1,5000 M 14,7563 40,2033 41,5985 25 3. 0,7500 M 14,7563 40,2033 40,9358 25 4. 0,3750 M 14,7563 40,2033 40,5963 25 5. 0,1875 M 14,7563 40,2033 40,3858 25
F. Hasil dan Pembahasan
No. m √ ρ Φ (ml) ̅1 (ml) ̅2 (ml) 1. 3,63976 1,90781 1,13688 23,20269 16,22538 33,81831 2. 1,64476 1,28248 1,07368 23,43813 16,51163 27,65295 3. 0,78463 0,88579 1,04718 20,83072 16,59535 23,74183 4. 0,38351 0,61928 1,03360 17,63759 16,62244 21,11421 5. 0,18963 0,43546 1,02518 20,17226 16,63161 19,30185 Grafik 1. Φ vs √m y = 8.5947x + 12.666 R² = 0.9674 0 5 10 15 20 25 0 0.2 0.4 0.6 0.8 1 1.2 1.4 Ф √m
Grafik Φ vs
√m
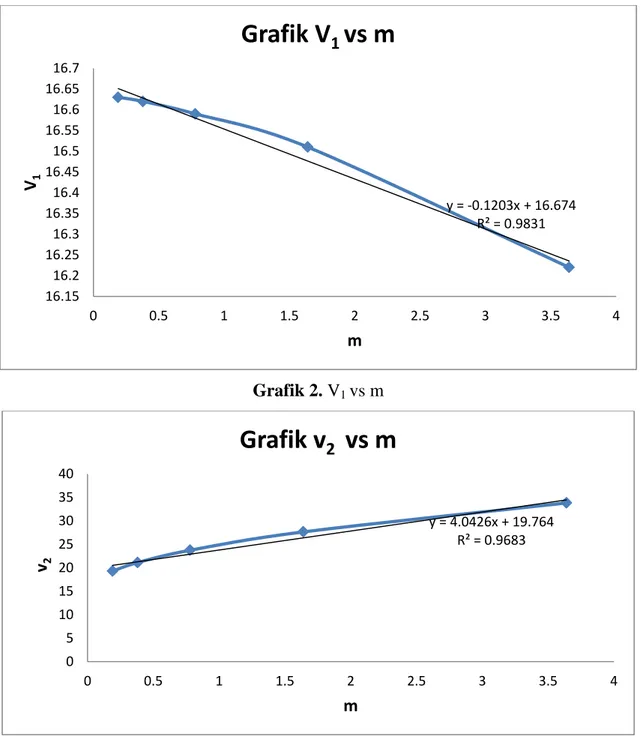
Grafik 2. V1 vs m
Grafik 3. v2 vs m Pembahasan
Pada percobaan volume molal parsial ini, digunakan larutan NaCl. NaCl berfungsi sebagai zat terlarut dan aquadest merupakan pelarutnya. NaCl digunkan karena merupakan larutan elektrolit kuat yang akan terurai menjadi Na+ dan Cl- di dalam air. Selain itu mampu menyerap air tanpa adanya penambahan volume, sehingga disebut volume molal parsial semu.
Percobaan ini dilakukan dengan 5 macam variasi molaritas larutan NaCl yaitu 3M; 1,5M; 0,75M; 0,375M dan 0,1875M. Adanya perbedaan konsentrasi NaCl akan mempengaruhi besarnya massa jenis pula. Semakin tinggi konsentrasinya massa jenis
y = -0.1203x + 16.674 R² = 0.9831 16.15 16.2 16.25 16.3 16.35 16.4 16.45 16.5 16.55 16.6 16.65 16.7 0 0.5 1 1.5 2 2.5 3 3.5 4 V1 m
Grafik V
1vs m
y = 4.0426x + 19.764 R² = 0.9683 0 5 10 15 20 25 30 35 40 0 0.5 1 1.5 2 2.5 3 3.5 4 v2 mGrafik v
2vs m
atau keraoatannya juga semakin besar. Hal ini disebabkan semakin tinggi konsentrasi, makin banyak pula NaCl yang terlarut di dalam air. Hal ini dibuktikan dengan hasil pengukuran massa piknometer berisi larutan NaCl dengan konsentrasi tinggi, massanya semakin besar. Hasil perhitungan massa jeni menyatakan semakin tinggi konsentrasi, massa jenisnya semakin besar.
Pada perhitungan volume molal semu (ϕ) diperoleh data 1 dan data 5 yang
menyimpang, sehingga pada pembuatan grafik, ϕ vs √ praktikan hanya menggunakan data 2 sampai 4. Karena grafik hubungan ϕ vs √ tidak linear sempurna seperti seharusnya, maka penentuan ϕ0 dan
√ dilakukan secara perhitungan. Adanya
kesalahan ini mungkin disebabkan oleh beberapa faktor, diantaranya: 1. Kesalahan dalam prosedur percobaan.
2. Pengenceran yang tidak teliti sehingga konsentrasinya terjadi kesalahan. 3. Larutan NaCl yang digunakan terlalu pekat.
4. Kurang teliti dalam penimbangan.
Penimbangan dilakukan terhadap masing-masing larutan dengan 5 variasi menggunakan piknometer 25 ml. Dari perhitungan, diperoleh massa jenis air sebesar 1,01788 gr/ml. Sedangkan massa jenis NaCl menunjukkan kenaikan sejalan dengan semakin besarnya molaritas. Molaritas yang semakin tinggi menyebabkan massa yang lebih besar pula sehingga dapat menambah berat larutan dalam air. Massa yang semakin tinggi inilah yang menyebabkan massa jenis semakin bertambah.
Dari hasil perhitungan, volume molal parsial NaCl semakin besar dengan bertambahnya konsentrasi. Hal ini dapat dilihat dari grafik V2 vs m yang semakin naik. Volume molal parsial NaCl semakin naik dengan bertambahnya konsentrasi disebabkan oleh volume NaCl akan semakin banyak jika konsentrasinya tinggi. Pada konsentrasi yang semakin besar, banyaknya zat NaCl terlarut semakin banyak sehingga volumenya juga semakin besar dibanding molaritas yang lebih rendah.
Sebaliknya, volume molal parsial air semakin rendah dengan bertambahnya konsentrasi. Hal ini sesuai dengan grafik V1 vs m. Keadaan ini dikarenakan pada konsentrasi tinggi, volume atau jumlah air yang digunakan untuk melarutkan lebih sedikit dibanding untuk konsentrasi kecil. Sehingga volume molal parsial air berbanding terbalik dengan molaritas larutan NaCl.
G. Kesimpulan dan Saran Kesimpulan
1. Semakin besar konsentrasinya, semakin besar pula massa jenis dan molalitasnya. 2. Massa jenis larutan NaCl lebih besar dari massa jenis air.
3. Volume molal parsial air berbanding terbalik dengan konsentrasi NaCl. 4. Volume molal parsial NaCl berbanding lurus dengan konsentrasinya.
5. Ekstrapolasi grafik ϕ vs √ mendekati linear bila larutan encer dan mendekati ideal. Saran
1. Praktikan sebaiknya menguasai materi sebelum melakukan percobaan. 2. Teliti dalam melakukan penimbangan.
3. Teliti dalam membuat larutan NaCl dan melakukan pengenceran.
H. Daftar Pustaka
Suhardjo. 1985. Kimia Fisika. Yogyakarta: Bina Aksara.
Wahyuni, Sri. 2013. Diktat Praktikum Kimia Fisik. Semarang: Jurusan Kimia FMIPA UNNES.
Bambang. 2012. Praktikum Volume Molal Parsial.
http://bambangchemistry.blogspot.com/2012archive.html (Diakses pada 26 april 2013, pukul 22.30 WIB)
Semarang, 27 April 2013 Praktikan
Lailatul Isnaeni 4311411021
LAMPIRAN Perhitungan - Massa Jenis - Molalitas (m)
1. Mula-mula = 8,7775 gram NaCl
n = M = m = n x ( ) √ √
2. Pengenceran ½ x dari mula-mula M1.V1=M2.V2 M2 = n = 0,07502 mol massa = 4,38867 gram m = ( ) √ √
3. Pengenceran ¼ x dari mula-mula M1.V1=M2.V2
M2 = n = 0,03751 mol
massa = 2,194335 gram
m = ( ) √ √
4. Pengenceran 1/8 x dari mula-mula M1.V1=M2.V2 M2 = n = 0,018755 mol massa = 1,0971675 gram m = ( ) √ √
5. Pengenceran 1/16 x dari mula-mula M1.V1=M2.V2 M2 = n = 0,0093775 mol massa = 0,54858 gram m = ( ) √ √
- Penentuan Volume Molal Semu (ϕ)
( ) ( ) ( ) ( ) ( ) ( ) ( ) ( )
( ) ( ) ( ) ( ) - Penentuan dan ( √ )
Penentuan ini berdasarkan grafik ϕ vs √ , akan tetapi karena grafik dari percobaan ini tidak benar-benar linear, maka secara umum ditentukan dengan:
√ √ Penentuan persamaan: √ √ √ √
Karena data 1 rancu, digunakan data ke 2 dan 3: √ √ Maka, ( √ ) - Penentuan ̅(H2O) ̅ √ ( √ ) ̅ √ ( √ ) 1. NaCl 3 M ̅ 2. NaCl 1,5 M ̅ 3. NaCl 0,75 M ̅
4. NaCl 0,375 M ̅ 5. NaCl 0,18755 M ̅ - Penentuan ̅ (NaCl) ̅ √ ( √ ) 1. NaCl 3 M ̅ 2. NaCl 1,5 M ̅ 3. NaCl 0,75 M ̅ 4. NaCl 0,375 M ̅ 5. NaCl 0,1875 M ̅