LAPORAN PRAKTIKUM KIMIA FISIK
PERCOBAAN N-1
PENENTUAN VOLUME MOLAR PARSIAL
Nama : Ahmad MuliansyahNIM : 13713045
Kelompok : II
Shift : II/ Rabu Siang (13.00-16.00) Asisten : Qurrotu A’yun 10511082 Tanggal Praktikum : 29 Oktober 2014
Tanggal Pengumpulan: 12 November 2014
LABORATORIUM KIMIA FISIK
PROGRAM STUDI TEKNIK MATERIAL
FAKULTAS TEKNIK MESIN DAN DIRGANTARA
INSTITUT TEKNOLOGI BANDUNG
PERCOBAAN N-1
PENENTUAN VOLUME MOLAR PARSIAL
I. TUJUAN PERCOBAAN
Menentukan volume molar parsial natrium klorida (NaCl) sebagai fungsi rapat massa.
II. TEORI DASAR
Volume molar adalah volume yang dimiliki setiap mol suatu zat pada temperatur dan tekanan tertentu. Volume molar parsial suatu zat dalam larutan adalah perubahan volume yang terjadi apabila satu mol komponen x ditambahkan pada larutan tersebut dan tidak mengubah komposisi sistem. Volume polar parsial dari komponen x pada suatu sistem sama dengan kenaikan atau penurunan yang sangat kecil pada volume dibagi dengan banyaknya mol zat yang ditambahkan, pada saat keadaan suhu, tekanan, dan jumlah komponen lain yang ada pada sistem tersebut konstan.
Secara matematik, volume molal parsial didefinisikan sebagai : (
) ̅
Dimana ̅ adalah volume molal parsial dari komponen ke-i. Secara fisik ̅ berarti kenaikan dalam besaran termodinamik V yang diamati bila satu mol senyawa i
ditambahkan ke suatu sistem yang besar, sehingga komposisinya tetap konstan. Pada temperatur dan tekanan konstan, persamaan di atas dapat ditulis sebagai ∑ ̅ dan dapat diintegrasikan menjadi :
∑ ̅
Faktor – Faktor yang mempengaruhi perubahan volume molar parsial adalah adanya perbedaan antara gaya intermolekular pada larutan dan pada komponen murni penyusun larutan tersebut, dan adanya perbedaan antara bentuk dan ukuran molekul suatu larutan dan pada komponen murni penyusun larutan tersebut. Ada tiga sifat termodinamik molal parsial utama, yakni: (i) volume molal parsial dari komponen-komponen dalam larutan (juga disebut sebagai panas differensial larutan), (ii) entalpi molal parsial, dan (iii) energi bebas molal parsial (potensial
kimia). Sifat-sifat ini dapat ditentukan dengan bantuan (i) metode grafik, (ii) menggunakan hubungan analitik yang menunjukkan V dan ni, dan (iii) menggunakan suatu fungsi yang disebut besaran molal nyata.
Pada praktikum ini digunakan metode volume molar nyata yang ditentukan sebagai:
̅ Atau ̅ Dimana ̅ adalah volume molal untuk komponen murni.
Pada praktikum ini, digunakan 2 macam zat, yaitu NaCl dan air, dan etanol dan air. Maka, persamaan di atas dapat ditulis menjadi:
̅
Dimana adalah jumlah mol air, dan adalah jumlah mol zat terlarut (NaCl atau etanol).
̅
Dimana adalah massa pelarut, dalam hal ini adalah air, dan
Sehingga, ̅
untuk pada 1 mol. Sedangkan harga pada variasi mol adalah
Setelah didapatkan semua harga dalam masing-masing variasi mol, maka semua harga ini dapat diplot terhadap mol. Kemiringan yang didapatkan dari grafik ini adalah ( ), dan dapat digunakan untuk menentukan harga volum molal parsial ( ̅ ), berdasarkan persamaan berikut:
̅ ( )
III. DATA PENGAMATAN
Berdasarkan pada percobaan yang telah dilakukan, diperoleh data sebagai berikut: Suhu saat percobaan (T) : 26,5 °C
Massa jenis air pada T (ρ) : 0,996649 gram/ml Berat piknometer kosong : 18,78 gram
Berat piknometer + air : 44,90 gram Mr NACl : 58,5 gr/mol Mr : 18,01 gr/mol Larutan induk : 3 M
Data percobaan :
Tabel 1. Data Pengamatan Volume Larutan
Induk
[NaCl] W pikno + larutan
(ml) (M) (gram) 5 0.3 45.18 10 0.6 45.33 15 0.9 45.83 20 1.2 45.87 25 1.5 46.43
IV. PENGOLAHAN DATA
Keterangan : Pelarut = air (H2O)
Zat = NaCl 4.1. Penentuan Volume Piknometer
( )
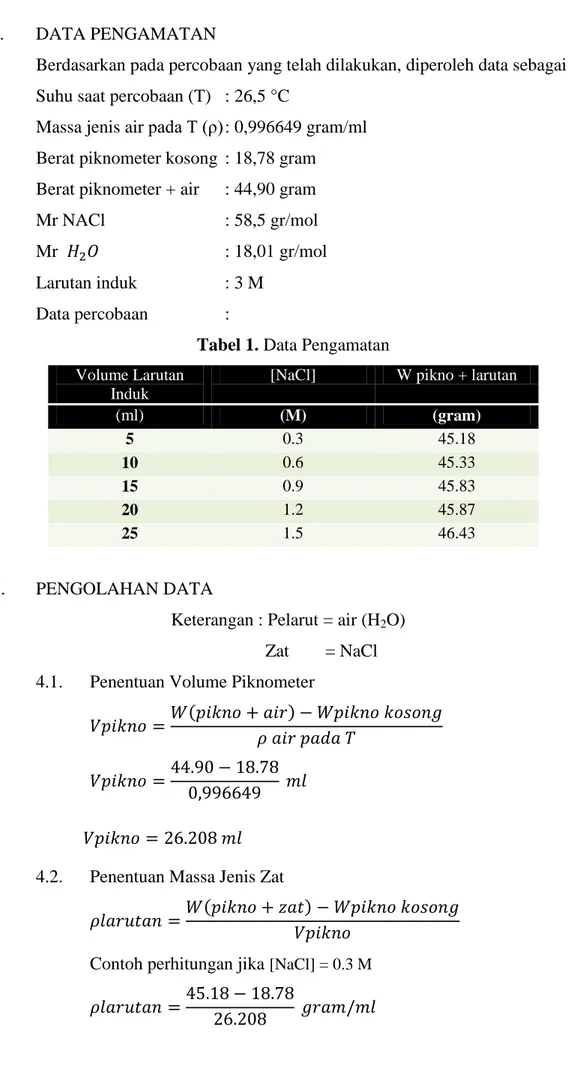
4.2. Penentuan Massa Jenis Zat
( )
Contoh perhitungan jika [NaCl] = 0.3 M
Tabel 2. Massa Jenis Larutan
[NaCl] W pikno + zat Massa Jenis Zat
(M) (gram) (gram/ml) 0.3 45.18 1.007 0.6 45.33 1.013 0.9 45.83 1.032 1.2 45.87 1.034 1.5 46.43 1.055
4.3. Penentuan Jumlah Mol Zat (n zat)
Contoh perhitungan jika [NaCl] = 0.3 M
Tabel 3. Jumlah Mol Zat
[NaCl] n zat (M) (mol) 0.300 0.008 0.600 0.016 0.900 0.024 1.200 0.031 1.500 0.039
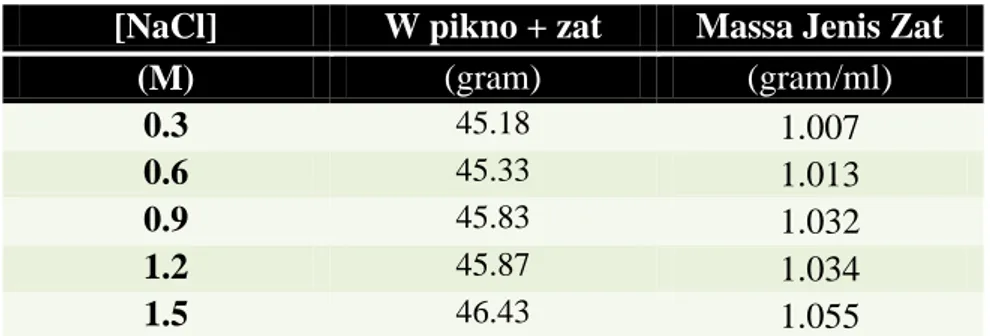
4.4. Penentuan Berat Pelarut (Ws)
( ) Contoh perhitungan jika [NaCl] = 0.3 M
Tabel 4. Berat Zat dan Pelarut
[NaCl] W pikno + larutan W zat Ws
(M) (gram) (gram) (gram)
0.300 45.18 0.451 25.949
0.600 45.33 0.936 25.614
0.900 45.83 1.404 25.646
1.200 45.87 1.814 25.276
1.500 46.43 2.282 25.368
4.5. Penentuan Jumlah Mol Pelarut (n pelarut)
Contoh perhitungan jika [NaCl] = 0.3 M
Tabel 5. Jumlah Mol Pelarut
[NaCl] Ws n pelarut (M) (gram) (mol) 0.300 25.949 1.441 0.600 25.614 1.422 0.900 25.646 1.424 1.200 25.276 1.403 1.500 25.368 1.409
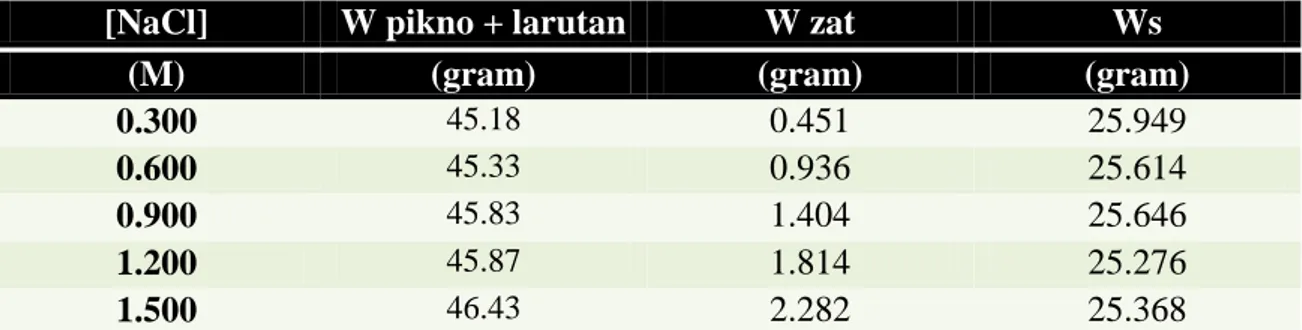
4.6. Penentuan Volume Molar Nyata
(
( ) ( )
)
Contoh perhitungan jika [NaCl] = 0.3 M
(
Tabel 6. Volume Molar Nyata
[NaCl] W(pikno+larutan) n zat ρ zat Ø
(M) gram mol gram/ml (ml)
0.300 45.18 0.008 1.007 56.706 0.600 45.33 0.016 1.013 57.015 0.900 45.83 0.024 1.032 56.564 1.200 45.87 0.031 1.034 56.847 1.500 46.43 0.039 1.055 56.546 4.7. Grafik
Tabel 7. Data Grafik
Ø √(n zat) 56.706 0.089 57.015 0.127 56.564 0.155 56.847 0.176 56.546 0.198 Keterangan grafik : √( )+58.17 maka, ( ) y = -19.555x + 58.177 R² = 0.9875 54.000 54.500 55.000 55.500 56.000 56.500 57.000 0.0800.0900.1000.1100.1200.1300.1400.1500.1600.1700.1800.1900.200 Ø √n NaCl
4.8. Penentuan Volume Molar Parsial ( ) √( ) ( ) √( ) Contoh perhitungan jika [NaCl] = 0.3 M ( ) ( ) Tabel 8. Volume Molar Parsial Zat dan Pelarut
[NaCl] V NaCl Vp (M) (ml) (ml) 0.300 56.495 18.084 0.600 56.467 18.108 0.900 56.430 18.140 1.200 56.386 18.177 1.500 56.385 18.219
VI. KESIMPULAN
Kesimpulan dari percobaan ini adalah bahwa volume molar parsial NaCl pada temperatur 26.5°C untuk beberapa konsentrasi adalah sebagai berikut
[NaCl] V NaCl (M) (ml) 0.300 56.495 0.600 56.467 0.900 56.430 1.200 56.386 1.500 56.385
VII. DAFTAR PUSTAKA
Bird, T. 1994. “Kimia Fisik untuk Universitas”. Gramedia Pustaka Utama. Jakarta.
P. W. Atkins. 1978. ”Physical Chemistry”. edisi 7. Oxford University. halaman 161-168.
Rao, RR dan Fasad, KR.2003.“Effects of Volume and Partial Molar Volume variation on Journal Bearings”. India.Vol 46. Hal 143-152.
Rosian,Z. 2005. “Kimia Fisika”. Rineka Cipta. Jakarta.
Sheemaker.1989.”Experimental in Physical Chemistry”.5 th ed.New York:Mc.Graw Hill.page 187-194
While, Frank.M. 1988. Mekanika Fluida edisi ke-2 jilid I. Jakarta : Erlangga
VIII. LAMPIRAN a. CRC
b. JAWABAN PERTANYAAN
1. Mengapa dalam penentuan volume molar parsial dengan menggunakan piknometer harus menggunakan termostat ?
Jawab:
Dalam menentukan volume molar parsial, diperlukan perhitungan massa jenis zat dan pelarut dengan menggunakan piknometer. Densitas suatu zat tergantung pada temperatur zat. Tujuan dari direndamnya piknometer dalam termostat adalah untuk mengatur suhu termostat dan menjaga suhu tersebut tetap konstan. Hal ini dilakukan supaya data yang diperoleh akurat dan perhitungan bisa mendekati nlai sesungguhnya (memperkecil nilai kesalahan).
2. Selama piknometer direndam di dalam termostat selama kurang lebih 15 menit, mengapa anda harus melakukan penambahan larutan ke dalam piknometer?
Jawab:
Piknometer adalah suatu alat yang terbuat dari kaca berbentuk menyerupai botol parfum atau sejenisnya dan digunakan untuk
mengukur nilai massa jenis atau densitas fluida. Larutan yang akan diukur massa jenisnya dimasukkan ke dalam piknometer sampai penuh dan diusahakan kapiler piknometer juga terisi larutan. Kemudian piknometer direndam di dalam termostat, hal ini bertujuan untuk mengatur suhu piknometer dan larutan.
Selama pekinkan rendaman ini dimungkinkan ada larutan yang tumpah oleh sebab itu harus ditambah dengan larutan lagi. Hal ini dilakukan agar volume larutan didalam piknometer tetap dan data yang diperoleh akan lebih akurat lagi.