LAPORAN PRAKTIKUM KIMIA FISIKA
PERCOBAAN X
PENENTUAN VOLUME MOLAL PARSIAL
NAMA : SARWINA HAFID
NIM : H311 11 278
KELOMPOK : VI (ENAM)
HARI / TANGGAL : SENIN / 15 APRIL 2013
ASISTEN : RAYMOND KWANGDINATA
LABORATORIUM KIMIA FISIKA JURUSAN KIMIA
FAKULTAS MATEMATIKA DAN ILMU PENGETAHUAN ALAM UNIVERSITAS HASANUDDIN
MAKASSAR 2013
BAB I PENDAHULUAN
1.1 Latar Belakang
Dalam termodinamika dikenal adanya dua tipe peubah, yaitu peubah ekstensif yang bergantung pada jumlah fase contohnya adalah volume (V), entropi (S), energi dalam (U), entalpi (H), dan peubah intensif, yaitu peubah yang tidak bergantung pada jumlah fase contohnya adalah tekanan (P) dan suhu (T). Volume molal parsial merupakan salah satu atau termasuk di dalam besaran ekstensif.
Volume molal parsial dari suatu larutan didefinisikan sebagai penambahan volume yang terjadi bila 1 mol komponen i ditambahkan pada larutan tersebut. Dalam pengukuran volume molal parsial dari suatu larutan, maka densitasnya diukur terlebih dahulu. Berdasarkan nilai densitas tersebut, maka dapat diperoleh nilai volume molal parsial.
Volume molal parsial dapat dipengaruhi oleh beberapa faktor diantaranya konsetrasi dan suhu. Konsentrasi suatu larutan tertentu tidak memiliki nilai yang sama pada dua temperatur yang berbeda karena kedua keadaan tersebut mengalami perubahan kerapatan.
Berdasarkan pada teori di atas, maka dilakukanlah percobaan penentuan volume molal suatu larutan, dalam hal ini adalah larutan NaCl. Dalam analisa ini, berbagai informasi mengenai sifat larutan dapat diketahui. Sifat-sifat tersebut antara lain massa larutan, densitas, molalitas, dan volume molal parsial larutan, yang kemudian dapat dijelaskan hubungannya dengan peningkatan konsentrasi larutan. Dengan menggunakan metode grafik, melalui percobaan ini dapat diketahui nilai volume molal parsial larutan NaCl.
1.2 Maksud dan Tujuan Percobaan 1.2.1 Maksud Percobaan
Maksud dari percobaan ini adalah untuk mengetahui dan mempelajari metode penentuan volume molal parsial suatu larutan.
1.2.2 Tujuan Percobaan
Tujuan dari percobaan ini adalah untuk menentukan volume molal parsial larutan natrium klorida sebagai fungsi konsentrasi dengan mengukur densitas larutan dengan menggunakan piknometer.
1.2.3 Prinsip Percobaan
Prinsip dari percobaan ini adalah menentukan volume molal parsial larutan natrium klorida dengan menghitung densitas larutan natrium klorida dengan variasi konsentrasi, yaitu 3 M, 1,5 M, 0,75 M, 0,375 M, dan 0,1875 M melalui penimbangan bobot larutan natrium klorida dengan menggunakan piknometer.
BAB II
TINJAUAN PUSTAKA
Termodinamika sangat penting dalam kimia, sebab dengan menggunakan termodinamika kita dapat menduga apakah suatu reaksi akan berlangsung atau tidak, dan apabila reaksi itu berlangsung, dapat dicari kondisi yang bagaimana yang dapat memaksimumkan produk. Tetapi, termodinamika mempunyai kelemahan, yaitu tidak dapat digunakan untuk mengetahui kecepatan reaksi yang berlangsung (Bird, 1993).
Menentukan volume molal parsial, terlebih dahulu melihat bagaimana menetapkan bagian volume larutan biner untuk masing-masing dua komponen. data yang umumnya digunakan untuk mendapatkan informasi volume yang adalah kerapatan larutan. Hal ini sering digunakan untuk larutan dengan berbagai jumlah komponen minor yang disebut sebagai zat terlarut, dalam beberapa jumlah tetap dari komponen utama, disebut pelarut. Densitas dapat digunakan untuk menghitung volume larutan dengan jumlah tertentu jumlah pelarut dan berbagai zat terlarut. Volume untuk larutan berbagai molalitas (m) didefinisikan sebagai jumlah mol zat terlarut per 1000 g pelarut. Volume molal parsial dari kedua komponen dapat diketahui dengan pengukuran yang tepat untuk menentukan data kerapatan larutan (Gordon dan Barrow, 1988).
Salah satu kelemahan tentang molaritas adalah nilai larutannya bergantung pada suhu. Jumlah liter larutan adalah volume yang akan sedikit berubah apabila suhunya juga berubah. Oleh karena itu, 1 M larutan dipersiapkan pada suhu 30 oC, pada suhu 0 oC konsentrasinya tidak lagi 1 M dan untuk mengatasi kekurangan ini maka digunakan satuan molalitas (Bird, 1993).
Setiap komponen dari campuran dapat dianggap sebagai fungsi T, P, n1, dan
n2. Oleh karena itu, sesuai dengan salah komponen ekstensif U, V, S, H, A, G, ada
sebagian Sifat molar, Ui, Vi, Si, Hi, Ai, Gi. Jumlah molar parsial didefinisikan oleh (Castellan, 1983): Ui =
(
n)
T,P,nj , Hi =(
n)
T,P,nj , Si =(
n)
T,P,nj Vi =(
n )T,P,nj , Ai =(
n )T,P,nj , Gi =(
n )T,P,njVolume molal larutan (V1) didefinisikan sebagai penambahan volume yang
terjadi bila 1 mol komponen i ditambahkan pada larutan. Volume total larutan yang mengandung 1000 g (55,51 mol) air dan m mol zat terlarut diberikan oleh persamaan (Taba, dkk., 2013).
V = N1V1 + N2V2 = 55,51 V1 + m V2
Andaikan V1˚ adalah volume molal a r murn 1˚ = 18,016 / 0,997044 = 18,069 cm3
pada 25 ˚C , maka volume molal zat terlarut ) didefinisikan sebagai berikut (Taba, dkk., 2013). V = N1V1˚ + N2V2 = 55,51V1˚ + m atau
0
1 0 1 1 2 V 55,51 V m 1 V N V N 1 Φ diketahui V = d N m 1000 2dimana: d = densitas larutan d0 = densitas pelarut murni
M2 = berat molekul zat terlarut sehingga diperoleh: do do d m 1000 M d 1 Φ 2 We Wo Wo W m 1000 M d 1 Φ 2
dimana: We = Berat piknometer kosong
Wo = Berat piknometer yang berisi air murni W = Berat piknometer yang berisi larutan
Ada tiga sifat termodinamika molal parsial utama, yaitu volume molal parsial dari komponen-komponen dalam larutan, entalpi molal parsial, dan energi bebas molal parsial. Sifat-sifat ini dapat ditentukan dengan bantuan metode grafik, dengan menggunakan hubungan analitik yang menunjukkan J dan ni, dan dengan
menggunakan suatu fungsi yang disebut besaran molal nyata (Dogra dan Dogra, 2009).
Menurut Dogra dan Dogra (2009), perhitungan molal parsial dapat dilakukan dengan beberapa cara, yaitu:
1. Metode Grafik
Metode ini, nilai J diplot sebagai suatu fungsi komposisi larutan dengan menjaga semua kompisisi komponen lain tetap kecuali satu. Jika plot ini linear, kemiringan garis tersebut akan menjadi besaran molal parsial dari komponen itu. Ini juga memperlihatkan bahwa sifat-sifat molal parsial dari komponen-komponen ini juga tidak bergantung pada konsentrasi. Jika plot J dalam hal ini tidak linear, maka:
Ji = i n P, T, i Δn ΔJ n → 0 2. Metode Analitik
Jika harga ekstensif dapat dinyatakan sebagai suatu fungsi aljabar dari komposisi tersebut, sifat molal parsial dapat dihitung secara analitik.
Sebuah metode densimetri digunakan untuk menentukan volume molal parsial, V* (i), NaCl, KCl, CaC12, MgCl2, Na2SO4, dan MgSO4 dalam air laut dan
expansibilities termal V*(i) garam. Sebuah hubungan semiempiris diusulkan untuk volume molal parsial garam, dalam kisaran suhu dan salinitas laut dunia. Parsial molal volume ion ini busur diperkirakan pada asumsi bahwa volume molal parsial pada pengenceran tak terbatas proton, V*0 (H+), adalah tepat dan bahwa volume transfer Cl- dari air murni air laut tidak berbeda dengan suhu. Persamaan volume molal parsial ion dinyatakan sebagai fungsi suhu dan salinitas yang diberikan (Poisson, 1976).
BAB III
METODE PERCOBAAN
3.1 Bahan Percobaan
Bahan yang digunakan dalam percobaan ini adalah larutan NaCl 3 M, akuades, kertas label, sabun cair, kertas saring, dan tissue roll.
3.2 Alat Percobaan
Alat yang digunakan dalam percobaan ini adalah piknometer 25 mL, labu ukur 100 mL, termometer 100 oC, neraca analitik, pipet volume 50 mL, bulb, gelas kimia 250 mL, gelas kimia 600 mL, sikat tabung, labu semprot, batang pengaduk, dan pipet tetes.
3.3 Prosedur Percobaan
Prosedur dari percobaan ini adalah larutan NaCl 3 M diencerkan sehingga konsentrasinya menjadi 1,5 M, 0,75 M, 0,375 M, dan 0,1875 M. Piknometer yang bersih dan kering ditimbang, lalu dicatat bobotnya. Piknometer diisi dengan akuades kemudian ditutup rapat, dicatat suhunya, dan bagian luarnya dikeringkan dengan menggunakan tissue roll, lalu ditimbang dan dicatat bobotnya. Piknometer ditimbang dengan mengganti akuades dengan larutan NaCl mulai dari konsentrasi rendah, yaitu berturut-turut 0,1875 M, 0,375 M, 0,75 M, 1,5 M, dan 3 M, lalu dicatat bobotnya. Setiap pergantian larutan, piknometer harus dibilas beberapa kali dengan menggunakan larutan yang akan dipakai. Suhu kamar dicatat.
BAB IV
HASIL DAN PEMBAHASAN
4.1 Hasil Pengamatan Taq = 30 ºC
We = Berat piknometer kosong (g) = 19,3234 gram Wo = Berat piknometer + akuades (g) = 44,4150 gram W = Berat piknometer + larutan (g)
do = densitas air pada 30 oC = 0,995646 g/cm3
NaCl (M) Bobot Piknometer + Larutan (g)
3 46,7986 1,5 45,6368 0,75 45,0370 0,375 44,7138 0,1875 44,5610 4.2 Perhitungan 4.2.1 Tabel Pengamatan NaCl (M) Berat Piknometer (g) W – We (g) W – Wo (g) Wo – We (g) We Wo W 3 19,3234 44,4150 46,7986 27,4752 2,3836 25,0916 1,5 19,3234 44,4150 45,6368 26,3134 1,2218 25,0916 0,75 19,3234 44,4150 45,0370 25,7136 0,6220 25,0916 0,375 19,3234 44,4150 44,7138 25,3904 0,2988 25,0916
0,1875 19,3234 44,4150 44,5610 25,2376 0,1460 25,0916
4.2.2 Penentuan Densitas Larutan (d) d = - e o - e do d1 = 46,7986 - 19,3234 44,4150 - 19,3234 0,995646 /cm 3 27,4752 25,0916 0,995646 /cm 3 1,0902 /cm3 d2 = 45,6368 - 19,3234 44,4150 - 19,3234 0,995646 /cm 3 26,3134 25,0916 0,995646 /cm 3 1,0441 /cm3 d3 = 45,0370 - 19,3234 44,4150 - 19,3234 0,995646 /cm 3 25,7136 25,0916 0,995646 /cm 3 1,0203 /cm3 d4 = 44,7138 - 19,3234 44,4150 - 19,3234 0,995646 /cm 3 25,3904 25,0916 0,995646 /cm 3 1,0075 /cm3 d5 = 44,5610 - 19,3234 44,4150 - 19,3234 0,995646 /cm 3
25,2376
25,0916 0,995646 /cm
3
1,0014 /cm3
4.2.3 Penentuan Molalitas Larutan (m) m = 1 ( ) - (d 1000) m1= 1 (1,0902 /cm3 mmol/cm33) - (58,5 /mol1000 ) = 1 0,3049 /mmol= 3,2798 mmol/ m2= 1 (1,5 mmol/cm1,0441 /cm33) - (58,5 /mol1000 ) = 1 0,6376 /mmol= 1,5685 mmol/ m3= 1 (0,75 mmol/cm1,0203 /cm33) - (58,5 /mol1000 ) = 1 1,3019 /mmol= 0,7681 mmol/ m4= 1 (0,375 mmol/cm1,0075 /cm3 3) - (58,5 /mol1000 ) = 1 2,6282 /mmol= 0,3805 mmol/ m5= 1 (0,1875 mmol/cm1,0014 /cm3 3) - (58,5 /mol1000 ) = 1 5,2823 /mmol= 0,1893 mmol/
4.2.4 Penentuan Volume Molal Parsial (ϕ) = 1 d ( ( 1000 m - o o e )) 1 = 1 1,0902 cm3 (58,5 mol ( 1000 mmol/mol 3,2798 mmol/ 46,7986 44,4150 44,4150 - 19,3234 )) = 0,9173 cm3/ (58,5 mol ( 1000 mmol/mol 3,2798 mmol/ 2,3836 25,0916 )) = 0,9173 cm3/g (58,5 g/mol (304,8966 g/mol x 0,0950)
= 0,9173 cm3/g (58,5 g/mol 28,9652 g/mol) = 27,0923 cm3/mol 2 = 1 1,0441 cm3 ( 58,5 mol ( 1000 mmol/mol 1,5684 mmol/ 45,6368 - 44,4150 44,4150 - 19,3234 )) = 0,9578 cm3/ (58,5 mol ( 1000 mmol/mol 1,5684 mmol/ 1,2218 25,0916 )) = 0,9578 cm3/g (58,5 g/mol (637,5925 g/mol x 0,0487) = 0,9578cm3/g (58,5 g/mol 31,0508 g/mol) = 26,2957 cm3/mol 3 = 1 1,0203 cm3 ( 58,5 mol ( 1000 mmol/mol 0,7681 mmol/ 45,0370 - 44,4150 44,4150 - 19,3234 )) = 0,9801 cm3/ (58,5 mol ( 1000 mmol/mol 0,7681 mmol/ 0,6220 25,0916 )) = 0,9801 cm3/g (58,5 g/mol 1301,9138 g/mol x 0,0248) = 0,9801 cm3 /g (58,5 g/mol 32,2875 g/mol) = 25,7048 cm3/mol 4= 1 1,0075 cm3 ( 58,5 mol ( 1000 mmol/mol 0,3805 mmol/ 44,7138 - 44,4150 44,4150 - 19,3234 )) = 0,9926 cm3/ (58,5 mol ( 1000 mmol/mol 0,3805 mmol/ 0,2988 25,0916 )) = 0,9926 cm3 /g (58,5 g/mol 2628,1209 g/mol x 0,0120) = 0,9926 cm3 /g (58,5 g/mol 31,5375 g/mol) = 27,0009 cm3/mol 5= 1 1,0014 cm3 ( 58,5 mol ( 1000 mmol/mol 0,1893 mmol/ 44,5610 - 44,4150 44,4150 19,3234 ))
= 0,9986 cm3/ (58,5 mol ( 1000 mmol/mol 0,1893 mmol/ 0,1460 25,0916 )) = 0,9986 cm3/g (58,5 g/mol 5282,6202 g/mol x 0,0058) = 0,9986 cm3 /g (58,5 g/mol 30,6392 g/mol) = 27,7233 cm3/mol 4.2.5 Analisa Grafik
NaCl (M) m (mmol/g) √ (cm3/mol) regresi
3 3,2798 1,8110 27,0923 26,5244 1,5 1,5685 1,2524 26,2957 26,6887 0,75 0,7681 0,8764 25,7048 26,7992 0,375 0,3805 0,6168 27,0009 26,8756 0,1875 0,1893 0,4351 27,7233 26,9290
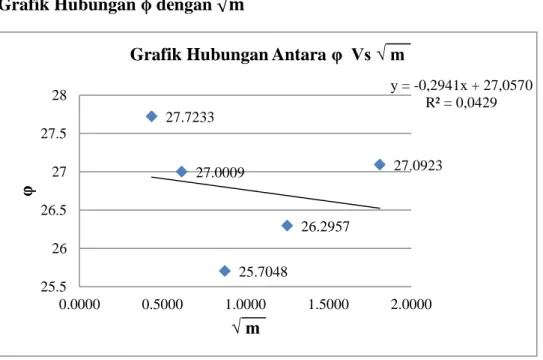
Grafik Hubungan ϕ dengan √
y = ax + b y = -0,2941x + 27,0570 lope = tan = = 26,5244 - 26,9290 1,8110 - 0,4351 = -0,4046 1,3759= -0,2941 cm 3/mol 27.0923 26.2957 25.7048 27.0009 27.7233 y = -0,2941x + 27,0570 R² = 0,0429 25.5 26 26.5 27 27.5 28 0.0000 0.5000 1.0000 1.5000 2.0000 φ √ m
Slope = volume molal parsial = -0,2941 cm3/mol
4.3 Pembahasan
Volume molal parsial didefinisikan sebagai penambahan volume yang terjadi bila 1 mol komponen tertentu ditambahkan ke dalam larutan. Simbol dari volume molal parsial adalah Ф den an satuan cm3/mol. Molalitas volume merupakan satuan konsentrasi yang jarang digunakan. Molalitas volume berarti konsentrasi dinyatakan dalam jumlah mol zat terlarut yang dilarutkan dalam satu liter larutan. Volume molal parsial komponen suatu campuran berubah-ubah bergantung pada komposisi, karena lingkungan setiap jenis molekul berubah jika komposisinya berubah. Volume molal parsial merupakan salah satu yang termasuk dalam besaran ekstensif. Dalam mengetahui volume molal parsial dari suatu larutan, maka densitas dari larutan tersebut diukur terlebih dahulu. Berdasarkan nilai densitas yang diperoleh, maka volume molal zat terlarut dari larutan yang diukur dapat diketahui.
Dalam percobaan ini, digunakan piknometer untuk mengukur bobot jenis akuades dan larutan NaCl. NaCl berfungsi sebagai zat terlarut dan akuades sebagai pelarut. Tujuan digunakan akuades adalah sebagai bahan pembanding sehingga bobot jenis dari larutan yang ingin kita tentukan dapat kita peroleh. Metode pengukuran dengan menggunakan piknometer, yaitu sebelum digunakan harus dibersihkan dan dikeringkan hingga tidak ada sedikit pun titik air di dalamnya. Hal ini bertujuan untuk memperoleh bobot kosong dari alat. Jika masih terdapat titik air di dalamnya, maka dapat mempengaruhi hasil penimbangan yang diperoleh. Pada pengisiannya dengan sampel, harus diperhatikan dengan baik agar di dalam piknometer tidak terdapat gelembung udara karena jika ada gelembung udara di dalamnya, maka akan mengurangi bobot sampel yang akan diperoleh. Larutan sampel kemudian diukur, dimulai dari akuades yang ditimbang menggunakan neraca analitik kemudian diukur suhu larutan dalam piknometer. Setelah itu, piknometer
dibilas dengan larutan yang akan digunakan. Dalam hal ini, larutan yang digunakan adalah larutan NaCl dengan menggunakan konsentrasi yang berbeda-beda.
Dalam pengerjaan, larutan NaCl 3 M diencerkan beberapa kali sehingga diperoleh larutan NaCl yang lebih encer, yakni 1,5 M, 0,75 M, 0,375 M, dan 0,1875 M. Selanjutnya, keseluruhan NaCl dengan konsentrasi berbeda itu kemudian dihitung volume molel parsialnya dengan menghitung bobot jenis masing-masing larutan. Pengenceran dilakukan untuk mengamati seberapa besar penambahan volume larutan yang terjadi pada berbagai variasi konsentrasi larutan. Dengan demikian, akan diketahui seberapa besar pengaruh konsentrasi larutan terhadap volume molal parsial larutan.
Penimbangan dimulai dari larutan yang memiliki konsentrasi terendah ke konsentrasi tinggi agar larutan tidak terkontaminasi oleh larutan yang lebih pekat karena dapat berpengaruh terhadap penentuan densitas. Dengan dimulai dari konsentrasi rendah, maka larutan yang konsentrasi tinggi tidak akan mempengaruhi bobot piknometer karena konsentrasinya lebih encer dari konsentrasi larutan yang akan ditimbang berikutnya.
Perbedaan konsentrasi larutan NaCl menghasilkan densitas yang berbeda-beda pula. Adapun dari hasil pengolahan data diperoleh densitas dari NaCl 3 M, 1,5 M, 0,75 M, 0,375 M, dan 0,1875 M secara berturut-turut adalah 1,0902 g/cm3, 1,0441 g/cm3, 1,0203 g/cm3, 1,0075 g/cm3, dan 1,0014 g/cm3. Dari data ini, tampak bahwa konsentrasi berbanding lurus dengan densitas larutan artinya semakin besar konsentrasi larutan maka densitasnya juga semakin besar. Hal ini disebabkan karena semakin tinggi konsentrasi suatu larutan, menunjukkan jumlah partikel dalam larutan tersebut semakin banyak dimana konsentrasi suatu larutan berbanding lurus dengan densitas larutan. Dengan demikian, maka dapat dijelaskan
bahwa densitas dan molaritas adalah besaran yang berbanding lurus dengan jumlah zat terlarut.
Dengan ditentukannya bobot jenis larutan, maka kita dapat menentukan molalitas dari larutan tersebut. Adapun molalitas dari larutan NaCl dengan konsentrasi NaCl 3 M, 1,5 M, 0,75 M, 0,375 M, dan 0,1875 M berturut-turut
adalah 3,2798 mmol/g, 1,5685 mmol/g, 0,7681 mmol/g, 0,3805 mmol/g, dan 0,1893 mmol/g. Nilai ini menunjukkan bahwa konsentrasi larutan dalam molalitas
berbanding lurus dengan molalitasnya, dimana semakin besar molaritas, maka molalitasnya juga semakin besar.
Dari percobaan ini juga diperoleh volume molal parsial dari larutan NaCl berturut-turut dari konsentrasi 3 M, 1,5 M, 0,75 M, 0,375 M, dan 0,1875 M adalah 27,0923 cm3/mol, 26,2957 cm3/mol, 25,7048 cm3/mol, 27,0009 cm3/mol, dan 27,7233 cm3/mol.
Molaritas didefinisikan sebagai suatu bagian volume dalam larutan. Volume larutan dipengaruhi oleh temperatur sedangkan molalitas didefinisikan sebagai jumlah mol zat terlarut per kilogram pelarut dalam larutan. Simbol untuk molalitas adalah m dan satuannya adalah molal. Molalitas didefinisikan dalam bagian kilogram sedangkan molaritas dalam liter. Molalitas didefinisikan sebagai bagian dalam pelarut, bukan larutan.
Dari grafik hubungan regresi dengan √ diperoleh volume molal parsial dari larutan NaCl adalah -0,2941 cm3/mol. Nilai R2 yang diperoleh dari grafik yaitu 0,0429. Nilai R2 berfungsi untuk memastikan apakah hasil yang diperoleh telah maksimal atau tidak. Dalam grafik tersebut, nilai dari R2 menunjukkan bahwa hasil yang diperoleh belum mendekati nilai sesungguhnya (R2 = 1). Tanda minus berarti
setiap penambahan 1 mol NaCl terjadi penurunan volume molal parsial sebesar 0,2941 cm3/mol.
BAB V
KESIMPULAN DAN SARAN
5.1 Kesimpulan
Dari percobaan yang dilakukan, maka dapat disimpulkan nilai volume molal parsial dari larutan NaCl adalah -0,2941 cm3/mol.
5.2 Saran
Sebaiknya digunakan berbagai jenis bahan lain dalam penentuan volume molal parsial sehingga kita dapat membandingkan nilai volume molal parsial antara bahan yang satu dengan yang lain.
Saran untuk laboratorium, sebaiknya saluran pembuangan di setiap meja dapat diperbaiki agar praktikan tidak mengganggu kelompok lainnya ketika harus membersihkan di meja lainnya.
Adapun saran dari praktikan untuk asisten adalah cukup dipertahankan cara membimbingnya, karena sudah cukup baik. Adapun dalam pengarahan menggunakan alat-alat laboratorium sebaiknya lebih ditingkatkan lagi karena praktikan masih butuh bimbingan yang lebih dan soal respon dikurangi.