LAPORAN PRAKTIKUM KIMIA FISIK KI-2142 PRAKTIKUM N-1
PENENTUAN VOLUM MOLAR PARSIAL
Nama : Catia Julie Aulia
NIM : 13714035
Kelompok : II
Shift : Rabu Siang Minggu ke-2 Tanggal Percobaan : 4 November 2015 Tanggal Laporan : 11 November 2015 Asisten : Nurul Fatimah (20515014)
LABORATORIUM KIMIA FISIK PROGRAM STUDI KIMIA
FAKULTAS MATEMATIKA DAN ILMU PENGETAHUAN ALAM INSTITUT TEKNOLOGI BANDUNG
I.
JUDUL PERCOBAAN
Penentuan Volum Molar Parsial.
II.
TUJUAN PERCOBAAN
1. Menentukan Volum Molar Parsial larutan NaCl sebagai fungsi rapat massa. 2. Menentukan pengaruh konsentrasi zat terlarut terhadap nilai Volume Molar
Parsial Zat.
III.
DASAR TEORI
Variabel termodinamika dibedakan menjadi dua jenis, yaitu besaran intensif dan besaran ekstensif. Besaran intensif adalah besaran yang nilainya tidak
dipengaruhi oleh faktor luar, contohnya tekanan dan temperatur. Sedangkan besaran ekstensif adalah besaran yang dipengaruhi oleh faktor luar, contohnya massa, volume, dan energi kinetik.
Kedua besaran tersebut secara matematis dapat dinyatakan sebagai fungsi homogen berderajat n dalam suatu fungsi :
f (N1, N2, . . . , Ni) = n f (N1, N2, . . ., Ni)
dengan dan N = tetapan; dan Ni = banyaknya mol komponen i dalam suatu sistem. Diferensiasi fungsi tersebut menghasilkan :
N1 ( ) N2( ) + . . . = n n-1 f (N1, N2, . . . , Ni) Persamaan ini dikenal sebagai teorema Euler untuk fungsi homogen berderajat n.
Terdapat tiga sifat termodinamika molar parsial, yakni volum molar parsial dari komponen-komponen dalam larutan, entalpi parsial, dan energi bebas parsial. Sifat-sifat molar parsial ini dapat ditentukan dengan cara metoda grafik, metoda analitik, metoda molar nyata, dan metoda intersep. Namun pada percobaan ini yang ditentukan adalah volume molar parsial larutan NaCl sebagai fungsi konsentrasi parsial yang didefinisikan sebagai :
(
) ̅̅̅
dengan Q = kuantitas ekstensif; Ni = banyaknya mol komponen i; dan Qi = sifat molar parsial komponen i.
Pada praktikum ini, metode yang digunakan adalah metode volum molar nyata yang ditentukan sebagai :
̅ atau ̅
Pada praktikum ini, digunakan 2 macam zat, yaitu NaCl dan air. Maka, persamaan di atas dapat ditulis menjadi :
̅
dimana n1 adalah jumlah mol air, dan n2 adalah jumlah mol zat terlarut NaCl. ̅
dimana m1 adalah massa pelarut, dalam hal ini adalah air; dan , sehingga : ̅
untuk pada 1 mol. Sedangkan harga pada variasi mol adalah
Setelah didapatkan semua harga dalam masing-masing variasi mol, maka semua harga ini dapat diplot terhadap mol. Kemiringan yang didapatkan dari grafik ini adalah (
), dan dapat digunakan untuk menentukan harga volum molal parsial ( ̅ ), berdasarkan persamaan berikut:
̅ ( )
IV.
DATA PENGAMATAN
T = 27,5o C
MassaPikno Kosong = 18,97 gram MassaPikno + Aqua DM = 45,15 gram Konsentrasi NaCl = 3 M
Tabel 1. Data Hasil Pengamatan
No. Konsentrasi Larutan (M) MassaPikno + Zat (gram)
1 0,3 45,45
2 0,6 45,77
3 0,9 46,08
4 1,2 46,36
V.
PENGOLAHAN DATA
1. Penentuan Volume Piknometer
Vpikno = = –
2. Penentuan Massa Jenis Zat
Perhitungan pada [NaCl] = 0,3 M
Dengan melakukan perhitungan yang sama pada molaritas yang berikutnya, diperoleh data massa jenis zat sebagai berikut.
Tabel 2. Massa Jenis NaCl dalam berbagai konsentrasi
[NaCl] (M) Wpikno + zat (gram) Zat (gram/mL)
0,3 45,45 1,0079 0,6 45,77 1,0201 0,9 46,08 1,0319 1,2 46,36 1,0426 1,5 46,65 1,0536 Vpikno = 26,27 mL
WPikno Kosong = 18,97 gram Vpikno = 26,27 mL
3. Penentuan Mol Zat
nzat =
Perhitungan pada [NaCl] = 0,3 M nzat =
Dengan melakukan perhitungan yang sama pada molaritas yang berikutnya, diperoleh data massa jenis zat sebagai berikut.
Tabel 3. Jumlah Mol NaCl dalam berbagai konsentrasi
[NaCl] (M) nzat (mol)
0,3 0,007881
0,6 0,015762
0,9 0,023630
1,2 0,031524
1,5 0,039405
4. Penentuan Massa Zat Pelarut
W
zat= n
zatx Mr
zatW
pelarut= W
pikno + zat– W
pikno kosong- W
zatPerhitungan pada [NaCl] = 0,3 M
W
zat= 0,007881 mol x 58,44 gram/mol
W
zat= 0,46 gram
W
pelarut= 45,45 gram – 18,97 gram – 0,46 gram
n
zat= 0,007881 mol
Vpikno = 26,27 mL
W
pelarut= 26,02 gram
Mrzat = MrNaCl
= 58,44 gram/mol Wpikno kosong = 18,97 gram
Dengan melakukan perhitungan yang sama pada molaritas yang
berikutnya, diperoleh data massa jenis zat sebagai berikut.
Tabel 4. Massa Zat Pelarut dalam berbagai konsentrasi
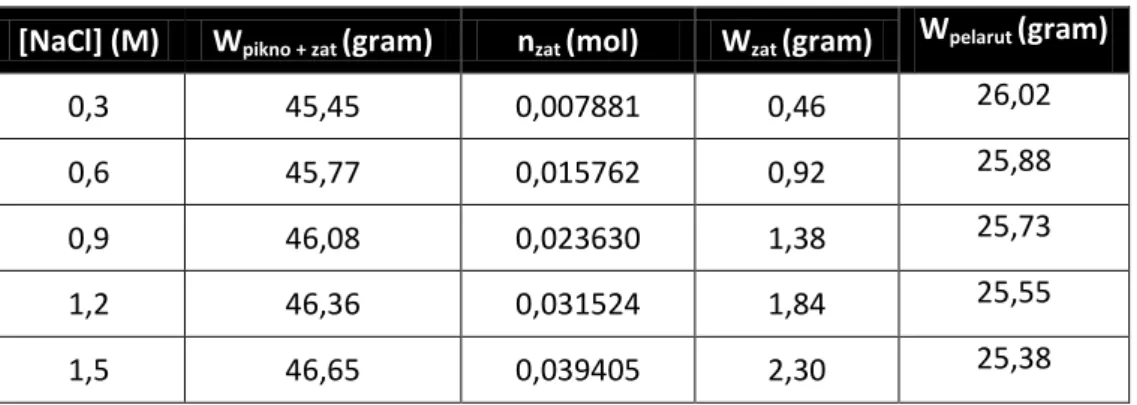
[NaCl] (M) Wpikno + zat (gram) nzat (mol) Wzat (gram) Wpelarut (gram)
0,3 45,45 0,007881 0,46 26,02
0,6 45,77 0,015762 0,92 25,88
0,9 46,08 0,023630 1,38 25,73
1,2 46,36 0,031524 1,84 25,55
1,5 46,65 0,039405 2,30 25,38
5. Penentuan Jumlah Mol Pelarut
Perhitungan pada [NaCl] = 0,3 M
Dengan melakukan perhitungan yang sama pada molaritas yang berikutnya, diperoleh data massa jenis zat sebagai berikut.
Tabel 5. Jumlah Mol Pelarut dalam berbagai konsentrasi.
[NaCl] (M) Wpelarut (gram) npelarut (mol)
0,3 26,02 1,4455 0,6 25,88 1,4377 0,9 25,73 1,4294 1,2 25,55 1,4194 1,5 25,38 1,4100
n
pelarut= 1,4455 mol
6. Penentuan Volum Molar Nyata
( )Perhitungan pada [NaCl] = 0,3 M
( – )
Dengan melakukan perhitungan yang sama pada molaritas yang berikutnya, diperoleh data massa jenis zat sebagai berikut.
Tabel 6. Volum Molar Nyata Larutan dalam berbagai konsentrasi
[NaCl] (M) Zat
(gram/mL) nzat (mol)
Wpikno + zat (gram) (mL/mol) 0,3 1,0079 0,007881 45,45 56,5393 0,6 1,0201 0,015762 45,77 55,8156 0,9 1,0319 0,023630 46,08 55,1765 1,2 1,0426 0,031524 46,36 54,6459 1,5 1,0536 0,039405 46,65 54,0869 Mrzat = MrNaCl = 58,44 gram/mol = 56,5393 mL/mol
7. Grafik Data Pengolahan
Tabel 7. Data pada Grafik
[NaCl] (M) (mL/mol) nzat (mol) √nzat
0,3 56,5393 0,007881 0,088774
0,6 55,8156 0,015762 0,125546
0,9 55,1765 0,023630 0,153720
1,2 54,6459 0,031524 0,177549
1,5 54,0869 0,039405 0,198506
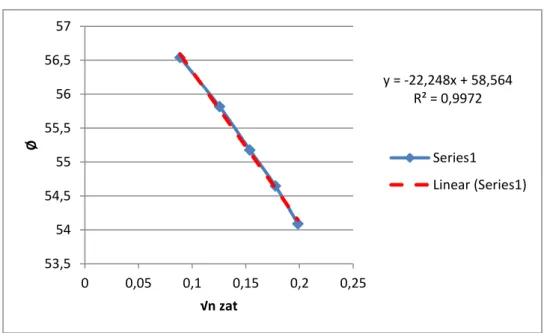
Grafik 1. Grafik Hubungan Ø dengan √nzat
Dari hasil regresi diperoleh : Y = mx + c y = -22,248x + 58,564 = -22,248 x √nzat + 58,564 ( ) y = -22,248x + 58,564 R² = 0,9972 53,5 54 54,5 55 55,5 56 56,5 57 0 0,05 0,1 0,15 0,2 0,25 Ø √n zat Series1 Linear (Series1)
8. Penentuan Volum Molar Parsial
( ) ( ) * = Vpelarut = ( ) ( )
Perhitungan pada [NaCl] = 0,3 M ( ) V* = V* = 18,0546 mL VPelarut = 18,06 mL + ( )
Dengan melakukan perhitungan yang sama pada molaritas yang berikutnya, diperoleh data massa jenis zat sebagai berikut.
Tabel 8. Volume Molar Parsial Zat dan Pelarut
[NaCl] (M) VNaCl (mL) VPelarut (mL)
0,3 56,5339 18,0546 0,6 55,8002 18,0392 0,9 55,1482 18,0263 1,2 54,6020 18,0107 1,5 54,0251 17,9928 VZat = 56,5339 mL VPelarut = 18,0546 mL
VII.
SIMPULAN
Berdasarkan data hasil pengolahan, didapatkan nilai Volume Molar Nyata larutan NaCl pada temperatur 27,5oC untuk beberapa konsentrasi adalah sebagai berikut; pada konsentrasi 0,3M sebesar 56,5339 mL; pada konsentrasi 0,6 M sebesar 55,8002 mL; pada konsentrasi 0,9 M sebesar 55,1482; pada konsentrasi 1,2 M sebesar 54,6020 mL; dan pada konsentrasi 1,5 M sebesar 54,0251 mL.
Hubungan antara konsentrasi dengan Volume Molar Parsial adalah berbanding terbalik, dimana jika nilai konsentrasi zat semakin besar, maka nilai Volume Molar Parsialnya akan semakin kecil, begitupun sebaliknya.
VIII.
DAFTAR PUSTAKA
Bird, T. 1994. Kimia Fisik untuk Universitas. Jakarta : Gramedia Pustaka Utama. Atkins, P.W . 1999. Kimia Fisika Jilid 1 Edisi Empat. Jakarta : Erlangga.
Diakses : 6 Oktober 2015 http://faculty.nwfsc.edu/web/science/struckl/ABSOLUTE%20DENSITY%20OF% 20WATER%20TABLE.pdf Diakses : 3 November 2015 http://www.sciencelab.com/msds.php?msdsId=9927593 Diakses : 3 November 2015 https://www.sciencelab.com/msds.php?msdsId=9927321

![Tabel 3. Jumlah Mol NaCl dalam berbagai konsentrasi [NaCl] (M) n zat (mol)](https://thumb-ap.123doks.com/thumbv2/123dok/2040927.3023639/5.892.273.624.494.698/tabel-jumlah-mol-nacl-berbagai-konsentrasi-nacl-zat.webp)
![Tabel 6. Volum Molar Nyata Larutan dalam berbagai konsentrasi [NaCl] (M) Zat](https://thumb-ap.123doks.com/thumbv2/123dok/2040927.3023639/7.892.169.731.531.744/tabel-volum-molar-nyata-larutan-berbagai-konsentrasi-nacl.webp)